Observation of embryo and morphological development of larval, juvenile and young speckled snowmark clownfish (Amphiprion sp.)
-
摘要:
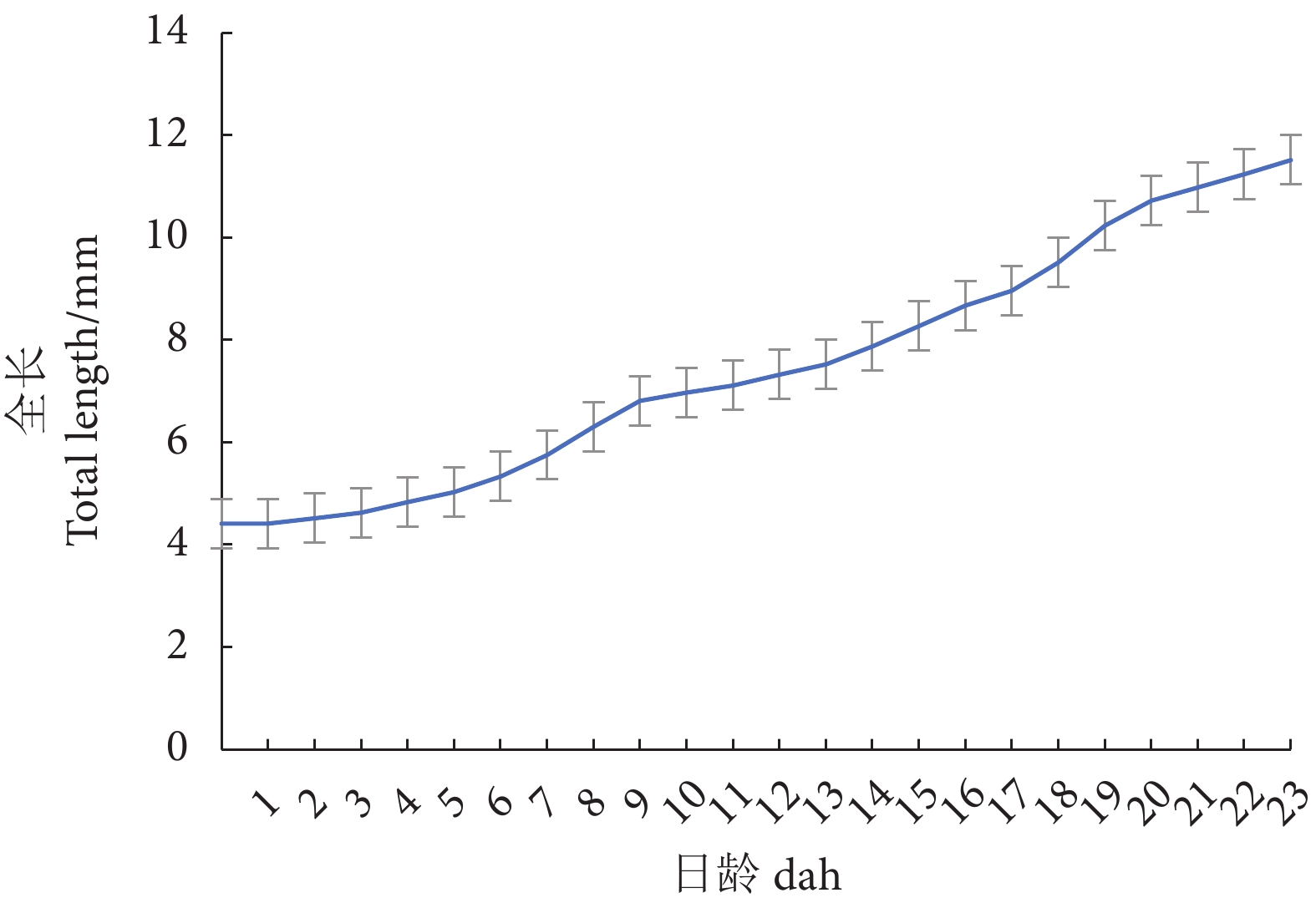
为建立喷点雪印小丑鱼 (Amphiprion sp.) 人工繁育技术,在人工模拟自然条件下对其繁殖习性、胚胎发育及胚后发育进行观察。结果表明:喷点雪印小丑鱼受精卵长径为1.9~2.1 mm,短径为0.93~0.95 mm;胚胎发育主要经历受精卵期→胚盘期→卵裂期→囊胚期→原肠胚期→神经胚期→器官形成期→孵化期等;在水温为 (27±0.5) ℃时,受精卵约需197 h孵化出膜。初孵仔鱼全长 (4.415±0.412) mm,身体透明,鳍膜明显,卵黄囊仅剩小部分残留,并已开口摄食。9日龄全长 (6.813±0.835) mm,鳍膜消失,各鳍基本形成,头部开始出现纹带,进入稚鱼期。21日龄全长 (10.581±2.659) mm,身体被鳞,体色、纹路开始分化。35日龄全长 (15.512±4.927) mm,形成4种不同体色、纹路的幼鱼。作为人工选育的品系,喷点雪印小丑鱼胚后发育过程中最为明显的变化是幼鱼期体色、纹路等形态特征的形成与分化。
Abstract:In order to improve the artificial breeding technology of the speckled snowmark clownfish (Amphiprion sp.), we observed the breeding habits, embryonic development and post-embryonic development under artificial simulated natural conditions. The results show that the fertilized eggs were 1.9−2.1 mm in long diameter and 0.93−0.95 mm in short diameter. The embryonic development mainly went through sperm-egg stage, embryonic disc stage, oogenesis stage, blastocyst stage, protointestinal stage, neuroembryonic stage, organ formation stage and hatching stage. At the water temperature of (27±0.5) ℃, it took approximately 197 h for the fertilized egg to hatch out of the membrane. The newly hatched larvae had a total length of (4.415±0.412) mm, a transparent body, obvious fin membranes, and only a small portion of the yolk sac remained, which had been opened for feeding. Larval stage: At 9 days after hatching [DAH, body length of (6.813±0.835) mm)], the fin membrane disappeared and the fins formed, and the banding on the head appeared. Juvenile stage: at 21 DAH [Body length of (10.581±2.659 mm)], accompanied by scale formation on the body, the differentiation of body colour and stripe banding started to appear. Young stage: 35 DAH [Body length of (15.512±4.927) mm], four different strains with different body colour patterns were easily identified. In brief, as an artificially selected new variety, the most obvious feature during the post-embryonic development of speckled snowmark clownfish is formation and differentiation of body colour patterns such as stripe banding during juvenile stage.
-
水产养殖是世界上增长最快的食品生产领域之一,对全球粮食安全和优质蛋白质供给贡献重大,海水网箱养殖是其中的重要组成部分[1]。作为海水网箱养殖系统的核心构件之一,材质合适的网衣对于海水养殖生产至关重要。常规的聚乙烯和尼龙材料的养殖网衣很容易受到污损生物的影响[2]。污损生物在海水网箱养殖网衣上的附着已经成为一个日益影响海水养殖产业的全球性问题[3]。其会降低养殖网箱的容积,缩紧网眼,增加锚链的拖曳强度[3],养殖网箱的质量也会严重增加,并进一步导致网箱浮力的降低和网衣形变的增加[2-3]。另外,污损生物的附着还会对网衣造成直接的物理损伤,加速其老化;网目尺寸的降低会减少水流、营养物质的交换和养殖生物自身排泄物的扩散稀释[4]。同时,溶解氧含量也会受其干扰,特别是在污损生物附着量较大的夏季,污损生物附着叠加较高的水温,加上污损生物自身的呼吸活动,会进一步加剧溶解氧含量的下降,严重时可能会出现缺氧现象,不仅影响养殖生产,还可能会影响周边海洋环境,造成局部富营养化等负面影响[5]。此外,污损生物群落的形成可能会为寄生虫和病原微生物提供栖息场所,从而对养殖生物的健康产生潜在危害[6]。换网、人工或机器清理、防污涂层、化学产品的投入等物理、化学方法是海水网箱养殖业中常用的清除污损生物的途径,但上述方式可能会对周边海洋环境造成不利影响,有效性不强[7],也会额外增加养殖成本,降低养殖收入[8]。因此,需要寻找更有效的替代策略。
使用新型材料是替代并弥补传统网衣材料缺点的一种可行性策略[9]。目前海水养殖领域已经涌现出超高分子量聚乙烯、龟甲网和金属网等材料,替代传统的聚乙烯和尼龙材质的网衣,减少污损生物附着带来的危害[10]。其中,铜合金和超高分子量聚乙烯材料因其独特的性能而受到关注。铜合金是由铜和其他金属元素组成的合金材料,具有很好的抗腐蚀性、抗污损生物附着和抗凝水性能,以及较高的强度和耐磨性,已应用于海水养殖生产中,相比较传统网衣材料,其优越性也有相关报道[11]。超高分子量聚乙烯一般指相对分子质量在150×104以上的无支链线性聚乙烯,分子链上基本不含极性基团,结晶度一般在65%~85%,密度为0.920~0.964 g·cm−3。相对其他常用的工程塑料,超高分子量聚乙烯的密度降低,而其断裂伸长率和抗冲击强度均大幅提升,使其在水产养殖领域得到了不少应用[12]。新材料的应用在防止污损生物附着和养殖生物逃逸,保持养殖生物健康,减少传统网衣材料对环境的潜在负面影响等方面均表现出了良好的应用前景。但目前关于不同材质新材料之间防止污损生物附着效果的比较研究仍较缺乏,国内极少见相关文献,需要进一步开展相关筛选研究。
本研究通过超高分子量聚乙烯材质网衣和铜合金材质网衣的现场海上挂网实验,比较分析2种材质网衣附着的污损生物的种类组成、数量、季节变化及演替规律等,为海水网箱养殖网衣新材料的应用筛选、网衣的维护和清洗策略提供科学依据。
1. 材料与方法
1.1 实验材料
超高分子量聚乙烯纤维材料购自荷兰帝斯曼迪尼玛纤维公司 (DSM Dyneema) 并喷涂了防污涂层,铜合金材料购自日本三菱伸铜株式会社,由专业网衣厂商编织成网,具体规格为30 cm×30 cm。其中,铜合金网衣网目尺寸 (方形网目边长) 为5 cm,网线直径4 mm;超高分子量聚乙烯网衣网目拉直内径尺寸为5.2 cm,网线直径3 mm (图1)。另外配套的材料还包括钢筋、聚乙烯缆绳、尼龙扎带、铁锚、浮球等。
1.2 实验方法
1.2.1 挂网制作
超高分子量聚乙烯和铜合金网衣首先使用与其大小匹配的钢筋框固定并连接在一起,用尼龙扎带将网衣固定在钢筋框上,每组网衣均为铜合金和超高分子量聚乙烯网衣各1片,在外侧4个角使用聚乙烯缆绳将网衣材料串联。
1.2.2 实验海域
经现场踏勘调研,现场挂网实验在福建莆田南日岛福建龙源风力发电有限公司风电场海域开展,具体位置为风电场的测风塔 (119.54°E, 25.24°N) (图2-a)。实验海域水深约15 m,最低潮时水深约12 m,测风塔的桩基作为实验的挂点 (图2-b)。
1.2.3 实验设计
由图2可知,实验场所养殖设施密布,受周边船只通航的影响,实验方案需要减少缆绳在水平方向上的伸展。实验示意图如图3所示,首先将约100 m长的缆绳两头分别固定在测风塔两侧的桩基上,向外拉伸,形成“U”形,在“U”形的中间位置,垂直方向上沉积物中布设1根铁锚用缆绳连接,使“U”形稳定,然后水平方向上在“U”形的一侧布设挂网材料,与海面垂直,离海面约0.5 m,挂网材料垂直方向上使用长度约16 m的缆绳与浮筒连接固定,保持挂网材料能够随潮水涨落。同时,在浮筒上使用黄色油漆标记不同挂网组,便于后续识别取样。取样或者更换新的网衣组时,使用船舶起锚机将缆绳拉出海面取样或者更换新的网衣组,同时将网衣组拆解,分成单个网衣材料,然后平铺包装在聚乙烯密封袋中,分类编号带回实验室待分析。
在污损生物生长旺盛的春季 (2022年3—5月) 和夏季 (2022年6—8月) 开展逐月现场实验。
1.2.4 污损生物的鉴定分析
对每一个网衣对应的的污损生物用精密电子天平测定 (精度为0.01 g) 湿质量,采用体式显微镜进行种类鉴定。
1.2.5 密实度计算
网衣密实度指污损生物和网线面积之和与网衣面积的比值,可以反映污损生物的覆盖情况,基于计算机识别技术的计算方法为:输入网衣图像,调整图像大小,选取网衣总面积,计算网衣区域面积 (D1),利用大津算法 (Otsu's method) 将图像中的物体与背景进行自动分割,计算附着物及网线面积 (D2)。示意图见图4。公式为:
$$ \text { 密实度 }=\left(D_2 / D_1\right) \times 100 {\text{%}} $$ (1) 1.2.6 污损生物的群落优势种
采用相对重要性指数 (IRI) 进行污损生物的群落优势种分析[13],公式为:
$$ { {\rm{IRI}} }=(W+N) \times F \times 10^4$$ (2) 式中:W为某一种类的湿质量占总湿质量的百分比;N为某一种类的丰度占总丰度的百分比;F为该种类的出现频率。IRI≥1 000作为重要优势种的判别标准。
2. 结果
2.1 春、夏季2种网衣的密实度变化
春、夏季高分子量聚乙烯网衣和铜合金网衣的密实度变化趋势 (图5) 表明,2种网衣的密实度变化趋势基本一致,整体上表现为春季至夏季逐渐增加。其中,高分子量聚乙烯网衣的密实度均高于铜合金网衣。
由高分子量聚乙烯网衣和铜合金网衣污损生物的附着情况 (图6) 可以直观地看出,春季3月2种网衣污损生物开始有少量附着,4月污损生物有比较明显的增加,5月污损生物的种类发生转变;夏季6月污损生物的种类又发生转变,且6—7月污损生物的附着量增加,8月污损生物的种类又发生转变。
![]() 图 6 春、夏季 2 种网衣污损生物的附着情况注:图中sp代表春季,su代表夏季;3—8代表月份;c代表铜合金网衣,h代表高分子量聚乙烯网衣。Fig. 6 Adhesion of fouled organisms of ultra high molecular polyethylene mesh and copper alloy mesh in different seasonsNote: In the figure, sp represents spring, and su represents autumn; 3−8 represent months, c represents copper alloy mesh, and h represents ultra high molecular polyethylene mesh.
图 6 春、夏季 2 种网衣污损生物的附着情况注:图中sp代表春季,su代表夏季;3—8代表月份;c代表铜合金网衣,h代表高分子量聚乙烯网衣。Fig. 6 Adhesion of fouled organisms of ultra high molecular polyethylene mesh and copper alloy mesh in different seasonsNote: In the figure, sp represents spring, and su represents autumn; 3−8 represent months, c represents copper alloy mesh, and h represents ultra high molecular polyethylene mesh.2.2 春、夏季2种网衣污损生物的湿质量和附着密度
春季,高分子量聚乙烯网衣和铜合金网衣污损生物的平均湿质量分别为 (144.83±15.69) 和 (118.32±20.13) g·网−1;夏季,平均湿质量分别为 (1 054.59±34.81) 和 (876.25±23.16) g·网−1。春季,高分子量聚乙烯网衣和铜合金网衣污损生物的平均密度分别为 (2 699±49) 和 (2 678±42) 个·网−1;夏季,平均密度分别为 (4 630±53) 和 (3 870±64) 个·网−1。整体上,春、夏季高分子量聚乙烯网衣的平均湿质量和平均密度均高于铜合金网衣。
2.3 春、夏季2种网衣污损生物的种类构成
春季高分子量聚乙烯网衣共鉴定出5大类12种污损生物,其中甲壳动物种类数最多 (5种),占总种类数的41.67%;藻类4种,占总种类数的33.33%;软体动物、环节动物、刺胞动物各1种,均占总种类数的8.33%。春季铜合金网衣也共鉴定出5大类12种污损生物,其中甲壳动物种类数最多 (5种),占总种类数的41.67%;藻类3种,占总种类数的25.00%;环节动物2种,占总种类数的16.67%;软体动物、刺胞动物各1种,均占总种类数的8.33%。
夏季高分子量聚乙烯网衣共鉴定出7大类35种污损生物,其中以软体动物和甲壳动物种类数最多,各11种,均占总种类数的31.43%;藻类6种,占总种类数的17.14%;环节动物3种,占总种类数的8.57%;苔藓动物2种,占总种类数的5.71%;刺胞动物、棘皮动物各1种,均占总种类数的2.86%。夏季铜合金网衣共鉴定出6大类19种污损生物,其中以软体动物和甲壳动物种类数最多,各6种,均占总种类数的31.58%;藻类3种,占总种类数的15.79%;环节动物2种,占总种类数的10.53%;刺胞动物和苔藓动物各1种,均占总种类数的5.26%。
春季高分子量聚乙烯网衣和铜合金网衣污损生物种类数相同,而夏季高分子量聚乙烯网衣污损生物种类数明显多于铜合金网衣。
2.4 春、夏季2种网衣污损生物的优势种类
春、夏季2种网衣污损生物的优势种类如表1所示。春季,高分子量聚乙烯网衣出现的优势种有4种,分别为长颈麦杆虫 (Caprella equilibra)、中胚花筒螅 (Tubularia mesembryanthemum)、理石叶钩虾 (Jassa marmorata) 和厚壳贻贝 (Mytilus coruscus);铜合金网衣出现的优势种有3种,分别为长颈麦杆虫、理石叶钩虾和厚壳贻贝。其中,长颈麦杆虫、理石叶钩虾和厚壳贻贝是2种网衣的共同优势种,第一优势种均为长颈麦杆虫,高分子量聚乙烯网衣和铜合金网衣长颈麦杆虫的IRI分别为4 740和3 676。
表 1 春、夏季2种网衣污损生物的优势种类统计Table 1 Statistics of dominant species of fouled organisms for two kinds of net in spring and summer网衣类型
Type of mesh春季 Spring 夏季 Summer 种名
Species
name数量
Quantity/
(个·网–1)湿质量
Wet mass/
(g·网–1)相对
重要性
指数
IRI种名
Species
name数量
Quantity/
(个·网–1)湿质量
Wet mass/
(g·网–1)相对
重要性
指数
IRI高分子量聚乙烯网衣
Ultra-high molecular
weight polyethylene mesh长颈麦杆虫
Caprella equilibra19 647 25.02 4 740 理石叶钩虾
Jassa marmorata13 326 13.65 3 285 中胚花筒螅
Tubularia mesembryanthemum131 202.42 3 970 长颈麦杆虫
Caprella equilibra10 325 10.17 2 544 理石叶钩虾
Jassa marmorata15 582 7.18 3 451 翡翠股贻贝
Perna viridis4 024 766.58 1 718 厚壳贻贝
Mytilus coruscus2 389 89.44 1 073 中胚花筒螅
Tubularia mesembryanthemum139 349.86 1 549 — — — — 背棘麦杆虫
Caprella caura5 407 13.35 1 367 — — — — 网纹藤壶
Amphibalanus
reticulatu393 639.55 1 146 铜合金网衣
Copper alloy mesh长颈麦杆虫
Caprella equilibra11 300 14.28 3 676 翡翠股贻贝
Perna viridis3 435 675.28 4 138 理石叶钩虾
Jassa marmorata8 929 4.06 2 641 长颈麦杆虫
Caprella equilibra5 392 5.91 2 813 厚壳贻贝
Mytilus coruscus2 520 129.50 1 356 理石叶钩虾
Jassa marmorata4 845 5.60 2 529 — — — — 中胚花筒螅
Tubularia mesembryanthemum103 208.87 1 641 注:—. 未鉴定出。 Note: —. Not identified. 夏季,高分子量聚乙烯网衣出现的优势种有6种,分别为理石叶钩虾、长颈麦杆虫、翡翠股贻贝 (Perna viridis)、中胚花筒螅、背棘麦杆虫 (Caprella caura) 和网纹藤壶 (Amphibalanus reticulatu);铜合金网衣出现的优势种有4种,分别为翡翠股贻贝、长颈麦杆虫、理石叶钩虾和中胚花筒螅。其中,翡翠股贻贝、长颈麦杆虫、理石叶钩虾和中胚花筒螅是2种网衣的共同优势种。高分子量聚乙烯网衣第一优势种是理石叶钩虾,IRI为3 285,而铜合金网衣第一优势种是翡翠股贻贝,IRI为4 138。
3. 讨论
3.1 2种材质网衣污损生物的生态特性
海水养殖网箱的网衣为各类污损生物的附着提供了附着基,同时,海水养殖网箱水体中丰富的营养盐为污损生物的生长提供了养料,在环境合适时,污损生物在网衣上大量繁殖生长,其附着种类和附着量与养殖海域、养殖种类、养殖设施、养殖季节等因素密切相关[14]。目前已知的中国沿海主要污损生物可以分为藻类、腔肠动物、苔藓动物、多毛类动物、软体动物、甲壳动物、被囊动物及海绵动物等8大类群,其群落组成有明显的地域性,并呈季节性变化[15]。本研究实验点位于福建南日岛海域,出现的污损生物共有7个类群,基本覆盖了上述各类群。由于受当地海区的水温、盐度、光照、溶解氧、pH、水流和营养物质等环境因素的影响,本研究出现的主要群落以近岸暖水种和沿岸温带广温种为主,春、夏季2种网衣污损生物的主要优势种类与严涛等[16]报道的东海区主要污损生物优势种相吻合。本研究表明甲壳动物和软体动物是春、夏季的主要优势类群,原因是软体动物中腹足类生物较多,其生态习性使其容易附着在网衣上,如藤壶幼虫可以释放一种黏合剂,在适宜的附着表面进行永久附着[17],而贻贝则使用胶原蛋白形成的足丝与底质牢固结合,进行选择性附着[18]。随着网衣密实度的增加,附着面积也随之增大,给甲壳动物等污损生物的生存提供了良好的场所,导致甲壳动物种类数随之增加。已有研究[19]表明,东海海域污损生物出现的低谷期为水温较低的冬、春季,其附着种数少,附着密度低,6—9月则是东海海域污损生物附着量高的季节。本研究结果与该研究一致,2种网衣污损生物的种类和数量均表现出夏季高于春季,特别是夏季总湿质量约为春季的6~9倍,总密度也比春季高约1 000个·网−1。这种季节性差异,是因为随着水温的升高,污损生物进入生长和繁殖旺盛期,个体增多,导致夏季2种网衣的密实度远高于春季[20]。春季的3—4月和夏季的6—7月2种网衣对湿质量贡献最大的附着生物均为中胚花筒螅,而5和7月对湿质量贡献最大的附着生物分别为厚壳贻贝和翡翠股贻贝,说明相同季节的不同月份之间污损生物的主要优势种也存在差异。由表1可以看出,春、夏季的优势种也存在差异,这与不同污损生物的最适生长温度有关[21]。
3.2 2种材质网衣对污损生物附着的影响
目前世界范围内海水养殖网箱的网衣一般采用传统合成纤维网衣材料加工制作,在养殖生产中由于污损生物附着严重,严重影响了网箱养殖的正常生产。本研究结果表明,不同材质的网衣对污损生物的附着有较大影响,春、夏季高分子量聚乙烯网衣污损生物的湿质量和密度均高于铜合金网衣。2种不同材质的网衣悬挂于相同海域,季节、水温、盐度、水文等环境条件相同,出现的污损生物种类、群落和生物量的差异与网衣材质有关。细菌在不同材料的表面形成的微生物膜是污损生物附着的基础,铜合金作为一种金属网衣,具有抑制微生物菌类和水生生物的作用,其主要原理是铜/海水界面的化学作用可以释放出具有杀菌作用的铜离子和其他合金元素,使铜合金表面无法形成微生物膜,从而使污损生物无法附着[22]。这种抑制效果受铜/海水界面的化学作用及污损生物的附着强度控制,同时也受铜合金网衣周边物理、化学和生物因素的影响。尽管高分子量聚乙烯网衣拉伸力等综合性能也较优秀,且本实验用高分子量聚乙烯网衣也喷涂了防污涂层,但其防污损生物附着能力仍弱于铜合金网衣,可能是由于随着时间的延长,高分子量聚乙烯网衣的防污涂层由于环境条件的影响出现磨损、剥落;同时,由于高分子量聚乙烯网衣更粗糙,更易于污损生物的附着。
值得指出的是,尽管铜合金网衣比超高分子量聚乙烯网衣的防污效果好,具有很好的抗腐蚀性、抗凝水性能,较高的强度、耐磨性、可回收利用性及较好的环保性能[11],且已在日本、美国、北欧、澳大利亚等国家或地区的海水养殖领域开展了实际应用[9,23-24]。但是,铜合金网衣的成本及网箱规格和装配技术要求均较高,需要进一步研究和改进。建议根据养殖实际需求,将多种材质的网衣联合使用,既可降低成本,又能满足渔业发展的需要。
4. 结论
超高分子量聚乙烯和铜合金网衣的污损生物附着呈现出一定的季节性差异,2种网衣污损生物的密实度、种类数、优势种种类数、湿质量和密度均表现为春季低于夏季。铜合金网衣的防污损生物附着效果优于高分子量聚乙烯网衣。
-
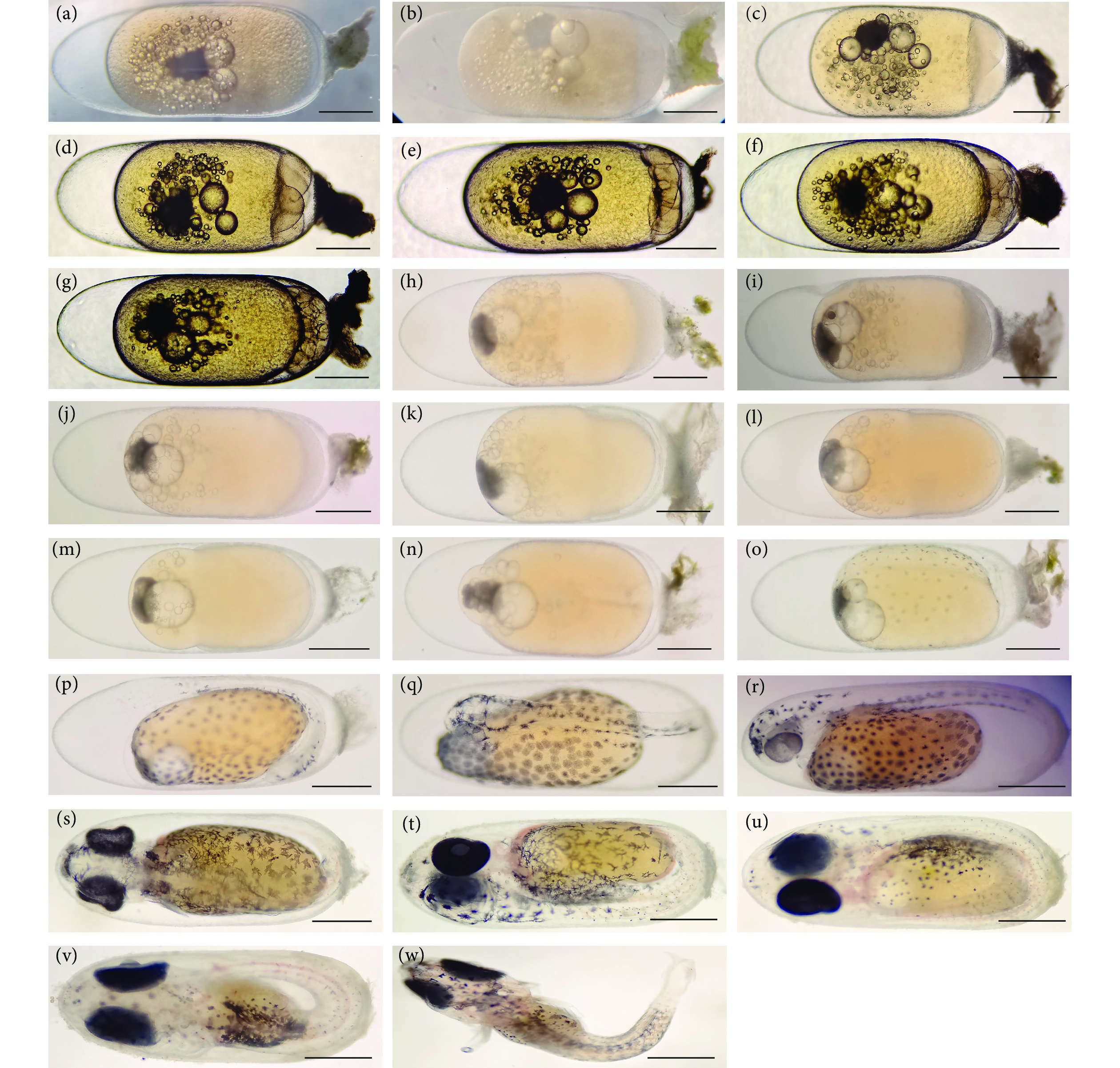
图 2 喷点雪印小丑鱼胚胎发育示意图
注:a. 受精卵期;b. 胚盘期;c—g. 卵裂期;h—j. 囊胚期;k—m. 原肠胚期;n—o. 神经胚期;p—u. 器官形成期;v. 孵化期;w. 仔鱼期;标尺为1 mm。
Figure 2. Schematic diagram of embryonic development of speckled snowmark clownfish
Note: a. Fertilized egg stage; b. Blastoderm stage; c−g. Cleavage stage; h−j. Blastocyst stage; k−m. Gastrula stage; n−o. Neurula stage; p−u. Organogenesis stage; v. Incubator; w. Larval stage; Scale bar is 1 mm.
表 1 喷点雪印小丑鱼胚胎发育过程
Table 1 Embryo development of speckled snowmark clownfish
胚胎发育时期
Embryonic development period受精后时间
Time after fertilization发育特征
Developmental characteristics受精卵期 Fertilized egg stage 0 h 卵质透明,动物极顶端有纤维附着丝,植物极一端有两个大油球和多个油球 胚盘期 Blastoderm stage 0.5 h 受精卵卵黄上方隆起一个帽状胚盘 2细胞期 2-cell phase 1 h 第1次分裂,形成2个细胞 4细胞期 4-cell phase 2 h 第2次分裂,形成4个细胞 8细胞期 8-cell phase 2.5 h 第3次分裂,形成8个细胞 16细胞期 16-cell phase 3 h 第4次分裂,形成16个细胞 32细胞期 32-cell phase 3.5 h 第5次分裂,形成32个细胞 囊胚早期 Early blastocyst 6 h 分裂球变得更小,细胞界限不清晰,在原胚盘处形成相似的隆起的囊胚 囊胚中期 Middle blastocyst 7 h 隆起的囊胚略微扁平 囊胚晚期 Late stage of blastocyst 8 h 细胞继续分裂,开始向卵黄下包 原肠早期 Early proctology 15 h 50 min 胚盘向植物极下包并内卷达卵径的1/4~1/3 原肠中期 Middle proctology 17 h 30 min 囊胚层下包达1/2左右 原肠晚期 Late stage of proctology 18 h 35 min 细胞继续下包达卵黄的3/4左右 神经胚期 Neurula stage 22 h 50 min 仅植物极一端有小部分卵黄囊外露 器官形成期 Organogenesis stage 39 h 42 min 尾巴轮廓已较为明显并离开卵黄 器官形成期 Organogenesis stage 53 h 42 min 出现无色透明的眼泡晶体,小泡状的耳囊 器官形成期 Organogenesis stage 72 h 头部左下方出现心脏,耳囊中出现耳石 器官形成期 Organogenesis stage 97 h 55 min 形成胸鳍雏形 器官形成期 Organogenesis stage 126 h 42 min 黑色素几乎布满整个眼睛 器官形成期 Organogenesis stage 164 h 胚体和卵黄囊均有血液流动 孵化期 Incubator 186 h 卵黄大部分被吸收,胚体的感觉器官相继形成 初孵仔鱼 Larval stage 197 h 卵膜开始软化变薄,完成孵化 表 2 仔、稚、幼鱼发育过程及特征
Table 2 Development process and characteristics of larvae, juveniles and young fish
孵化后日龄
Day after hatching发育时期
Developmental period发育特征
Developmental characteristics0 仔鱼期 Larva 仔鱼口裂形成,已开口摄食 1 仔鱼期 Larva 肛门与外界贯通,卵黄囊消耗完毕 2 仔鱼期 Larva 尾鳍开始发育,鳍条7~9条 4 仔鱼期 Larva 脑部器官基本形成 5 仔鱼期 Larva 鳍条发育速度加快 6 仔鱼期 Larva 鳍膜开始逐渐消退 7 仔鱼期 Larva 口裂扩大,身体色素加深 9 稚鱼期 Juvenile 鳍膜完全消失,第一条纹带开始在头部形成 15 稚鱼期 Juvenile 体表开始长出鳞片,各鳍发育基本完成 16 稚鱼期 Juvenile 部分稚鱼出现第二条纹带 21 幼鱼期 Young fish 身体大部分被鳞,开始出现体色和纹带不同的幼鱼 23 幼鱼期Young fish 身体完全被鳞,从外表可大致分为4种形态 35 幼鱼期 Young fish 体色、纹路分化完成,体表特征与成鱼基本一致 -
[1] 叶乐, 胡静, 王雨, 等. 光周期和光照强度对克氏双锯鱼仔鱼存活、生长和发育的影响[J]. 琼州学院学报, 2014, 21(5): 78-86. [2] 滕力平, 杨担光, 李晓光, 等. 二线小丑鱼的人工繁殖[J]. 水产科学, 2005(2): 26-28. [3] 鲍鹰, 张鹏, 祝承勇, 等. 红小丑人工繁殖和育苗的初步研究[J]. 海洋科学, 2009, 33(2): 5-10. [4] 鲍鹰, 张鹏, 祝承勇, 等. 棘颊雀鲷人工繁殖与育苗的初步研究[J]. 海洋科学, 2011, 35(3): 67-71. [5] 单乐州, 邵鑫斌, 闫茂仓, 等. 透红小丑鱼的繁殖习性、胚胎发育和胚后发育[J]. 水产科技情报, 2015, 42(1): 25-29, 35. [6] KUMAR T T A, GOPI M, DHANEESH K V, et al. Hatchery production of the clownfish Amphiprion nigripes at Agatti Island, Lakshadweep, India[J]. J Environ Biol, 2012, 33(3): 623-628.
[7] DHANEESH K V, DEVI K N, KUMAR T T A, et al. Breeding, embryonic development and salinity tolerance of Skunk clownfish Amphiprion akallopisos[J]. J King Saud Univ Sci, 2012, 24(3): 201-209. doi: 10.1016/j.jksus.2011.03.005
[8] 윤영석, 노섬, 최영웅, et al. Saddleback clownfish, Amphiprion polymnus 의 종묘생산에 관한 연구 1) 산란과 난 발생 및 자치어 사육[J]. 한국양식학회지, 2005, 18(2): 107-114.
[9] 王斌, 王士莉, 杨爱国, 等. 眼斑双锯鱼的人工繁育技术研究[J]. 渔业科学进展, 2010, 31(5): 41-46. [10] MADHU K, MADHU R. Successful breeding of common clownfish Amphiprion percula under captive conditions in Andaman and Nicobar Island[J]. Fish Chim, 2002, 22(9): 16-17.
[11] DHANEESH K V, KUMAR T T A, SHUNMUGARAGJ T. Embryonic development of percula clown fish, Amphiprion percula (Lacepede, 1802)[J]. Middle East J Sci Res, 2009, 4(2): 84-89.
[12] 鞠晨曦, 李云, 刘红, 等. 眼斑双锯鱼胚胎发育的形态学观察[J]. 海洋渔业, 2014, 36(1): 8-15. [13] BALAMURUGAN J, KATHIRESAN K, MEENAKUMARI B. Interspecific hybridization and reproductive biology of marine clownfishes, the orange clownfish Amphiprion percula and clown anemonefish A. ocellaris[J]. N Am J Aquac, 2018, 80(3): 301-309. doi: 10.1002/naaq.10033
[14] 何丽斌, 朱志煌, 马敏宁, 等. 毕加索小丑鱼胚胎发育的形态学观察[J]. 应用海洋学学报, 2017, 36(4): 545-549. [15] 何丽斌, 黄镇, 吴水清, 等. 基于转录组测序技术对调控毕加索小丑鱼 (Picasso clownfish) 白化体征关键基因的研究[J]. 海洋学报, 2022, 44(2): 67-76. [16] 李飞, 高欣东, 刘洋, 等. 不同温度、盐度条件对三种小丑鱼仔鱼发育和变态的影响[J]. 河北渔业, 2022(6): 9-14, 34. [17] 张薇, 孙志宾, 马爱军, 等. 双锯鱼属 (Amphiprion) 四种鱼种比较胚胎学研究和进化探讨[J]. 海洋与湖沼, 2018, 49(3): 671-681. [18] 刘鉴毅, 李琪, 孙艳秋, 等. 多纹钱蝶鱼胚胎发育及胚后发育观察[J]. 中国水产科学, 2021, 28(8): 978-987. [19] 黄小林, 杨育凯, 李涛, 等. 黄斑篮子鱼仔、稚、幼鱼形态观察与生长研究[J]. 南方水产科学, 2018, 14(5): 88-94. [20] LI J, HAN Y L, MA Q H, et al. Early development of lamprey Lampetra japonica (Martens, 1868)[J]. Aquac Res, 2019, 50(5): 1501-1514. doi: 10.1111/are.14026
[21] BOHÓRQUEZ-CRUZ M, RODRÍGUEZ S, SONNENHOLZNER S, et al. Early development and juvenile culture technique of speckled flounder, Paralichthys woolmani (Jordan & Williams, 1897) under ambient seawater[J]. J Appl Ichthyol, 2018, 34(3): 610-616. doi: 10.1111/jai.13624
[22] 刘明鉴, 郭华阳, 高杰, 等. 尖翅燕鱼早期胚胎发育及仔稚鱼形态观察[J]. 南方水产科学, 2022, 18(4): 103-111. [23] dos SANTOS J A, SOARES C M, BIALETZKI A. Early ontogeny of yellowtail tetra fish Astyanax lacustris (Characiformes: Characidae)[J]. Aquac Res, 2020, 51(10): 4030-4042. doi: 10.1111/are.14746
[24] 黄小林, 李涛, 林黑着, 等. 网箱养殖黄斑篮子鱼胚胎发育观察[J]. 南方水产科学, 2018, 14(2): 96-101. [25] 吕爽, 夏苏东, 高燕, 等. 白条双锯鱼胚胎及仔稚鱼发育形态学观察[J]. 南方农业学报, 2021, 52(12): 3303-3310. [26] 张呈祥, 徐钢春, 徐跑, 等. 美洲鲥仔、稚、幼鱼的形态发育与生长特征[J]. 中国水产科学, 2010, 17(6): 1227-1235. [27] 吕雪娇, 王雨浓, 刘清华, 等. 鞍带石斑鱼仔稚幼鱼骨骼发育与生长特性研究[J]. 海洋科学, 2018, 42(5): 116-121. [28] 刘银华, 张雅芝, 钟幼平, 等. 云纹石斑鱼仔、稚、幼鱼的形态观察[J]. 应用海洋学学报, 2016, 35(4): 514-521. [29] 吴水清, 郑乐云, 黄种持, 等. 云纹石斑鱼(♀)×鞍带石斑鱼(♂)杂交子代胚胎发育及仔稚幼鱼形态观察[J]. 渔业研究, 2016, 38(1): 27-35. [30] PEPE-VICTORIANO R, MIRANDA L, ORTEGA A, et al. Descriptive morphology and allometric growth of the larval development of Sarda chiliensis chiliensis (Cuvier, 1832) in a hatchery in northern Chile[J]. Aquac Rep, 2021, 19: 100576. doi: 10.1016/j.aqrep.2020.100576
[31] PAULINE S, NATACHA R, DELAI H, et al. Thyroid hormones regulate the formation and environmental plasticity of white bars in clownfishes[J]. Proc Natl Acad Sci USA, 2021, 118(23): e2101634118. doi: 10.1073/pnas.2101634118
[32] 李小慧, 汪学杰, 牟希东, 等. 观赏鱼着色研究进展[J]. 河北渔业, 2008(12): 6-7, 14.




 下载:
下载:









 粤公网安备 44010502001741号
粤公网安备 44010502001741号
