Comparative analysis of muscle quality, intestinal morphology and microbial composition in two cultured frogs species
-
摘要:
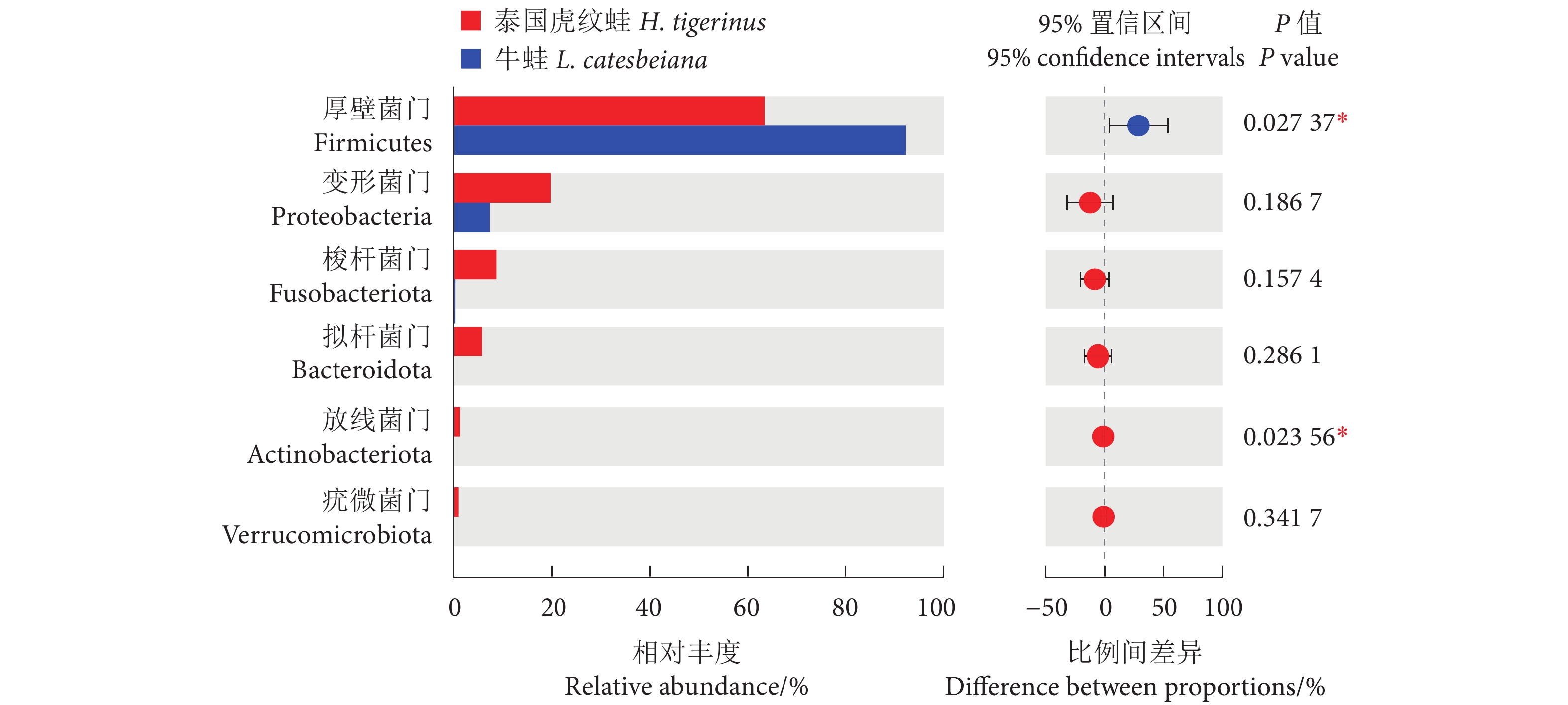
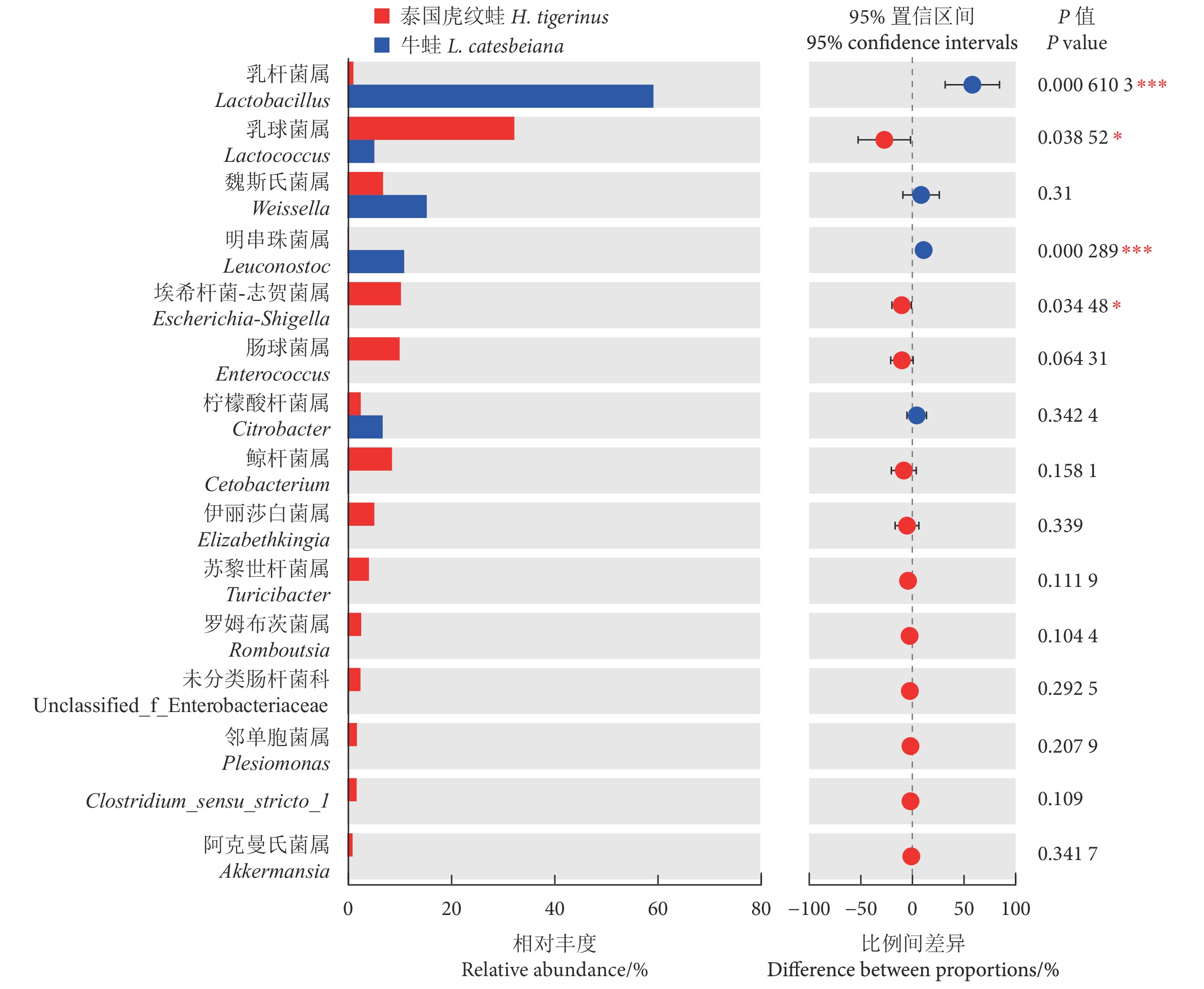
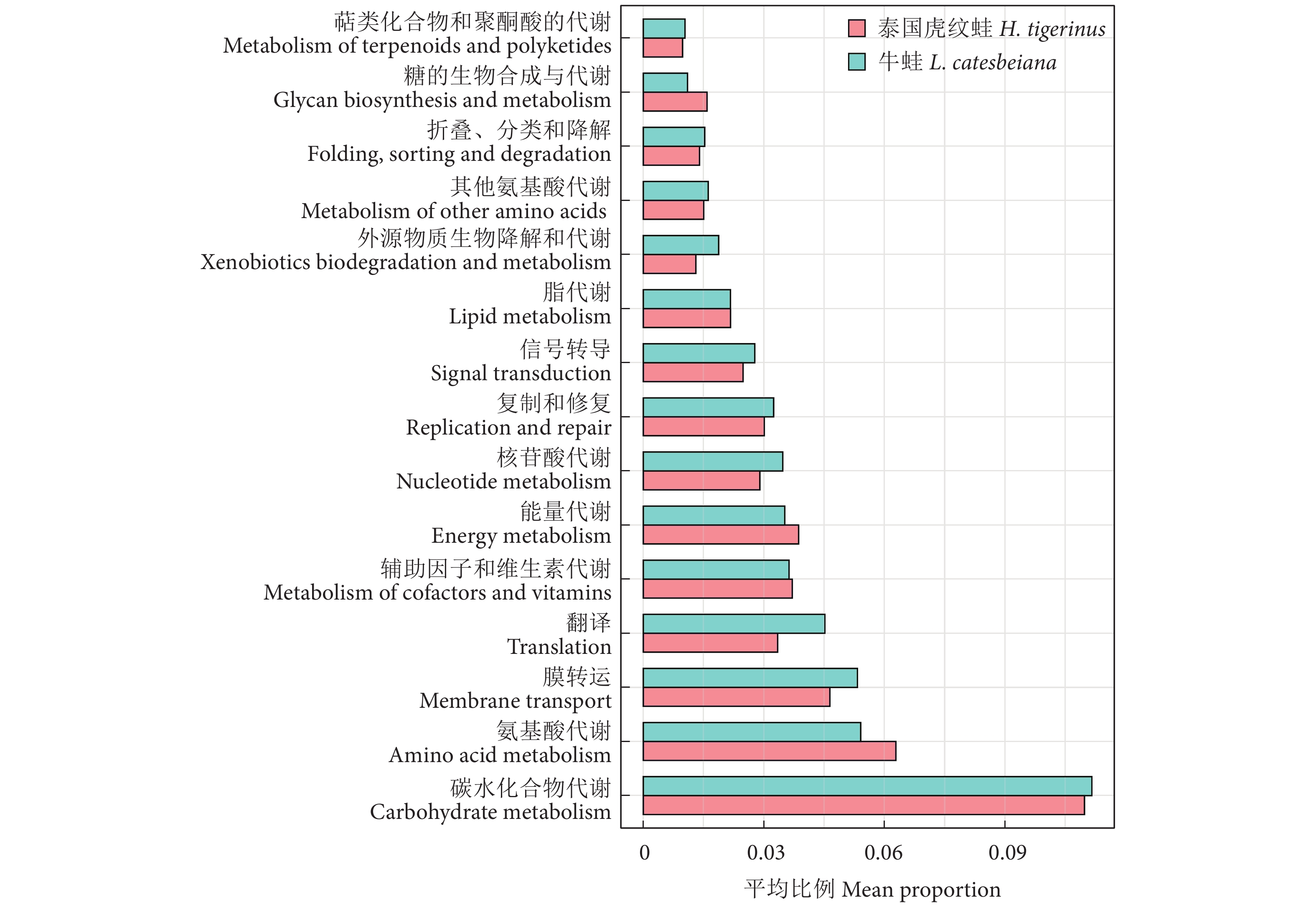
为分析泰国虎纹蛙 (Hoplobatrachus tigerinus) 和牛蛙 (Lithobates catesbeiana) 的肌肉品质、肠道形态及微生物构成,采用食品安全国家标准测定方法对这两种养殖蛙的肌肉营养成分进行监测,结合肌肉质构和显微结构的分析对两者肌肉品质进行评价,同时利用高通量测序和组织学切片技术对两者肠道微生物群落构成和显微结构进行分析。结果显示,泰国虎纹蛙和牛蛙氨基酸总量差异不显著 (P>0.05);牛蛙的不饱和脂肪酸含量显著高于泰国虎纹蛙 (P<0.05)。此外,牛蛙肌肉的硬度、咀嚼性和胶黏性均显著高于泰国虎纹蛙 (P<0.05)。肠道微生物分析显示,泰国虎纹蛙的Shannon、Ace和Chao1指数均显著高于牛蛙 (P<0.05);门水平上,牛蛙的厚壁菌门丰度显著高于泰国虎纹蛙 (P<0.05),而放线菌门丰度显著低于后者 (P<0.05);属水平上,泰国虎纹蛙的乳球菌属 (Lactococcus) 和埃希杆菌-志贺菌属 (Escherichia-Shigella)丰度显著高于牛蛙 (P<0.05),而乳杆菌属 (Lactobacillus) 和明串珠菌属 (Leuconostoc) 丰度显著低于后者 (P<0.05)。研究表明,泰国虎纹蛙和牛蛙肌肉品质存在差异,但营养价值均较高;高通量测序分析显示两者肠道微生物群落组成存在差异。
Abstract:In order to investigate the muscle quality, intestinal morphology and microbial composition of Hoplobatrachus tigerinus and Lithobates catesbeiana, we monitored the muscle nutritional components of two cultured frogs species by national food safety standard measurement method, and evaluated their muscle quality in addition with analysis of muscle texture and microstructure. Besides, we applied high-throughput sequencing and histological section technology to analyze the microbial community composition and microstructure of their gut. The results show that there was no significant difference in the total amino acids between H. tigerinus and L. catesbeiana (P>0.05). The unsaturated fatty acids content of L. catesbeiana were significantly higher than those of H. tigerinus (P<0.05). In addition, the muscle hardness, chewiness and gumminess of L. catesbeiana were significantly higher than those of H. tigerinus (P<0.05). The analyses of intestinal microbial communities show that the Shannon, Ace and Chao1 indexes of H. tigerinus were significantly higher than those of L. catesbeiana (P<0.05). At phylum level, the abundance of Firmicutes in L. catesbeiana was significantly higher than that in H. tigerinus (P<0.05), while the abundance of Actinobacteriota was significantly lower (P<0.05); At genus level, the abundance of Lactococcus and Escherichia-Shigella in H. tigerinus was significantly higher than that in L. catesbeiana (P<0.05), while Lactobacillus and Leuconostoc were significantly lower (P<0.05). The results show that there are differences in muscle quality between H. tigerinus and L. catesbeiana, but both have high nutritional value; high-throughput sequencing analyses show that there are differences in the composition of intestinal microbial communities between the two species.
-
-
表 1 泰国虎纹蛙和牛蛙每100 g肌肉常规营养成分比较
Table 1 Comparison of conventional nutrients per 100 g of muscle between H. tigerinus and L. catesbeian g
营养成分
Nutrientional composition泰国虎纹蛙
H. tigerinus牛蛙
L. catesbeiana水分 Moisture 74.53±0.12 73.03±0.12 灰分 Crude ash 1.13±0.06b 1.03±0.06a 粗蛋白 Crude protein 23.63±0.15 24.00±0.36 粗脂肪 Crude lipid 0.70±0.00a 0.83±0.56b 注:同行不同字母表示组间差异显著 (P<0.05),下表同此。 Note: Values with different letters within the same row indicate significant differences (P<0.05), the same in the following tables. 表 2 泰国虎纹蛙和牛蛙每100 g肌肉氨基酸比较
Table 2 Comparison of amino acids per 100 g of muscle of H. tigerinus and L. catesbeian
g 氨基酸
Amino acid泰国虎纹蛙
H. tigerinus牛蛙
L. catesbeiana氨基酸
Amino acid泰国虎纹蛙
H. tigerinus牛蛙
L. catesbeiana天门冬氨酸 Asp 2.57±0.06 2.55±0.08 亮氨酸 Leu 0.62±0.01 0.55±0.03 谷氨酸 Glu 1.18±0.02 1.17±0.44 赖氨酸 Lys 1.64±0.04 1.62±0.05 丝氨酸 Ser 1.16±0.02 1.18±0.04 脯氨酸 Pro 1.14±0.06 1.02±0.01 甘氨酸 Gly 3.98±0.12 3.98±0.13 氨基酸总量 TAA 24.50±0.52 24.10±0.79 苏氨酸 Thr 1.20±0.08b 1.03±0.01a 必需氨基酸 EAA 11.10±0.22 10.80±0.35 组氨酸 His 1.47±0.04 1.42±0.05 非必需氨基酸 NEAA 13.42±0.29 13.31±0.40 丙氨酸 Ala 1.23±0.02 1.23±0.38 呈味氨基酸 FAA 10.72±0.24 10.75±0.35 精氨酸 Arg 0.73±0.01 0.77±0.03 支链氨基酸 BCAA 5.02±0.12 4.94±0.20 酪氨酸 Tyr 1.21±0.04 1.19±0.04 芳香氨基酸 AAA 2.28±0.55 2.26±0.73 缬氨酸 Val 2.08±0.05 2.07±0.09 EAA/NEAA 82.69% 81.13% 蛋氨酸 Met 0.96±0.02 0.95±0.03 EAA/TAA 45.26% 44.75% 苯丙氨酸 Phe 1.07±0.02 1.07±0.04 FAA/TAA 43.71% 44.61% 异亮氨酸 Ile 2.33±0.07 2.31±0.09 BCAA/AAA 2.20 2.19 表 3 泰国虎纹蛙和牛蛙肌肉氨基酸营养价值评价
Table 3 Evaluation of amino acids traits in muscles of H. tigerinus and L. catesbeiana
项目
Item必需氨基酸
Essential amino acid泰国虎纹蛙
H. tigerinus牛蛙
L. catesbeiana氨基酸评分
AAS异亮氨酸 Ile 0.58 0.58 亮氨酸 Leu 0.09 0.08 赖氨酸 Lys 0.30 0.30 苏氨酸 Thr 0.30 0.26 缬氨酸 Val 0.41 0.41 蛋氨酸+半胱氨酸
Met+Cys0.27 0.27 苯丙氨酸+酪氨酸
Phe+Tyr0.38 0.37 化学评分
CS异亮氨酸 Ile 0.43 0.43 亮氨酸 Leu 0.07 0.06 赖氨酸 Lys 0.23 0.23 苏氨酸 Thr 0.25 0.22 缬氨酸 Val 0.42 0.42 蛋氨酸+半胱氨酸
Met+Cys0.17 0.17 苯丙氨酸+酪氨酸
Phe+Tyr0.24 0.24 必需氨基酸
指数
EAAI22.76 21.81 表 4 泰国虎纹蛙和牛蛙每100 g肌肉脂肪酸比较
Table 4 Comparison of fatty acids in per 100 g muscles of H. tigerinus and L. catesbeiana
g 脂肪酸
Fatty acid泰国虎纹蛙
H. tigerinus牛蛙
L. catesbeiana脂肪酸
Fatty acid泰国虎纹蛙
H. tigerinus牛蛙
L. catesbeiana月桂 C12:0 0.03±0.00b 0.02±0.00a 二十碳三烯酸 C20:3 2.64±0.05 2.76±0.10 豆蔻 C14:0 0.38±0.03a 0.57±0.01b 二十碳四烯酸 C20:4 8.75±0.21b 5.27±0.05a 十五烷酸 C15:0 0.18±0.01a 0.22±0.01b 芥酸 C22:1 0.07±0.00a 0.10±0.00b 棕榈酸 C16:0 22.23±0.06b 19.57±0.15a 二十碳五烯酸 C20:5 1.72±0.05a 3.08±0.10b 十七烷酸 C17:0 0.29±0.00a 0.33±0.00b 二十二碳四烯酸 C22:4 0.55±0.02 0.64±0.06 硬脂酸 C18:0 7.42±0.36b 6.25±0.22a 二十四碳一烯酸 C24:1 0.85±0.03b 0.30±0.02a 花生酸 C20:0 0.09±0.00 0.09±0.01 二十二碳五烯酸 C24:1 2.30±0.06a 2.59±0.05b 二十三烷酸 C23:0 0.34±0.01a 0.57±0.01b 二十二碳六烯酸 (DHA) C22:6 6.53±0.11a 9.28±0.23b 棕桐油酸 C16:1 2.84±0.24a 5.15±0.15b 必需脂肪酸 EFA 25.71±0.36b 19.07±0.18a 油酸 C18:1 14.73±0.31a 22.20±0.17b 饱和脂肪酸 SFA 30.94±0.31b 27.61±0.35a 亚油酸 C18:2 24.40±0.30b 17.93±0.15a 不饱和脂肪酸 UFA 68.73±0.31a 72.30±0.23b 亚麻酸 C18:3 1.31±0.08b 1.14±0.03a 单不饱和脂肪酸 MUFA 21.38±0.38a 31.17±0.20b 二十碳一烯酸 C20:1 0.61±0.02a 0.94±0.06b 多不饱和脂肪酸 PUFA 47.6±0.14b 41.1±0.41a 二十碳二烯酸 C20:2 1.70±0.12b 1.02±0.02a PUFA/SFA (P/S) 1.53±0.12 1.49±0.33 表 5 泰国虎纹蛙和牛蛙肌肉质构特性的比较
Table 5 Comparison of texture properties in muscle of H. tigerinus and L. catesbeiana
指标
Index泰国虎纹蛙
H. tigerinus牛蛙
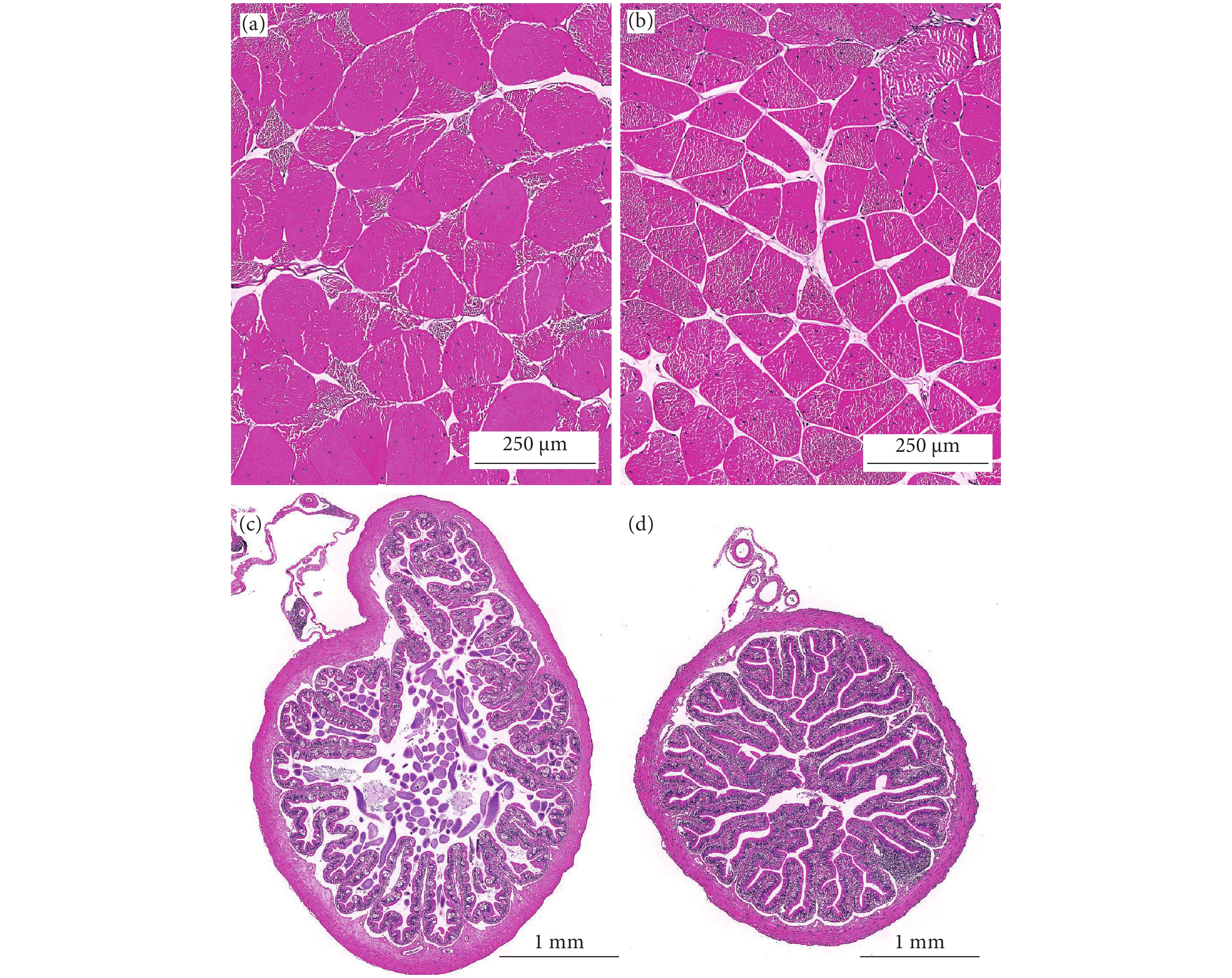
L. catesbeiana硬度 Hardness/N 58.67±9.05a 90.37±15.76b 黏性Stickiness 4.91±1.17b 3.27±1.23a 弹性 Springiness/mm 0.65±0.08 0.66±0.12 咀嚼性 Chewiness/mJ 25.99±0.08a 43.24±12.87b 胶黏性 Gumminess/N 37.49±5.70a 66.43±15.12b 内聚性 Cohesiveness/% 0.73±0.46 0.76±0.07 表 6 泰国虎纹蛙和牛蛙肌纤维和肠道组织结构比较
Table 6 Comparison of muscle fibe and intestine morphology of H. tigerinus and L. catesbeiana
项目
Item泰国虎纹蛙
H. tigerinus牛蛙
L. catesbeiana肌纤维密度
Density of muscle fibers/(根·mm−2)124.80±10.89 122.24±7.87 肌纤维直径
Diameter of muscle fibers/μm87.72±27.97a 94.10±18.02b 肠绒毛高度
Intestinal villus height/μm636.46±93.56a 676.54±111.15b 肠绒毛宽度
Intestinal villus width/μm188.69±30.86a 231.69±51.77b 肠肌层厚度
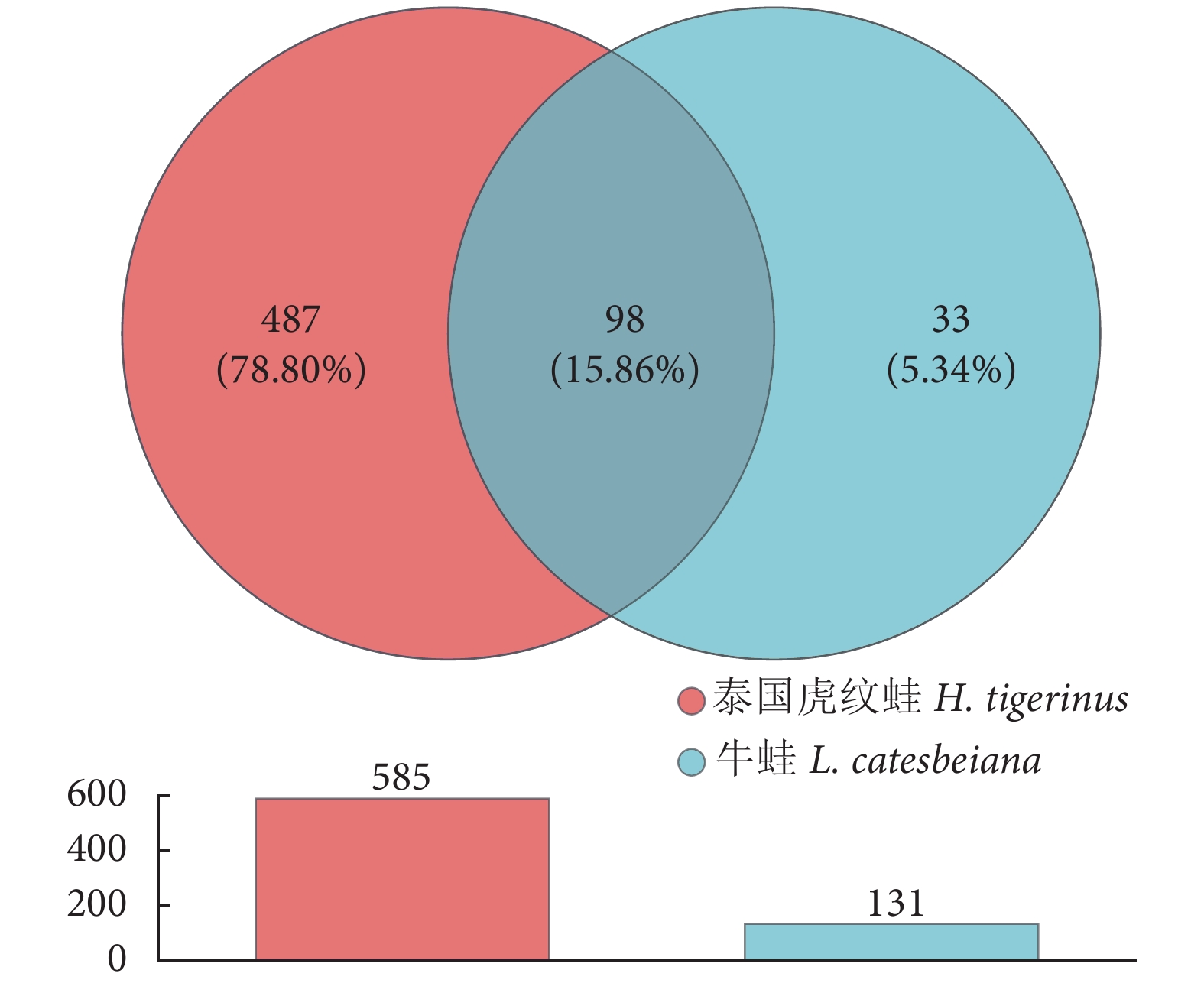
Intestinal muscular thickness/μm140.85±34.82b 124.01±15.16a 表 7 Alpha多样性指数
Table 7 Alpha diversity indices of six samples
多样性指数
Diversity index泰国虎纹蛙
H. tigerinus牛蛙
L. catesbeianaGood_coverage 0.999 5 0.999 7 Shannon 2.39±0.49b 1.13±0.20a Simpson 0.17±0.05a 0.50±0.10b Ace 219.42±82.25b 70.66±19.79a Chao1 213.39±80.07b 69.73±21.97a -
[1] 方卫东, 鲁康乐, 张春晓, 等. 豆粕替代鱼粉对牛蛙生长、体组成、消化酶活力及肝脏生化指标的影响[J]. 水产学报, 2016, 40(11): 1742-1752. [2] 刘世伟. 稻蛙共作对稻田土壤生态及水稻生长、产量与品质性状的影响[D]. 广州: 华南农业大学, 2019: 8. [3] 牛树辉, 李红燕, 潘厚军, 等. 鲜活饵料和人工配合饲料对鳜肌肉营养成分和质构特性的影响[J]. 水生生物学报, 2023, 47(1): 37-44. [4] JIANG W D, WU P, TANG R J, et al. Nutritive values, flavor amino acids, healthcare fatty acids and flesh quality improved by manganese referring to up-regulating the antioxidant capacity and signaling molecules TOR and Nrf2 in the muscle of fish[J]. Food Res Int, 2016, 89: 670-678. doi: 10.1016/j.foodres.2016.09.020
[5] 何志刚, 王冬武, 徐永福, 等. 黑斑蛙肌肉营养成分分析及评价[J]. 中国饲料, 2018(17): 74-77. [6] 刘芳彬, 王伟, 黄永春, 等. 棘胸蛙肌肉营养成分季节变化分析与评价[J]. 食品工业科技, 2022, 43(9): 365-371. [7] 刘丽, 刘楚吾, 林东年, 等. 泰国虎纹蛙与中国虎纹蛙肌肉的营养成分比较[J]. 水利渔业, 2008(3): 64-66. [8] 蓝蔚青, 杜金涛, 刘大勇, 等. 3种养殖蛙类肌肉基本营养成分分析[J]. 广东海洋大学学报, 2022, 42(2): 142-147. [9] WANG A R, RAN C, RINGO E, et al. Progress in fish gastrointestinal microbiota research[J]. Rev Aquac, 2018, 10(3): 626-640. doi: 10.1111/raq.12191
[10] 何志刚, 伍远安, 徐永福, 等. 野生与养殖黑斑蛙肌肉营养品质的比较分析[J]. 水产科学, 2019, 38(4): 506-513. [11] 刘文舒, 郭小泽, 陈彦良, 等. 养殖黑斑蛙肠道微生物结构与功能分析[J]. 经济动物学报, 2021, 25(2): 68-76. [12] 刘文舒, 陈彦良, 郭小泽, 等. 虎纹蛙肠道微生物结构与功能分析[J]. 野生动物学报, 2020, 41(1): 171-181. [13] 刘亚秋, 刘明典, 李新辉, 等. 3个广东鲂地理种群肌肉营养成分及能量密度比较研究[J]. 南方水产科学, 2022, 18(4): 163-169. [14] XIA Y, YU E M, LU M X, et al. Effects of probiotic supplementation on gut microbiota as well as metabolite profiles within Nile tilapia, Oreochromis niloticus[J]. Aquaculture, 2020, 527: 735428. doi: 10.1016/j.aquaculture.2020.735428
[15] 韩迎雪, 林婉玲, 杨少玲, 等. 15种淡水鱼肌肉脂肪含量及脂肪酸组成分析[J]. 食品工业科技, 2018, 39(20): 217-222. [16] 陈明勇, 彭剑林, 李灿鹏. 双团棘胸蛙(Paa yunnanensis)肌肉营养成分分析与评价[J]. 云南大学学报(自然科学版), 2010, 32(1): 114-117. [17] 李晋南, 王良, 王连生. 水产动物异亮氨酸营养研究进展[J]. 动物营养学报, 2022, 34(3): 1374-1387. doi: 10.3969/j.issn.1006-267x.2022.03.002 [18] ZHANG S H, YANG Q, REN M, et al. Effects of isoleucine on glucose uptake through the enhancement of muscular membrane concentrations of GLUT1 and GLUT4 and intestinal membrane concentrations of Na+/glucose co-transporter 1 (SGLT-1) and GLUT2[J]. Br J Nutr, 2016, 116(4): 593-602. doi: 10.1017/S0007114516002439
[19] 魏佳, 王壮壮, 于海波, 等. 产L-苏氨酸重组大肠杆菌的构建和发酵性能[J]. 微生物学通报, 2019, 46(4): 695-706. [20] 王莉苹, 陈飞, 韩雨哲, 等. 支链氨基酸(BCAA)及水产动物对其需求量的研究进展[J]. 饲料工业, 2015, 36(14): 35-40. [21] 赵亭亭, 陈超, 邵彦翔. 雌雄条纹锯鮨肌肉营养成分的比较与评价[J]. 渔业科学进展, 2019, 40(3): 151-159. [22] 卢文麒, 许琪娅, 蔡国鹤, 等. 不同规格花鳗鲡肌肉营养成分比较分析[J]. 饲料工业, 2023, 44(14): 80-86. doi: 10.13302/j.cnki.fi.2023.14.013 [23] 张茜, 王瑞, 于智超, 等. 棕榈酸诱导胰岛β细胞氧化应激和内质网应激的研究进展[J]. 激光生物学报, 2023, 32(2): 118-125. [24] 徐庆, 张新胜, 张永, 等. 辛酸、癸酸和硬脂酸对ApoE~(-/-)小鼠肠道中外源性胆固醇吸收的影响[J]. 卫生研究, 2018, 47(1): 119-122, 127. [25] SIRI-TARINO P W, CHIU S, BERGERON N, et al. Saturated fats versus polyunsaturated fats versus carbohydrates for cardiovascular disease prevention and treatment[J]. Annu Rev Nutr, 2015, 35(1): 517-543. doi: 10.1146/annurev-nutr-071714-034449
[26] 张瑞, 白云鹏, 贾莉, 等. 牛至精油对平凉红牛半腱肌肉品质、脂肪酸及挥发性风味物质的影响[J]. 动物营养学报, 2022, 34(7): 4452-4463. [27] 梁琍, 桂庆平, 冉辉, 等. 野生与养殖黄颡鱼鱼卵的营养成分比较[J]. 水产科学, 2016, 35(5): 522-527. [28] 胡磊, 谢庆超, 潘迎捷, 等. 蒸制和煮制对中华绒螯蟹中胆固醇和脂肪酸含量的影响[J]. 上海海洋大学学报, 2023, 32(3): 649-659. [29] 吴娜. 基于脂质热氧化降解解析中华绒螯蟹关键香气物质的形成机制[D]. 上海: 上海海洋大学, 2017: 44-73. [30] 周礼敬, 沈东霞, 詹会祥. 鱼类肌肉营养成分与人体健康研究[J]. 畜牧与饲料科学, 2013, 34(5): 69-71. [31] 郭俊涛, 谢遇春, 苏馨, 等. 大足黑山羊不同部位肌肉脂肪酸比较研究[J]. 肉类研究, 2020, 34(9): 6-11. [32] 杜宁宁, 黄晓丽, 郝其睿, 等. 八种鲑科鱼类肌肉营养成分分析与营养价值评价[J]. 水产学杂志, 2022, 35(4): 9-18, 37. [33] 董立学, 喻亚丽, 毛涛, 等. 池塘内循环流水养殖斑点叉尾鮰肌肉品质的分析[J]. 中国水产科学, 2021, 28(7): 914-924. [34] CHENG J H, SUN D W, HAN Z, et al. Texture and structure measurements and analyses for evaluation of fish and fillet freshness quality: a review[J]. Comp Rev Food Sci Food Saf, 2014, 13(1): 52-61. doi: 10.1111/1541-4337.12043
[35] KUEBUTORNYE F K A, WANG Z, LU Y, et al. Effects of three host-associated Bacillus species on mucosal immunity and gut health of Nile tilapia, Oreochromis niloticus and its resistance against Aeromonas hydrophila infection[J]. Fish Shellfish Immunol, 2020, 97: 83-95. doi: 10.1016/j.fsi.2019.12.046
[36] KHOSRAVI S, RAHIMNEJAD S, HERAULT M, et al. Effects of protein hydrolysates supplementation in low fish meal diets on growth performance, innate immunity and disease resistance of red sea bream Pagrus major[J]. Fish Shellfish Immunol, 2015, 45(2): 858-868. doi: 10.1016/j.fsi.2015.05.039
[37] 林宜锦, 杨欢, 林鹏志, 等. 饵料中添加肉桂醛对日本鳗鲡肠道结构的影响[J]. 饲料研究, 2022, 45(11): 52-55. [38] 邵闯, 秦守旺, 朱波, 等. 投喂策略对牛蛙蝌蚪生长发育及肝肠功能的影响[J]. 水产学报, 2023, 47(10): 72-83. [39] 王健, 王玲, 鲁康乐, 等. 摄食全豆粕蛋白饲料的牛蛙肠道微生物组成[J]. 集美大学学报(自然科学版), 2018, 23(4): 241-248. [40] 江昀, 胡亚洲, 向建国, 等. 不同健康状态的棘胸蛙肠道菌群结构分析[J]. 水生生物学报, 2022, 46(9): 1332-1340. [41] LIU Z, LIU W S, RAN C, et al. Abrupt suspension of probiotics administration may increase host pathogen susceptibility by inducing gut dysbiosis[J]. Sci Rep, 2016, 6(1): 23214. doi: 10.1038/srep23214
[42] 张美玲, 单承杰, 杜震宇. 益生菌与鱼类肠道健康研究进展[J]. 水产学报, 2021, 45(1): 147-157. [43] 包瑞璇, 周皓隆, 方再郗, 等. 大菱鲆肠道乳杆菌Lactobacillus sp. N5的筛选鉴定及其抑制水产病原菌的研究[J]. 水产学杂志, 2023, 36(3): 38-45. [44] 雷喜玲, 叶金云, 陈丽仙, 等. 屎肠球菌的作用机制及其在水产动物中的应用[J]. 饲料工业, 2022, 43(22): 9-15. [45] 王腾腾. 一株许氏平鲉肠道乳酸菌的分离鉴定、特性分析及其应用研究[D]. 上海: 上海海洋大学, 2017: 31-37. [46] 韩琳. 一例日本对虾暴发性死亡的病原分析及益生菌联用对对虾免疫增强作用[D]. 上海: 上海海洋大学, 2017: 21-36. [47] WANG L, WANG J, LU K L, et al. Total replacement of fish meal with soybean meal in diets for bullfrog (Lithobates catesbeianus): effects on growth performance and gut microbial composition[J]. Aquaculture, 2020, 524: 735236. doi: 10.1016/j.aquaculture.2020.735236



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
