Hydroacoustic estimates of fish abundance and behavior characteristics in Yangzonghai Lake
-
摘要:
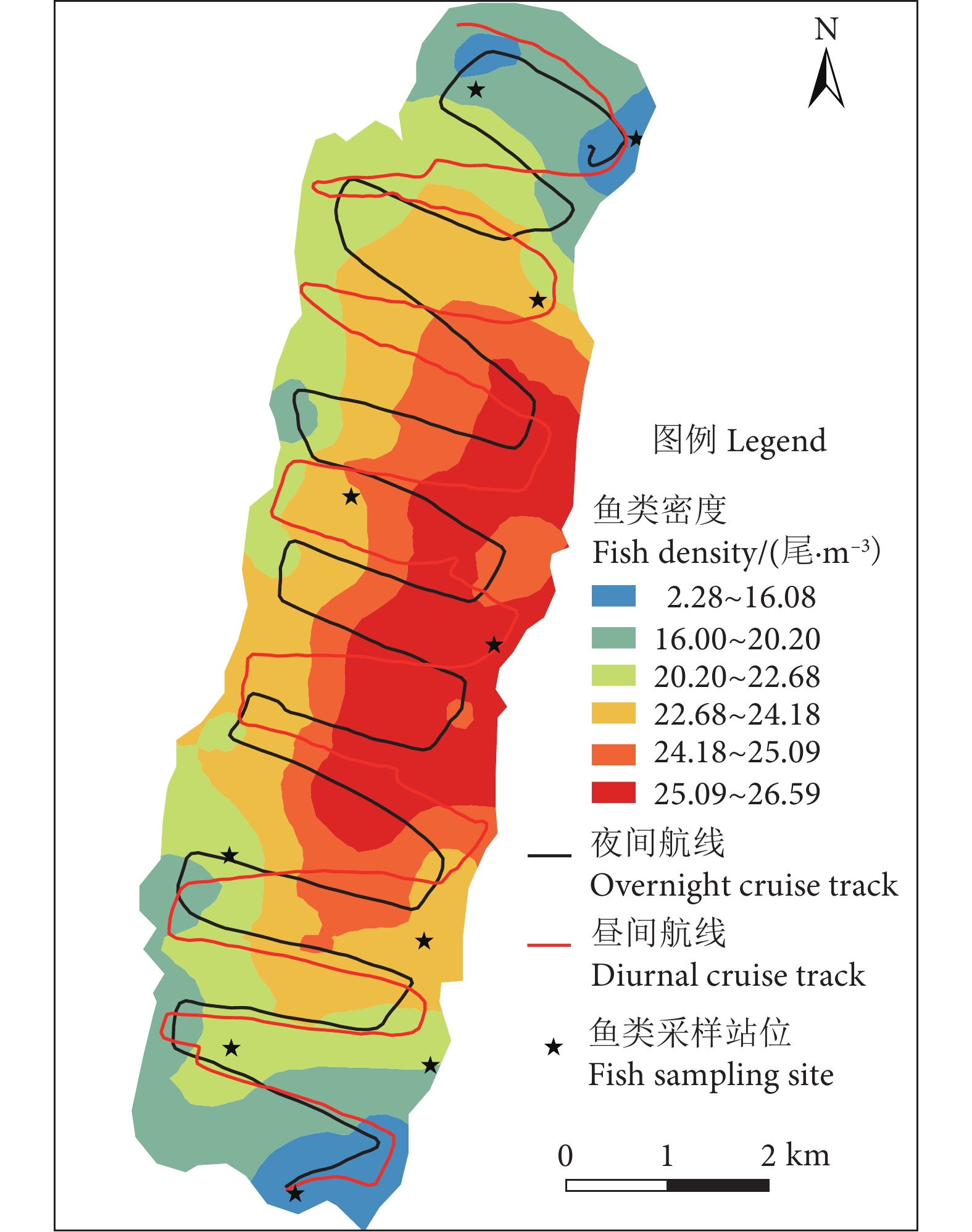
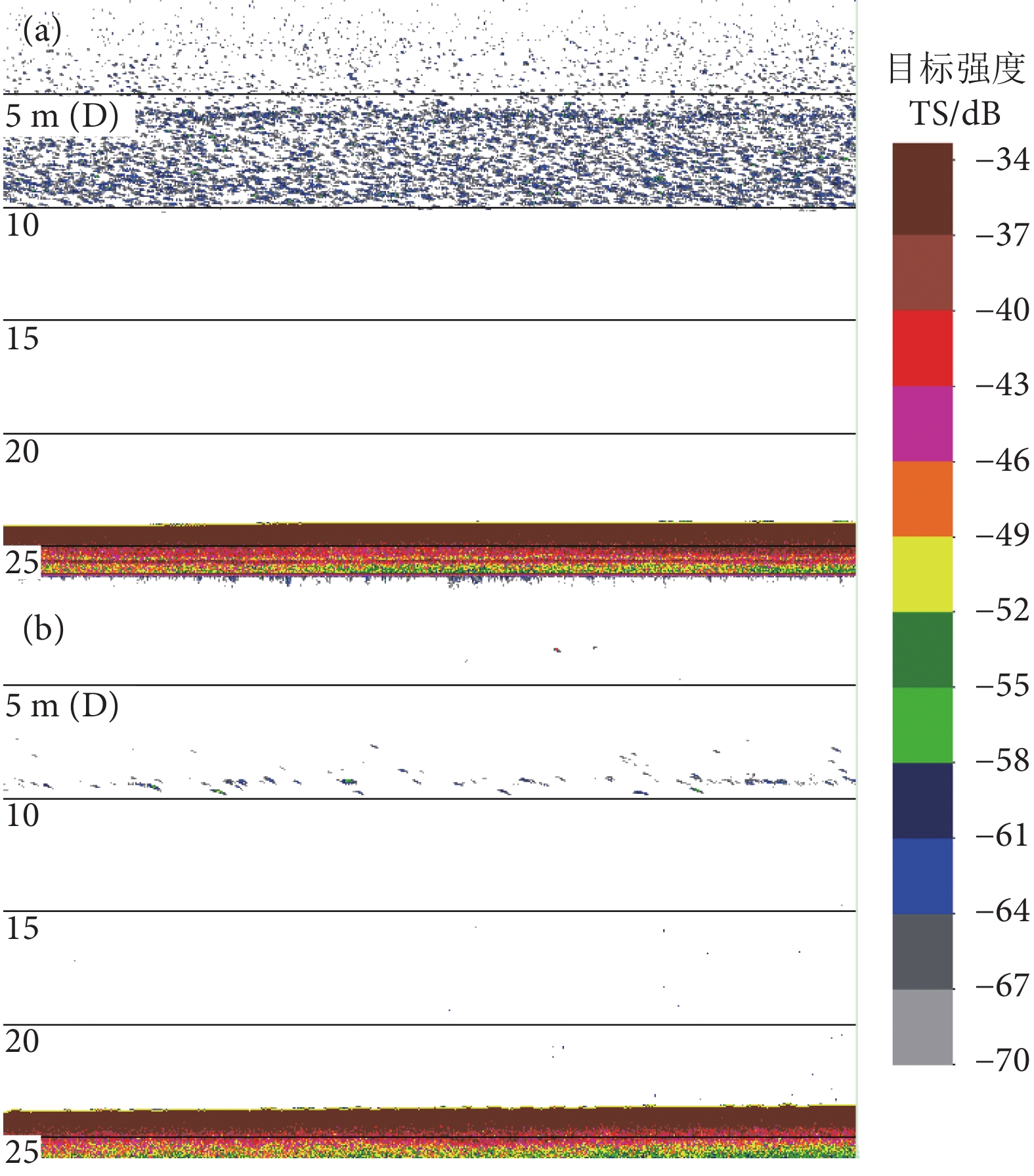
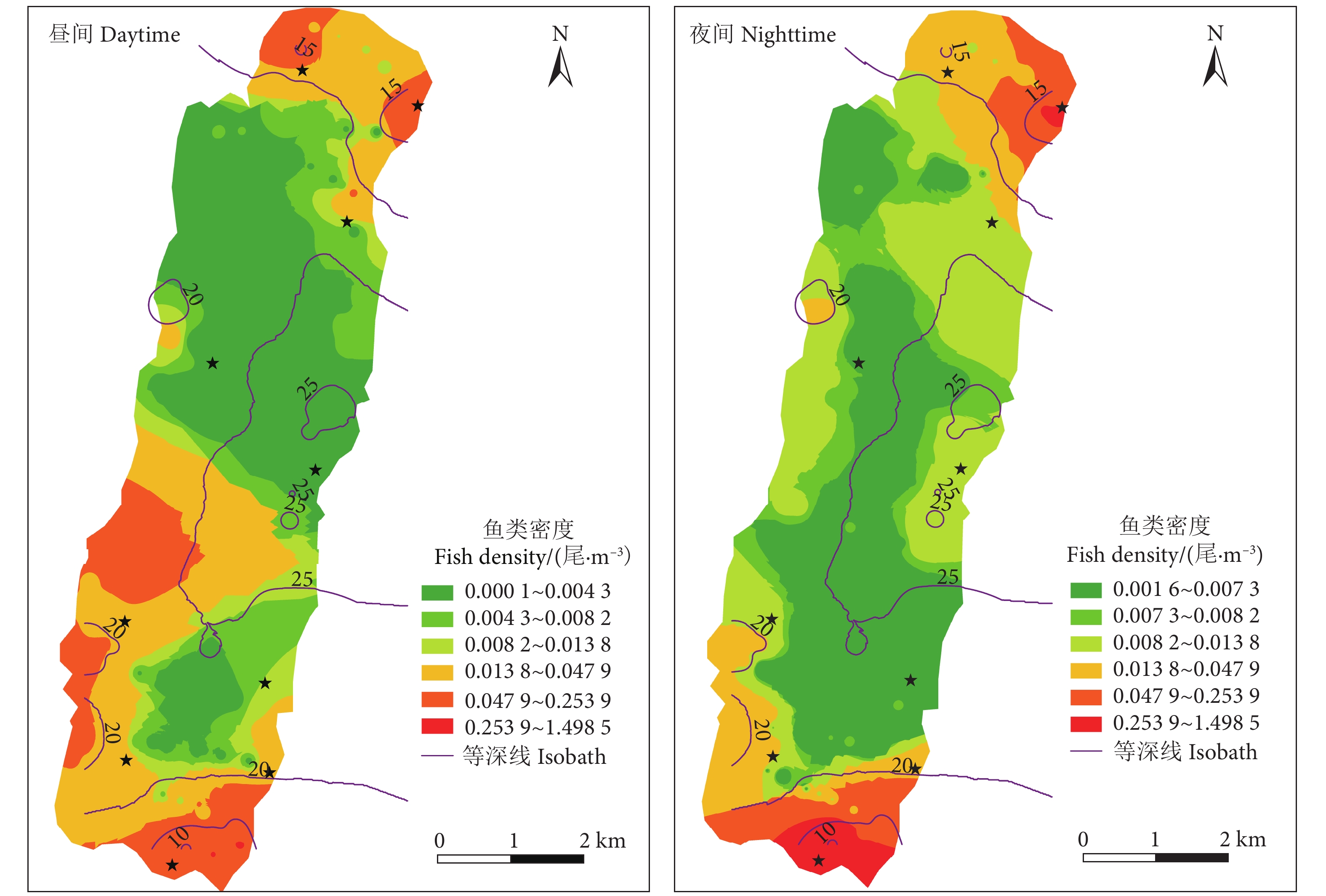
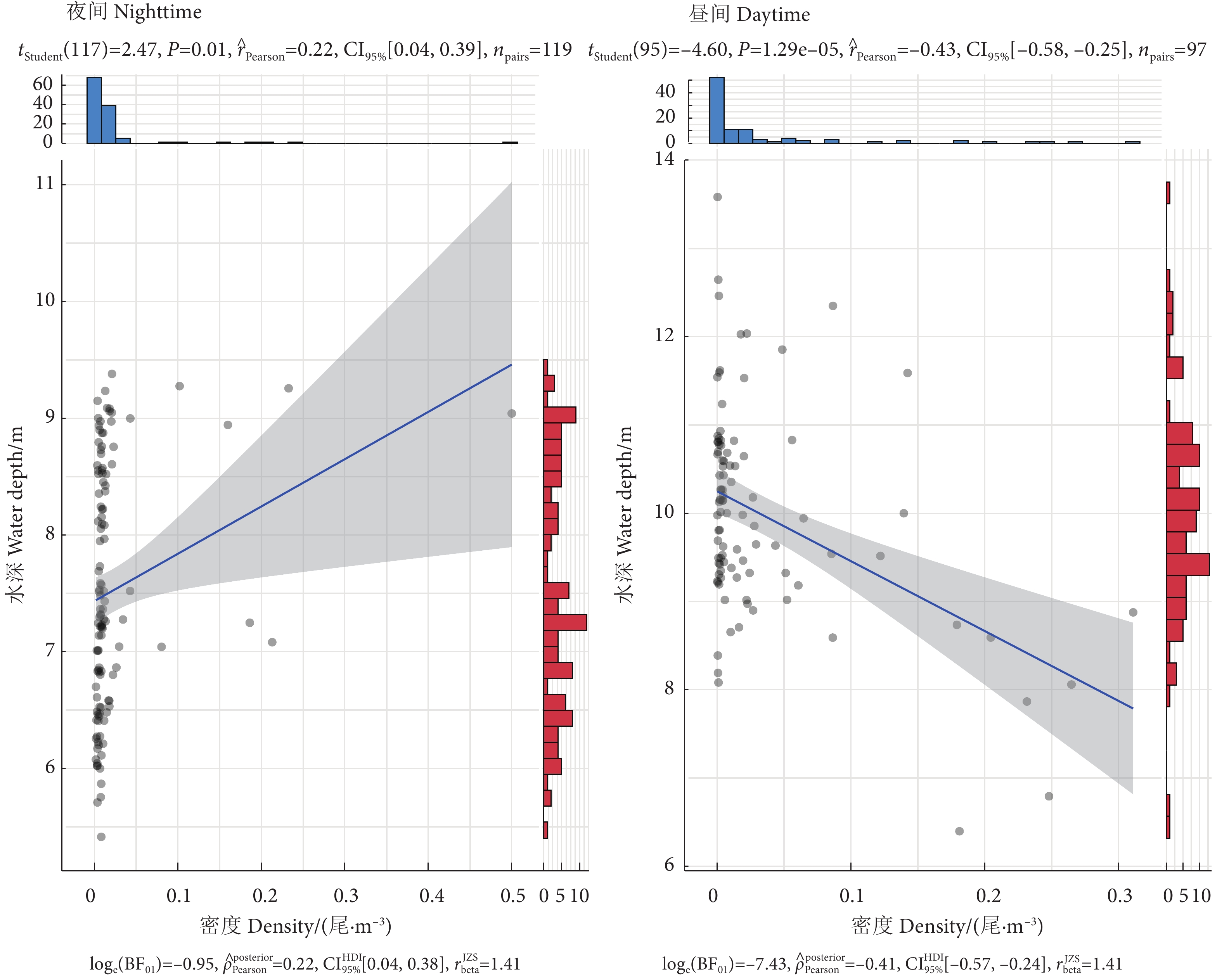
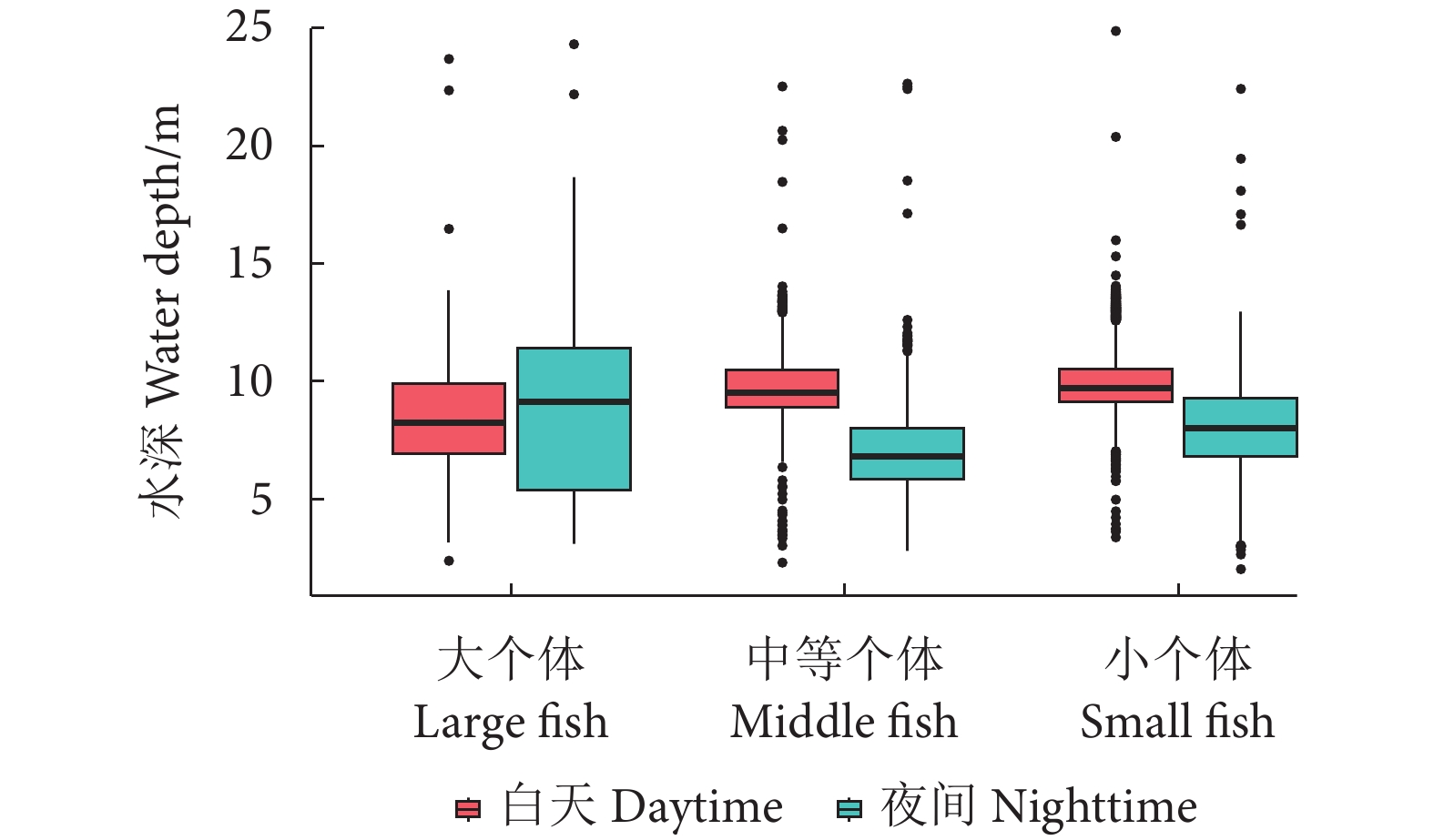
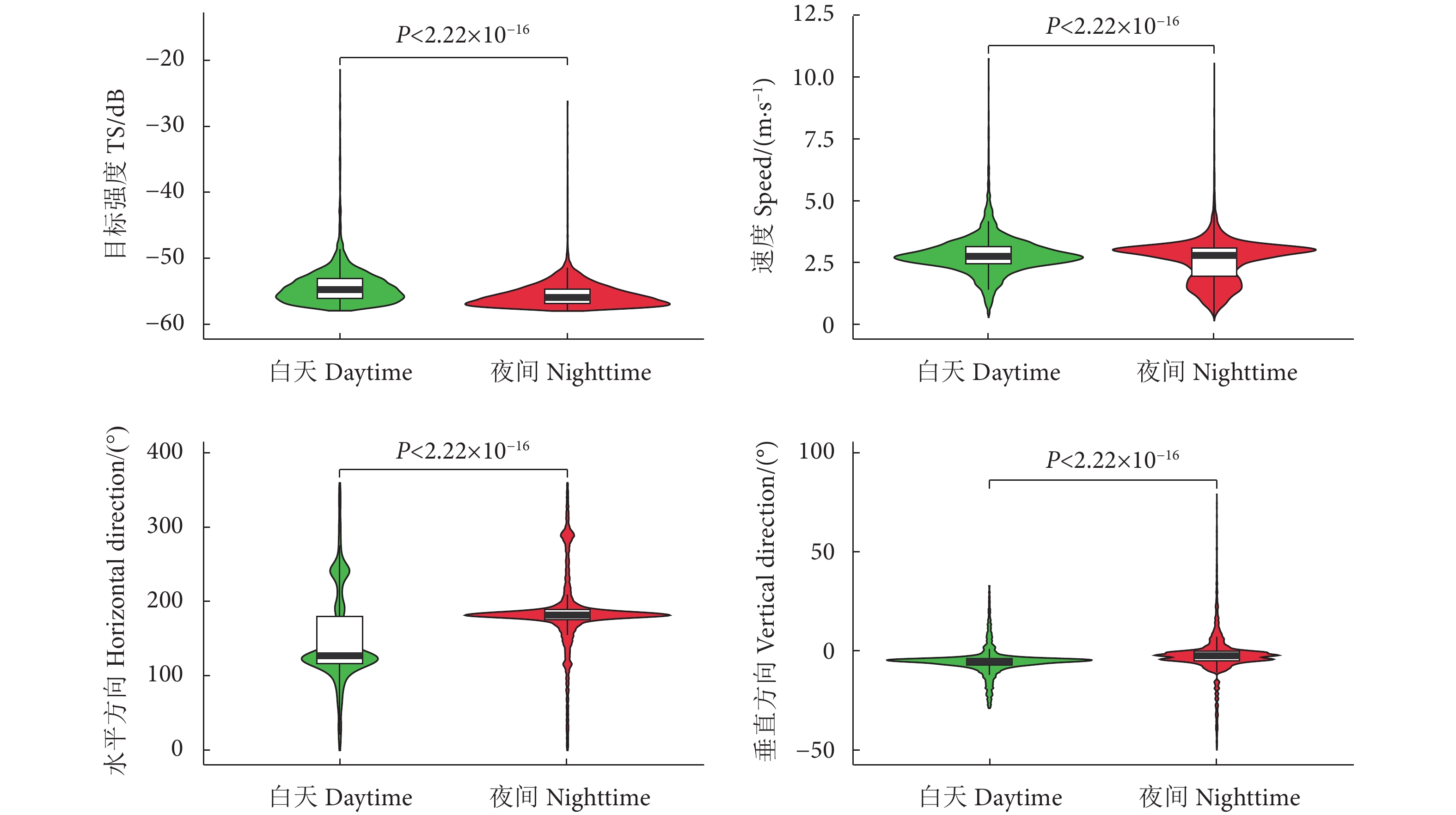
阳宗海是云南九大湖泊之一,为评估其鱼类分布特征及资源现状,分别于2022年3、5、8和10月采集渔获物,并于6月20—21日昼夜利用鱼探仪进行水声学探测。结果显示,阳宗海共采集鱼类24种,隶属于7目14科23属,太湖新银鱼 (Neosalanx taihuensis)、鲢 (Hypophthalmichthys molitrix)、鳙 (Aristichthys nobilis)、子陵吻鰕虎 (Rhinogobius giurinus)、䱗 (Hemiculter leucisculus)、间下鱵 (Hyporhamphus intermedius) 为阳宗海鱼类优势种。其中,太湖新银鱼、子陵吻鰕虎等小个体鱼类,数量占比超90%。整体来看,鱼类水平空间分布无明显昼夜差异,高密度区均分布在南北2个浅水区。鱼类垂直分布、行为特征存在显著昼夜差异,表现为夜间大量弱声信号聚集于5~10 m水层,白天则分散分布;夜间75%的鱼类向上游动而昼间则相反,中小型鱼类在夜间小幅上浮,而大型鱼类在夜间垂直迁移更为活跃。初步估算,阳宗海鱼类昼夜平均密度分别为0.033和0.038 尾·m−3。结果表明,目前阳宗海已形成了以外来鱼类为优势种、土著鱼类种类和数量不断减少的新群落结构。建议加大对太湖新银鱼等小型鱼类的捕捞,继续开展鲢、鳙和中上层土著肉食性鱼类的增殖放流来调整鱼类群落结构,以达到调控水质的目的。
Abstract:Yangzonghai Lake is one of the nine major lakes in Yunnan plateau. In order to evaluate the distribution characteristics and resource status of fish, we had carried out four catch investigations in March, May, August and October in 2022 and conducted two hydroacoustic detections (Split beam echosounder, EY60) in June 20−21, 2022. The results show that a total of 24 fish species were collected, belonging to 23 genera, 14 families and 7 orders. Among them, Neosalanx taihuensis, Hypophthalmichthys molitrix, Aristichthys nobilis, Rhinogobius giurinus, Hemiculter leucisculus and Hyporhamphus intermedius were the dominant fish species in Yangzonghai Lake. Small fish such as N. taihuensis and R. giurinus accounted for more than 90% of the total number of fish species. Overall, the spatial distribution of fish had no significant differences between day and night. High-density areas were all distributed in two shallow water areas to the north and south of the lake. The vertical distribution and behavioral characteristics of fish showed significant differences between day and night. In the nighttime, a large amount of weak sound signals were concentrated at 5−10 m water layer, while they are scattered in the daytime. Besides, 75% of fish swam upstream in the nighttime, while vice verse in the daytime. The number of small and medium-sized fish tended to rise slightly in the nighttime, while larger fish were more active in vertical migration in the nighttime. The average densities of fish in Yangzonghai Lake in the daytime and in the nighttime were estimated as 0.033 and 0.038, respectively. The results show that a new community structure has been formed in Yangzonghai Lake, with exotic fish species as dominant and decreasing variety and quantity of indigenous fish species. It is recommended to increase the fishing of small fish such as N. taihuensis, and continue to carry out proliferation and release of silver carp, bighead and pelagic indigenous carnivorous fish to adjust the fish community structure, so as to achieve the goal of water quality regulation.
-
方斑东风螺 (Babylonia areolata)属软体动物门、腹足纲、蛾螺科,俗称“花螺”、“海猪螺”和“南风螺”,分布于中国东南沿海、东南亚及日本等地,是中国东南沿海主要的养殖海珍品和经济贝类,因其肉质鲜美、营养丰富,成为畅销国内外且具有推广前景的优质海水养殖贝类品种[1]。近年来,方斑东风螺的养殖生产在中国部分地区如广东、广西和海南等有较快发展,但在养殖过程中常受到氨氮 (NH4-N)毒性的影响。积累的氨以离子氨 (
$ {\rm{NH}}_4^ + $ )或非离子氨 (NH3)的形式存在于水体,从而影响水生动物的生长[2]。NH4-N是水产养殖水环境中的主要有毒物质和重要的水体环境指标之一,被认为是水产养殖中的常见胁迫因子,其浓度受养殖水体中动物排泄物、分泌物、残饵、动植物尸体等含氮有机物分解的影响[3-4]。研究表明,多数水生生物对NH4-N毒性非常敏感。关于NH4-N对鱼类、虾类等水生生物消化系统和抗氧化系统酶活力影响的研究已有不少报道[5-8],但NH4-N胁迫对方斑东风螺消化酶活力影响的研究仍属空白。徐武杰等[9]研究NH4-N胁迫对三疣梭子蟹 (Portunus trituberculatus) 消化酶活力的影响时发现,在NH4-N胁迫下其中肠腺中的胃蛋白酶和脂肪酶活力表现出明显的诱导作用,而对3种消化器官中淀粉酶活力表现出明显的抑制作用;胡炜等[10]研究发现慢性NH4-N胁迫会对刺参 (Stichopus japonicus) 摄食、消化与生长产生不利影响,在质量浓度低于4 mg·L–1的NH4-N胁迫下,刺参消化酶活力短期可被显著诱导上调,高NH4-N质量浓度对消化酶活力起抑制效应并可导致生理紊乱,且该响应存在体质量、规格上的差异;王程昊等[11]研究发现,NH4-N胁迫也会影响泥蚶 (Arca granosa)体内的几种免疫酶活力。NH4-N还可降低水生动物生长速度,影响其血液生化指标并伤害免疫功能、组织机构及繁殖能力[12-13]。当水体中NH4-N质量浓度低于生物体耐受限度时,机体能够自行调节其体内相关酶的活力从而适应外界环境的变化,但当一定质量浓度的NH4-N持续长时间刺激且超过机体调节限度时,机体的非特异性免疫系统及消化系统就会受到破坏,相关酶活力下降[14-16]。另外,NH4-N胁迫还会增加水生动物的致病性[17],从而影响水生动物健康。为探究方斑东风螺在NH4-N刺激下其体内消化酶活力变化,进而揭示其消化酶应对急性胁迫时的调节机制,本文通过开展方斑东风螺不同质量浓度的NH4-N胁迫实验,测定NH4-N对其常见消化酶活力的影响,以期充实NH4-N对贝类毒理实验消化酶层面的基础数据,并为其他贝类NH4-N胁迫实验提供科学依据。
1. 材料与方法
1.1 实验材料
方斑东风螺由中国水产科学研究院南海水产研究所热带水产研究开发中心 (海南陵水)提供,并在该基地进行实验。实验所用方斑东风螺平均体质量为 (0.392±0.080) g,体长为(0.65±0.15) cm,实验开始前先暂养2 d。养殖过程中水质参数为温度 (26.0±1.0) ℃,盐度33±0.8,溶解氧 (DO)质量浓度大于6.5 mg·L–1,亚硝酸盐质量浓度小于0.04 mg·L–1,NH4-N质量浓度小于0.01 mg·L–1,pH为8.0±0.2。实验用水为过滤的海水。
1.2 实验方法
1.2.1 饲养管理及实验设计
将氯化铵 (NH4Cl,AR)配置成质量浓度为0~500 mg·L–1的溶液,按实验要求放入健康状况良好且大小均一的方斑东风螺,观察其行为、活动及存活状况,得到24 h和 96 h 100%死亡浓度 [ (LC100, 24 h)和 (LC100, 96 h)],根据实验结果确定出实验液NH4-N质量浓度的上、下限。实验过程中停止投饵。
根据所确定的上、下限设置5个NH4-N质量浓度,分别为0 mg·L–1、22 mg·L–1、47 mg·L–1、102 mg·L–1和220 mg·L–1,各组均为3个平行,每个实验容器 (3 L)内投放30只健康状况良好的方斑东风螺,分别于第6、第12、第24、第36、第48、第72和第96小时从各养殖桶中随机取样3只,检测其消化酶活力的变化情况。同时,每隔3 h从每个容器中取水样,及时调整至设定的表观质量浓度。
每日换水1次,每次换水50%,并将养殖桶中的排泄物以及死去的方斑东风螺及时除去。间隔观察并记录各实验组方斑东风螺的状态、行为活动、中毒症状及死亡率。判断死亡的标准为实验东风螺置于塑料板上无明显活动迹象,用解剖刀触碰无反应。
1.2.2 样品处理
用0.2 mol·L–1生理盐水将各实验组所取样品 (整个螺)按1∶2 (m∶V)进行研磨,研磨液于5 000 r·min–1、4 ℃下离心10 min,取1 mL上清液于洁净EP (eppendorf)管中,−80 ℃保存待测,分别采用相关试剂盒测定蛋白及各消化酶活力,试剂盒购自南京建成生物工程研究所。
1.2.3 数据处理与分析
利用SPSS 21.0对实验数据进行统计分析,先对数据作单因素方差分析 (One-Way ANOVA),处理间若有显著差异,再用Duncan法比较均值间的差异显著性 (P<0.05),本文数据均采用“平均值±标准差 (
$\overline X \pm {\rm SD}$ )”表示。2. 结果
2.1 NH4-N胁迫对方斑东风螺的急性毒性作用
NH4Cl处理组中,随着NH4Cl浓度的升高,方斑东风螺呈现不同的应激行为甚至死亡,主要表现为运动缓慢,对外界刺激反应迟钝,爬壁运动减少,逐渐翻背,沉于水桶底部,身体僵硬直至死亡。死亡状态的东风螺,吻管向外凸出,螺肉外翻、惨白僵硬。300 mg∙L–1 NH4Cl处理组第48小时开始出现死亡,第96小时成活率为 (60.0±1.6)%,而500 mg·L–1 NH4-N处理组于第24 小时便出现 (20.3±2.1)%的死亡率,死亡个体吻稍微张开、出现体色变红现象,且第96小时成活率为0,其余各组成活率为100% (表1)。可见,NH4-N浓度越大,其毒性作用越强,方斑东风螺死亡率越高;相同条件下,NH4-N胁迫时间越久,方斑东风螺死亡率也越高。
表 1 氨氮对方斑东风螺急性毒性实验结果Table 1. Acute toxicity experiment of NH4-N to B. areolataρ(NH4Cl)/mg·L–1 死亡率/% mortality rate 第24小时 第48小时 第72小时 第96小时 对照 control 0 0 0 0 25 0 0 0 0 50 0 0 0 0 75 0 0 0 0 100 0 0 0 0 200 0 0 0 0 300 0 21.4±3.3 40.1±2.9 60.0±1.6 500 20.3±2.1 50.0±2.7 73.6±4.2 100.0 2.2 NH4-N胁迫对方斑东风螺溶菌酶活力的影响
不同浓度NH4-N对方斑东风螺溶菌酶活力的影响显著 (P<0.05),而处理时间对方斑东风螺溶菌酶活力影响极显著 (P<0.01)。第6小时时各NH4-N浓度处理组个体溶菌酶活力与对照组相比均呈降低趋势,但随着时间的延长,溶菌酶活力呈先增后降 (22 mg·L–1 和102 mg·L–1处理组)或先增后降再增 (47 mg·L–1和220 mg·L–1处理组)的趋势 (图1-a)。综上,溶菌酶活力表现出“抑制−诱导”的趋势。
![]() 图 1 氨氮胁迫对方斑东风螺4种消化酶活力的影响不同字母表示同一组不同处理时间之间存在显著性差异,字母下标数字代表组号,分别为22 mg∙L–1、47 mg∙L–1、102 mg∙L–1和220 mg∙L–1Figure 1. Effect of NH4-N stress on activities of four digestive enzymes of B. areolataDifferent letters indicate significant difference. The subscript letters represent group No., which are 122 mg∙L–1, 47 mg∙L–1, 102 mg∙L–1 and 220 mg∙L–1, respectively.
图 1 氨氮胁迫对方斑东风螺4种消化酶活力的影响不同字母表示同一组不同处理时间之间存在显著性差异,字母下标数字代表组号,分别为22 mg∙L–1、47 mg∙L–1、102 mg∙L–1和220 mg∙L–1Figure 1. Effect of NH4-N stress on activities of four digestive enzymes of B. areolataDifferent letters indicate significant difference. The subscript letters represent group No., which are 122 mg∙L–1, 47 mg∙L–1, 102 mg∙L–1 and 220 mg∙L–1, respectively.2.3 NH4-N胁迫对方斑东风螺胃蛋白酶活力的影响
处理时间和不同质量浓度的NH4-N均极显著影响方斑东风螺胃蛋白酶活力 (P<0.01)。相比对照组,22 mg·L–1处理组个体胃蛋白酶活力随时间的延长呈“诱导−抑制”变化趋势,但47 mg·L–1处理组个体胃蛋白酶活力随时间的延长却呈现“抑制−诱导−抑制”变化趋势,而其他各处理组个体胃蛋白酶活力随时间的变化趋势为“抑制−诱导”且峰值均出现在第72 小时,谷值均出现在第6小时 (图1-b)。
2.4 NH4-N胁迫对方斑东风螺脂肪酶活力的影响
处理时间对方斑东风螺脂肪酶活力影响极显著 (P<0.01),不同浓度的NH4-N胁迫导致各组处理个体脂肪酶活力变化趋势也存在显著差异 (P<0.05)。各处理组脂肪酶活力较对照组在总体上呈抑制作用或与对照组呈相似水平,但中质量浓度处理组 (47 mg·L–1、102 mg·L–1)个体脂肪酶活力在第6小时时表现出诱导作用,低、高质量浓度处理组 (22 mg·L–1、220 mg·L–1)个体脂肪酶活力于第48小时时表现出诱导作用 (图1-c)。
2.5 NH4-N胁迫对方斑东风螺淀粉酶活力的影响
处理时间对方斑东风螺淀粉酶活力影响极显著 (P<0.01),不同浓度的NH4-N胁迫导致各组处理个体淀粉酶活力变化趋势存在明显差异 (P<0.05)。各处理组淀粉酶活力相比对照组在处理时间较短的情况下并无太大的诱导或抑制作用,NH4-N质量浓度为47 mg·L–1和102 mg·L–1的处理组在第72和第96小时才表现出明显的诱导作用,而NH4-N质量浓度为220 mg·L–1的处理组在第6小时表现出明显的抑制作用,并在第36和第96小时时具有一定的诱导作用 (图1-d)。
3. 讨论
3.1 NH4-N对方斑东风螺生存状况和成活率的影响
研究表明,对水生动物造成危害甚至死亡的NH4-N成分主要是NH3[2]。NH3因不带电荷且具有较强的脂溶性而对水生动物有极大毒性,能够穿透贝体细胞膜表现出毒性效应,但
${\rm{NH}}_4^ + $ 对水生动物毒性很小[7,11,18]。本实验结果显示,方斑东风螺对NH4-N具有一定的耐受性,因此高质量浓度 (500 mg∙L–1) NH4-N处理24 h仅 (20.3±2.1)%的死亡率,但在96 h后全部死亡,说明该NH4-N浓度已超过方斑东风螺最大耐受浓度。师尚丽等[2]指出,NH4-N的浓度越大,其毒性作用越强,与本实验结果一致。因此,养殖生产中应尽可能地降低养殖水体中NH4-N的浓度,及时清理投喂的冰鲜鱼、虾蟹肉等残渣及死亡的东风螺等,防止含氮有机物分解产生NH4-N。另外,方斑东风螺对NH4-N的应激行为表现为运动缓慢、对外界刺激反应迟钝和爬壁运动减少等,可能是NH4-N影响了东风螺的组织器官,如影响肌肉伸缩能力和神经介质传递。研究表明,水体中的NH4-N会影响鱼、贝类等水产动物的生长摄食、组织器官和免疫机能等 [12,19-23]。洪美玲等[24]在研究NH4-N对中华绒螯蟹 (Eriocheir sinensis)幼体的免疫指标及肝胰腺组织结构影响时指出,NH4-N不仅损伤机体非特异性免疫防御系统,还对机体细胞和组织造成伤害。王琨[25]研究发现,在NH4-N的影响下鲤 (Cyprinus carpio)幼鱼的各个组织器官 (鳃、肠、心肌、肾脏、脾脏和肝脏)均受到不同程度的损伤,且高浓度的NH4-N使鲤幼鱼的红细胞数量和血红蛋白浓度下降,而组织器官的损伤和免疫机能的下降正是造成鲤容易患病、死亡的主要原因。
3.2 NH4-N对方斑东风螺个体消化酶活力的影响
大量研究表明,NH4-N作为养殖水质污染源之一,除了对鱼、贝类等水产动物机体的血液指标、组织结构和免疫机能造成损害,还能降低鱼虾贝类的产卵能力[26],引起血淋巴理化因子和抗病能力的变化[27-28],使血淋巴中血细胞 (如透明细胞、颗粒细胞和半颗粒细胞)数量下降[7],还会对水生生物消化系统酶活力造成影响[5]。本研究结果表明,不同质量浓度的NH4-N对消化酶活力均产生影响,且随着处理时间的延长表现出不同的诱导或抑制作用。NH4-N对方斑东风螺个体溶菌酶活力表现出“抑制−诱导”的趋势,说明贝类溶菌酶活力的提高可能也是一种防御反应外的被动病理显示[29]。相比对照组,22 mg·L–1处理组个体胃蛋白酶活力随时间的延长呈“诱导−抑制”变化趋势,但47 mg·L–1处理组个体胃蛋白酶活力随时间的延长呈“抑制−诱导−抑制”变化趋势;而其他各处理组个体胃蛋白酶活力均在NH4-N处理一段时间后表现出抑制作用。可以看出在NH4-N急性胁迫下,由于NH4-N的毒性作用,使得机体的相关代谢酶活力降低,而机体的应激反应又在短时间内诱导酶活力上升,其恢复正常水平的时间反映了机体对环境的适应能力。最终酶活力的显著降低说明对处理个体已经造成毒害作用。而不同NH4-N质量浓度对方斑东风螺处理个体脂肪酶活力的总体抑制,更表明了NH4-N的毒害作用。赵海涛[30]通过南方鲶 (Silurus meridionalis)幼鱼的NH4-N胁迫实验得出,经NH4-N胁迫后南方鲶幼鱼的造血机能受损,机体无法将氧 (O2)顺利携带进入,猜测NH4-N急性中毒引起死亡的主要原因是由机体组织缺氧造成。而乔顺风等[31-32]认为,NH4-N的毒性大小取决于存在状态,当水体中的NH4-N以NH3状态存在时,便会对水生动物产生很强的神经性毒害,造成急性氨中毒。李波等[33]在研究亚硝酸 (HNO2)和NH4-N对黄颡鱼 (Pelteobagrus fulvidraco)的急性毒性时发现,NH4-N对黄颡鱼的毒性明显大于HNO2对黄颡鱼的毒性,因而把NH4-N作为黄颡鱼养殖过程中毒性危害的重要影响因子。
此外,虽然各消化酶活力随着NH4-N处理浓度显著变化,但并不存在明显的线性关系或一致规律,变化规律较特异,这可能与东风螺的高抗逆性等生理习性或所处发育阶段不同有关,也可能是NH4-N的胁迫对其消化系统造成了一定的紊乱效应,但并未引起死亡是因为胁迫处理计量仍在其适应范围内。有研究表明,NH4-N胁迫程度的差异性与对象规格、养殖密度和个体差异等有关[34]。NH4-N处理组方斑东风螺消化酶活力的变化规律很好地指引了养殖过程中水体NH4-N的控制范围,从而防止因超过最大承受能力而造成重大养殖损失。
-
表 1 阳宗海鱼类种类组成
Table 1 Composition of fish species in Yangzonghai Lake
种类
Species数量百分比
Quantity
proportion/%体质量量百分比
Body mass
ratio/%体长范围
Range of body
length/mm体质量范围
Range of body
mass/g相对重要
性指数
IRI栖息水层
Habitat太湖新银鱼 Neosalanx taihuensis 65.18 1.19 25~61 0.16~0.99 6 637 中上层 子陵吻鰕虎 Rhinogobius giurinus 15.43 0.37 20~62 0.10~3.57 1 580 底层 间下鱵 Hyporhamphus intermedius 4.85 0.84 85~170 1.72~11.28 569 上层 䱗 Hemiculter leucisculus 2.88 4.39 45~195 1.20~145.34 727 上层 黄颡鱼 Pelteobagrus fulvidraco 2.43 2.36 33~195 0.71~90.76 479 底层 黄䱂 Hypseleotris swinhonis 2.22 0.06 23~53 0.13~2.35 228 底层 高体鳑鲏 Rhodeus ocellatus 2.06 0.18 19~74 0.16~9.45 224 中下层 瓦氏黄颡鱼 Pelteobagrus vachelli 1.26 1.10 33~165 0.85~72.1 236 底层 鲢 Hypophthalmichthys molitrix 1.23 64.99 77~600 2.34~3 930.00 6 622 中上层 麦穗鱼 Pseudorasbora parva 0.72 0.14 35~94 0.60~15.22 86 底层 鲫 Carasius auratus 0.47 2.09 47~245 3.73~496.18 256 中下层 鳙 Aristichthys nobilis 0.31 17.84 77~620 10.00~4 950.00 1 815 中上层 尼罗罗非鱼 Oreochromis nilotica 0.29 1.55 25~270 0.55~680.00 147 中下层 粘皮鲻鰕虎 Mugilogobius myxodermus 0.17 0.00 20~35 0.20~0.60 5 底层 花䱻 Hemibarbus maculatus 0.14 0.40 103~220 16.61~172.67 43 中下层 大鳞副泥鳅 Paramisgurnus dabryanus 0.09 0.06 87~150 3.47~28.70 12 底层 云南光唇鱼 Acrossocheilus yunnanensis 0.08 0.09 65~141 4.34~130.00 17 中下层 泥鳅 Misgurrnus anguillicaudatus 0.05 0.02 85~130 3.61~21.40 4 底层 青鱼 Mylopharyngodon piceus 0.04 0.64 220~395 138.07~430.70 34 中下层 鲤 Cyprinus carpio 0.04 0.43 173~270 137.94~605.00 24 中下层 草鱼 Ctenopharyngodon idellus 0.04 0.70 137~490 45.90~2 660.00 22 中上层 鲇 Silurus asotus 0.04 0.54 220~500 120.00~2 000.00 12 底层 食蚊鱼 Gambusia affinis 0.01 <0.01 3.4 0.70~0.76 0.2 上层 黄鳝 Monopterus albus <0.01 <0.01 210 9.00 0.01 底层 表 2 不同时间鱼类密度分布
Table 2 Fish density distribution in different periods
变量
Variable鱼类平均密度
Average fish density/(尾·m−3)95%置信区间
95% confidence interval/(尾·m−3)偏度
Skewness峰度
Kurtosis资源量
Abundance/(107 尾)夜间 Nighttime 0.0378±0.153 0.020~0.045 7.964 71.824 2.25 昼间 Daytime 0.0329±0.064 0.001~0.066 2.683 6.849 1.96 -
[1] 胡文渊, 赵帅营, 张涛, 等. 砷污染下阳宗海浮游动物群落特征及其影响因素[J]. 生态学杂志, 2021, 40(10): 3195-3204. [2] 陈瑞娟, 李明, 周思辰, 等. 2019—2020年阳宗海水质现状及特征[J]. 环境科学导刊, 2022, 41(1): 5-9. [3] 蔡娜, 张虎才, 常风琴, 等. 阳宗海水质参数季节性变化特征及趋势[J]. 地球科学前沿, 2017, 7(4): 500-512. [4] 连玉喜, 李昌, 叶少文, 等. 云南高原渔洞水库鱼类空间分布格局及主要影响因子[J]. 湖泊科学, 2018, 30(6): 1755-1765. [5] 安莉, 杨剑虹, 张丽媛, 等. 阳宗海鱼类资源现状调查[C]//中国科学技术协会. 湖泊湿地与绿色发展: 第五届中国湖泊论坛论文集. 长春: 吉林人民出版社, 2015: 383-386. [6] 董春燕, 李君轶, 张辉, 等. 长江中游鱼类资源量的估算[J]. 动物学杂志, 2021, 56(1): 73-79. [7] ZHOU S J, PUNT A E, SMITH A, et al. An optimized catch-only assessment method for data poor fisheries[J]. ICES J Mar Sci, 2018, 75(3): 964-976. doi: 10.1093/icesjms/fsx226
[8] RUDD M B, THORSON J T. Accounting for variable recruitment and fishing mortality in length-based stock assessments for data-limited fisheries[J]. Can J Fish Aquat Sci, 2017, 75(7): 1019-1035.
[9] 薛绍伟, 梁祥, 王静, 等. 云龙水库鱼类资源分布特征与鲢资源量估算[J]. 云南农业大学学报(自然科学), 2021, 36(3): 424-429. [10] 曾雷, 陈国宝, 于杰. 南澳岛海域渔业资源声学评估与空间分布[J]. 南方水产科学, 2018, 14(2): 26-35. [11] 武智, 李新辉, 李捷, 等. 红水河岩滩水库鱼类资源声学评估[J]. 南方水产科学, 2017, 13(3): 20-25. [12] 武智, 李新辉, 谭细畅, 等. 淡水水体气泡的声学信号特征与识别研究: 以乐昌峡水库为例[J]. 水生态学杂志, 2021, 42(4): 32-39. [13] RECHENCQ M, VIGLIANO P, MACCHI P, et al. Fish distribution patterns and habitat availability in lakes Moreno Este and Moreno Oeste, Patagonia, Argentina[J]. Limnologica, 2014, 49: 73-83. doi: 10.1016/j.limno.2014.09.003
[14] 梁祥, 薛绍伟, 武智, 等. 云龙水库鱼类资源声学评估[J]. 西南农业学报, 2021, 34(9): 2057-2062. [15] ZHANG J, CHEN G B, CHEN Z Z, et al. Application of hydroacoustics to investigate the distribution, diel movement, and abundance of fish on Zhubi Reef, Nansha Islands, South China Sea[J]. Chin J Oceanol Limnol, 2016, 5: 964-976.
[16] 王靖, 张超, 王丹, 等. 清河水库鲢鳙鱼类资源声学评估: 回波计数与回波积分法的比较[J]. 南方水产, 2010, 6(5): 50-55. [17] 郑慈英. 珠江鱼类志[M]. 北京: 科学出版社, 1989: 26-367. [18] 陈小勇. 云南鱼类名录[J]. 动物学研究, 2013, 34(4): 281-343. [19] 陈银瑞, 褚新洛. 云南鱼类志: 上册[M]. 北京: 科学出版社, 1989: 37-350. [20] 褚新洛. 云南鱼类志: 下册[M]. 北京: 科学出版社, 1990: 5-264. [21] FOOTE K, KNUDSEN H, VESTNES G, et al. Calibration of acoustic instruments for fish density estimation: a practical guide[J]. ICES Coop Res Rep, 1987, 144: 1-69.
[22] AGLEN A. Random errors of acoustic fish abuneance estimates in relation to the survey grid density applied[J]. FAO Fish Rep, 1983, 300: 293-298.
[23] 朱书礼, 陈蔚涛, 李新辉, 等. 柳江鱼类群落结构及多样性研究[J]. 水生生物学报, 2022, 46(3): 375-384. [24] SIMMONDS J, MACLENNAN D N. Fisheries acoustics: theory and practice[M]. Oxford: John Wiley & Sons, 2008: 176-177.
[25] RUDSTAM L G, PARKER-STETTER S L, SULLIVAN P J, et al. Towards a standard operating procedure for fishery acoustic surveys in the Laurentian Great Lakes, North America[J]. ICES J Mar Sci, 2009, 66: 1391-1397. doi: 10.1093/icesjms/fsp014
[26] KIESER R, MULLIGAN T J. Analysis of echo counting data: a model[J]. Can J Fish Aquat Sci, 1984, 41(3): 451-458. doi: 10.1139/f84-054
[27] 吴晛天, 胡忠军, 葛航, 等. 基于基尔霍夫近似模型的鲢和鳙目标强度测量 [J/OL]. 水产学报, 1-14[2023-11-10] http://kns.cnki.net/kcms/detail/31.1283.S.20220721.1344.002.html. [28] 李树深. 云南湖泊鱼类的区系及其类型分化[J]. 动物学报, 1982(2): 169-176. [29] 王伟营, 杨君兴, 陈小勇. 云南境内南盘江水系鱼类种质资源现状及保护对策[J]. 水生态学杂志, 2011, 32(5): 19-29. [30] 陈自明, 杨君兴, 苏瑞凤, 等. 滇池土著鱼类现状[J]. 生物多样性杂志, 2001, 9(4): 407-413. [31] 熊飞, 李文朝, 潘继征, 等. 云南抚仙湖鱼类资源现状与变化[J]. 湖泊科学, 2006, 18(3): 305-311. [32] 宁晓雨, 陶贻亮, 张磊, 等. 异龙湖鱼类群落结构及多样性[J]. 湖南城市学院学报(自然科学版), 2022, 31(6): 53-57. [33] BELYEA L R, LANCASTER J. Assembly rules within a contingent ecology[J]. Oikos, 1999, 86(3): 402-416. doi: 10.2307/3546646
[34] 万安, 张晓可, 谢枫, 等. 低头坝养鱼对上下游局域栖息地和鱼类群落时空格局的影响[J]. 湖泊科学, 2016(1): 178-186. [35] 李翀. 长江上游保护区干流鱼类栖息地地貌及水文特征研究[D]. 北京: 中国水利水电科学研究院, 2013: 5-6. [36] MIRANDA L E, KILLGORE K J. Fish depth distributions in the lower Mississippi River[J]. River Res Appl, 2014, 30(3): 347-359. doi: 10.1002/rra.2652
[37] 周起超, 杨炫, 王玮璐, 等. 云南程海和阳宗海季节性分层及其消退对冬季水华的潜在影响[J]. 湖泊科学, 2020, 32(3): 701-712. [38] 袁琳娜, 杨常亮, 李晓铭, 等. 高原深水湖泊水温日成层对溶解氧、酸碱度、总磷浓度和藻类密度的影响: 以云南阳宗海为例[J]. 湖泊科学, 2014, 26(1): 161-168. [39] 杨正健, 刘德富, 易仲强, 等. 三峡水库香溪河库湾拟多甲藻的昼夜垂直迁移特性[J]. 环境科学研究, 2010, 23(1): 26-32. [40] YE S W, LIAN Y X, GODLEWSKA M, et al. Day-night differences in hydroacoustic estimates of fish abundance and distribution in Lake Laojianghe, China[J]. J Appl Ichthyol, 2013, 29(6): 1423-1429. doi: 10.1111/jai.12367
[41] DJEMALI I, LAOUAR H. Acoustic fish biomass assessment in a deep Tunisian reservoir: effects of season and diel rhythm on survey results[J]. Afr J Aquat Sci, 2017, 42(1): 35-43. doi: 10.2989/16085914.2016.1277181
[42] DJEMALI I, TOUJANI R, GUILLARD J. Hydroacoustic fish biomass assessment in man-made lakes in Tunisia: horizontal beaming importance and diel effect[J]. Aquat Ecol, 2008, 43(4): 1121-1131.
[43] 陈国宝, 李永振, 赵宪勇, 等. 南海北部海域重要经济鱼类资源声学评估[J]. 中国水产科学, 2005, 12(4): 445-451. [44] TONG J F, XUE M H, ZHU Z H, et al. Impacts of morphological characteristics on target strength of chub mackerel (Scomber japonicus) in the Northwest Pacific Ocean[J]. Front Mar Sci, 2022, 9: 856483. doi: 10.3389/fmars.2022.856483
[45] 田思泉, 薛铭华, 童剑锋, 等. 北太平洋渔业资源种类目标强度研究进展[J]. 中国水产科学, 2021, 28(3): 371-379. [46] 刘家寿, 王齐东, 解绶启, 等. 内陆大水面生态牧场化管理: 群落调控、生物多样性恢复与资源利用[J]. 科技促进发展, 2020(2): 237-242. [47] 于谨磊, 夏曼莉, 关保华, 等. 鳑鲏与河蚌交互作用对浮游生物和底栖生物的影响分析[J]. 湖泊科学, 2021, 33(4): 1230-1240. [48] 刘建康, 谢平. 揭开武汉东湖蓝藻水华消失之谜[J]. 长江流域资源与环境, 1999, 8(3): 312-319. [49] YIN C J, HE W C, GUO L G, et al. Can top-down effects of planktivorous fish removal be used to mitigate cyanobacterial blooms in large subtropical highland lakes?[J]. Water Res, 2022, 218: 118483. doi: 10.1016/j.watres.2022.118483
-
期刊类型引用(10)
1. 孙阿君,丁炜东,曹丽萍,曹哲明,邴旭文. 氨氮胁迫对翘嘴鳜幼鱼抗氧化酶、消化酶活性及应激相关基因表达的影响. 水产科技情报. 2024(01): 44-51 .  百度学术
百度学术
2. 王筱,冼健安,张秀霞,张泽龙,李军涛,郑佩华,吴恒梅,鲁耀鹏. 方斑东风螺人工养殖、环境生理和营养需求研究进展. 中国饲料. 2024(03): 83-88+117 .  百度学术
百度学术
3. 张钰伟,赵旺,邓正华,黄星美,温为庚,孙敬锋,王瑞旋. 芽孢杆菌对方斑东风螺生长、存活、免疫及消化酶活性的影响. 南方水产科学. 2023(01): 106-115 .  本站查看
本站查看
4. 梁晶,邢诒炫,吕布,臧战,刘子岭,唐贤明,於锋,Hebert Ely Vasquez,战欣,郑兴,顾志峰. 底砂粒径对方斑东风螺生长、消化、抗氧化及底质的影响. 水产科技情报. 2023(03): 137-145 .  百度学术
百度学术
5. 梅泊承,张晓东,赵淳朴,徐继林,王丹丽,郭春阳. 串联养殖模式下的凡纳滨对虾(Litopenaeus vannamei)与缢蛏(Sinonovacula constricta)生长特性、消化免疫及水生态效应. 海洋与湖沼. 2023(03): 907-920 .  百度学术
百度学术
6. 赵旺,温为庚,谭春明,黄星美,杨蕊,陈明强,杨其彬,陈旭. 饥饿胁迫对猛虾蛄溶菌酶和消化酶活性的影响. 水产科技情报. 2022(01): 30-35 .  百度学术
百度学术
7. 谭春明,赵旺,马振华,于刚. 红腹海参消化道指标、组织学和酶活性的季节变化. 南方水产科学. 2022(05): 39-45 .  本站查看
本站查看
8. 周建聪,顾志峰,叶丙聪,刘闯,羊玉梅,刘春胜,王爱民,石耀华. 盐度和氨氮对方斑东风螺存活和能量收支的影响. 海洋科学. 2022(10): 104-112 .  百度学术
百度学术
9. 韩朝婕,陈屹洋,贺振楠,张严匀,周文礼,高金伟,贾旭颖. 氨氮胁迫对水产动物生长、消化酶及免疫影响的研究进展. 河北渔业. 2021(05): 32-35 .  百度学术
百度学术
10. 丁炜东,曹丽萍,曹哲明,邴旭文. 氨氮胁迫对翘嘴鳜幼鱼鳃、消化道酶活力的影响. 南方水产科学. 2020(03): 31-37 .  本站查看
本站查看
其他类型引用(6)





 下载:
下载:


 粤公网安备 44010502001741号
粤公网安备 44010502001741号
