Effects of schizophyllan on growth, immunity and intestinal microflora of Litopenaeus vannamei
-
摘要:
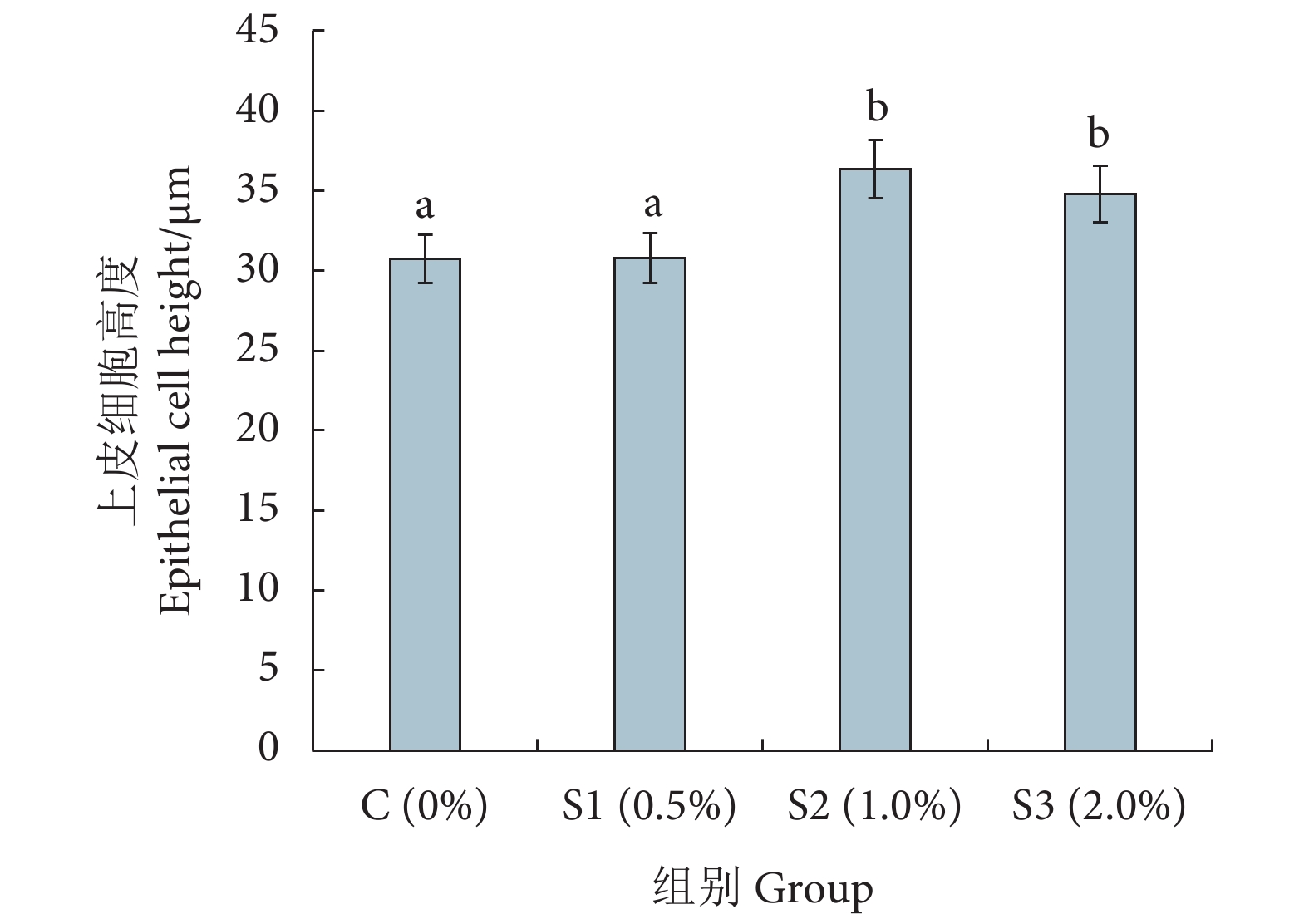
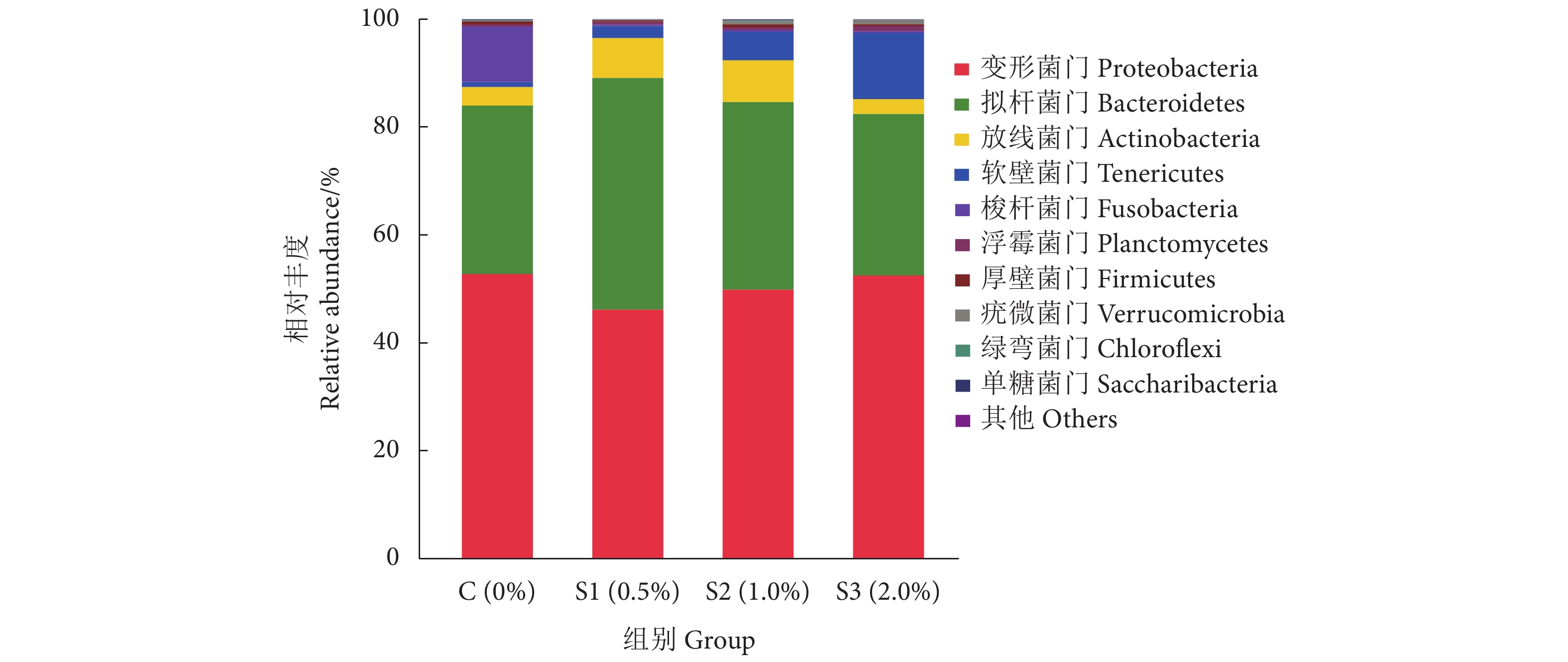
裂褶菌多糖是裂褶菌 (Schizophyllum communer Fr.) 子实体、菌丝体或发酵液提取的具有β-(1,6) 分支的 β-(1,3)-D葡聚糖。为了探究裂褶菌多糖饲养凡纳滨对虾 (Litopenaeus vannamei) 的效果,选用12口凡纳滨对虾养殖池,按照裂褶菌多糖的添加量 (质量分数),分别设置0% (C组)、0.5% (S1组)、1.0% (S2组) 和2.0% (S3组) 4组进行56 d的饲养实验,分析对虾的生长、血清理化、免疫指标和肠道菌群等变化。结果显示,S2组的终末体质量、平均体质量增长率和特定生长率均显著高于C、S1和S3组 (P<0.05);S2、S3组内层上皮细胞的高度显著高于C和S1组 (P<0.05)。与对照组相比,S2和S3组血清中的尿酸含量显著降低 (P<0.05),S1组则无显著性差异 (P>0.05)。S2和S3组血清中溶菌酶、总一氧化氮合成酶、酚氧化酶和碱性磷酸酶的活性均显著高于对照组 (P<0.05)。S2组过氧化氢酶、超氧化物歧化酶活性和总抗氧化能力显著高于对照组 (P<0.05);各实验组血清丙二醛含量均有不同程度的降低 (P>0.05)。肠道菌群Ace、Chao1、Shannon、Simpson指数均无显著性差异 (P>0.05)。在门水平上,与对照组相比,添加裂褶菌多糖的各实验组变形菌门相对丰度均下降,软壁菌门升高。在属水平上,与对照组相比,S2组中Formosa、Pseudoruegeria、Muricauda和鲁杰氏菌属 (Ruegeria) 相对丰度均显著升高 (P<0.05),而弧菌属 (Vibrio) 相对丰度显著降低 (P<0.05)。结果表明,在饲料中添加1.0%的裂褶菌多糖能显著提升凡纳滨对虾的生长性能、免疫力和抗氧化能力,增加肠道有益菌丰度,降低有害菌丰度。
Abstract:Schizophyllan (SPG) is a type of polysaccharide with β-(1,6) branching β-(1,3)-D-glucan, extracted from the fruiting body, mycelium or fermentation broth of Schizophyllum communer. In order to study the effects of SPG feed on the cultivation of Litopenaeus vannamei, we selected 12 L. vannamei breeding ponds, and set up four groups according to the addition amounts of SPG [Group C (0%), Group S1 (0.5%), Group S2 (1.0%) and Group S3 (2.0%)] for a 56-day experiment, then we investigated the growth, blood clearance, immune indicators and intestinal microflora. The results show that the final body mass, average weight gain rate and specific weight gain rate of Group S2 were significantly higher than those of Group C, S1 and S3 (P<0.05). The height of inner epithelial cells in Group S2 and S3 were significantly higher than those in Group C and S1 (P<0.05). Compared with Group C, the contents of serum uric acid (UC) in Group S2 and S3 were significantly lower (P<0.05), but there was no significant difference in Group S1 (P>0.05). The activities of lysozyme (LZM), total nitric oxide synthase (TNOS), phenol oxidase (PO) and alkaline phosphatase (AKP) in serum of Group S2 and S3 were significantly higher than those in Group C (P<0.05). The activities of catalase (CAT), superoxide dismutase (SOD) and total antioxidant capacity (T-AOC) in Group S2 were significantly higher than those of Group C (P<0.05). Compared with the control group, the contents of serum malondialdehyde (MDA) in all experimental groups decreased to different extents (P>0.05). There was no significant difference in Ace, Chao1, Shannon and Simpson indexes of intestinal flora (P>0.05). At phylum level, compared with Group C, the abundance of Proteobacteria in the experimental groups added with SPG decreased, while that of Tenericutes increased. At genus level, compared with Group C, the abundances of Formosa, Pseudoruegeria, Muricauda and Rugella in Group S2 increased significantly (P<0.05), while the abundance of Vibrio decreased significantly (P<0.05). In conclusion, adding 1.0% SPG in feed can improve the growth performance, immunity and antioxidant capacity of L. vannamei, increase the proportion of beneficial bacteria and reduce the proportion of harmful bacteria in intestinal tract.
-
Keywords:
- Litopenaeus vannamei /
- Schizophyllan /
- Intestinal microbiota /
- Immunity
-
盐度是影响河口、过河口及海水水生生物生长和发育的重要环境因子,与水生生物的性腺发育关系密切。研究表明,成体金钱鱼 (Scatophagus argus)[1]、印度囊鳃鲶 (Heteropneustes fossilis)[2]、红眼沙鲈(Psammoperca waigiensis)[3-4]、梭鱼 (Liza haematocheila)[5]、凡纳滨对虾 (Litopenaeus vannamei)[6]、中华绒螯蟹(Eriocheir sinensis)[7]等的性腺需要在一定盐度刺激下才可正常发育。
刀鲚 (Coilia nasus) 是长江口重要的洄游性经济鱼类[8],主要分布于中国、韩国沿海以及日本的有明海[9-12],因味道鲜美、肉质细嫩成为重要的经济鱼类[13]。近年来由于水体污染、水利兴修、资源过度开发等因素,进入产卵场的刀鲚种群数量显著降低,以致不能形成常规的渔汛[14-15]。盐度是刀鲚在洄游过程中最直观的影响因素[16],研究显示,进行生殖洄游的鱼类须到达特定盐度才能完成卵巢的正常发育,才会发生产卵行为[17],如鲥 (Tenualosa reevesii)、暗纹东方鲀 (Takifugu obscurus)、大麻哈鱼 (Oncorhynchus keta) 的性腺发育和成熟仅在盐度低于0.5的淡水环境中进行;而日本鳗鲡 (Anguilla japonica)、松江鲈 (Trachidermus fasciatus)的性腺发育与繁殖需要盐度较高的海水环境[17]。近年,Xu等[18]通过代谢组学对刀鲚卵巢发育不同步的问题进行了研究,Yin等[19]通过代谢组学研究了刀鲚在产卵迁移过程中能量的消耗和储存,但未明确指出海、淡水对卵巢发育的影响。为了更好地保护并合理利用刀鲚资源,需要通过人工养殖来维持其资源量,因此,对刀鲚在人工海、淡水环境下卵巢发育机制的研究十分重要。
代谢组学技术作为近年新兴的一种高通量测序技术,在各研究领域尤其是环境对物种的影响中得到广泛应用[20-22],代谢组代表生物细胞、组织、器官或生物体中的完整代谢产物,这些代谢产物可以通过代谢组学的方法进行测定[23]。关于刀鲚卵巢发育的代谢组学研究较少,本研究主要通过液相色谱-质谱联用 (Liquid chromatograph-mass spectrometer, LC-MS) 的代谢组学技术分析筛选养殖在淡水和海水2种环境下刀鲚卵巢组织的差异代谢产物,并对差异代谢产物进行代谢通路富集分析,为进一步研究刀鲚在生殖洄游过程中卵巢组织的发育及其机制以及人工养殖提供参考依据。
1. 材料与方法
1.1 实验材料
实验于2018年12月—2019年2月在上海市水产研究所奉贤基地进行,实验材料选用该基地提供的野生型F3代,Ⅱ龄刀鲚。实验前将刀鲚放入淡水池中 (长5 m×宽3 m×高1 m) 中暂养2周,其后随机分到淡水组 (实验组) 和海水组 (对照组,盐度为25) 水泥池中养殖,每组100尾。海水从河口抽取,盐度约为9,用日晒盐将盐度提高到25。每天08:00、15:00投喂从池塘捞取的活饵 (桡足类、糠虾等),每14 d换水1次。
1.2 实验方法
1.2.1 采样方法
养殖实验结束后,停食1 d。将刀鲚置于30 mg·L−1丁香酚溶液中麻醉5 min后,用干毛巾将鱼体表面擦干,取其性腺,一半装于2 mL的冻存管,迅速置于液氮罐中冷冻,之后于−80 ℃保存以备刀鲚卵巢代谢组学分析;另一半置于Bouin's液中固定24 h,通过石蜡切片和HE染色确定性别后,将海、淡水刀鲚的卵巢分别每3个样混合,每组6个平行,平均体长为 (21.00±2.67) cm,平均体质量为 (25.80±9.05) g。
1.2.2 样本处理
称取刀鲚卵巢样本20 mg ,加入400 μL提取液 [V(甲醇)∶V(水)=4∶1],利用高通量组织破碎仪破碎 (−20 ℃, 50 Hz, 6 min);涡旋 (30 s) 混匀后,低温超声萃取30 min (5 ℃, 40 kHz);将其置于−20 ℃ 30 min;离心(13 000×g, 4 ℃, 15 min),去掉上清液,并加入100 μL复溶液 [V(乙腈)∶V(水)=1∶1] 复溶,同时将所有样本的提取液等体积混匀制备质控样本 (Quality control, QC),每个QC的体积与样本体积相同。将所测样本和QC转移至LC-MS 进样瓶进行上机分析。本次LC-MS 分析的仪器平台为AB SCIEX公司的超高效液相色谱串联飞行时间质谱UPLC-TripleTOF系统。
1.2.3 色谱条件
实验采用美国Milford公司BEH C18色谱柱 (100 mm × 2.1 mm,1.7 μm)。配置流动相A 为水 (含0.1%甲酸),流动相B 为V(乙腈)∶V(异丙醇)=1∶1 (含0.1%甲酸),进行梯度洗脱,流速为0.40 mL·min−1,进样量为20 μL,柱温为40 ℃。
1.2.4 质谱条件
样品质谱信号采集分别采用正负离子扫描模式、离子喷雾电压。质谱检测范围为50~1 000 m.z−1。ESI离子源参数设置雾化气压 (GS1) 50 psi;辅助气压 (GS2) 50 psi;气帘气压:30 psi;温度:500 ℃;喷雾电压:5 000 V (POS模式)或−4 000 V (NEG模式)。
1.3 数据处理与分析
首先采用代谢组学Progenesis QI处理软件 (Waters Corporation, Milford, USA)过滤质谱数据的低质量峰,填充缺失值,归一化,评估QC样本RSD,数据log转换预处理。将原始数据用Progenesis QI进行搜库鉴定,将质谱信息与代谢数据库HMDB和METLIN进行匹配。
采用R软件包Ropls进行多元统计分析:首先将所有实验样品与QC样品比较后进行主成分分析 (Principal Component Analysis, PCA)和正交偏最小二乘判别分析(Orthogonal Partial Least Squares Discrimination Analysis, OPLS-DA),再经200次置换检验以判断模型是否过拟合。
采用t检验并结合OPLS-DA分析中的VIP值,筛选出组间的差异代谢物,筛选条件为差异倍数(Fold-change FC>1)、P(<0.05)和变量投影重要度(Variable importance in the projection, VIP>1),三者取交集。代谢通路的注释分析基于KEGG数据库。
将得到的差异代谢产物在KEGG Compound和HMDB数据库进行化合物分类情况统计。
2. 结果
2.1 多元统计分析结果
首先对淡水组 (N=6) 和海水组 (N=6) 的样品进行PCA和OPLS-DA分析以评估两组间的统计学差异,发现所有样品均处于样本置信区间。十字架表示的质控样本比较集中,说明仪器的稳定性好,检测的数据可靠,可用于PCA和OPLS-DA分析。PCA得分结果显示,淡水组和海水组样品点在空间上具有明显的分离,表明两组间的代谢模式存在差异 (图1-a);OPLS-DA分析可看出两组数据的样品点分别聚为一簇,在空间上呈现分离状态,表明淡水组和海水组间产生了显著差异 (图1-b),模型的评价指标R2=0.971,Q2=0.562,说明所构建的模型良好。为进一步验证模型是否过拟合,采用200次置换检验 (图2),可知Q2于y轴的截距为负,且置换检验得到的R2=0.873 5和Q2=−0.146 4均小于原始值,由此可见模型没有过拟合,可以用于后续差异代谢物筛选的分析。
2.2 总代谢产物Venn图
对在阳离子和阴离子2种模式下获得的海、淡水养殖刀鲚的卵巢代谢产物数据分别构建Venn图(图3)。在阳离子分离模式下,2组卵巢组织中共有代谢产物310个,其中淡水组中特有代谢产物9个,海水组12个;在阴离子分离模式下,2组共有代谢产物392个,其中淡水组中特有代谢产物也为9个,海水组则降到10个。
2.3 差异代谢产物注释
海水和淡水养殖刀鲚卵巢组织样本中的差异代谢产物的火山图见图4,差异代谢产物具体信息详见表1。与海水组相比,淡水组刀鲚卵巢组织有47个代谢产物表现出显著差异性,其中11个代谢产物有上调表达,36个代谢产物有下调表达,表达差异程度最显著的为碳环血氧烷A2 (Carbocyclic thromboxane A2)、半乳糖神经酰胺 (Galactosyl ceramide),差异倍数分别为10.40、2.78倍。根据表1,淡水组的皮质醇含量比海水组高1.61倍,且呈显著性差异 (P<0.05)。
表 1 差异代谢物信息表Table 1. Differential metabolites information sheet差异代谢物
Differential metabolite分子式
Molecular formula变量投影重要度
VIPFC
Fold changeP 变化趋势
Variation trend磷脂酰肌醇 PI [20:4(5Z,8Z,11Z,14Z)/0:0] C29H49O12P 1.58 0.93 0.017 下降 谷氨酰胺色氨酸 Glutaminyltryptophan C16H20N4O4 1.05 0.96 0.018 下降 L-异亮氨酸 L-Isoleucine C6H13NO2 1.33 0.96 0.005 下降 木麻黄6-α-D-葡萄糖苷 Casuarine 6-alpha-D-glucoside C14H25NO10 1.13 0.94 0.043 下降 甘油一脂 MG(10:0/0:0/0:0) C13H26O4 3.59 0.71 0.025 下降 皮质醇 Cortisol C21H30O5 3.28 1.61 0.008 上升 碳环血氧烷A2 Carbocyclic thromboxane A2 C22H36O3 2.88 10.40 0.007 上升 (±)9-十八碳二烯酸 (±)9-HPODE C18H32O4 2.90 0.58 0.020 下降 N-棕榈酰蛋氨酸 N-palmitoyl methionine C21H41NO3S 1.86 0.75 0.022 下降 13-羟基十八酸 13-hydroxyoctadecanoic acid C18H36O3 1.95 0.86 0.005 下降 咖啡酰环戊醇 Caffeoylcycloartenol C39H56O4 2.07 0.81 0.036 下降 11,13-二十碳二烯酸 15-OxoEDE C20H34O3 2.51 0.70 0.032 下降 2,3-二氢苯并呋喃 2,3-dihydrobenzofuran C8H8O 1.19 1.08 0.033 上升 4-甲酰基吲哚 4-formyl indole C9H7NO 1.34 0.83 0.040 下降 红花素C Safflomin C C30H30O14 2.04 0.85 0.003 下降 6-[(2-羧基乙酰基)氧]-3,4,5-三羟基氧烷-2-羧酸6-[(2-carboxyacetyl)oxy]-3,4,5-trihydroxyoxane-2-carboxylic acid C9H12O10 2.07 1.12 0.001 上升 异戊二烯 Isoputreanine C7H16N2O2 2.33 0.84 0.001 下降 脯氨酸 L-Proline C5H9NO2 1.80 0.91 0.003 下降 羟脯氨酸 Hydroxyprolyl-hydroxyproline C10H16N2O5 3.13 0.72 0.007 下降 5-O-阿魏酰黑精 5-O-Feruloylnigrumin C21H25NO10 1.0 0.95 0.037 下降 壬二酸 Azelaic acid C9H16O4 1.12 0.96 0.012 下降 尿苷 Uridine C9H12N2O6 1.35 0.95 0.001 下降 视黄酯 Retinyl ester C20H30O2 1.24 0.96 0.004 下降 顺-9,10-环氧硬脂酸 cis-9,10-Epoxystearic acid C18H34O3 1.66 0.92 0.025 下降 异柠檬酸盐 Isocitrate C6H8O7 1.55 1.12 0.047 上升 戊二酸 Glutaric acid C5H8O4 2.53 1.38 0.015 上升 6-脱氧噬菌体胺 (6-脱氧花青) 6-Deoxyfagomine C6H13NO2 1.36 0.94 0.012 下降 乙酰-L-酪氨酸 Acetyl-L-tyrosine C11H13NO4 1.38 0.87 0.010 下降 γ-谷氨酰鸟氨酸 Gamma glutamyl ornithine C10H19N3O5 1.87 1.58 0.023 上升 对茴香酸异戊酯 (异戊基异茴香酸酯) Isoamyl p-anisate C13H18O3 1.76 0.67 0.041 下降 3-氧十二酸 3-Oxododecanoic acid C12H22O3 1.01 0.92 0.043 下降 C-2神经酰胺 C-2 Ceramide C20H39NO3 2.21 0.75 0.028 下降 磷脂酰乙醇胺 PE(15:0/16:1(9Z)) C36H70NO8P 1.42 1.10 0.030 上升 半乳糖神经酰胺 Galactosyl ceramide (d18:1/14:0) C38H73NO8 1.97 2.78 0.045 上升 N-棕榈酰甘氨酸 N-Palmitoyl glycine C18H35NO3 1.97 0.86 0.000 下降 二十碳五烯酸 Eicosapentaenoic acid C20H30O2 1.01 0.98 0.004 下降 溶血磷脂酰乙醇胺 LysoPE(0:0/20:2(11Z,14Z)) C25H48NO7P 1.33 1.12 0.037 上升 9-羟基癸酸 9-Hydroxydecanoic acid C10H20O3 1.21 0.92 0.028 下降 甘油一脂 MG(a-13:0/0:0/0:0)[rac] C16H32O4 1.92 0.79 0.040 下降 反式-2-十二碳烯二酸 Traumatic acid C12H20O4 1.37 0.86 0.025 下降 9-氧壬酸 9-Oxo-nonanoic acid C9H16O3 1.15 0.93 0.019 下降 8-羟基-5,6-辛二烯酸 8-Hydroxy-5,6-octadienoic acid C8H12O3 1.04 0.94 0.016 下降 (S)-3-磺酸盐 (S)-3-Sulfonatolactate C3H6O6S 2.57 3.05 0.046 上升 γ-谷氨酰缬氨酸 gamma-Glutamylvaline C10H18N2O5 1.80 0.87 0.008 下降 穗花牡荆苷 Agnuside C22H26O11 1.41 0.91 0.005 下降 假尿苷 Pseudouridine C9H12N2O6 1.19 0.93 0.003 下降 雌三醇7-(6-反式-对-香豆酰基葡萄糖苷)
Eriodictyol 7-(6-trans-p-coumaroylglucoside)C30H28O13 1.44 0.92 0.020 下降 注:FC表示某差异代谢物在淡水组相对于海水组的表达倍数变化,FC>1表示该代谢物上调,FC<1表示该代谢物下调;P<0.05表示差异显著,P<0.01表示差异极显著。 Note: FC value indicates the change of expression multiple of a differential metabolite in FOV group compared with SOV group. FC>1 indicates that the metabolite is upregulated; FC<1 indicates that the metabolite is down-regulated. P<0.05 indicates significant difference, and P<0.01 indicates extremely significant difference. 将上述47个差异表达代谢产物比对到KEGG 数据库进行富集分析,共有8个代谢产物显著富集到12条KEGG通路上 (图5和表2)。显著差异代谢产物的富集通路主要涉及氨酰-tRNA生物合成 (Aminoacyl-tRNA biosynthesis)、嘧啶代谢 (Pyrimidine metabolism)、鞘磷脂代谢 (Sphingolipid metabolism)和三羧酸循环 (TCA cycle)。上调表达的2个代谢产物L-脯氨酸 (L-Proline)和L-异亮氨酸 (L-Isoleucine)参与到氨酰tRNA生物合成通路上。下调表达的2个代谢产物尿苷和假尿苷参与到嘧啶代谢通路中。在实验组卵巢组织中上调表达的半乳糖神经酰胺和异柠檬酸 (Isocitrate) 代谢物分别参与到鞘磷脂代谢和三羧酸循环通路中。
表 2 差异代谢产物的KEGG通路富集表Table 2. KEGG pathway enrichment table of differential metabolites富集的差异代谢产物名称
Enriched differential metabolite name富集个数
Numble富集通路
ID Pathway通路描述
Pathway desciptionP 半乳糖神经酰胺 Galactosyl ceramide (d18:1/14:0) 1 map00600 鞘脂代谢 0.059 脯氨酸 L-Proline 1 map00330 精氨酸和脯氨酸代谢 0.176 异柠檬酸盐 Isocitrate 1 map00020 柠檬酸循环 0.057 戊二酸 Glutaric acid 1 map00310 赖氨酸降解 0.130 皮质醇 Cortisol 1 map00140 类固醇激素生物合成 0.207 尿苷 Uridine;假尿苷 Pseudo uridine 2 map00240 嘧啶代谢 0.011 异柠檬酸盐 Isocitrate 1 map00630 乙醛酸和二羧酸代谢 0.137 L-异亮氨酸 L-Isoleucine;脯氨酸 L-Proline 2 map00970 氨酰tRNA生物合成 0.008 L-异亮氨酸 L-Isoleucine 1 map00290 缬氨酸、亮氨酸和异亮氨酸生物合成 0.064 二十碳五烯酸 Eicosapentaenoic acid 1 map01040 不饱和脂肪酸生物合成 0.097 L-异亮氨酸 L-Isoleucine 1 map00280 缬氨酸、亮氨酸和异亮氨酸降解 0.107 (S)-3-磺酸盐 (S)-3-Sulfonatolactate 1 map00270 半膀氨酸和蛋氨酸代谢 0.141 将得到的差异代谢产物比对到HMDB数据库,统计发现占比最多的是脂质和类脂分子,高达41.18%;其次为有机酸及其衍生物,占比35.29%。
将代谢差异物比对到KEGG Compound数据库,发现聚类最多的是氨基酸和羧酸;比对到KEGG Pathway数据库,发现富集程度最高的分别是脂质代谢通路 (Lipid metabolism)、氨基酸代谢通路和消化系统。
3. 讨论
通过非靶向代谢组学得到刀鲚卵巢在海、淡水环境下47种差异代谢物,发现代谢物主要包括脂质和类脂、有机酸及衍生物、氨基酸及羧酸,这与Xu等[18]对刀鲚卵巢Ⅲ—Ⅴ期发育过程的研究结果相似,差异代谢物主要涉及糖酵解和糖异生、组氨酸代谢、赖氨酸代谢以及脂肪酸的代谢相关通路。由此可见,海、淡水环境对人工养殖刀鲚的卵巢发育具有重要作用。
碳环血氧烷A2是由活化的血小板在止血过程中产生的,具有凝血之前的特性,也是一种已知的血管收缩剂[24-26],本实验淡水组碳环血氧烷A2高表达可能是刀鲚机体组织为应对进入到淡水中盐度降低作出的适应性调节。半乳糖神经酰胺是一种强免疫兴奋剂,在许多体内实验模型中显示出强大的抗肿瘤活性[27],虹鳟 (Oncorhynchus mykiss) 在洄游产卵期会遇到海水中不同的病毒、细菌等进而增强体内免疫系统[28],本研究与此类似,刀鲚为应对环境改变所带来的免疫胁迫压力,也会通过增强特殊的免疫通路来完成洄游繁殖进程。
皮质醇是一类类固醇激素,属于糖皮质激素类,其通过糖异生作用提高血糖水平,也具有抑制免疫系统的功能,有助于脂肪、蛋白质和碳水化合物的代谢[29]。研究表明,在产卵季节,大麻哈鱼的血浆皮质醇水平会有升高现象[30]。皮质醇在薄唇鲻鱼 (Liza ramada) 卵巢卵黄形成早期呈下降趋势,在卵黄中期呈上升趋势,在卵黄后期下降,在产卵前期上升到较高水平,皮质醇的这种周期性变化支持了卵巢的发育和产卵[31]。类固醇代谢在卵巢发育中发挥着重要作用,其主要由内分泌腺如精巢、卵巢和肾上腺等单位合成之后释放到血液循环中,而所有的类固醇激素均由胆固醇合成,Xu等[18]研究指出,胆固醇合成途径在刀鲚卵巢发育过程中 (Ⅲ—Ⅴ期) 逐渐增强。本实验中皮质醇在淡水环境下比海水环境高1.61倍,每年2月初次性成熟的刀鲚开始从沿海区域进入长江等近海淡水区进行生殖洄游,在此过程中卵巢逐渐发育成熟,说明皮质醇在刀鲚洄游过程中参与了卵巢的发育过程,可能进一步促进了卵巢发育。此外,鱼体内的皮质醇具调节渗透压作用,能够刺激鱼类鳃上皮氯细胞密度增加,增强鳃内Na+/K+-ATPase活性,使过多的盐分排除体外[32-34],推测皮质醇在刀鲚的洄游过程中参与了渗透压的调节。
氨酰-tRNA合成酶在翻译中的作用是通过准确地将同源tRNA与相应的氨基酸配对来定义遗传密码,增强生物体在蛋白质翻译水平的准确性[35-36],本实验中下调的差异代谢物L-脯氨酸和L-异亮氨酸被富集到氨酰-tRNA生物合成代谢通路上,表明刀鲚卵巢组织为适应低盐度的环境可能相应地降低了蛋白质的翻译。同样下调表达的尿苷和假尿苷2个差异代谢产物富集到嘧啶代谢通路中,该通路的产物β-氨基丁酸 (β-aminobutyric acid) 可以参与到TCA循环中[37] ,表明淡水养殖环境下刀鲚卵巢组织内嘧啶类代谢受到部分抑制,甚至可影响能量代谢。刀鲚卵巢组织中鞘磷脂代谢在淡水环境中得到提升,被富集到该通路的半乳糖神经酰胺可稳固细胞膜脂质双分子层的机械稳定和化学抗性[38-39],由此可见,在刀鲚洄游过程中神经酰胺类代谢产物在信号转导和细胞识别中发挥重要作用。
4. 结论
本研究使用LC-MS非靶向代谢组学分析方法,研究了养殖在海、淡水中刀鲚的卵巢组织代谢产物的变化,共筛选得到47种差异代谢产物,推测碳环血氧烷A2和半乳糖神经酰胺的高表达,分别是为了更好地适应环境变化作出的适应性调节和增强免疫;淡水环境下皮质醇大量积累,推测皮质醇在刀鲚的洄游过程中参与了渗透压调节,同时可能与卵巢的发育相关;对差异代谢产物进行KEGG通路富集分析,筛选出氨酰-tRNA生物合成、嘧啶代谢和鞘磷脂代谢3条最显著的代谢途径,推测盐度的变化对刀鲚卵巢组织中的氨基酸、嘧啶、鞘磷脂的合成代谢有较大影响。
-
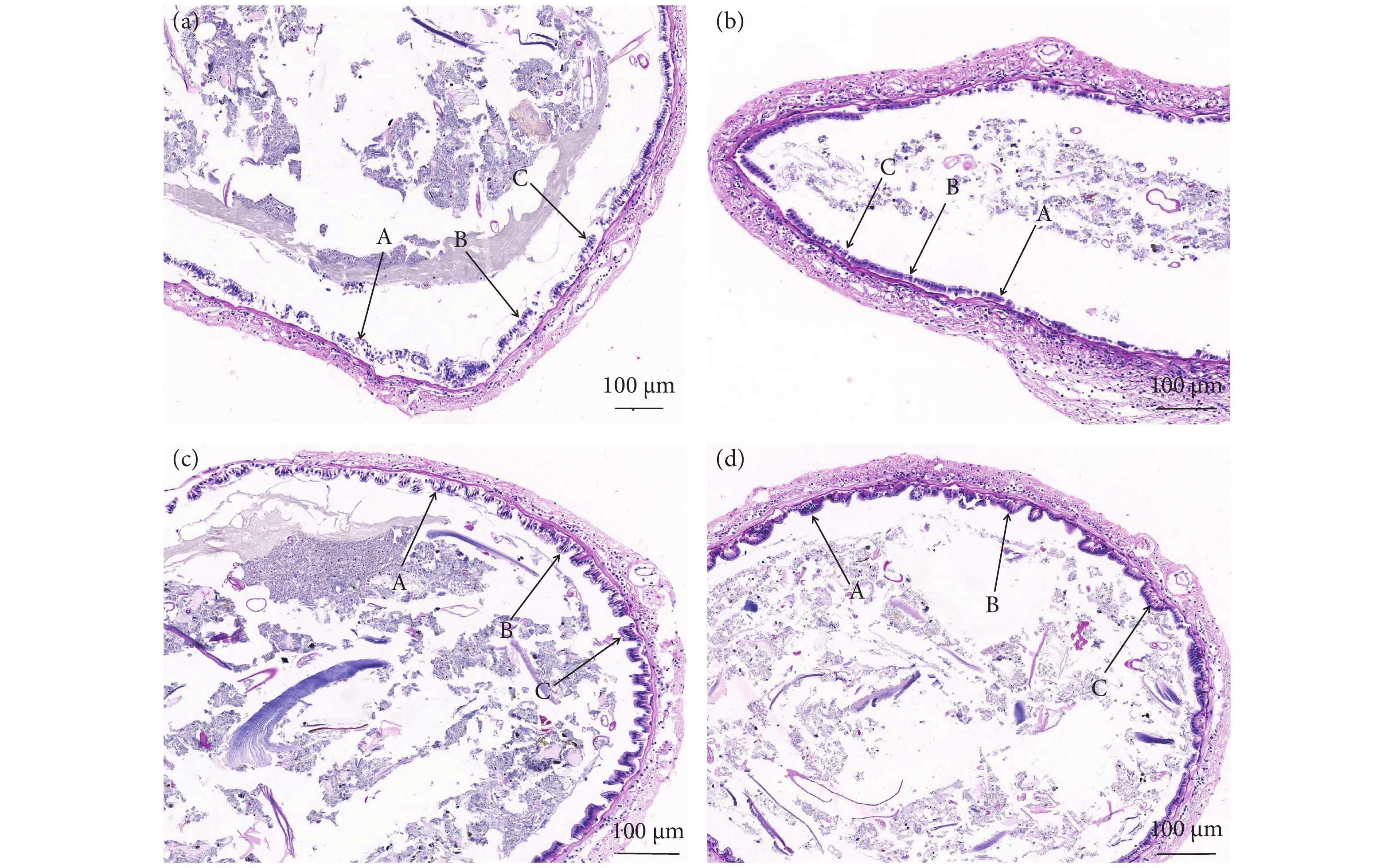
图 1 对照组与实验组肠道切片对比 (200×)
a. C组 (0%) 肠道切片;b. S1 组 (0.5%) 肠道切片;c. S2 组 (1.0%) 肠道切片;d. S3 组 (2.0%) 肠道切片;A、B、C为不同上皮细胞高度。
Figure 1. Comparison of intestinal slices between control group and test groups (200×)
a. Intestinal slices of Group C; b. Intestinal slices of Group S1; c. Intestinal slices of Group S2; d. Intestinal slices of Group S3; A, B and C represent different epithelial cell heights.
表 1 裂褶菌多糖对凡纳滨对虾生长性能比较
Table 1 Comparison of effects of schizophyllan on growth performance of L. vannamei
指标
Index裂褶菌多糖添加量 Addition amounts of schizophyllan 0% (C) 0.5% (S1) 1.0% (S2) 2.0% (S3) 初始体质量 Initial body mass/g 1.85±0.03 1.85±0.03 1.85±0.03 1.85±0.03 终末体质量 Final body mass/g 18.44±3.34a 20.33±0.45a 23.13±0.31b 19.90±2.55a 体质量增长率 WGR/% 896.94±180.42a 999.10±24.37a 1 150.45±16.51b 975.68±137.90a 特定生长率 SGR/(%·d−1) 4.09±0.33a 4.28±0.40a 4.51±0.24b 4.23±0.23a 饲料系数 FCR 1.45±0.01 1.47±0.02 1.45±0.02 1.46±0.03 成活率 SR/% 70.15±0.10a 70.12±0.11a 75.37±0.32b 72.21±0.13c 摄食量 FI/g 18.89±0.43a 21.44±0.36b 25.77±0.38c 21.23±0.40b 终末体长 Final body length/cm 11.03±1.16 11.75±0.35 12.25±0.64 11.88±0.88 注:组间显著性差异采用不同小写字母表示 (P<0.05),下同。 Note: Different lowercase letters indicate significant differences between groups (P<0.05); the same below. 表 2 裂褶菌多糖对凡纳滨对虾血清生化指标的影响
Table 2 Effect of schizophyllan on serum biochemical indexes of L. vannamei
指标
Index裂褶菌多糖添加量 Addition amount of schizophyllan 0% (C) 0.5% (S1) 1.0% (S2) 2.0% (S3) 总蛋白 TP/(g·L−1) 52.71±13.01 59.49±11.00 69.07±4.48 53.91±7.18 胆固醇 CHO/(mmol·L−1) 0.72±0.21 0.69±0.10 0.64±0.20 0.74±0.39 尿酸 UA/(μmol·L−1) 20.17±5.95a 16.06±3.51ab 12.95±2.09b 10.75±2.44b 谷草转氨酶 AST/(U·L−1) 382.00±142.68 443.67±100.81 474.33±140.63 427.33±143.12 谷丙转氨酶 ALT/(U·L−1) 431.67±55.37a 247.33±91.15b 302.00±61.29ab 230.67±123.45b 溶菌酶 LZM/(U·mL−1) 0.05±0.01a 0.09±0.03ac 0.14±0.04b 0.13±0.03bc 酚氧化酶 PO/(U·mL−1) 0.30±0.11a 0.52±0.03b 0.47±0.03b 0.41±0.05b 碱性磷酸酶 ALP/(U·mL−1) 0.64±0.32a 1.43±0.39b 1.70±0.24b 1.43±0.03b 总一氧化氮合酶 TNOS/(U·mL−1) 12.89±1.44a 13.75±0.83ac 15.59±1.64bc 16.23±1.04b 超氧化物歧化酶 SOD/(U·mL−1) 246.55±7.35a 267.37±47.87a 333.78±25.07b 253.23±40.09a 过氧化氢酶 CAT/(U·mL−1) 12.93±2.87a 17.18±2.57b 23.68±0.91c 20.59±0.97bc 丙二醛 MDA/(nmol·L−1) 6.40±1.20 5.95±0.54 5.77±0.68 6.31±2.71 总抗氧化能力 T-AOC/(U·mL−1) 5.18±1.66a 5.75±0.82ab 8.67±2.41b 7.40±1.62ab 表 3 裂褶菌多糖对凡纳滨对虾肠道菌群多样性的影响
Table 3 Effects of schizophyllan on intestinal microflora diversity of L. vannamei
指标
Index裂褶菌多糖添加量 Addition amounts of schizophyllan 0% (C) 0.5% (S1) 1.0% (S2) 2.0% (S3) 操作分类单元 OTUs 236.33±19.50 201.00±25.16 242.67±82.97 240.33±3.21 Chaol 指数 Chao1 261.33±19.43 227.33±24.83 266.67±78.82 274.33±23.03 ACE 指数 ACE 261.33±10.50 226.33±22.23 269.67±71.39 262.47±22.50 香农指数 Shannon 3.37±0.57 3.45±0.18 3.48±0.15 3.42±0.12 辛普森指数 Simpson 0.70±0.24 0.53±0.13 0.57±0.08 0.65±0.05 覆盖率指数 Coverage 0.999±0.00 0.999±0.00 0.999±0.00 0.999±0.00 -
[1] 文国樑, 李卓佳, 林黑着, 等. 规格与盐度对凡纳滨对虾肌肉营养成分的影响[J]. 南方水产, 2007, 3(3): 31-34. [2] 李玉虎, 宋芹芹, 张志怀, 等. 凡纳滨对虾生长发育规律及生长曲线拟合研究[J]. 南方水产科学, 2015, 11(1): 89-95. [3] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2023中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2023: 22, 24. [4] TZIANABOS A O. Polysaccharide immunomodulators as therapeutic agents: structural aspects and biologic function[J]. Clin Microbiol Rev, 2000, 13(4): 523-533. doi: 10.1128/CMR.13.4.523
[5] 张虎成, 齐贺. 发酵原料药生产[M]. 北京: 中国轻工业出版社, 2014: 238-240. [6] 尚庆辉, 解玉怀, 张桂国, 等. 植物多糖的免疫调节作用及其机制研究进展[J]. 动物营养学报, 2015, 27(1): 49-58. doi: 10.3969/j.issn.1006-267x.2015.01.008 [7] 毛绍春, 李竹英, 李聪. 人工裂褶菌多糖结构及含量变化研究[J]. 资源开发与市场, 2007, 23(5): 385-386. doi: 10.3969/j.issn.1005-8141.2007.05.001 [8] 李翘楚, 张璐, 王红艳, 等. 裂褶菌胞内多糖的提取纯化及生物活性分析[J]. 食品工业科技, 2023, 44(4): 252-260. [9] 刘小玲, 徐向群, 黄燕华, 等. 桦褐孔菌多糖对凡纳滨对虾生长和血清免疫相关酶活性的影响[J]. 水产科学, 2014, 33(4): 201-207. [10] 昌鸣先, 陈孝煊, 吴志新, 等. 虫草多糖对日本沼虾免疫机能的影响[J]. 华中农业大学学报, 2001, 20(3): 275-278. doi: 10.3321/j.issn:1000-2421.2001.03.020 [11] 徐申波, 郭振, 陈师勇, 等. 灵芝多糖对凡纳滨对虾生长和免疫功能的影响[J]. 青岛农业大学学报 (自然科学版), 2021, 38(4): 290-294, 304. [12] 李红权, 刘存歧, 李志英, 等. 灰树花多糖对日本对虾免疫活性的影响[J]. 水生态学杂志, 2008, 29(6): 128-131. [13] ZHAO H X, CAO J M, WANG A L, et al. Effect of long-term administration of dietary β-1, 3-glucan on growth, physiological and immune responses in Litopenaeus vannamei (Boone, 1931)[J]. Aquac Int, 2012, 20(1): 145-158. doi: 10.1007/s10499-011-9448-6
[14] 万安滔, 张林存, 程星宇, 等. 香菇多糖对罗非鱼非特异性免疫力的影响[J]. 江苏农业科学, 2012, 40(4): 225-227. [15] 杨娜, 王鸿飞, 董栓泉, 等. 裂褶菌多糖对小鼠免疫活性作用的研究[J]. 现代食品科技, 2014, 30(8): 1-5. [16] COOK M T, HAYBALL P J, HUTCHINSON W, et al. Administration of a commercial immunostimulant preparation, EcoActiva™ as a feed supplement enhances macrophage respiratory burst and the growth rate of snapper (Pagrus auratus, Sparidae (Bloeh and Schneider)) in winter[J]. Fish Shellfish Immunol, 2003, 14(4): 333-345. doi: 10.1006/fsim.2002.0441
[17] MISRA C K, DAS B K, MUKHERJEE S C, et al. Effect of long term administration of dietary β-glucan on immunity, growth and survival of Labeo rohita fingerlings[J]. Aquaculture, 2006, 255(14): 82-94.
[18] AI Q H, MAI K, ZHANG L, et a1. Effects of dietary β-l, 3 glucan on innate immune response of large yellow croaker, Pseudosciaena crocea[J]. Fish Shellfish Immunol, 2007, 22(4): 394-402. doi: 10.1016/j.fsi.2006.06.011
[19] 董淑丽, 王占彬, 雷雪芹, 等. 热应激对动物血液生化指标的影响[J]. 家畜生态, 2004, 25(2): 54-56. [20] COMA J, CARRION D, ZIMMERMAN D R. Use of plasma urea nitrogen as a rapid response criterion to determine the lysine requirement of pigs[J]. J Anim Sci, 1995, 73(2): 472-481. doi: 10.2527/1995.732472x
[21] 赵军, 林英庭, 孙建凤, 等. 饲粮中不同水平浒苔对蛋鸡蛋黄品质、抗氧化能力和血清生化指标的影响[J]. 动物营养学报, 2011, 23(3): 452-458. [22] WORTMANN, ROBERT L. Gout and hyperuricemia[J]. Curr Opin Rheumatol, 2002, 14(3): 281-286. doi: 10.1097/00002281-200205000-00015
[23] LI H F, XU C, ZHOU L, et al. Beneficial effects of dietary β-glucan on growth and health status of Pacific white shrimp Litopenaeus vannamei at low salinity[J]. Fish Shellfish Immunol, 2019, 91: 315-324.
[24] 黄健彬, 迟艳, 周传朋, 等. 褐藻寡糖对卵形鲳鲹幼鱼生长性能, 抗氧化能力和免疫功能的影响[J]. 南方水产科学, 2022, 18(3): 118-128. [25] 江晓路, 杜以帅, 王鹏, 等. 褐藻寡糖对刺参体腔液和体壁免疫相关酶活性变化的影响[J]. 中国海洋大学学报, 2009, 39(6): 1188-1192. [26] 王鹏, 江晓路, 江艳华, 等. 褐藻低聚糖对提高大菱鲆免疫机能的作用[J]. 海洋科学, 2006, 30(8): 6-9. [27] VALENTE L M P, BATISTA S, RIBEIRO C, et al. Physical processing or supplementation of feeds with phytogenic compounds, alginate oligosaccharide or nucleotides as methods to improve the utilization of Gracilaria gracilis by juvenile European seabass (Dicentrarchus labrax)[J]. Aquaculture, 2021, 530: 1-14.
[28] JAMI M J, KENARI A A, PAKNEJAD H, et al. Effects of dietary b-glucan, mannan oligosaccharide, Lactobacillus plantarum and their combinations on growth performance, immunity and immune related gene expression of Caspian trout, Salmo trutta caspius (Kessler, 1877)[J]. Fish Shellfish Immunol, 2019, 91: 202-208.
[29] ZHAO H X, CAO J M, WANG A L, et al. Effect of dietary β-1, 3-glucan on the immune response of Litopenaeus vannamei exposed to nitrite-N[J]. Aquac Nutr, 2012, 18(3): 272-280. doi: 10.1111/j.1365-2095.2011.00893.x
[30] SORAAT A, SASIMANAS U, CHEEWARAT P, et al. Feeding-regimen of β-glucan to enhance innate immunity and disease resistance of Nile tilapia, Oreochromis niloticus Linn, against Aeromonas hydrophila and Flavobacterium columnare[J]. Fish Shellfish Immunol, 2019, 87: 120-128. doi: 10.1016/j.fsi.2018.12.062
[31] JONES S E, LENNON J T. Dormancy contributes to the maintenance of microbial diversity[J]. P Natl Acad Sci USA, 2010, 107(13): 5881-5886. doi: 10.1073/pnas.0912765107
[32] WU J F, XIONG J B, WANG X, et al. Intestinal bacterial community is indicative for the healthy status of Litopenaeus vannamei[J]. Chin J Appl Ecol, 2016, 27(2): 611-621.
[33] 韩少锋. 罗非鱼腐败过程菌群结构分析及腐败菌的分离、鉴定与调控[D]. 北京: 中国农业科学院, 2010: 7-33. [34] MUKHOPADHYA I, HANSEN R, ELOMAR E M, et al. IBD: what role do proteobacteria play?[J]. Nat Rev Gastro Hepat, 2012, 9(4): 219-230. doi: 10.1038/nrgastro.2012.14
[35] 于明超, 张晓华, 郑艳芬, 等. 一种运动鲁杰氏菌菌株及其应用: CN105779366B[P]. 2019-05-31. [36] KO S R, JEONG Y, CHO S H, et al. Functional role of a novel algicidal compound produced by Pseudoruegeria sp. M32A2M on the harmful algae Alexandrium catenella[J]. Chemosphere, 2022, 300: 1-9.
[37] 陈晓瑛, 王国霞, 孙育平, 等. 饲料中添加低聚木糖对凡纳滨对虾幼虾消化酶活力、肠道形态及细菌数量的影响[J]. 动物营养学报, 2018, 30(4): 1522-1529. [38] SU P, HAN Y, JIANG C, et al. Effects of chitosan ligosaccharides on growth performance, digestive enzyme and intestinal bacterial flora of tiger puffer (Takifugu rubripes Temminck et Schlegel, 1850)[J]. J Appl Ichthyol, 2017, 33(3): 458-467. doi: 10.1111/jai.13282
[39] 潘金露. 饲料中壳寡糖和褐藻酸寡糖对大菱鲆(Scophthalmus maximus)消化及肠道菌群的影响[D]. 大连: 大连海洋大学, 2016: 19-24. [40] 殷朝敏, 高虹, 范秀芝, 等. 一种增强白参菌多糖生物活性的复合改性方法及其在调节人体肠道菌群中的应用: CN202210822554.4[P]. 2022-07-13. [41] 曹海鹏, 温乐夫, 周桂娴, 等. 南美白对虾白便综合征病原霍乱弧菌的分离与药敏试验[J]. 动物医学进展, 2016, 37(2): 128-132. [42] PESTOVA M I, CLIFT R E, VICKERS R J, et al. Effect of weaning and dietary galactose supplementation on digesta glycoproteins in pigs[J]. J Sci Food Agric, 2000, 80(13): 1918-1924. doi: 10.1002/1097-0010(200010)80:13<1918::AID-JSFA731>3.0.CO;2-B
-
期刊类型引用(6)
1. 王子涵,曾聪,姜子禺,曹玲. 东海及其邻近海域受胁鱼类保护空缺分析. 热带海洋学报. 2023(01): 66-86 .  百度学术
百度学术
2. 王新月,陈生熬,王程欣,訾方泽,常德胜,许豪,李大鹏. 叶尔羌高原鳅耳石形态探究及群体判别分析. 渔业科学进展. 2023(04): 201-211 .  百度学术
百度学术
3. 谢玉,玄文丹,周永东,朱凯,朱文斌,王忠明,徐开达,王嘉浩. 东海海域带鱼矢耳石形态特征与生长研究. 浙江海洋大学学报(自然科学版). 2023(04): 294-302 .  百度学术
百度学术
4. 潘梦珍,王海山,叶乐,陈治,杨超杰. 崖州湾附近海域金线鱼形态学指标的相关性. 海南热带海洋学院学报. 2020(02): 11-17 .  百度学术
百度学术
5. 蔡研聪,黄梓荣,李佳俊,许友伟,孙铭帅,陈作志,刘维达. 南海北部近海新记录种——苏门答腊金线鱼资源分布特征. 南方水产科学. 2020(06): 1-11 .  本站查看
本站查看
6. 杨超杰,唐婷婷,吴东霞,杜良玉,方馨正. 崖州湾附近海域金线鱼繁殖生物学研究. 海南热带海洋学院学报. 2019(05): 6-11 .  百度学术
百度学术
其他类型引用(5)




 下载:
下载:





 粤公网安备 44010502001741号
粤公网安备 44010502001741号
