Seasonal variation of fishery resources in Wailingding marine ranching and adjacent waters
-
摘要:
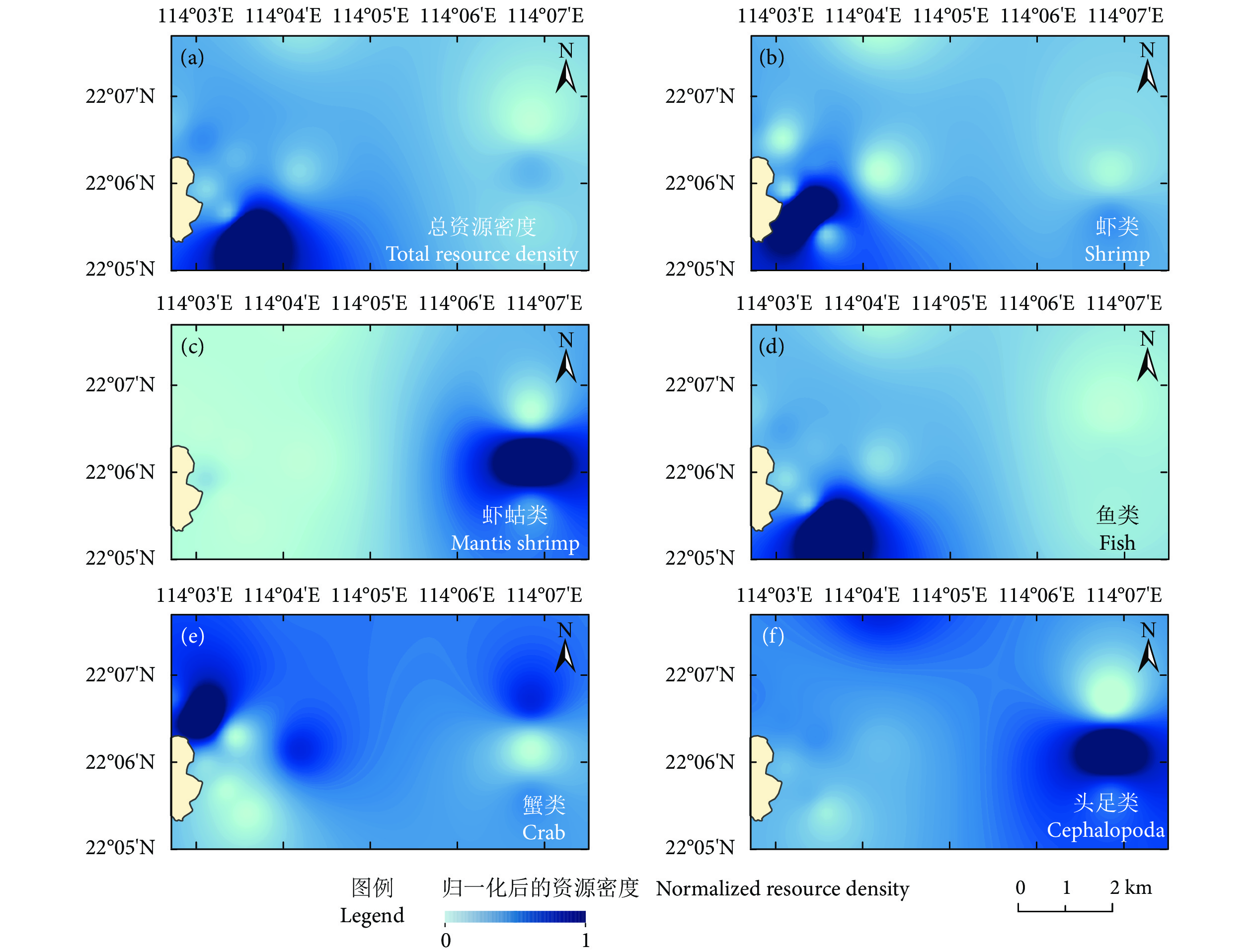
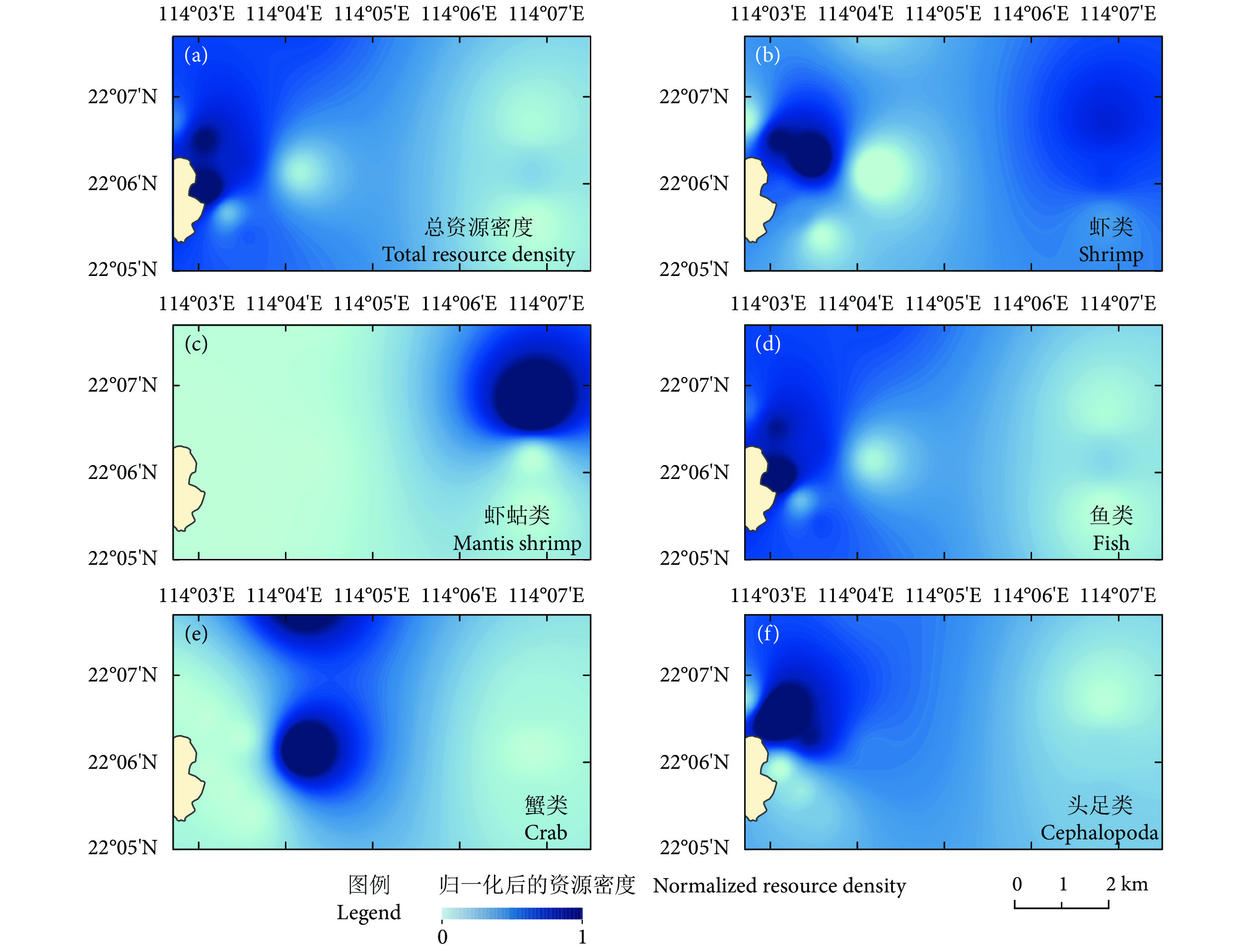
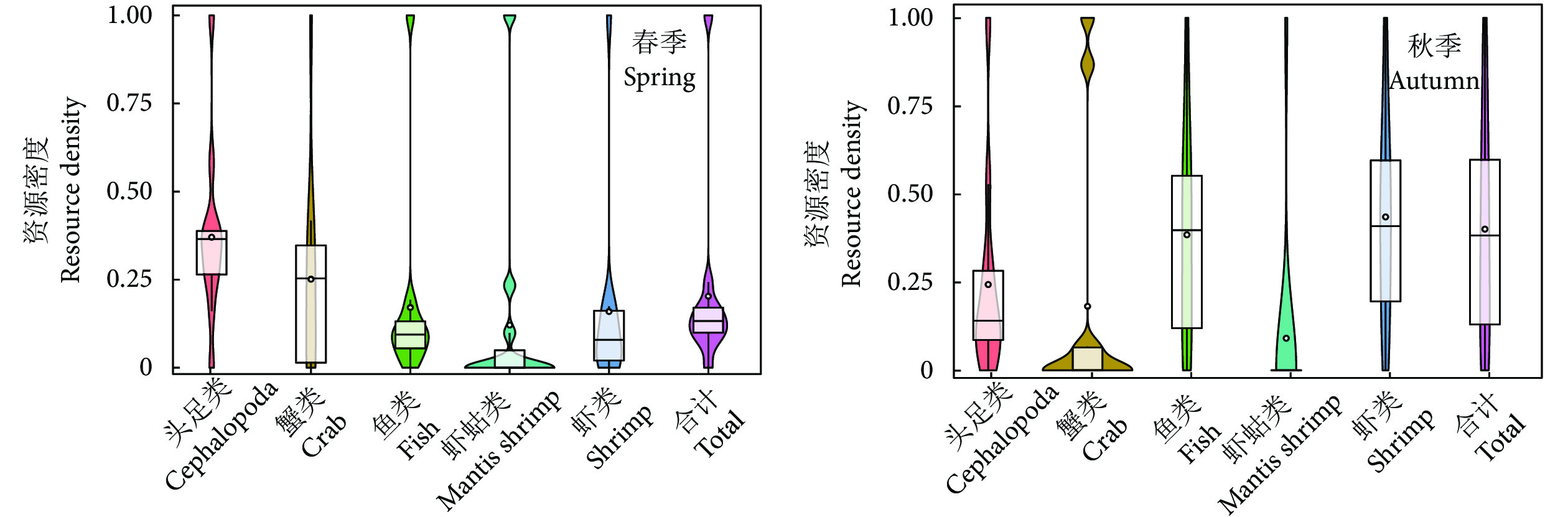
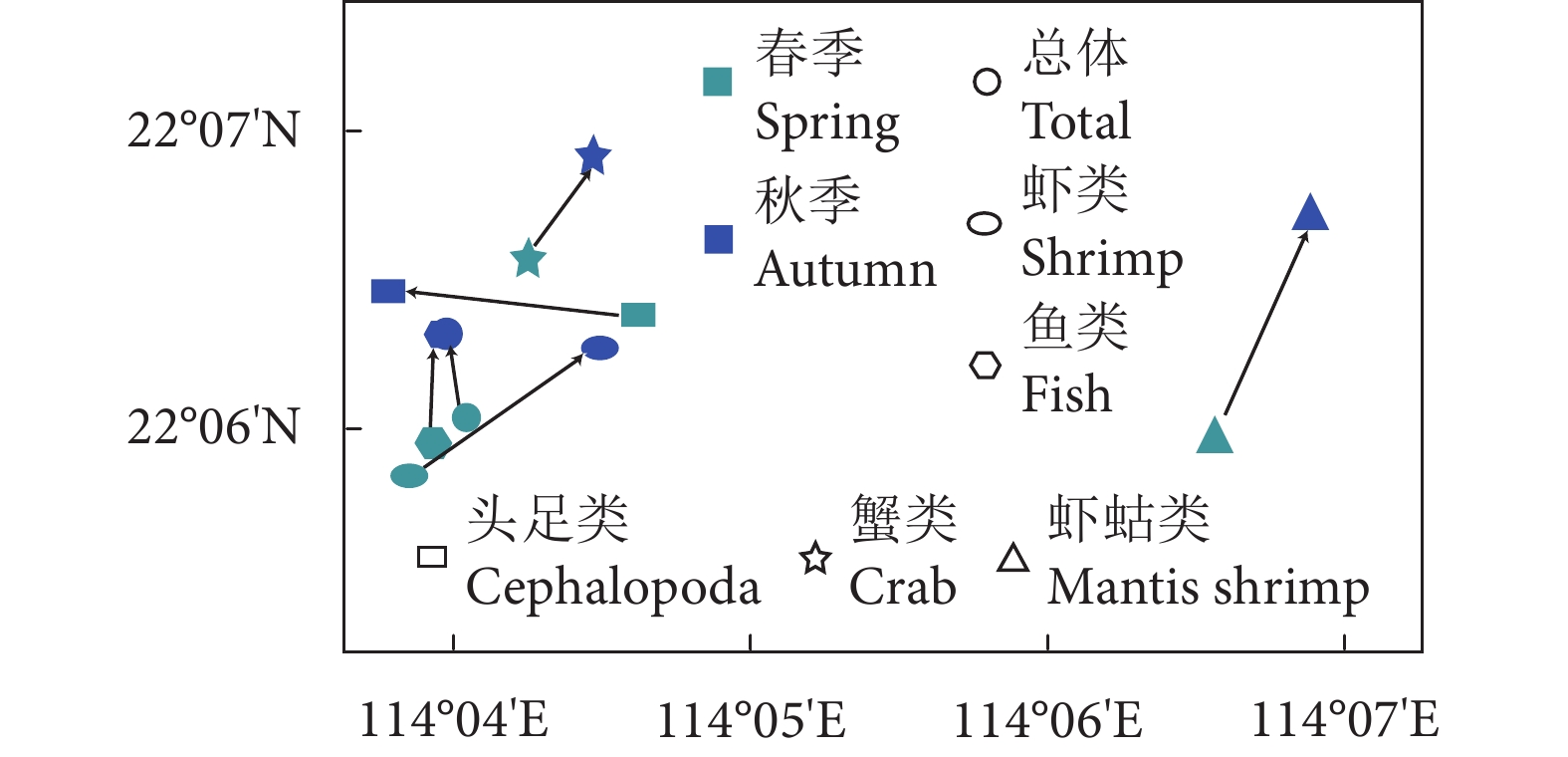
珠江口外伶仃海域是重要的传统渔场和渔业资源洄游通道,近年来在人类活动和气候变化的双重压力下生境发生了巨大变化。为深入了解渔业资源的季节变动规律,根据珠江口外伶仃海洋牧场附近海域2020和2021年的调查数据,采用空间分析方法,探究了不同渔获种类的季节动态变化和特征分布,并对渔场重心进行分析归纳。结果表明,总体资源密度春季高于秋季,呈斑点状分布,春季渔场重心分布集中于南部海域,秋季渔场重心向西北方向移动;鱼类资源密度分布与总资源密度相似,春季鱼类资源重心位于西南方向,秋季向西北方向移动;蟹类春季资源密度整体分布均匀,秋季资源密度有所提高,高密度海域有所增加,呈片状分布,资源重心由西部向东北方向移动;虾类春季资源密度低于秋季,资源重心向东北方向移动;虾蛄类整体资源密度较低,资源重心春季位于西部海域,秋季向东北方向移动;头足类春季资源密度高于秋季,均呈片状分布,资源重心从东向西移动。
Abstract:Wailingding waters of the Pearl River Estuary have always been an important traditional fishing ground and migration channel for fishery resources. In recent years, great changes have taken place in habitats under the dual pressure of human activities and climate change. In order to deeply understand the seasonal variation of fishery resources, based on the survey data of the marine ranching in Wailingding waters in 2020 and 2021, we applied the spatial analysis method to explore the seasonal dynamics and characteristics distribution of different catch species, and summarized the fishing ground center of gravity. The results show that the total resource density in spring was higher than that in autumn, distributing in a patchy pattern. In spring, the center of gravity of the fishing ground were concentrated in the southern waters, but moved northwestward in autumn. The density distribution of fish resources was similar to that of total resources. In spring, the center of gravity of fish resources was located in the southwest direction, but moved northwestward in autumn. The resource density of crabs in spring was relatively uniform and increased in autumn, and high-density sea areas increased, distributing in a flaky pattern, and the center of gravity of resources moved from west to northeast. The resource density of shrimps in spring was lower than that in autumn, and the center of gravity of resources moved northeastward. The resource density of mantis shrimps was low and the center of gravity of resources was located in the western sea area in spring, but moved northeastward in autumn. The resource density of cephalopoda in spring was higher than that in autumn, distributing in a flaky pattern, and the center of gravity of resources moved from east to west.
-
古菌(Archaea),亦称古细菌(Archaebacteria),是自然界生物三大类群之一[1]。古菌广泛存在于土壤、湖泊和海洋等全球各种生态系统中[2-5],在海洋生物圈中起着极其重要的作用,影响着海洋生态系统碳(C)、氮(N)、硫(S)和铁(Fe)等元素的循环[6-10]。由于古细菌对极端环境具有特殊的适应机制,之前普遍认为古菌主要分布于深海极端环境中,对其研究也主要集中在深海区域,虽然近年来在沿岸海域也发现有大量古菌存在[11],但国内外目前关于近岸海域古菌群落的研究依然相对较少[12]。
由于近岸海域更易受到沿岸径流和人类活动的影响,环境复杂多变,这一区域的古菌群落结构也更具复杂性和独特性[2, 9]。规模化浅海养殖活动改变了海水中悬浮颗粒物扩散和沉降,进而改变了海底沉积物的理化性质[13-14]。沉积物中古菌群落也很可能受到了影响,但是关于近岸养殖海域沉积物古菌群落的特征还未见报道。
古菌生物群落结构的研究是了解其生态功能的前提和基础。由于绝大多数古菌都很难分离和培养[15],传统微生物学实验手段不能用于古菌研究,因此目前大多采用新型的分子生物学技术手段进行古细菌生物群落的研究。高通量测序(high-throughput sequencing)技术是近年来建立的基于大分子rRNA及其基因结构的分子生物学技术,摆脱了依赖于微生物分离培养的实验方法,可一次性测定几十万到几百万条DNA序列,序列覆盖范围更广,能更全面反映古菌群落生物多样性特性,为深入研究古菌群落特征提供了极大可能[16]。
文章采用基于MiSeq平台的高通量测序技术,研究了典型的亚热带海湾——大亚湾大鹏澳养殖区沉积物中古菌的群落结构特征,并以非养殖区为对照作比较分析。文章初步探讨了大鹏澳海域沉积环境古菌群落结构,为揭示近海规模化养殖对生态系统的影响提供了基础数据。
1. 材料与方法
1.1 采样地点
大亚湾是典型的亚热带半封闭型海湾,大鹏澳位于大亚湾西南侧,面积约14 km2,平均水深约7 m。大鹏澳[17]是大亚湾内主要海水养殖区,近年来湾内主要开展葡萄牙牡蛎(Crassostrea angulata)筏式养殖和鱼类网箱养殖,网箱养殖的主要品种有鲷科鱼类、鲈、鲳和石斑鱼等。
1.2 样品采集
于2014年8月用柱状采泥器在大鹏澳葡萄牙牡蛎筏式养殖区(oyster farm,OF)、鱼类网箱养殖区(fish farm,FF)和非养殖区(non-aquaculture,NA)采集了直径8 cm,长40~45 cm的圆柱状沉积物样品。采样站位见图 1。每个区域采集2管柱状样,样品在冰盒中保存送至南海水产研究所深圳试验基地实验室,并用灭菌的钢尺切割为表层(0~5 cm)和深层(30~40 cm)。同一区域2个柱状样相同深度的样品充分混匀后装入已灭菌的离心管,于-80 ℃保存。
1.3 沉积物样品DNA提取与检测
称取牡蛎养殖区表层(oyster farm surface,OFS)和深层(oyster farm deep,OFD),网箱养殖区表层(fish farm surface,FFS)和深层(fish farm deep,FFD),以及非养殖区表层(non-aquaculture area surface,NAS)和深层(non-aquaculture area deep,NAD)沉积物样品各0.5 g,用Fast DNAⓇ SPIN Kit for Soil试剂盒(Mpbio,USA)提取样品总DNA。提取方法按照试剂盒说明书进行。DNA先用1%的琼脂糖凝胶电泳检测,检测合格后再通过16S rRNA全长PCR检测,所用引物为27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′- GGTTACCTTGTTACG- ACTT′-3′)。PCR反应体系包含1.5 μL 10×PCR缓冲液(不含Mg2+,TaKaRa),1.2 μL氯化镁(MgCl2)(25 mmol · L-1,TaKaRa),1.2 μL dNTPs(2.5 mmol · L-1,TaKaRa),0.6 μL上下游引物(10 μmol · L-1),0.3 μL胎牛血清蛋白(100 mg ·mL-1,Roche)和0.075 μL rTaq DNA聚合酶(5 U · μL-1),模版DNA 0.5 μL,最终用去离子水补充至15 μL。反应条件设置为95 ℃预变性3 min;30个循环,95 ℃变性40 s、55 ℃退火40 s、72 ℃延伸1 min;最终72 ℃延伸7 min。对扩增产物进行1%的琼脂糖凝胶电泳,用DL2000(TaKaRa,Japan)作为标准分子量标记,所得到的目的DNA片段大小约为1 500 bp,符合MiSeq高通量测序要求。
1.4 MiSeq平台高通量测序
选取16S rRNA的V4区序列进行高通量测序分析。PCR扩增引物为515F/806R,其中反向引物包含1条6 bp的条形码。PCR反应的30 μL体系包含15 μL PhusionⓇ高保真PCR混合剂(New England Biolabs),0.2 μmol · L-1的正反引物以及10 ng的模版DNA。PCR反应条件为98 ℃预变性1 min,30个循环,50 ℃退火30 s,72 ℃延伸60 s,72 ℃最终延伸5 min。PCR产物通过2%的琼脂糖凝胶电泳检测并用GeneJET凝胶回收试剂盒(Thermo Scientific)对PCR产物纯化和回收;用NEB NextⓇ UltraTM DNA Library Prep Kit for Illumina(NEB,USA)试剂盒构建克隆文库并在Illumina MiSeq平台(Illumina,California USA)测序。
1.5 数据分析
扩增序列处理,截去条形码和引物序列。通过Flash 1.2.7软件对序列进行拼接,用Qiime 1.7.0软件进行更加精确与严格的序列质量检测与筛选,最终得到有效序列。碱基测序精度用Q值表示,Q=-10 log10 (E),E值代表每个碱基的测序错误率。Q20和Q30的值分别表示碱基质量值为20(测序错误率小于1%)和30(测序错误率小于0.1%)的碱基所占百分比。MOTHUR软件进行OTU计算,相似性等于或大于97%的序列(3% cutoff)归为同一分类单元(operational taxonomic unit,OTU)。采用MEGA 6.06软件进行系统发育分析,系统进化树用邻位相连法(neighbor-joining,NJ)构建,Clustal X2进行多序列比对,Kimura 2-parameter模型进行估算,自举值(bootstrap)设为1 000重复。
2. 结果
2.1 MiSeq测序序列质量分析
不同样品的有效序列数、长度和有效性检测结果见表 1。各区域样品测序得到的有效序列数范围为21 355~70 010条,FFS和NAD样品分别具有最多和最少的有效序列。有效序列的长度在254 bp左右,与预期的片段大小相符合。Q20和Q30的值分别在98.5%和95.6%以上,说明测序数据精确可信。
表 1 样品的有效序列数、长度和有效性检测结果Table 1. Number, average length and effectiveness of valid sequences样品sample 有效序列数/条valid sequence/tag 长度/nt average length Q20/% Q30/% 牡蛎养殖区表层OFS 54 615 254 98.70 96.07 牡蛎养殖区深层OFD 49 091 255 98.56 95.72 网箱养殖区表层FFS 70 010 253 98.51 95.79 网箱养殖区深层FFD 69 089 255 98.52 95.66 非养殖区表层NAS 62 092 253 98.52 95.80 非养殖区深层NAD 21 355 254 98.70 96.12 2.2 大鹏澳沉积物古菌群落空间分布特征
大鹏澳不同区域沉积物中古菌OTU数量占总原核微生物的比例差异明显,范围为5.61%~49.10%,FFD和FFS分别具有最高和最低值(表 2)。古菌占总原核微生物的比例在空间分布上具有很大差异,OFS、OFD、FFS、FFD、NAS和NAD样品中古菌比例分别为12.42%、44.09%、5.61%、49.10%、6.19%和13.43%。养殖区深层样品的古菌比例明显高于非养殖区,OFD和FFD的古菌比例均高于对照区3倍以上;OFS古菌比例约为FFS的2倍,而2个养殖区深层样品中古菌比例差异不大。大鹏澳沉积物古菌在垂向分布上也存在明显异质性,均是深层样品的古菌占比例高于表层,而且表、深层之间的差异在养殖区最为显著,FFD沉积物中古菌比例约为FFS的9倍,而NAD古菌比例仅为NAS的2倍。这些结果表明大鹏澳沉积物古菌群落结构及分布存在明显的空间异质性。
表 2 大鹏澳沉积物中古菌占原核微生物的比例Table 2. Proportions of sediment archaea in prokaryotic microorganisms in Dapeng Cove样品sample OFS OFD FFS FFD NAS NAD 古菌占原核生物比例/% percentage 12.42 44.09 5.61 49.10 6.19 13.43 2.3 大鹏澳古菌群落生物多样性分析
养殖区沉积物古菌群落的多样性指数总体上低于非养殖区(表 3)。养殖区表层样品古菌多样性指数和均匀度指数高于深层样品,而Simpson优势集中性指数则低于深层样品。非养殖区表层和深层的多样性指数差异不大。古菌群落生物多样性在养殖区与非养殖区的表层没有太大差异,但在深层的差异相对较为明显。非养殖区表层和深层之间古菌群落均匀度指数的差异小于养殖区,说明古菌在表层和深层的分布相对均匀。养殖区深层沉积物的优势集中性指数高于表层,而非养殖区没有发现这种差异。
表 3 大鹏澳沉积物中古菌群落多样性指数Table 3. Diversity index of sediment archaea in Dapeng Cove样品sample Shannon多样性指数(H′) 物种均匀度指数(E′) Simpson优势集中性指数(C) 牡蛎养殖区表层OFS 4.71 0.78 0.02 牡蛎养殖区深层OFD 4.44 0.74 0.03 网箱养殖区表层FFS 4.76 0.79 0.02 网箱养殖区深层FFD 4.32 0.72 0.04 非养殖区表层NAS 4.70 0.78 0.02 非养殖区深层NAD 4.80 0.80 0.02 2.4 大鹏澳古菌群落生物序列分析与空间分布
序列比对结果显示大鹏澳沉积物中古菌共17纲,28目,37科,37属,OFS、OFD、FFS、FFD、NAS和NAD样品古菌分别有17、15、16、17、17和14纲。选取丰度最高的10个纲的古菌作图。大鹏澳海域沉积物古菌分属泉古菌(Crenarchaeota)和广古菌(Euryarchaeota)2个大类,泉古菌在古菌群落中占据绝对优势,平均序列数占总序列数的79.53%(35.39%~90.66%)。大鹏澳沉积物中泉古菌门古菌包含9个类群,各类群在6个样品中所占比例分别为MCG(Miscellaneous CrenarChaeotic Group, 24.13%~84.10%)、MBGB(Marine Benthic Group B, 2.22%~7.53%)、MHVG(0.46%~0.51%)、THSCG(0.09%~0.85%)、Thaumarchaeota(0~1.83%)、MBGA(0.09%~0.70%)、AAG(0~0.22%)以及2种未鉴定种类的古菌(1.17%~3.51%)(图 2)。不同区域样品中泉古菌分布存在差异,OFD和NAD样品中没有发现Thaumarchaeota,NAD中不含有MBGA。广古菌门古菌分属8个类群,分别为热原体纲(Thermoplasmata, 5.15% ~54.51%)、Parvarchaea(0.14% ~2.26%)、DSEG(0.44% ~1.65%)、Methanobacteria(0.48% ~1.66%)、Methanomicrobia(0~1.75%)、Micrarchaea(0~0.09%)和2类未鉴定种类的古菌(0.10% ~0.39%)。广古菌在不同区域样品的分布也存在差异,OFD样品没有发现Methanomicrobia,而只有很少量的Micrarchaea在OFS和NAS样品中存在,其余样品中均未发现。
大鹏澳沉积物中古菌群落的优势种属于广古菌门的Thermoplasmata,泉古菌门的MCG纲和MBGB纲,这3个纲古菌占总量的66.60% ~91.48%。表层和深层沉积物中古菌群落的优势种也存在差异,表层沉积物中古菌群落的优势种均属于广古菌门的热原体纲,其所占比例为50.79% ~59.34%,而深层沉积物中优势种均来自于泉古菌门的MCG纲,所占比例为57.89% ~90.66%。深层沉积物中优势种在群落中的优势度比表层更明显。
不同区域古菌群落优势种也存在差异,养殖区表层热原体纲古菌的相对丰度明显高于深层(OFS、OFD分别为54.27%、8.13%;FFS、FFD分别为52.65%、5.14%),但该古菌的相对丰度在NAS和NAD之间相差不大(分别为42.35%和36.54%)。值得注意的是,在NAS样品中一种未被鉴定的古菌数量比例(约为10%)超过了MBGB纲,成为第三优势菌,而其他样品中第三优势古菌均属MBGB纲。另外,一种广古菌门古菌(未鉴定到纲水平)只在养殖区沉积物深层中出现,而在非养殖区没有发现,反映了古菌分布的空间异质性。
2.5 系统发育分析
大鹏澳沉积物古菌系统发育树见图 3。系统发育树的分支可归为泉古菌门和广古菌门两大类,分别包含5和7个纲。泉古菌门的丰度高于广古菌门,但两者所含种类数相近。有一种古菌并未鉴定到门,但其与泉古菌门较为接近。表层沉积物的优势菌群——热原体纲的分支最多,都为E2目,鉴定出的古菌分属7个科。深层沉积物的优势菌落——MCG纲古菌的生物多样性也较高,占据了系统发育树的5个分支。同一纲中进化距离相近的种类,如Candidatus Nitrososphaera-SCA1170等氮循环相关氨氧化古菌,以及热原体纲的古菌都聚合到一起。系统发育树下方Parvarchaea纲分支与其他古菌距离相对较远,表明古菌进化具有多样性和特殊性的特征。
3. 讨论
古菌的进化与环境密切相关,其群落结构的演变是对环境变化做出的适应性反馈,因此其可以作为特定地质环境的标志物[18]。大鹏澳沉积物古菌主要为泉古菌门和广古菌门,这与在苏禄海[19]和西北大西洋[20]的研究结果相一致。KARNER等[21]报道太平洋海域的泉古菌为沉积物古菌群落的优势种,而大鹏澳沉积物古菌群落优势种属广古菌门热原体纲,说明古菌在近岸区域与深海海域的分布存在一定的差异。大鹏澳不同区域各类群古菌群落的相对丰度及比例间的差异,表明养殖活动可能对古菌群落结构造成了影响。养殖区古菌的多样性和物种分布均匀度均有所降低,而优势种的相对丰度和优势度更加明显,这与陈明明等[12]对象山港网箱养殖区古菌研究的结果相一致。大鹏澳古菌群落结构在不同区域和深度上的变化,一定程度上反映了沉积环境在小尺度上存在明显的空间异质性。
在西北大西洋等海域的研究报道中古菌数量约占沉积物原核生物总量的1% ~12%[11, 20, 22-23],大鹏澳非养殖区域沉积物中古菌比例约为9.8%,在此范围之内,而养殖区古菌比例约为44%,远远高于此比例。沉积物理化特征是决定古菌(尤其是相关功能古菌)数量的重要因素。有研究发现有机质的沉积速率和埋藏通量是影响厌氧微生物矿化作用的重要因素[24]。大鹏澳养殖区沉积物中古菌比例显著高于非养殖区,可能与养殖活动向海底输运沉积了更多的有机质相关[14]。但是,关于有机质等环境因子对古菌的影响也存在相互“冲突”的结果。例如,HOU等[25]研究东湖沉积物中氨氧化古细菌(ammonia-oxidizing archaea,AOA)群落分布时发现富营养化湖泊沉积物中AOA的数量与沉积物中有机物的含量成反比。WESSÉ等[26]也发现加富的土壤中AOA的数量与土壤有机质含量存在负相关关系。但另一方面,HERRMANN等[27]发现在贫营养和中营养海域,AOA数量与有机碳的含量呈正相关。这些相互“冲突”的结果说明古菌数量与环境的营养水平存在复杂的关系,在不同的环境条件下,对有机质输入会产生不同的响应。
沉积物中古菌的数量也可能受到氧气含量的影响。古菌代谢的多样性与嗜极生理使其能够在低氧等极端环境中生存[28]。沉积物中的氧气含量相对较低,并且随着深度加深而急剧下降。养殖活动会导致养殖区底层沉积物有机质增加[29-30]。富含有机质的沉积物由于有机质的氧化作用,其氧气含量会更低,很多细菌都难以适应和生存,从而使古菌的数量增加。大鹏澳深层沉积物中的古菌数量约是表层的9倍,也证明了这一点。与该研究结果相一致,有研究显示在海底沉积物深度超过1 m时,古菌成为微生物群落的优势种[20, 31],湖泊和湿地沉积物中古菌垂直分布也呈现相似特征[32-34]。对北极海洋沉积物古菌的研究也发现在越深越厌氧的沉积物中古菌丰度越高[22]。另外,氧气是有机物矿化反应的最终电子受体,直接影响有机质矿化反应和N、磷(P)等元素的含量及其比例,从而改变与这些元素循环代谢相关的微生物,如与氮循环相关的硝化菌和反硝化菌的种类和数量[32, 35],LIU等[33]也报道AOA的生物多样性与沉积物中可利用磷的浓度呈正相关。这些发现说明沉积环境理化因子对古菌群落存在着复杂的影响。
热原体纲在系统发育树上的分支最多并都有很好的聚类,反映出相近的进化关系,但也有少数同一科的古菌并未聚类在一起,这与古菌特殊的生理机制和遗传特征有关,也可能受到研究方法的影响。基于PCR片段扩增的种属鉴别方法,根本上都是基于16S rRNA引物特异性的。目前大部分引物序列是在很多生境下的古菌没有发现之前所建立,或者尚没有考虑这部分古菌的序列。PCR扩增引物中不能匹配的序列会导致相应古菌谱系被遗漏或者无法鉴别[36],这些也可能是有些古菌未能鉴定种属的原因。
-
[1] 黄洪亮, 冯超, 李灵智, 等. 当代海洋捕捞的发展现状和展望[J]. 中国水产科学, 2022, 29(6): 938-949. [2] LI J J, LI J, GONG P H, et al. Effects of the artificial reef and flow field environment on the habitat selection behavior of Sebastes schlegelii juveniles[J]. Appl Anim Behav Sci, 2021, 245: 105492. doi: 10.1016/j.applanim.2021.105492
[3] 陈丕茂, 舒黎明, 袁华荣, 等. 国内外海洋牧场发展历程与定义分类概述[J]. 水产学报, 2019, 43(9): 1851-1869. [4] 谢笑艳, 陈丕茂, 佟飞, 等. 珠海外伶仃岛海域海洋牧场选址探讨[J]. 南方水产科学, 2022, 18(5): 18-29. [5] 冯永玖, 方学燕, 陈新军, 等. 基于GIS的西北太平洋柔鱼资源空间插值及不确定性分析[J]. 资源科学, 2015, 37(11): 2299-2308. [6] 范江涛, 张俊, 冯雪, 等. 基于地统计学的南沙海域鸢乌贼渔场分析[J]. 生态学杂志, 2017, 36(2): 442-446. doi: 10.13292/j.1000-4890.201702.004 [7] 唐政, 单秀娟, 关丽莎, 等. 基于不同空间插值法的黄海和东海北部游泳动物多样性空间分布研究[J]. 渔业科学进展, 2020, 41(6): 1-11. doi: 10.19663/j.issn2095-9869.20190715001 [8] 史文娇, 岳天祥, 石晓丽, 等. 土壤连续属性空间插值方法及其精度的研究进展[J]. 自然资源学报, 2012, 27(1): 163-175. doi: 10.11849/zrzyxb.2012.01.017 [9] 彭彬, 周艳莲, 高苹, 等. 气温插值中不同空间插值方法的适用性分析: 以江苏省为例[J]. 地球信息科学学报, 2011, 13(4): 539-548. [10] 石朋, 芮孝芳. 降雨空间插值方法的比较与改进[J]. 河海大学学报 (自然科学版), 2005(4): 361-365. [11] 贾悦, 崔宁博, 魏新平, 等. 基于反距离权重法的长江流域参考作物蒸散量算法适用性评价[J]. 农业工程学报, 2016, 32(6): 130-138. doi: 10.11975/j.issn.1002-6819.2016.06.018 [12] 朱求安, 张万昌, 余钧辉. 基于GIS的空间插值方法研究[J]. 江西师范大学学报 (自然科学版), 2004, 28(2): 183-188. [13] 陈吕凤, 朱国平. 基于地理加权模型的南设得兰群岛北部南极磷虾渔场空间分布影响分析[J]. 应用生态学报, 2018, 29(3): 938-944. doi: 10.13287/j.1001-9332.201803.037 [14] 冯雪, 范江涛, 孙晓, 等. 珠海外伶仃人工鱼礁对鱼类资源养护效果初步评估[J]. 南方农业学报, 2021, 52(12): 3228-3236. doi: 10.3969/j.issn.2095-1191.2021.12.005 [15] 黄梓荣. 南海北部陆架区头足类的种类组成和资源密度分布[J]. 南方水产, 2008, 4(5): 1-7. [16] 郑兰香, 杨程, 黄凌霄, 等. 基于反距离权重插值法的抽水型水库水质空间分布分析[J]. 宁夏工程技术, 2018, 17(3): 270-273. doi: 10.3969/j.issn.1671-7244.2018.03.019 [17] 汤国安, 杨昕. ArcGIS地理信息系统空间分析实验教程[M]. 北京: 科学出版社, 2012: 442-443. [18] 汪金涛, 陈新军. 中西太平洋鲣鱼渔场的重心变化及其预测模型建立[J]. 中国海洋大学学报 (自然科学版), 2013, 43(8): 44-48. [19] 李建生, 程家骅. 长江口水域主要渔业生物资源状况的分析[J]. 南方水产, 2005, 1(2): 21-25. [20] CAI W J, DAI M H, WANG Y C, et al. The biogeochemistry of inorganic carbon and nutrients in the Pearl River estuary and the adjacent Northern South China Sea[J]. Cont Shelf Res, 2004, 24(12): 1301-1319. doi: 10.1016/j.csr.2004.04.005
[21] TAO W, NIU L X, LIU F, et al. Influence of river-tide dynamics on phytoplankton variability and their ecological implications in two Chinese tropical estuaries[J]. Ecol Indic, 2020, 115: 106458. doi: 10.1016/j.ecolind.2020.106458
[22] HUANG L M, JIAN W J, SONG X Y, et al. Species diversity and distribution for phytoplankton of the Pearl River estuary during rainy and dry seasons[J]. Mar Pollut Bull, 2004, 49(7/8): 588-596.
[23] LU Y F, DING Z B, LI W, et al. The effect of seawater environmental factors on the corals of Wailingding Island in the Pearl River Estuary[J]. Cont Shelf Res, 2020, 197: 104087. doi: 10.1016/j.csr.2020.104087
[24] 韩旭东, 章守宇, 汪振华, 等. 马鞍列岛及其东部海域鱼类群落格局与环境因子之间的关系[J]. 水产学报, 2019, 43(6): 1483-1497. [25] SMITH J A, CORNWELL W K, LOWRY M B, et al. Modelling the distribution of fish around an artificial reef[J]. Mar Freshw Res, 2017, 68(10): 1955-1964. doi: 10.1071/MF16019
[26] KIM D H, WOO J H, YOON H S, et al. Efficiency, tranquility and stability indices to evaluate performance in the artificial reef wake region[J]. Ocean Eng, 2016, 122: 253-261. doi: 10.1016/j.oceaneng.2016.06.030
[27] 李圣法, 程家骅, 严利平. 东海大陆架鱼类群落的空间结构[J]. 生态学报, 2007, 27(11): 4377-4386. doi: 10.3321/j.issn:1000-0933.2007.11.001 [28] 李永振, 陈国宝, 孙典荣. 珠江口鱼类组成分析[J]. 水产学报, 2000, 24(4): 312-317. [29] 胥延钊. 渤海渔业生物群落结构特征研究[D]. 上海: 上海海洋大学, 2021: 21-25. [30] 王新元, 李建龙, 章翔, 等. 三亚蜈支洲岛热带海洋牧场渔业资源现状及季节变动[J]. 海洋与湖沼, 2021, 52(6): 1557-1566. doi: 10.11693/hyhz20210500124 [31] 唐广隆. 万山群岛海域渔业资源群落特征及黄鳍棘鲷食性特征[D]. 舟山: 浙江海洋大学, 2022: 44-47. [32] 吴强, 王俊, 李忠义, 等. 黄渤海春季甲壳类群落结构的空间变化[J]. 水产学报, 2012, 36(11): 1685-1693. [33] THAYER J A, BERTRAM D F, HATCH S A, et al. Forage fish of the Pacific rim as revealed by diet of a piscivorous seabird: synchrony and relationships with sea surface temperature[J]. Can J Fish Aquat Sci, 2008, 65(8): 1610-1622. doi: 10.1139/F08-076
[34] 李斌, 陈国宝, 郭禹, 等. 南海中部海域渔业资源时空分布和资源量的水声学评估[J]. 南方水产科学, 2016, 12(4): 28-37. doi: 10.3969/j.issn.2095-0780.2016.04.004 [35] 范江涛, 张俊, 冯雪, 等. 南沙海域鸢乌贼渔场与海洋环境因子的关系[J]. 上海海洋大学学报, 2019, 28(3): 419-426. [36] 方星楠, 余为, 陈新军. 东太平洋赤道海域茎柔鱼渔场的时空分布[J]. 水产科学, 2022, 41(3): 475-483. -
期刊类型引用(4)
1. 赖胜,杨慧林,陈美玲,龙馨怡,刘淑丽,简敏菲. 鄱阳湖南矶湿地苔草植被根际土壤微生物群落结构分析. 江西师范大学学报(自然科学版). 2023(01): 82-90 .  百度学术
百度学术
2. 冯敬宾,任春华,江晓,严岩,董俊德,胡超群. 大亚湾夏季表层浮游细菌生物量分布与环境变量的关系. 海洋湖沼通报. 2019(02): 81-89 .  百度学术
百度学术
3. 关统伟,向慧平,王鹏昊,邓奥宇,董丹,赵顺先,张习超. 基于高通量测序的郫县豆瓣不同发酵期细菌群落结构及其动态演替. 食品科学. 2018(04): 106-111 .  百度学术
百度学术
4. 宋宇. 草莓不同生长时期土壤微生物群落结构变化. 贵州农业科学. 2018(08): 59-62 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载:


 粤公网安备 44010502001741号
粤公网安备 44010502001741号
