Study on relationship between body mass and blood indexes of juvenile Thunnus albacares
-
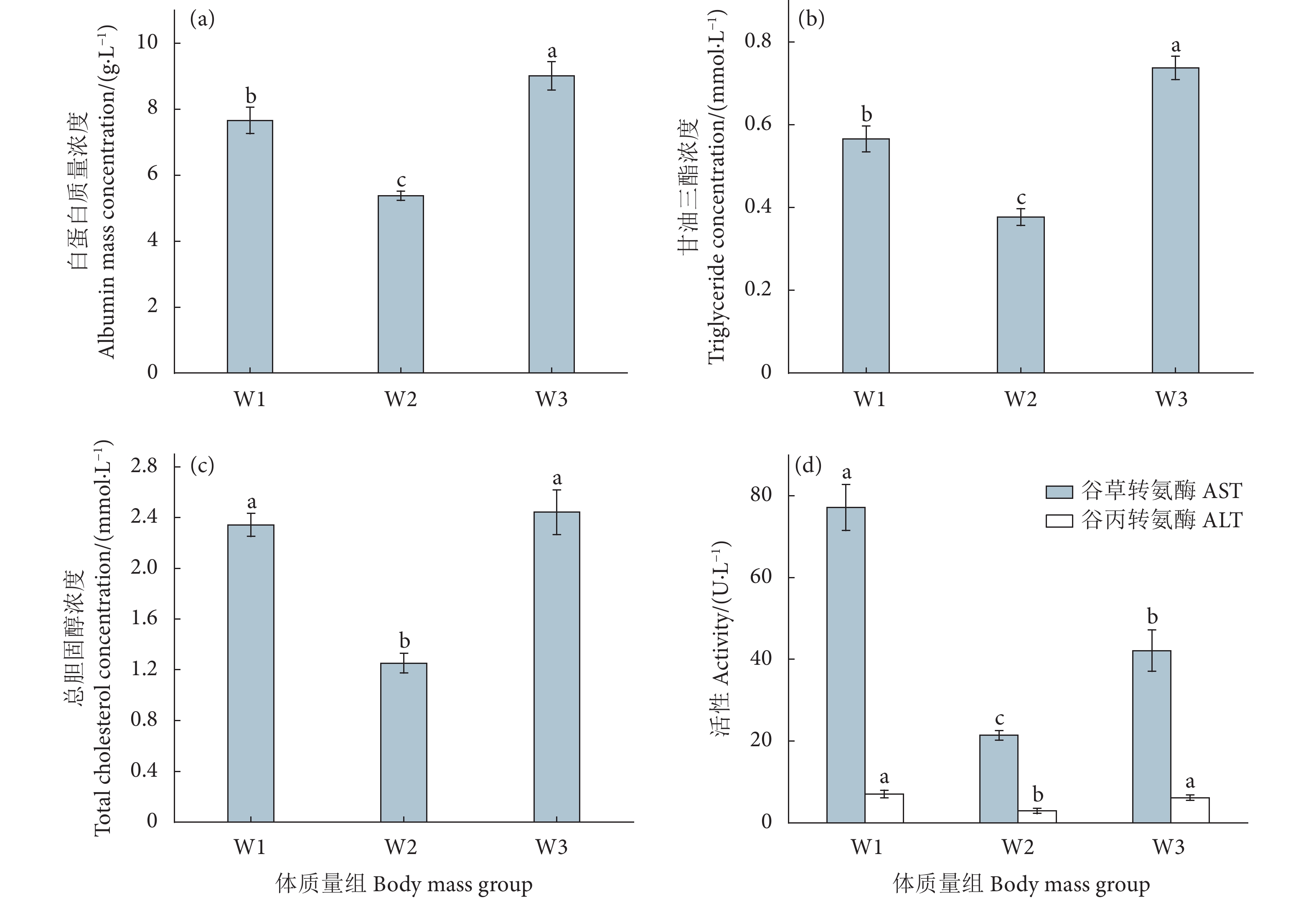
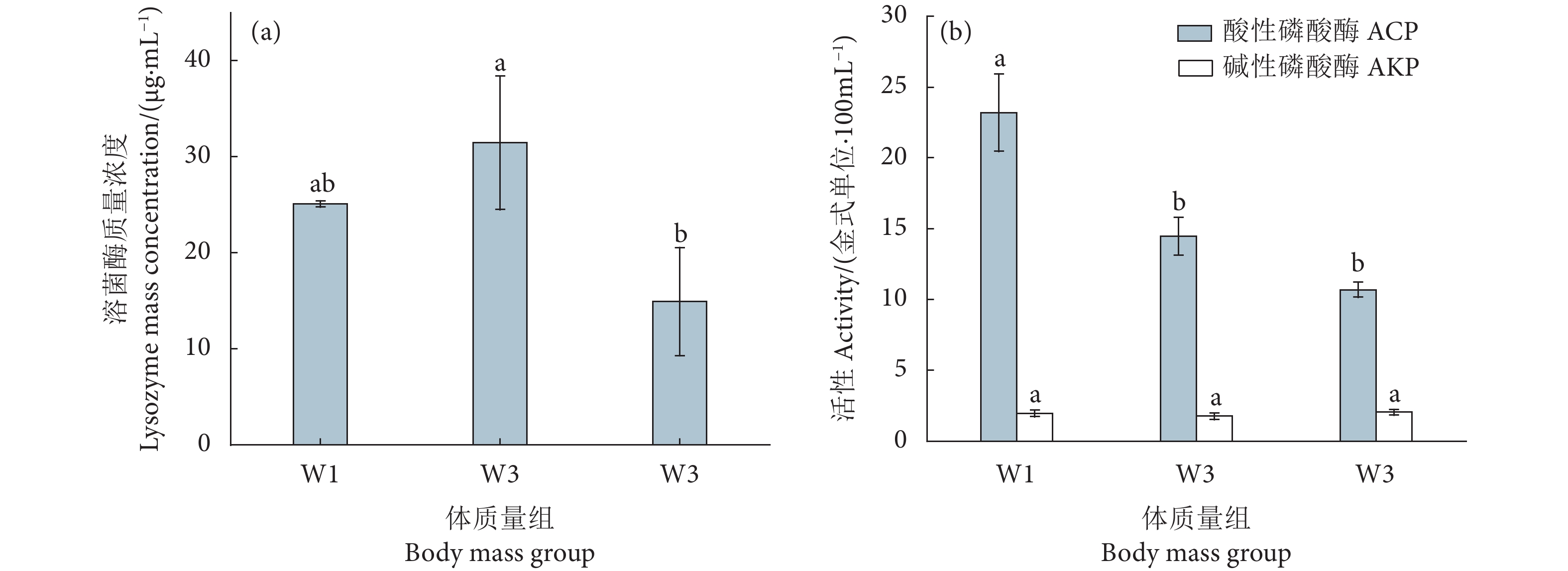
摘要: 为给黄鳍金枪鱼 (Thunnus albacares) 人工养殖提供科学依据,探究了人工养殖黄鳍金枪鱼幼鱼血液基础指标数据及生化指标与体质量的关系,测定了不同体质量的黄鳍金枪鱼幼鱼 (W1: 400~900 g; W2: 900~1 400 g; W3: 1 400~1 900 g) 血清中的白蛋白、甘油三酯、总胆固醇、溶菌酶的浓度和转氨酶、磷酸酶的活性。结果显示,白蛋白、甘油三酯和谷草转氨酶 (AST) 组间差异显著 (P<0.05)。W2组的谷丙转氨酶 (ALT) 活性和总胆固醇浓度显著低于其余两组 (P<0.05)。白蛋白、甘油三酯和总胆固醇浓度大小依次为W3>W1>W2。碱性磷酸酶活性组间差异不显著 (P>0.05)。W1组酸性磷酸酶活性显著高于其余两组 (P<0.05),W1组溶菌酶浓度与其余两组差异不显著 (P>0.05)。结果表明,黄鳍金枪鱼幼鱼在3个体质量组中血液指标存在差异,W2组与其他两组差异较大,W1和W3组差异较小。Abstract: In order to study the basic blood indexes of artificially bred yellowfin tuna (Thunnus albacares), we determined the concentrations or activities of albumin, triglyceride, total cholesterol, transaminase, lysozyme and phosphatase in its serum (W1: 400−900 g; W2: 900−1 400 g; W3: 1 400−1 900 g) with different body mass. The results show that there were significant differences among the albumin, triglyceride and aspertate aminotransferase groups (P<0.05). The glutamic pyruvic transaminase activity and total cholesterol concentration in W2 group were significantly lower than those in the other two groups (P<0.05). The decending order of the concentrations of albumin, triglyceride and total cholesterol was W3>W1>W2. There was no significant difference in the alkaline phosphatase activity among the groups (P>0.05). The acid phosphatase activity in W1 group was significantly higher than that in the other two groups (P<0.05), and the lysozyme concentration in W1 group was not significantly different from that in the other two groups (P>0.05). The results reveal that there were differences in the blood indexes among the three groups of different mass; the difference between W2 group and the other two groups was greater, and the difference between W1 group and W3 group was smaller.
-
Keywords:
- Thunnus albacares /
- Body mass /
- Serum /
- Aspertate aminotransferase
-
粒径谱 (Size spectrum) 是以能量生态学为基础,把各类复杂的水域生态系统、食物循环、种群变动和影响机制等简化为谱图的一种方法[1]。它不依赖于传统的生物学分类知识[2],具有数据需求少、易操作和结果直观等特点,避免了生物特性鉴定不准确或调查资源有限引起的误差,在总体上、宏观地研究不同生态系统和群落动态及其变化机制和控制因素[1],可以用来比较不同历史时期和环境条件下生态系统的特点和差异[3],从某一粒级估计其他粒级的生物量或产量[1-2],评估捕捞[4]或环境对生态系统的压力[5-6],为研究水生生态学提供了新思路。1988年王荣等[7]首次把粒径谱的概念引入国内,如今我国粒径谱研究的发展及应用越来越广泛,涉及海湾[8]、湿地[9]和河口[10]等生境,在浮游生物[8,10]、底栖生物[9]中已有一定的应用和研究成果,而粒径谱应用于鱼类群落研究[11]近年才开始起步。
浙江省南部近海位于暖温带海区的温州和台州近海,有多条江河入海,受到浙江沿岸水、台湾暖流和黑潮次表层水等水团影响,悬浮物和营养物充足,饵料生物丰富[12],为多种鱼类提供了必要的栖息、索饵和繁衍场所。近年来,由于过度捕捞、环境污染等问题,近海水域的渔业资源严重衰退,渔业群落结构发生较大变动[13]。目前,国内已有学者对浙江省南部近海鱼类群落进行了物种生态优势度[14]、多样性[15]、生态位[16]等方面的研究,但受到气候变化和捕捞压力的持续影响,该海域鱼类群落结构发生着动态变化,需要进一步掌握其群落特征。本文根据2019年浙江南部近海4个季节的渔业资源调查数据,从时间和空间上进行鱼类群落粒径谱分析,探究该海域鱼类群落粒径谱特征,为鱼类资源保护与生态可持续发展提供参考。
1. 材料与方法
1.1 采样与测定
研究区域为浙江南部近岸海域 (120.93°E—122.95°E, 27.21°N—28.97°N),采样时间为2019年2月26日—3月2日 (冬季)、5月23—27日 (春季)、8月1—7日 (夏季) 和11月1—4日 (秋季),共4个航次的渔业资源和环境调查 (图1)。
调查船“浙洞渔10109”,主机马力540 HP,总吨位305 t,取样网具为网口宽40 m、网高7.5 m、网囊网目2 cm的底拖网。其中冬、夏季各27个站位,春季26个站位,秋季24个站位 (图1)。调查时每站位拖曳1次,平均拖速3 kn,每次作业时间1 h。同时,使用温盐深测量仪 (Conductivity temperature depth, CTD) 于每个站位测定盐度、温度、深度和pH等环境数据 (表1)。现场采样中样品的采集、保存和测定等均按照《海洋监测规范 (GB 17378)》和《海洋调查规范 (GB/T 12763)》执行。
表 1 浙江南部近海环境指标统计值Table 1 Statistical values of environmental indicators in offshore waters of southern Zhejiang Province季节
Season环境因子
Environmental factor最小值
Minimum value最大值
Maximum value平均值±标准差
$\overline { X}\pm { \rm {SD}} $春季 Spring 水深 Water depth/m 20.00 66.50 47.66±14.32 水温 Temperature/℃ 21.20 24.50 22.46±0.79 盐度 Salinity 26.30 33.10 28.77±1.74 pH 8.23 8.71 8.44±0.14 夏季 Summer 水深 Water depth/m 19.90 65.20 48.50±14.18 水温 Temperature/℃ 28.00 30.20 28.94±0.45 盐度 Salinity 31.70 34.00 33.36±0.71 pH 8.09 8.32 8.17±0.06 秋季 Autumn 水深 Water depth/m 16.70 63.70 51.21±12.25 水温 Temperature/℃ 21.60 23.90 22.96±0.58 盐度 Salinity 28.40 33.20 31.64±1.40 pH 8.15 8.27 8.22±0.04 冬季 Winter 水深 Water depth/m 21.50 66.00 48.26±13.63 水温 Temperature/℃ 10.40 15.80 13.21±1.80 盐度 Salinity 28.80 34.30 32.24±1.60 pH 8.18 8.34 8.26±0.04 1.2 研究方法
1.2.1 Sheldon鱼类粒径谱
鱼类个体生物量 (g) 经过log2转换后划分粒级,以最小生物量为起点,每一个粒级的上限值是下限值的2倍[17],即粒径间距以公比2成等比形式增长,作为横轴;单位面积 (km2)上对应粒级的生物量经过log2转换后作为纵轴,以此构建鱼类Sheldon粒径谱。谱上的散点用曲线连接后形成的峰型可以反映鱼类群落的结构特征[18-19]。
1.2.2 标准化鱼类粒径谱
鱼类标准化粒径谱的横轴是粒径级上限值经过log2转换后划分粒级作为横轴;每个单位面积上的鱼类总生物量与该粒级上鱼类个体生物量的变化幅度的比值,经log2对数化后作为纵轴,并对谱线进行相关性和回归分析,实质上代表了鱼类群落的粒级丰度[18-20]。
$$ \mathrm{\beta }\left({w}_{i}\right)={\rm{log}}_{2}\left[\frac{{B}\left({{w}}_{i}\right)}{\Delta {{w}}_{i}}\right] $$ (1) 式中:
$ \beta \left({w}_{i}\right) $ 为第$ i $ 粒级所对应的纵坐标;$ B\left({w}_{i}\right) $ 为单位面积上第$ i $ 粒级的总生物量;$ \Delta {w}_{i} $ 为第$ i $ 粒级上个体生物量的变化幅度。在理想的稳定状态下,标准化粒径谱为线性,且斜率为−1[2]。当鱼类群落受外界干扰打破平衡时,标准化粒径谱为抛物线型[11,21],曲线随捕捞强度增大而更加陡峭[18],且曲率或斜率大小受到当年生幼鱼和鱼类粒径大小[22]、人类捕捞活动强度[4]、栖息地环境[18]等因素影响。
1.2.3 多维尺度法
为了揭示不同站点鱼类群落的相似度结构,筛选出同时在3个或以上站点出现且丰度占1个站位1%以上的物种用于分析[23],以平衡稀有种、偶见种对整个鱼类群落的影响,再用该数据计算Bray-Curtis相似矩阵,在该矩阵的基础上,用多维尺度法 (Multidimensional Scaling, MDS) 对浙江省南部近岸海域的鱼类群落空间特征进行分析。使用胁强系数 (Stress) 检验MDS结果,一般情况下Stress<0.2时,可用MDS的二维散点图来表示,其图形有一定意义[24]。为判断分组的统计学意义,用相似性分析 (Analysis of similarities, ANOSIM) 检验组间的差异显著性,Global R>0为有效分组,表示组间差异大于组内差异。
1.3 数据处理与分析
鱼类生物学原始数据进行拖网时间 (1 h) 和拖网速度 (3 kn) 标准化,在R 4.0.2中完成鱼类粒径谱建立、显著性检验以及环境因子与标准化粒径谱曲率的相关性分析,鱼类群落分组用Primer 6.15进行MDS分析,采用Primer 6.15的ANOSIM和SPSS 19.0的单因素方差分析 (One-way ANOVA) 检验粒径谱特征差异和各分组间差异的显著性。
2. 结果
2.1 全年鱼类粒径谱
全年Sheldon鱼类粒径谱形状呈不规则的锯齿状 (图2-a),大体为单峰模式,粒级介于−2~11 (表2)。在−2~6粒级单位面积的生物量呈上升趋势,6~7粒级生物量增加趋势放缓,在7~9粒级呈下降趋势,9~11粒级缓慢增加。生物量最高值出现在6~7粒级,主要由带鱼 (Trichiurus lepturus)、刺鲳 (Psenopsis anomala)、镰鲳 (Pampus echinogaster) 等组成 (表2)。其中带鱼的生物量和数量占整个粒级上生物量和数量百分比的36.04%和36.57%,平均个体生物量为69 g;刺鲳的生物量和数量占比分别为12.02%和11.33%,平均个体生物量为75 g;镰鲳的生物量和数量占比分别为10.49%和9.70%,平均个体生物量为76 g。
表 2 浙江南部近海鱼类群落组成及营养级状况Table 2 Composition of fish community and trophic level in offshore waters of southern Zhejiang Province粒径
Size range粒径级上限值
Upper limit of
size class/g总生物量
Total biomass/
(g·km−2)主要鱼类物种
Main fish species营养级
Trophic level
$\overline X \pm {\rm{SD}}$−3~−2 −2 1 麦氏犀鳕 Bregmaceros mcclellandi 3.30±0.42* −2~−1 −1 2 麦氏犀鳕 B. mcclellandi 3.30±0.42* 粗吻海龙 Trachyrhamphus serratus — −1~0 0 9 麦氏犀鳕 B. mcclellandi 3.30±0.42* 六丝钝尾虾虎鱼 Amblychaeturichthys hexanema 3.65±0.05[25] 舒氏冠海龙 Corythoichthys schultzi 3.80±0.50* 0~1 1 40 麦氏犀鳕 B. mcclellandi 3.30±0.42* 六丝钝尾虾虎鱼 A. hexanema 3.65±0.05[25] 细条天竺鲷 Jaydia lineata 3.70±0.50* 赤鼻棱鳀 Thryssa kammalensis 3.91±0.31[25] 鳄齿鱼 Champsodon capensis 4.20±0.73* 1~2 2 163 六丝钝尾虾虎鱼 A. hexanema 3.65±0.05[25] 细条天竺鲷 J. lineata 3.70±0.50* 麦氏犀鳕 B. mcclellandi 3.30±0.42* 拉氏狼牙虾虎鱼 Odontamblyopus lacepedii — 2~3 3 613 拉氏狼牙虾虎鱼 O. lacepedii — 龙头鱼 Harpadon nehereus 3.62±0.20[25] 发光鲷 Acropoma japonicum − 细条天竺鲷 J. lineata 3.70±0.50* 大头白姑鱼 Pennahia macrocephalus 4.10 ±0.64* 蓝圆鲹 Decapterus maruadsi 3.63±0.06[25] 带鱼 T. lepturus 3.76±0.13[25] 赤鼻棱鳀 Thryssa kammalensis 3.91±0.31[25] 3~4 4 2 778 赤鼻棱鳀 T. kammalensis 3.91±0.31[25] 大头白姑鱼 P. macrocephalus 4.10 ±0.64* 白姑鱼 Pennahia argentata 4.10 ±0.70* 发光鲷 A. japonicum — 龙头鱼 H. nehereus 3.62±0.20[25] 4~5 5 8 507 黄鲫 Setipinna tenuifilis 3.74±0.15[25] 黑姑鱼 Atrobucca nibe 4.00±0.69* 大头白姑鱼 P. macrocephalus 4.10 ±0.64* 龙头鱼 H. nehereus 3.62±0.20[25] 5~6 6 17 971 小黄鱼 Larimichthys polyactis 3.70±0.40* 龙头鱼 H. nehereus 3.62±0.20[25] 带鱼 T. lepturus 3.76±0.13[25] 刺鲳 P. anomala 4.00±0.28* 6~7 7 19 326 带鱼 T. lepturus 3.76±0.13[25] 刺鲳 P. anomala 4.00±0.28* 镰鲳 P. echinogaster 3.50±0.20* 7~8 8 10 651 带鱼 T. lepturus 3.76±0.13[25] 镰鲳 P. echinogaster 3.50±0.20* 刺鲳 P. anomala 4.00±0.28* 8~9 9 4 018 镰鲳 P. echinogaster 3.50±0.20* 蓝圆鲹 D. maruadsi 3.63±0.06[25] 绿鳍鱼 Chelidonichthys kumu 3.70±0.57* 黄鳍东方鲀 Takifugu xanthopterus — 9~10 10 5 234 黄鮟 Lophius litulon 4.17±0.09[25] 中国花鲈 Lateolabrax maculatus — 10~11 11 5 867 黄鮟 L. litulon 4.17±0.09[25] 注:*. 数据来源于FishBase (www.fishbase.org);—. 无数据。
Note: *. Data from FishBase (www.fishbase.org); —. No data.全年标准化鱼类粒径谱 (图2-b) 的拟合曲线呈“穹顶”抛物线状,回归系数R2为0.88 (P<0.01),曲线穹顶位于3~7粒级,曲率为−0.15,表明浙江南部近海鱼类群落总体处于受干扰状态。
2.2 鱼类粒径谱的季节差异
2.2.1 Sheldon鱼类粒径谱
浙江南部近海4个季节Sheldon型鱼类生物量粒径谱形状基本呈单峰模式,季节差异不显著 (P=0.93,图3)。4个季节鱼类粒级介于−2~11,其中冬季粒级介于−1~11,春季为0~10,夏季为−2~10,秋季为0~9;鱼类总生物量以夏季 (8月) 最大,春季 (5月) 最小。冬季,Sheldon峰值位于10~11粒级,主要由黄鮟 (Lophius litulon)组成,其渔获重量百分比和数量百分比分别占该粒级的68.95%和66.67%,生物量最高值位于5~6粒级,主要由小黄鱼 (Larimichthys polyactis)、黄鲫 (Setipinna tenuifilis)构成,小黄鱼的渔获重量百分比和数量百分比分别为34.51%和28.34%,黄鲫的相应占比分别为18.93%和22.81%。春季,鱼类生物量最高值位于5~6粒级,主要由带鱼、龙头鱼 (Harpadon nehereus)构成,其中带鱼的渔获质量百分比和数量百分比分别为38.18%和35.55%,龙头鱼的相应占比分别为18.57%和20.09%;夏季,鱼类生物量最高值位于6~7粒级,主要由带鱼和日本鲭 (Scomber japonicus) 组成,其中带鱼的渔获质量百分比和数量百分比分别为50.60%和49.73%,日本鲭的相应占比分别为15.55%和14.32%;秋季,鱼类生物量最高值位于6~7粒级,主要由刺鲳、镰鲳等组成,其中刺鲳的渔获质量百分比和数量百分比分别为28.27%和24.23%,镰鲳的相应占比分别为18.97%和18.37%。
2.2.2 标准化鱼类粒径谱
浙江省南部近岸海域4个季节标准化鱼类粒径谱的拟合曲线均呈“穹顶”抛物线型 (图4),所有回归结果均极显著 (P<0.01)。回归系数R2以冬季最大 (R2=0.90),夏季最小 (R2=0.75,表3);曲率介于−0.18~−0.09,以冬季最大 (−0.09),夏秋次之,春季最小 (−0.18,表3),且冬季曲线相对平缓,春季曲线较为陡峭,这表明春季浙江南部近海鱼类生物量受外界干扰程度最大,而冬季相对稳定。
表 3 标准化鱼类粒径谱各季拟合曲线的参数Table 3 Parameters of seasonal fitted curve of normalized fish size spectra季节
Season拟合方程
Fitted
equation曲率
Curvature回归系数R2
Regression
coefficient冬季 Winter y=−0.09x2+0.83x+4.54 −0.09 0.90 春季 Spring y=−0.18x2+1.70x+2.63 −0.18 0.87 夏季 Summer y=−0.13x2+1.07x+5.08 −0.13 0.75 秋季 Autumn y=−0.16x2+1.51x+3.59 −0.16 0.88 2.3 鱼类群落空间差异
对浙江省南部近海四季各站位鱼类丰度进行多维尺度分析,得出四季MDS图 (图5)。Stress值分别为0.13、0.17、0.18和0.13,均在0.2以下,表明MDS结果可以反映各站位间的关系。冬季27个站位以69%的群落相似性将鱼类群落分为组Ⅰ、组Ⅱ、组Ⅲ、组Ⅳ,春季以57%的相似性分为4组,夏季以48%的相似性分为3组,秋季以64%的相似性分为3组。其中冬季组Ⅰ(站位21)、春季组Ⅰ(站位42) 和夏季组Ⅰ(站位04) 在各自季节自成一组,聚类相似性接近0。ANOSIM结果显示,冬季Global R=0.83 (P<0.01),春季Global R=0.74 (P<0.01),夏季Global R=0.69 (P<0.01),秋季Global R=0.85 (P<0.01),说明各分组间差异性极显著。
2.4 鱼类粒径谱的空间差异
根据MDS结果,构建四季14个群落组的Sheldon粒径谱 (图6),每个群落组均呈不规则的锯齿状。除夏季外,远岸站位比近岸站位的粒级区间大、生物量高。
冬季,组Ⅰ (站位21) 粒级介于4~10,主要由带鱼等鱼种组成;组Ⅱ(站位33、34) 粒级介于1~7,主要以六丝钝尾虾虎鱼 (Amblychaeturichthys hexanema)等为主;组Ⅲ (01、06、11等近岸站位) 粒级介于−1~10,以丰度高的拉氏狼牙虾虎鱼 (Odontamblyopus lacepedii)、黄鲫等小粒级鱼类为主;组Ⅳ (03、04、13等远岸站位) 粒级介于0~11,出现黄鮟等生物量较高鱼类。
春季,组Ⅰ(站位42) 粒级介于4~9,以龙头鱼等种类为主;组Ⅱ (32、33、23、24等远岸站位) 粒级介于0~10,总生物量最大,主要由带鱼等组成;组Ⅲ (39、35等近岸站位) 粒级介于2~9,峰值出现在5~7粒级上,以小黄鱼等为主;组Ⅳ (01、21等近岸站位) 粒级介于2~9,以黄鲫等鱼类为主。
夏季,组Ⅰ(站位04) 粒级介于4~8,在5~6粒级上捕获大量白姑鱼 (Pennahia argentata),生物量较高形成峰值,而在6~7粒级上捕获1尾短尾大眼鲷 (Priacanthus macracanthus),生物量低于5~6和7~8粒级上的生物量,致使波谷出现;组Ⅱ(33、14、42等远岸站位) 粒级介于−2~9,最小粒级主要由麦氏犀鳕 (Bregmaceros mcclellandi)、六丝钝尾虾虎鱼等低生物量鱼类组成;组Ⅲ (01、31、35等近岸站位) 粒级介于−1~10,捕获1尾海鳗 (Muraenesox cinereus) 使9~10粒级上生物量较高。
秋季,组Ⅰ(站位31、35) 粒级介于3~8,以龙头鱼居多;组Ⅲ (24、32、42等远岸站位) 粒级介于0~9,较群落组Ⅱ (01、06、16等近岸站位) 粒级 (1~9) 更完整,峰值出现在粒级7~8上,主要由刺鲳、带鱼、镰鲳等组成。
14个鱼类群落组的标准化粒径谱 (图7) 均存在显著差异 (P<0.01),除冬季群落组Ⅰ近似线性外,其他各组拟合曲线均呈穹顶型。冬季,拟合曲线的曲率为−0.17~−0.01,R2介于0.68~0.89 (表4),其中组Ⅰ拟合曲线的曲率最大且近似直线,其次为组Ⅳ和组Ⅲ,组Ⅱ最小,生物量由组Ⅳ向组Ⅰ依次减少。春季,拟合曲线的曲率为−0.29~−0.19,R2介于0.31~0.80 (表4),其中组Ⅱ拟合曲线的曲率最大,其次为组Ⅲ和组Ⅰ,组Ⅳ最小;组Ⅱ生物量最大,其次是组Ⅲ、Ⅳ、Ⅰ。夏季,拟合曲线的曲率为−0.38~−0.10,R2介于0.57~0.82 (表4),其中组Ⅲ拟合曲线的曲率最大,其次为组Ⅱ,组Ⅰ最小;组Ⅲ生物量最大,组Ⅰ生物量最小。秋季,拟合曲线的曲率为−0.24~−0.15,R2介于0.26~0.88 (表4),其中组Ⅰ拟合曲线的曲率最大,其次为组Ⅲ,组Ⅱ最小;组Ⅲ生物量最大,组Ⅰ生物量最小。四季各群落组标准化粒径谱的曲率大小表明,除夏季外,近岸鱼类群落整体上比远岸鱼类群落受到更大的干扰。
表 4 各季节分组标准化鱼类粒径谱拟合曲线参数Table 4 Parameters of seasonal fitted curve of normalized fish size spectra in different groups季节
Season分组
Group拟合方程
Fitted equation曲率
Curvature回归系数R2
Regression coefficient生物量
Biomass/(g·km−2)冬季 Winter 组Ⅰ y=−0.01x2+0.64x+0.92 −0.01 0.89 8 004 组Ⅱ y=−0.17x2+1.33x+3.44 −0.17 0.68 4 291 组Ⅲ y=−0.10x2+0.93x+4.27 −0.10 0.85 17 109 组Ⅳ y=−0.08x2+0.70x+4.99 −0.08 0.75 28 858 春季 Spring 组Ⅰ y=−0.28x2+3.83x−8.03 −0.28 0.31 5 232 组Ⅱ y=−0.19x2+1.80x+3.10 −0.19 0.74 24 650 组Ⅲ y=−0.28x2+2.78x+0.19 −0.28 0.80 19 059 组Ⅳ y=−0.29x2+2.89x−0.57 −0.29 0.78 9 667 夏季 Summer 组Ⅰ y=−0.38x2+3.21x+0.49 −0.38 0.82 8 076 组Ⅱ y=−0.13x2+1.12x+4.72 −0.13 0.65 29 358 组Ⅲ y=−0.10x2+0.92x+5.27 −0.10 0.57 34 790 秋季 Autumn 组Ⅰ y=−0.15x2+1.60x+1.05 −0.15 0.26 4 069 组Ⅱ y=−0.24x2+2.32x+1.78 −0.24 0.88 16 406 组Ⅲ y=−0.16x2+1.31x+4.03 −0.16 0.59 20 425 3. 讨论
3.1 鱼类群落特征
Sheldon鱼类粒径谱的峰型主要反映海域生态系统对外界干扰的适应性响应[26]。Warwick[27]与Jung和Houde[19]的研究表明,粒径谱图应为“双峰模式”,小粒级物种和大粒级物种分别形成波峰,并于交汇处形成波谷。本研究显示,浙江南部近海2019年整体粒级介于−2~11,但仅在6~7粒级出现最高生物量 (19 326 g·km−2),由带鱼、刺鲳、镰鲳等数量多的低生物量鱼类组成,在8~9粒级处捕获的镰鲳、蓝圆鲹等生物量 (4 018 g·km−2) 最低,低于7~8 (10 651 g·km−2) 和9~10 (5 234 g·km−2) 粒级,致使于8~9粒级处形成波谷,而不存在第二个峰值,表明该海域鱼类粒径处于不平衡状态,鱼类组成主要以小型鱼类为主,大型经济鱼类较少,这可能与过度捕捞有关。
标准化粒径谱拟合曲线的曲率、回归系数可指示群落的健康和稳定状况[28-29]。本研究中,浙江南部近海鱼类标准化粒径谱拟合曲线呈“穹顶”抛物线型,曲率为−0.15,高于稳态理论值−1,曲线较陡,说明小型鱼类居于有利地位,不易被大型鱼类捕食,向大型鱼类能量传递效率偏低,表明鱼类群落中的营养循环效率低。标准化粒径谱拟合曲线R2 (0.88) 接近1,说明各个粒级之间的能量传递效率近似。
本研究发现,东海传统“四大海产”中,鱼类除小黄鱼、带鱼能保持一定的采样率外,大黄鱼 (L. crocea) 等采样率极低。浙江省南部近岸海域鱼类群落主要以六丝钝尾虾虎鱼、麦氏犀鳕、拉氏狼牙虾虎鱼、鳄齿鱼 (Champsodon capensis) 等饵料性鱼类为主,而刀鲚 (Coilia nasus)、大黄鱼、中国花鲈等高营养级的经济鱼类少,几乎无法形成利于捕捞的渔汛期,这可能是因为不合理的捕捞活动造成亲体资源量剧减,加之近年海岸带开发、环境污染等原因,也可能与调查采样的海域范围有关。
3.2 鱼类粒径谱季节变动及其影响因素
鱼类粒径谱反映鱼类群落的粒径结构[18,30]及鱼类大小与丰度的关系[31]。本研究中,浙江南部近海冬季鱼类的粒级介于−1~11,春季为0~10,夏季为−2~10,秋季为0~9,各季节粒级大小存在季节变动。本次调查中冬季平均水温为13.21 ℃,最大粒级 (10~11) 捕获冷温性鱼类黄鮟、远东海鲂 (Zeus faber) 和中国花鲈,最小粒级 (−2~−1) 捕获虻鲉 (Erisphex pottii)、舒氏冠海龙 (Corythoichthys schultzi)、粗吻海龙 (Trachyrhamphus serratus)、六丝钝尾虾虎鱼等生物量低的鱼类和幼鱼;春季水温上升,平均值22.46 ℃,黄鮟等大粒级的冷温性鱼种游向水温较低处使粒级区间小于冬季,最小粒级 (−1~0) 捕获眼镜鱼 (Mene maculata)、翼红娘鱼 (Lepidotrigla alata)、蓝圆鲹的幼鱼,而高粒级只捕获1尾乌鲹 (Parastromateus niger);夏季正值禁渔期,平均水温为28.94 ℃,营养盐丰富,带鱼等暖温性鱼类洄游至近海进行育幼,以幼鱼数量居多,最小粒级 (−3~−2) 以带鱼为主;秋季平均水温为22.96 ℃,在伏季休渔期结束后,人类捕捞强度逐渐增大导致高粒级经济鱼类剧减,鱼类粒级区间缩小,最小粒级 (−1~0) 捕获发光鲷、六丝钝尾虾虎鱼、丝棘虎鲉 (Minous pusillus)、麦氏犀鳕、棕腹刺鲀 (Gastrophysus spadiceus),最大粒级有带鱼、鮸 (Miichthys miiuy)、鲶 (Silurus asotus)、棕腹刺鲀。
同时,粒径谱图形的曲率受到各季节最小粒级上鱼类生物量[9]、当年生幼鱼数量、洄游性与定栖性鱼类生物量[26]、捕捞强度[32]等影响。本研究发现,冬季浙江南部近海鱼类群落相对稳定,最小粒级上捕获数量较多的小个体鱼类,使得该粒级总生物量较高。冷温性鱼种黄鮟等个体较大的成鱼在冷水系沿岸流影响下出现,这或许是冬季存在高粒级 (10~11) 的原因,从而使得冬季鱼类群落的粒径结构较其余季节好,标准化粒径谱的曲率相对平缓。春、夏季,最小粒级上鱼类的数量和生物量均较少,秋季虽在最小粒级上捕获较多麦氏犀鳕,但随着捕捞强度的增大,高粒级鱼类缺乏,使标准化鱼类粒径谱的曲率相对陡峭。此外,小粒径的丝棘虎鲉、粗吻海龙、六丝钝尾虾虎鱼等定栖性鱼类的存在,发光鲷、麦氏犀鳕、蓝圆鲹、眼镜鱼等洄游性鱼类的季节性出现,以及带鱼等当年生鱼类的出现,都会使得谱图曲率产生季节变化。冬季到春季曲率降低与位于春季最小粒级 (0~1) 上的1尾眼镜鱼、蓝圆鲹、翼红娘鱼有关,春季生物量为3 g·km−2,低于冬季生物量 (7 g·km−2),且粒级区间小于冬季;春季到夏季曲率升高与夏季最小粒级 (−2~0) 捕获到较多麦氏犀鳕、带鱼幼鱼、六丝钝尾虾虎鱼有关,且0~1粒级上夏季生物量 (9 g·km−2) 高于春季 (4 g·km−2);夏季到秋季曲率下降是由于秋季最小粒级 (0~1) 上的麦氏犀鳕、发光鲷等造成,生物量 (6 g·km−2) 低于夏季生物量 (9 g·km−2),且粒级区间较秋季小;秋季到冬季曲率上升与冬季最小粒级 (−1~0) 捕获粗吻海龙、六丝钝尾虾虎鱼、丝棘虎鲉等,少数大粒级 (10~11) 黄鮟有关,且0~1粒级生物量 (7 g·km−2) 高于秋季生物量 (6 g·km−2)。
因此,浙江南部近海鱼类粒径谱季节变化明显,主要受环境变化、最小粒径级的鱼类生物量变化、洄游性与定栖性鱼类、当年生幼鱼影响。禁渔期的季节性、人类捕捞活动的季节性强度不同也会对鱼类群落结构和生物量产生影响,进而使得鱼类粒径谱结构发生季节变化。徐姗楠等[11,26]对大亚湾和胶州湾的研究也得到类似结论。
3.3 鱼类粒径谱空间特征
鱼类群落的空间分布特征受鱼类生活习性、丰度分布、栖息地环境等影响[33-34]。对比浙江南部近海四季14个群落组的相似性发现,冬、春季在69%和57%的相似性水平上分别聚为4组,夏、秋季在48%和64%的相似性水平上分别聚为3组,即春、夏季群落相似性均低于冬、秋季,这可能与鱼类生活习性、栖息地环境等有关。秋、冬季鱼类分散索饵或越冬洄游,分布较均匀,各组结构较相似;春、夏季部分鱼类在沿岸产卵、索饵,因环境需求不同,呈分群、斑块状分布,导致各组差异较明显[33],带鱼、龙头鱼、黄鲫等物种并非只出现在某一个站位或群聚中,这可能由于该部分鱼类适温、适盐性强,不存在空间上的相互隔离,即由鱼类丰度分布的空间差异导致[34],本研究进一步证实了这点。
同时,鱼类群落的空间分布也与鱼类生态特征、过度捕捞、环境因素等有关[35]。综合分析14个组发现,各组间均有极显著性差异 (P<0.01),除单个站位组的冬季组Ⅰ (站位21)、春季组Ⅰ (站位42)、夏季组Ⅰ (站位04) 外,近岸站位 (如站位06、16、26等) 和远岸站位 (如站位23、32、13等) 基本不会划分成同一组 (图5),即近岸站位和远岸站位群落结构具有较大差异,这可能与鱼类生态特性有关,与梁海[34]研究结果一致。各组Sheldon粒径谱中,冬季最高值在组Ⅳ,春季为组Ⅱ,夏季为组Ⅲ,秋季为组Ⅲ,这4组粒级区间大、生物量高且均包含大部分远岸站位。从种类组成上看,远岸站点包含了带鱼、中国花鲈、海鳗等生物量稍高的鱼类种类,近岸站点主要由黄鲫、镰鲳、龙头鱼、黑姑鱼等丰度大的小型鱼类组成。标准化粒径谱中,冬季群落组Ⅳ、春季群落组Ⅱ和秋季群落组Ⅲ的曲率分别大于冬季组Ⅲ、春季组Ⅳ和秋季组Ⅱ,整体上,近岸比远岸受到更大干扰,鱼类群落结构发生变化。而夏季正值禁渔期,致使组Ⅱ曲率小于组Ⅲ,证实禁捕政策取得一定成效,近岸站位渔业资源得到一定恢复。研究表明,人类捕捞影响鱼类粒级结构[18],过度捕捞导致大粒级鱼类缺乏[36],标准化粒径谱的曲率随捕捞强度的增加而减小[18,37]。同时,本研究发现标准化粒径谱曲率与环境因子有显著相关性 (图8),其中曲率大小与海表温度 (R=−0.27) 呈极显著负相关,与盐度 (R=0.59) 呈非常显著正相关,与pH (R=−0.46) 呈非常显著负相关,与水深深度 (R=0.11) 无明显相关性,即曲率与海域盐度、pH和温度的相关性显著。有研究认为,蓝圆鲹等鱼类受温度影响大,带鱼、龙头鱼等鱼类的越冬洄游与外侧较深海域的盐度有关[38],环境因子通过影响鱼类生长全过程导致各粒径级对应物种组成变化,从而影响整个鱼类粒径谱形状[18]。此外,宋伦等[8,39]研究表明,海域富营养化对粒径谱的粒径结构和曲率也具有影响。
![]() 图 8 标准化粒径谱曲率与环境因子的相关性分析*. P<0.05,显著相关;**. P<0.01,极显著相关;***. P<0.001,非常显著相关。Fig. 8 Correlation analysis between curvature of normalized size spectra and environmental indicators*. P<0.05, significant correlation; **. P<0.01, extremely significant correlation; ***. P<0.001, very significant correlation.
图 8 标准化粒径谱曲率与环境因子的相关性分析*. P<0.05,显著相关;**. P<0.01,极显著相关;***. P<0.001,非常显著相关。Fig. 8 Correlation analysis between curvature of normalized size spectra and environmental indicators*. P<0.05, significant correlation; **. P<0.01, extremely significant correlation; ***. P<0.001, very significant correlation.3.4 展望
根据鱼类粒径谱的结构形态,对偏离理论稳定状态的系统制定修复计划,如生物操纵策略中的增殖放流,根据实际情况在群落/生态系统中补充低于拟合值的生物。小范围海域可通过定向捕捞、投放幼鱼或成鱼等措施;在大范围海域,可先将幼鱼投放在邻近较为稳定的环境中,以确保鱼类资源的亲体补充量,增强群落稳定性和抗干扰能力。本研究从粒径谱角度出发,探索了鱼类群落的粒径谱结构和组成,并从季节和空间两方面分析了鱼类群落的空间差异和变动,为浙江南部近岸海域渔业资源管理和生态可持续发展提供了重要的参考依据。
致谢:对上海海洋大学渔业资源和生态系统量化评估与管理研究室、浙江省海洋水产养殖研究所的老师和同学在样品采集和生物学分析中的付出,戴黎斌、王士聪、薛铭华等提供的帮助,谨致谢忱!
-
图 1 黄鳍金枪鱼幼鱼体质量与白蛋白、甘油三酯、总胆固醇和转氨酶的关系
注:不同字母间表示差异显著 (P<0.05),字母相同则差异不显著 (P>0.05),图2同此。
Figure 1. Relationship between albumin, triglyceride, total cholesterol, transaminase and body mass of juvenile T. albacares
Note: Different and same letters indicate significant difference (P<0.05) and insignificant difference (P>0.05), respectively. The same case in Fig. 2.
-
[1] 吴旭东, 张奇, 赵红雪, 等. 宁夏鲇属鱼类一新纪录种——兰州鲇形态学特征描述[J]. 淡水渔业, 2006, 36(3): 26-29. doi: 10.3969/j.issn.1000-6907.2006.03.005 [2] 陈洁, 熊邦喜, 顾钱洪, 等. 内源及外源因子对鱼类血液生理生化指标的影响[J]. 湖北农业科学, 2011, 50(9): 1861-1865. doi: 10.3969/j.issn.0439-8114.2011.09.041 [3] 周胜杰, 杨蕊, 于刚, 等. 黄鳍金枪鱼幼鱼体长与血液指标关系研究[J]. 南方水产科学, 2021, 17(5): 126-132. doi: 10.12131/20210052 [4] 何福林, 向建国, 李常健, 等. 水温对虹鳟血液学指标影响的初步研究[J]. 水生生物学报, 2007, 31(3): 363-369. doi: 10.3321/j.issn:1000-3207.2007.03.010 [5] HERMENEAN A, DAMACHE G, ALBU P, et al. Histopatological alterations and oxidative stress in liver and kidney of Leuciscus cephalus following exposure to heavy metals in the Tur River, North Western Romania[J]. Ecotoxicol Environ Saf, 2015, 119: 198-205. doi: 10.1016/j.ecoenv.2015.05.029
[6] 管标, 温海深, 刘群, 等. 急性温度胁迫对虹鳟肝脏代谢酶活性及生长相关基因表达的影响[J]. 大连海洋大学学报, 2014, 29(6): 566-571. doi: 10.3969/J.ISSN.2095-1388.2014.06.005 [7] 杜强, 林黑着, 王芸, 等. 华南沿海5种海水鱼类血液生化指标的比较研究[J]. 饲料工业, 2014, 35(21): 74-76. doi: 10.13302/j.cnki.fi.2014.21.018 [8] 杨国华, 钟山, 杨萍, 等. 杂交鳢及其亲本血清蛋白和甘油三酯含量的比较分析[J]. 河北渔业, 2011(10): 4-6, 24. doi: 10.3969/j.issn.1004-6755.2011.10.002 [9] 米博瀚. 碳酸盐胁迫下瓦氏雅罗鱼磷酸酶基因差异表达与生理应答[D]. 上海: 上海海洋大学, 2020: 4-9. [10] 张思敏, 李吉方, 温海深, 等. 急性温度胁迫对许氏平鲉肝脏代谢机能和血液指标的影响及生理机制[J]. 中国海洋大学学报(自然科学版), 2018, 48(5): 32-38. doi: 10.16441/j.cnki.hdxb.20170224 [11] 柳飞, 李健, 李吉涛, 等. 碳酸盐碱度对脊尾白虾生存、生长、繁殖及免疫酶活性的影响[J]. 中国水产科学, 2016, 23(5): 1137-1147. [12] 刘金兰, 李其雨. 4种养殖鱼类溶菌酶活性比较研究[J]. 天津农业科学, 2011, 17(6): 42-44. doi: 10.3969/j.issn.1006-6500.2011.06.012 [13] 刘峰, 王舒淇, 朱绍彰, 等. 鱼类保活运输及其对肌肉和血液生理生化指标影响研究进展[J]. 食品安全质量检测学报, 2021, 12(16): 6310-6316. doi: 10.19812/j.cnki.jfsq11-5956/ts.2021.16.002 [14] 龙治海, 李华, 段元亮, 等. 饲料蛋白水平对鲈鲤幼鱼生长性能及部分血液指标的影响[J]. 四川农业科技, 2021(5): 51-54. doi: 10.3969/j.issn.1004-1028.2021.05.018 [15] 朱莉飞, 李伟, 王赛赛, 等. 氯化镉暴露对罗非鱼血液指标的影响[J]. 江苏农业科学, 2019, 47(18): 217-219. doi: 10.15889/j.issn.1002-1302.2019.18.047 [16] PAIS, LUIGI G, MUDADU, et al. Colorimetric analysis and determination of histamine in samples of yellowfin tuna (Thunnus albacares) marketed in Sardinia (Italy) by a combination of rapid screening methods and LC-MS/MS[J]. Foods, 2022, 11(5): 639. doi: 10.3390/foods11050639
[17] LEE G Y, SUH S M, LEE Y M, et al. Multiplex PCR assay for simultaneous identification of five types of tuna (Katsuwonus pelamis, Thunnus alalonga, T. albacares, T. obesus and T. thynnus)[J]. Foods, 2022, 11(3): 280. doi: 10.3390/foods11030280
[18] MA Z, WU S, MENG X, et al. Feeding depths of wild caught yellowfin tuna Thunnus albacares juveniles and skipjack tuna Katsuwonus pelamis in sea cages[J]. Isr J Aquac-Bamidgeh, 2017, 69: 5.
[19] 马振华, 于刚, 周胜杰, 等. 一种黄鳍金枪鱼野生幼鱼室内驯化养殖装置: 212488028U[P]. 2021-02-09. [20] 方伟, 周胜杰, 赵旺, 等. 黄鳍金枪鱼5月龄幼鱼形态性状对体质量的相关性及通径分析[J]. 南方水产科学, 2021, 17(1): 52-58. doi: 10.12131/20200158 [21] 周胜杰, 杨蕊, 于刚, 等. 黄鳍金枪鱼体质量与消化酶和免疫相关酶活性的关系研究[J]. 南方水产科学, 2022, 18(3): 163-169. doi: 10.12131/20210191 [22] 苏建青, 褚秀玲, 刘文强, 等. 鱼类肝病的发生原因及诊治[J]. 齐鲁渔业, 2009, 26(12): 29-31. [23] 陈明, 王梦芝, 王剑飞, 等. 不同ω-6/ω-3PUFA日粮对扬州鹅肝功酶和白球比的影响[J]. 中国畜牧杂志, 2011, 47(13): 46-50. [24] 张利娜, 陈桃英, 刘利平. 长江口降海雌、雄鳗鲡血清生化指标和卵黄蛋白原的差异分析[J]. 上海海洋大学学报, 2017, 26(5): 658-665. doi: 10.12024/jsou.20170201957 [25] 刘伟, 文华, 蒋明, 等. 2种蛋白水平的饲料循环投喂对奥尼罗非鱼幼鱼生长、体成分和血清生化指标的影响[J]. 华南农业大学学报, 2013, 34(3): 405-410. doi: 10.7671/j.issn.1001-411X.2013.03.024 [26] 唐国盘, 黄安群, 秦改晓, 等. 高温下饲料投喂频率对黄河鲤鱼幼鱼的生长、体成分、血清生化指标及抗病力的影响[J]. 黑龙江畜牧兽医, 2017(9): 234-238. doi: 10.13881/j.cnki.hljxmsy.2017.0821 [27] 温安祥, 周定刚. 几种不同食性鱼类部分血液生化指标的比较研究[J]. 四川动物, 2005(4): 80-84. doi: 10.3969/j.issn.1000-7083.2005.04.017 [28] 王丽宏, 叶元土, 张宝彤, 等. 几种养殖鱼类血清转氨酶活性参考值的探讨[J]. 饲料工业, 2011, 32(24): 18-20. doi: 10.3969/j.issn.1001-991X.2011.24.006 [29] 丁浪, 杨严鸥, 姚峰, 等. 瓦氏黄颡鱼饥饿后再投喂的生长及转氨酶活性的个体差异[J]. 长江大学学报(自然科学版), 2019, 16(11): 81-84, 101. [30] 孟兆娜, 陈玉春, 管雪婷, 等. 复方中草药对镜鲤(Cyprinus carpio L.)血清转氨酶及红细胞抗氧化酶活性的影响[J]. 东北农业大学学报, 2010, 41(8): 75-80. doi: 10.3969/j.issn.1005-9369.2010.08.016 [31] 陈洁. 主养草鱼池塘三种混养模式对鱼类生长和血液指标的影响[D]. 武汉: 华中农业大学, 2011: 59-60. [32] 黄权, 高峰, 孟繁伊, 等. 饥饿和再投喂对花羔红点鲑肌肉组分和血液指标的影响[J]. 吉林农业大学学报, 2009, 31(4): 460-466, 475. doi: 10.13327/j.jjlau.2009.04.024 [33] 孟繁伊, 黄权, 郝凤奇. 不同年龄花羔红点鲑肌肉成分和血液指标的比较研究[J]. 中国水产科学, 2009, 16(1): 113-119. doi: 10.3321/j.issn:1005-8737.2009.01.016 [34] 章龙珍, 庄平, 张涛, 等. 人工养殖不同年龄史氏鲟的血液生化指标[J]. 水产学报, 2007, 31(2): 159-164. [35] 杨元昊, 周继术, 卢玲, 等. 兰州鲇与鲇形态特征和血清生化指标的比较研究[J]. 水生态学杂志, 2013, 34(1): 87-91. doi: 10.15928/j.1674-3075.2013.01.016 [36] 孔雨昕, 田佳鑫, 王桂芹. 鱼类脂肪肝的特征及发病原因研究概况[J]. 科学养鱼, 2020(2): 42-44. doi: 10.3969/j.issn.1004-843X.2020.02.024 [37] 周小秋, 冯琳, 姜维丹, 等. 营养与鱼类免疫研究进展[J]. 动物营养学报, 2014, 26(10): 3175-3184. doi: 10.3969/j.issn.1006-267x.2014.10.032 [38] 张晨捷, 彭士明, 高权新, 等. 饲料中大豆油替代鱼油对银鲳 (Pampus argenteus) 幼鱼血清溶菌酶活性及组织抗氧化能力的影响[J]. 渔业科学进展, 2017, 38(3): 115-123. doi: 10.11758/yykxjz.20160222001 [39] 王坛, 华雪铭, 朱伟星, 等. 饲料中添加溶菌酶对吉富罗非鱼生长、免疫-抗氧化功能及血清抗菌性能的影响[J]. 水生生物学报, 2016, 40(4): 663-671. doi: 10.7541/2016.89 [40] 薛宝贵, 楼宝, 徐冬冬, 等. 密度胁迫对黄姑鱼幼鱼生长、代谢及非特异性免疫的影响[J]. 渔业科学进展, 2013, 34(2): 45-51. doi: 10.3969/j.issn.1000-7075.2013.02.006 [41] 何亮银, 史晓丽, 周逢芳, 等. 低盐胁迫对大黄鱼非特异性免疫酶活力的影响[J]. 应用海洋学学报, 2022, 41(2): 347-354. doi: 10.3969/J.ISSN.2095-4972.2022.02.020 [42] 田海军, 陈建国, 龙勇, 等. 复方中草药对鲤肝脏转氨酶的影响[J]. 水产科学, 2007(11): 625-627. doi: 10.3969/j.issn.1003-1111.2007.11.010 [43] 王文博, 汪建国, 李爱华, 等. 拥挤胁迫后鲫鱼血液皮质醇和溶菌酶水平的变化及对病原的敏感性[J]. 中国水产科学, 2004, 11(5): 408-412. doi: 10.3321/j.issn:1005-8737.2004.05.005 [44] 封青川, 卢爱灵, 李庚午, 等. 连续4次(每次间隔36h)部分肝切除对大鼠肝ACP、AKP、HSC70/HSP68和PCNA的影响[J]. 动物学报, 2001(S1): 190-198. [45] 牛景彦, 刘占才, 王育水, 等. 染汞后草鱼组织器官磷酸酶活性的变化[J]. 浙江农业学报, 2015, 27(9): 1545-1549. doi: 10.3969/j.issn.1004-1524.2015.09.09 [46] 唐婉琴, 张江惠, 袁伦强. 水体锰暴露对草鱼碱性磷酸酶、酸性磷酸酶及代谢率的影响[J]. 重庆师范大学学报(自然科学版), 2018, 35(3): 69-74. [47] 韩振兴, 王韫沛, 张硕, 等. 电磁场对鲫血清4种生化指标的影响研究[J]. 大连海洋大学学报, 2018, 33(3): 359-364. doi: 10.16535/j.cnki.dlhyxb.2018.03.013 [48] 唐首杰, 刘辛宇, 吴太淳, 等. 慢性氨氮胁迫对“新吉富”罗非鱼幼鱼生长及血清生化指标的影响[J]. 水产科学, 2019, 38(6): 741-748. -
期刊类型引用(9)
1. 姚紫荆,杨晓明,吴峰,田思泉. 基于参数最优地理探测器的南太平洋长鳍金枪鱼渔业资源分布驱动力研究. 海洋渔业. 2025(02): 153-162 .  百度学术
百度学术
2. 张鸿霖,马有成,宋厚成,张健,曾志坚. 基于结构方程模型研究环境因子对毛里塔尼亚双拖鲣CPUE的影响. 中国水产科学. 2024(04): 465-475 .  百度学术
百度学术
3. 王月,杨晓明,朱江峰. 中西太平洋自由群鲣资源丰度序列的振荡模态分析. 海洋渔业. 2024(03): 266-274 .  百度学术
百度学术
4. 刘志强,郭绍健,王禹程,周成,吴峰,万荣. 中西太平洋金枪鱼延绳钓钓钩深度分布及其影响因素. 上海海洋大学学报. 2024(04): 1020-1030 .  百度学术
百度学术
5. 范江涛,冯志萍,余为,马胜伟,陈新军. 南海鸢乌贼栖息地模型优化及季节性差异分析. 海洋湖沼通报(中英文). 2024(05): 111-120 .  百度学术
百度学术
6. 杨诗玉,冯佶,李亚楠,朱江峰. 基于气候变化因子的印度洋长鳍金枪鱼资源评估. 南方水产科学. 2024(06): 84-94 .  本站查看
本站查看
7. 何露雪,付东洋,李忠炉,王焕,孙琰,刘贝,余果. 南海西北部蓝圆鲹时空分布及其与环境因子的关系. 渔业科学进展. 2023(01): 24-34 .  百度学术
百度学术
8. 王啸,刘文俊,张健. 基于ARIMA的海洋尼诺指数对中西太平洋黄鳍金枪鱼年际CPUE的影响. 南方水产科学. 2023(04): 10-20 .  本站查看
本站查看
9. 郑好好,杨晓明,朱江峰. 基于多尺度地理加权回归模型的中西太平洋围网鲣渔获率环境影响机制研究. 南方水产科学. 2023(05): 1-10 .  本站查看
本站查看
其他类型引用(3)




 下载:
下载:














 粤公网安备 44010502001741号
粤公网安备 44010502001741号
