Cloning and expression profiling of Cyp1a gene in Lutjanus argentimaculatus under 4-bromodiphenyl ether (BDE-3) and decabromodiphenyl ether (BDE-209) exposure
-
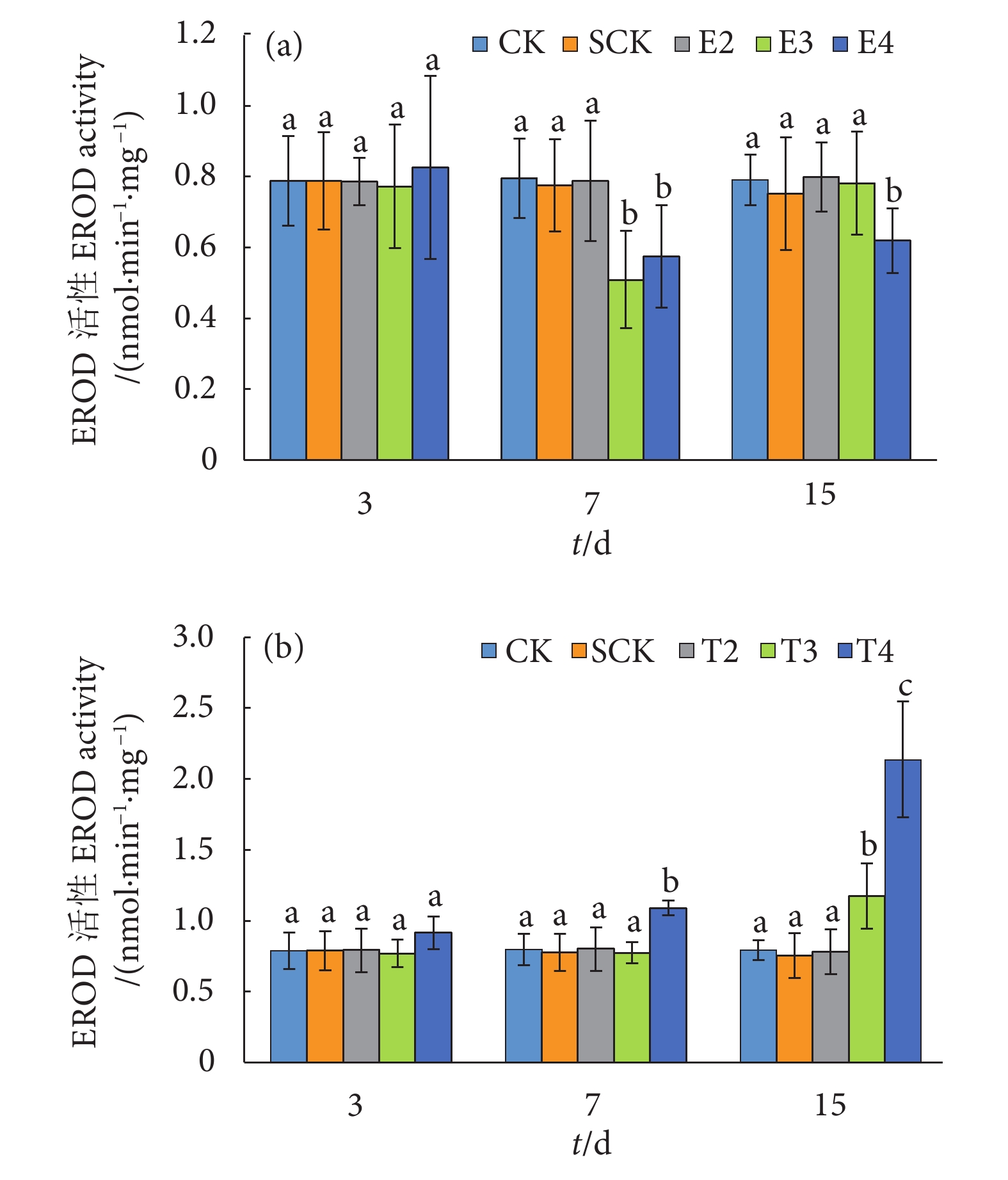
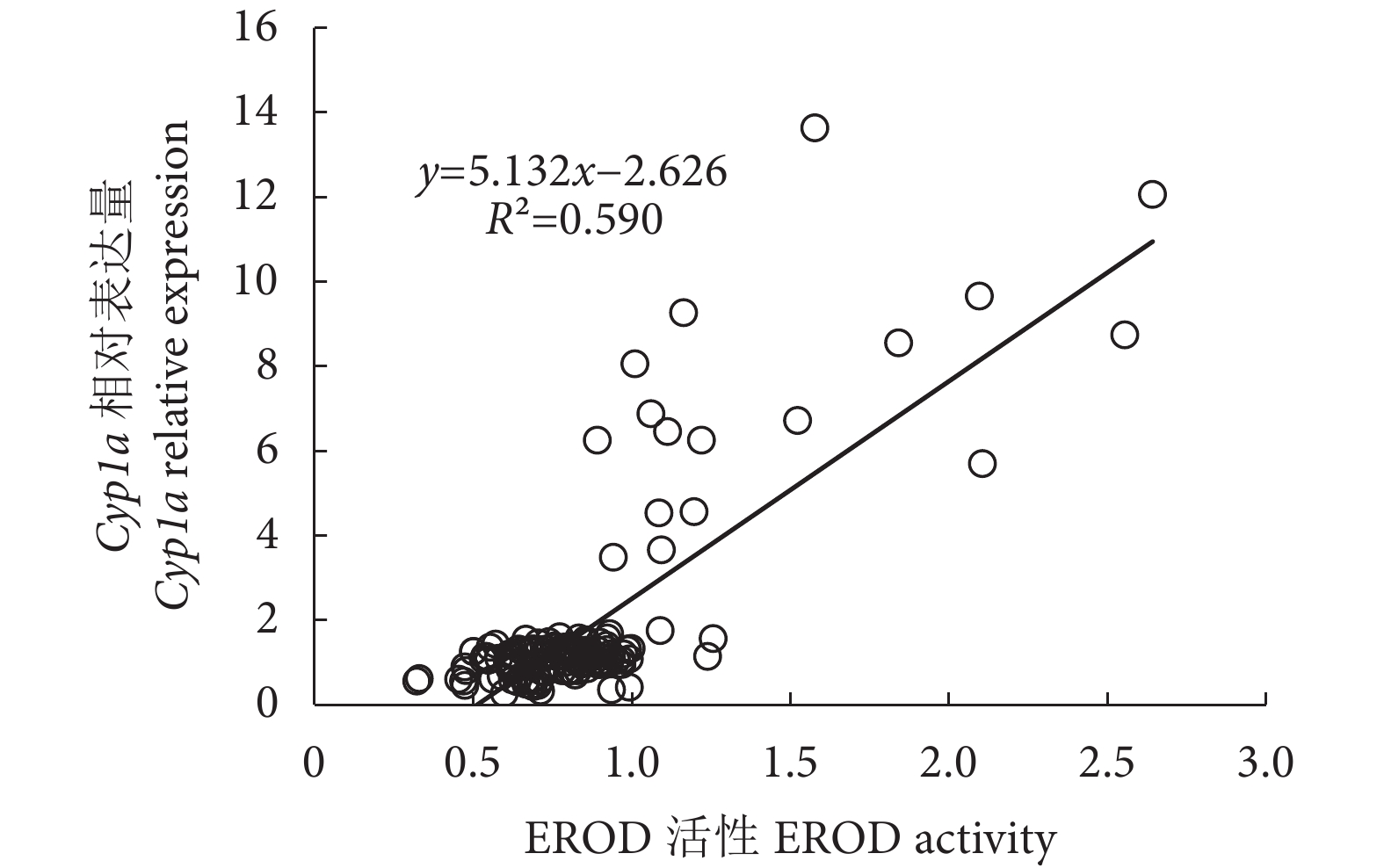
摘要: 细胞色素P450酶 (Cytochrome P450, CYPs) 由P450基因编码,其中Cyp1a基因参与不同类型外源物质的生物转化和代谢。克隆了紫红笛鲷 (Lutjanus argentimaculatus) Cyp1a基因,对其组织表达模式进行分析,探讨了不同质量浓度 (10、50和250 μg·L−1) 一溴联苯醚 (4-bromodiphenyl ether, BDE-3) 和十溴联苯醚 (decabromodiphenyl ether, BDE-209) 胁迫对紫红笛鲷肝脏Cyp1a表达及7-乙氧基香豆素-O-脱乙基酶 (7-ethoxyresorufin O-deethylase, EROD) 活性的影响。结果表明,紫红笛鲷Cyp1a cDNA全长2540 bp,开放阅读框长1 566 bp,编码521个氨基酸。同源分析结果表明紫红笛鲷CYP1A与花鲈 (Lateolabrax maculatus) CYP1A蛋白相似性最高 (92.69%),进化树分析与白梭吻鲈 (Sander lucioperca) 聚为一支,进化地位最近。Cyp1a基因在紫红笛鲷肝脏表达量最高,其次是脑和鳃,肌肉最低。10 μg·L−1 BDE-3和BDE-209未对Cyp1a基因表达和EROD活性产生影响,而50和250 μg·L−1BDE-3胁迫7~15 d则对两者产生显著抑制,且呈现剂量效应。与BDE-3相反,50和250 μg·L−1 BDE-209 处理组Cyp1a基因表达和EROD活性显著增加,且Cyp1a基因表达与EROD活性呈显著正相关。高浓度BDE-3和BDE-209可对紫红笛鲷肝脏Cyp1a基因的表达产生影响,但两者的影响模式不同。Abstract: Cytochrome P450 enzymes (CYPs) are encoded by P450 genes, in which cytochrome P450 1A (Cyp1a) genes mainly involve in biotransformation and metabolism of numerous xenobiotics. In this study, we cloned the Cyp1a gene from Lutjanus argentimaculatus, and investigated its tissue expression pattern. In addition, we evaluated different concentrations (10, 50 and 250 μg·L−1) of BDE-3 and BDE-209 on Cyp1a gene profile and 7-ethoxyresorufin-O-deethylase (EROD) activity in liver of L. argentimaculatus. The results show that the full length of Cyp1a cDNA was 2 540 bp with 1 566 open reading frame encoding 521 amino acids. The sequence homology of L. argentimaculatus CYP1A was the highest (92.69%) with that of Lateolabrax maculatus. Phylogenetic analysis results indicate that CYP1A was closely aligned with Sander lucioperca protein. Cyp1a transcripts were most abundant in liver, followed by brain and gill, but lowest in muscle. 10 μg·L−1 of BDE-3 and BDE-209 showed no effects on both Cyp1a expression and EROD activity, while high concentrations (50 and 250 μg·L−1) of BDE-3 down-regulated both of them significantly in a concentration-dependent manner on 7th-15th day. In contrast, exposure to 50 and 250 μg·L−1 of BDE-209 resulted in increasing of hepatic Cyp1a level and EROD activity. Moreover, Cyp1a genes levels and EROD activities showed a good correlation. High concentrations of BDE-3 and BDE-209 can affect Cyp1a gene expression in liver of L. argentimaculatus in different manners.
-
凡纳滨对虾(Litopenaeus vannamei)又称南美白对虾, 具有生长速度快、环境适应性强等特点, 是中国重要的海水养殖品种[1]。近年来随着养殖规模的扩大和养殖密度的增加, 疾病成为阻碍凡纳滨对虾产业发展的瓶颈之一[2-4]。由于对其疾病发生的原因及机理了解不够, 对虾一旦发病, 养殖户往往会大量使用或滥用抗生素等药物, 这不仅会造成致病菌多重抗药性, 而且会引发对虾肠道菌群失调和药物残留等问题, 危害环境和食品安全, 负面效应日益严重[5]。因此, 寻找新型免疫增强剂等提高对虾免疫力、促进其生长显得尤为重要。研究表明, 在饲料中适量添加中草药和海洋红酵母(Rhodotorula mucilaginosa)等成分能有效提高凡纳滨对虾和尼罗罗非鱼(Oreochromis niloticus)的生长和免疫能力[6-7]。
短链脂肪酸—丁酸是厚壁菌门细菌的主要代谢产物, 可以为动物肠道黏膜提供能量, 降低肠道pH, 减少有害菌生长, 且不产生抗药性[8-9]。聚β-羟基丁酸酯(poly-β-hydroxybutyrate, PHB)作为短链脂肪酸β-羟基丁酸的聚合体, 是由细菌合成的一种酯类天然产物, 具有生物可降解性和生物相容性等特点[10]。在碳、氮营养失衡的情况下, 细菌胞内可以积累PHB作为碳源和能量储备物质[11]。PHB可在动物肠道内降解为β-羟基丁酸单体, 通过营造肠道微酸性环境促进有益微生物(尤其是革兰氏阳性细菌)在肠道中形成优势菌群[8, 12]。此外, PHB为脂溶性颗粒, 其疏水特性可避免短链脂肪酸易挥发的缺点, 更适于在水产养殖中应用[11]。该研究拟通过投喂不同PHB含量的饲料养殖凡纳滨对虾, 测定对虾肝胰腺免疫和消化酶活性及HSP70和Toll免疫基因表达量的变化, 初步探讨饲料添加不同含量PHB对对虾免疫和消化机能的影响, 以期为PHB在对虾养殖中的应用提供基础数据。
1. 材料与方法
1.1 材料
实验用凡纳滨对虾取自中国水产科学研究院南海水产研究所深圳试验基地, 平均体质量为(5.66±0.14)g。实验前在玻璃纤维桶(300 L)中暂养7 d, 每桶30尾, 投喂不含PHB的对虾基础配合饲料。养殖水温为(25±0.5)℃, 盐度30, pH 8.5, 连续充气, 日换水量为总水量1/3。实验与暂养期间的养殖条件基本一致。
凡纳滨对虾配合饲料为揭阳“海大牌”2号料, 其中粗蛋白质量分数为40%。实验用PHB购自宁波天安生物材料有限公司, 其添加方法参照de SCHRYVER等[13], 即将PHB溶解于80%三氯甲烷溶液中, 均匀喷洒在饲料颗粒表面, 室温通风条件下晾干去除三氯甲烷, 4 ℃冰箱密闭保存备用。
1.2 实验设计
将暂养7 d的凡纳滨对虾随机分为4组, 即对照组和PHB饲喂组, 每组3个平行, 每个平行30尾虾。对照组对虾投喂不添加PHB的对虾基础配合饲料, PHB饲喂组分别投喂含有PHB质量分数为1%、3%和5%的对虾配合饲料。对虾日投喂量为虾体质量的5%, 依摄食情况具体调整, 日投喂3次(08:00、12:00和18:00), 自然光周期, 养殖周期为35 d。每天记录对虾成活率。
1.3 样品制备
分别于养殖第35天从每个平行组随机取5尾虾的肝胰腺, 用0.9%的预冷生理盐水漂洗, 去除多余的组织液, 用滤纸擦拭后称量, 放置于灭菌的离心管中。按照m(组织):V(生理盐水)=1:9的比例与对虾肝胰腺组织混合, 超声粉碎, 用冷冻离心机于4 ℃、3 000 r · min-1离心10 min, 吸取上清进行分装, 保存在-80 ℃, 用于测定相关酶活性。
1.4 免疫和消化酶活性的测定
分别测定各组凡纳滨对虾肝胰腺的总抗氧化能力(T-AOC)、溶菌酶(LSZ)、淀粉酶、脂肪酶、胃蛋白酶和胰蛋白酶活性以及肝胰腺总蛋白含量, 实验使用南京建成生物工程研究所的试剂盒, 且所用试剂盒均为该研究所同一批次生产。
总抗氧化能力单位定义为, 每毫克动物组织蛋白1 min在37 ℃下使反应系统的吸光度(OD)每升高0.01为1个单位; 溶菌酶能水解细菌细胞壁上的肽聚糖使细菌裂解, 通过测定菌液透光度变化测定溶菌酶活性; 淀粉-碘比色法测定淀粉酶活性, 单位定义为37 ℃下, 10 mg淀粉被每毫克组织蛋白与底物溶液作用30 min后水解为1个活性单位; 1个脂肪酶活性单位定义为每克组织蛋白37 ℃条件下与底物作用1 min水解1 μmol底物; 1个胃蛋白酶活性单位定义为37 ℃下每毫克组织蛋白每分钟分解蛋白生成1 μg氨基酸; 采用考马斯亮蓝法进行组织蛋白定量。在37 ℃下, 每毫克组织中含有的胰蛋白酶1 min使吸光值变化0.003为1个胰蛋白酶活性单位。
1.5 免疫基因表达分析
利用Trizol试剂分别提取不同处理组凡纳滨对虾肝胰腺组织的总RNA, 核酸定量仪确定其纯度和浓度符合标准, 1.0%琼脂糖凝胶电泳检验所得RNA的完整度和质量, DNaseⅠ消化总RNA中多余的DNA, 再用M-MLV反转录酶将RNA反转录得到相应的cDNA, 所得产物于-20 ℃保存备用。具体操作按照说明书进行。
根据GenBank中的凡纳滨对虾HSP70、Toll和内参基因β-actin的cDNA序列, 使用Primer Premier 5.0软件分别设计正反特异性引物(表 1), Real-time PCR分别检测各处理组对虾肝胰腺中HSP70和Toll基因的表达量, 每个样品做3个重复, 按照SYBR Premix Ex TaqTMⅡ(TaKaRa)试剂盒说明书进行具体操作。反应体系总量为20 μL, 包括10 μL SYBR Premix Ex TaqTMⅡ(2×), 0.8 μL正向引物(浓度10 μmol · L-1), 0.8 μL反向引物(浓度10 μmol · L-1), 0.4 μL ROX Reference DyeⅡ(50×), 2.0 μL cDNA, 6.0 μL DEPC水。反应程序为95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 34 s, 40个循环; 95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s。采用2-ΔΔCt法计算凡纳滨对虾HSP70和Toll基因的相对表达量。
表 1 该研究所用引物序列Table 1. Sequence of primers in this study引物名称
primer name引物序列(5′→3′)
primer sequence登录号
accession No.HSP70-F AGGAGACCGCTGAGGCTTAC AY645906 HSP70-R AGCACATTCAGACCCGAGAT Toll-F CCAGCTTAGAAGACCGGCAA DQ923424 Toll-R GTTGTCCGAGCAGAAGTCCA β-actin-F GCCCTGTTCCAGCCCTCATT AF300705 β-actin-R ACGGATGTCCACGTCGCACT 1.6 数据分析
用SPSS 17.0软件处理实验所得数据, 以“平均值±标准误(X ±SE)”表示, 进行单因素方差分析, 显著性水平为α=0.05。
2. 结果
2.1 PHB对肝胰腺免疫指标的影响
PHB对凡纳滨对虾肝胰腺总抗氧化能力和溶菌酶活性的影响见图 1。与对照组相比, 养殖第35天, 3%和5%PHB添加组对虾肝胰腺的总抗氧化能力显著高于对照组(P<0.05), 其中5%PHB添加组最高, 约为对照组的1.8倍(图 1-A)。3%PHB添加组的溶菌酶活性与对照组相比显著升高(P<0.05), 而1%与5%PHB添加组的溶菌酶活性与对照组之间差别不显著(P>0.05, 图 1-B)。
![]() 图 1 聚β-羟基丁酸酯对凡纳滨对虾肝胰腺总抗氧化能力和溶菌酶活性的影响不同小写字母表示组间差异显著(P < 0.05), 相同小写字母表示组间差异不显著(P>0.05);后图同此Figure 1. T-AOC and LSZ activity in hepatopancreas of L.vannamei after PHB treatmentDifferent letters indicate significant difference (P < 0.05), while the same letters indicate no significant difference (P>0.05).The same case in the following figures.
图 1 聚β-羟基丁酸酯对凡纳滨对虾肝胰腺总抗氧化能力和溶菌酶活性的影响不同小写字母表示组间差异显著(P < 0.05), 相同小写字母表示组间差异不显著(P>0.05);后图同此Figure 1. T-AOC and LSZ activity in hepatopancreas of L.vannamei after PHB treatmentDifferent letters indicate significant difference (P < 0.05), while the same letters indicate no significant difference (P>0.05).The same case in the following figures.PHB对凡纳滨对虾肝胰腺HSP70基因和Toll基因表达量的影响见图 2。与对照组相比, 养殖第35天, 3个PHB添加组的HSP70基因表达量均显著升高, 其中1%PHB添加组的表达量最高(P<0.05), 约为对照组的2.4倍(图 2-A); Toll基因表达量随PHB添加浓度的升高呈先增高后降低的趋势, 1%和3%PHB添加组的Toll基因表达量显著升高(P<0.05), 约为对照组的2倍, 但5%PHB添加组的表达量与对照组差异不显著(P>0.05, 图 2-B)。
2.2 PHB对肝胰腺消化指标的影响
PHB对凡纳滨对虾肝胰腺淀粉酶、脂肪酶、胃蛋白酶和胰蛋白酶活性的影响见图 3。与对照组相比, 养殖第35天, 1%和5%PHB添加组对虾肝胰腺的淀粉酶活性显著升高(P<0.05), 分别为对照组的1.2和1.8倍。而3%PHB添加组淀粉酶活性与对照组差异不显著(P>0.05, 图 3-A)。脂肪酶各PHB添加组与对照组均无显著性差异(P>0.05, 图 3-B)。5% PHB添加组的胃蛋白酶活性显著升高(P<0.05), 而1%PHB添加组胃蛋白酶活性与对照组差异不显著(P>0.05), 3%PHB添加组胃蛋白酶活性有显著降低现象(P<0.05, 图 3-C)。与胃蛋白酶活性一致, 5%PHB添加组的胰蛋白酶活性显著高于其他各组(P<0.05), 1%、3%PHB添加组和对照组间均无显著差异(P>0.05, 图 3-D)。
3. 讨论
肝胰腺是甲壳动物体内分泌酶、吸收及储存营养物质的重要器官, 其酶活性通常被用作衡量动物消化和免疫功能的指标之一[12, 14]。PHB在甲壳动物消化道内能降解为短链脂肪酸β-羟基丁酸, 具有促进动物生长、提高动物免疫能力的功能。研究表明, PHB能提高感染白斑综合征病毒(WSSV)的中国对虾(Fenneropenaeus chinensis)的成活率, 延长其存活时间, 并降低感染前期虾体的病毒拷贝数[15]; PHB同样能提高卤虫(Artemia franciscana)[9]和莫桑比克罗非鱼(Oreochromis mossambicus)[16]的成活率, 在动物抵抗病原感染的过程中发挥作用。
此外, PHB还能降低对虾肠道的pH, 营造不利于有害菌生长的弱酸性环境, 调节肠道菌群, 增强对虾抵御病原菌的能力。PHB在动物肠道内降解产生的β-羟基丁酸能在革兰氏阴性菌胞内释放H+, 抑制病原细菌的酶活性从而抑制其生长, 维护肠道健康, 增强养殖对虾的消化和免疫功能[9]。用PHB培养的卤虫无节幼体投喂罗氏沼虾(Macrobrachium rosenbergii), 结果显示, 含有PHB的实验组罗氏沼虾成活率显著升高, 肠道总细菌数和弧菌数降低, 说明PHB对一些肠道潜在致病菌有抑制作用[17]。
3.1 PHB对凡纳滨对虾肝胰腺免疫指标的影响
凡纳滨对虾无特异性免疫系统, 主要通过吞噬细胞及各种免疫因子来抵御外界环境胁迫和疾病[18]。对虾在代谢过程中会产生大量的活性氧, 而过量的活性氧会引发机体的氧化损伤, 清除活性氧的能力与对虾的免疫力密切相关, 所以总抗氧化能力能综合反映对虾的抗氧化防御系统功能[19-21]。溶菌酶是一种抗菌蛋白, 能破坏细菌的细胞壁, 在甲壳动物免疫中起着重要作用, 其活性可以用来衡量对虾非特异性免疫功能强弱[22]。研究表明, 添加质量分数为1%的PHB能延长感染WSSV的凡纳滨对虾的存活时间[23]。在一定范围内, 中华绒螯蟹(Eriocheir sinensis)幼蟹血清中的总超氧化物歧化酶活性随PHB添加量的增加而升高, 说明在饲料中适量添加PHB能增强幼蟹的抗氧化能力, 提高其非特异性免疫能力[24]。该研究结果显示, 3%和5%PHB添加组对虾肝胰腺的总抗氧化能力显著升高, 表明饲料中该水平的PHB添加有助于提高凡纳滨对虾的抗氧化能力; 同时3%PHB添加组的溶菌酶活性最高。以上结果说明饲料中适量添加PHB对凡纳滨对虾肝胰腺的免疫能力具有一定的促进作用。但对于不同的免疫酶PHB的最适浓度不一致, 如何平衡不同指标的差异, 以确定提高凡纳滨对虾综合免疫能力的最适添加浓度, 还有待进一步研究。
HSP70和Toll基因在生物体内广泛存在, 与动物的免疫能力密切相关。HSP70是一种应激蛋白, 在动物受到环境刺激时表达量增加, 提高动物的应激能力[25]。Toll途径能在细菌、真菌和病毒等病原体入侵动物机体时被激活, 诱导动物的非特异性免疫[26]。因此, HSP70和Toll基因的表达量在一定程度上反映对虾机体的免疫力。该实验在饲料中添加PHB显著促进了HSP70和Toll基因的表达, 其中添加1%PHB的实验组表达量最高, 但5%PHB添加组的表达量有所下降。研究表明, 用富含PHB的真养产碱杆菌(Alcaligenes eutrophus H16)培养的卤虫喂养罗氏沼虾幼虾, 显著提高了其成活率[27]。邓康裕等[23, 28]研究表明, PHB能在凡纳滨对虾受到WSSV病毒感染后延长其存活时间, 刺激其免疫基因的表达, 且最有效的添加水平为1%, 与该实验研究结果一致。
3.2 PHB对凡纳滨对虾肝胰腺消化指标的影响
在机体代谢中, 丁酸作为能量物质可以促进肠道黏膜细胞增殖、增强对营养物质的吸收作用[29]。β-羟基丁酸能够增加肠黏膜绒毛的大小和蛋白酶的活力, 促进动物对营养物质的消化吸收, 提高饲料蛋白质和矿物质的利用率, 从而促进动物生长[9, 30]。NAJDEGERAMI等[31-32]研究表明, PHB可以显著提高西伯利亚鲟(Acipenser baerii)的特定生长率、增重率和成活率, 增加其肠道胃蛋白酶活性, 却抑制了淀粉酶活性。SUI等[24]的研究也显示, PHB的添加提高了中华绒螯蟹幼蟹的胃蛋白酶、胰蛋白酶和脂肪酶活性, 但淀粉酶活性下降。该研究中5%PHB添加组的对虾肝胰腺中淀粉酶、胃蛋白酶和胰蛋白酶活性与对照组相比均显著升高, 而脂肪酶活性均无显著性变化, 表明饲料中添加PHB对养殖对虾肝胰腺消化酶具有促进作用, 有利于其对淀粉、蛋白质等营养物质的消化。以上研究中PHB均不同程度地提高了养殖动物的消化能力, 但对不同种类消化酶的促进效果不同, 推测可能与养殖动物的种类和投喂的饲料组成有关。WELTZIEN等[33]发现丁酸在甲壳动物体内过量积累可能造成酮酸中毒现象, 而该研究中PHB的添加是否存在过量还需进一步深入研究。邓元告等[12]发现高剂量PHB和较长时间饲喂均显著降低中华绒螯蟹肝胰腺淀粉酶和胰蛋白酶活性, 推测可能是PHB在幼蟹胃肠道中降解产生β-羟基酸单体, 较低的肠道pH对幼蟹的生理机能产生胁迫而造成的, 因此建议饲料中低剂量PHB可饲喂较长时间, 而较高剂量PHB应适当缩短饲喂时间。
综上, 在饲料中添加适量PHB对凡纳滨对虾的免疫和消化机能具有促进作用, 在对虾免疫增强剂开发中具有较高的应用潜力。在不同的研究中PHB的最适添加水平存在不一致现象, 推测可能与养殖动物种类、生长期、养殖环境和养殖时间有关。未来将针对PHB对凡纳滨对虾肠道菌群的影响和宿主代谢之间的相关性进行研究, 以期解析PHB在对虾中的免疫促生长机理。
-
表 1 实验所用引物
Table 1 Primers used in experiment
引物名称
Primer name引物序列
Primer sequence (5'–3')用途
Purposecyp1a-F GTCTCCGTTGCTAATGTGATCTGTGG Cyp1a中间片段克隆 cyp1a-R GTGATGTCCCGAATGTTGTCCTTGTC cyp1a-5P1 GACCATGACAGGGCAGTGGATATG 5' RACE PCR cyp1a-5P2 GAGTCAGTGATGTCACGAATGTTG cyp1a-3P1 AATGTGCTTTGGCCGACGCTACAA 3' RACE PCR cyp1a-3P2 CTGCTCAGCTTGGTGAACCTCAGT cyp1a-YZF CTCGGGCAAGAACTTTACTA 序列全长验证 cyp1a-YZR GTATCTCCTTATACTTCACT cyp1a-qF GTCTCTGTTGCTAACGTGATCTGTGG RT-PCR[22] cyp1a-qR 同cyp1a-R 18S-qF GTCAAACCCTTTGTCTCCGA 18S-qR CGATGATCAATGTGTCCTGC -
[1] LU K, SONG Y, ZENG R. The role of cytochrome P450-mediated detoxification in the insect adaptation to xenobiotics[J]. Curr Opin Insect Sci, 2021, 43: 103-107. doi: 10.1016/j.cois.2020.11.004
[2] LAU I C K, FEYEREISEN R, NELSON D R, et al. Analysis and preliminary characterisation of the cytochrome P450 monooxygenases from Frankia sp. EuI1c (Frankia inefficax sp. )[J]. Arch Biochem Biophys, 2019, 669: 11-21. doi: 10.1016/j.abb.2019.05.007
[3] MILLER J C, HOLLATZ A J, SCHULER M A. P450 variations bifurcate the early terpene indole alkaloid pathway in Catharanthus roseus and Camptotheca acuminate[J]. Phytochemistry, 2021, 183: 112626. doi: 10.1016/j.phytochem.2020.112626
[4] YANG T, LI T, FENG X, et al. Multiple cytochrome P450 genes: conferring high levels of permethrin resistance in mosquitoes, Culex quinquefasciatus[J]. Sci Rep, 2021, 11(1): 9041. doi: 10.1038/s41598-021-88121-x
[5] NELSON D R. Cytochrome P450 diversity in the tree of life[J]. Biochim Biophys Acta Proteins Proteom, 2018, 1866(1): 141-154. doi: 10.1016/j.bbapap.2017.05.003
[6] 张文领, 牟希东, 胡隐昌, 等. 福寿螺细胞色素P450 基因CYP3192A1 的克隆与表达分析[J]. 南方水产科学, 2017, 13(1): 66-75. doi: 10.3969/j.issn.2095-0780.2017.01.009 [7] HAN J, KIM D, KIM H, et al. Genome-wide identification of 52 cytochrome P450 (CYP) genes in the copepod Tigriopus japonicus and their B[α]P-induced expression patterns[J]. Comp Biochem Physiol D, 2017, 23: 49-57.
[8] 高锴, 闫佩, 檀翠玲, 等. 虹鳟鱼鳃及肝脏多种CYP1 基因表达模式作为生物标志物监测海河水污染状况[J]. 环境科学, 2015, 36(10): 3878-3883. [9] PENG F, HARDY E M, BÉRANGER R, et al. Human exposure to PCBs, PBDEs and bisphenols revealed by hair analysis: a comparison between two adult female populations in China and France[J]. Environ Pollut, 2020, 267: 115425. doi: 10.1016/j.envpol.2020.115425
[10] DA C, WANG R, XIA L, et al. Sediment records of polybrominated diphenyl ethers (PBDEs) in Yangtze River Delta of Yangtze River in China[J]. Mar Pollut Bull, 2021, 160: 111714.
[11] LIU B, SONG N, JIANG T, et al. Polybrominated diphenyl ethers in surface sediments from fishing ports along the coast of Bohai Sea, China[J]. Mar Pollut Bull, 2021, 164: 112037. doi: 10.1016/j.marpolbul.2021.112037
[12] YUAN J, SUN X, CHE S, et al. AhR-mediated CYP1A1 and ROS overexpression are involved in hepatotoxicity of decabromodiphenyl ether (BDE-209)[J]. Toxicol Lett, 2021, 352: 26-33. doi: 10.1016/j.toxlet.2021.09.008
[13] LI Y, MA F, LI Z, et al. Exposure to 4-bromodiphenyl ether during pregnancy blocks testis development in male rat fetuses[J]. Toxicol Lett, 2021, 342: 38-49. doi: 10.1016/j.toxlet.2021.02.004
[14] YAO Y, WANG B, HE Y, et al. Fate of 4-bromodiphenyl ether (BDE3) in soil and the effects of co-existed copper[J]. Environ Pollut, 2020, 261: 114214. doi: 10.1016/j.envpol.2020.114214
[15] 李嘉伟, 尹晓宇, 周旖旎, 等. 五溴联苯醚(BDE-99)和羟基五溴联苯醚(5-OH-BDE-99)经由THRβ影响斑马鱼胚胎眼部色素的沉着[J]. 生态毒理学报, 2020, 15(5): 181-188. [16] THORNTON L M, PATH E M, NYSTROM G S, et al. Embryo-larval BDE-47 exposure causes decreased pathogen resistance in adult male fathead minnows (Pimephales promelas)[J]. Fish Shellfish Immunol, 2018, 80: 80-87. doi: 10.1016/j.fsi.2018.05.059
[17] 王余江, 樊琳, 陈创奇, 等. 视黄酸和多溴联苯醚联合暴露对斑马鱼运动行为的影响[J]. 生态毒理学报, 2019, 14(2): 260-267. doi: 10.7524/AJE.1673-5897.20180206002 [18] YANG J, ZHAO H, CHAN K M. Toxic effects of polybrominated diphenyl ethers (BDE 47 and 99) and localization of BDE-99-induced cyp1a mRNA in zebrafish larvae[J]. Toxicol Rep, 2017, 4: 614-624. doi: 10.1016/j.toxrep.2017.11.003
[19] SØFTELAND L, PETERSEN K, STAVRUM A, et al. Hepatic in vitro toxicity assessment of PBDE congeners BDE47, BDE153 and BDE154 in Atlantic salmon (Salmo salar L. )[J]. Aquat Toxicol, 2011, 105(3/4): 246-263.
[20] BOON J P, ZANDEN J J, LEWIS W E, et al. The expression of CYP1A, vitellogenin and zona radiata proteins in Atlantic salmon (Salmo salar) after oral dosing with two commercial PBDE flame retardant mixtures: absence of short-term responses[J]. Mar Environ Res, 2002, 54(3-5): 719-724. doi: 10.1016/S0141-1136(02)00127-7
[21] MUYOT F B, MAGISTRADO M L, MUYOT M C, et al. Growth performance of the mangrove red snapper (Lutjanus argentimaculatus) in freshwater pond comparing two stocking densities and three feed types[J]. Philippine J Fish, 2021, 28(1): 1-7.
[22] CHEN H, ZHANG Z, ZHANG L, et al. Effects of di-n-butyl phthalate on gills- and liver-specific EROD activities and CYP1A levels in juvenile red snapper (Lutjanus argentimaculatus)[J]. Comp Biochem Physiol C, 2020, 232: 108757.
[23] KUMAR S, STECHER G, TAMURA K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Mol Biol Evol, 2016, 33(7): 1870-1874. doi: 10.1093/molbev/msw054
[24] 余铭恩, 郑榕辉, 张玉生. 3种海洋鱼类肝微粒体EROD活性的测定[J]. 生态学报, 2014, 34(19): 5416-5424. [25] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. doi: 10.1006/meth.2001.1262
[26] CHAUBE R, RAWAT A, INBARAJ R M, et al. Cloning and characterization of estrogen hydroxylase (cyp1a1 and cyp1b1) genes in the stinging catfish Heteropneustes fossilis and induction of mRNA expression during final oocyte maturation[J]. Comp Biochem Physiol A, 2021, 253: 110863. doi: 10.1016/j.cbpa.2020.110863
[27] ARUKWE A. Complementary DNA cloning, sequence analysis and differential organ expression of β-naphthoflavone-inducible cytochrome P4501A in Atlantic salmon (Salmo salar)[J]. Comp Biochem Physiol C, 2002, 133(4): 613-624.
[28] WOO S J, CHUNG J K. Cytochrome P450 1 enzymes in black rockfish, Sebastes schlegelii: molecular characterization and expression patterns after exposure to benzo[a]pyrene[J]. Aquat Toxicol, 2020, 226: 105566. doi: 10.1016/j.aquatox.2020.105566
[29] COCCI P, MOSCONI G, PALERMO F A. Effects of 4-nonylphenol on hepatic gene expression of peroxisome proliferator-activated receptors and cytochrome P450 isoforms (CYP1A1 and CYP3A4) in juvenile sole (Solea solea)[J]. Chemosphere, 2013, 93(6): 1176-1181. doi: 10.1016/j.chemosphere.2013.06.058
[30] 梁秋芳, 董小燕, 冯平. CYP2D 亚家族基因及其进化机制研究进展[J]. 广西师范大学学报 (自然科学版), 2021, 39(5): 58-63. [31] BURKIAN V, ZAMARATSKAIA G, SAKALLI S, et al. Tissue-specific expression and activity of cytochrome P450 1A and 3A in rainbow trout (Oncorhynchus mykiss)[J]. Toxicol Lett, 2021, 341: 1-10. doi: 10.1016/j.toxlet.2021.01.011
[32] RUSNI S, SASSA M, TAKEHANA Y, et al. Correlation between cytochrome P450 1A (cyp1a) mRNA expression and ambient phenanthrene and pyrene concentration in Javanese medaka Oryzias javanicus[J]. Fish Sci, 2020, 86: 605-613. doi: 10.1007/s12562-020-01428-y
[33] KIM R, KIM B, HWANG D, et al. Evaluation of biomarker potential of cytochrome P450 1A (CYP1A) gene in the marine medaka, Oryzias melastigma exposed to water-accommodated fractions (WAFs) of Iranian crude oil[J]. Comp Biochem Physiol C, 2013, 157(2): 172-182.
[34] PETRULIS J R, CHEN G, BENN S, et al. Application of the ethoxyresorufin-O-deethylase (EROD) assay to mixtures of halogenated aromatic compounds[J]. Environ Toxicol, 2001, 16(2): 177-184. doi: 10.1002/tox.1022
[35] ROY M A, SANT K E, VENEZIA O L, et al. The emerging contaminant 3, 3'-dichlorobiphenyl (PCB-11) impedes Ahr activation and Cyp1a activity to modify embryotoxicity of Ahr ligands in the zebrafish embryo model (Danio rerio)[J]. Environ Pollut, 2019, 254: 113027. doi: 10.1016/j.envpol.2019.113027
[36] SMITH E M, IFTIKAR F I, HIGGINS S, et al. In vitro inhibition of cytochrome P450-mediated reactions by gemfibrozil, erythromycin, ciprofloxacin and fluoxetine in fish liver microsomes[J]. Aquat Toxicol, 2012, 109: 259-266. doi: 10.1016/j.aquatox.2011.08.022
[37] DAR S A, GORA A H, BHAT I A, et al. Studies of anthelminthic benzimidazole derivatives on cytochrome P450 1A (CYP1A) dependent detoxification mechanism in Labeo rohita[J]. Aquaculture, 2017, 481: 79-84. doi: 10.1016/j.aquaculture.2017.08.015
[38] 迟潇, 陈碧娟, 孙雪梅, 等. 基于IBR模型研究BDE-47和BDE-153对半滑舌鳎的毒性效应[J]. 生态毒理学报, 2020, 15(4): 192-202. [39] VEN L T M V, KUIL T, LEONARDS P E G, et al. A 28-day oral dose toxicity study in Wistar rats enhanced to detect endocrine effects of decabromodiphenyl ether (decaBDE)[J]. Toxicol Lett, 2008, 179(1): 6-14. doi: 10.1016/j.toxlet.2008.03.003
[40] WANG B, WANG H, XIAO D, et al. In vitro effects of brominated flame retardants, selected metals and their mixtures on ethoxyresorufin-O-deethylase activity in Mossambica tilapia liver[J]. Ecotoxicol Environ Saf, 2018, 161: 350-355. doi: 10.1016/j.ecoenv.2018.05.084
[41] 黄志斐, 马胜伟, 张喆, 等. BDE3胁迫对翡翠贻贝 (Perna viridis) SOD、MDA和GSH的影响[J]. 南方水产科学, 2012, 8(5): 25-30. doi: 10.3969/j.issn.2095-0780.2012.05.004 [42] XIE Z, LU G, QI P. Effects of BDE-209 and its mixtures with BDE-47 and BDE-99 on multiple biomarkers in Carassius auratus[J]. Environ Toxicol Pharmacol, 2014, 38(2): 554-561. doi: 10.1016/j.etap.2014.08.008
[43] YANG J, ZHU J, CHAN K M. BDE-99, but not BDE-47, is a transient aryl hydrocarbon receptor agonist in zebrafish liver cells[J]. Toxicol Appl Pharmacol, 2016, 305: 203-215. doi: 10.1016/j.taap.2016.06.023
[44] SHARIFIAN S, HOMAEI A, KAMRANI E, et al. New insights on the marine cytochrome P450 enzymes and their biotechnological importance[J]. Int Biol Macromol, 2020, 142: 811-821. doi: 10.1016/j.ijbiomac.2019.10.022
[45] SÁNCHEZ-OCAMPO E M, AZUELA G E, SALAS M S, et al. Alterations in viability and CYP1A1 expression in SH SY5Y cell line by pollutants present in Madín Dam, Mexico[J]. Sci Total Environ, 2020, 719: 137500. doi: 10.1016/j.scitotenv.2020.137500
[46] LI Z, ZHONG L, MU W, et al. Effects of chronic exposure to tributyltin on tissue specific cytochrome P450 1 regulation in juvenile common carp[J]. Xenobiotica, 2016, 46(6): 511-515. doi: 10.3109/00498254.2015.1092618
[47] CAPPELLETTI N, SPERANZA E, TATONE L, et al. Bioaccumulation of dioxin-like PCBs and PBDEs by detritus-feeding fish in the Rio de la Plata estuary, Argentina[J]. Environ Sci Pollut Res Int, 2015, 22(9): 7093-7100. doi: 10.1007/s11356-014-3935-z
[48] KUIPER R V, BERGMAN Å, VOS J G, et al. Some polybrominated diphenyl ether (PBDE) flame retardants with wide environmental distribution inhibit TCDD-induced EROD activity in primary cultured carp (Cyprinus carpio) hepatocytes[J]. Aquat Toxicol, 2004, 68(2): 129-139. doi: 10.1016/j.aquatox.2004.03.005
[49] WHAL M, LAHNI B, GUENTHER R, et al. A technical mixture of 2, 2', 4, 4'-tetrabromo diphenyl ether (BDE47) and brominated furans triggers aryl hydrocarbon receptor (AhR) mediated gene expression and toxicity[J]. Chemosphere, 2008, 73: 209-215. doi: 10.1016/j.chemosphere.2008.05.025
[50] MERSON R R, KARCHNER S I, HAHN M E. Interaction of fish aryl hydrocarbon receptor paralogs (AHR1 and AHR2) with the retinoblastoma protein[J]. Aquat Toxicol, 2009, 94(1): 47-55. doi: 10.1016/j.aquatox.2009.05.015
[51] ROY N K, CANDELMO A, DELLATORRE M, et al. Characterization of AHR2 and CYP1A expression in Atlantic sturgeon and shortnose sturgeon treated with coplanar PCBs and TCDD[J]. Aquat Toxicol, 2018, 197: 19-31. doi: 10.1016/j.aquatox.2018.01.017
-
期刊类型引用(11)
1. 姜晓娜,胡雪松,石潇丹,葛彦龙,李池陶,程磊,石连玉,贾智英. 不同月龄镜鲤“龙科11号”形态性状对体质量的通径分析. 水产学杂志. 2024(06): 59-65+103 .  百度学术
百度学术
2. 刘康,韦玲静,张盛,莫飞龙,卢玉典,杨宾兰,甘宝江,廖愚,肖珊. 不同规格百色黑鲤的形态性状与体质量的相关性及通径分析. 江西水产科技. 2024(06): 10-15 .  百度学术
百度学术
3. 刘艳超,陈锋,魏聪,李建川. 2种规格弧唇裂腹鱼幼鱼形态性状对体质量的相关性及通径分析. 安徽农学通报. 2022(06): 98-101 .  百度学术
百度学术
4. 胡静,周胜杰,杨蕊,陈旭,杨其彬,马振华. 眼斑双锯鱼仔稚鱼发育异速生长. 水生生物学报. 2020(04): 844-852 .  百度学术
百度学术
5. 李振通,田永胜,唐江,成美玲,马文辉,庞尊方,李文升,刘江春,王晓梅,翟介明. 云龙石斑鱼与云纹石斑鱼、珍珠龙胆石斑鱼的生长性状及对比分析. 水产学报. 2019(04): 1005-1017 .  百度学术
百度学术
6. 苟盼盼,王秀利,窦冬雨,荆笛,刘圣聪,刘福君,刘海金,杨君,孟雪松,仇雪梅. 红鳍东方鲀不同家系群体的形态性状差异与相关性分析. 大连海洋大学学报. 2019(05): 674-679 .  百度学术
百度学术
7. 赵旺,江淼,陈明强,林凤昊,杨蕊,于刚,孟祥君,马振华. 离岸养殖与陆基养殖尖吻鲈形态性状与体质量的相关性研究. 海洋学报. 2018(08): 53-62 .  百度学术
百度学术
8. 赵旺,杨蕊,胡静,杨其彬,马振华,于刚. 5月龄斜带石斑鱼形态性状对体质量影响的通径分析. 大连海洋大学学报. 2017(05): 557-562 .  百度学术
百度学术
9. 赵旺,胡静,马振华,于刚,杨蕊,王理. 尖吻鲈幼鱼形态性状对体质量影响的通径分析及生长曲线拟合. 南方农业学报. 2017(09): 1700-1707 .  百度学术
百度学术
10. 赵旺,于刚,王江勇,严俊贤,杨蕊,吴开畅. 7月龄方斑东风螺形态性状对体质量的通径分析. 海洋科学. 2017(11): 82-88 .  百度学术
百度学术
11. 王兰梅,朱文彬,董在杰,苏胜彦,傅建军,阎明信,刘念. 福瑞鲤选育家系不同养殖阶段的生长差异分析. 南方水产科学. 2017(01): 43-49 .  本站查看
本站查看
其他类型引用(4)



 下载:
下载:









 粤公网安备 44010502001741号
粤公网安备 44010502001741号
