Effect of taurine on intestinal microbes and immune function in golden pompano (Trachinotus ovatus)
-
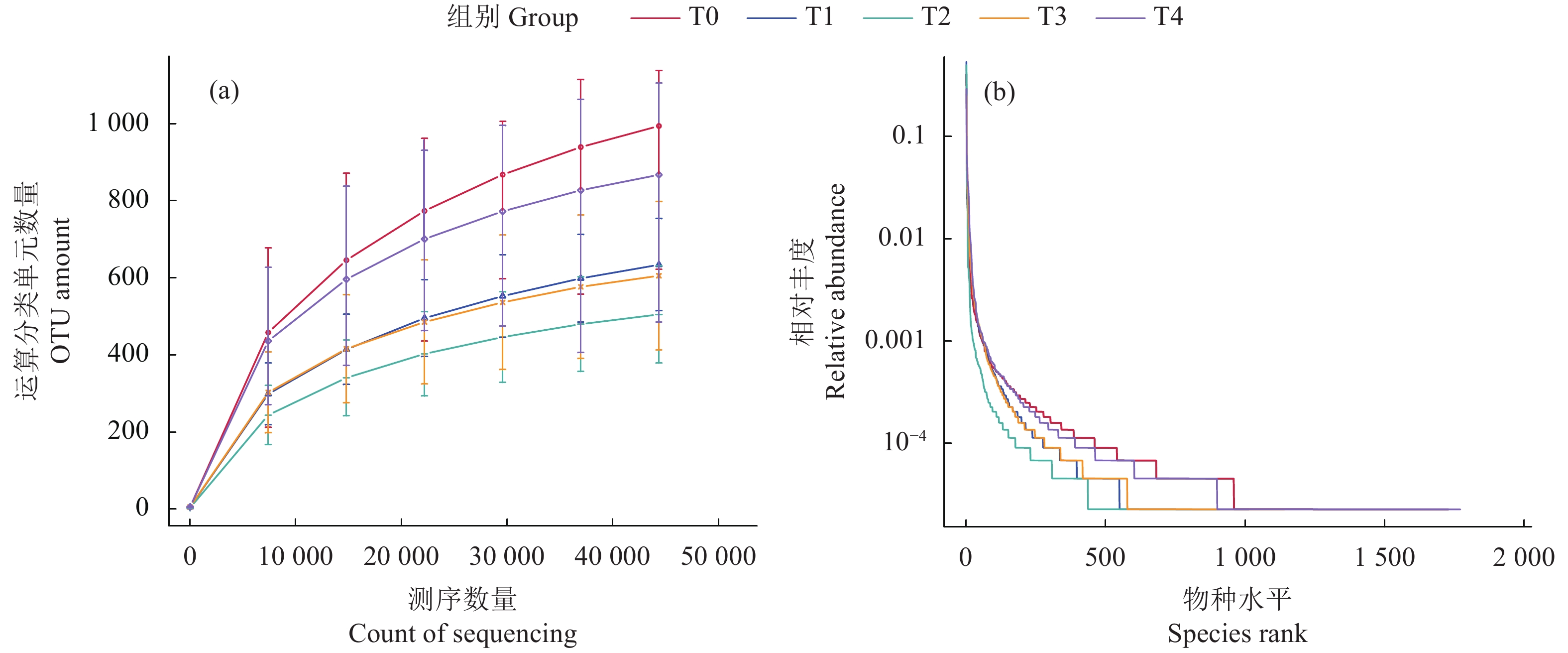
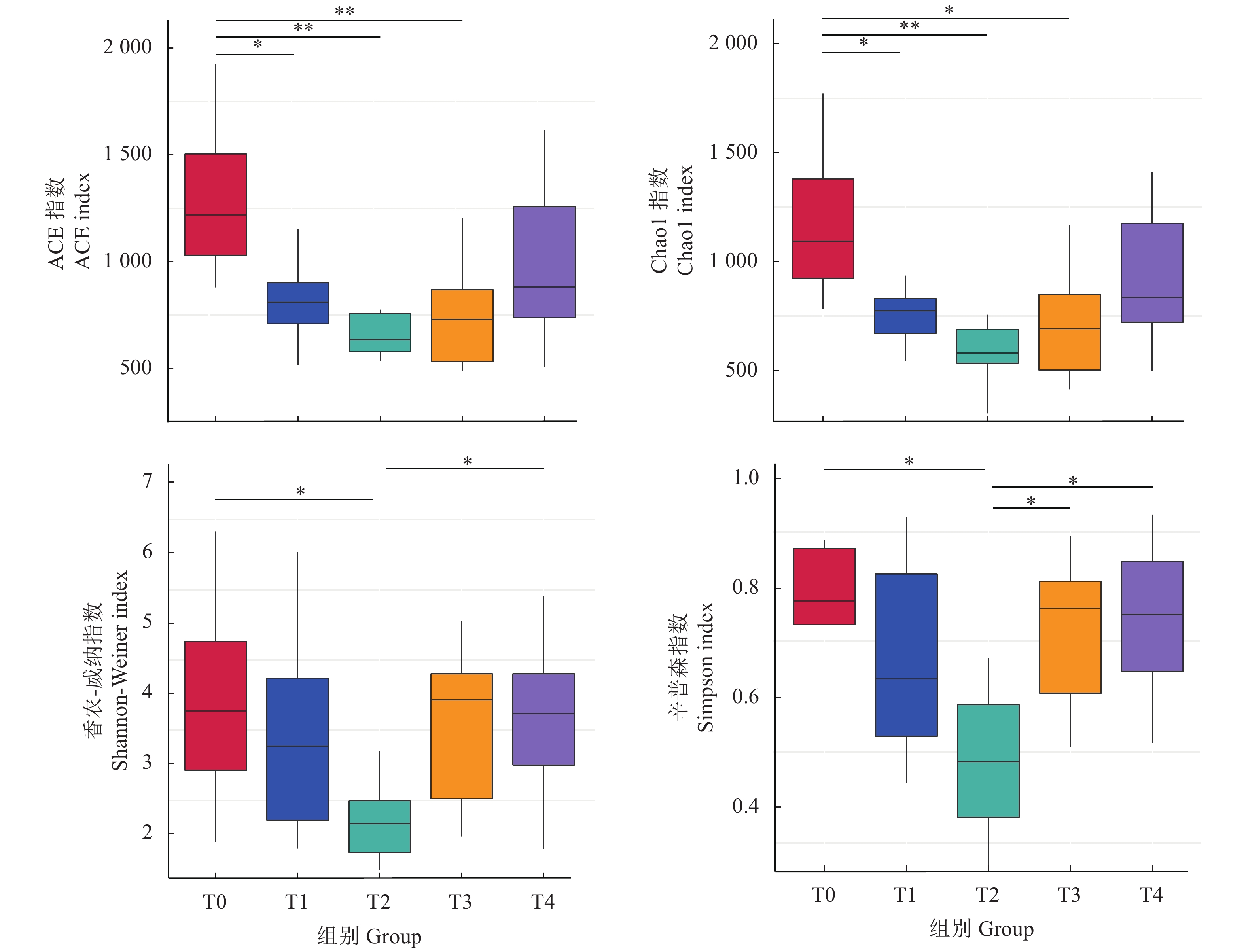
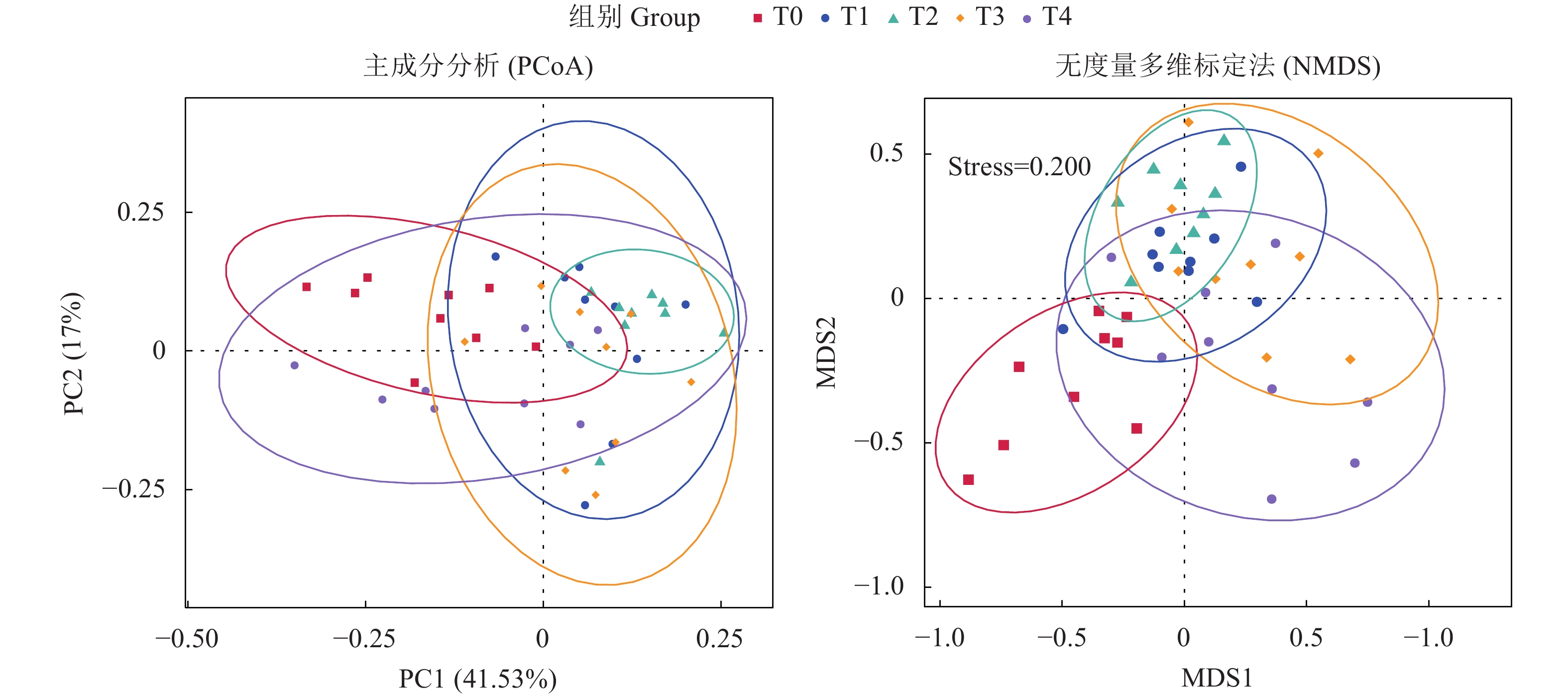
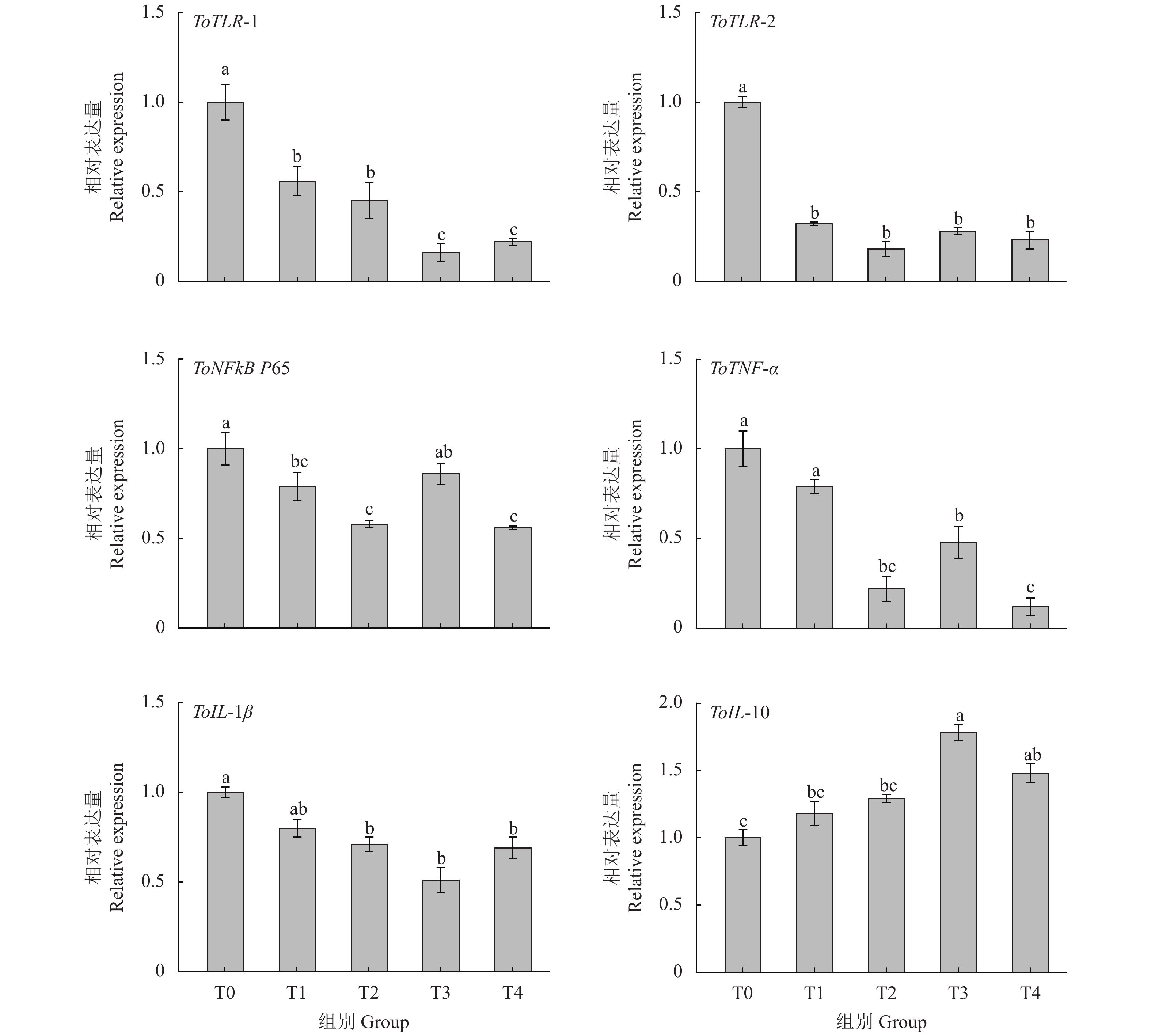
摘要: 为了探讨牛磺酸对卵形鲳鲹 (Trachinotus ovatus) 肠道微生物菌群结构和免疫功能的影响,试验以鱼粉、发酵豆粕和玉米蛋白粉为基础蛋白源配制了牛磺酸质量分数分别为1.3 g·kg−1 (T0)、4.4 g·kg−1 (T1)、7.4 g·kg−1 (T2)、10.5 g·kg−1 (T3)、12.7 g·kg−1 (T4)的等氮等脂饲料。将750尾卵形鲳鲹 (81.0±0.5) g随机分为5组 (每组150尾,分为3个平行),试验为期56 d。高通量测序结果显示在卵形鲳鲹肠道内共获得87 707条序列,能够注释到数据库的OTUs数目为5 130 (95.32%),在门水平上,变形菌门、软壁菌门、螺旋体门为优势菌群。Alpha和Beta多样性分析表明,T2组中的肠道微生物丰富度和多样性最低,T1和T4组间物种组成差异较大 (P<0.05)。随外源性牛磺酸的添加,血清溶菌酶活性显著提高,补体C4和免疫球蛋白含量显著增加 (P<0.05);各试验组ToTLR-1、ToTLR-2、ToTNF-α和ToIL-1β基因表达量显著降低 (P<0.05);T1、T2和T4组的ToNFkB P65基因表达量显著低于对照组 (P<0.05);T3和T4组ToIL-10基因表达量显著高于对照组 (P<0.05)。该试验结果显示,外源牛磺酸对卵形鲳鲹肠道微生物菌群和免疫功能具有显著影响。Abstract: In order to investigate the effects of taurine on the intestinal microflora structure and immune function of Trachinotus ovatus, we used fish meal, fermented soybean meal and corn gluten meal as the basic protein sources to prepare the nitrogen and fat feed with taurine contents of 1.3 g·kg−1 (T0), 4.4 g·kg−1 (T1), 7.4 g·kg−1 (T2), 10.5 g·kg−1 (T3), 12.7 g·kg−1 (T4), respectively. Seven hundred and fifty individuals of T. ovatus with an average body mass of (80.0±0.5) g were randomly devided into five groups with three replicates of fifty fish, and the experiment lasted 56 d. Sequencing results show that a total of 87 707 sequences had been obtained in the intestine of T. ovatus. The number of OTUs that can be annotated to the database was 5 130 (95.32%). At phylum level, Proteobacteria, Tenericutes and Spirochaetes were the predominant phyla. Alpha diversity and beta diversity analyses show that the richness and diversity of intestinal microbial in T2 group were the lowest and the species composition was significantly different between T1 and T4 groups (P<0.05). The serum lysozyme activity, C4, and Ig increased significantly with the addition of exogenous taurine (P<0.05). The expression of ToTLR-1, ToTLR-2, ToTNF-α and ToIL-1β in each group decreased significantly (P<0.05). The expression of ToNFkB P65 of T1, T2 and T4 groups was significantly lower than that of the control group (P<0.05), while the expression of ToIL-10 of T3 and T4 groups was significantly higher than that of control group (P<0.05). The results indicate that exogenous taurine has a significant impact on intestinal microflora and immune function.
-
Keywords:
- Trachinotus ovatus /
- Taurine /
- Intestinal microbes /
- Immune function
-
中国对虾 (Fenneropenaeus chinensis),又名中国明对虾、明虾,体型大,价格昂贵,是黄、渤海区重要的经济虾类之一。其蛋白质含量高,富含镁 (Mg)、铁 (Fe) 等多种微量元素,营养价值高[1]。中国对虾在贮运流通过程中易发生黑变,严重影响商品价值。研究表明,虾体中的酪氨酸在有氧条件下经酚氧化酶 (Phenoloxidase, PO) 催化生成L-3,4-二羟基苯丙氨酸 (Levodopa, L-DOPA),进一步生成醌类化合物,而醌类物质极不稳定,可自发聚合生成黑色素,或者与蛋白质官能团交联生成黑色素,导致黑变发生[2]。虾的防黑保鲜一直是国内外研究的热点,目前虾类保鲜除控制温度外,主要采用化学方法。生产中常用亚硫酸盐类、4-己基间苯二酚 (4-hexylresorcinol, 4-HR) 等化学试剂来延缓虾的黑变。GB 2760—2014《食品添加剂使用标准》明确规定了焦亚硫酸钠和4-HR的残留限量,即虾体内二氧化硫 (SO2) 残留量不得超过0.1 g·kg−1,4-HR残留量不得超过1 mg·kg−1。国内外学者对亚硫酸盐类[3-5]和4-HR[6-7]在虾类防黑保鲜中的应用进行了系列研究,发现在限量范围内,亚硫酸盐和4-HR的防黑效果有限,且过量使用则可能产生安全问题[8]。近年来的相关研究多聚于一些天然植物提取物,如植物多酚[9]、石榴皮提取物[10]、绿茶提取物[11]等,在抑制虾类黑变方面表现出较大的应用潜力。将这些天然植物提取物与焦亚硫酸钠、4-HR等复配使用,有助于解决单一成分防黑效果不理想的问题[12]。
本研究在GB 2760限定范围内对具有潜在防黑作用的物质进行筛选,将常用的焦亚硫酸钠、4-HR与筛选确定的天然植物提取物进行复配,通过正交试验确定了复合防黑保鲜剂的最优配比,并对其在中国对虾防黑保鲜方面的应用效果进行了验证。研究结果为虾类绿色高效防黑保鲜剂的开发与应用提供参考。
1. 材料与方法
1.1 材料与试剂
鲜活中国对虾购于青岛市崂山区沙子口码头,体长 (19.7±1.25) cm,体质量 (62.5±10.0) g,充氧保活条件下2 h内运至实验室,经暂养后流水冲洗,然后加冰猝死,置于无菌样品袋中备用。
石榴皮提取物 (纯度为90%)、葡萄籽提取物 (纯度为95%) (均为食品级) 购自陕西昊辰生物科技有限公司;竹叶抗氧化物 (食品级) 购自河南豫中生物科技有限公司;三氯乙酸 (TCA)、抗坏血酸、焦亚硫酸钠、硫代巴比妥酸 (TBA)、4-己基间苯二酚 (均为分析纯) 购自国药集团化学试剂有限公司。
1.2 仪器与设备
METTLER TOLEDO (梅特勒托利多) 分析天平 (苏州赛恩斯仪器有限公司);T18高速分散机 (德国IKA公司);SHA-B恒温振荡器 (常州国语仪器制造有限公司);5PX-25085H-II生化培养箱 (上海新苗医疗器械有限公司)。
1.3 方法
1.3.1 对虾酚氧化酶的提取与纯化
参照Zhang等[13]的方法提取酚氧化酶粗酶,并略作调整。将虾的头胸部经液氮冷冻后研磨成粉,按照1∶3 (m∶v) 的比例将头胸部粉末与缓冲液 [0.05 mol·L−1、pH 7.2磷酸盐缓冲液,含0.2% (w) Brij-35和1 mol·L–1氯化钠 (NaCl)] 混合,4 ℃下搅拌30 min,过滤,将上清液于4 ℃、8 000 r·min–1离心30 min,过滤,得到的上清液即为粗酶液。
参照Sae-Leaw和Benjakul[14]的方法对酚氧化酶粗酶进行纯化。称取一定质量的硫酸铵固体加入到酚氧化酶粗酶液中,使其质量分数达50%,静置30 min后于8 000 r·min–1条件下离心30 min,去除上清液,收集沉淀于透析袋中透析24 h,期间更换3次透析液,透析结束后进行浓缩,8 000 r·min–1离心30 min,除去不溶物。经硫酸铵沉淀后的粗酶液上样于弱阴离子交换柱DEAE Sepharose Fast Flow (1.6 cm×25 cm),用0.05 mol∙L–1的磷酸盐 (pH 7.2) 清洗柱至A280 nm小于0.05,分别使用含0.1、0.2、0.3、0.4、0.5 mol·L–1 NaCl的磷酸盐缓冲液 (0.05 mol·L–1, pH 7.2) 进行洗脱,流速1 mL·min–1,测定各管的酚氧化酶活性,将有酚氧化酶活性和蛋白峰的管分别合并,利用超滤管对其除盐浓缩后置于−80 ℃中保存备用。
1.3.2 不同物质对酚氧化酶活性的影响
参照Nirmal等[15]的方法并略有改动。将不同质量浓度 (1.0、3.0、5.0、7.0、10.0 g·L–1) 的抗坏血酸、竹叶抗氧化物、石榴皮提取物、葡萄籽提取物与酚氧化酶溶液按1∶1 (v∶v)的比例混合,室温下反应30 min后与底物L-DOPA溶液 (15 mmol·L–1,去离子水溶解) 混合,45 ℃水浴中孵育3 min,测定其475 nm处的动力学曲线。对照组以去离子水代替。试验结果以相对于酚氧化酶最大酶活的百分比表示。1个酶活力单位(U)定义为,在475 nm波长下,单位体积酶溶液 (mL) 在单位时间 (min) 内使酶促反应吸光度值增加0.001,用U·mL–1酶液表示。
1.3.3 复合保鲜剂配比优化
预试验发现,焦亚硫酸钠溶液质量浓度不超过15 g·L–1时,处理对虾体内的SO2残留量低于0.1 g·kg–1;4-HR溶液质量浓度不超过50 mg·L–1时,4-HR残留量不高于1 mg·L–1。基于预试验结果,并参照文献[12],选取抗坏血酸、竹叶抗氧化物、焦亚硫酸钠、4-HR,分别设置质量浓度为1.0~5.0 g·L–1、1.0~5.0 g·L–1、13.0~15.0 g·L−1、30.0~50.0 mg·L–1。采用4因素、3水平L9 (34) 正交试验 (表1) 对复合保鲜剂的配比进行优化。以中国对虾酚氧化酶活性为指标,对照组以去离子水代替,每组取3次平行样。
表 1 复合保鲜剂配方正交试验设计Table 1 Orthogonal experiment design of compound anti-blackening preservative水平
LevelA:抗坏血酸
Ascorbic acid/(g·L–1)B:竹叶抗氧化物
Bamboo leaf antioxidant/(g·L–1)C:焦亚硫酸钠
Sodium metabisulfite/(g·L–1)D:4-HR
4-hexylresorcinol/(mg·L–1)1 1.0 1.0 13.0 30.0 2 3.0 3.0 14.0 40.0 3 5.0 5.0 15.0 50.0 1.3.4 复合保鲜剂的配制和使用
按1.3.3得到的复合保鲜剂的最佳配比配制成溶液,虾与保鲜剂的比例为1∶4 (m∶v),浸泡时间为1 min,浸泡后沥水2~3 min。
1.3.5 指标检测
按照1.3.4的方法处理后,于4 ℃条件下贮藏,分别在第0、第24、第48、第72、第96、第120、第144 小时取样,同时对照组以去离子水浸泡后于同一条件下取样,进行黑变评分并测定相关指标。
1.3.5.1 黑变评分
参考Montero等[6]的方法,由6名经培训的感官品评人员采用表2的标准对样品的黑变情况进行评分。
表 2 中国对虾黑变评分标准Table 2 Evaluation criteria for blakening of F. chinensis分值
Score黑变情况
Condition of blackening0 无黑变,即体表完全没有黑点 0.1~1.0 轻微黑变,即体表有少量黑点或整体黑变面积较小 1.1~2.0 中等黑变,即体表有较多的黑点或整体黑变面积稍大 2.1~3.0 严重黑变,即体表有大量黑点或整体黑变面积大 1.3.5.2 硫代巴比妥酸反应物 (Thiobarbituric acid reactive substance, TBARS) 值的测定
TBARS值的测定参照GB 5009.181—2016 《食品安全国家标准 食品中丙二醛的测定》中第二法 分光光度法,结果以mg·kg−1表示。
1.3.5.3 挥发性盐基氮 (Total volatile basic nitrogen, TVB-N) 值的测定
TVB-N值参照GB 5009.228—2016《食品中挥发性盐基氮的测定》中的微量扩散法测定,结果以mg·100 g–1表示。
1.3.5.4 菌落总数的测定
菌落总数参照GB 4789.2—2022《食品微生物学检验 菌落总数测定》,采用平板计数,计数单位为lg CFU·g–1。
1.3.5.5 微生物多样性分析
将经复合保鲜剂处理后的中国对虾于4 ℃条件下贮藏,分别在第0、第72、第144 小时取样,分析其微生物多样性。采用HTAB (Hexadecyltrimethy ammonium bromide) 法[16]从样本中提取基因组DNA,对16S rDNA的V3–V4区进行扩增,电泳检测PCR扩增产物的纯度,用QuantiFluorTM荧光计定量,将纯化的扩增产物等量混合,连接测序接头,构建测序文库,Illumina PE250上机测序 (由广州基迪奥生物科技有限公司协助完成)[17]。参照Huptas等[18]的方法筛选数据后进行聚类分析,将一致性超过95%的序列聚类为操作分类单位 (Operational taxonomic unit, OTU) 去除聚类比对过程中的嵌合体序列,得到最终有效数据,并进行OTU丰度统计分析。
1.3.6 数据处理
试验重复2次,每次取3次平行样,结果以“平均值±标准差 ($\bar x $±s)”表示。采用t-检验进行组间差异显著性分析,P<0.05为差异显著,P<0.01为差异极显著。使用Origin Pro 2022b软件作图。
2. 结果与分析
2.1 不同物质对酚氧化酶活力的抑制作用
抗坏血酸、葡萄籽提取物、石榴皮提取物、竹叶抗氧化物对酚氧化酶的抑制作用见图1。当抗坏血酸的质量浓度为3.0 g·L–1时,可抑制90%以上的酚氧化酶活性。抗坏血酸可以通过还原黑变过程中的中间产物-醌类物质来阻断黑变进程[19],抗坏血酸还可以作为竞争性抑制剂与酚氧化酶的双铜活性中心结合,减少酶与底物的接触,进而抑制黑变[20]。在试验选定的浓度范围内,葡萄籽提取物对酚氧化酶的抑制作用与其质量浓度几乎呈线性相关,但过高浓度的葡萄籽提取物溶液颜色过深,对虾的感官品质有不良影响,因此不适宜作为复合保鲜剂的配方。石榴皮提取物对酚氧化酶的抑制作用有限,当质量浓度提高至7.0 g·L–1时,也仅能将相对酶活控制在70%左右。竹叶抗氧化物质量浓度为3.0 g·L–1时几乎可以完全抑制酚氧化酶活性,竹叶提取物由黄酮、酚类、酸类等物质构成,具有良好的抑菌和抗氧化作用[21]。因此,后续试验选择抗坏血酸和竹叶抗氧化物作为复配组分。
2.2 复合保鲜剂的最优配比试验
将筛选出的抗坏血酸、竹叶抗氧化物与焦亚硫酸钠、4-HR复配,以酚氧化酶活性为指标进行正交试验 (表3)。结果显示极差:RC> RD> RA> RB,说明在选定的浓度范围内,对酚氧化酶活性影响大小依次为焦亚硫酸钠>4-HR>抗坏血酸>竹叶抗氧化物。较优方案为A2B3C3D3,即复合保鲜剂的最优配比为:抗坏血酸质量浓度3.0 g·L–1、竹叶抗氧化物质量浓度5.0 g·L–1、焦亚硫酸钠质量浓度15.0 g·L–1、4-HR质量浓度50.0 mg·L–1。
表 3 L9 (34) 正交试验结果Table 3 L9 (34) orthogonal test results序号
No.A:抗坏血酸
Ascorbic acidB:竹叶抗氧化物
Bamboo leaf antioxidantC:焦亚硫酸钠
Sodium metabisulfiteD:4-HR
4-hexylresorcinol酚氧化酶活性
PO activity/(U·L−1)1 1 1 1 1 115.00 2 1 2 3 2 46.67 3 1 3 2 3 85.00 4 2 1 3 3 24.67 5 2 2 2 1 103.33 6 2 3 1 2 81.67 7 3 1 2 2 96.67 8 3 2 1 3 110.00 9 3 3 3 1 51.67 K1 246.67 236.33 306.67 270.00 K2 209.67 260.00 285.00 225.00 K3 258.34 218.33 123.00 219.67 k1 82.22 78.78 102.22 90.00 k2 69.89 86.67 95.00 75.00 k3 86.11 72.78 41.00 73.22 R 48.67 23.67 162.00 50.33 2.3 防黑保鲜效果验证
2.3.1 黑变评分情况
中国对虾经复合保鲜剂处理后的黑变情况见图2。对照组在冷藏期间黑变评分迅速上升,贮藏第24小时,头胸和躯干部出现黑斑;第48小时黑变加重;第72小时黑斑遍布对虾全身,这与郭芳等[22]的观察结果基本一致。经复合保鲜剂处理后,中国对虾在整个贮藏期间的黑变评分均显著低于对照组 (P<0.05),尤其是前96 h仅发生了轻微黑变,即使在贮藏144 h后虾的感官品质也在可接受范围内,表明复合保鲜剂有效延缓了中国对虾黑变进程,这与其含有的抑菌成分和抗氧化成分有效抑制黑变过程中腐败菌的生长以及酚氧化酶氧化反应有关[23]。此外,徐扬等[24]和López-Caballero等[25]研究发现焦亚硫酸钠对虾类的黑变控制效果有限,仅在贮藏前期起到控制黑变的效果,贮藏后期 (4~5 d) 与未处理之间无显著性差异。然而,本研究中复合保鲜剂处理组在贮藏期内与对照组差异显著 (P<0.05),说明研制的复合保鲜剂的抑菌和抗氧化活性更强,从而抑制虾类黑变的效果更优,可有效延长虾类的货架期。
2.3.2 TBARS值变化情况
TBARS值可用于评估水产品的脂肪氧化程度,氧化程度越高,TBARS值越大[26]。中国对虾的初始TBARS值为0.067 mg·kg–1。冷藏过程中,两组对虾TBARS值的增长趋势相似 (图3-a)。相较对照组,处理组增长趋势较为缓慢,且在整个贮藏期间TBARS值均显著低于对照组 (P<0.05),表明复合保鲜剂能够有效延缓中国对虾脂质氧化,这与其中的抗坏血酸、竹叶抗氧化物等成分都具有良好的抗氧化作用有关[27-28],有效抑制了脂质氧化引起的对虾在贮藏过程中的品质劣变。杨峰等[29]通过对南极磷虾 (Euphausia superba) 的保鲜研究同样发现复配后的保鲜剂能够显著抑制脂质氧化,与单一抑黑剂相比效果更优。
2.3.3 TVB-N值变化情况
TVB-N值是评价水产品鲜度的重要指标[30]。中国对虾冷藏期间TVB-N值变化见图3-b。在冷藏过程中,两组样品的TVB-N值呈增加趋势。冷藏24 h以及后续的取样点,处理组的TVB-N值均显著低于对照组 (P<0.05)。根据GB 2733—2015,对虾的TVB-N的限量值为30.0 mg·100 g–1。冷藏第144 小时,对照组TVB-N值达32.65 mg·100 g–1,而此时此处理组TVB-N值仅为24.83 mg·100 g–1。复合保鲜剂中的成分对微生物的生长有抑制作用,减少了微生物对蛋白质的降解,导致TVB-N值增加缓慢,这与Gokoglu等[31]观察不同抑黑剂处理红虾 (Aristaeomorpha foliacea) 后的TVB-N值变化结果一致。此外,Senapati等[32]研究发现经4-HR处理后凡纳滨对虾 (Litopenaeus vannamei) 的TVB-N值低于焦亚硫酸钠处理组。加之,竹叶抗氧化物中的黄酮类化合物成分以及抗坏血酸低pH的特性使其均具有抑制微生物生长的作用[33-34],表明研制的复合保鲜剂可以更有效地控制中国对虾在贮藏过程中的品质变化。
2.3.4 菌落总数变化情况
菌落总数是评定水产品鲜度的重要指标,水产品腐败与微生物的生长繁殖密切相关[35]。如图3-c所示,对照组、处理组的初始菌落总数分别为2.69和2.45 lg CFU·g–1。在冷藏前48 h,两组对虾的菌落总数增长迅速,48 h后增长趋缓。冷藏过程中对照组的菌落总数均显著高于处理组 (P<0.05)。冷藏第120小时,对照组的菌落总数已达5.11 lg CFU·g–1,此时处理组的菌落总数仅为4.65 lg CFU·g–1,仍在一级鲜度范围内[36],说明复合保鲜剂能够在一定程度上抑制微生物的繁殖,这与复合保鲜剂中的4-HR[37]、焦亚硫酸钠[38]、竹叶抗氧化物[39]、抗坏血酸[40]4种组分均具备一定的抑菌作用有关。因此,研制的复合保鲜剂可有效延缓中国对虾的菌落总数升高,一定程度上延长了对虾的货架期。
2.3.5 菌群结构变化情况
中国对虾经复合保鲜剂处理后,在冷藏过程中的菌群结构变化情况见图4。第0天的对照组与处理组的初始菌群略有差别,对照组中别弧菌属 (Aliivibrio)、黏着杆菌属 (Tenacibaculum)、交替假单胞菌属 (Pseudoalteromonas) 比例相对较高,而处理组则是别弧菌属、黄杆菌属 (Flavobacterium)、弧菌属 (Vibrio) 比例占优。
对照组中的别弧菌属在贮藏前期比例迅速增加,第72小时达54%,而贮藏后期比例减少;发光杆菌属 (Photobacterium) 随冷藏时间的延长占比逐渐升高,第144小时占比增至45%,成为中国对虾的优势菌属。Kuuliala等[41]在大西洋银鳕 (Gadus morhua) 中也观察到发光杆菌属在冷藏过程中比例持续增长的现象,说明发光杆菌属可能是导致水产品腐败的重要菌属,其生长代谢产物是中国对虾冷藏后期不良气味形成的主要来源。处理组中的优势菌属为致腐能力相对较弱的别弧菌属,其比例随着贮藏时间的延长持续增加,而致腐能力较强的发光杆菌属在冷藏后期明显减少,表明复合保鲜剂可有效抑制发光杆菌属的繁殖。因此,复合保鲜剂的抑菌活性可达到延缓水产品在贮藏过程中快速腐败的目的。Peng等[42]研究表明一种新型的羟基吡喃酮-氨基硫脲衍生物对虾体内的副溶血性弧菌 (V. parahaemolyticus) 表现出强烈的抑菌活性,有效延长了虾类的货架期,与本研究结果相似。
3. 结论
本研究经对选取的多种具有抑黑作用的物质进行单因素试验和正交试验,最终确定复合防黑保鲜剂较优配比为:抗坏血酸质量浓度3.0 g·L–1、竹叶抗氧化物质量浓度5.0 g·L–1、焦亚硫酸钠质量浓度15.0 g·L–1、4-HR质量浓度50.0 mg·L–1。经复合保鲜剂处理后,中国对虾黑变被明显抑制,同时该保鲜剂具有抑制细菌生长、延缓脂质氧化的作用。微生物多样性分析结果表明,发光杆菌属和别弧菌属是中国对虾冷藏过程的优势菌属,而复合保鲜剂可以有效抑制发光杆菌属的生长繁殖。因此,研制的复合保鲜剂具有良好的抑黑保鲜效果,具有较好的应用前景。
-
表 1 细菌16S rDNA V3—V4可变区引物
Table 1 Bacterial 16S rDNA V3–V4 corresponding primers
引物名称
Primer name引物序列 (5'−3')
Primer sequence341F CCTAYGGGRBGCASCAG 806R GGACTACNNGGGTATCTAAT 表 2 卵形鲳鲹肠道免疫基因引物序列
Table 2 Real-time quantitative PCR primers for immune related genes in T.ovatus
引物名称
Primer name引物序列 (5'−3')
Primer sequence登录号
Accession No.用途
Amplification targetToTLR-1 F: GAACCTTCTGATGCTGAATCTG
R: TGCTCCAAGTGCTAATCTCTMG762971.1 qRT-PCR ToTLR-2 F: CTCCACCTTGCGATACCT
R: TCCAACACCTCCAGAGATGMG762972.1 qRT-PCR ToNFkB P65 F: GTTCGCATCTCGCTCGTAA
R: TGGCCTCATTCACATCCTTMN233364.1 qRT-PCR ToIL-1β F: GGAGACTGTGGAGGACAAGAGC
R: GCGGGCAGACATGAAGGTGMK224504.1 qRT-PCR ToIL-10 F: AGTCAGTCTCCACCCCCATCTT
R: GCCCACTGGAGTTCAGATGCTKY231908 qRT-PCR ToTNF-α F: GGCGTCGTTCAGAGTCTCCT
R: TCCTCCTGGGCAGTGGTTT[24] qRT-PCR EF-1α F: CCCCTTGGTCGTTTTGCC
R: GCCTTGGTTGTCTTTCCGCTA[22] 内参 表 3 牛磺酸对卵形鲳鲹血清免疫指标的影响
Table 3 Effect of taurine on serum immune parameters of T. ovatus
指标
Index组别 Group T0 T1 T2 T3 T4 补体C3 C3/(g·L−1) 0.13±0.45 0.14±0.02 0.15±0.21 0.16±0.48 0.16±0.13 补体C4 C4/(g·L−1) 0.17±0.25b 0.23±0.14ab 0.24±0.81ab 0.26±0.60a 0.24±0.64ab 溶菌酶 LZM/(U·mL−1) 175.91±21.08c 194.30±17.42bc 204.30±15.72b 253.18±18.79a 211.29±12.96b 免疫球蛋白A IgA/(g·L−1) 0.39±0.74b 0.51±0.16ab 0.46±0.16ab 0.64±0.21a 0.48±0.18ab 免疫球蛋白G IgG/(g·L−1) 1.16±0.19b 1.27±0.46ab 1.44±0.68ab 2.01±0.78a 1.59±0.71ab 免疫球蛋白M IgM/(g·L−1) 1.94±0.63 2.51±0.66 2.61±0.68 3.07±1.21 2.78±0.91 注:同行数据不同小写字母表示差异显著 (P<0.05) Note: Values in the same column with different letters are significantly different (P<0.05) -
[1] SALZE G P, DAVIS D A. Taurine: a critical nutrient for future fish feeds[J]. Aquaculture, 2015, 437: 215-229. doi: 10.1016/j.aquaculture.2014.12.006
[2] YU H, GUO Z, SHEN S, et al. Effects of taurine on gut microbiota and metabolism in mice[J]. Amino Acids, 2016, 48(7): 1601-1617.
[3] BAEZA-ARIÑO R, MARTÍNEZ-LLORENS S, NOGALES-MÉRIDA S, et al. Study of liver and gut alterations in sea bream Sparus aurata L., fed a mixture of vegetable protein concentrates[J]. Aquacult Res, 2016, 47(2): 460-471.
[4] SILVA P F, MCGURK C, KNUDSEN D L, et al. Histological evaluation of soya bean-induced enteritis in Atlantic salmon (Salmo salar L.): quantitative image analysis vs. semi-quantitative visual scoring[J]. Aquaculture, 2015, 445: 42-56.
[5] 郝甜甜, 王际英, 李宝山, 等. 复合动植物蛋白部分替代鱼粉对大菱鲆幼鱼生长、体成分及生理生化指标的影响[J]. 渔业科学进展, 2019, 40(4): 11-20. [6] 徐志强, 豆腾飞, 赵平, 等. 植物蛋白替代鱼粉饲料中添加精氨酸对丝尾鳠生长、血液生化及肠道组织结构的影响[J]. 云南农业大学学报(自然科学), 2020, 35(2): 251-261. [7] LIM S, LEE K. Partial replacement of fish meal by cottonseed meal and soybean meal with iron and phytase supplementation for parrot fish Oplegnathus fasciatus[J]. Aquaculture, 2009, 290(3/4): 283-289.
[8] 曹逸铭, 高勤峰, 董双林, 等. 饲料中肉骨粉和豆粕替代鱼粉对虹鳟生长和氮收支的影响[J]. 中国海洋大学学报(自然科学版), 2019, 49(3): 79-85. [9] 王亚军, 林文辉, 杨智慧, 等. 发酵豆粕部分替代鱼粉对日本鳗鲡生长性能和体内矿物元素的影响[J]. 南方水产科学, 2013, 9(3): 39-43. doi: 10.3969/j.issn.2095-0780.2013.03.007 [10] HIEN T T T, BE T T, LEE C M, et al. Development of formulated diets for snakehead (Channa striata and Channa micropeltes): can phytase and taurine supplementation increase use of soybean meal to replace fish meal?[J]. Aquaculture, 2015, 448: 334-340.
[11] RIMOLDI S, FINZI G, CECCOTTI C, et al. Butyrate and taurine exert a mitigating effect on the inflamed distal intestine of European sea bass fed with a high percentage of soybean meal[J]. Fish Aquat Sci, 2016, 19(4): 1-14.
[12] YAN L C, FENG L, JIANG W D, et al. Dietary taurine supplementation to a plant protein source-based diet improved the growth and intestinal immune function of young grass carp (Ctenopharyngodon idella)[J]. Aquacult Nutr, 2019, 25(4): 873-896.
[13] 解文放, 左玉, 李庆伟, 等. 动物肠道菌群与宿主肠道免疫系统相互作用的研究进展[J]. 中国细胞生物学学报, 2017, 39(11): 1467-1472. doi: 10.11844/cjcb.2017.11.0203 [14] GONG Y N, WANG X, WANG J, et al. Chemical probing reveals insights into the signaling mechanism of inflammasome activation[J]. Cell Res, 2010, 20(12): 1289-1305. doi: 10.1038/cr.2010.135
[15] MIAO J, ZHENG L, ZHANG J, et al. The effect of taurine on the toll-like receptors/nuclear factor kappa B (TLRs/NF-κB) signaling pathway in Streptococcus uberis-induced mastitis in rats[J]. Int Immunopharmacol, 2011, 11(11): 1740-1746. doi: 10.1016/j.intimp.2011.06.008
[16] KIM C, CHA Y N. Taurine chloramine produced from taurine under inflammation provides anti-inflammatory and cytoprotective effects[J]. Amino Acids, 2014, 46(1): 89-100. doi: 10.1007/s00726-013-1545-6
[17] 孙立元, 郭华阳, 朱彩艳, 等. 卵形鲳鲹育种群体遗传多样性分析[J]. 南方水产科学, 2014, 10(2): 67-71. doi: 10.3969/j.issn.2095-0780.2014.02.010 [18] ZHAO W, XIE J, FANG H, et al. Effects of corn starch level on growth performance, antioxidant capacity, gut morphology and intestinal microflora of juvenile golden pompano, Trachinotus ovatus[J]. Aquaculture, 2020, 524: 735197. doi: 10.1016/j.aquaculture.2020.735197
[19] SHEN J, LIU H, TAN B, et al. Effects of replacement of fishmeal with cottonseed protein concentrate on the growth, intestinal microflora, haematological and antioxidant indices of juvenile golden pompano (Trachinotus ovatus)[J]. Aquacult Nutr, 2020, 26(4): 1119-1130. doi: 10.1111/anu.13069
[20] 李秀玲, 刘宝锁, 张楠, 等. 发酵豆粕替代鱼粉对卵形鲳鲹生长和血清生化的影响[J]. 南方水产科学, 2019, 15(4): 68-75. doi: 10.12131/20190041 [21] MA Q W, GUO H Y, ZHU K C, et al. Dietary taurine intake affects growth and taurine synthesis regulation in golden pompano, Trachinotus ovatus (Linnaeus 1758)[J]. Aquaculture, 2021, 530: 735918.
[22] ZHAO C, GUO H, ZHU K, et al. Molecular characterization of Na+/K+/2Cl− cotransporter 1 alpha from Trachinotus ovatus (Linnaeus, 1758) and its expression responses to acute salinity stress[J]. Comp Biochem Physiol B, 2018, 223: 29-38.
[23] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. doi: 10.1006/meth.2001.1262
[24] SUN B, LEI Y, CAO Z, et al. TroCCL4, a CC chemokine of Trachinotus ovatus, is involved in the antimicrobial immune response[J]. Fish Shellfish Immunol, 2019, 86: 525-535. doi: 10.1016/j.fsi.2018.11.080
[25] 张家松, 段亚飞, 张真真, 等. 对虾肠道微生物菌群的研究进展[J]. 南方水产科学, 2015, 11(6): 114-119. doi: 10.3969/j.issn.2095-0780.2015.06.016 [26] MIYAZAKI T, SASAKI S I, TOYODA A, et al. Impaired bile acid metabolism with defectives of mitochondrial-tRNA taurine modification and bile acid taurine conjugation in the taurine depleted cats[J]. Sci Rep, 2020, 10(1): 4915.
[27] HUANG C, GUO Y, YUAN J. Dietary taurine impairs intestinal growth and mucosal structure of broiler chickens by increasing toxic bile acid concentrations in the intestine[J]. Poult Sci, 2014, 93(6): 1475-1483. doi: 10.3382/ps.2013-03533
[28] 张建斌, 车向荣, 陈娟娟. 谷氨酰胺和牛磺酸对断奶仔猪肠道黏膜酶活性的影响[J]. 家畜生态学报, 2019, 40(11): 29-33. doi: 10.3969/j.issn.1673-1182.2019.11.006 [29] 李秀玲, 刘宝锁, 刘波, 等. 不同脂肪源对卵形鲳鲹肠道微生物菌群的影响[J]. 水产科学, 2020, 39(1): 88-95. [30] REVECO F E, ØVERLAND M, ROMARHEIM O H, et al. Intestinal bacterial community structure differs between healthy and inflamed intestines in Atlantic salmon (Salmo salar L.)[J]. Aquaculture, 2014, 420/421: 262-269.
[31] HOOPER L V, WONG M H, THELIN A, et al. Molecular analysis of commensal host-microbial relationships in the intestine[J]. Science, 2001, 291(5505): 881-884. doi: 10.1126/science.291.5505.881
[32] GAYLORD T G, TEAGUE A M, BARROWS F T. Taurine supplementation of all-plant protein diets for rainbow trout (Oncorhynchus mykiss)[J]. J World Aquacult Soc, 2006, 37(4): 509-517. doi: 10.1111/j.1749-7345.2006.00064.x
[33] LAZADO C C, CAIPANG C M A. Mucosal immunity and probiotics in fish[J]. Fish Shellfish Immunol, 2014, 39(1): 78-89.
[34] DEHGHANI R, OUJIFARD A, MOZANZADEH M T, et al. Effects of dietary taurine on growth performance, antioxidant status, digestive enzymes activities and skin mucosal immune responses in yellowfin seabream, Acanthopagrus latus[J]. Aquaculture, 2020, 517: 734795. doi: 10.1016/j.aquaculture.2019.734795
[35] LI M, LAI H, LI Q, et al. Effects of dietary taurine on growth, immunity and hyperammonemia in juvenile yellow catfish Pelteobagrus fulvidraco fed all-plant protein diets[J]. Aquaculture, 2016, 450: 349-355.
[36] 徐奇友, 许红, 郑秋珊, 等. 牛磺酸对虹鳟仔鱼生长、体成分和免疫指标的影响[J]. 动物营养学报, 2007, 19(5): 544-548. doi: 10.3969/j.issn.1006-267X.2007.05.005 [37] WEI Y C, PAN T S, CHANG M X, et al. Cloning and expression of Toll-like receptors 1 and 2 from a teleost fish, the orange-spotted grouper Epinephelus coioides[J]. Vet Immunol Immunopathol, 2011, 141(3/4): 173-182.
[38] ARLEEVSKAYA M I, LARIONOVA R V, BROOKS W H, et al. Toll-like receptors, infections, and rheumatoid arthritis[J]. Clin Rev Allergy Immunol, 2020, 58(2): 172-181. doi: 10.1007/s12016-019-08742-z
[39] WALCZEWSKA M, BIAŁECKA A, GACOŃ A, et al. Effect of selected biofilm inhibitors, N-acetylcysteine and DNase, on some biological properties of taurine haloamines (TauCl and TauBr)[J]. Eur J Immunol, 2013, 38(4): 434-442.
-
期刊类型引用(1)
1. 程思忠,谢岩黎,孙淑敏,马卫宾,李倩,杨玉辉. 黄曲霉毒素B_1降解菌的筛选鉴定及降解酶挖掘. 食品安全质量检测学报. 2023(04): 1-7 .  百度学术
百度学术
其他类型引用(3)



 下载:
下载:






 粤公网安备 44010502001741号
粤公网安备 44010502001741号
