Study on microstructure and growth characteristics of Uroteuthis edulis statolith in East China Sea
-
摘要:
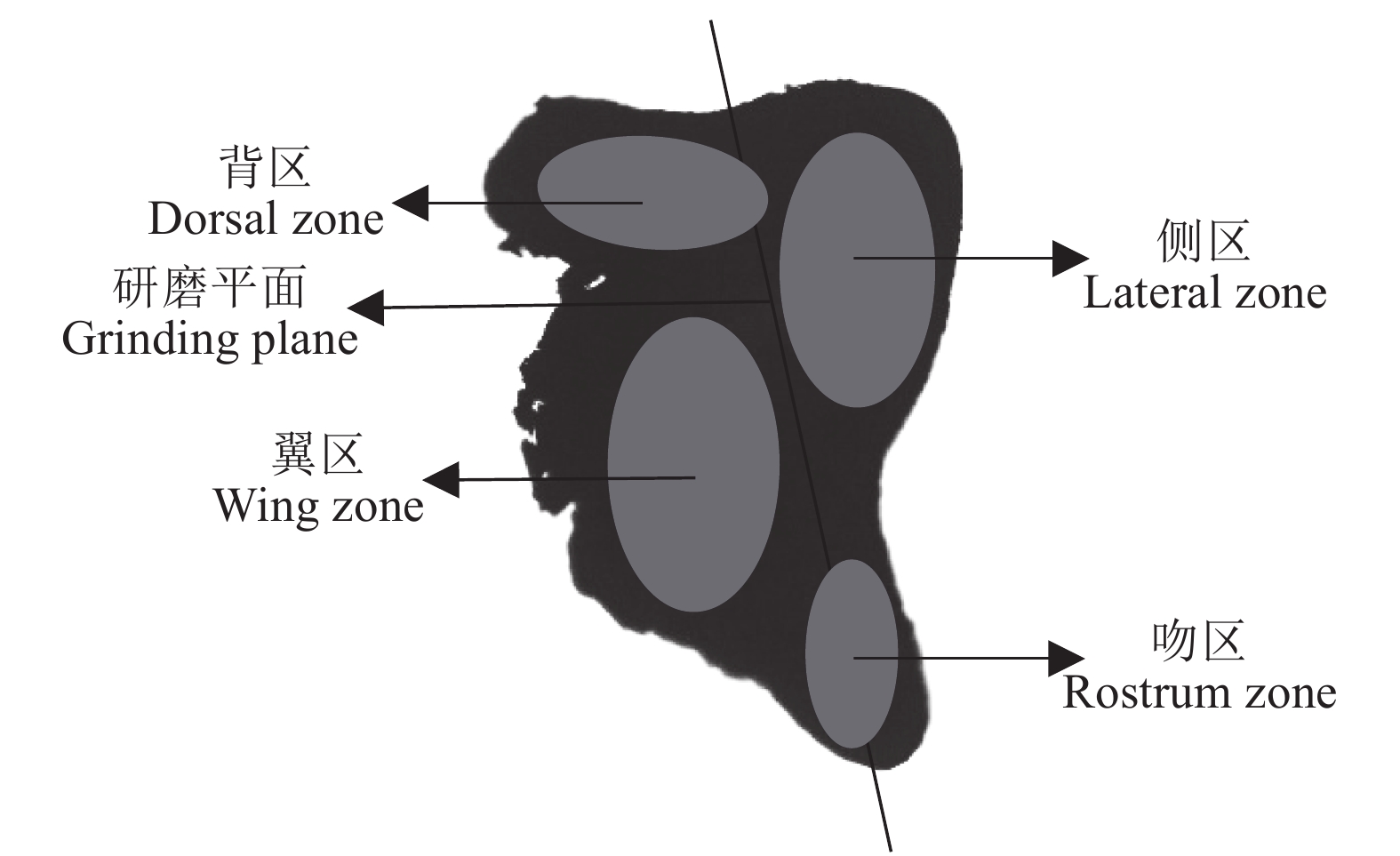
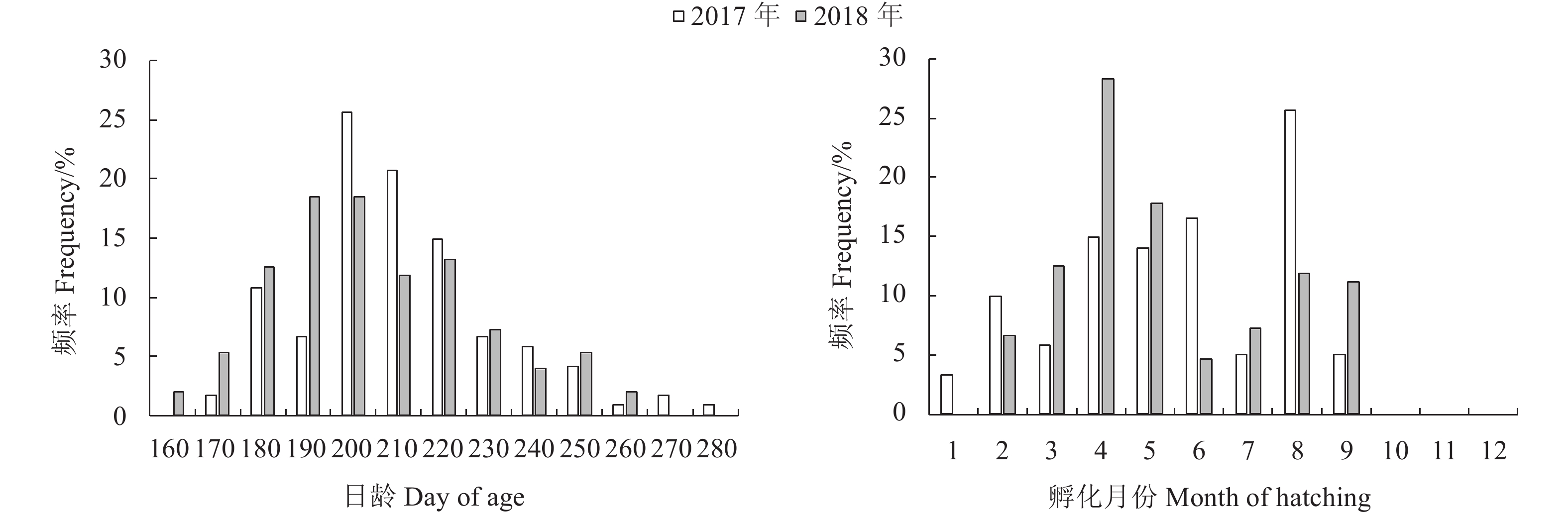
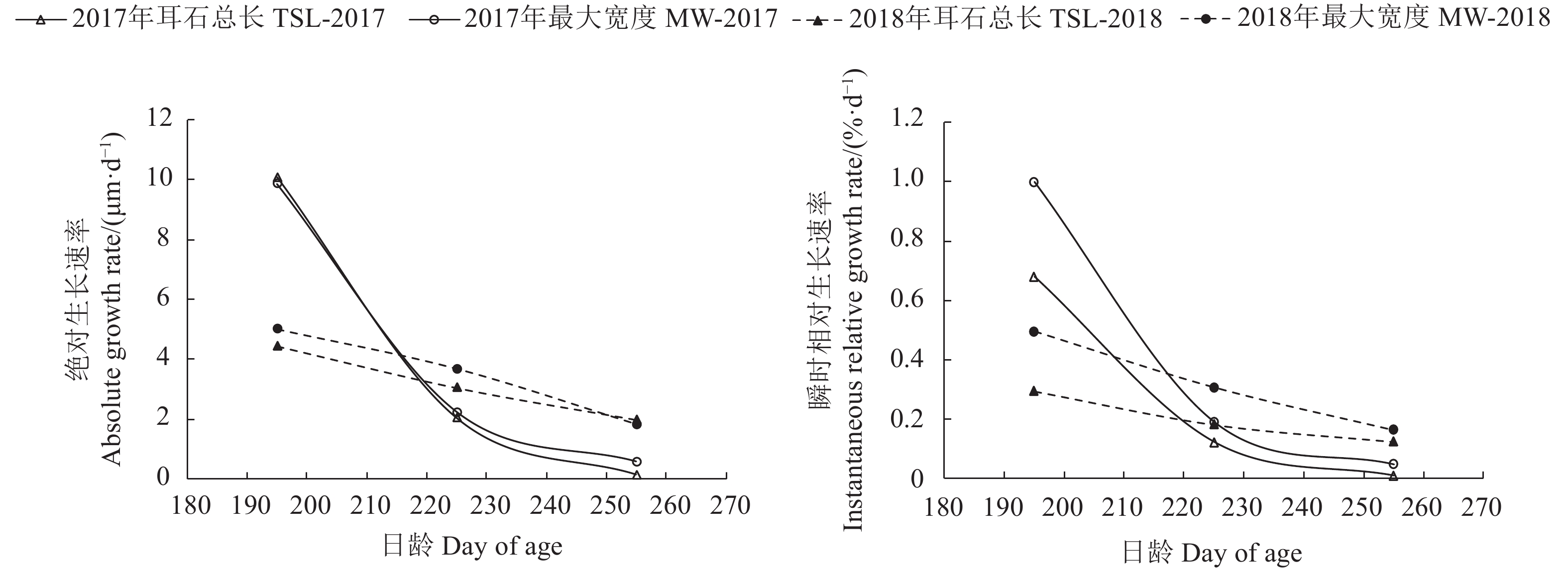
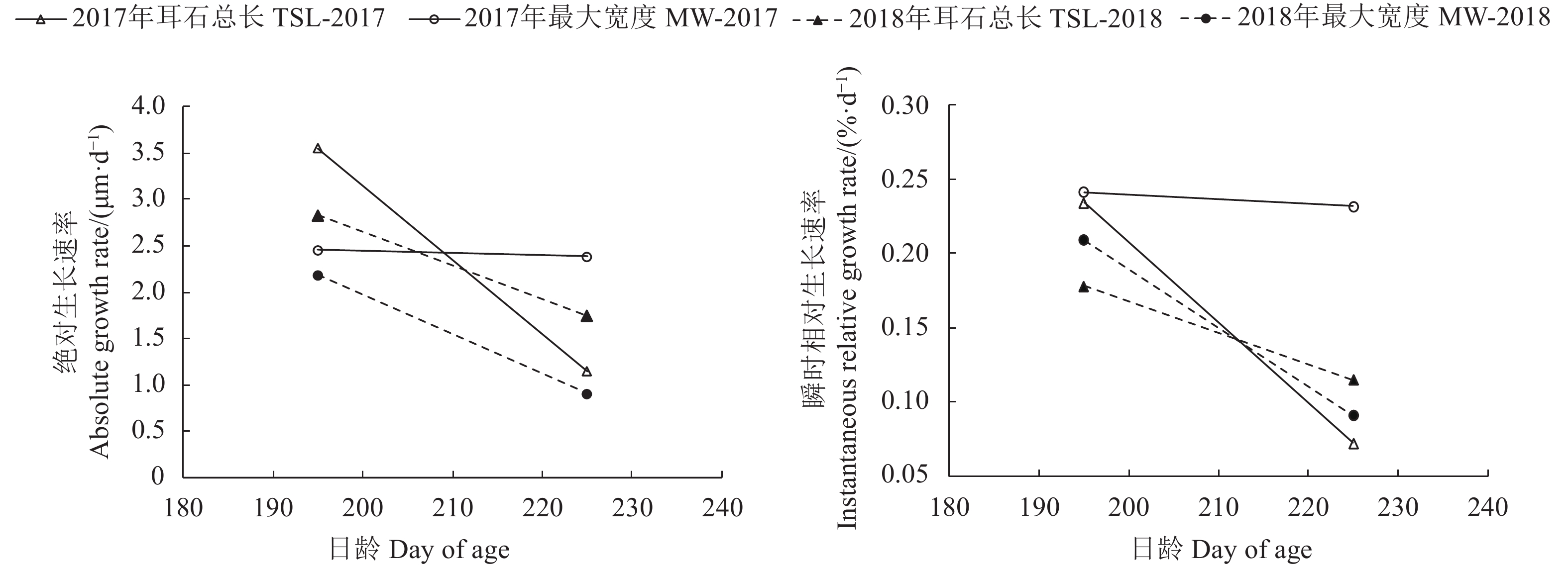
文章根据2017年和2018年9月至翌年3月在东海采集的剑尖枪乌贼 (Uroteuthis edulis) 样本,对其耳石形态进行观察与测量,并结合日龄信息对耳石微结构及生长特征进行了研究。结果表明,耳石生长纹由明暗相间的环纹组成,依据生长纹的宽度及亮度划分为后核心区、暗区和外围区。通过耳石日龄进行逆推发现春、夏产卵群体为优势群体,优势群体间耳石各形态参数差异显著 (P<0.05)。主成分分析表明,耳石总长 (TSL) 和最大宽度 (MW) 可作为表征春、夏产卵群体耳石长度和宽度的指标。春、夏产卵群体TSL生长模型采样年间差异均显著 (P<0.05),春季产卵群体分别以逻辑斯蒂和对数生长模型拟合最佳,夏季产卵群体以逻辑斯蒂和线性拟合最佳。春、夏产卵群体MW生长模型采样年间差异均不显著 (P>0.05),以逻辑斯蒂生长模型拟合最佳,性别间差异不显著 (P>0.05)。180~240 d,春季产卵群体TSL和MW的生长速率均大于夏季产卵群体。
Abstract:Based on Uroteuthis edulis samples collected from September 2017 to March 2018 and from September 2018 to March 2019, we observed the statolith morphology, and studied the microstructure and growth characteristics of the otolith. The results show that the statolith growth increments were composed of light and dark rings, and could be divided as postnuclear zone, dark zone and peripheral zone according to their width and brightness. According to the statolith age, the spawning population in spring and summer was the dominant cohort, and the morphological variables of the statolith between the two cohorts were significantly different (P<0.05). Principal component analysis shows that the total length (TSL) and maximum width (MW) of the otoliths could be used as indicators to characterize the length and width of statoliths in spring and summer spawning cohorts. The TSL growth function of the spring and summer spawning cohorts was significantly different in the two years (P<0.05). The former best fitted with Logistic and logarithmic growth functions, and the latter best fitted with Logistic and linear functions. The MW growth function of the spawning population in spring and summer showed no significant difference (P>0.05). The logistic growth function was the best fit and the gender difference was not significant (P>0.05). During the 180~240 days, the growth rate of spring and summer spawning cohorts both showed a downward trend, and the growth rates of TSL and MW in spring spawning cohorts were greater than those in summer.
-
Keywords:
- Uroteuthis edulis /
- statolith /
- Microstructure /
- Growth characteristics /
- East China Sea
-
富山武装乌贼 (Enoploteuthis chunii) 最早发现于日本海富山湾,是一种小型头足类,其活动范围很广,昼深夜浅[1],在中国、韩国海域内也有分布[2]。富山武装乌贼作为西太平洋海洋食物网的重要一环,是海洋哺乳动物和鱼类的重要食饵,常被大量发现于条纹原海豚 (Stenella caeru-leoalba) [3]、太平洋蓝鳍金枪鱼 (Thunnus orientalis)[4]的胃中。目前国内外学者对其相关研究较少,Hong[2]研究了富山武装乌贼的形态信息,但针对其生长规律、摄食习惯等其他信息的研究仍是空白。头足类生长发育过程中角质颚的形态大小、色素沉积等表型特征的变化与其摄食习性的转变息息相关[5-7]。因此,了解和掌握富山武装乌贼角质颚的生长发育规律,不仅有利于掌握其个体发育期摄食生态的变化,也有助于进一步研究其在海洋生态系统中的地位和作用。
角质颚是研究头足类的重要硬组织,作为头足类的摄食器官,有着结构稳定、不易腐蚀等优点[8-11]。除此之外,角质颚还储藏了头足类丰富的个体生长信息 [12-14]。刘必林等[12]研究了智利外海茎柔鱼 (Dosidicus gigas) 角质颚微结构,探讨了其生长规律;林静远等[13]分析了剑尖乌贼 (Uro-teuthis edulis) 的日龄及生长;方舟等[14]研究了北太平洋柔鱼 (Ommastrephes bartramii) 的角质颚形态,认为环境因素也会对角质颚生长产生影响。角质颚的色素沉积情况也是研究生长的重要依据,陆化杰等[15]分析了中国南海西沙群岛海域鸢乌贼 (Sthenoeuthis oualaniensis) 色素沉积等级与胴长、体质量、性腺成熟度和角质颚形态参数的生长关系,陈炫妤等[16]也通过此方法对西北印度洋鸢乌贼的色素沉积进行了研究。且由于富山武装乌贼昼夜垂直活动的生活习性为西太平洋众多生物提供了饵料,因此不同水层生活的鱼类胃中均能发现其角质颚,研究其角质颚的表型特征与生长的关系有助于研究西北太平洋海洋生物间的食物网关系。本研究将富山武装乌贼角质颚形态参数及色素沉积面积变化与胴长结合,通过研究其表型变化分析生长发育规律。
本研究根据2019年上海海洋大学“淞航号”在西太平洋海域进行渔业资源调查时采集的样本,通过研究富山武装乌贼角质颚的各部分形态指标及色素沉积面积的变化特点,结合胴长分析其不同个体发育时期的生长特点及规律,可为后续研究其捕食者的摄食规律提供相关资料,也可根据其捕食者胃含物中富山武装乌贼的数量来估算其在西太平洋的资源量[17-18]。另外,本研究还结合富山武装乌贼摄食习性的变化分析了不同胴长组角质颚表型变化差异的原因。
1. 材料与方法
1.1 材料
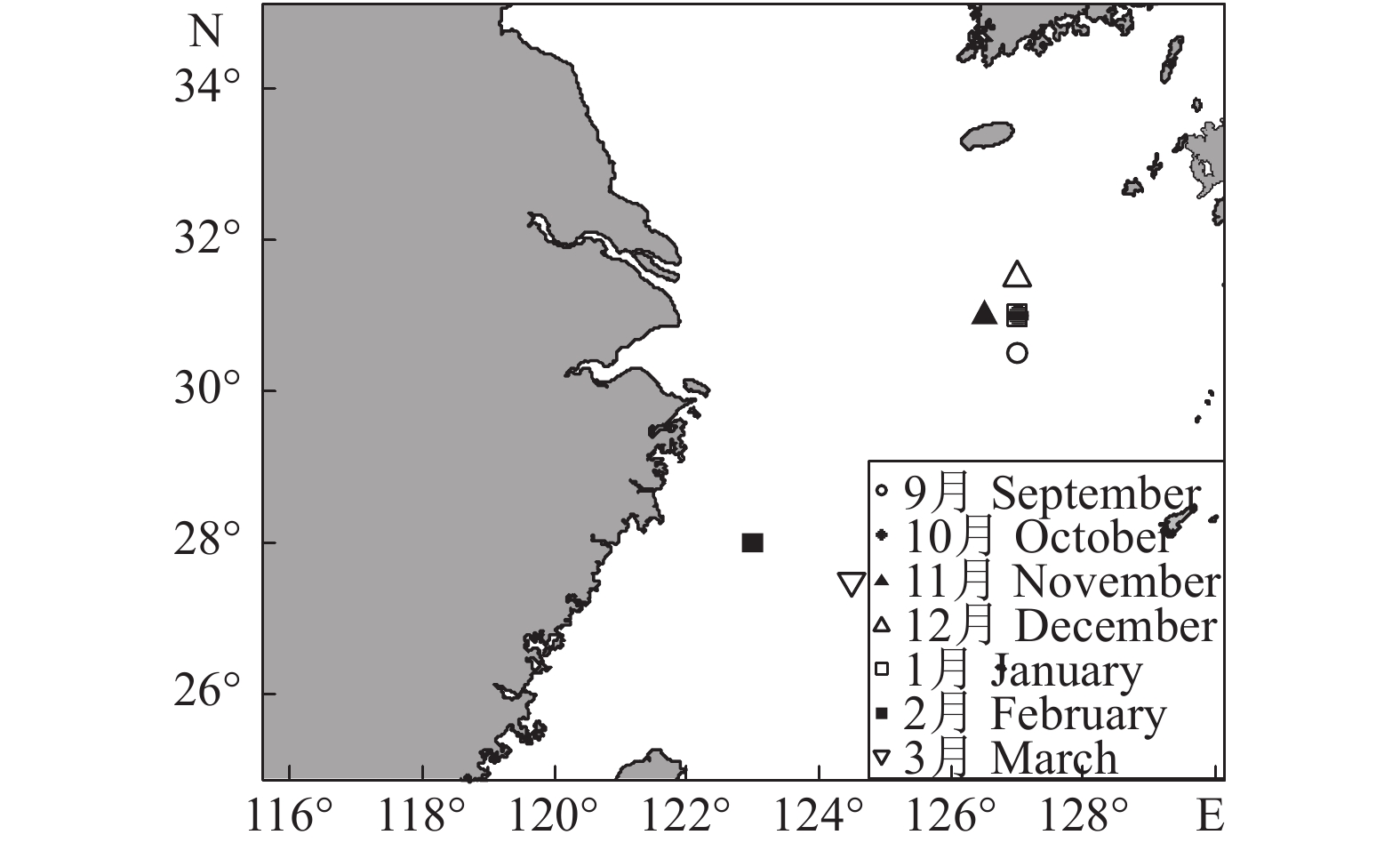
富山武装乌贼样本由上海海洋大学“淞航号”远洋渔业资源调查船于2019年3月和9月采自西北太平洋海域 (148°00'E—148°10'E, 31°99'N—38°76'N),共91尾 (表1)。样品在实验室进行解冻及清洗处理后,使用游标卡尺测量其胴长 (Mantel length, ML),精确到1 mm。从头部提取角质颚,清洗后存放于含75%乙醇的离心管中[18]。
表 1 富山武装乌贼采样信息Table 1. Sampling information of E. chunii采样海域
Sampling
sea area采样日期
Sampling
date样品数量
Sample
size胴长范围
Mantle length
range/mm148°00'E, 33°00'N 2019年3月21日 25 32~62 148°00'E, 31°99'N 2019年3月23日 4 43~49 148°10'E, 38°76'N 2019年9月5日 62 18~45 1.2 数据处理方法
1.2.1 拍照及图片处理
使用体视显微镜OLYMPUSSZ61对角质颚的侧视图进行拍照,拍取的照片用 Photoshop CS 6.0 (Adobe Systems Inc.,2019) 对图像进行亮度、对比度和去噪声等处理。
1.2.2 角质颚长度测定
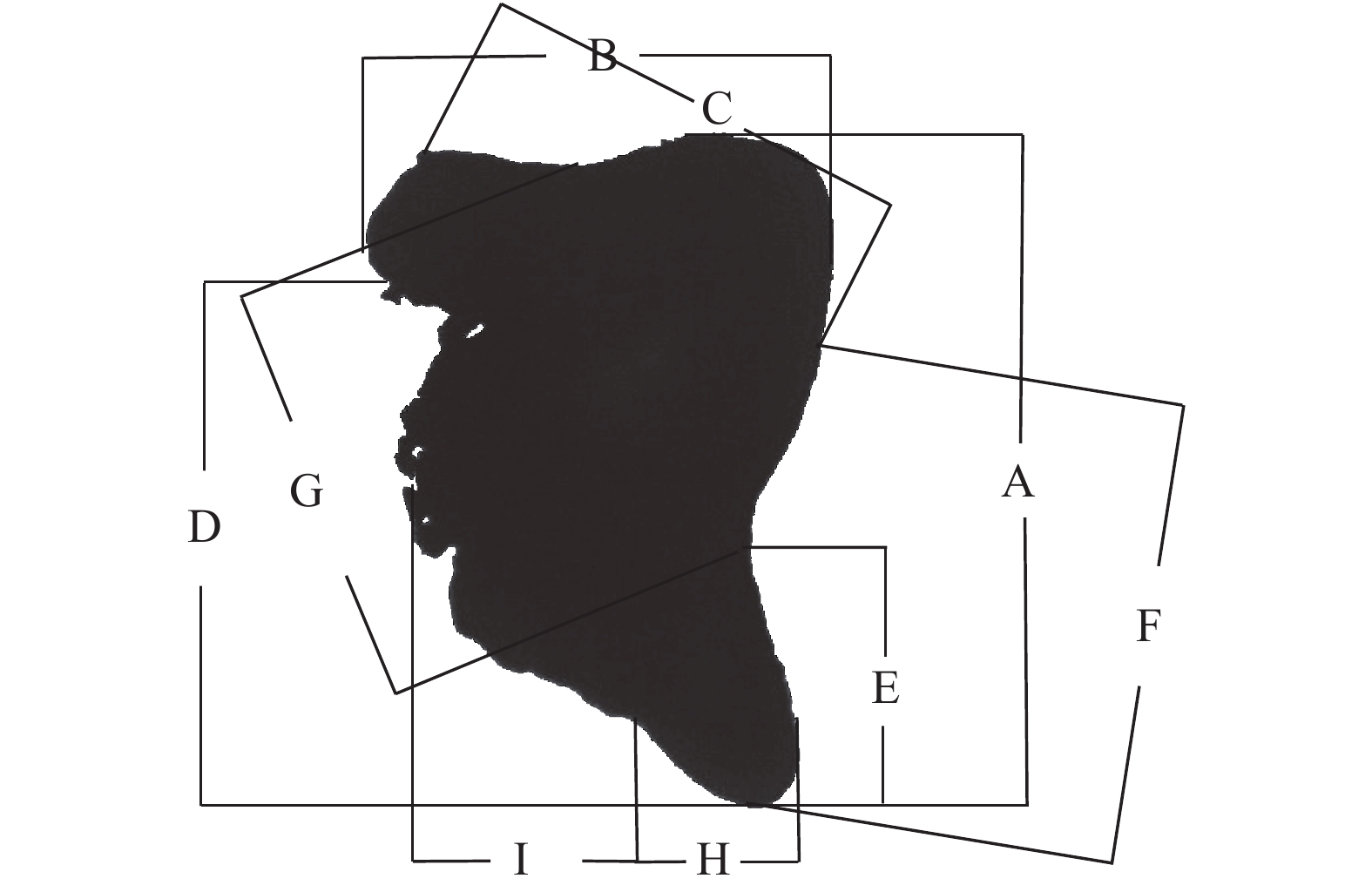
使用生物图像处理软件Digimizer测量角质颚形态学指标,包括上头盖长 (Upper hood length, UHL)、上脊突长 (Upper crest length, UCL)、上喙长 (Upper rostrum length, URL)、上侧壁长 (Upper lateral wall length, ULWL)、上翼长 (Upper wing length, UWL)、下头盖长 (Lower hood length, LHL)、下脊突长 (Lower crest length, LCL)、下喙长 (Lower rostrum length, LRL)、下侧壁长 (Lower lateral wall length, LLWL)、下翼长 (Lower wing length, LWL) (图1),测量结果精确到0.01 mm[19]。
1.2.3 角质颚色素面积计算
根据角质颚色素沉积情况,将其分为2个区域,色素沉积较深的部分为Ⅰ区,色素沉积较浅的部分为Ⅱ区 (图2)。由于通过拍照将角质颚转换为图片形式进行测量,因此其色素沉积面积均为实际的投影面积,使用Photoshop测量角质颚色素沉积面积,计算其占角质颚总面积的比例。
1.2.4 统计分析
分别采用线性、指数、幂函数、对数关系对富山武装乌贼角质颚长度与胴长进行拟合,根据最小AIC原则选择最适方程[20]。采用单因素方差分析法 (One-way ANOVA) 对不同胴长组富山武装乌贼角质颚长度和色素沉积进行差异性分析,显著水平P=0.05 [21]。
2. 结果
2.1 角质颚长度与胴长总体关系
富山武装乌贼角质颚各项形态参数随着胴长增加逐渐增大 (表2)。根据AIC原则分析显示,角质颚长度与胴长呈显著的线性关系 (图3),其方程式为:
表 2 富山武装乌贼角质颚形态参数值Table 2. Morphometric parameters of beak of E. chunii mm形态指标
Morphologic
index最大值
Maximum最小值
Minimum均值
Mean标准差
Standard
deviation上头盖长 UHL 6.16 3.34 4.48 0.86 上脊突长 UCL 8.68 4.57 6.14 1.18 上喙长 URL 2.18 0.87 1.45 0.31 上侧壁长 ULWL 7.09 3.56 4.95 0.98 上翼长 UWL 3.36 1.55 2.38 0.50 下头盖长 LHL 3.25 1.87 1.47 0.32 下脊突长 LCL 3.43 1.69 2.32 0.44 下喙长 LRL 2.60 1.01 1.60 0.38 下侧壁长 LLWL 6.45 3.33 4.56 0.92 下翼长 LWL 4.12 1.90 2.60 0.52 YML=0.072 3XUHL−2.008 (R2=0.730 3, N=91)
YML=0.099 8XUCL−2.721 1 (R2=0.735 8, N=91)
YML=0.023 4XURL−0.649 (R2=0.602 5, N=91)
YML=0.083 5XULWL−2.094 (R2=0.743 3, N=91)
YML=0.042 4XUWL−0.928 2 (R2=0.746, N=91)
YML=0.026 1XLHL−0.570 7 (R2=0.703 8, N=91)
YML=0.038 2XLCL−1.013 3 (R2=0.772 7, N=91)
YML=0.031 2XLRL−0.529 7 (R2=0.697 2, N=91)
YML=0.079XLLWL−1.855 2 (R2=0.752 8, N=91)
YML=0.042 7XLWL−1.142 1 (R2=0.692 2, N=91)
2.2 角质颚色素沉积面积与胴长的关系
根据最小AIC原则分析显示,角质颚色素沉积面积随胴长总体呈线性增长趋势 (图4)。
上颚色素沉积面积与胴长关系式为:
Y上1=0.002 4XML−0.112 2 (R2=0.395 4, N=91)
Y上2=0.006 1XML+0.112 9 (R2=0.594 9, N=91)
下颚色素沉积面积与胴长关系式为:
Y下1=0.005 2XML+0.121 1 (R2=0.422 4, N=91)
Y下2=0.002 9XML+0.106 2 (R2=0.396 6, N=91)
2.3 角质颚表型变化分析
2.3.1 角质颚各项形态参数变化
富山武装乌贼角质颚各项形态参数随着角质颚生长总体呈上升趋势,各项形态指标在31、41、62 mm处发生明显的跃变 (图5)。ANOVA进一步分析发现,角质颚各项形态指标在18~31 mm、32~41 mm、>42 mm均存在显著的组间差异 (P<0.05)。
2.3.2 角质颚色素沉积面积占比变化
富山武装乌贼角质颚色素沉积由喙部开始向侧壁延伸,呈依次减少的趋势,由深变浅,且随着胴长增加其色素覆盖面积也逐步增加;上颚头盖、下颚头盖和下颚侧壁在胴长32 mm处色素沉积发生跃变,上颚侧壁在胴长43 mm处色素沉积突变明显 (图6)。ANOVA进一步分析发现,角质颚上颚头盖Ⅰ区、上颚Ⅰ、Ⅱ区色素沉积在18~31 mm、>42 mm两个胴长组间存在显著性差异 (P<0.05),上颚侧壁Ⅰ、Ⅱ区色素沉积在18~41 mm、>42 mm两个胴长组间存在显著性差异 (P<0.05)。上颚头盖Ⅱ区色素沉积随胴长增加不断变化,胴长组间无明显差异,随着角质颚生长,在胴长介于31~40 mm,上、下颚色素沉积面积增加明显。
2.3.3 个体发育期角质颚表型变化
根据角质颚长度和色素沉积度可按胴长将富山武装乌贼分为A组(18~31 mm)、B组(32~41 mm)、C组(>42 mm)共3组 (表3)。胴长18~31 mm时,上颚喙部相对较短,上、下颚侧壁色素沉积面积较小,色素沉积程度较浅,下颚翼部无色素沉积,下颚侧壁脊不明显;胴长31~41 mm时,上颚喙部长度增加且变尖,上下颚侧壁及头盖部分色素沉积明显增加,下颚翼部有轻微色素沉积,下颚侧壁脊略明显;胴长>42 mm时,上颚喙部尖且长,上、下颚色素沉积面积变大,程度加深,下颚翼部有明显色素沉积,下颚侧壁脊明显 (图7)。
表 3 角质颚表型变化信息Table 3. Information of beak phenotype change胴长组
Mantle length
group/mm上颚 Upper beak 下颚 Lower beak 喙部
Beak侧壁色素沉积面积
Pigmentation area of
lateral wall翼部色素沉积面积
Pigmentation area
of wing侧壁脊
Ridge of
lateral wall侧壁色素沉积面积
Pigmentation area of
lateral wall18~31 较长 24% 无沉积 不明显 42% 32~41 尖且长 36% 较小 略明显 64% 42~62 尖且长 51% 较大 明显 65% 3. 讨论
3.1 角质颚大小、色素沉积与胴长关系
最小AIC分析显示,角质颚各项形态参数和胴长呈显著的线性相关,这与南海北部秋季杜氏枪乌贼 (U. duvaucelii) [22]、印度洋西北海域鸢乌贼[23]结果相似。分析关系式斜率发现,角质颚各部分生长也存在一定差异,斜率越小就代表其生长越快。富山武装乌贼UCL、ULWL、LLWL斜率分别为0.099 8、0.083 5、0.079,因此上颚脊突部、侧壁部及下颚侧壁部生长较快。角质颚不同部位的生长速度与其摄食习惯相关,上、下颚的脊突部与侧壁部在富山武装乌贼摄食活动中主要起支撑作用,快速生长可方便其咬合食物[24]。
角质颚色素沉积面积占比随胴长总体也呈增长趋势,这与阿根廷滑柔鱼 (Illex argentinus) 和秘鲁外海茎柔鱼的研究结果相似。方舟等[25]分析阿根廷滑柔鱼角质颚色素变化及其与个体生长等因素的关系,发现色素沉积的平均等级总体上随着其生长而增加;胡贯宇等[26]发现上喙长和下翼长是影响角质颚色素沉积等级的主要因素,且角质颚各形态参数与角质颚色素沉积等级呈正相关关系。
3.2 个体发育期角质表型变化
在个体发育的不同阶段,角质颚的增长速度也有不同。研究结果显示胴长18~31 mm角质颚生长较缓慢,胴长32~41 mm角质颚生长较快,胴长>42 mm角质颚生长速度又逐渐减缓 (图5),这与柔鱼从仔鱼到稚鱼再到成鱼的生长规律相符[27]。根据已有的研究资料显示,19 mm富山武装乌贼为仔鱼幼体 [4];胴长38 mm的希氏武装乌贼 (E. higginsi) 为雌性未成熟个体,胴长62 mm的琼氏武装乌贼 (E. jonesi) 为成熟个体[28]。希氏武装乌贼、琼氏武装乌贼与富山武装乌贼同为武装乌贼属,因此本研究胴长18~31 mm富山武装乌贼处于仔稚鱼期,胴长32~41 mm处于未成熟的幼鱼期,胴长>42 mm慢慢处于成鱼期。仔鱼期时,头足类摄食小型浮游动物、营养需求有限,因而角质颚发育较慢;稚鱼期时,个体快速生长需提高摄食量,以获取足够丰富的营养;成鱼期时,个体发育逐渐变大,发育逐渐趋于成熟,生长速度也逐渐趋于稳定,摄食习惯相对固定,因此其角质颚变化速度逐渐下降[29-31]。
在个体发育的不同阶段,角质颚的色素沉积也不同。研究结果显示,富山武装乌贼角质颚上颚头盖、下颚头盖和下颚侧壁在胴长32 mm处色素沉积发生跃变,上颚侧壁在胴长43 mm处色素沉积跃变明显 (图6)。结合个体发育期分析认为,第一次色素沉积的跃变发生在仔稚鱼向未成熟幼体过渡期,这个阶段往往食性会发生改变,食物由小型浮游动物转变成较大的甲壳类;第二次色素沉积的跃变发生在幼体向成体过渡期,此时进入性腺成熟阶段,食物转向具有较高能量的鱼类[32-34]。在富山武装乌贼生长过程中,由于其摄食习惯的改变,导致其色素沉积逐渐加深,角质颚的硬度也逐渐增加 [34-37],进而有助于其更好地撕碎食物[32],提高进食效率。
综合角质颚大小及色素沉积变化,本研究将富山武装乌贼角质颚表型变化分为仔稚鱼期 (胴长18~31 mm)、幼鱼期 (胴长32~41 mm) 和成鱼期 (胴长>42 mm) 3个阶段 (图7)。仔稚鱼期,较短的上颚喙部和较浅的色素沉积适合捕食游泳能力弱的浮游动物类;幼鱼期,尖长的上颚喙部和较深的色素沉积适合捕食有壳的甲壳类;成鱼期,更加尖长的上颚喙部和更深的色素沉积适合捕食游泳迅速的鱼类[10]。
3.3 展望与不足
富山武装乌贼具有昼夜垂直移动的习性,一般是昼深夜浅,这为西太平洋众多生物提供了丰富的饵料。角质颚因具有耐腐蚀特性长存于捕食者的胃中[3-4]。因此,在掌握个体发育角质颚的生长变化基础上,有助于通过分析捕食者胃含物中残留的角质颚来评估富山武装乌贼的资源量,揭示其在海洋生态系统中的作用[18]。目前,有关富山武装乌贼的研究较少,仅针对特定海域内以及一些海洋生物胃含物中残留个体有零星报道[38]。本研究分析了富山武装乌贼不同生长发育时期角质颚长度及色素沉积面积的变化,并结合其摄食、生活习性等分析其表型变化的原因和特点。本研究认为,富山武装乌贼角质颚表型的变化主要与其个体发育期的食性转变有关。然而,由于样本量偏少,并没有开展其食性方面的研究。因此,今后希望采用胃含物、脂肪酸及碳、氮稳定同位素等分析技术,来准确解析富山武装乌贼的摄食习性,以此来佐证本文的相关研究结论,同时为研究其他海洋生物的摄食习性提供参考。
-
表 1 剑尖枪乌贼采样信息
Table 1 Sampling information of U. edulis
采样时间
Sampling time样本量
Number/尾胴长分布
Mantle range/mm2017年9月 September 2017 65 69~198 2017年10月 October 2017 28 75~135 2017年11月 November 2017 40 110~234 2017年12月 December 2017 49 86~223 2018年1月 January 2018 61 93~180 2018年2月 February 2018 30 70~158 2018年3月 March 2018 40 92~154 2018年9月 September 2018 101 62~198 2018年10月 October 2018 78 74~223 2018年11月 November 2018 30 95~170 2018年12月 December 2018 36 86~222 2019年1月 January 2019 44 60~227 2019年2月 February 2019 36 64~143 2019年3月 March 2019 80 58~164 表 2 剑尖枪乌贼耳石形态参数范围
Table 2 Range of statolith morphological variables of U. edulis
种群
Population形态变量
Statolith morphological variable2017年 2018年 最大值
Maximum最小值
Minimum平均值
Average最大值
Maximum最小值
Minimum平均值
Average春季产卵群体
Spring cohort of hatching耳石总长 TSL 1 844.85 1 235.61 1 668.59 1 801.94 1 351.45 1 596.00 翼区长 WL 1 497.33 1 059.71 1 278.37 1 402.94 986.78 1 221.98 吻区长 RL 823.75 420.47 659.79 819.45 467.82 636.64 最大宽度 MW 1 413.10 785.13 1 180.76 1 394.36 849.50 1 110.71 吻区宽 RW 499.52 326.07 419.12 471.94 321.89 392.38 翼区宽 WW 671.52 300.35 510.79 665.01 248.84 475.27 背侧区长 DLL 1 159.45 763.83 1 009.71 1 161.53 731.33 940.48 吻侧区长 RLL 1 550.46 1 007.74 1 336.71 1 522.09 1 121.98 1 313.07 侧区长 LDL 1 266.43 827.60 1 069.12 1 159.16 883.07 1 014.24 夏季产卵群体
Summer cohort of hatching耳石总长 TSL 1 737.59 1 394.36 1 572.81 1 754.75 1 372.90 1 513.06 翼区长 WL 1 308.56 1 003.94 1 166.24 1 385.78 995.36 1 163.41 吻区长 RL 733.66 467.65 621.41 798.05 484.83 583.37 最大宽度 MW 1 240.19 905.27 1 030.70 1 209.87 862.37 993.33 吻区宽 RW 467.67 227.55 351.13 420.45 291.74 342.76 翼区宽 WW 565.67 373.28 469.41 579.19 317.51 425.59 背侧区长 DLL 1 099.44 763.87 885.55 1 010.42 721.09 853.36 吻侧区长 RLL 1 391.98 1 090.39 1 256.22 1 468.65 1 080.02 1 254.73 侧区长 LDL 1 095.17 906.14 985.01 1 065.45 868.01 960.55 表 3 剑尖枪乌贼耳石形态参数的4个主成分负荷值和贡献率
Table 3 Loadings of four principal components for statolith morphological variables of U. edulis
年份
Year形态变量
Statolith morphological variable春季产卵群体-主成分
Principal component of spring hatching夏季产卵群体-主成分
Principal component of summer hatching1 2 3 4 1 2 3 4 2017 耳石总长 TSL 0.97 0.02 0.01 −0.01 0.89 −0.12 −0.22 −0.17 翼区长 WL 0.82 0.31 −0.23 −0.36 0.84 −0.40 −0.07 0.16 吻区长 RL 0.75 −0.58 0.06 −0.20 0.77 −0.20 −0.30 0.16 最大宽度 MW 0.96 −0.05 0.03 0.07 0.83 0.18 0.40 0.02 吻区宽 RM 0.67 −0.26 −0.52 0.43 0.47 0.62 −0.03 0.45 翼区宽 WM 0.66 −0.19 0.66 0.13 0.54 −0.48 0.52 −0.12 背侧区长 DLL 0.93 −0.15 0.00 0.06 0.76 0.20 0.45 0.13 吻侧区长 RLL 0.91 0.25 −0.09 −0.21 0.79 −0.04 −0.52 0.00 侧区长 LDL 0.58 0.73 0.17 0.27 0.60 0.47 −0.05 −0.63 贡献率 Contribution rate/% 66.75 12.85 8.90 5.45 54.09 12.53 11.60 7.87 累计贡献率 Cumulative contribution rate/% 66.75 79.60 88.50 93.95 54.09 66.62 78.22 86.10 2018 耳石总长 TSL 0.97 −0.08 −0.02 −0.07 0.96 −0.09 −0.10 0.16 翼区长 WL 0.85 −0.37 0.16 −0.18 0.89 −0.23 −0.28 0.11 吻区长 RL 0.80 −0.46 −0.09 0.24 0.88 −0.17 0.27 0.24 最大宽度 MW 0.94 0.18 −0.09 0.09 0.92 0.27 0.14 −0.11 吻区宽 RM 0.67 0.30 0.53 0.38 0.72 −0.41 0.43 −0.26 翼区宽 WM 0.71 0.24 −0.61 0.08 0.48 0.81 0.14 0.21 背侧区长 DLL 0.90 0.18 −0.09 0.15 0.88 0.31 0.12 −0.19 吻侧区长 RLL 0.90 −0.27 0.10 −0.18 0.87 −0.40 −0.17 0.11 侧区长 LDL 0.75 0.41 0.15 −0.46 0.78 0.23 −0.46 −0.27 贡献率 Contribution rate/% 70.38 9.04 8.22 5.77 69.27 14.29 7.09 3.84 累计贡献率 Cumulative contribution rate/% 70.38 79.42 87.64 93.41 69.27 83.56 90.65 94.49 表 4 春、夏季产卵群体耳石总长和最大宽度生长模型的参数及赤池信息量比较
Table 4 Comparison of parameters and AIC for TSL and MW growth models of spring and summer hatching cohort
种群
Population形态变量
Morphological variable年份
Year生长模型
Growth pattern模型参数 Model parameter a b c R2 AIC 春季产卵群体
Spring cohort of hatching耳石总长 TSL 2017 线性 Line 1 150.94 2.39 0.30 369.33 指数 Exponential 1 232.41 0.003 0.29 369.69 对数 Logarithm 536.71 −1216.58 0.31 368.10 幂函数 Power 307.49 0.32 0.31 368.50 逻辑斯蒂 Logistic 1 718.77 0.06 147.68 0.43 360.60 von Bertalanffy 1 673.35 −0.002 9 536.20 0.21 383.95 2018 线性 Line 957.28 3.10 0.53 726.01 指数 Exponential 1 075.81 0.002 0.52 726.77 对数 Logarithm 649.40 −1861.60 0.53 724.64 幂函数 Power 186.10 0.40 0.53 725.10 逻辑斯蒂 Logistic 3 495.23 0.003 256.28 0.52 726.18 von Bertalanffy 1 595.32 −0.002 9 718.77 0.47 791.55 最大宽度 MW 2017—2018 线性 Line 419.87 3.40 0.47 1137.5 指数 Exponential 617.92 0.003 0.45 1140.7 对数 Logarithm 731.21 −2773.46 0.49 1132.6 幂函数 Power 39.57 0.628 0.47 1135.6 逻辑斯蒂 Logistic 4 731.12 0.004 510.74 0.46 1139.7 Von Bertalanffy 1 133.30 −0.002 7 363.71 0.38 1219.0 夏季产卵群体
Summer cohort of hatching耳石总长 TSL 2017 线性 Line 1 029.26 2.75 0.27 461.47 指数 Exponential 1 118.80 0.002 0.27 461.77 对数 Logarithm 553.00 −1349.29 0.28 460.63 幂函数 Power 251.26 0.35 0.30 460.92 逻辑斯蒂 Logistic 1 607.02 0.09 149.93 0.35 454.81 von Bertalanffy 1 571.76 −0.002 9 280.15 0.18 479.48 2018 线性 Line 818.10 3.73 0.57 289.79 指数 Exponential 960.12 0.002 0.57 289.85 对数 Logarithm 700.44 −2146.00 0.57 289.92 幂函数 Power 135.23 0.46 0.57 289.81 逻辑斯蒂 Logistic 3 519.15 0.004 251.78 0.57 289.80 von Bertalanffy 1 521.39 −0.002 9 280.15 0.48 319.92 最大宽度 MW 2017—2018 线性 Line 520.24 2.54 0.42 705.25 指数 Exponential 624.50 0.002 0.42 705.75 对数 Logarithm 489.73 −1 564.90 0.43 704.55 幂函数 Power 79,32 0.48 0.42 704.83 逻辑斯蒂 Logistic 4 108.58 0.003 531.77 0.42 705.58 von Bertalanffy 1 013.12 −0.002 7 511.95 0.39 756.07 注:下划线代表选择的最适宜生长模型
Note: The underlines represent fitted growth model. -
[1] SIN Y M, YAU C, CHU K H. Morphological and genetic differentiation of two loliginid squids, Uroteuthis (Photololigo) chinensis and Uroteuthis (Photololigo) edulis (Cephalopoda: Loliginidae), in Asia[J]. J Exp Mar Biol Ecol, 2005, 369(1): 22-30.
[2] 陈新军, 王尧耕, 钱卫国. 中国近海重要经济头足类资源与渔业[M]. 北京: 科学出版社, 2013: 44-51. [3] JEREB P, ROPER C E. Cephalopods of the world. An annotated and illustrated catalogue of cephalopod species known to date. Myopsid and Oegopsid squids[M]. Rome: Food and Agriculture Organization of the United Nations, 2010: 98-117.
[4] JEREB P, ROPER C E. Cephalopods of the Indian Ocean. A review. Part I. Inshore squids (Loliginidae) collected during the International Indian Ocean Expedition[J]. P Biol Soc Wash, 2006, 119(1): 91-136. doi: 10.2988/0006-324X(2006)119[91:COTIOA]2.0.CO;2
[5] 丁天明, 宋海棠. 东海剑尖枪乌贼生物学特征[J]. 浙江海洋学院学报(自然科学版), 2000, 19(4): 371-374. [6] 林静远, 刘必林, 王立权. 基于角质颚微结构的剑尖枪乌贼的日龄与生长[J]. 华东理工大学学报(自然科学版), 2019, 45(5): 775-782. [7] 刘宗祐. 利用形态测量法探讨剑尖枪锁管与台湾锁管族群分布结构之研究[D]. 基隆: 台湾海洋大学, 2005: 1-9. [8] WANG K Y, CHANG K Y, LIAO C H, et al. Growth strategies of the swordtip squid, Uroteuthis Edulis, in response to environmental changes in the Southern East China Sea: a cohort analysis[J]. B Mar Sci, 2013, 89(3): 677-698. doi: 10.5343/bms.2012.1044
[9] COLLINS M A, PIERCE G J. Size selectivity in the diet of Loligo forbesi (Cephalopoda: Loliginidae)[J]. J Mar Biol Assoc UK, 1996, 76(4): 1081-1090. doi: 10.1017/S0025315400040972
[10] 刘必林, 陈新军, 陆化杰, 等. 头足类耳石[M]. 北京: 科学出版社, 2011: 23-160. [11] CHEN X J, LU H J, LIU B L, et al. Age, growth and population structure of jumbo flying squid, Dosidicus gigas, based on statolith microstructure off the EEZ of Chilean waters[J]. J Mar Biol Assoc UK, 2010, 91(1): 229-235.
[12] 刘必林, 陈新军, 李建华. 东太平洋茎柔鱼的耳石微结构[J]. 水产学报, 2016, 40(8): 1211-1217. [13] 陆化杰, 陈新军, 方舟, 等. 西南大西洋阿根廷滑柔鱼耳石微结构及生长特性[J]. 渔业科学进展, 2012, 33(3): 15-25. doi: 10.3969/j.issn.1000-7075.2012.03.003 [14] 刘玉, 王雪辉, 杜飞雁, 等. 基于耳石微结构的南海鸢乌贼日龄和生长研究[J]. 热带海洋学报, 2019, 38(6): 62-73. [15] 李建华, 张鑫浩, 金岳, 等. 基于耳石和角质颚微结构的中国枪乌贼年龄与生长比较[J]. 海洋渔业, 2018, 40(5): 513-521. doi: 10.3969/j.issn.1004-2490.2018.05.001 [16] 王凯毅. 台湾东北部陆棚海域剑尖枪锁管生活史之研究[D]. 基隆: 台湾海洋大学, 2009: 22-47. [17] YAMAGUCHI T, AKETAGAWAK T, TAKAYAMA K, et al. Migratory routes of different sized swordtip squid (Uroteuthis edulis) caught in the Tsushima Strait[J]. Fish Res, 2019, 209: 24-31. doi: 10.1016/j.fishres.2018.08.008
[18] YAMAGUCHI T, KAWAKAMI Y, MATSUYAMA M. Migratory routes of the swordtip squid Uroteuthis edulis inferred from statolith analysis[J]. Aquat Biol, 2015, 24(1): 53-60. doi: 10.3354/ab00635
[19] YAMAGUCHI T, KAWAKAMI Y, MATSUYAMA M. Analysis of the hatching site and migratory behaviour of the swordtip squid (Uroteuthis edulis) caught in the Japan Sea and Tsushima Strait in autumn estimated by statolith analysis[J]. Mar Biol Res, 2018, 14(1): 105-112. doi: 10.1080/17451000.2017.1351616
[20] NATSUKARI Y, NAKANOSE T. Age and growth of loliginid squid Photololig edulis (Hoyle, 1885)[J]. J Exp Mar Biol Ecol, 1988, 116(2): 177-190. doi: 10.1016/0022-0981(88)90054-8
[21] 金岳. 基于硬组织的中国近海枪乌贼渔业生物学研究[D]. 上海: 上海海洋大学, 2018: 80-94. [22] NATSUKARI Y, TASHIRO M. Neritic squid resources and cuttlefish resources in Japan[J]. Mar Freshw Behav Phy, 1991, 18(3): 149-226. doi: 10.1080/10236249109378785
[23] 胡贯宇, 陈新军, 刘必林, 等. 茎柔鱼耳石和角质颚微结构及轮纹判读[J]. 水产学报, 2015, 39(3): 361-370. [24] FANG Z, CHEN X, SU H, et al. Exploration of statolith shape variation in jumbo flying squid, Dosidicus gigas, based on wavelet analysis and machine learning methods for stock classification[J]. B Mar Sci, 2018, 94(4): 1465-1482. doi: 10.5343/bms.2017.1176
[25] ARKHIPIKIN A I. Statoliths as ‘black boxes’ (life recorders) in squid[J]. Mar Freshw Res, 2005, 56(5): 573-583. doi: 10.1071/MF04158
[26] JACKSON G D, MOLTSCHZNIWSKYJ N A. The influence of ration level on growth and statolith increment width of the tropical squid Sepioteuthis lessoniana (Cephalopoda: Loliginidae): an experimental approach[J]. Mar Biol, 2001, 138(4): 819-825. doi: 10.1007/s002270000496
[27] DURHOLTZ M D, LIPINSKI M R. Influence of temperature on the microstructure of statoliths of the thumbstall squid Lolliguncula brevis[J]. Mar Biol, 2000, 136(6): 1029-1037. doi: 10.1007/s002270000298
[28] 马金, 陈新军, 刘必林, 等. 环境对头足类耳石微结构的影响研究进展[J]. 上海: 海洋大学学报, 2009, 18(5): 616-622. [29] JACKSON G D, WADLEY V A. Age, growth and reproduction of the tropical squid Nototodarus hawaiiensis (Cephalopoda: Ommastrephidae) off the North West Slope of Australia[J]. Fish Bull, 1998, 96(4): 779-787.
[30] 陈姿莹. 台湾东北部不同海域及不同渔法采样下剑尖枪锁管渔业生物学差异[D]. 基隆: 台湾海洋大学, 2013: 16-26 [31] SUKRAMONGKOL N, TSUCHIYA K, TOKAI T. Fishery biology of Loligo edulis in Moroiso Bay, Kanagawa Prefecture, Japan[J]. La Mer, 2006, 44(3/4): 131-143.
[32] 许语婕. 东海南部剑尖枪锁管之资源评估[D]. 基隆: 台湾海洋大学, 2015: 10-21. [33] ARKHIPKIN A I, BIZIKOV V A. Statolith in accelerometers of squids and cuttlefish[J]. Ruthenica, 1998, 8(1): 81-84.
[34] 贾涛, 陈新军, 李纲, 等. 哥斯达黎加外海茎柔鱼个体与耳石间生长关系研究[J]. 上海海洋大学学报, 2011, 20(3): 417-423. [35] FORSYTHE J W. Accounting for the effect of temperature on squid growth in nature: from hypothesis to practice[J]. Mar Freshw Res, 2004, 55(4): 331-339. doi: 10.1071/MF03146
[36] ARKHIPKIN A I, BJORKE H. Statolith shape and microstructure as indicators of ontogenetic shifts in the squid Gonatus fabricii (Oegopsida, Gonatidae) from the Norwegian Sea[J]. Polar Biol, 2000, 23(1): 1-10. doi: 10.1007/s003000050001
[37] 国家海洋局. 2017年中国海洋生态环境状况公告[EB/OL]. (2018-06-06). http://gc.mnr.gov.cn/201806/t20180619_1797652.html. [38] 生态环境部. 2018年中国海洋生态环境状况报告公[EB/OL]. (2019-05-29). https://hbdc.mee.gov.cn/hjyw/201905/W020190529623962003076.pdf. [39] LIU B L, CHEN X J, YI Q. A comparison of fishery biology of jumbo flying squid, Dosidicus gigas outside three Exclusive Economic Zones in the Eastern Pacific Ocean[J]. Chin J Oceanol Limnol, 2013, 31(3): 523-533. doi: 10.1007/s00343-013-2182-3
[40] UNAI M, CASIMIRO Q V, OSCAR S N. Age, growth and maturation of jumbo squid Dosidicus gigas (Cephalopoda: Ommastrephidae) from the Gulf of California, Mexico[J]. Fish Res, 2004, 66(1): 31-47. doi: 10.1016/S0165-7836(03)00184-X
[41] 刘必林, 刘娜, 李建华, 等. 智利外海茎柔鱼角质颚微结构及其年龄与生长研究[J]. 南方水产科学, 2020, 16(1): 62-68. doi: 10.12131/20190116 [42] 方舟, 陈新军, 金岳. 基于角质颚的东、黄海头足类科类判别[J]. 上海海洋大学学报, 2019, 28(3): 365-372. -
期刊类型引用(2)
1. 杨艳,蓝一,刘佳敏,王茜. 渔业生物环境DNA宏条形码数据库研究进展. 湖北农业科学. 2025(01): 174-180 .  百度学术
百度学术
2. 李筱芹,吴开阳,倪达富,杨丽亚,鲁桃秀,张连博,邓华堂,吴彤飞,何荣超,付梅,姚维志,吕红健. 基于环境DNA技术的梯级水坝对长江上游重要支流鱼类多样性的影响研究——以綦江为例. 生态学报. 2024(19): 8865-8883 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载:








 粤公网安备 44010502001741号
粤公网安备 44010502001741号
