Study on respiratory metabolism changes of juvenile Penaeus monodon following strenuous activity
-
摘要:
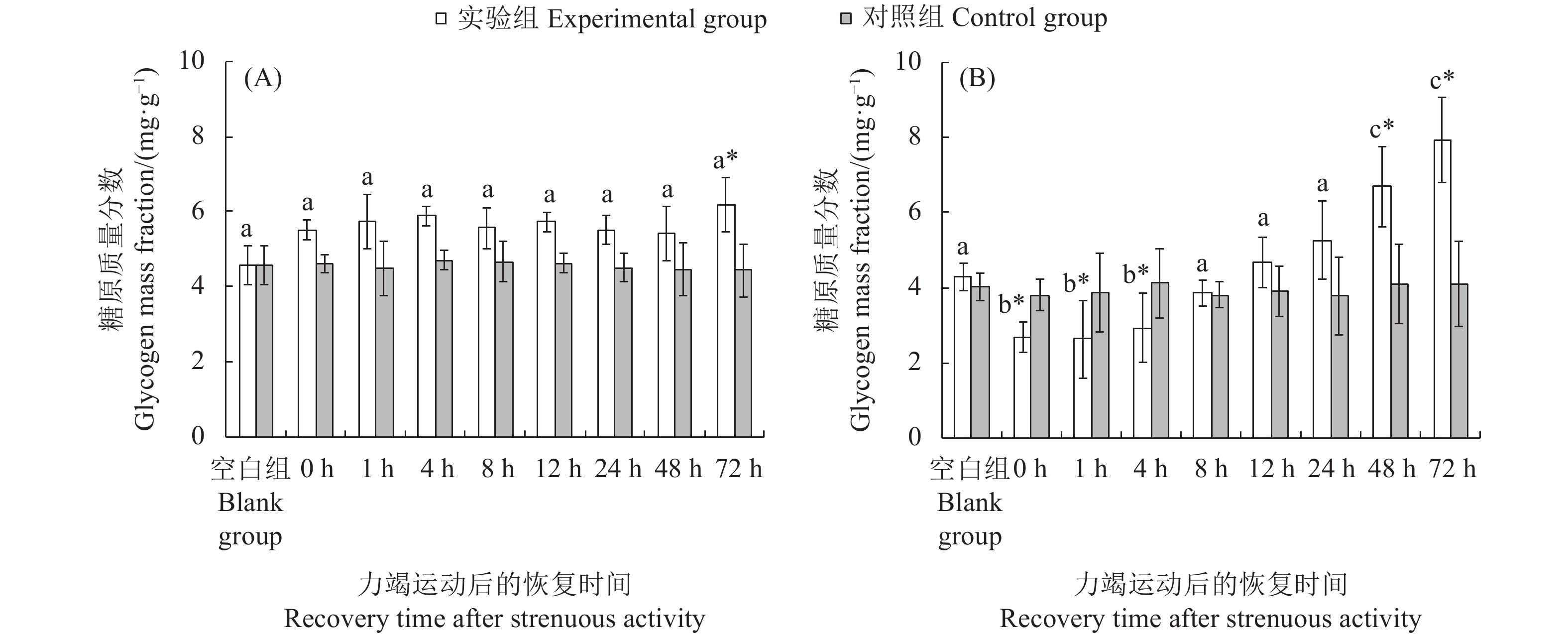
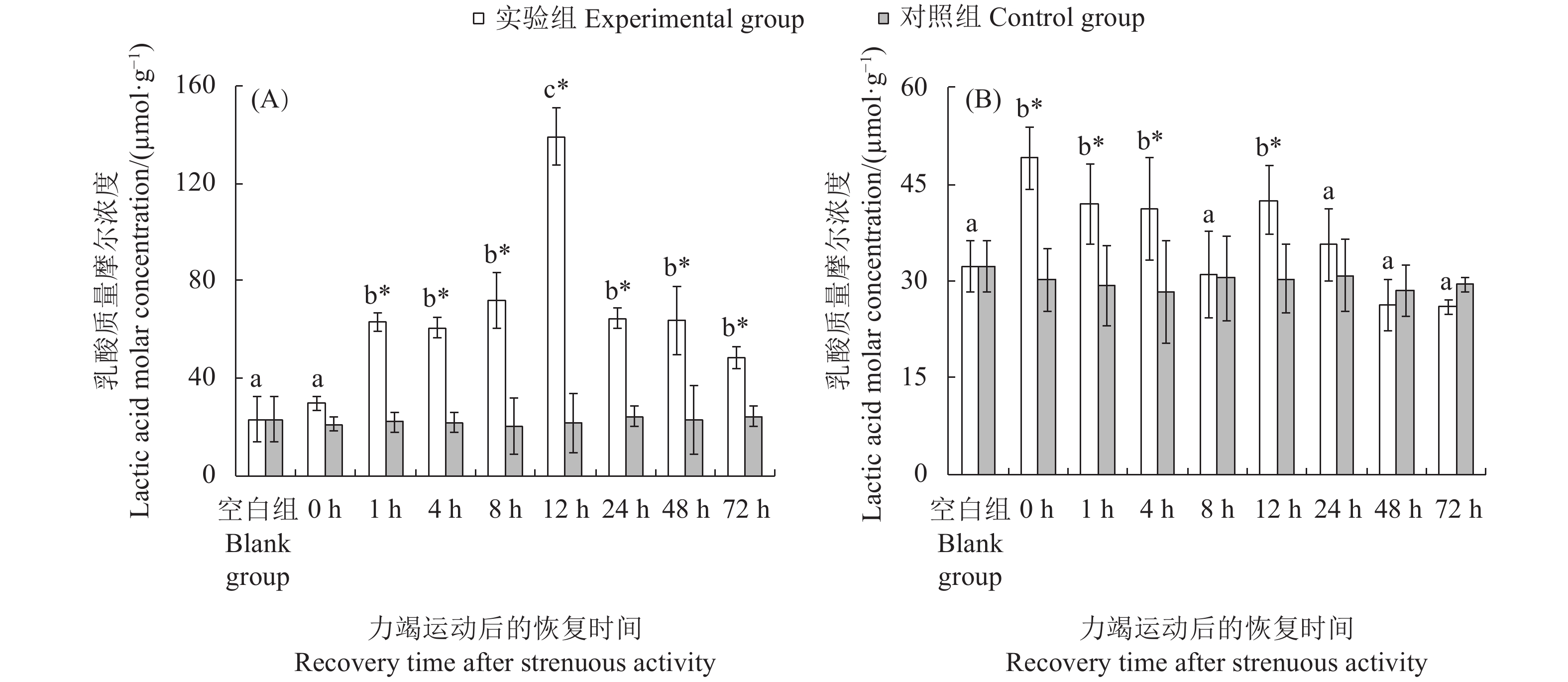
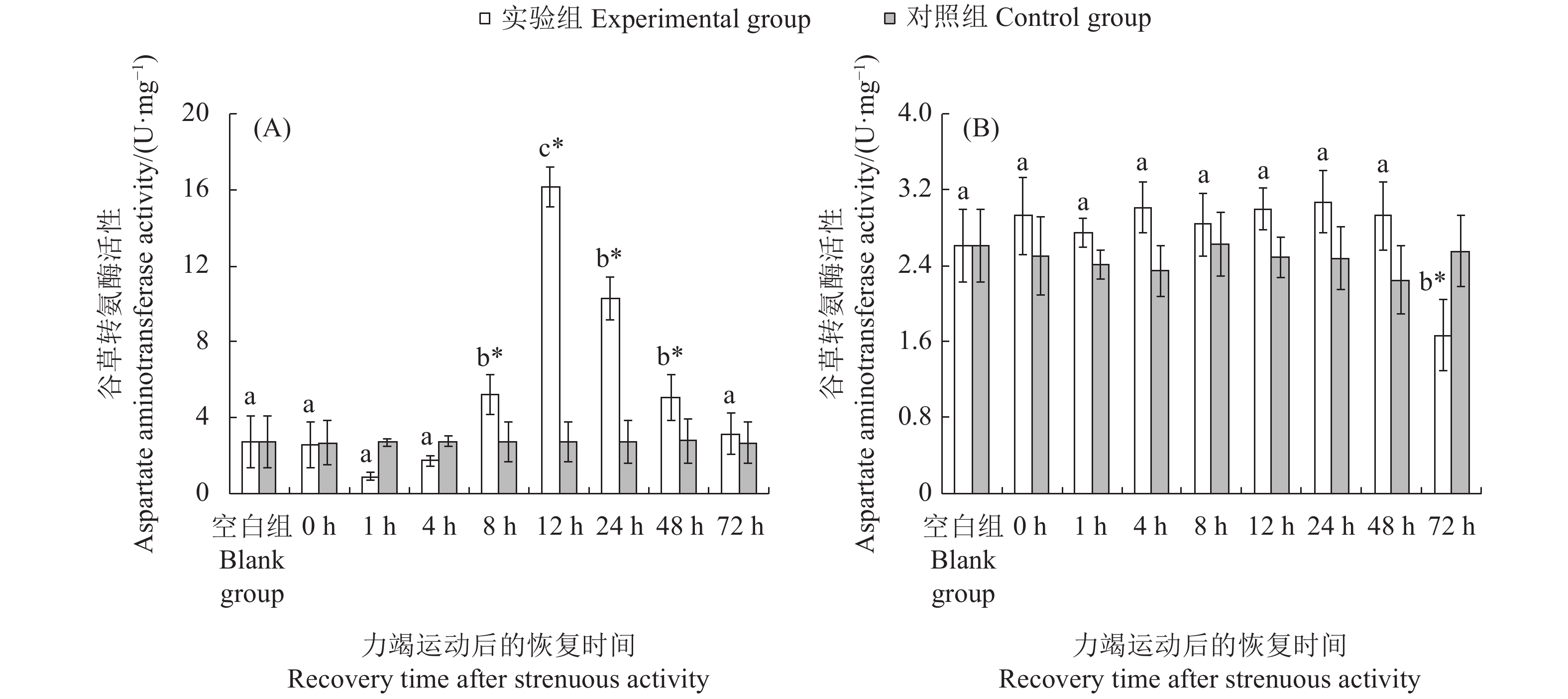
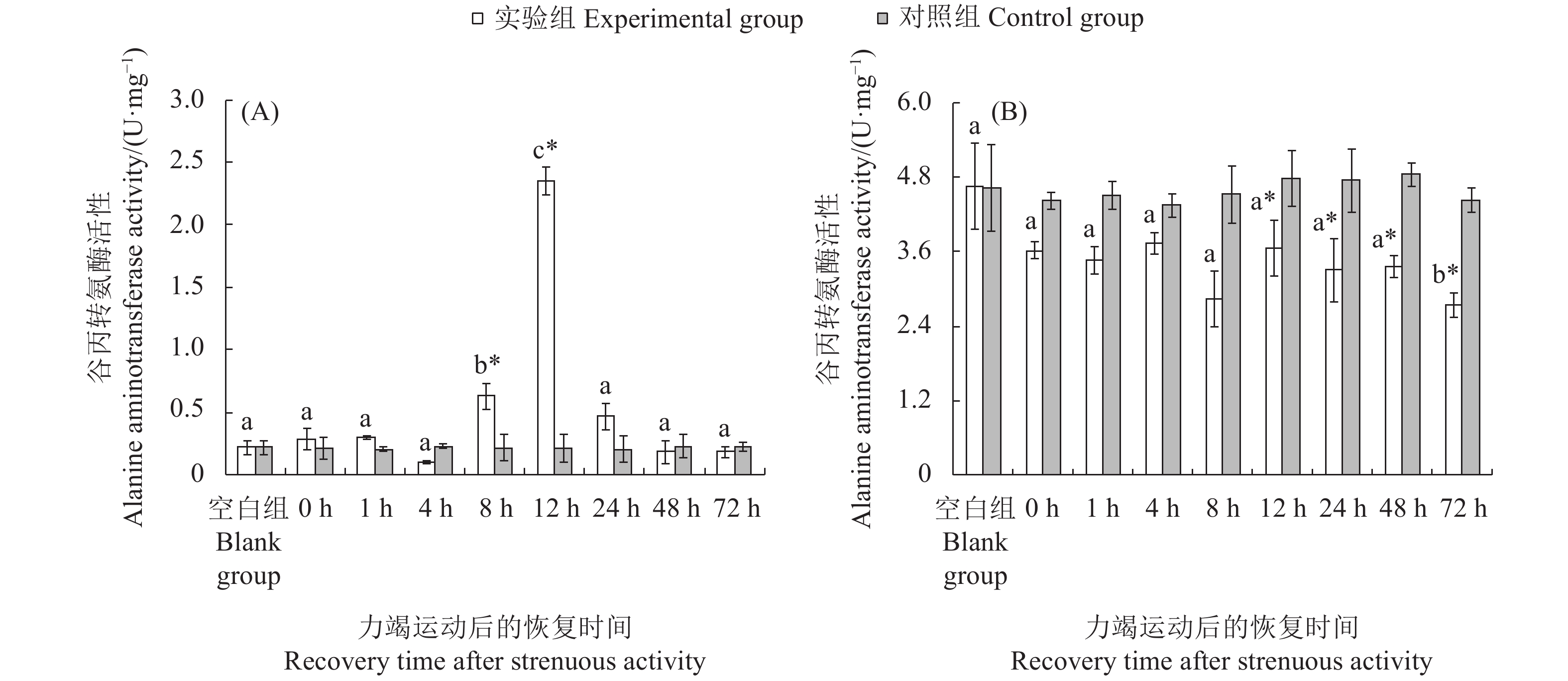
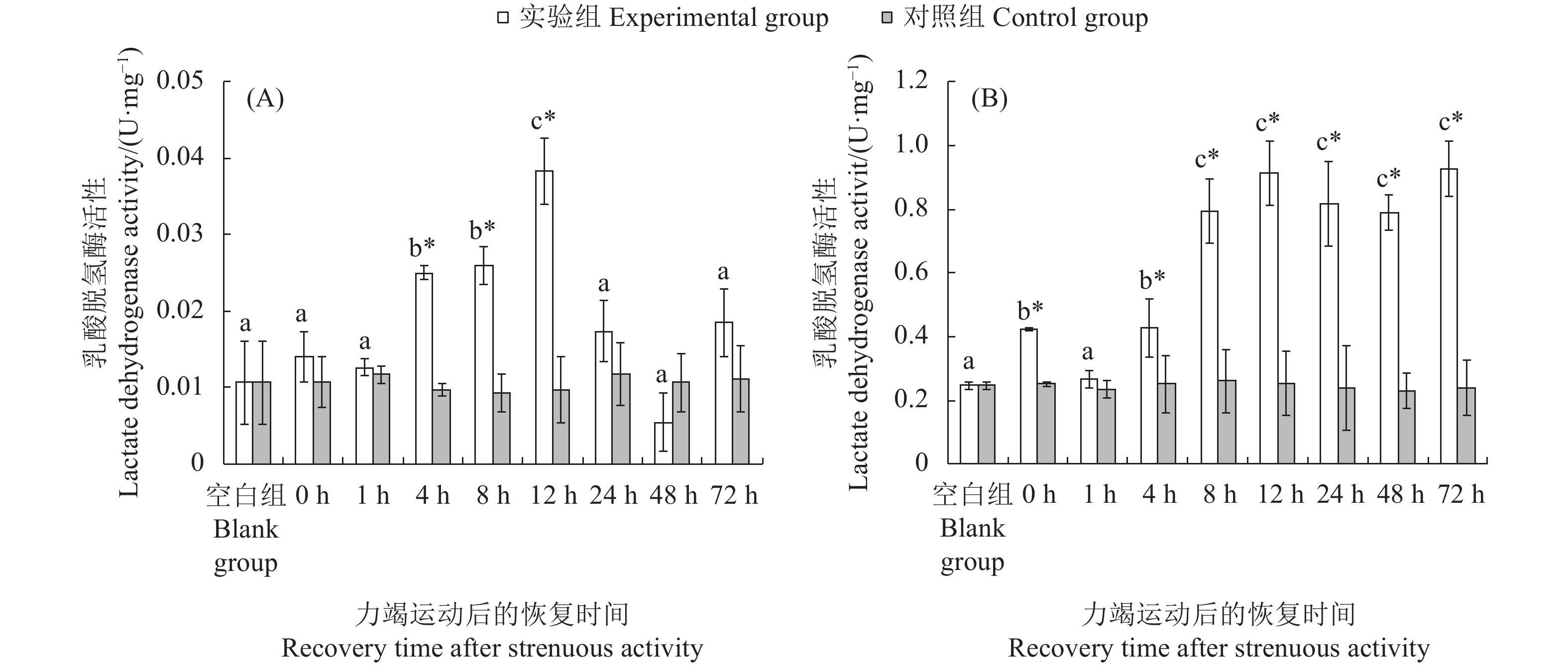
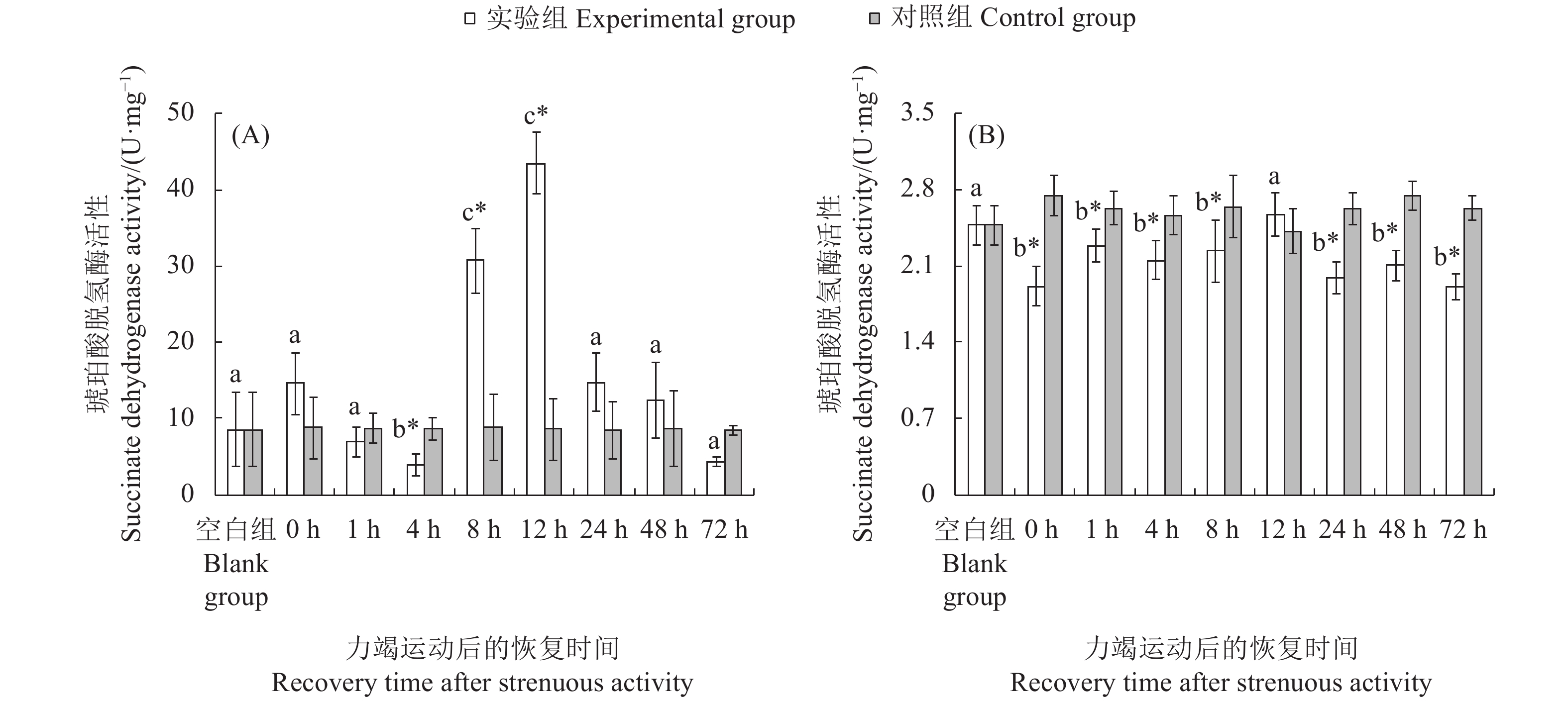
文章以斑节对虾 (Penaeus monodon) 为研究对象,在实验室水槽模拟幼虾力竭运动情况,探究幼虾力竭运动后的呼吸代谢恢复规律,以期为斑节对虾养殖生产和增殖放流提供科学依据。结果显示,在力竭后的各恢复时间点,斑节对虾幼虾肝胰腺总蛋白质 (TP)、乳酸 (LA),以及谷草转氨酶 (AST)、谷丙转氨酶 (ALT) 、乳酸脱氢酶 (LDH) 和琥珀酸脱氢酶(SDH)活性均存在显著差异 (P<0.05);腹部肌肉中LA、LDH活性存在显著差异。肝胰腺TP在恢复后第4小时显著高于对照组,第48小时恢复至对照组水平;LA在恢复后第12小时显著高于对照组,第24小时恢复至对照组水平;AST和ALT活性在运动后第8至第12小时内显著上升,第24小时恢复至对照组水平;LDH和SDH活性持续上升,恢复后第12 小时显著高于对照组,第48 小时恢复至对照组水平。肌肉糖原 (GLY) 在运动后显著下降,恢复后第12小时恢复至对照组水平;LA在运动后显著升高,第8 小时下降至对照组水平;LDH活性运动后显著升高,第1至第12小时内持续升高,第72小时仍处于显著高于对照组水平。幼虾在力竭运动后无氧代谢显著增强,第8 小时可再次进行力竭运动;肝胰腺为幼虾清除代谢物的器官,对运动后呼吸代谢恢复起到重要作用。
Abstract:In order to provide scientific basis for the breeding and releasing of Penaeus monodon, we simulated the exhausted movement of the juveniles in the laboratory flume, then investigated their respiratory metabolic recovery after exhaustion exercise. With different recovery times after exhaustive exercise, there were significant changes in the total protein content (TP) and lactic acid (LA) concentrations as well as the activities of aspartate aminotransferase (AST), alanine aminotransferase (ALT), lactate dehydrogenase (LDH) and succinate dehydrogenase (SDH) in the hepatopancreas of the juveniles (P<0.05). There was significant difference in the LA concentration and LDH activity in abdominal muscles. The TP concentration in hepatopancreas was significantly higher than that of the control group after 4 h of exhaustive exercise, and returned to the control level at 48th hour. The LA concentration of hepatopancreas was significantly higher than that of the control group at 12th hour, and returned to the control level at 24th hour. The activities of AST and ALT in hepatopancreas increased significantly during the 8th to 12th hour, and returned to the control level at 24th hour. The activities of LDH and SDH increased and were significantly higher than that of the control group at 12th hour, and returned to the control level at 48th hour. The glycogen concentration (GLY) in the muscle decreased significantly after exhaustive exercise and returned to the control level at the 12th hour. The LA concentration increased significantly after exhaustive exercise and decreased to the control level at 8th hour. The LDH activity increased significantly after exhaustive exercise, and continued to increase during 1st to 12th hour, and remained significantly higher than that of the control group at 72th hour. The anaerobic metabolism of the juveniles was significantly enhanced after exhaustive exercise, and exhaustive exercise could be performed again after 8 h; heaptopancreas was the place where the juveniles cleared metabolites, and began to deal with internal environment imbalance after exercise.
-
Keywords:
- Penaeus monodon /
- Respiratory metabolism /
- Strenuous activity /
- Recovery process
-
罗非鱼(Oreochromis,tilapia)是原产于热带、亚热带暖水性鱼类,有尼罗、莫桑比克、奥利亚、米来西等十多个品种,具有繁殖力强、生长速度快、耐粗食、抗病力强等优点,是当前淡水养殖业的重要养殖品种之一。随着全球性海洋捕捞渔业资源的衰退,国际市场对水产养殖产品的需求越来越大。在众多的养殖品中,罗非鱼以其肉质厚、骨刺少,便于加工保鲜、富含多种不饱和脂肪酸等优点被公认是健康食品,被称为21世纪之鱼,在全球的消费量呈上升趋势,是第一个全球性的水产养殖品种。
我国罗非鱼养殖业发展迅速,近十年来,产量以平均每年14.75%左右的速度递增,稳居世界首位。目前,广东、广西、海南、福建、山东等地罗非鱼养殖业发展势头迅猛,并带动了种苗、饲料、加工、贸易等相关产业的发展,罗非鱼产业在我国的发展有着较强的竞争优势,是我国最具国际竞争实力的品种,也是最具产业化发展条件的品种。但随着罗非鱼产业的快速发展,也存在一些生产、加工方面的问题,也可能存在一些贸易壁垒的问题。
本文全面分析了国内外罗非鱼贸易情况,我国罗非鱼的生产情况、质量安全问题及可能遇到的技术性贸易壁垒,提出了提高我国罗非鱼出口贸易竞争力的相关措施,以期为我国罗非鱼产业的可持续发展提供参考。
1. 我国罗非鱼生产情况
1.1 罗非鱼产量及养殖分布地区
中国大陆的罗非鱼养殖始于20世纪60年代引进莫桑比克罗非鱼(O. mossambicus),但由于其养殖性能差,尤其是过度繁殖,成鱼体型小,体色黝黑,未能在大陆有较大发展。从1978年起,中国大陆多次引入尼罗罗非鱼(O. niloticus),该种鱼的养殖性能远优于莫桑比克罗非鱼,从此,中国大陆罗非鱼养殖业有了迅速发展,特别是奥尼杂交鱼种的养殖,使我国罗非鱼的养殖取得了长足的发展。1997年罗非鱼成为继中国大陆传统养殖种类鲢(Hypophthalmichthys molitrix)、鳙(Aristichthys nobilis)、草鱼(Ctenopharyngodon idellus)、鲤(Cyprinus carpio)、鲫(Carassius auratu)之后的第六位主要淡水养殖鱼类。罗非鱼在我国除西藏和青海等省外的30多个省市广泛养殖。在国际上,中国大陆罗非鱼养殖产量居世界首位。自20世纪90年代中期以来,我国罗非鱼产量逐年增长,1995~2005年期间,平均增长率为14.75%。1995~2005年全球及中国罗非鱼产量见图 1[1-2](http://www.globefish.org/index.php?id=2738)。
罗非鱼在中国大陆的养殖分布很不平衡,南方地区的广东、广西、海南、福建得益于气候,罗非鱼养殖发展迅速,养殖模式以池塘混养为主,产量占淡水养殖产量的20%,较高的可达30%,成为这些地区主要的养殖对象之一。在北方地区,尤其是山东、辽宁等地发展也很快,以利用发电厂的废热水池及水库网箱养殖为主。2004年各地区罗非鱼养殖产量见表 1,2004年罗非鱼主要产区的产量占全国罗非鱼总产量的百分比分别为广东49.0%,广西14.30%,海南13.44%,福建10.88%,山东3.0%,云南3.04%,这6省份产量合计占全国总产量的93.61%[1]。
表 1 2004年全国各地罗非鱼养殖产量Table 1 The tilapia output according province in 2004t 省份
province产量
output省份
province产量
output省份
province产量
output省份
province产量
output省份
province产量
output全国 897 276 山东 26 518 浙江 2 888 河南 1 841 黑龙江 294 广东 439 650 河北 14 973 四川 2 746 北京 1 679 上海 231 广西 129 301 江西 5 632 湖北 2 674 天津 1 347 宁夏 167 海南 120 590 安徽 5 539 湖南 2 496 贵州 942 甘肃 112 福建 97 645 重庆 5 278 山西 2 086 新疆 621 内蒙古 111 云南 27 249 江苏 3 217 辽宁 2 070 陕西 527 吉林 52 数据来源:中国渔业年鉴(2005)
Data source: China fisheries year book(2005)1.2 我国罗非鱼主要养殖地区的生产概况
(1) 广东省。广东省是我国养殖罗非鱼最早、养殖面积最多和产量最高的地区。由于气候条件适宜,从池塘混养到网箱养殖、海水养殖、池塘精养,从最先开始的珠江三角洲拓展到内陆山区,罗非鱼产量呈逐年增长之势,据统计,广东省2003年罗非鱼总产量为38.9万t,约占全国总量的48.3%;2004年广东省罗非鱼总产量为44.0万t,占全国的49%,出口量为5.3万t,创汇1.02亿美元,分别占全国的60.9%和63.7%;2005年广东省出口量为7.3万t,创汇1.6亿美元,分别占全国的68.2%,69.6%,从以上分析看,广东省近几年罗非鱼出口仍然保持强劲的增长趋势。广东省优越的地理气候条件及对罗非鱼繁殖、培育、养殖技术的日臻成熟,特别是随着无公害罗非鱼养殖基地的建立,广东省罗非鱼的养殖将不断增加,2010年产量预计可达60万t。
(2) 广西省。广西处于亚热带,气候适宜罗非鱼的生长,且广西水库河流多,大部分还处于未开发的状态,水质好。因此,广西养殖罗非鱼具备了优良条件,养殖产量逐步上升。2002年总产量为11.1万t,2003年为11.4万t,2004年12.83万t,占全国总产量的14.30%,位居第二。
(3) 海南省。海南主要以海水养殖为主,且热带气候也很适宜罗非鱼的养殖,近几年迅速发展罗非鱼养殖业,2002年海南省罗非鱼产量为8.2万t,2003年为10.1万t,2004年12.1万t,占全国总产量的13.44%。2004年海南罗非鱼加工出口量为1.4万t,出口值3 460万美元,占全省水产品出口量的33%和出口额的26%。
(4) 福建省。地处亚热带,气候温和、雨量充沛、水质肥沃,特别适合罗非鱼养殖,罗非鱼养殖产量由1999年的9.97万t,全国第二位,降至2003年的9.28万t,居第四位,占全国总产量的11.52%。2004年9.76万t,占全国总产量的10.88%。
(5) 台湾地区。台湾地区历年罗非鱼产量及出口美国数量见图 2,台湾地区的罗非鱼产量呈逐年增长趋势,但总产量并不高,2004年总产量为9万t,台湾地区是除中国大陆以外的第二大罗非鱼出口地区。到目前为止,2004年向美国出口罗非鱼总量为2.76万t,出口总金额为0.36亿美元。主要出口国家为美国,还向日本提供高质量的罗非鱼鱼片供应生鱼片市场。2005年台湾地区向美国出口冻鱼片和冻全鱼总量为2.72万t,出口总金额为0.39亿美元。
1.3 我国罗非鱼出口情况
中国近几年罗非鱼出口增长势头强劲,连续几年来的增长率位居世界第一。2004年我国罗非鱼出口量为8.7万t,出口总金额为1.6亿美元;2005年我国罗非鱼出口量为10.6万t,出口总金额为2.31亿美元。其中,美国为我国罗非鱼最大出口国,2004、2005年罗非鱼出口美国情况见表 2 (http://www.ag.arizona.edu/azaqua/ista/Markets/Hermosillo/)。我国罗非鱼的出口趋势也与美国进口罗非鱼趋势一致。与2004年比较,2005年出口美国数量和金额增长率分别为25.3%和43.3%,出口金额达1.7亿美元。冻罗非鱼片量已超过冻全鱼量,其中片冻量为44 121 t,增幅为57.10%,冻全鱼量为30 884 t,降幅为2.8%,但出口总金额反而上升11.7%。从出口价格看,中国出口到美国的罗非鱼,2004、2005年冻鱼片价格维持在3.0美元·kg-1,低于美国这2年平均进口价约0.2~0.3美元;冻全鱼由2004年的1.1美元·kg-1上升至2005年的1.2美元·kg-1,与美国平均进口价相当。
表 2 中国2001~2005罗非鱼出口美国数量及金额Table 2 The tilapia weight and value of export USA from China from 2001 to 20052001 2002 2003 2004 2005 冻全鱼
whole frozen tilapia重量/t weight 10 870 19 616 28 763 31 781 30 884 金额/×103美元value/thousand dollar 10 497 20 239 30 497 34 424 38 440 冻鱼片
frozen fillet重量/t weight 2 529 6 026 15 857 28 086 44 121 金额/×103美元value/thousand dollar 8 597 20 898 51 501 85 076 132 810 鲜鱼片
fresh fillet重量/t weight 191 844 857 0 0 金额/×103美元value/thousand dollar 617 2 979 25 096 0 0 总重量
total weight重量/t weight 19 400 32 000 45 476 59 868 75 005 增长率/% increasing ratio 10.4 65 42.1 31.6 25.3 总金额
total value金额/×103美元value/thousand dollar 22 711 44 115 84 507 119 500 171 250 增长率/% increasing ratio 8 94.2 91.6 41.4 43.3 数据来源:美国罗非鱼协会
Data source: America tilapia association(ATA)2. 提高我国罗非鱼出口竞争力的措施
随着罗非鱼产业化的成熟,竞争愈来愈激烈,南美洲的哥斯达黎加、厄瓜多尔、洪都拉斯、巴西等国因地理优势,具有较强的竞争优势,亚洲的越南、菲律宾等也正积极发展罗非鱼产业。越南渔业部鼓励罗非鱼养殖业的发展,计划到2010年罗非鱼产量超过20万t。在欧洲,有投资集团计划投资1 500万欧元在欧洲建立最大的罗非鱼室内养殖场,同时在比利时设立罗非鱼加工厂,室内渔场计划每年为欧洲零售市场提供3 000 t新鲜罗非鱼(http://www.ag.arizona.edu/azaqua/ata.html)。可以预见,未来几年可能会有更多的投资者加入到这个领域,世界范围内的罗非鱼产量将猛增,罗非鱼产业领域的竞争将越来越激烈。
2.1 我国罗非鱼产业的竞争优势
2.1.1 我国罗非鱼产业存在的竞争优势
(1) 养殖区域相对集中,易于形成规模化生产的产业带。我国罗非鱼主产区集中在广东、广西、海南、福建,4省的产量占全国总产量的85%以上。从加工企业看,同样集中分布在广东、广西和海南。产地集中、加工企业集中,为发展产业化经营提供了有利条件。(2)养殖技术日趋成熟,有利于参与国际市场竞争。我国罗非鱼养殖经过近半个世纪的发展,已经形成多种养殖模式,包括池塘养殖、网箱养殖、工厂化流水养殖和与其他养殖品种混养等。无论哪种养殖模式,从苗种、饲料、加工等技术已能完全控制,在各个环节中都有良好的技术储备。(3)养殖和加工生产成本低。中国罗非鱼成本较低,仅为0.70美元·kg-1,是罗非鱼世界主要养殖国家中成本最低国家之一,美国罗非鱼产品成本2.0美元·kg-1。相比之下,我国具有更强的竞争力,这是我国罗非鱼出口的最大优势所在[3]。
2.1.2 影响我国罗非鱼竞争力的主要问题
(1) 出口产品单一,缺乏品牌优势。我国出口罗非鱼产品正从冻全鱼向冻鱼片过渡,冻鱼片已经逐渐取代昔日冻全鱼的位置[4]。(2)产业化规模小,组织化程度低。我国罗非鱼出口贸易逐渐形成气候,由于我国渔业信息化程度相对滞后,信息不畅,企业得不到实时反应市场需求的信息。现在罗非鱼养殖、科研、加工和销售基本上处于各自独立的状态,龙头企业规模小,组织化程度低,产业链还没有建立起来,不利于参与罗非鱼国际化水平的竞争。(3)质量认证管理体系有待进一步完善。罗非鱼企业在质量认证管理方面有较大的改善,但不能松懈,这将影响到我国罗非鱼产业全局声誉问题。按HACCP的要求,生产优质产品,必须从原料生产开始,保证生产过程的各个环节达到质量要求,从而确保最终产品的质量,即建立完整的质量保证体系。
2.2 提高我国罗非鱼出口贸易竞争力的对策
品质和价格是当今国际市场竞争的2大要素,为适应入世要求,同时在2个方面保持优势,将罗非鱼养殖、科研、加工和销售有机结合起来,提高罗非鱼产业的国际竞争力。
2.2.1 提高我国罗非鱼出口贸易竞争力的政府行为
(1) 充分发挥政府部门的宏观指导作用。政府有关部门应加强WTO/TBT协议和WTO/SPS协议条款及国外技术壁垒状况的研究工作,还应联合科研部门,进一步加强基础科学的研究,以科学研究成果为依据,据理力争,有效维护我国水产企业的合法权益。政府应积极参与国际间贸易谈判,争取有利的出口地位,对国外的不合理贸易保护和歧视性技术壁垒采取有效反击。(2)健全和完善质量控制制度,加强质量管理。为了与国际标准接轨,我国的水产标准应以国际食品法典委员会(CAC)标准为依据并结合我国国情做适当的调整、修订。政府各部门要加强产品质量安全重要性和有关法律法规标准的宣传教育工作,继续实施水产品药物残留专项整治,大力推行无公害养殖、绿色养殖,从源头控制水产品质量安全,抓紧按照国家和国际标准,对水产品生产和加工的各个环节进行严格监控,当前世界各国尚未专门对罗非鱼产品制定专门的标准,作为全球罗非鱼贸易大国,我国应走在更前一步[5]。由中国水产科学研究院南海水产研究所制定的《冻罗非鱼片》国家标准,已通过专家审查,《冻罗非鱼片》标准的颁布实施,将对我国罗非鱼片生产起到促进和规范作用。(3)积极发挥政府营销促销作用。通过政府部门的组织引导,推进生产企业分工协作,沟通联系,形成行业间信息互通、资源共享的良性互赢格局。充分发挥行业协会的作用,如中国水产学会、加工与流通协会,罗非鱼协会等,通过这些协会去强化行业自律,规范从业行为,维护行业内的正常竞争和利益合理分配,有效计划和组织生产,平衡产销各环节的经济利益,共同开拓国际市场,共同防范和抵御市场风险,避免恶性竞争和盲目压价行为的发生。美国罗非鱼协会(American tilapia association,ATA)颇有成效地把全国罗非鱼养殖业主组织起来,传播信息和技术,促进了罗非鱼行业的产业化,具有重要借鉴意义。近年国家启动了政府营销促销工作。统一组团参加了日本东京国际渔业博览会,中央财政出资资助企业租用展位20个;组织水产企业参加第二届中国国际农产品交易会;2006年中国水产流通与加工协会把帮助会员企业创建名牌商标作为工作重点之一。这些举措加大对我国出口水产品的主要市场和潜在市场的开发力度,扩大了我国水产品的国际影响力。
2.2.2 提高我国罗非鱼竞争力的企业行为
(1) 良种选育技术。目前市面上罗非鱼品种很杂,比较多的是通过一些类固醇类的激素诱变育种得到的单雄性鱼种,但因育种技术的差异,雄性率一般在70%~95%之间,另外,因为选育工作不够重视、近亲繁殖严重、子代退化现象突出,这些鱼种放养后,生长缓慢、饲料浪费、严重影响出塘规格,降低商品率。养殖中应选择雄性率高(97%以上)、生长速度快(日平均增重2 g以上)的杂交鱼种。对于生产出的鱼规格偏小问题,应从遗传育种着手,充分考虑我国温带气候特点和池塘、网箱养殖环境条件,采用现代生物技术和遗传育种理论,培育出生长速度快、适合当年或2年养成大规格商品鱼的品种;同时加大良种保种和供种的力度,建立以国家级罗非鱼良种为核心,大力推广优良品牌,保护优良品牌。(2)养殖饲料方面。高能全价饲料蛋白质含量高,鱼类所必需氨基酸及各种营养全面,配比平衡,鱼类摄食后消化率高,粪便及其他废弃物少,可减少养殖水质的污染,保持水质的良好与稳定,减少鱼类的发病机会。合理的多品种搭配放养,能提高饲料的利用率,有利于水质调节,保持长期稳定的好水质,鱼类生长快速、病害少,并且能最大限度地减少对养殖水体环境的污染。(3)加工技术。国内大多以鲜活或冰鲜销售,出口的主要产品将会由目前的冻全鱼为主变成为以冻鱼片为主。随着罗非鱼深加工产品的开发,高附加值产品将不断增加。企业应利用现代加工技术,加快熏鱼、鱼鳞、鱼皮、鱼糜、调味料、活性钙、鱼油和酶制剂等产品的开发。同时,食用方便的深加工产品将会受到欢迎,冻鱼片、鲜鱼片的贸易数量及金额的大幅增长,醋渍、成形产品、沾滚上面粉的油炸鱼和熟制品,烟熏鱼片及罗非鱼糜也将是未来开发的新产品[6]。值得注意的是,2005年哥斯达黎加罗非鱼皮出口量为412 t,价值28.9万美元,鱼鳞出口量130 t,价值14.6万美元。这些产品用来提取果冻或者胶原质,用于欧洲化妆品产业[3]。这些深加工都显著地提高了罗非鱼产业的经济效益,值得国内企业学习和借鉴。(4)积极拓展国内国际市场。美国现为全世界最大罗非鱼消费国,是传统的消费市场,目前已有法国、荷兰、英国、日本等采购商进口罗非鱼产品,新的罗非鱼消费市场正在形成。同时国内市场的消费潜力巨大,目前,已经有一些大型超市、中档餐馆开始推销罗非鱼产品。随着罗非鱼加工产品的多样化,社会消费水平的整体提高,以及人们对罗非鱼产品了解的加深,将有助于市场消费的进一步增加。因此,企业要抓紧实施品牌战略,从商标注册、广告宣传、产品包装到营销策略,全方位树立产品品牌形象,努力打造有中国地方特色的精品名牌,提高罗非鱼的质量和加工品质。不断提高产品的市场竞争力和附加值。要立足国内市场,开拓国际市场,积极参加产品博览会、广交会等,及时了解市场需求信息,提高产品知名度。
3. 我国罗非鱼出口产业可能遇到的问题及其对策
现在罗非鱼养殖、科研、加工和销售基本上处于各自独立的状态,龙头企业规模小,组织化程度低,产业链尚未有机地建立起来,不利于参与罗非鱼国际化水平的竞争。
(1) 反倾销问题。随着美国罗非鱼进口量急剧上升,价格持续下降可能导致罗非鱼行业抵制措施出台,美国国内水产工业如何应对廉价鱼的流入,有一些贸易措施可能很快就会出台并实施,以遏制罗非鱼过于廉价的情况出现[7]。罗非鱼行业要吸取我国对虾出口受到反倾销诉讼的教训。必须努力提高产品质量和附加值,开发高端新品。在确保美国这一最大出口市场的同时,应注意拓宽其他国家和地区的市场,尤其是欧盟、日本、韩国及中东,以分散市场风险。除了致力出口,也必须扩大罗非鱼的国内消费。日本、韩国与中国大陆近在咫尺,应是中国开发高档鲜活罗非鱼和鲜罗非鱼片市场的潜在地区。
为避免重蹈对虾产业遭遇反倾销的覆辙,相关企业应建立现代企业制度,建立健全符合国际通用准则的管理制度、财会制度,避免为争夺市场竞相压价的行为;罗非鱼协会应建立出口风险预警机制,通过收集分析国际主要水产品市场的信息,对市场供应量增长较快、价格走低给予关注和发出“警报”,争取产业保护的主动权。
(2) 技术贸易壁垒问题。近年来,随着经济全球化和贸易自由化进程的加快,关税逐渐降低,但一些国外贸易团体却开始利用中国现行食品标准与CAC标准不一致这一现象,通过设置各种技术壁垒达到拒绝中国食品进口的目的。对中国水产、农畜等产品实施“技术贸易壁垒”的世贸组织成员从发达国家(欧盟、美国、日本)延伸到部分发展中国家(韩国、新加坡)。欧盟对进口水产品检验非常“苛刻”,检验项目多达100多项,门槛很高[8]。欧盟委员会专门制定水产品投放市场的卫生条件的规定(91/493/EC指令),而且要求向欧盟市场输出水产品的加工企业必须获得欧盟注册。欧盟对进口水产品质量和卫生要求越来越严,而且必须从原料生产开始,保证生产过程的各个环节达到质量要求,从而确保最终产品的质量,即建立一个完整的质量保证体系,全面推行HACCP制度。加工出口企业应重视质量安全,注重从源头上加强对水产品质量的控制,推行无公害养殖模式,从严控制养殖罗非鱼药物残留,加强对原料和加工产品的质量监控,不要存在侥幸心理,获得出口国的认证也是消除可能的贸易壁垒的有效方法。
4. 结语
全球罗非鱼消费量逐步上升,我国罗非鱼产量也不断增长,我国的罗非鱼出口在目前还有一定的竞争优势,但是也存在诸多问题。根据对我国罗非鱼出口竞争力优势的分析,我国罗非鱼出口总体上具有一定优势,但形势并不乐观。因此,有必要从政府、企业的角度出发,不断增强我国罗非鱼出口的竞争优势。政府应针对入世后,面临贸易竞争及外国政府出于保护本国市场的动机和政治因素影响而设置的贸易壁垒等严峻形势,大力扶持渔业龙头企业,加快发展渔业产业化,鼓励技术开发,促进技术引进;积极促进市场和生产经营规模扩大;狠抓质量安全管理,强化政府营销促销职能;组织引导,发挥行业协会的作用,着力增强我国罗非鱼产业的对外竞争力。对企业来说,提高国际贸易竞争力,关键是以技术为核心促进罗非鱼出口贸易增长,技术的获得、资本的积累以及经营规模的扩大是取得出口贸易增长、促进贸易地位提高的重要途径。积极发展国际贸易,既是提升罗非鱼产业素质的客观需要,也是加快中国农业国际化步伐,提高竞争能力和综合效益的现实选择。
-
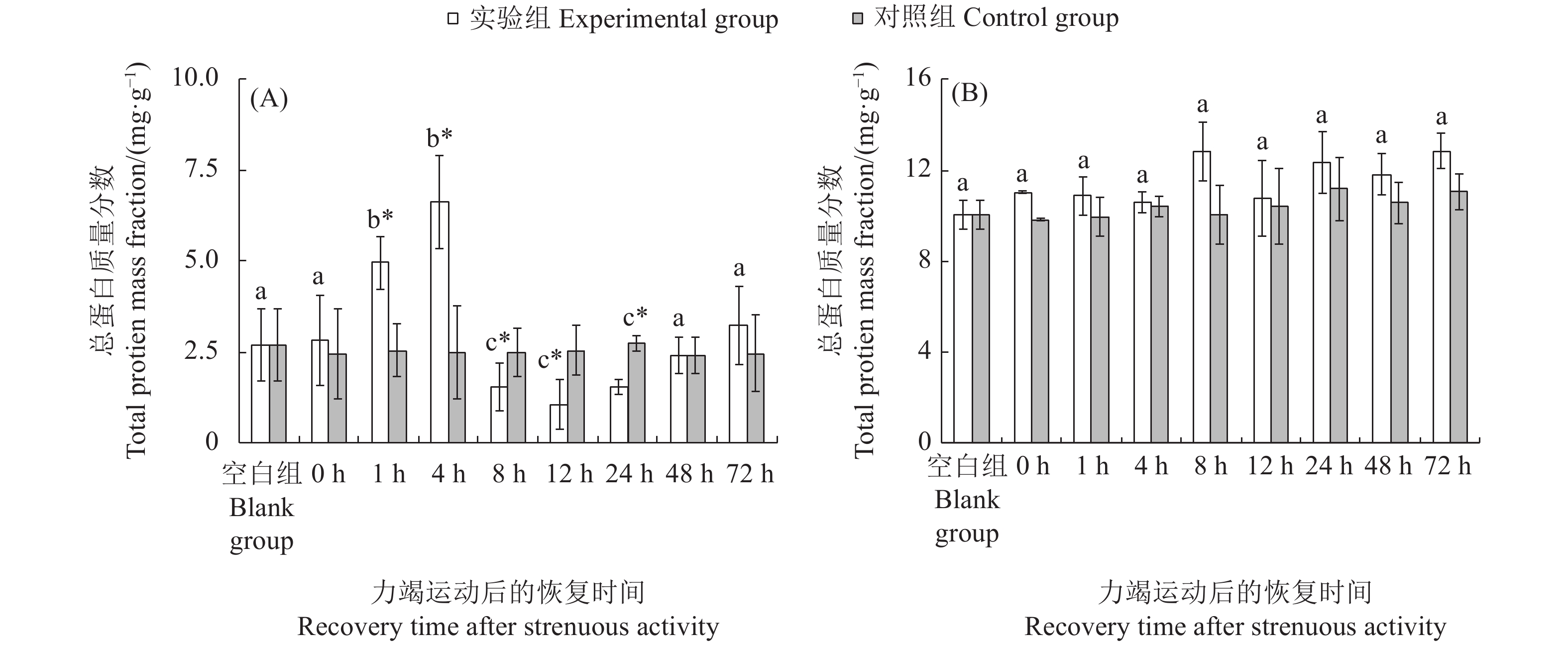
图 1 斑节对虾幼虾力竭运动后肝胰腺 (A) 与肌肉 (B) 中总蛋白质量分数变化
不同字母代表各恢复时间点实验组间存在显著差异(P<0.05);“*”表示实验组和对照组在胁迫后同一时间点差异显著(P<0.05),后图同此
Figure 1. Total protein mass fractions in hepatopancreas (A) and muscle (B) of juvenile P. monodon following strenuous activity
Different letters represent significant differences between the experimental groups at different recovery time (P<0.05); *. Significant differences between experimental group and the control group at the same time (P<0.05). The same case in the following figures
表 1 实验水体的物理化学参数
Table 1 Physical and chemical parameters of experimental water body
水体
Water body温度
Temperature/℃盐度
SalinitypH 溶解氧
Dissolved oxygen/(mg·L−1)育肥池 Fattening pond 25±1 23±2 8.0±0.3 4.2±0.5 环形水道 Circular waterway 25 23 7.8 4.5 恢复池 Recovering pond 25±1 23 7.8±0.3 5.6±0.5 表 2 斑节对虾幼虾在力竭运动后8个恢复时间点和空白组腹部肌肉、肝胰腺中代谢指标单因素分析
Table 2 Analysis of metabolic capacity in abdominal muscles (M) and heaptopancreas (H) of juvenile P. monodon following strenuous activity by One-Way ANOVA
因变量
Dependent variable自由度
df均方
MSF P 肌乳酸质量浓度 LA mass concentraion (M) 8 0.000 19 2.613 0.043 肝乳酸质量浓度 LA mass concentraion (H) 8 0.003 3.082 0.023 肌总蛋白质量分数 TP mass fraction (M) 8 3.152 1.294 0.307 肝总蛋白质量分数 TP mass fraction (H) 8 9.508 12.283 0.000 肌糖原质量分数 GLY mass fraction (M) 8 10.057 2.326 0.045 肝糖原质量分数 GLY mass fraction\ (H) 8 0.582 1.305 0.302 肌SDH活性 SDH activity (M) 8 0.007 0.491 0.847 肝SDH活性 SDH activity (H) 8 21.175 22.601 0.000 肌LDH活性 LDH activity (M) 8 0.232 6.318 0.001 肝LDH活性 LDH activity (H) 8 0.000 29 8.599 0.000 肌ALT活性 ALT activity (M) 8 0.937 2.151 0.085 肝ALT活性 ALT activity (H) 8 0.502 6.380 0.001 肌AST活性 AST activity (M) 8 0.560 0.943 0.507 肝AST活性 AST activity (H) 8 75.490 227.247 0.000 -
[1] KIEFFER J D. Limits to exhaustive exercise in fish[J]. Comp Biochemis Physiol A, 2000, 126(2): 161-179. doi: 10.1016/S1095-6433(00)00202-6
[2] KIEFFER J D. Perspective-Exercise in fish: 50+years and going strong[J]. Comp Biochem Physiol A, 2010, 156(2): 163-168. doi: 10.1016/j.cbpa.2010.02.009
[3] GREGORYM A. A comparison of startle response in two morphs of the brook stickleback (Culaea inconstans): further evidence for a trade-off between defensive morphology and swimming ability[J]. Evol Ecol, 1997, 11(1): 83-90. doi: 10.1023/A:1018487529938
[4] DALL W, HILL B J, ROTHLISBERG P C, et al. The biology of the Penaeidae[J]. J Crus Biol, 1990, 27(4): 325-329.
[5] 张沛东. 对虾行为生理生态学的实验研究[D]. 青岛: 中国海洋大学, 2006: 4-5. [6] 唐小红, 樊佳佳, 于凌云, 等. 鱼类糖酵解关键酶的研究进展[J]. 中国农学通报, 2014(2): 69-75. [7] 朱晏苹, 曹振东, 付世建. 力竭性运动后瓦氏黄颡鱼幼鱼乳酸和血糖变化[J]. 重庆师范大学学报(自然科学版), 2010, 27(2): 14-17. [8] 李秀明, 张耀光, 何春梅, 等. 力竭追赶训练对两种鲤科鱼类呼吸循环系统参数和力竭运动后代谢特征的影响[J]. 水生生物学报, 2019, 43(1): 78-85. [9] 苗增良, 李鹏, 周秀锦, 等. 急性力竭性运动后日本黄姑鱼乳酸、糖原和葡萄糖水平变化[J]. 江苏农业科学, 2012, 40(9): 212-214. doi: 10.3969/j.issn.1002-1302.2012.09.086 [10] 李可贵. 摄食、力竭性运动及其交互作用对鲇鱼幼鱼代谢及酸碱状态的影响[M]. 重庆: 重庆师范大学, 2010: 17-23. [11] ZHANG Y, TIMMERHAUS G, ANTTILA K, et al. Domestication compromises athleticism and respiratory plasticity in response to aerobic exercise training in Atlantic salmon (Salmo salar)[J]. Aquaculture, 2016, 463: 79-88. doi: 10.1016/j.aquaculture.2016.05.015
[12] SKJERVOLD P O, FJÆRA S O, ØSTBY P B, et al. Live-chilling and crowding stress before slaughter of Atlantic salmon (Salmo salar)[J]. Aquaculture, 2001, 192(2): 265-280.
[13] 李丹丹, 陈丕茂, 朱爱意, 等. 黑鲷幼鱼力竭运动后代谢酶活性的恢复水平[J]. 南方水产科学, 2018, 14(6): 59-65. doi: 10.12131/20180064 [14] 刘明镜, 于丽娟, 皇甫加清, 等. 无氧运动诱导的斑马鱼代谢及适应性变化[J]. 水生生物学报, 2013, 37(6): 1153-1157. [15] 于晓明. 三种对虾游泳能力及其游泳生理的比较实验研究[D]. 青岛: 中国海洋大学, 2009: 26-55. [16] ZHANG P, ZHANG X, LI J, et al. Swimming ability and physiological response to swimming fatigue in whiteleg shrimp, Litopenaeus vannamei[J]. Comp Biochem Physiol A, 2006, 145(1): 26-32. doi: 10.1016/j.cbpa.2006.04.014
[17] 陈国福, 黄倢, 宋晓玲. 对虾免疫机能研究概况[J]. 水产学报, 2004, 28(2): 209-215. [18] 郭彪, 王芳, 侯纯强, 等. 温度突变对凡纳滨对虾己糖激酶和丙酮酸激酶活力以及热休克蛋白表达的影响[J]. 中国水产科学, 2008, 15(5): 885-889. doi: 10.3321/j.issn:1005-8737.2008.05.024 [19] 张华军, 李卓佳, 张家松, 等. 密度胁迫对凡纳滨对虾稚虾免疫指标及生长的影响[J]. 南方水产科学, 2012, 8(4): 43-48. doi: 10.3969/j.issn.2095-0780.2012.04.007 [20] 张海恩, 何玉英, 李健, 等. 密度胁迫对中国对虾幼虾生长、抗氧化系统功能及水质指标的影响[J]. 渔业科学进展, 2020, 41(2): 140-149. doi: 10.19663/j.issn2095-9869.20190122001 [21] 段妍. 凡纳滨对虾游泳行为生理生态学实验研究[D]. 青岛: 中国海洋大学, 2012: 21-40. [22] 丁阳阳, 江世贵, 李运东, 等. 斑节对虾Pellino基因的克隆及其在不同胁迫条件下的表达分析[J]. 南方水产科学, 2019, 15(3): 87-96. doi: 10.12131/20180216 [23] MILLIGAN C L, HOOKE G B, JOHNSON C. Sustained swimming at low velocity following a bout of exhaustive exercise enhances metabolic recovery in rainbow trout[J]. J Exp Biol, 2000, 203(5): 921-926.
[24] 李黎, 曹振东, 付世建. 力竭性运动后鲇鱼幼鱼乳酸、糖原和葡萄糖水平的变动[J]. 水生生物学报, 2007, 31(6): 880-885. doi: 10.3321/j.issn:1000-3207.2007.06.017 [25] 朱晏苹, 曹振东, 付世建. 不同游泳速度条件下瓦氏黄颡幼鱼的有氧和无氧代谢反应[J]. 水生生物学报, 2010, 34(5): 905-912. [26] LIU Y, CAO Z D, FU S J, et al. The effect of exhaustive chasing training and detraining on swimming performance in juvenile dark barbel catfish (Peltebagrus vachelli)[J]. J Comp Physiol B, 2009, 179(7): 847-855. doi: 10.1007/s00360-009-0365-1
[27] 李根瑞. 仿刺参对环境低氧胁迫的生理生化响应研究[M]. 上海: 上海海洋大学, 2016: 27-33. [28] 管越强, 李利, 王慧春, 等. 低氧胁迫对日本沼虾呼吸代谢和抗氧化能力的影响[J]. 河北大学学报 (自然科学版), 2010, 30(3): 301-306. [29] BROOKS, GEORGE A. The lactate shuttle during exercise and recovery[J]. Medic Sci Spor Exer, 1986, 18(3): 360-368. doi: 10.1249/00005768-198606000-00019
[30] ZEHRA S, KHAN M A. Dietary pyridoxine requirement of fingerling Channa punctatus (Bloch) based on growth performance, liver pyridoxine concentration, and carcass composition[J]. J Appl Aquacult, 2018, 30(3): 238-255. doi: 10.1080/10454438.2018.1456999
[31] 周莹, 王际英, 李宝山, 等. 许氏平鲉幼鱼对饲料中维生素B6需求量的研究[J]. 渔业科学进展, 2019: 1-14. https://doi.org/10.19663/j.issn2095-9869.20191012001. [32] 黄凯, 吴宏玉, 蒋焕超, 等. 饥饿对凡纳滨对虾能量代谢及脂肪酸组分的影响[J]. 水生态学杂志, 2011, 32(1): 105-110. [33] CHENG W, LIU C, KUO C. Effects of dissolved oxygen on hemolymph parameters of freshwater giant prawn, Macrobrachium rosenbergii (de Man)[J]. Aquaculture, 2003, 220(1/2/3/4): 843-856.
[34] 查蒙, 管维良, 茅林春. 山梨醇对凡纳滨对虾无水运输中呼吸和能量代谢的影响[J]. 食品研究与开发, 2019, 40(1): 30-36. doi: 10.3969/j.issn.1005-6521.2019.01.006 [35] MOOSAVI B, BERRY E A, ZHU X, et al. The assembly of succinate dehydrogenase: a key enzyme in bioenergetics[J]. Cel Mol Life Sci, 2019, 76(20): 4023-4042. doi: 10.1007/s00018-019-03200-7
[36] 王兴强, 曹梅, 马甡, 等. 密度对凡纳滨对虾存活、生长和能量收支的影响[J]. 中国农学通报, 2005(8): 409-412. doi: 10.3969/j.issn.1000-6850.2005.08.115 [37] ANAND P S, BALASUBRAMANIAN C P, CHRISTINA L, et al. Substrate based black tiger shrimp, Penaeus monodon culture: stocking density, aeration and their effect on growth performance, water quality and periphyton development[J]. Aquaculture, 2019, 507: 411-418. doi: 10.1016/j.aquaculture.2019.04.031
[38] FRANKLIN C E, JOHNSTON I A, BATTY R S, et al. Metabolic recovery in herring larvae following strenuous activity[J]. J Fish Biol, 1996, 48(2): 207-216. doi: 10.1111/j.1095-8649.1996.tb01113.x
[39] SAVANT K B, AMTE G K. Influence of some environmental-factors on respiratory responses in the tropical estuarine crab Ilyoplax gangetica (Kemp)[J]. J Environ Biol, 1995, 16(4): 311-317.
[40] 陶易凡, 强俊, 王辉, 等. 低pH胁迫对克氏原螯虾鳃和肝胰腺酶活力及组织结构的影响[J]. 中国水产科学, 2016, 23(6): 1279-1289.




 下载:
下载:

 粤公网安备 44010502001741号
粤公网安备 44010502001741号
