Anti-hepatic injury effect of enzymatic hydrolysate from soft tissue of Pinctada martensii
-
摘要:
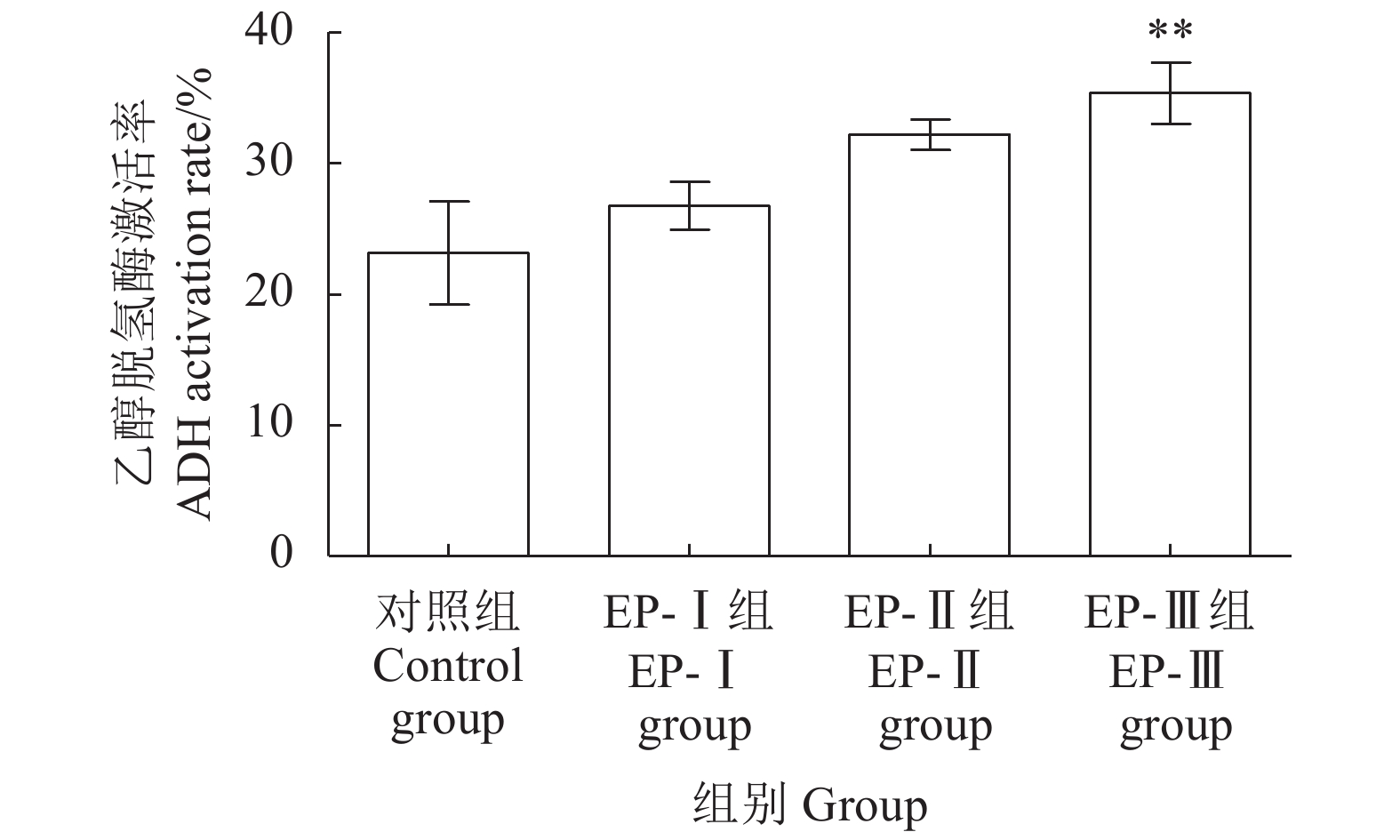
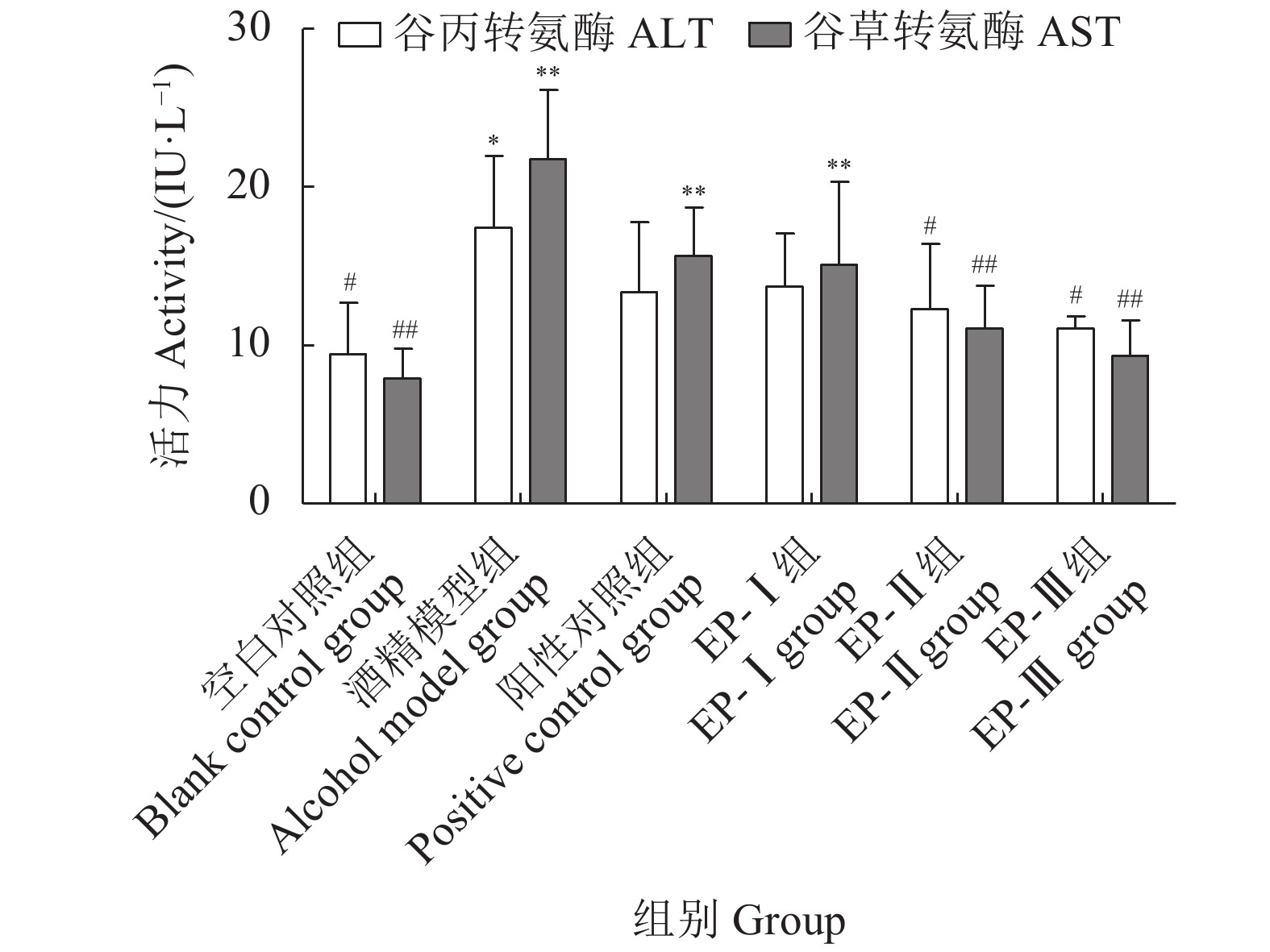
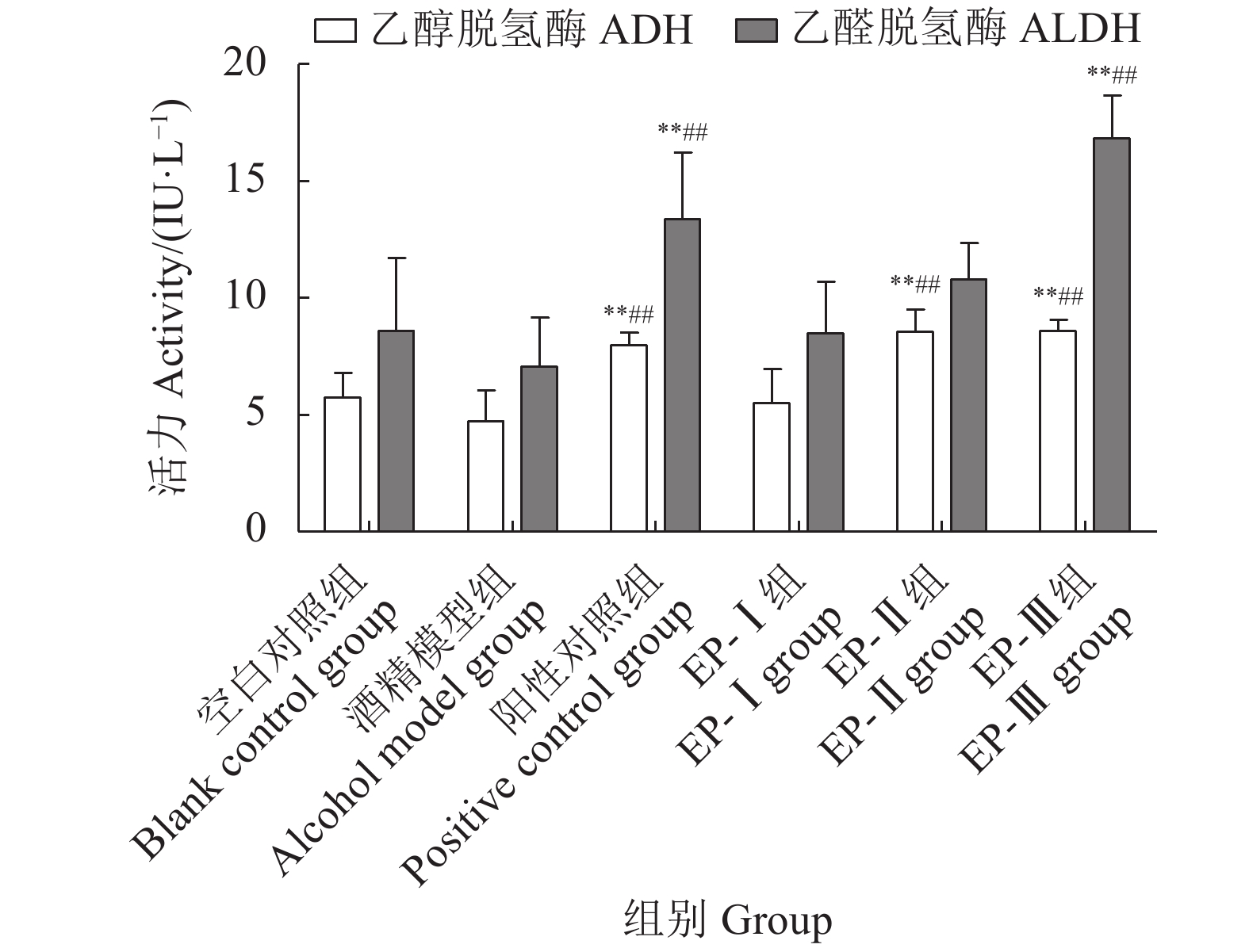
为探究马氏珠母贝肉酶解产物 (Enzymatic hydrolysate from Pinctada martensii, EP)对酒精性肝损伤 (Alcoholic liver damage, ALD)的保护作用,该研究将EP超滤分级为截留分子量>10 kD (EP-Ⅰ)、3~10 kD (EP-Ⅱ)和<3 kD (EP-Ⅲ) 3个组分,检测其体外抗肝损伤活性及对ALD小鼠肝保护作用的影响。体外试验结果显示,EP-Ⅲ可显著激活体外乙醇脱氢酶 (ADH)活性 (P<0.01),3个超滤组分均具有一定的体外抗氧化能力且ep-ⅲ>EP-Ⅱ>EP-Ⅰ;动物试验结果显示,与模型对照组相比,各超滤组分均能够显著降低小鼠血清中谷丙转氨酶 (ALT)和谷草转氨酶 (AST)活力、小鼠肝脏指数及肝脏中丙二醛 (MDA)和甘油三酯 (TG)含量,同时显著增强小鼠肝脏中超氧化物歧化酶 (SOD)、乙醇脱氢酶 (ADH)和乙醛脱氢酶 (ALDH)活力,提高肝脏中的谷胱甘肽 (GSH)含量。综上,马氏珠母贝肉酶解超滤组分对急性ALD具有一定的辅助保护作用,其中EP-Ⅲ的保护作用效果最佳,其机制可能与加快机体乙醇代谢和减缓乙醇对机体造成的氧化损伤相关。
-
关键词:
- 马氏珠母贝肉酶解产物 /
- 酒精性肝损伤 /
- 体外抗肝损伤活性 /
- 乙醇代谢
Abstract:In order to analyze the anti-hepatic injury effect of enzymatic hydrolysate from Pinctada martensii (EP), we seperated EP by membrane ultrafiltration into three molecular size fractions [MW> 10 kD (EP-Ⅰ), MW=3–10 kD (EP-Ⅱ) and MW < 3 kD (EP-Ⅲ)], and then measured the effects of three ultrafiltration fractions on the anti-ALD in vitro and liver-protection on mice. The results of experiments in vitro show that EP-III could activate alcohol dehydrogenase (ADH) significantly (P<0.01), and="" three="" fractions="" demonstrated="" different="" antioxidant="" capacities="">EP-Ⅱ>EP-Ⅰ). The results of mice experiment show that compared with the alcohol model group, the activities of ALT and AST in serum, liver index, the levels of MDA and TG in liver decreased in each ultrafiltration fraction group significantly, while the activities of SOD, ADH and ALDH and the levels of GSH in liver increased significantly. Therefore, the ultrafiltration fractions of enzymatic hydrolysate from soft tissue of P. martensii showed good protective effect on alcoholic liver damage, and the effect of EP-Ⅲ with low molecular mass was the best. Its mechanism may be related to accelerating ethanol metabolism and slowing down the oxidative damage caused by ethanol.
-
方斑东风螺 (Babylonia areolata)属软体动物门、腹足纲、蛾螺科,俗称“花螺”、“海猪螺”和“南风螺”,分布于中国东南沿海、东南亚及日本等地,是中国东南沿海主要的养殖海珍品和经济贝类,因其肉质鲜美、营养丰富,成为畅销国内外且具有推广前景的优质海水养殖贝类品种[1]。近年来,方斑东风螺的养殖生产在中国部分地区如广东、广西和海南等有较快发展,但在养殖过程中常受到氨氮 (NH4-N)毒性的影响。积累的氨以离子氨 (
$ {\rm{NH}}_4^ + $ )或非离子氨 (NH3)的形式存在于水体,从而影响水生动物的生长[2]。NH4-N是水产养殖水环境中的主要有毒物质和重要的水体环境指标之一,被认为是水产养殖中的常见胁迫因子,其浓度受养殖水体中动物排泄物、分泌物、残饵、动植物尸体等含氮有机物分解的影响[3-4]。研究表明,多数水生生物对NH4-N毒性非常敏感。关于NH4-N对鱼类、虾类等水生生物消化系统和抗氧化系统酶活力影响的研究已有不少报道[5-8],但NH4-N胁迫对方斑东风螺消化酶活力影响的研究仍属空白。徐武杰等[9]研究NH4-N胁迫对三疣梭子蟹 (Portunus trituberculatus) 消化酶活力的影响时发现,在NH4-N胁迫下其中肠腺中的胃蛋白酶和脂肪酶活力表现出明显的诱导作用,而对3种消化器官中淀粉酶活力表现出明显的抑制作用;胡炜等[10]研究发现慢性NH4-N胁迫会对刺参 (Stichopus japonicus) 摄食、消化与生长产生不利影响,在质量浓度低于4 mg·L–1的NH4-N胁迫下,刺参消化酶活力短期可被显著诱导上调,高NH4-N质量浓度对消化酶活力起抑制效应并可导致生理紊乱,且该响应存在体质量、规格上的差异;王程昊等[11]研究发现,NH4-N胁迫也会影响泥蚶 (Arca granosa)体内的几种免疫酶活力。NH4-N还可降低水生动物生长速度,影响其血液生化指标并伤害免疫功能、组织机构及繁殖能力[12-13]。当水体中NH4-N质量浓度低于生物体耐受限度时,机体能够自行调节其体内相关酶的活力从而适应外界环境的变化,但当一定质量浓度的NH4-N持续长时间刺激且超过机体调节限度时,机体的非特异性免疫系统及消化系统就会受到破坏,相关酶活力下降[14-16]。另外,NH4-N胁迫还会增加水生动物的致病性[17],从而影响水生动物健康。为探究方斑东风螺在NH4-N刺激下其体内消化酶活力变化,进而揭示其消化酶应对急性胁迫时的调节机制,本文通过开展方斑东风螺不同质量浓度的NH4-N胁迫实验,测定NH4-N对其常见消化酶活力的影响,以期充实NH4-N对贝类毒理实验消化酶层面的基础数据,并为其他贝类NH4-N胁迫实验提供科学依据。
1. 材料与方法
1.1 实验材料
方斑东风螺由中国水产科学研究院南海水产研究所热带水产研究开发中心 (海南陵水)提供,并在该基地进行实验。实验所用方斑东风螺平均体质量为 (0.392±0.080) g,体长为(0.65±0.15) cm,实验开始前先暂养2 d。养殖过程中水质参数为温度 (26.0±1.0) ℃,盐度33±0.8,溶解氧 (DO)质量浓度大于6.5 mg·L–1,亚硝酸盐质量浓度小于0.04 mg·L–1,NH4-N质量浓度小于0.01 mg·L–1,pH为8.0±0.2。实验用水为过滤的海水。
1.2 实验方法
1.2.1 饲养管理及实验设计
将氯化铵 (NH4Cl,AR)配置成质量浓度为0~500 mg·L–1的溶液,按实验要求放入健康状况良好且大小均一的方斑东风螺,观察其行为、活动及存活状况,得到24 h和 96 h 100%死亡浓度 [ (LC100, 24 h)和 (LC100, 96 h)],根据实验结果确定出实验液NH4-N质量浓度的上、下限。实验过程中停止投饵。
根据所确定的上、下限设置5个NH4-N质量浓度,分别为0 mg·L–1、22 mg·L–1、47 mg·L–1、102 mg·L–1和220 mg·L–1,各组均为3个平行,每个实验容器 (3 L)内投放30只健康状况良好的方斑东风螺,分别于第6、第12、第24、第36、第48、第72和第96小时从各养殖桶中随机取样3只,检测其消化酶活力的变化情况。同时,每隔3 h从每个容器中取水样,及时调整至设定的表观质量浓度。
每日换水1次,每次换水50%,并将养殖桶中的排泄物以及死去的方斑东风螺及时除去。间隔观察并记录各实验组方斑东风螺的状态、行为活动、中毒症状及死亡率。判断死亡的标准为实验东风螺置于塑料板上无明显活动迹象,用解剖刀触碰无反应。
1.2.2 样品处理
用0.2 mol·L–1生理盐水将各实验组所取样品 (整个螺)按1∶2 (m∶V)进行研磨,研磨液于5 000 r·min–1、4 ℃下离心10 min,取1 mL上清液于洁净EP (eppendorf)管中,−80 ℃保存待测,分别采用相关试剂盒测定蛋白及各消化酶活力,试剂盒购自南京建成生物工程研究所。
1.2.3 数据处理与分析
利用SPSS 21.0对实验数据进行统计分析,先对数据作单因素方差分析 (One-Way ANOVA),处理间若有显著差异,再用Duncan法比较均值间的差异显著性 (P<0.05),本文数据均采用“平均值±标准差 (
$\overline X \pm {\rm SD}$ )”表示。2. 结果
2.1 NH4-N胁迫对方斑东风螺的急性毒性作用
NH4Cl处理组中,随着NH4Cl浓度的升高,方斑东风螺呈现不同的应激行为甚至死亡,主要表现为运动缓慢,对外界刺激反应迟钝,爬壁运动减少,逐渐翻背,沉于水桶底部,身体僵硬直至死亡。死亡状态的东风螺,吻管向外凸出,螺肉外翻、惨白僵硬。300 mg∙L–1 NH4Cl处理组第48小时开始出现死亡,第96小时成活率为 (60.0±1.6)%,而500 mg·L–1 NH4-N处理组于第24 小时便出现 (20.3±2.1)%的死亡率,死亡个体吻稍微张开、出现体色变红现象,且第96小时成活率为0,其余各组成活率为100% (表1)。可见,NH4-N浓度越大,其毒性作用越强,方斑东风螺死亡率越高;相同条件下,NH4-N胁迫时间越久,方斑东风螺死亡率也越高。
表 1 氨氮对方斑东风螺急性毒性实验结果Table 1. Acute toxicity experiment of NH4-N to B. areolataρ(NH4Cl)/mg·L–1 死亡率/% mortality rate 第24小时 第48小时 第72小时 第96小时 对照 control 0 0 0 0 25 0 0 0 0 50 0 0 0 0 75 0 0 0 0 100 0 0 0 0 200 0 0 0 0 300 0 21.4±3.3 40.1±2.9 60.0±1.6 500 20.3±2.1 50.0±2.7 73.6±4.2 100.0 2.2 NH4-N胁迫对方斑东风螺溶菌酶活力的影响
不同浓度NH4-N对方斑东风螺溶菌酶活力的影响显著 (P<0.05),而处理时间对方斑东风螺溶菌酶活力影响极显著 (P<0.01)。第6小时时各NH4-N浓度处理组个体溶菌酶活力与对照组相比均呈降低趋势,但随着时间的延长,溶菌酶活力呈先增后降 (22 mg·L–1 和102 mg·L–1处理组)或先增后降再增 (47 mg·L–1和220 mg·L–1处理组)的趋势 (图1-a)。综上,溶菌酶活力表现出“抑制−诱导”的趋势。
![]() 图 1 氨氮胁迫对方斑东风螺4种消化酶活力的影响不同字母表示同一组不同处理时间之间存在显著性差异,字母下标数字代表组号,分别为22 mg∙L–1、47 mg∙L–1、102 mg∙L–1和220 mg∙L–1Figure 1. Effect of NH4-N stress on activities of four digestive enzymes of B. areolataDifferent letters indicate significant difference. The subscript letters represent group No., which are 122 mg∙L–1, 47 mg∙L–1, 102 mg∙L–1 and 220 mg∙L–1, respectively.
图 1 氨氮胁迫对方斑东风螺4种消化酶活力的影响不同字母表示同一组不同处理时间之间存在显著性差异,字母下标数字代表组号,分别为22 mg∙L–1、47 mg∙L–1、102 mg∙L–1和220 mg∙L–1Figure 1. Effect of NH4-N stress on activities of four digestive enzymes of B. areolataDifferent letters indicate significant difference. The subscript letters represent group No., which are 122 mg∙L–1, 47 mg∙L–1, 102 mg∙L–1 and 220 mg∙L–1, respectively.2.3 NH4-N胁迫对方斑东风螺胃蛋白酶活力的影响
处理时间和不同质量浓度的NH4-N均极显著影响方斑东风螺胃蛋白酶活力 (P<0.01)。相比对照组,22 mg·L–1处理组个体胃蛋白酶活力随时间的延长呈“诱导−抑制”变化趋势,但47 mg·L–1处理组个体胃蛋白酶活力随时间的延长却呈现“抑制−诱导−抑制”变化趋势,而其他各处理组个体胃蛋白酶活力随时间的变化趋势为“抑制−诱导”且峰值均出现在第72 小时,谷值均出现在第6小时 (图1-b)。
2.4 NH4-N胁迫对方斑东风螺脂肪酶活力的影响
处理时间对方斑东风螺脂肪酶活力影响极显著 (P<0.01),不同浓度的NH4-N胁迫导致各组处理个体脂肪酶活力变化趋势也存在显著差异 (P<0.05)。各处理组脂肪酶活力较对照组在总体上呈抑制作用或与对照组呈相似水平,但中质量浓度处理组 (47 mg·L–1、102 mg·L–1)个体脂肪酶活力在第6小时时表现出诱导作用,低、高质量浓度处理组 (22 mg·L–1、220 mg·L–1)个体脂肪酶活力于第48小时时表现出诱导作用 (图1-c)。
2.5 NH4-N胁迫对方斑东风螺淀粉酶活力的影响
处理时间对方斑东风螺淀粉酶活力影响极显著 (P<0.01),不同浓度的NH4-N胁迫导致各组处理个体淀粉酶活力变化趋势存在明显差异 (P<0.05)。各处理组淀粉酶活力相比对照组在处理时间较短的情况下并无太大的诱导或抑制作用,NH4-N质量浓度为47 mg·L–1和102 mg·L–1的处理组在第72和第96小时才表现出明显的诱导作用,而NH4-N质量浓度为220 mg·L–1的处理组在第6小时表现出明显的抑制作用,并在第36和第96小时时具有一定的诱导作用 (图1-d)。
3. 讨论
3.1 NH4-N对方斑东风螺生存状况和成活率的影响
研究表明,对水生动物造成危害甚至死亡的NH4-N成分主要是NH3[2]。NH3因不带电荷且具有较强的脂溶性而对水生动物有极大毒性,能够穿透贝体细胞膜表现出毒性效应,但
${\rm{NH}}_4^ + $ 对水生动物毒性很小[7,11,18]。本实验结果显示,方斑东风螺对NH4-N具有一定的耐受性,因此高质量浓度 (500 mg∙L–1) NH4-N处理24 h仅 (20.3±2.1)%的死亡率,但在96 h后全部死亡,说明该NH4-N浓度已超过方斑东风螺最大耐受浓度。师尚丽等[2]指出,NH4-N的浓度越大,其毒性作用越强,与本实验结果一致。因此,养殖生产中应尽可能地降低养殖水体中NH4-N的浓度,及时清理投喂的冰鲜鱼、虾蟹肉等残渣及死亡的东风螺等,防止含氮有机物分解产生NH4-N。另外,方斑东风螺对NH4-N的应激行为表现为运动缓慢、对外界刺激反应迟钝和爬壁运动减少等,可能是NH4-N影响了东风螺的组织器官,如影响肌肉伸缩能力和神经介质传递。研究表明,水体中的NH4-N会影响鱼、贝类等水产动物的生长摄食、组织器官和免疫机能等 [12,19-23]。洪美玲等[24]在研究NH4-N对中华绒螯蟹 (Eriocheir sinensis)幼体的免疫指标及肝胰腺组织结构影响时指出,NH4-N不仅损伤机体非特异性免疫防御系统,还对机体细胞和组织造成伤害。王琨[25]研究发现,在NH4-N的影响下鲤 (Cyprinus carpio)幼鱼的各个组织器官 (鳃、肠、心肌、肾脏、脾脏和肝脏)均受到不同程度的损伤,且高浓度的NH4-N使鲤幼鱼的红细胞数量和血红蛋白浓度下降,而组织器官的损伤和免疫机能的下降正是造成鲤容易患病、死亡的主要原因。
3.2 NH4-N对方斑东风螺个体消化酶活力的影响
大量研究表明,NH4-N作为养殖水质污染源之一,除了对鱼、贝类等水产动物机体的血液指标、组织结构和免疫机能造成损害,还能降低鱼虾贝类的产卵能力[26],引起血淋巴理化因子和抗病能力的变化[27-28],使血淋巴中血细胞 (如透明细胞、颗粒细胞和半颗粒细胞)数量下降[7],还会对水生生物消化系统酶活力造成影响[5]。本研究结果表明,不同质量浓度的NH4-N对消化酶活力均产生影响,且随着处理时间的延长表现出不同的诱导或抑制作用。NH4-N对方斑东风螺个体溶菌酶活力表现出“抑制−诱导”的趋势,说明贝类溶菌酶活力的提高可能也是一种防御反应外的被动病理显示[29]。相比对照组,22 mg·L–1处理组个体胃蛋白酶活力随时间的延长呈“诱导−抑制”变化趋势,但47 mg·L–1处理组个体胃蛋白酶活力随时间的延长呈“抑制−诱导−抑制”变化趋势;而其他各处理组个体胃蛋白酶活力均在NH4-N处理一段时间后表现出抑制作用。可以看出在NH4-N急性胁迫下,由于NH4-N的毒性作用,使得机体的相关代谢酶活力降低,而机体的应激反应又在短时间内诱导酶活力上升,其恢复正常水平的时间反映了机体对环境的适应能力。最终酶活力的显著降低说明对处理个体已经造成毒害作用。而不同NH4-N质量浓度对方斑东风螺处理个体脂肪酶活力的总体抑制,更表明了NH4-N的毒害作用。赵海涛[30]通过南方鲶 (Silurus meridionalis)幼鱼的NH4-N胁迫实验得出,经NH4-N胁迫后南方鲶幼鱼的造血机能受损,机体无法将氧 (O2)顺利携带进入,猜测NH4-N急性中毒引起死亡的主要原因是由机体组织缺氧造成。而乔顺风等[31-32]认为,NH4-N的毒性大小取决于存在状态,当水体中的NH4-N以NH3状态存在时,便会对水生动物产生很强的神经性毒害,造成急性氨中毒。李波等[33]在研究亚硝酸 (HNO2)和NH4-N对黄颡鱼 (Pelteobagrus fulvidraco)的急性毒性时发现,NH4-N对黄颡鱼的毒性明显大于HNO2对黄颡鱼的毒性,因而把NH4-N作为黄颡鱼养殖过程中毒性危害的重要影响因子。
此外,虽然各消化酶活力随着NH4-N处理浓度显著变化,但并不存在明显的线性关系或一致规律,变化规律较特异,这可能与东风螺的高抗逆性等生理习性或所处发育阶段不同有关,也可能是NH4-N的胁迫对其消化系统造成了一定的紊乱效应,但并未引起死亡是因为胁迫处理计量仍在其适应范围内。有研究表明,NH4-N胁迫程度的差异性与对象规格、养殖密度和个体差异等有关[34]。NH4-N处理组方斑东风螺消化酶活力的变化规律很好地指引了养殖过程中水体NH4-N的控制范围,从而防止因超过最大承受能力而造成重大养殖损失。
-
表 1 马氏珠母贝肉酶解产物及其超滤组分中蛋白质和小分子肽含量
Table 1 Content of protein and small molecule peptide in EP and its ultrafiltration components
$\overline {\mathit{\boldsymbol{X}}}{\bf \pm {{SD}}} $ 组别
Group蛋白质质量分数
Protein mass fraction/(g·kg−1)小分子肽质量分数
Small molecular peptide mass fraction/(g·kg−1)小分子肽占比
Proportion of small molecular peptides/%马氏珠母贝肉酶解产物组 EP group 616.65±50.15 451.14±15.39 73.38±4.11 EP-Ⅰ组 EP-Ⅰ group 575.67±36.22 91.91±17.89** 16.08±3.75** EP-Ⅱ组 EP-Ⅱ group 554.42±39.59 155.33±26.00** 28.13±5.09** EP-Ⅲ组 EP-Ⅲ group 490.29±24.35* 431.74±16.74 88.22±5.90** 注:与马氏珠母贝肉酶解产物组相比,*. P<0.05,**. P<0.01;表2同此 Note: Compared with the enzymatic hydrolysate of P. martensii; *. P < 0.05; **. P < 0.01. The same case in Table 2. 表 2 马氏珠母贝肉酶解产物及其超滤组分的氨基酸组成
Table 2 Amino acid composition of EP and its ultrafiltration components
g·kg−1 氨基酸种类
Amino acid species马氏珠母贝肉酶解产物
EP groupEP-Ⅰ组
EP-Ⅰ groupEP-Ⅱ组
EP-Ⅱ groupEP-Ⅲ组
EP-Ⅲ group天冬氨酸 Asp 49.10±0.35 31.80±0.41** 35.10±0.61** 46.10±0.61** 苏氨酸 Thr* 22.30±0.65 13.50±0.74** 21.10±0.45 19.10±0.66** 丝氨酸 Ser 18.10±0.28 11.20±0.31** 11.80±0.74** 10.40±0.54** 谷氨酸 Glu 55.20±0.71 58.90±0.11** 58.70±0.40** 72.20±0.34** 脯氨酸 Pro# 20.10±0.55 17.30±0.58 ** 17.90±0.27** 14.10±0.17** 甘氨酸 Gly# 35.30±0.82 29.00±0.34** 32.10±0.45** 36.00±0.45 丙氨酸 Ala# 30.00±0.41 26.20±0.62** 31.00±0.69 31.40±0.92 胱氨酸 Cys 0.70±0.04 0.50±0.07 0.60±0.16 1.50±0.10** 缬氨酸 Val*# 24.60±0.92 21.20±0.69* 25.20±0.24 24.70±0.75 蛋氨酸 Met* 11.60±0.54 12.80±0.20** 10.10±0.44** 10.00±0.45** 异亮氨酸 Ile*# 20.60±0.61 21.80±0.65 21.80±0.25 21.50±0.83 亮氨酸 Leu*# 31.10±0.44 28.50±0.74** 33.40±0.54** 36.50±0.38** 酪氨酸 Tyr 5.10±0.17 6.90±0.13** 9.10±0.18** 7.80±0.21** 苯丙氨酸 Phe*# 17.00±0.96 14.60±0.51** 18.90±0.17** 19.70±0.66** 赖氨酸 Lys* 37.40±0.83 23.20±0.45** 26.00±0.98** 32.60±0.88** 组氨酸 His 6.80±0.59 8.30±0.27* 8.90±0.25* 7.70±0.20 精氨酸 Arg 28.00±0.59 13.60±0.54** 20.10±0.88** 15.20±0.34** 氨基酸总和 Total amino acid, TAA 413.00±4.53 339.30±3.51 381.80±3.82 406.50±1.80 必需氨基酸 Essential amino acid, EAA 164.60±2.86 135.60±1.17 156.50±1.68 164.10±0.78 疏水性氨基酸 Hydrophobic amino acid, HAA 178.70±1.51 158.60±1.73 180.30±1.23 183.90±1.74 注:*. 必需氨基酸;#. 疏水性氨基酸 Note: *. Essential amino acid; #. Hydrophobic amino acid 表 3 马氏珠母贝肉酶解产物超滤组分的体外抗氧化能力
Table 3 Antioxidant capacity of EP ultrafiltration components in vitro
$\overline {\mathit{\boldsymbol{X}}}{\bf \pm {{SD}}} $ 组别
Group2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)
二铵盐自由基清除率
ABTS free radical scavenging activity/%2,2-联苯基-1-苦基肼基自由基清除率
DPPH free radical scavenging activity/%还原力A700 nm
Reducing power维生素C组 VC group 89.60±0.23 89.39±0.82 1.878±0.083 EP-Ⅰ组 EP-Ⅰ group 86.68±0.44** 84.54±1.47* 1.568±0.060** EP-Ⅱ组 EP-Ⅱ group 87.46±0.18** 85.13±2.57* 1.811±0.050 EP-Ⅲ组 EP-Ⅲ group 88.14±0.25** 86.34±1.21 1.811±0.046 注:与维生素C组相比,*. P < 0.05;**. P < 0.01 Note: Compared with VC group, *. P < 0.05; **. P < 0.01 表 4 马氏珠母贝肉酶解产物超滤组分对酒精性肝损伤小鼠体质量及其肝脏指数的影响
Table 4 Effects of EP ultrafiltration components on body mass and liver index of ALD mice
$\overline {\mathit{\boldsymbol{X}}}{\bf \pm {{SD}}} $ 组别
Group初次灌胃体质量
Body mass of primary gastric perfusion/g末次灌胃体质量
Body mass of last gastric perfusion/g肝脏指数
Liver index/(mg·g−1)空白对照组 Blank control group 23.63±1.05 25.31±0.71 3.55±0.21## 酒精模型组 Alcohol model group 24.37±0.83 26.35±0.87 4.40±0.26** 阳性对照组 Positive control group 23.35±1.40 25.40±1.29 3.97±0.37*# EP-Ⅰ组 EP-Ⅰ group 24.75±0.97 26.23±0.80 4.20±0.38** EP-Ⅱ组 EP-Ⅱ group 24.31±0.73 26.47±1.44 3.90±0.32## EP-Ⅲ组 EP-Ⅲ group 23.75±0.76 26.57±1.59 3.78±0.15## 注:与空白对照组相比,*. P<0.05,**. P<0.01;与酒精模型组相比,#. P<0.05,##. P<0.01;图2、图3、表5同此 Note: Compared with blank control group, *. P<0.05, **. P< 0.01; compared with alcohol model group, #. P < 0.05, ##. P<0.01. The same case in Figure 2–3 and Table 5. 表 5 马氏珠母贝肉酶解产物超滤组分对酒精性肝损伤小鼠肝脏中超氧化物歧化酶、谷胱甘肽、丙二醛和甘油三酯的影响
Table 5 Effects of EP ultrafiltration components on SOD, GSH, MDA and TG in liver of ALD mice
$\overline {\mathit{\boldsymbol{X}}}{\bf \pm {{SD}}} $ 组别
Group超氧化物歧化酶活力
SOD activity/(U·mg−1)谷胱甘肽
GSH/(nmol·mL−1)丙二醛
MDA/(nmol·mg−1)甘油三酯
TG/(nmol·mL−1)空白对照组 Blank control group 15.88±0.45## 2.64±0.27## 1.10±0.28## 0.02±0.01## 酒精模型组 Alcohol model group 14.75±0.40** 1.58±0.13** 1.90±0.60** 0.07±0.02** 阳性对照组 Positive control group 15.24±0.38 1.92±0.28** 1.19±0.24## 0.02±0.02## EP-Ⅰ组 EP-Ⅰ group 15.13±0.28** 2.07±0.29**## 1.44±0.28## 0.05±0.03** EP-Ⅱ组 EP-Ⅱ group 15.20±0.61** 2.14±0.38**## 1.22±0.35## 0.03±0.03## EP-Ⅲ组 EP-Ⅲ group 15.58±0.61## 2.25±0.45## 1.04±0.17## 0.03±0.01## -
[1] 章超桦, 吴红棉. 马氏珠母贝肉的营养成分及其游离氨基酸组成[J]. 水产学报, 2000, 24(2): 180-184. [2] 于志鹏, 武思佳, 赵文竹, 等. 海洋贝类蛋白源生物活性肽及肽组学的研究进展[J]. 食品工业科技, 2015, 36(22): 384-388. [3] 吴燕燕, 尚军, 李来好, 等. 合浦珠母贝肉短肽的分离及其抗氧化活性研究[J]. 食品工业科技, 2013, 33(7): 123-126. [4] 吴燕燕, 宫晓静, 李来好, 等. 风味蛋白酶水解合浦珠母贝肉制备抗菌肽人工神经网络法优化工艺[J]. 食品科学, 2011, 32(20): 63-68. [5] 章超桦, 刘亚, 杨萍, 等. 马氏珠母贝肉酶解蛋白抗疲劳功能的初步研究[J]. 中国海洋药物, 2006(4): 46-47. doi: 10.3969/j.issn.1002-3461.2006.04.011 [6] 曹文红, 吴红棉, 章超桦, 等. 马氏珠母贝肉酶解产物ACE抑制活性的研究[J]. 食品与发酵工业, 2008, 34(8): 60-64. [7] 韩丽娜, 秦小明, 林华娟, 等. 马氏珠母贝肉的醒酒作用机理初探[J]. 食品科技, 2010, 35(10): 180-183. [8] WU S, YANG C, XU N, et al. The protective effects of helix b surface peptide on experimental acute liver injury induced by carbon tetrachloride[J]. Digest Dis Sci, 2017, 62(6): 1537-1549. doi: 10.1007/s10620-017-4553-7
[9] MING C W, PEI L Z, CHANG X J, et al. Preliminary characterization, antioxidant activity in vitro and hepatoprotective effect on acute alcohol-induced liver injury in mice of polysaccharides from the peduncles of Hovenia dulcis[J]. Food Chem Toxicol, 2012, 50(9): 2964-2970. doi: 10.1016/j.fct.2012.06.034
[10] YAN S L, YANG H T, LEE H L, et al. Protective effects of maslinic acid against alcohol-induced acute liver injury in mice[J]. Food Chem Toxicol, 2014, 74(6): 1537-1549.
[11] BRANDON W E, SCHRUM L W, SCHMIDT C M, et al. Rodent models of alcoholic liver disease: of mice and men[J]. Alcohol, 2012, 46(8): 715-725. doi: 10.1016/j.alcohol.2012.08.004
[12] CRABB D W, GALLI A, FISCHER M, et al. Molecular mechanisms of alcoholic fatty liver: role of peroxisome proliferator-activated receptor alpha[J]. Alcohol, 2004, 34(1): 35-38. doi: 10.1016/j.alcohol.2004.07.005
[13] HETAL A K, SAMIR P. Management of alcoholic hepatitis: current concepts[J]. World J Hepatol, 2012, 4(12): 335-341. doi: 10.4254/wjh.v4.i12.335
[14] 胡滨, 李康林, 吴桥, 等. 猪血蛋白酶解物对小鼠急性酒精性肝损伤的保护作用[J]. 食品科学, 2018, 39(11): 185-190. doi: 10.7506/spkx1002-6630-201811029 [15] 刘鹏. 低分子量促乙醇代谢玉米肽制备与蛋白成分对活性贡献关系研究[D]. 广州: 华南理工大学, 2015: 17. [16] CAI X X, YAN A N, FU N Y, et al. In vitro antioxidant activities of enzymatic hydrolysate from Schizochytrium sp. and its hepatoprotective effects on acute alcohol-induced liver injury in vivo[J]. Mar Drugs, 2017, 15(4): 115-124. doi: 10.3390/md15040115
[17] UDENIGWE C C, ALUKO R E. Chemometric analysis of the amino acid requirements of antioxidant food protein hydrolysates[J]. Int J Mol Sci, 2011, 12(12): 3148-3161.
[18] 郭辉, 何慧, 韩樱, 等. 玉米肽对小鼠酒后肝脏乙醇脱氢酶活力的影响及醒酒机理[J]. 食品科学, 2011, 32(11): 265-269. [19] SARMADI B H, ISMAIL A. Antioxidative peptides from food proteins: a review[J]. Peptides, 2010, 31(10): 1949-1956.
[20] GIMÉNEZ B, ALEMÁN A, MONTERO P, et al. Antioxidant and functional properties of gelatin hydrolysates obtained from skin of sole and squid[J]. Food Chem, 2009, 114(3): 976-983. doi: 10.1016/j.foodchem.2008.10.050
[21] GUO C Y, JIANG T L, HUI H E, et al. Ultrafiltration preparation of potent bioactive corn peptide as alcohol metabolism stimulator in vivo and study on its mechanism of action[J]. J Food Biochem, 2013, 37(2): 161-167. doi: 10.1111/j.1745-4514.2011.00613.x
[22] 翟硕, 张海悦, 田田. 黑豆多肽的制备及其对乙醇脱氢酶活性的影响研究[J]. 食品安全质量检测学报, 2016, 7(12): 4864-4869. [23] 蒲月华, 邓旗, 杨萍, 等. 珍珠贝多肽体外抗氧化活性的研究[J]. 食品科技, 2016(11): 124-128. [24] 吴静, 胡晓, 杨贤庆, 等. 鸢乌贼酶解产物的抗氧化稳定性与功能特性[J]. 南方水产科学, 2016, 12(5): 105-111. doi: 10.3969/j.issn.2095-0780.2016.05.013 [25] 彭文锋, 钟政永. ADA与ALT、AST、GGT联合检测在肝脏疾病诊断中的意义[J]. 当代医学, 2011, 17(9): 4-6. doi: 10.3969/j.issn.1009-4393.2011.9.003 [26] 王佳佳, 赵莎莎, 杨最素, 等. 文蛤寡肽对小鼠急性肝损伤的保护作用[J]. 食品科学, 2017, 38(13): 190-195. doi: 10.7506/spkx1002-6630-201713031 [27] JE J Y, CHA J Y, CHO Y S, et al. Hepatoprotective effect of peptic hydrolysate from salmon pectoral fin protein byproducts on ethanol-induced oxidative stress in Sprague-Dawley rats[J]. Food Res Int, 2013, 51(2): 648-653. doi: 10.1016/j.foodres.2013.01.045
[28] 刘奇奇, 温久福, 区又君, 等. 急性操作胁迫对四指马鲅幼鱼肝脏组织结构和氧化应激的影响[J]. 南方水产科学, 2017, 13(5): 103-109. doi: 10.3969/j.issn.2095-0780.2017.05.014 [29] SCHEMITT E G, HARTMANN R M, COLARES J R, et al. Protective action of glutamine in rats with severe acute liver failure[J]. World J Hepatol, 2019, 11(3): 27-40.
[30] KOCH O R, PANI G, BORRELLO S, et al. Oxidative stress and antioxidant defenses in ethanol-induced cell injury[J]. Mol Aspects Med, 2004, 25(1/2): 191-198.
[31] LU J, LYU Y B, LI M T, et al. Alleviating acute alcoholic liver injury in mice with Bacillus subtilis co-expressing alcohol dehydrogenase and acetaldehyde dehydrogenase[J]. J Funct Foods, 2018, 49: 342-350. doi: 10.1016/j.jff.2018.09.006
[32] XIAO C Q, ZHOU F B, ZHAO M M, et al. Chicken breast muscle hydrolysates ameliorate acute alcohol-induced liver injury in mice through alcohol dehydrogenase (ADH) activation and oxidative stress reduction[J]. Food Funct, 2018, 9(2): 1-42.
-
期刊类型引用(10)
1. 孙阿君,丁炜东,曹丽萍,曹哲明,邴旭文. 氨氮胁迫对翘嘴鳜幼鱼抗氧化酶、消化酶活性及应激相关基因表达的影响. 水产科技情报. 2024(01): 44-51 .  百度学术
百度学术
2. 王筱,冼健安,张秀霞,张泽龙,李军涛,郑佩华,吴恒梅,鲁耀鹏. 方斑东风螺人工养殖、环境生理和营养需求研究进展. 中国饲料. 2024(03): 83-88+117 .  百度学术
百度学术
3. 张钰伟,赵旺,邓正华,黄星美,温为庚,孙敬锋,王瑞旋. 芽孢杆菌对方斑东风螺生长、存活、免疫及消化酶活性的影响. 南方水产科学. 2023(01): 106-115 .  本站查看
本站查看
4. 梁晶,邢诒炫,吕布,臧战,刘子岭,唐贤明,於锋,Hebert Ely Vasquez,战欣,郑兴,顾志峰. 底砂粒径对方斑东风螺生长、消化、抗氧化及底质的影响. 水产科技情报. 2023(03): 137-145 .  百度学术
百度学术
5. 梅泊承,张晓东,赵淳朴,徐继林,王丹丽,郭春阳. 串联养殖模式下的凡纳滨对虾(Litopenaeus vannamei)与缢蛏(Sinonovacula constricta)生长特性、消化免疫及水生态效应. 海洋与湖沼. 2023(03): 907-920 .  百度学术
百度学术
6. 赵旺,温为庚,谭春明,黄星美,杨蕊,陈明强,杨其彬,陈旭. 饥饿胁迫对猛虾蛄溶菌酶和消化酶活性的影响. 水产科技情报. 2022(01): 30-35 .  百度学术
百度学术
7. 谭春明,赵旺,马振华,于刚. 红腹海参消化道指标、组织学和酶活性的季节变化. 南方水产科学. 2022(05): 39-45 .  本站查看
本站查看
8. 周建聪,顾志峰,叶丙聪,刘闯,羊玉梅,刘春胜,王爱民,石耀华. 盐度和氨氮对方斑东风螺存活和能量收支的影响. 海洋科学. 2022(10): 104-112 .  百度学术
百度学术
9. 韩朝婕,陈屹洋,贺振楠,张严匀,周文礼,高金伟,贾旭颖. 氨氮胁迫对水产动物生长、消化酶及免疫影响的研究进展. 河北渔业. 2021(05): 32-35 .  百度学术
百度学术
10. 丁炜东,曹丽萍,曹哲明,邴旭文. 氨氮胁迫对翘嘴鳜幼鱼鳃、消化道酶活力的影响. 南方水产科学. 2020(03): 31-37 .  本站查看
本站查看
其他类型引用(6)





 下载:
下载:




 粤公网安备 44010502001741号
粤公网安备 44010502001741号
