Preparation and immunogenicity of Lactococcus lactis vaccine expressing Sip-Pgk fusion protein of Streptococcus agalactiae isolated from tilapia
-
摘要:
为研制比无乳链球菌(Streptococcus agalactiae)单个蛋白抗原免疫效果更佳的多蛋白重组罗非鱼 (Oreochromis sp.) 链球菌病口服疫苗,该研究利用同源重组法构建表达无乳链球菌Sip-Pgk融合蛋白的pNZ8148-sip-pgk质粒,通过电转化乳酸乳球菌(Lactococcus lactis) NZ9000中获得L. lactis NZ9000 pNZ8148-sip-pgk重组乳酸菌,使用nisin诱导表达并进行Western blot鉴定,制备Sip-Pgk融合蛋白乳酸菌口服疫苗,通过不同免疫次数隔周免疫的方式灌胃罗非鱼。ELISA检测免疫后的血清抗体水平,在灌胃免疫结束后的第18天通过腹腔注射无乳链球菌攻毒获得相对免疫保护率。结果显示,构建的重组乳酸菌诱导表达的蛋白大小为92 kD,与目的蛋白大小一致。与2次免疫比较,3次免疫该融合蛋白乳酸菌疫苗能显著提高罗非鱼的血清抗体水平和对无乳链球菌的免疫保护效果。3次免疫Sip-Pgk融合蛋白乳酸菌疫苗的血清水平显著高于单一蛋白组和PBS组,其相对免疫保护率最高(45.56%)。
Abstract:In order to develop a more effective Oreochromis sp. oral vaccine of Streptococcus agalactiae, we constructed a recombinant plasmid pNZ8148-sip-pgk which expressed Sip-Pgk fusion protein of S. agalactiae by using homologous recombination, and Lactococcus lactis NZ9000 pNZ8148-sip-pgk was obtained by electrotransformation of L. lactis NZ9000. The Sip-Pgk fusion protein was induced by nisin and tested by Western blot so that a Sip-Pgk fusion protein Lactobacillus oral vaccine was prepared. The tilapia was vaccinated orally by gavage with recombinant L. lactis NZ9000 pNZ8148-sip-pgk for twice or three times. ELISA was used to detect the level of serum antibody after immunization, and the relative immune protection rate was obtained by intraperitoneal injection of S. agalactis on the 18th day after immunization. The results show that the inducible protein size of the constructed recombinant Lactobacillus was 92 kD, which was consistent with the size of the target protein. Compared with the second immunization, the third immunization with the fusion protein Lactobacillus vaccine could significantly improve the serum antibody level of tilapia and the immune protection against S. agalactiae. The serum level of Lactobacillus vaccine immunized with three times Sip-Pgk fusion protein was significantly higher than that of single protein group and PBS group, with the highest relative immune protection rate of 45.56%.
-
Keywords:
- Oreochromis sp. /
- Streptococcus agalactiae /
- Lactococcus lactis vaccine /
- fusion protein /
- immunity
-
罗非鱼(Oreochromis sp.)是中国南方主要养殖鱼类之一,具有食性杂、适应性广、繁殖能力强、生长速度快等优点[1-3]。中国是目前世界上最大的罗非鱼养殖、消费和加工出口国之一[4],而广东是中国主要罗非鱼养殖产地,每年罗非鱼的产量约60×104 t[5]。近年来,罗非鱼病害的爆发对其产业造成巨大损失,且趋势越发严重,阻碍了罗非鱼产业的健康发展[6-7]。罗非鱼病害的主要病原有海豚链球菌(Streptococcus iniae)和无乳链球菌(S. agalactiae)[8-11],其中90%以上的临床菌株为无乳链球菌[12-14]。
罗非鱼无乳链球菌病发生的主要原因有养殖水质差、养殖密度大、使用低质饲料等[15]。该病的防治方法主要有药物、生态和免疫防治。化学药物防治是最直接、便捷的防控手段,但长期使用化学药品容易产生耐药性,导致药物残留引起质量安全问题。疫苗具有无残留、不易引起耐药性、安全高效等优点,可替代化学药物作为罗非鱼链球菌病防控的重要途径,是罗非鱼病害防控的发展趋势。相较于其他免疫方式,口服疫苗使用更为方便,具有不受养殖时间、地点和受体大小的限制,对鱼体无损伤等优点[16-17]。乳酸乳球菌(Lactococcus lactis)是一种安全级的微生物[18],其细胞壁缺乏脂多糖而没有诱导产生内毒素的风险,基因组较小,表达的天然蛋白少,适合作为外源蛋白的表达宿主。且乳酸菌表达的蛋白不需要蛋白的纯化和复性过程,并具有免疫佐剂的作用[19-20],是作为活载体口服疫苗传递抗原的理想选择。Sáez等[21]构建重组铜(Cu)/锌(Zn)超氧化物歧化酶乳酸菌疫苗,口服免疫小鼠(Mus musculus)结果显示,重组乳酸菌可作为抗布鲁氏杆菌的活载体口服疫苗。Adachi等[22]用酪乳酸杆菌构建的表达HPV E7蛋白的载体疫苗通过口服免疫小鼠后可诱导产生有效的粘膜免疫应答。
随着对无乳链球菌的研究不断深入,研究者发现越来越多的无乳链球菌亚单位抗原,如无乳链球菌膜表面蛋白(surface immunogenic protein, Sip)与磷酸甘油酸激酶(phosphoglycerate kinase,Pgk)均具有较好的免疫原性[23-24]。Pgk是糖代谢活动的必需酶,缺失容易引起无乳链球菌糖代谢紊乱从而使细菌无法生存;Sip在无乳链球菌定植和黏附机体细胞过程中起着至关重要的作用。这两种蛋白在无乳链球菌的进化过程中保守性强,均可作为无乳链球菌疫苗抗原的候选蛋白。研究表明,将两个或以上的免疫原性基因融合,表达的融合蛋白的免疫原性优于单个蛋白[25-27],布日额等[28]把sip和pgk基因串联表达,Western blot结果表明Sip- Pgk融合蛋白抗原能与无乳链球菌的多抗血清发生特异性反应,具有较好的免疫生物学活性。
罗非鱼无乳链球菌有多种表面抗原蛋白,目前研究报道最多的是Sip[29-30],而Pgk未见报道,Sip-Pgk融合蛋白的罗非鱼乳酸菌疫苗也未见报道。选取多个具有免疫原性的基因作为疫苗组分联合表达是疫苗的研究趋势,因此本研究选取sip和pgk基因联合表达无乳链球菌Sip-Pgk融合蛋白作为疫苗组分,制备L. lactis NZ9000 pNZ8148-sip-pgk作为罗非鱼口服疫苗,通过灌胃免疫罗非鱼后用无乳链球菌进行感染,评价该罗非鱼口服疫苗的免疫保护效果,以期为罗非鱼链球菌病口服疫苗的研究提供新思路。
1. 材料与方法
1.1 实验材料
健康罗非鱼[体长(8±1) cm,体质量(14±1) g],取自广东省罗非鱼良种场。无乳链球菌(WC1535)、pNZ8148质粒、HRP标记的兔抗尼罗罗非鱼IgM抗体均为实验室保存。L. lactis NZ9000、大肠杆菌MC1061感受态购买于REBIO。TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit、TaKaRa MiniBEST Agarose Gel DNA Extraction Kit、TaKaRa MiniBEST Plasmid Purification Kit、In-Fusion试剂盒、Capturem™ His-Tagged Purification Miniprep Kit和PCR相关实验耗材购买于TaKaRa公司。Anti-6×His tag®抗体(HRP,ab1187)、辣根过氧化物酶(HRP)标记的羊抗兔抗体、TMB显色液等Western blot相关耗材购买于广州勤卓生物科技有限公司。BHI培养基、M17培养基、nisin (乳酸菌肽)、氯霉素购于广州市康龙生物科技有限公司。
根据同源重组法原则,设计sip和pgk的PCR引物,并在目的基因引物末端加上6×His标签,选取pNZ8148的通用引物作为鉴定引物,实验所用引物合成于广州艾基生物技术有限公司,引物序列见表1。
表 1 引物信息Table 1 Primers used in this study引物名称
primer name引物序列
primer sequence序列名称
sequence name扩增大小/bp
lengthsip-F GAGGCACTCACCATGAAAATGAATAAAAAGGTACTATTGACATCGACAAT sip 1 349 sip-R GGTTCAAAGAAAGCTTAATGGTGATGGTGATGATGTTTGTTAAATGATACGTG pgk-F GAGGCACTCACCATGGCTAAATTGACTGTTAAAGACGTTGATTTGAAA pgk 1 242 pgk-R GGTTCAAAGAAAGCTTAATGGTGATGGTGATGATGTTTTTCAGTCAATGCT sip-F2 GAGGCACTCACCATGAAAATGAATAAAAAGGTACTATTG sip-2 1 314 sip-R2 TTTGTTAAATGATACTACGTGAACGTGGTCATAGTGGTTGGC pgk-F2 GTATCATTTAACAAAGCTAAATTGACTGTTAAAGACGTTGATTTGAAAGG pgk-2 1 245 pgk-R2 GGTTCAAAGAAAGCTTAATGGTGATGGTGATGATGTTATTTTTCAGTCAATGCT pNZ8148-F TGTCGATAACGCGAGCATAATAAAC pNZ8148-R CAGTAATTGCTTTATCAACTGCTGC 注:斜体部分为载体同源的15 bp 碱基序列;横线为6×His 标签的碱基序列 Note: The italic part is the 15 bp base sequence of homologous carrier, and the horizontal lines indicate the base sequence of 6×His tag. 1.2 PCR扩增sip和pgk基因
无乳链球菌WC1535在BHI培养基中37 ℃、180 r·min−1过夜培养,TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit提取无乳链球菌基因组DNA,以无乳链球菌基因组DNA为模板,扩增sip、pgk、sip-2、pgk-2基因。反应体系:模板1 μL,10×buffer 2 μL,dNTP 0.2 μL,上游下游引物各1 μL,Ex Taq酶0.2 μL,ddH2O 14.6 μL。PCR扩增程序:94 ℃ 10 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。PCR产物经琼脂糖凝胶电泳检测,TaKaRa MiniBEST Agarose Gel DNA Extraction Kit纯化胶回收目的条带,PCR回收产物用于后续载体构建。
1.3 PNZ8148质粒NcoI和HindIII酶切
pNZ8148质粒在30 μg·mL−1氯霉素的LB液体培养基中37 ℃,180 r·min−1过夜扩大培养,TaKaRa MiniBEST Plasmid Purification Kit提取pNZ8148质粒,NcoI和HindIII进行双酶切,酶切反应体系:Cut Smart 2 μL,NcoI 0.5 μL,HindIII 0.5 μL,pNZ8148 3 μL,ddH2O 14 μL,37 ℃ 4 h。酶切产物经琼脂糖凝胶电泳检测,TaKaRa MiniBEST Agarose Gel DNA Extraction Kit纯化胶回收目的条带,酶切回收产物用于后续载体构建。
1.4 乳酸乳球菌NZ9000感受态细胞的制备
将L. lactis NZ9000划线在含0.5%葡萄糖的M17琼脂培养基上,30 ℃静置培养过夜。挑取活化过的乳酸乳球菌单菌落于含0.5%葡萄糖的M17液体培养基,30 ℃静置培养6 h。按1∶10比例取上述培养物于含0.5%葡萄糖+1%甘氨酸的M17液体培养基,30 ℃静置培养过夜。按1∶10比例取上述培养物于含0.5%葡萄糖+0.5 mol·L−1蔗糖+2%甘氨酸的M17液体培养基,继续静置培养至光密度(OD600)=0.5,4 ℃ 5 000 g离心15 min弃上清。加入1体积预冷溶液(0.5 mol·L−1蔗糖+10%甘油)重悬,4 ℃ 5 000 g离心15 min弃上清。加入0.5体积预冷溶液[0.25体积(0.5 mol·L−1蔗糖+10%甘油)+0.05 mol·L−1 Na-EDTA (pH 7.5)]重悬,冰浴15 min,4 ℃ 5 000 g离心15 min弃上清。加入0.01体积预冷溶液(0.5 mol·L−1蔗糖+10%甘油)重悬,分装,−80 ℃保存备用。
1.5 重组表达载体的构建与鉴定
利用TaKaRa公司In-Fusion试剂盒,分别把纯化的sip、pgk、sip-2和pgk-2片段连接双酶切处理的pNZ8148,50 ℃反应组装15 min,热激法转化MC1061感受态细胞。涂布在含30 μg·mL−1氯霉素的LB琼脂培养基上,37 ℃培养过夜,对应获得MC1061 pNZ8148-sip、pNZ8148-pgk、pNZ8148-sip-pgk。利用引物pNZ8148-F和pNZ8148-R PCR鉴定,HindIII酶切阳性质粒,并送样至广州艾基生物技术有限公司进行测序验证。
从MC1061 pNZ8148、pNZ8148-sip、pNZ8148-pgk、pNZ8148-sip-pgk提取质粒pNZ8148、pNZ8148-sip、pNZ8148-pgk、pNZ8148-sip-pgk。取1 000 ng质粒与100 μL乳酸乳球菌NZ9000感受态细胞混匀,加入预冷的2 mm电击杯中,电击参数设置为2 kV、200 Ω、25 μF,加入至900 μL预冷的复苏液(M17+0.5%葡萄糖+0.5 mol·L−1蔗糖+0.002 mol·L−1 MgCl2+0.002 mol·L−1 CaCl2)中于冰上静置5 min,30 ℃静置培养4 h。最终涂布在终质量浓度为10 μg·mL−1氯霉素的M17琼脂平板上,30 ℃培养36 h,对应获得L. lactis NZ9000 pNZ8148、pNZ8148-sip、pNZ8148-pgk、pNZ8148-sip-pgk。阳性克隆在终质量浓度为10 μg·mL−1氯霉素的M17液体培养基扩培后提取质粒,PCR扩增鉴定。
1.6 重组乳酸乳球菌蛋白的表达、纯化和Western blot分析
将L. lactis NZ9000 pNZ8148、pNZ8148-sip、pNZ8148-pgk、pNZ8148-sip-pgk于终质量浓度为10 μg·mL−1氯霉素的M17液体培养基30 ℃静置过夜培养,按1∶10取过夜培养物于终质量浓度为10 μg·mL−1氯霉素的M17液体培养基培养至OD600=0.5,加入总质量浓度为10 ng·mL−1的nisin 30 ℃诱导培养4 h,4 ℃ 5 000 g离心15 min弃上清,等体积的PBS洗菌体2次,用超声波破碎(200 W,每次工作时间2 s,每次间隔5 s,共20 min)。利用Capturem™ His-Tagged Purification Miniprep Kit纯化Sip、Pgk和Sip-Pgk融合蛋白,采用BCA测定纯化的蛋白浓度。
蛋白样品经处理后进行SDS-PAGE电泳,将蛋白带从凝胶转移至醋酸纤维素膜上。一抗为Anti-6×His tag®抗体(HRP,稀释浓度为1∶3 000),二抗为含带HRP 标记的羊抗兔(稀释浓度为1∶5 000),将膜浸入新配制的显色溶液中,当条带或斑点出现后,终止反应,拍照保存。
1.7 重组乳酸乳球菌口服免疫及免疫保护效果评价
将准备的420尾罗非鱼随机分为12组,每组35尾,暂养稳定后进行免疫实验。把12组分成2个大组,6组为在首次免疫7 d后进行2次免疫(14 d),另外6组为在2次免疫(14 d)的基础上7 d后进行3次免疫(21 d),免疫方式为隔周免疫。6个实验组分别为L. lactis NZ9000、L. lactis NZ9000 pNZ8148-sip-pgk (Sip-Pgk融合蛋白乳酸菌疫苗)、L. lactis NZ9000 pNZ8148-sip (Sip蛋白乳酸菌疫苗)、L. lactis NZ9000 pNZ8148-pgk (Pgk蛋白乳酸菌疫苗)、L. lactis NZ9000 pNZ8148和PBS。收集的菌体用PBS稀释成2×1010 CFU·mL−1的菌液,每次灌胃量为200 μL,空白对照组灌胃等体积的PBS溶液。
免疫结束后分别从每组中随机选取罗非鱼尾静脉采血,静置4 ℃过夜,分离血清。采用ELISA测定血清IgM抗体水平,1∶50稀释罗非鱼血清,无乳链球菌WC1535作为固定抗原;抗体是HRP标记的兔抗尼罗罗非鱼IgM抗体(1∶3 000稀释),使用酶标仪测定OD450。
免疫结束后第18天采用无乳链球菌WC1535(血平板培养,28 ℃)进行人工感染实验,所用的浓度为3×108 CFU·mL−1。对各组实验鱼进行腹腔注射攻毒,每尾的注射量为100 μL,水温为(28±2) ℃,连续14 d统计各组鱼死亡情况。取濒死鱼的脑、脾脏、肝脏和肾脏组织分离培养来检查死亡鱼症状判断是否为无乳链球菌感染所致。按照以下公式计算各组相对免疫保护率(relative percent survival, RPS):RPS=(1−免疫组死亡率/对照组死亡率)×100%。
1.8 统计分析
血清抗体效价表示为“平均值±标准差(
$\overline X \pm $ SD)”,运用SPSS 22.0软件作单因素方差分析,分析各组相对免疫保护率及其抗体水平之间差异的显著性。2. 结果
2.1 PCR扩增sip和pgk基因
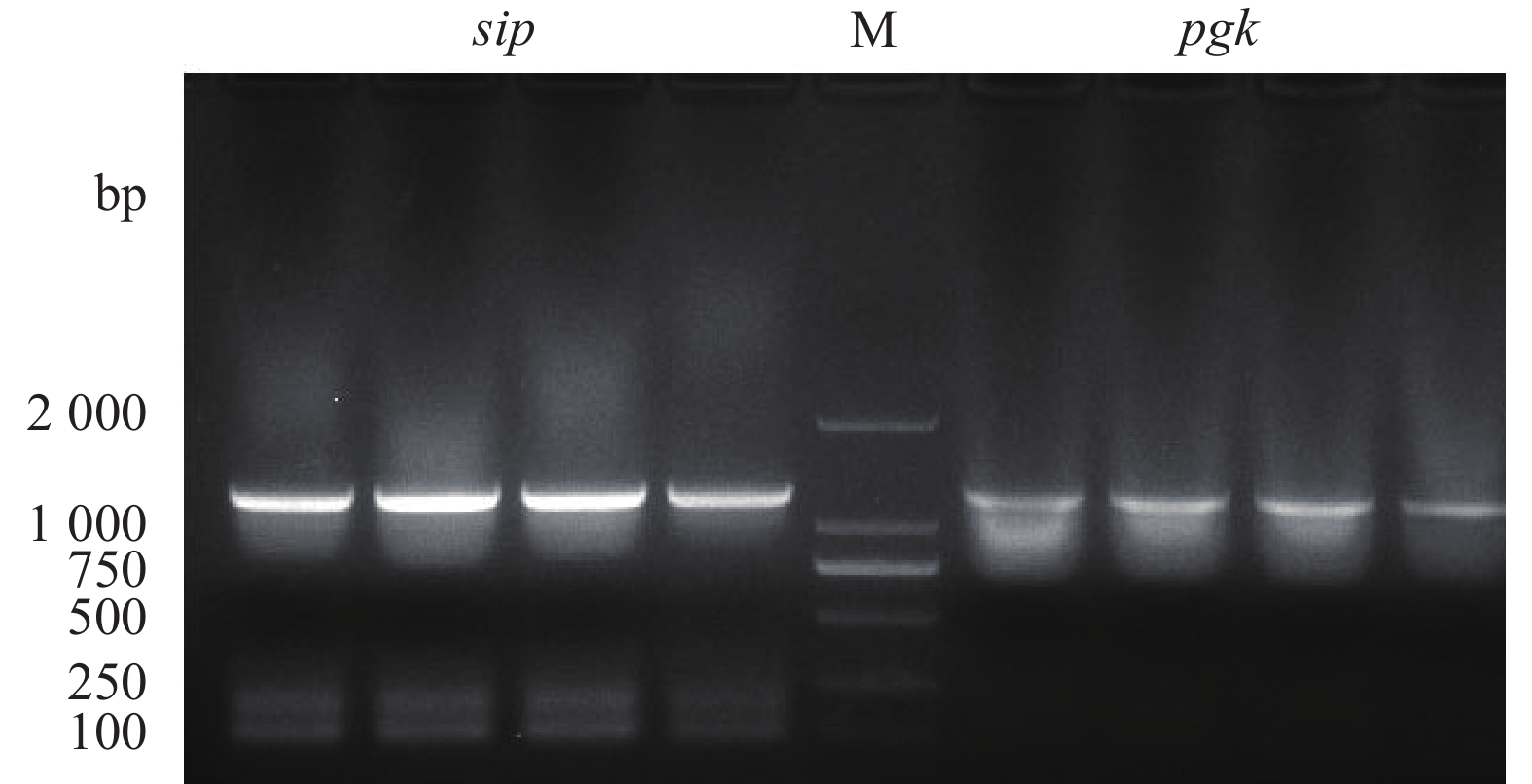
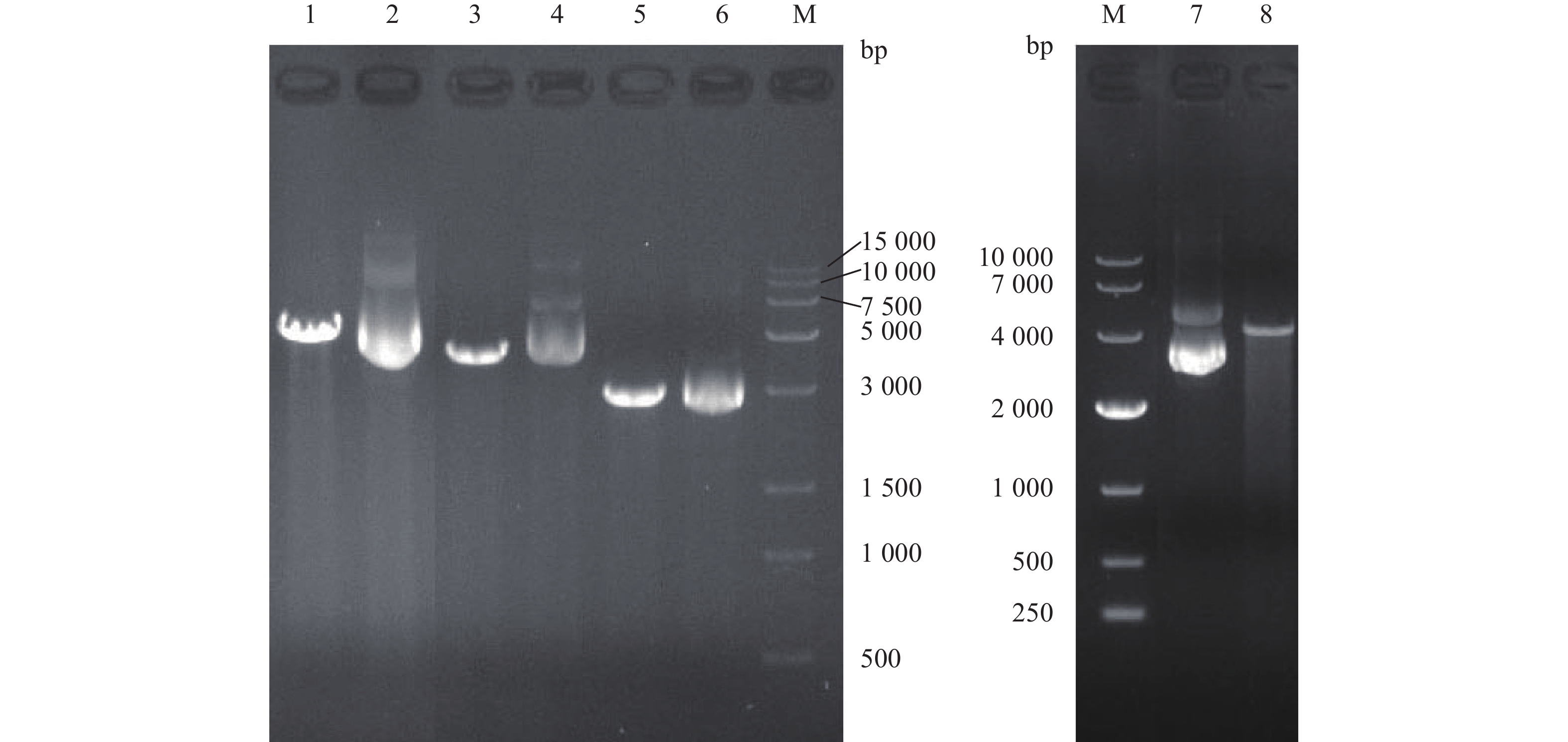
sip、pgk、sip-2、pgk-2预期扩增片段大小分别为1 353 bp、1 245 bp、1 335 bp、1 245 bp,与PCR结果大小一致(图1~图2)。
2.2 pNZ8148质粒NcoI和HindIII酶切的结果
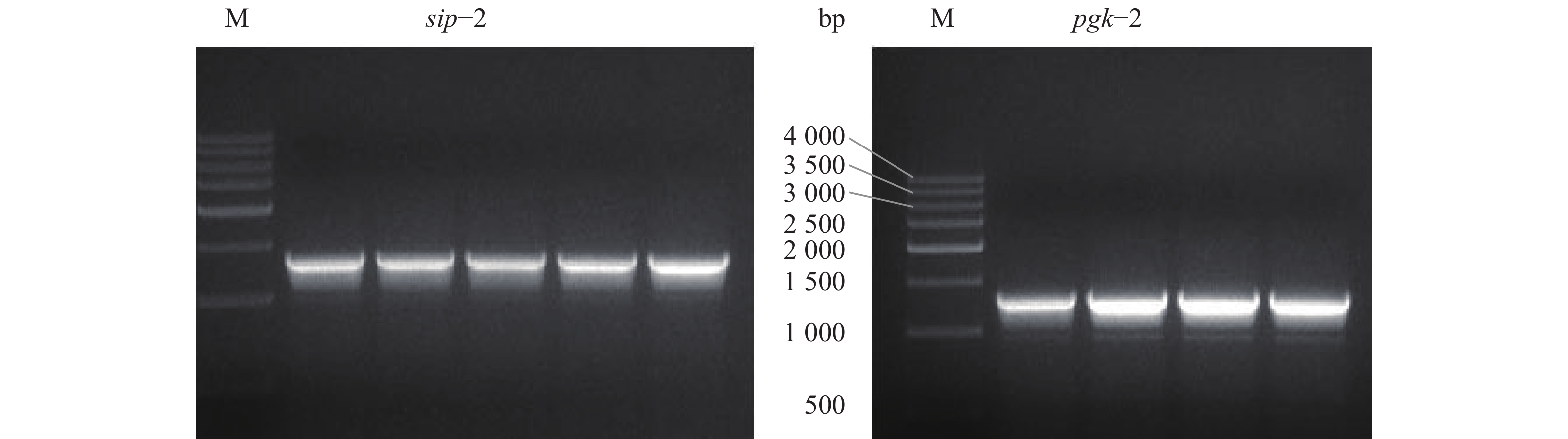
pNZ8148质粒进行NcoI和HindIII双酶切,获得大小为3 161 bp的线性化质粒(图3)。
2.3 重组表达载体的PCR和酶切鉴定
利用引物pNZ8148-F和pNZ8148-R鉴定重组质粒,pNZ8148、pNZ8148-sip、pNZ8148-pgk、pNZ8148-sip-pgk PCR预期扩增目的片段分别为281 bp、1 565 bp、1 457 bp、2 765 bp,与PCR结果大小一致(图4)。阳性克隆质粒pNZ8148-sip-pgk、pNZ8148-sip、pNZ8148、pNZ8148-pgk经HindIII酶切,其对应的线性化片段大小分别为5 926 bp、4 726 bp、3 165 bp、4 618 bp (图5)。重组质粒测序结果与预测序列一致,成功构建了乳酸菌表达质粒pNZ8148-sip、pNZ8148-pgk和pNZ8148-sip-pgk。
![]() 图 4 重组质粒pNZ8148-sip、pNZ8148、pNZ8148-pgk、pNZ8148-sip-pgk PCR扩增鉴定1. 重组质粒pNZ8148-sip;2. pNZ8148-sip的阳性对照;3, 4. 空白对照;5. 重组质粒pNZ8148;6. pNZ8148的阳性对照;7. 重组质粒pNZ8148-pgk;8. pNZ8148-pgk阳性对照;9. 重组质粒pNZ8148-sip-pgk;10. pNZ8148-sip-pgk阳性对照Fig. 4 PCR identification of recombinant plasmid pNZ8148-sip, pNZ8148, pNZ8148-pgk and pNZ8148-sip-pgk1. recombinant plasmid pNZ8124-sip; 2. positive control of pNZ8148-sip; 3 and 4. blank control; 5. recombinant plasmid pNZ8124; 6. positive control of pNZ8148-sip; 7. recombinant plasmid pNZ8124-pgk; 8. positive control of pNZ8148-pgk; 9. recombinant plasmid pNZ8124-sip-pgk; 10. positive control of pNZ8148-sip-pgk
图 4 重组质粒pNZ8148-sip、pNZ8148、pNZ8148-pgk、pNZ8148-sip-pgk PCR扩增鉴定1. 重组质粒pNZ8148-sip;2. pNZ8148-sip的阳性对照;3, 4. 空白对照;5. 重组质粒pNZ8148;6. pNZ8148的阳性对照;7. 重组质粒pNZ8148-pgk;8. pNZ8148-pgk阳性对照;9. 重组质粒pNZ8148-sip-pgk;10. pNZ8148-sip-pgk阳性对照Fig. 4 PCR identification of recombinant plasmid pNZ8148-sip, pNZ8148, pNZ8148-pgk and pNZ8148-sip-pgk1. recombinant plasmid pNZ8124-sip; 2. positive control of pNZ8148-sip; 3 and 4. blank control; 5. recombinant plasmid pNZ8124; 6. positive control of pNZ8148-sip; 7. recombinant plasmid pNZ8124-pgk; 8. positive control of pNZ8148-pgk; 9. recombinant plasmid pNZ8124-sip-pgk; 10. positive control of pNZ8148-sip-pgk![]() 图 5 重组质粒pNZ8148-sip-pgk、pNZ8148-sip、pNZ8148、pNZ8148-pgk的HindIII酶切鉴定1. HindIII酶单切过的载体 pNZ8148-sip-pgk;2. pNZ8148-sip-pgk质粒;3. HindIII酶单切过的载体pNZ8148-sip;4. pNZ8148-sip质粒;5. HindIII酶单切过的载体pNZ8148;6. pNZ8148质粒;7. pNZ8148-pgk质粒;8. HindIII酶单切过的载体pNZ8148-pgkFig. 5 pNZ8148-sip-pgk, pNZ8148-sip, pNZ8148 and pNZ8148-pgk digested by HindIII1. plasmid of pNZ8148-sip-pgk digested by HindIII; 2. plasmid of pNZ8148-sip-pgk; 3. plasmid of pNZ8148-sip digested by HindIII; 4. plasmid of pNZ8148-sip-pgk; 5. plasmid of pNZ8148 digested by HindIII; 6. plasmid of pNZ8148; 7. plasmid of pNZ8148-pgk digested by HindIII; 8. plasmid of pNZ8148-pgk
图 5 重组质粒pNZ8148-sip-pgk、pNZ8148-sip、pNZ8148、pNZ8148-pgk的HindIII酶切鉴定1. HindIII酶单切过的载体 pNZ8148-sip-pgk;2. pNZ8148-sip-pgk质粒;3. HindIII酶单切过的载体pNZ8148-sip;4. pNZ8148-sip质粒;5. HindIII酶单切过的载体pNZ8148;6. pNZ8148质粒;7. pNZ8148-pgk质粒;8. HindIII酶单切过的载体pNZ8148-pgkFig. 5 pNZ8148-sip-pgk, pNZ8148-sip, pNZ8148 and pNZ8148-pgk digested by HindIII1. plasmid of pNZ8148-sip-pgk digested by HindIII; 2. plasmid of pNZ8148-sip-pgk; 3. plasmid of pNZ8148-sip digested by HindIII; 4. plasmid of pNZ8148-sip-pgk; 5. plasmid of pNZ8148 digested by HindIII; 6. plasmid of pNZ8148; 7. plasmid of pNZ8148-pgk digested by HindIII; 8. plasmid of pNZ8148-pgk2.4 目的蛋白在乳酸乳球菌中的诱导表达及鉴定分析
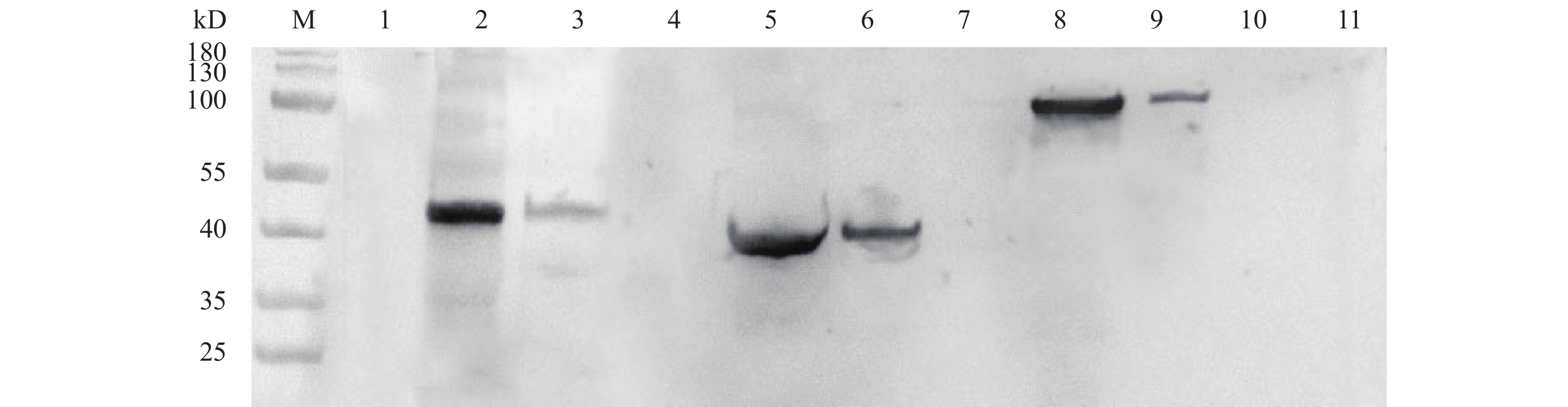
重组表达载体目的蛋白Sip、Pgk、Sip-Pgk的分子量理论值分别为48、44、92 kD。Western blot检测结果表明,在预期位置出现明显的免疫印迹(图6),说明重组L. lactis NZ9000 pNZ8148-sip、pNZ8148-pgk、pNZ8148-sip-pgk菌株表达了Sip、Pgk、Sip-Pgk蛋白。纯化后的Sip、Pgk和Sip-Pgk融合蛋白的蛋白质量浓度分别为8.77、11.54和14.21 mg·mL−1。
![]() 图 6 诱导表达蛋白Sip、Pgk、Sip-Pgk的Western blot检测分析M. protein标记;1. 未诱导的L. lactis NZ9000 pNZ8148-sip蛋白;2,3. 诱导的L. lactis NZ9000 pNZ8148-sip 蛋白上清和沉淀;4. 未诱导的L. lactis NZ9000 pNZ8148-pgk;5,6. 诱导的L. lactis NZ9000 pNZ8148-pgk蛋白上清和沉淀;7. 未诱导的L. lactis NZ9000 pNZ8148-sip-pgk;8,9. 诱导的 L. lactis NZ9000 pNZ8148-sip-pgk蛋白上清和沉淀;10. 诱导的L. lactis NZ9000 pNZ8148;11. L. lactis NZ9000Fig. 6 Western blot detection and analysis of expression products of recombinant Sip, Pgk and Sip-PgkM. protein marker; 1. protein of uninduced L. lactis NZ9000 pNZ8148-sip; 2 and 3. supernatant protein and precipitated protein of induced L. lactis NZ9000 pNZ8148-sip; 4. protein of uninduced L. lactis NZ9000 pNZ8148-pgk; 5 and 6. supernatant protein and precipitated protein of induced L. lactis NZ9000 pNZ8148-pgk; 7. protein of uninduced L. lactis NZ9000 pNZ8148-sip-pgk; 8 and 9. supernatant protein and precipitated protein of induced L. lactis NZ9000 pNZ8148-sip-pgk; 10. protein of induced L. lactis NZ9000 pNZ8148; 11. protein of uninduced L. lactis NZ9000 pNZ8148
图 6 诱导表达蛋白Sip、Pgk、Sip-Pgk的Western blot检测分析M. protein标记;1. 未诱导的L. lactis NZ9000 pNZ8148-sip蛋白;2,3. 诱导的L. lactis NZ9000 pNZ8148-sip 蛋白上清和沉淀;4. 未诱导的L. lactis NZ9000 pNZ8148-pgk;5,6. 诱导的L. lactis NZ9000 pNZ8148-pgk蛋白上清和沉淀;7. 未诱导的L. lactis NZ9000 pNZ8148-sip-pgk;8,9. 诱导的 L. lactis NZ9000 pNZ8148-sip-pgk蛋白上清和沉淀;10. 诱导的L. lactis NZ9000 pNZ8148;11. L. lactis NZ9000Fig. 6 Western blot detection and analysis of expression products of recombinant Sip, Pgk and Sip-PgkM. protein marker; 1. protein of uninduced L. lactis NZ9000 pNZ8148-sip; 2 and 3. supernatant protein and precipitated protein of induced L. lactis NZ9000 pNZ8148-sip; 4. protein of uninduced L. lactis NZ9000 pNZ8148-pgk; 5 and 6. supernatant protein and precipitated protein of induced L. lactis NZ9000 pNZ8148-pgk; 7. protein of uninduced L. lactis NZ9000 pNZ8148-sip-pgk; 8 and 9. supernatant protein and precipitated protein of induced L. lactis NZ9000 pNZ8148-sip-pgk; 10. protein of induced L. lactis NZ9000 pNZ8148; 11. protein of uninduced L. lactis NZ9000 pNZ81482.5 测定血清抗体的检测结果
应用ELISA检测罗非鱼血清,酶标仪检测记录各反应孔的OD450 (表2)。结果显示,与对照组相比,蛋白乳酸菌疫苗2次免疫和3次免疫均能显著提高血清特异性抗体水平,且后者抗体水平显著高于前者(P<0.05)。2次免疫、3次免疫和Sip-Pgk融合蛋白乳酸菌疫苗的抗体水平都与Sip、Pgk蛋白乳酸菌疫苗存在显著性差异(P<0.05)。
表 2 罗非鱼血清ELISA抗体检测结果Table 2 Detection of ELISA antibody level of immunized tilapia组别
group光密度 OD450 2次免疫 3次免疫 L. lactis NZ9000 pNZ8148-pgk 0.102 2±0.001 9** 0.113 6±0.000 7** L. lactis NZ9000 pNZ8148-sip 0.151 8±0.001 9** 0.161 4±0.001 1** L. lactis NZ9000 pNZ8148-sip-pgk 0.200 9±0.000 8** 0.240 7±0.000 6** L. lactis NZ9000 pNZ8148 0.086 7±0.000 6 0.088 5±0.002 8 L. lactis NZ9000 0.085 1±0.000 7 0.085 5±0.002 4 PBS 0.082 5±0.001 6 0.082 7±0.000 4 注:**. 相同免疫时间各组与PBS对照组之间存在极显著性差异(P<0.01) Note: **. Very significant difference exists between those groups and PBS control group at the same immune time (P<0.01). 2.6 重组乳酸乳球菌口服疫苗免疫保护效果
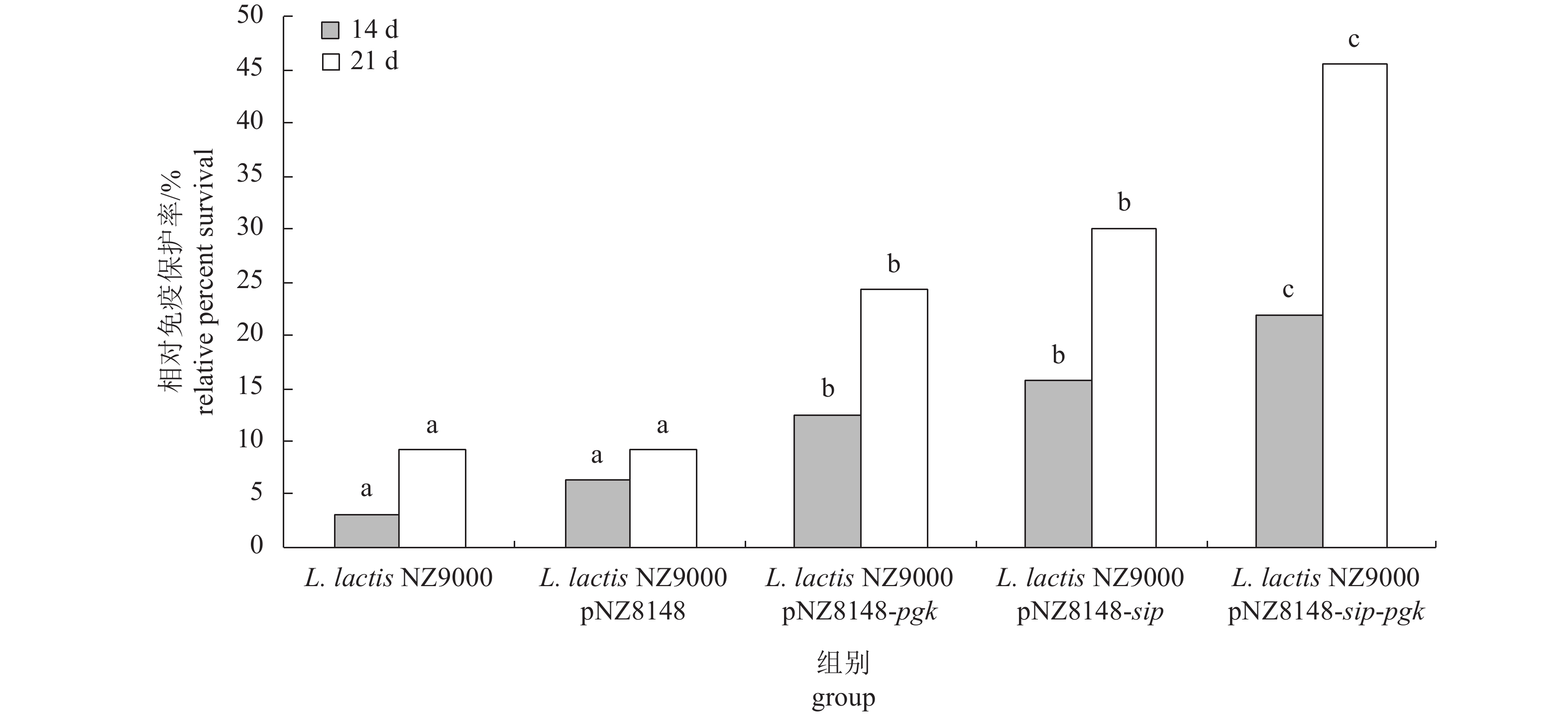
免疫结束后18 d,无乳链球菌腹腔注射攻毒(图7)。结果显示,免疫组中3次免疫的相对免疫保护率显著高于2次免疫,说明3次免疫的免疫效果更好。在所有蛋白乳酸菌疫苗中,3次免疫的Sip-Pgk融合蛋白乳酸菌疫苗的相对免疫保护率最高(45.46%),与Sip和Pgk蛋白乳酸菌疫苗的相对免疫保护率存在显著性差异(P<0.05),与L. lactis NZ9000 pNZ8148和L. lactis NZ9000的相对免疫保护率存在极显著性差异(P<0.01)。
![]() 图 7 重组乳酸乳球菌口服疫苗免疫的相对免疫保护率数值为平均值±标准差;各组上方不同字母表示相同免疫时间组间差异显著(P<0.05)Fig. 7 Relative percent survivals of recombinant L. lactis NZ9000 pNZ8148-sip, pNZ8148, pNZ8148-pgk and pNZ8148-sip-pgkThe data are shown as $ \overline X \pm {\rm{SD}}$; different letters above columns represent significant difference among those groups at the same immune time (P<0.05).
图 7 重组乳酸乳球菌口服疫苗免疫的相对免疫保护率数值为平均值±标准差;各组上方不同字母表示相同免疫时间组间差异显著(P<0.05)Fig. 7 Relative percent survivals of recombinant L. lactis NZ9000 pNZ8148-sip, pNZ8148, pNZ8148-pgk and pNZ8148-sip-pgkThe data are shown as $ \overline X \pm {\rm{SD}}$; different letters above columns represent significant difference among those groups at the same immune time (P<0.05).3. 讨论
本研究通过同源重组法将sip和pgk两段基因串联插入pNZ8148载体,对pNZ8148载体进行双酶切处理,根据线性化载体两端的序列,设计PCR上下游引物时在引物的5'端加上与线性化载体两末端同源的15 bp碱基序列,即可与线性化载体两端的序列进行定向交换,从而使目的基因精确地连接到目的载体,还可以一次连接多段目的片段,相较于传统的克隆方法更有效地避免了假阳性的出现,大大提高了实验效率并节省了时间。
乳酸菌在食品、药物加工中广泛得到应用,用于活载体疫苗制备已经相当成熟[31]。pNZ8148载体是乳酸菌表达载体,具有最有效的食品诱导表达系统乳链菌肽诱导的基因表达(nisin controlled gene expression,NICE)系统。NICE系统有高效表达细菌、病毒抗原和一些毒性蛋白的能力,其表达诱导物nisin是一种生物安全肽,对人体无毒副作用,进入消化道后被对应的蛋白酶作用从而失活,不会影响肠道的菌群平衡,作为食用性疫苗的传递载体有一定的优势[17]。诱导物nisin对革兰氏阳性菌有一定的抑制作用,使用的诱导物浓度过高可能会伤害宿主菌从而导致蛋白表达量下降,因此通常使用亚致死剂量诱导NlCE系统中目标蛋白的表达。在大多数的乳酸菌表达载体的研究中,常用的nisin诱导表达质量浓度为10 ng·mL−1,诱导表达时间为4~5 h[32-34]。诱导表达条件与表达宿主菌株、表达载体和表达的目的蛋白等有关,本实验使用的nisin质量浓度为10 ng·mL−1,诱导时间为4 h。为方便蛋白分析,设计引物时在下游引物引入6×His标签,只需要His标签的通用抗体即可完成Western blot的检测。重组表达sip-pgk融合蛋白经Western blot分析表明可与鼠抗His的单克隆抗体特异性结合显示大小为92 kD的单一条带,说明目的蛋白成功表达,目的蛋白主要存在于破碎后菌液的上清中。
研究表明乳酸菌进入机体消化后是通过胃肠道的黏膜免疫系统进行抗原递呈,进而激发免疫反应[35-36]。由于罗非鱼的胃肠消化作用,口服疫苗免疫需2次以上的加强免疫[37],本研究设计Sip-Pgk融合蛋白乳酸菌疫苗、Sip蛋白乳酸菌疫苗、Pgk蛋白乳酸菌疫苗、L. lactis NZ9000、L. lactis NZ9000 pNZ8148和PBS 6个实验组,分别进行了2次和3次的多次免疫。ELISA测定免疫罗非鱼血清的结果表明,2次免疫后乳酸菌疫苗能够显著提高罗非鱼的血清抗体水平,而3次免疫后血清抗体水平相较于2次免疫呈递增趋势,说明3次免疫更显著地激活了罗非鱼的免疫反应。实验组L. lactis NZ9000和L. lactis NZ9000 pNZ8148也能产生一定的相应抗体,这可能是因为乳酸菌本身也具有引起免疫应答的能力,但是抗原性较弱。蛋白乳酸菌疫苗与PBS组的血清抗体水平存在极显著差异,而Sip-Pgk融合蛋白乳酸菌疫苗与Sip、Pgk蛋白乳酸菌疫苗的血清抗体水平也存在极显著差异,说明相较于单个蛋白乳酸菌疫苗,Sip-Pgk融合蛋白乳酸菌疫苗更明显地提高了血清的抗体水平。无乳链球菌注射免疫罗非鱼的保护结果显示,Sip-Pgk融合蛋白、Sip蛋白、Pgk蛋白乳酸菌疫苗经3次免疫的相对免疫保护率高于2次免疫,说明3次免疫的效果更好。因此在养殖过程中尽可能对罗非鱼进行多次免疫,从而达到对链球菌最佳保护效果。经3次免疫后,Sip蛋白、Pgk蛋白、Sip-Pgk融合蛋白乳酸菌疫苗的相对免疫保护率分别为30.03%、24.24%、45.46%,表明Sip-Pgk融合蛋白乳酸菌疫苗的相对免疫保护率显著高于Sip和Pgk蛋白乳酸菌疫苗,这与血清抗体水平结果相吻合,说明融合蛋白疫苗对罗非鱼的免疫保护优于单个蛋白疫苗。
常见鱼类的免疫方法有浸泡、注射和口服等,其中注射免疫效果最佳,Sip蛋白注射免疫罗非鱼相对保护率能达到60%以上[38]。蔡玉臻等[39]制备Sip蛋白乳酸菌口服疫苗通过优化灌胃条件免疫罗非鱼,最高相对免疫保护率为41.0%。相较于注射免疫,口服免疫相对免疫保护率偏低,这可能与免疫方法和抗原摄取率有关,重组菌疫苗与不同受体组织相互作用时的分子状态存在差异,这也可能会影响机体对菌株载体释放的生物活性物质的应答能力[40]。虽然口服免疫的相对免疫保护率低于注射免疫,但考虑到注射免疫方式的操作难度、人工繁琐等局限性,口服疫苗更适用于罗非鱼的养殖实践应用,可通过乳酸菌表达优化口服疫苗投喂方式,降低疫苗免疫的工作量,提高养殖户使用疫苗的便利程度。本研究串联表达sip-pgk双基因,制备出Sip-Pgk融合蛋白乳酸菌口服疫苗,该疫苗的相对免疫保护率与Sip和Pgk单个蛋白乳酸菌口服疫苗组存在显著差异,说明融合蛋白能增强口服疫苗免疫效果,研究结果对进一步开发罗非鱼链球菌病乳酸菌口服疫苗、提高疫苗的免疫保护效果具有一定的指导意义。
-
图 4 重组质粒pNZ8148-sip、pNZ8148、pNZ8148-pgk、pNZ8148-sip-pgk PCR扩增鉴定
1. 重组质粒pNZ8148-sip;2. pNZ8148-sip的阳性对照;3, 4. 空白对照;5. 重组质粒pNZ8148;6. pNZ8148的阳性对照;7. 重组质粒pNZ8148-pgk;8. pNZ8148-pgk阳性对照;9. 重组质粒pNZ8148-sip-pgk;10. pNZ8148-sip-pgk阳性对照
Figure 4. PCR identification of recombinant plasmid pNZ8148-sip, pNZ8148, pNZ8148-pgk and pNZ8148-sip-pgk
1. recombinant plasmid pNZ8124-sip; 2. positive control of pNZ8148-sip; 3 and 4. blank control; 5. recombinant plasmid pNZ8124; 6. positive control of pNZ8148-sip; 7. recombinant plasmid pNZ8124-pgk; 8. positive control of pNZ8148-pgk; 9. recombinant plasmid pNZ8124-sip-pgk; 10. positive control of pNZ8148-sip-pgk
图 5 重组质粒pNZ8148-sip-pgk、pNZ8148-sip、pNZ8148、pNZ8148-pgk的HindIII酶切鉴定
1. HindIII酶单切过的载体 pNZ8148-sip-pgk;2. pNZ8148-sip-pgk质粒;3. HindIII酶单切过的载体pNZ8148-sip;4. pNZ8148-sip质粒;5. HindIII酶单切过的载体pNZ8148;6. pNZ8148质粒;7. pNZ8148-pgk质粒;8. HindIII酶单切过的载体pNZ8148-pgk
Figure 5. pNZ8148-sip-pgk, pNZ8148-sip, pNZ8148 and pNZ8148-pgk digested by HindIII
1. plasmid of pNZ8148-sip-pgk digested by HindIII; 2. plasmid of pNZ8148-sip-pgk; 3. plasmid of pNZ8148-sip digested by HindIII; 4. plasmid of pNZ8148-sip-pgk; 5. plasmid of pNZ8148 digested by HindIII; 6. plasmid of pNZ8148; 7. plasmid of pNZ8148-pgk digested by HindIII; 8. plasmid of pNZ8148-pgk
图 6 诱导表达蛋白Sip、Pgk、Sip-Pgk的Western blot检测分析
M. protein标记;1. 未诱导的L. lactis NZ9000 pNZ8148-sip蛋白;2,3. 诱导的L. lactis NZ9000 pNZ8148-sip 蛋白上清和沉淀;4. 未诱导的L. lactis NZ9000 pNZ8148-pgk;5,6. 诱导的L. lactis NZ9000 pNZ8148-pgk蛋白上清和沉淀;7. 未诱导的L. lactis NZ9000 pNZ8148-sip-pgk;8,9. 诱导的 L. lactis NZ9000 pNZ8148-sip-pgk蛋白上清和沉淀;10. 诱导的L. lactis NZ9000 pNZ8148;11. L. lactis NZ9000
Figure 6. Western blot detection and analysis of expression products of recombinant Sip, Pgk and Sip-Pgk
M. protein marker; 1. protein of uninduced L. lactis NZ9000 pNZ8148-sip; 2 and 3. supernatant protein and precipitated protein of induced L. lactis NZ9000 pNZ8148-sip; 4. protein of uninduced L. lactis NZ9000 pNZ8148-pgk; 5 and 6. supernatant protein and precipitated protein of induced L. lactis NZ9000 pNZ8148-pgk; 7. protein of uninduced L. lactis NZ9000 pNZ8148-sip-pgk; 8 and 9. supernatant protein and precipitated protein of induced L. lactis NZ9000 pNZ8148-sip-pgk; 10. protein of induced L. lactis NZ9000 pNZ8148; 11. protein of uninduced L. lactis NZ9000 pNZ8148
图 7 重组乳酸乳球菌口服疫苗免疫的相对免疫保护率
数值为平均值±标准差;各组上方不同字母表示相同免疫时间组间差异显著(P<0.05)
Figure 7. Relative percent survivals of recombinant L. lactis NZ9000 pNZ8148-sip, pNZ8148, pNZ8148-pgk and pNZ8148-sip-pgk
The data are shown as $ \overline X \pm {\rm{SD}}$; different letters above columns represent significant difference among those groups at the same immune time (P<0.05).
表 1 引物信息
Table 1 Primers used in this study
引物名称
primer name引物序列
primer sequence序列名称
sequence name扩增大小/bp
lengthsip-F GAGGCACTCACCATGAAAATGAATAAAAAGGTACTATTGACATCGACAAT sip 1 349 sip-R GGTTCAAAGAAAGCTTAATGGTGATGGTGATGATGTTTGTTAAATGATACGTG pgk-F GAGGCACTCACCATGGCTAAATTGACTGTTAAAGACGTTGATTTGAAA pgk 1 242 pgk-R GGTTCAAAGAAAGCTTAATGGTGATGGTGATGATGTTTTTCAGTCAATGCT sip-F2 GAGGCACTCACCATGAAAATGAATAAAAAGGTACTATTG sip-2 1 314 sip-R2 TTTGTTAAATGATACTACGTGAACGTGGTCATAGTGGTTGGC pgk-F2 GTATCATTTAACAAAGCTAAATTGACTGTTAAAGACGTTGATTTGAAAGG pgk-2 1 245 pgk-R2 GGTTCAAAGAAAGCTTAATGGTGATGGTGATGATGTTATTTTTCAGTCAATGCT pNZ8148-F TGTCGATAACGCGAGCATAATAAAC pNZ8148-R CAGTAATTGCTTTATCAACTGCTGC 注:斜体部分为载体同源的15 bp 碱基序列;横线为6×His 标签的碱基序列 Note: The italic part is the 15 bp base sequence of homologous carrier, and the horizontal lines indicate the base sequence of 6×His tag. 表 2 罗非鱼血清ELISA抗体检测结果
Table 2 Detection of ELISA antibody level of immunized tilapia
组别
group光密度 OD450 2次免疫 3次免疫 L. lactis NZ9000 pNZ8148-pgk 0.102 2±0.001 9** 0.113 6±0.000 7** L. lactis NZ9000 pNZ8148-sip 0.151 8±0.001 9** 0.161 4±0.001 1** L. lactis NZ9000 pNZ8148-sip-pgk 0.200 9±0.000 8** 0.240 7±0.000 6** L. lactis NZ9000 pNZ8148 0.086 7±0.000 6 0.088 5±0.002 8 L. lactis NZ9000 0.085 1±0.000 7 0.085 5±0.002 4 PBS 0.082 5±0.001 6 0.082 7±0.000 4 注:**. 相同免疫时间各组与PBS对照组之间存在极显著性差异(P<0.01) Note: **. Very significant difference exists between those groups and PBS control group at the same immune time (P<0.01). -
[1] 杜娟娟, 董浚键, 叶星, 等. 尼罗罗非鱼Siglec-4b like基因的克隆与表达特性分析[J]. 南方水产科学, 2016, 12(1): 67-76. doi: 10.3969/j.issn.2095-0780.2016.01.010 [2] 卢迈新. 罗非鱼链球菌病研究进展[J]. 南方水产, 2010, 6(1): 75-79. doi: 10.3969/j.issn.1673-2227.2010.01.013 [3] 王慧芝, 车斌, 陈国平. 中国罗非鱼出口现状及应对措施[J]. 山西农业科学, 2010, 38(8): 81-83. doi: 10.3969/j.issn.1002-2481.2010.08.22 [4] 张红燕, 袁永明, 贺艳辉, 等. 中国罗非鱼产品出口贸易特点及展望[J]. 农业展望, 2017, 13(9): 104-107. doi: 10.3969/j.issn.1673-3908.2017.09.020 [5] 廖静, 罗茵. 《中国罗非鱼产业发展报告》预测我国罗非鱼产量有望超1000万吨[J]. 海洋与渔业, 2017(12): 46. [6] 谢云丹, 冯娟, 刘婵, 等. 自然感染无乳链球菌罗非鱼的比较病理学及毒力基因谱分析[J]. 南方水产科学, 2019, 15(2): 47-57. doi: 10.12131/20180185 [7] 吴南, 郭佳, 熊丽, 等. 罗非鱼链球菌病疫苗的研究进展[J]. 南方水产科学, 2013, 9(6): 90-96. doi: 10.3969/j.issn.2095-0780.2013.06.015 [8] SUANYUK N, KONG F R, KO D, et al. Occurrence of rare genotypes of Streptococcus agalactiae in cultured red tilapia Oreochromis sp. and Nile tilapia O. niloticus in Thailand: relationship to human isolates?[J]. Aquaculture, 2008, 284(1/2/3/4): 35-40.
[9] 辛年香, 蔡延渠. 鱼类链球菌病的研究进展[J]. 科学养鱼, 2017(9): 61-63. [10] 陆英杰, 赖达光, 田鑫江, 等. 罗非鱼海豚链球菌的分离鉴定及药敏试验[J]. 广东农业科学, 2014, 41(7): 110-113. doi: 10.3969/j.issn.1004-874X.2014.07.029 [11] PASNIK J D, JOYCE J E, KLESIUS H P. Duration of protective antibodies and correlation with survival in Nile tilapia Oreochromis niloticus following Streptococcus agalactiae vaccination[J]. Dis Aquat Org, 2005, 66(2): 129-134.
[12] MIAN G F, GODOY D T, LEAL C A G, et al. Aspects of the natural history and virulence of S. agalactiae infection in Nile tilapia[J]. Vet Microbiol, 2009, 136(1/2): 180-183.
[13] 李莉萍, 王瑞, 梁万文, 等. 罗非鱼无乳链球菌弱毒株与其母源株部分生物学特性及免疫原性比较研究[J]. 西南农业学报, 2015, 28(5): 2316-2322. [14] KAYANSAMRUAJ P, PIRARAT N, KATAGIRI T, et al. Molecular characterization and virulence gene profiling of pathogenic Streptococcus agalactiae populations from tilapia (Oreochromis sp.) farms in Thailand[J]. J Vet Diagn Invest, 2014, 26(4): 488-495. doi: 10.1177/1040638714534237
[15] 张新艳, 樊海平, 钟全福, 等. 罗非鱼无乳链球菌的分离、鉴定及致病性研究[J]. 水产学报, 2008, 32(5): 772-779. [16] 王玉堂. 疫苗及其在水生动物疾病预防中的应用(七) [J]. 中国水产, 2019(1): 84-87. [17] 易德玮, 罗玲, 杨坤明, 等. 乳酸菌作为DNA疫苗载体的研究进展[J]. 饲料博览, 2018(8): 16-19. doi: 10.3969/j.issn.1001-0084.2018.08.004 [18] SAMAZAN F, ROKBI B, SEGUIN D, et al. Production, secretion and purification of a correctly folded staphylococcal antigen in Lactococcus lactis[J]. Microb Cell Fact, 2015, 14(1): 104-118. doi: 10.1186/s12934-015-0271-z
[19] BERMUDEZ-HUMARAN L G, CORTES-PEREZ N G, L'HARIDON R, et al. Production of biological active murine IFN-gamma by recombinant Lactococcus lactis[J]. FEMS Microbiol Lett, 2008, 280(2): 144-149. doi: 10.1111/j.1574-6968.2007.01038.x
[20] BAHEY-EL-DIN M, GAHAN C G, GRIFFIN B T. Lactococcus lactis as a cell factory for delivery of therapeutic proteins[J]. Curr Gene Ther, 2010, 10(1): 34-45. doi: 10.2174/156652310790945557
[21] SÁEZ D, FERNÁNDEZ P, RIVERA A, et al. Oral immunization of mice with recombinant Lactococcus lactis expressing Cu, Zn superoxide dismutase of Brucella abortus triggers protective immunity[J]. Vaccine, 2012, 30(7): 1283-1290. doi: 10.1016/j.vaccine.2011.12.088
[22] ADACHI K, KAWANA K, YOKOYAMA T, et al. Oral immunization with a Lactobacillus casei vaccine expressing human papillomavirus (HPV) type 16 E7 is an effective strategy to induce mucosal cytotoxic lymphocytes against HPV16 E7[J]. Vaccine, 2010, 28(16): 2810-2817. doi: 10.1016/j.vaccine.2010.02.005
[23] PEREIRA U P, SOARES S C, BLOM J, et al. In silico prediction of conserved vaccine targets in Streptococcus agalactiae strains isolated from fish, cattle, and human samples[J]. Genet Mol Res, 2013, 12(3): 1283-2912.
[24] VIDOVA B, CHOTÁR M, GODANY A, et al. N-terminal anchor in surface immunogenic protein of Streptococcus agalactiae and its influence on immunity elicitation[J]. Folia Microbiologica, 2009, 54(2): 161-166. doi: 10.1007/s12223-009-0025-6
[25] KIM B R, YANG E K, KIM D Y, et al. Generation of anti-tumour immune response using dendritic cells pulsed with carbonic anhydrase IX-Acinetobacter baumannii outer membrane protein A fusion proteins against renal cell carcinoma[J]. Clin Exp Immunol, 2011, 167(1): 73-83.
[26] 吴金花, 布日额, 王金良, 等. 奶牛乳腺炎无乳链球菌sip、pgk及FbsA基因主要抗原区域的融合表达及抗原性鉴定[J]. 中国兽医学报, 2017, 37(7): 1292-1299. [27] 曾祖聪, 可小丽, 卢迈新, 等. 罗非鱼无乳链球菌LrrG-Sip融合蛋白免疫原性研究[J]. 南方水产科学, 2017, 13(3): 51-57. doi: 10.3969/j.issn.2095-0780.2017.03.007 [28] 布日额, 吴金花, 王金良, 等. 奶牛乳腺炎无乳链球菌sip与pgk双基因主要抗原区域的融合表达[J]. 中国兽医学报, 2015, 35(8): 1228-1231. [29] MATSUI H, TAKEUCHI Y, OKUE K, et al. P172 An immunochromatographic detection of the Group B Streptococcus antigen from enrichment cultures[J]. Int J Antimicrob AG, 2013, 20(9): 1381-1387.
[30] 杜琳, 吕天星, 赵红梅, 等. 无乳链球菌CP+Sip-FbsA偶联蛋白免疫学特性的研究[J]. 中国预防兽医学报, 2016, 38(12): 976-980. [31] 王艳, 王卓, 张瑜. 重组L. lactis的研究进展及在兽用疫苗中的应用[J]. 中国畜禽种业, 2014, 10(5): 41-43. doi: 10.3969/j.issn.1673-4556.2014.05.024 [32] MOHSENI A H, RAZAVILAR V, KEYVANI H, et al. Efficient production and optimization of E7 oncoprotein from Iranian human papillomavirus type 16 in, Lactococcus lactis, using nisin-controlled gene expression (NICE) system[J]. Microb Pathogenesis, 2017, 110(9): 554-560.
[33] YAGNIK B, PATEL S, DAVE M, et al. Factors affecting inducible expression of outer membrane protein A (OmpA) of Shigella dysenteriae Type-1 in Lactococcus lactis using Nisin inducible controlled expression (NICE)[J]. Ind J Microbiol, 2016, 56(1): 80-87. doi: 10.1007/s12088-015-0556-2
[34] ABTS A, MAVARO A, STINDT J, et al. Easy and rapid purification of highly active Nisin[J]. Int J Pept, 2011, 2011(5): 175145.
[35] 赵维静, 赵建伟, 胡译文, 等. 表面展示狂犬病病毒糖蛋白的重组乳酸菌的构建及其免疫原性的研究[J]. 中国兽医科学, 2019, 49(4): 432-439. [36] ABREU, MARIA T. Toll-like receptor signalling in the intestinal epithelium: how bacterial recognition shapes intestinal function[J]. Nat Rev Immunol, 2010, 10(2): 131-144. doi: 10.1038/nri2707
[37] 魏仙仙, 张富春, 李金耀. 重组乳酸乳球菌作为活载体疫苗的研究进展[J]. 中华生物医学工程杂志, 2017, 23(3): 252-258. [38] MUNANG'ANDU H M, PAUL J, EVENSEN Ø. An overview of vaccination strategies and antigen delivery systems for Streptococcus agalactiae vaccines in Nile tilapia (Oreochromis niloticus)[J]. Vaccines, 2016, 4(4): 48-61. doi: 10.3390/vaccines4040048
[39] 蔡玉臻, 刘志刚, 卢迈新, 等. 尼罗罗非鱼无乳链球菌Sip蛋白乳酸菌活载体口服疫苗的研制及其免疫效果[J]. 水产学报, 2019, 43(3): 661-670. [40] van BAARLEN P, TROOST F, van der MEER C, et al. Human mucosal in vivo transcriptome responses to three lactobacilli indicate how probiotics may modulate human cellular pathways[J]. Proc Natl Acad Sci USA, 2011, 108(11): 4562-4569.
-
期刊类型引用(2)
1. 叶梓茵,欧慧慧,丁月霞. 罗非鱼无乳链球菌毒力检测及药敏试验. 中国兽医杂志. 2021(07): 47-51 .  百度学术
百度学术
2. 李战军,张建柏,曹亚男,陈坤,刘蓬,徐惠章,王鹤. 鱼类副乳房链球菌病研究进展. 大连海洋大学学报. 2021(06): 1059-1070 .  百度学术
百度学术
其他类型引用(5)



 下载:
下载:
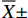

 粤公网安备 44010502001741号
粤公网安备 44010502001741号
