Effect of dietary protein level on digestive enzyme activity and histological structure in intestine and liver of juvenile Schizopygopsis younghusbandi
-
摘要:
为探究饲料蛋白水平对拉萨裸裂尻 (Schizopygopsis younghusbandi) 幼鱼肠道和肝脏的消化酶活性及组织结构的影响,设计出蛋白质水平分别为20%、25%、30%、35%、40%、45%的6种等脂等能的饲料,饲喂初始体质量为 (22.42±0.56) g的拉萨裸裂尻幼鱼60 d。结果显示,随着饲料蛋白水平升高,肠道和肝脏的蛋白酶活性呈先升高后降低的趋势,其中35%蛋白水平组蛋白酶活性显著高于其他实验组 (P<0.05)。脂肪酶和淀粉酶活性随着饲料蛋白水平的升高呈降低趋势 (P<0.05)。前、中、后肠的管壁厚度和绒毛高度呈先升高后降低的趋势 (P<0.05),其中在30%蛋白水平组的前肠和中肠管壁厚度最高,35%蛋白水平组后肠管壁厚度最高,30%蛋白水平组前肠、中肠和后肠绒毛高度最高。饲料蛋白水平高于35%时会损伤肝脏组织结构。在该实验条件下,综合考虑鱼体肠道和肝脏中消化酶活性及组织结构,拉萨裸裂尻幼鱼饲料蛋白水平以30%为宜。
Abstract:To explore the effects of different feed protein levels on the digestive enzyme activity and histological structure in the intestine and liver of juvenile Schizopygopsis younghusbandi, we designed six kinds of equal-energy experimental feeds with different protein levels (20%, 25%, 30%, 35%, 40%, 45%) to feed the juveniles with initial body mass of (22.42±0.56) g for 60 d. The results show that with the increase of feed protein level, the protease activity in intestine and liver increased first then declined. The protease activity in 35% protein group was significantly higher than that in the other groups (P<0.05). The lipase and amylase activities reduced significantly (P<0.05). The wall thickness and villus height of foregut, midgut and hindgut all increased and then decreased (P<0.05). The wall thickness of foregut and midgut were highest in 30% group, while the wall thickness of the hindgut was highest in the 35% group. The villus height of foregut, midgut and hindgut were highest in 30% group. Feed protein level higher than 35% may damage liver tissue structure. Under this condition, considering the digestive enzymes activity and histological structure of intestines and liver, the optimum protein level of juvenile S. younghusbandi should be 30%.
-
蛋白质是鱼类最重要的营养物质,对其生长具有不可替代的作用,但饲料蛋白质水平过高时,鱼体无法全部消化吸收,造成饲料浪费和环境污染。研究发现,在一定范围内,消化道中的蛋白酶活性随饲料蛋白水平升高而增加,当蛋白水平过高时,蛋白酶活性会有所降低[1]。脂肪酶和淀粉酶活性则随饲料蛋白水平升高而降低[2]。适宜的饲料蛋白水平可促进消化道和肝脏结构完整,高蛋白水平饲料可导致刺参 (Apostichopus japonicus) 消化道外层细胞和黏膜细胞的轮廓模糊[3]以及斑马鱼(Danio rerio)仔鱼肠道表面积减小[4]。拉萨裸裂尻 (Schizopygopsis younghusbandi) 属鲤形目、鲤科、裂腹鱼亚科、裸裂尻属,主要分布于西藏雅鲁藏布江中。其种群数量可观,个体较大,是西藏主要经济鱼类之一。但由于近年来过度捕捞、外来物种入侵[5]以及水电站建设[6]等原因,拉萨裸裂尻种群数量已有衰减的迹象,因此亟需对其开展保护研究。饲料是人工驯化及养殖过程中关键的技术难题,但目前尚未见拉萨裸裂尻饲料营养需求方面的报道。本实验用不同蛋白水平饲料饲养拉萨裸裂尻幼鱼60 d,探究饲料蛋白水平对其肠道和肝脏中消化酶活性及组织结构的影响,以重新确定拉萨裸裂尻幼鱼人工养殖阶段的蛋白需求量。
1. 材料与方法
1.1 实验饲料
设计6种等脂等能实验饲料,蛋白质水平分别为20%、25%、30%、35%、40%、45%。其中,蛋白源为白鱼粉、酪蛋白、南极磷虾粉,脂肪源为鱼油,糖源为玉米淀粉、糊化淀粉。饲料原料经粉碎后过60目筛,按照配比称质量,采用逐级混匀法混合均匀,制成直径2 mm的饲料,−4 ℃下保存备用。基础实验饲料组成见表1。
表 1 基础饲料配方及营养组成 (风干基础)Table 1 Composition and nutrient levels of basal diets (air-dry basis)% 原料
ingredientw (饲料蛋白质)/% dietary protein level 20 25 30 35 40 45 白鱼粉 white fish meal 20.00 24.80 25.00 25.00 25.00 26.80 酪蛋白 casein 3.80 5.60 11.40 17.20 22.80 27.00 糊化淀粉 gelatinized starch 9.00 9.00 9.00 9.00 9.00 6.00 玉米淀粉 corn starch 37.50 31.00 21.00 12.00 3.00 0.00 鱼油 fish oil 5.10 4.65 4.48 4.32 4.20 4.00 南极磷虾粉 antarctic krill meal 2.00 2.00 2.00 2.00 2.00 2.00 多维 multi-dimensional 0.50 0.50 0.50 0.50 0.50 0.50 多矿 multi-mineral 5.00 5.00 5.00 5.00 5.00 5.00 纤维素 cellulose 14.10 14.45 18.62 21.98 25.50 25.70 羧甲基纤维素 carboxymethyl cellulose 3.00 3.00 3.00 3.00 3.00 3.00 合计 total 100.00 100.00 100.00 100.00 100.00 100.00 营养成分* nutrient level 粗蛋白质 CP 20.06 25.16 30.35 35.81 40.37 45.68 粗脂肪 EE 7.05 7.01 7.01 7.00 7.03 7.08 粗灰分 ash 5.26 5.86 5.17 5.4 5.76 5.88 总能/(MJ·kg-1) gross energy 15.10 15.26 15.10 15.07 15.01 15.39 水分 moisture 11.09 11.65 11.5 11.12 11.52 11.47 注:*. 实测值;多矿:碳酸钙8%,乳酸钙12%,乳酸亚铁8%,柠檬酸锌4%,乳酸锌4%,柠檬酸钾6%,碳酸钾5%,氯化钠 20%,富硒酵母 0.5%,柠檬酸钠 12%,麦芽糊精 20.5%;多维:维生素A 10%,维生素B1 5%,维生素B2 5%,维生素B5 5%,维生素B6 5%,维生素B12 0.1%,维生素C 25%,维生素D 10%,维生素E 10%,胡萝卜素 5%,麦芽糊精 19.9% Note: *. measured values; mineral premix: CaCO3.5H2O 8%, calcium lactate 12%, fenous lactate 8%, zinc citrate 4%, zinc lactate 4%, potassium citrate 6%, potash 1%, sodium chloride 20%, selenium-enriched yeasts 0.5%, sodium citrate 12%, maltodextrin 20.5%; vitamin premix (mg∙kg-1 diet): vitamin A 10%, vitamin B1 5%, vitamin B2 5%, vitamin B5 5%, vitamin B6 5%, vitamin B12 0.1%, vitamin C 25%, vitamin D 10%, vitamin E 10%, carotene 5%, maltodextrin 19.9% 1.2 实验用鱼和饲养管理
2017年在雅鲁藏布江日喀则段捕获拉萨裸裂尻幼鱼,养于长4.0 m×宽3.0 m×高0.6 m的水泥池中,使用蛋白水平为35%的实验饲料驯养60 d后;选择能正常抢食、大小均匀、健康、无伤病、体质量为 (22.42±0.56) g的拉萨裸裂尻540尾,随机分为6组,每组3个平行,每个平行30尾,放入18个水族缸 (长0.6 m×宽0.5 m×高0.4 m),缸内水24 h循环,循环量为120 L∙h−1。实验期间分别投喂6种蛋白质水平的实验饲料60 d,每天按实验鱼体质量3%~5%的投喂量投喂3次 (07:00,12:00,17:00),投饵1 h后将残饵捞出。实验期间水温12.0~13.0 ℃,溶解氧≥6.0 mg∙L−1,pH 8.0~8.5,氨氮≤0.01 mg∙L−1,亚硝酸盐≤0.02 mg∙L−1。
1.3 消化酶测定方法
实验结束后,每个平行随机抽取10尾实验鱼,解剖,取肠道和肝胰脏,保存于–20 ℃冰箱中,用于测定消化酶活性。消化酶活性测定均按照江苏省南京建成生物研究所试剂盒说明书操作。蛋白酶活性单位定义为:在37 ℃条件下,每分钟酶解产生1 μg酪氨酸为1个活性单位 (U)。脂肪酶活性定义为:在37 ℃条件下,每分钟水解产生1 μg脂肪酸所消耗的脂肪酶量为1个酶活性单位。淀粉酶活性定义为:在37 ℃,100 mL酶液中的淀粉酶在30 min内,能完全水解10 mg淀粉时为1个酶活性单位。组织匀浆液中蛋白浓度采用考马斯亮蓝法测定[7],以牛血清白蛋白为基准物。
1.4 消化道和肝脏组织固定及切片制作方法
实验结束后随机抽取每个平行中6尾实验鱼,解剖取肠道(从前至后均分为前、中、后肠)及肝胰脏。Bouin's液中固定24 h,保存于70%乙醇中。经脱水、透明、浸蜡、包埋后用Elex切片机切片,厚度5 μm,H.E染色,中性树胶封片。在Nikon SMZ18显微镜下拍照,用NIS elements D 4.6.0.00数据测量软件,测量相关数据。
1.5 数据统计
实验结果以“平均值±标准差(
$ {\overline X} \pm {\rm SD} $ ) ”表示。用SPSS 19.0统计软件中One-Way ANOVA进行单因素方差分析,若差异显著,则采用Duncan's进行多重比较,差异显著水平为P<0.05。2. 结果
2.1 不同饲料蛋白水平下拉萨裸裂尻消化酶活性变化
随着蛋白水平增加,各组肠和肝脏中蛋白酶活性均先升高后降低,35%蛋白水平的活性最高,显著高于其他组 (P<0.05),20%蛋白水平的活性最低 (表2)。随着蛋白水平升高,肠和肝脏中脂肪酶活性不断降低,20%蛋白水平最高,显著高于35%、40%和45%蛋白水平组 (P<0.05)。肠和肝中淀粉酶活性随蛋白水平升高而降低,肠淀粉酶活性在20%蛋白水平时最高,显著高于除25%蛋白水平外的其他蛋白水平组 (P<0.05),肝淀粉酶活性在20%蛋白水平时最高,显著高于35%、40%和45%蛋白水平组 (P<0.05)。
表 2 不同饲料蛋白水平下拉萨裸裂尻幼鱼消化酶活性的变化Table 2 Change of digestive enzyme activities of juvenile S. younghusbandi with different dietary protein levelsn=10; $\overline{{\mathit{\boldsymbol{X}}}} \bf{\pm} {\bf{SD}}$ w (饲料蛋白质)/%
dietary protein level肝脏蛋白酶/(U∙mg−1)
LPR肠蛋白酶/(U∙mg−1)
IPR肠脂肪酶/(U∙g−1)
ILPS肝脏脂酶/(U∙g−1)
LLPS肠淀粉酶/(U∙g−1)
IAMS肝淀粉酶/(U∙g−1)
LAMS20 48.23±8.60a 428.06±86.56a 48.39±2.04b 8.10±0.33c 1.97±0.04c 0.49±0.02c 25 105.89±6.73c 941.01±123.74bc 47.40±3.95b 7.72±0.41c 1.86±0.12c 0.47±0.03bc 30 139.09±15.89d 1 248.78±146.72d 44.74±2.89b 7.57±0.39bc 1.78±0.10b 0.45±0.04bc 35 190.01±5.22e 1 710.12±46.97e 38.90±2.49a 6.82±0.59ab 1.61±0.04b 0.43±0.02b 40 114.68±6.12c 1 032.13±100.06c 36.75±2.1a 6.40±0.51a 1.42±0.09a 0.36±0.02a 45 89.45±4.37b 835.01±28.79b 36.59±2.26a 6.42±0.37a 1.39±0.17a 0.35±0.04a 注:上标字母按平均值从小到大排列,依次为a,b ...;同列字母相同或无字母表示差异不显著(P>0.05),不同表示差异显著(P<0.05);下表同此 Note: The letters are drawn from small to large according to the average value followed by a, b...; in the same column, values with same small letter superscripts or no superscripts indicate no significant differences (P>0.05), different small letter superscripts indicate significant differences (P<0.05). The same case in the following tables. 2.2 不同饲料蛋白水平下拉萨裸裂尻幼鱼消化组织结构变化
随着蛋白水平升高,各组前、中、后肠管壁厚度均先升高后降低 (表3)。前肠管壁厚度在30%蛋白水平最高,显著高于其他组 (P<0.05);中肠管壁厚度在30%蛋白水平时最高,显著高于25%蛋白水平组外的其他组 (P<0.05);后肠管壁厚度在35%蛋白水平组最高,显著高于30%蛋白水平组外的其他各组 (P<0.05)。
表 3 不同饲料蛋白水平下拉萨裸裂尻幼鱼肠道管壁厚度的变化Table 3 Change of intestinal tube wall thickness of juvenile S. younghusbandi with differentdietary protein levelsn=6; $\overline {{\mathit{\boldsymbol{X}}}} {\bf{\pm}} {\bf{SD}}$ w (饲料蛋白质)/%
dietary protein level前肠/μm
foregut中肠/μm
midgut后肠/μm
hindgut20 77.33±3.88a 67.99±2.56a 38.93±4.81a 25 118.90±12.07c 82.57±1.82cd 47.97±2.63b 30 166.71±9.40e 88.59±4.74d 55.18±1.73cd 35 133.02±8.91d 78.96±5.43bc 59.86±6.55d 40 115.61±4.23c 73.06±3.23ab 50.69±3.12bc 45 94.50±3.11b 68.43±8.75a 35.33±1.78a 随着蛋白水平升高,各组前、中、后肠道绒毛高度同样先升高后降低 (表4)。前肠绒毛高度在30%蛋白水平时最高,显著高于其他组 (P<0.05);中肠和后肠绒毛高度在30%蛋白水平时最高,显著高于35%蛋白水平组外的其他组 (P<0.05)。
表 4 不同饲料蛋白水平下拉萨裸裂尻幼鱼肠道绒毛高度的变化Table 4 Changes of intestinal villus height of juvenile S. younghusbandi under different dietary protein levelsn=6; ${\overline {{\mathit{\boldsymbol{X}}}} {{\mathit{\boldsymbol{\pm}}}} {\bf{SD}}}$ w (饲料蛋白质)/%
dietary protein level前肠/μm
foregut中肠/μm
midgut后肠/μm
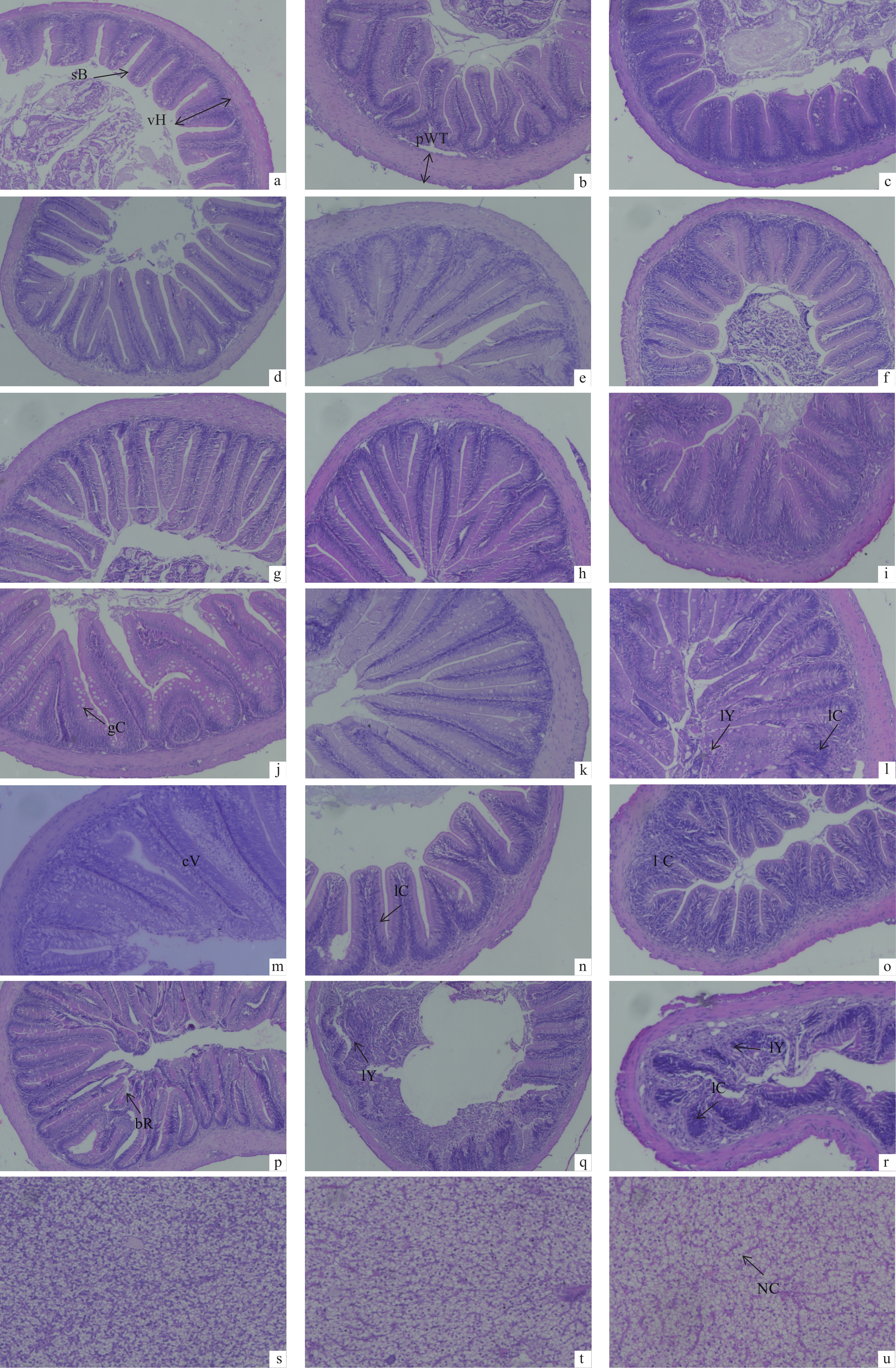
hindgut20 286.90±8.86a 214.11±12.45a 180.13±8.72c 25 368.69±13.36b 251.62±13.76b 193.10±5.3c 30 485.67±55.61c 343.89±19.89d 236.72±17.49d 35 397.04±13.13b 338.78±16.67cd 230.70±7.17d 40 309.88±25.19a 305.01±29.15c 159.87±5.67b 45 258.11±33.08a 242.91±18.55ab 128.15±5.03a 随着蛋白水平升高,前、中、后肠绒毛褶皱增多,纹状缘结构逐渐清晰完整,杯状细胞逐渐增多。在30%蛋白水平时,消化道组织结构状况最优 (图1-a~i)。但随着蛋白水平继续升高,在35%蛋白水平时,前、中、后肠绒毛褶皱开始减少,空泡和淋巴细胞开始增多 (图1-j~l)。40%蛋白水平组,小肠上皮细胞出现大量空泡,淋巴细胞增多 (图1-m~o)。45%蛋白水平组,纹状结构缘断裂,不完整,甚至出现断裂缺刻、溶解 (图1-p~r)。
肝脏组织切片结果显示,20%、25%、30%蛋白水平组肝脏组织结构正常(图1-s~u);35%蛋白水平组肝脏细胞内脂肪空泡体积开始变大 (图1-v);40%蛋白水平组肝脏组织中肝细胞索不明显,肝脏细胞排列不规则,伴有轻微纤维样变性 (图1-w~x);45%蛋白水平组肝脏组织纤维化变性严重,肝脏细胞溶解,组织空泡明显增大 (图1-y~z)。
3. 讨论
3.1 饲料蛋白水平对拉萨裸裂尻幼鱼消化酶活性的影响
随饲料蛋白水平升高,鱼体蛋白酶活性先升高后降低[8-14]。本实验中,随着饲料蛋白水平升高,拉萨裸裂尻幼鱼肠和肝脏中的蛋白酶活性同样呈先升高后降低的变化趋势。这可能是随着饲料蛋白水平升高,鱼体胃蛋白酶原和胰凝乳蛋白酶原基因表达水平升高[15],导致合成、分泌的蛋白酶量增加。蛋白酶活性降低与饲料蛋白源质量有关[16],本实验中采用的蛋白源白鱼粉和酪蛋白均为优质蛋白源,因此,可排除由于蛋白质量原因导致的蛋白酶活性降低,推测可能是由于饲料蛋白水平超过其需要量后,加重了肠道及肝脏消化负担,积累有毒物质,引起负反馈调节[17]。
饲料蛋白水平对亚东鲑 (Salmotrutta fario)[8]、方正银鲫 (Carassius auratus gibelio Bloch)[11]、美洲沼虾 (Macrobrachium americanum)[13]和异育银鲫 (Carassius auratus gibelio)[18]的脂肪酶活性均无显著影响。本实验中,随着饲料蛋白水平升高,在饲料中脂肪含量不变的情况下,拉萨裸裂尻幼鱼肠道和肝脏中的脂肪酶活性不断降低,说明饲料蛋白水平升高对拉萨裸裂尻幼鱼肝脏和肠道中的脂肪酶活性有一定的抑制作用。这与瓦氏黄颡鱼(Pelteobagrus vachelli)[2]、石斑鱼(Epinephelus akaara)[19]的研究结果基本一致。其原因可能是随着蛋白水平升高,拉萨裸裂尻优先利用饲料中的蛋白质,抑制了幼鱼对脂肪的分解和利用,导致其肠道和肝脏中的脂肪酶活性不断降低。
肝脏中淀粉酶活性随着饲料中淀粉含量增加而显著升高[20-21]。当饲料配方中淀粉、葡聚糖、麦麸、玉米淀粉含量相应降低时,淀粉酶活性也会降低[13, 15]。本实验中,随着饲料蛋白水平升高,虽然拉萨裸裂尻幼鱼肝脏和肠道中的淀粉酶活性不断降低,但对应的饲料配方中玉米淀粉含量也在降低。故而不确定饲料蛋白水平升高对拉萨裸裂尻幼鱼肝脏和肠道中的淀粉酶活性是否有抑制作用。笔者更倾向于认为拉萨裸裂尻幼鱼肝脏和肠道中的淀粉酶活性受饲料中淀粉含量的影响。
3.2 饲料蛋白水平对拉萨裸裂尻幼鱼消化道和肝脏组织结构的影响
消化道是消化吸收的重要场所,鱼类肠道的杯状细胞、纹状缘、皱襞的形态是衡量消化吸收能力的重要指标[22]。青海湖裸鲤 (Gymnocypris przewalskii) 可能通过增加肠壁厚度提高肠道的消化吸收功能[23],适宜的饲料蛋白水平有促进大菱鲆 (Scophthalmus maximus)幼鱼肠道黏膜皱襞数量及高度的作用[24]。本实验中,饲料蛋白水平从20%增加到30%的过程中,拉萨裸裂尻幼鱼肠道组织出现管壁增厚、绒毛褶皱增多、绒毛高度增加等情况,说明在一定范围内增加饲料蛋白水平,有促进拉萨裸裂尻幼鱼肠道组织细胞生长和分化、提高消化吸收的作用。当蛋白水平高于35%时,由于过高的饲料蛋白水平可促进肠道细胞过度生长和分化,致使细胞体积较小,未成熟的新生细胞所占比例增加,导致肠上皮细胞长度降低;同时饲料蛋白水平超过鱼体自身消化吸收的上限后,过高的饲料蛋白水平会降低鱼体Nrf2基因表达量[25],导致与鱼体抗氧化体系中的超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT) 和过氧化物酶 (POD) 合成量降低[26],使肠道组织抗氧化能力降低,肠道细胞因氧化损伤而凋亡。多种因素共同作用,最终导致了拉萨裸裂尻幼鱼肠道组织结构损伤,出现绒毛褶皱减少、纹状缘结构模糊、断裂缺刻、空泡和淋巴细胞增多等现象。
肝脏内可进行氨基酸的转氨基作用、脱氨基作用、脱羧基作用以及氮的分解代谢。当饲料蛋白水平过高时,多余的蛋白质将由肝脏转换成脂肪,贮存于肝脏中,导致肝脏脂肪过度蓄积,引起脂肪肝病变。本实验中,当饲料蛋白水平达到35%时,肝脏组织结构开始出现脂肪积累,与奥尼罗非鱼 (Oreochromis niloticus×O. aureus) 的肝脏病理变化相似[27],这可能与饲料蛋白水平超过鱼体自身需要,蛋白质转变成脂肪有关。当饲料蛋白水平达到40%时,出现脂肪细胞溶解、空泡面积增大的现象,这可能是由于过高的饲料蛋白水平导致肝脏产生过多含氮毒性物质进而对肝脏细胞产生毒害作用引起的。
4. 结论
适量增加饲料蛋白水平可以提高拉萨裸裂尻鱼消化道消化酶活性,改善鱼体消化道组织结构;但饲料蛋白水平过高会降低鱼体消化酶活性、损伤消化道组织结构。综合考虑鱼体消化酶活性、消化道和肝脏组织结构完整性,建议长期养殖拉萨裸裂尻幼鱼时,饲料蛋白水平以30%为宜。
-
表 1 基础饲料配方及营养组成 (风干基础)
Table 1 Composition and nutrient levels of basal diets (air-dry basis)
% 原料
ingredientw (饲料蛋白质)/% dietary protein level 20 25 30 35 40 45 白鱼粉 white fish meal 20.00 24.80 25.00 25.00 25.00 26.80 酪蛋白 casein 3.80 5.60 11.40 17.20 22.80 27.00 糊化淀粉 gelatinized starch 9.00 9.00 9.00 9.00 9.00 6.00 玉米淀粉 corn starch 37.50 31.00 21.00 12.00 3.00 0.00 鱼油 fish oil 5.10 4.65 4.48 4.32 4.20 4.00 南极磷虾粉 antarctic krill meal 2.00 2.00 2.00 2.00 2.00 2.00 多维 multi-dimensional 0.50 0.50 0.50 0.50 0.50 0.50 多矿 multi-mineral 5.00 5.00 5.00 5.00 5.00 5.00 纤维素 cellulose 14.10 14.45 18.62 21.98 25.50 25.70 羧甲基纤维素 carboxymethyl cellulose 3.00 3.00 3.00 3.00 3.00 3.00 合计 total 100.00 100.00 100.00 100.00 100.00 100.00 营养成分* nutrient level 粗蛋白质 CP 20.06 25.16 30.35 35.81 40.37 45.68 粗脂肪 EE 7.05 7.01 7.01 7.00 7.03 7.08 粗灰分 ash 5.26 5.86 5.17 5.4 5.76 5.88 总能/(MJ·kg-1) gross energy 15.10 15.26 15.10 15.07 15.01 15.39 水分 moisture 11.09 11.65 11.5 11.12 11.52 11.47 注:*. 实测值;多矿:碳酸钙8%,乳酸钙12%,乳酸亚铁8%,柠檬酸锌4%,乳酸锌4%,柠檬酸钾6%,碳酸钾5%,氯化钠 20%,富硒酵母 0.5%,柠檬酸钠 12%,麦芽糊精 20.5%;多维:维生素A 10%,维生素B1 5%,维生素B2 5%,维生素B5 5%,维生素B6 5%,维生素B12 0.1%,维生素C 25%,维生素D 10%,维生素E 10%,胡萝卜素 5%,麦芽糊精 19.9% Note: *. measured values; mineral premix: CaCO3.5H2O 8%, calcium lactate 12%, fenous lactate 8%, zinc citrate 4%, zinc lactate 4%, potassium citrate 6%, potash 1%, sodium chloride 20%, selenium-enriched yeasts 0.5%, sodium citrate 12%, maltodextrin 20.5%; vitamin premix (mg∙kg-1 diet): vitamin A 10%, vitamin B1 5%, vitamin B2 5%, vitamin B5 5%, vitamin B6 5%, vitamin B12 0.1%, vitamin C 25%, vitamin D 10%, vitamin E 10%, carotene 5%, maltodextrin 19.9% 表 2 不同饲料蛋白水平下拉萨裸裂尻幼鱼消化酶活性的变化
Table 2 Change of digestive enzyme activities of juvenile S. younghusbandi with different dietary protein levels
n=10; $\overline{{\mathit{\boldsymbol{X}}}} \bf{\pm} {\bf{SD}}$ w (饲料蛋白质)/%
dietary protein level肝脏蛋白酶/(U∙mg−1)
LPR肠蛋白酶/(U∙mg−1)
IPR肠脂肪酶/(U∙g−1)
ILPS肝脏脂酶/(U∙g−1)
LLPS肠淀粉酶/(U∙g−1)
IAMS肝淀粉酶/(U∙g−1)
LAMS20 48.23±8.60a 428.06±86.56a 48.39±2.04b 8.10±0.33c 1.97±0.04c 0.49±0.02c 25 105.89±6.73c 941.01±123.74bc 47.40±3.95b 7.72±0.41c 1.86±0.12c 0.47±0.03bc 30 139.09±15.89d 1 248.78±146.72d 44.74±2.89b 7.57±0.39bc 1.78±0.10b 0.45±0.04bc 35 190.01±5.22e 1 710.12±46.97e 38.90±2.49a 6.82±0.59ab 1.61±0.04b 0.43±0.02b 40 114.68±6.12c 1 032.13±100.06c 36.75±2.1a 6.40±0.51a 1.42±0.09a 0.36±0.02a 45 89.45±4.37b 835.01±28.79b 36.59±2.26a 6.42±0.37a 1.39±0.17a 0.35±0.04a 注:上标字母按平均值从小到大排列,依次为a,b ...;同列字母相同或无字母表示差异不显著(P>0.05),不同表示差异显著(P<0.05);下表同此 Note: The letters are drawn from small to large according to the average value followed by a, b...; in the same column, values with same small letter superscripts or no superscripts indicate no significant differences (P>0.05), different small letter superscripts indicate significant differences (P<0.05). The same case in the following tables. 表 3 不同饲料蛋白水平下拉萨裸裂尻幼鱼肠道管壁厚度的变化
Table 3 Change of intestinal tube wall thickness of juvenile S. younghusbandi with differentdietary protein levels
n=6; $\overline {{\mathit{\boldsymbol{X}}}} {\bf{\pm}} {\bf{SD}}$ w (饲料蛋白质)/%
dietary protein level前肠/μm
foregut中肠/μm
midgut后肠/μm
hindgut20 77.33±3.88a 67.99±2.56a 38.93±4.81a 25 118.90±12.07c 82.57±1.82cd 47.97±2.63b 30 166.71±9.40e 88.59±4.74d 55.18±1.73cd 35 133.02±8.91d 78.96±5.43bc 59.86±6.55d 40 115.61±4.23c 73.06±3.23ab 50.69±3.12bc 45 94.50±3.11b 68.43±8.75a 35.33±1.78a 表 4 不同饲料蛋白水平下拉萨裸裂尻幼鱼肠道绒毛高度的变化
Table 4 Changes of intestinal villus height of juvenile S. younghusbandi under different dietary protein levels
n=6; ${\overline {{\mathit{\boldsymbol{X}}}} {{\mathit{\boldsymbol{\pm}}}} {\bf{SD}}}$ w (饲料蛋白质)/%
dietary protein level前肠/μm
foregut中肠/μm
midgut后肠/μm
hindgut20 286.90±8.86a 214.11±12.45a 180.13±8.72c 25 368.69±13.36b 251.62±13.76b 193.10±5.3c 30 485.67±55.61c 343.89±19.89d 236.72±17.49d 35 397.04±13.13b 338.78±16.67cd 230.70±7.17d 40 309.88±25.19a 305.01±29.15c 159.87±5.67b 45 258.11±33.08a 242.91±18.55ab 128.15±5.03a -
[1] 陈义方, 李卓佳, 牛津, 等. 饲料蛋白水平对不同规格凡纳滨对虾蛋白质表观消化率和消化酶活性的影响[J]. 南方水产科学, 2012, 08(5): 66-71. doi: 10.3969/j.issn.2095-0780.2012.05.010 [2] 孙翰昌, 徐敬明, 庞敏. 饲料蛋白水平对瓦氏黄颡鱼消化酶活性的影响[J]. 水生态学杂志, 2010, 31(2): 84-88. [3] 吴永恒, 王秋月, 冯政夫, 等. 饲料粗蛋白含量对刺参消化酶及消化道结构的影响[J]. 海洋科学, 2012, 36(1): 36-41. doi: 10.3969/j.issn.1671-6647.2012.01.005 [4] LEIGH S C, NGUYEN-PHUC B Q, GERMAN D P. The effects of protein and fiber content on gut structure and function in zebrafish (Danio rerio)[J]. J Comp Physiol B, 2018, 188: 237-253. doi: 10.1007/s00360-017-1122-5
[5] 段友健. 拉萨裸裂尻鱼个体生物学和种群动态研究[D]. 武汉: 华中农业大学, 2015: 93-94. [6] 李芳. 西藏尼洋河流域水生生物研究及水电工程对其影响的预测评价[D]. 西安: 西北大学, 2006: 69-73. [7] 王孝平, 邢树礼. 考马斯亮法测定蛋白质含量的研[J]. 天津化工, 2009, 23(3): 40-41. doi: 10.3969/j.issn.1008-1267.2009.03.016 [8] 王常安, 户国, 孙鹏, 等. 饲料蛋白质和脂肪水平对亚东鲑亲鱼生长性能、消化酶活性和血清指标的影响[J]. 动物营养学报, 2017, 29(2): 571-582. doi: 10.3969/j.issn.1006-267x.2017.02.025 [9] 李成, 秦溱, 李金龙, 等. 不同蛋白水平饲料对光倒刺鲃幼鱼生长, 消化酶及体成分的影响[J]. 饲料工业, 2018, 39(24): 34-39. [10] 梁萍, 秦志清, 林建斌, 等. 饲料中不同蛋白质水平对半刺厚唇鱼幼鱼生长性能及消化酶活性的影响[J]. 中国农学通报, 2018, 34(2): 136-140. doi: 10.11924/j.issn.1000-6850.casb17090056 [11] 桑永明, 杨瑶, 尹航, 等. 饲料蛋白水平对方正银鲫幼鱼生长, 体成分, 肝脏生化指标和肠道消化酶活性的影响[J]. 水生生物学报, 2018, 42(4): 736-743. doi: 10.7541/2018.090 [12] RAMESH R, DUBE K, REDDY A K, et al. Effect of varying protein levels on growth and digestive enzyme activities of pengba Osteobrama belangeri (Valenciennes, 1844)[J]. Ind J Fish, 2017, 64: 206-213.
[13] MENDEZ-MARTINEZ Y, GARCIA-GUERRERO M U, MARTINEZ-CORDOVA L R, et al. Effect of different ratios of dietary protein-energy on growth, body proximal composition, digestive enzyme activity, and hepatopancreas histology in Macrobrachium americanum (Bate, 1868) prawn juveniles[J]. Aquaculture, 2018, 485: 1-11. doi: 10.1016/j.aquaculture.2017.11.012
[14] TOK N C, JAIN K K, PRABU D L, et al. Metabolic and digestive enzyme activity of Pangasianodon hypophthalmus (Sauvage, 1878) fingerlings in response to alternate feeding of different protein levels in the diet[J]. Aquacult Res, 2017, 48(6): 2895-2911. doi: 10.1111/are.2017.48.issue-6
[15] SILVA W S, COSTA L S, LÓPEZ-OLMEDA J F, et al. Gene expression, enzyme activity and performance of Nile tilapia larvae fed with diets of different CP levels[J]. Animal, 2019, 13(7): 1376-1384. doi: 10.1017/S175173111800318X
[16] 米海峰. 不同蛋白源和大豆抗营养因子对牙鲆蛋白消化酶的活性与基因表达的影响[D]. 青岛: 中国海洋大学, 2008: 39-43. [17] LÓPEZ-LÓPEZ S, NOLASCO H, VILLARREAL-COLMENARES H A. Digestive enzyme response to supplemental ingredients in practical diets for juvenile freshwater crayfish Cherax quadricarinatus[J]. Aquacult Nut, 2005, 11(2): 79-85.
[18] 吴本丽, 黄龙, 何吉祥, 等. 长期饥饿后异育银鲫对饲料蛋白质的需求[J]. 动物营养学报, 2018, 30(6): 2215-2225. doi: 10.3969/j.issn.1006-267x.2018.06.025 [19] 赵书燕, 林黑着, 黄忠, 等. 不同蛋白质水平下添加小肽对石斑鱼生长、消化酶、血清生化和抗氧化能力的影响[J]. 南方水产科学, 2016, 12(3): 15-23. doi: 10.3969/j.issn.2095-0780.2016.03.003 [20] ZHANG W, LIU K, TAN B P, et al. Transcriptome, enzyme activity and histopathology analysis reveal the effects of dietary carbohydrate on glycometabolism in juvenile largemouth bass, Micropterus salmoides[J]. Aquaculture, 2019, 504: 39-51. doi: 10.1016/j.aquaculture.2019.01.030
[21] WANG L G, HU S Y, LOU B, et al. Effect of different dietary protein and lipid levels on the growth, body composition, and intestinal digestive enzyme activities of juvenile yellow drum Nibea albiflora (Richardson)[J]. J Ocean Univ Chin, 2018, 17(5): 1261-1267. doi: 10.1007/s11802-018-3660-1
[22] HEIKKINEN J, VIELMA J, KEMILAINEN O, et al. Effects of soybean meal based diet on growth performance, gut histopathology and intestinal microbiota of juvenile rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2006, 261(1): 259-268. doi: 10.1016/j.aquaculture.2006.07.012
[23] CHEN F J, WANG H C. Study on histological structure of intestine in Gymnocypris przewalskii with different age[J]. P Vet Med, 2013, 34(1): 34-37.
[24] WEI Y L, LIANG M Q, ZHENG K K, et al. The effects of fish protein hydrolysate on the digestibility of juvenile turbot (Scophthalmus maximus L)[J]. Acta Hydrobiol Sinica, 2014, 38(5): 910-920.
[25] 徐静. 蛋白对生长中期草鱼生产性能、肠道、机体和鳃健康及肌肉品质的作用及其作用机制[D]. 雅安: 四川农业大学, 2016: 34-35. [26] 孙金辉, 范泽, 张美静, 等. 饲料蛋白水平对鲤幼鱼肝功能和抗氧化能力的影响[J]. 南方水产科学, 2017, 13(3): 113-119. doi: 10.3969/j.issn.2095-0780.2017.03.015 [27] 李坚明, 甘晖, 冯广朋, 等. 饲料脂肪含量与奥尼罗非鱼幼鱼肝脏形态结构特征的相关性[J]. 南方水产, 2008, 4(5): 37-43. doi: 10.3969/j.issn.2095-0780.2008.05.006 -
期刊类型引用(4)
1. 宋浩清,赫明漪,李廷银,段远,王敏奇,马光红,毕保良,毕润. 饲料蛋白质水平对中国结鱼幼鱼生长性能、饲料利用、体组成及消化酶活性的影响. 饲料研究. 2024(11): 66-71 .  百度学术
百度学术
2. 秦志清,梁萍,林建斌,高苏蕊,邱曼丽,李学贵,刘银华,赖铭勇,吴斌. 饲料蛋白质水平对黑脊倒刺鲃幼鱼生长性能、消化酶活性、蛋白质代谢及肠道形态的影响. 动物营养学报. 2023(02): 1134-1146 .  百度学术
百度学术
3. 郭赛,陈效儒,袁汉文,罗凯,张付贤,陈燚,郜卫华,田娟. 饲料蛋白质水平和加工工艺对克氏原螯虾生长性能、消化力和抗氧化性能的影响. 渔业科学进展. 2023(05): 90-103 .  百度学术
百度学术
4. 刘永士,王建军,朱建明,陆根海,施永海,刘建忠. 不同养殖密度下二龄刀鲚消化酶活性与分布特点. 安徽农业大学学报. 2021(02): 234-240 .  百度学术
百度学术
其他类型引用(10)



 下载:
下载:
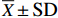
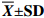

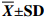
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
