Study on fast brining technology for low-salinity tilapia fillets
-
摘要:
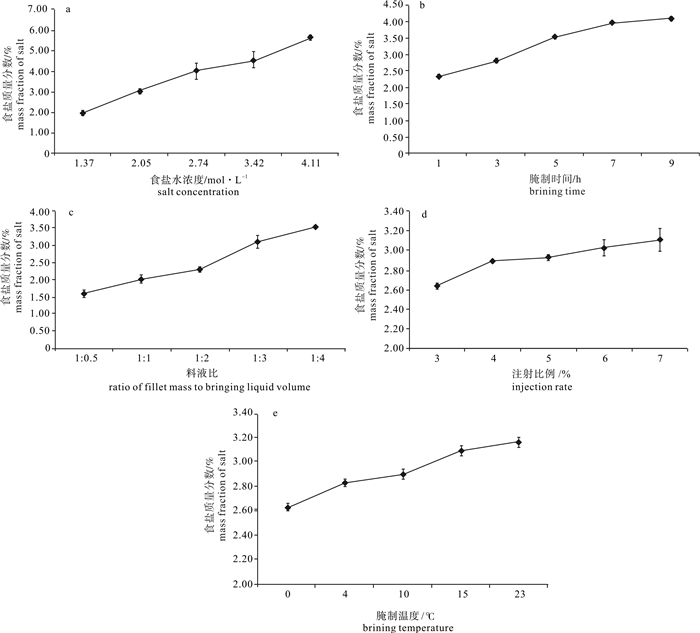
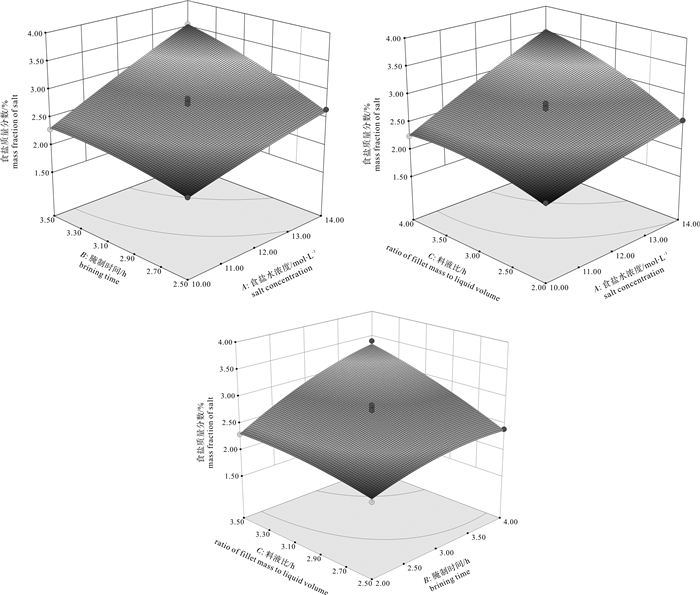
为探究不同腌制方式对罗非鱼(Oreochromis mossambicus)鱼片品质的影响,获得低盐罗非鱼片的快速腌制工艺,比较了静置腌制、注射腌制、真空腌制、超声腌制4种腌制方式对鱼片食盐质量分数、水分质量分数、质量变化率、pH、蛋白质水解指数和质构的影响,并在注射腌制单因素实验基础上,采用响应面优化法考察了食盐水浓度、腌制时间、料液比对注射腌制鱼片食盐质量分数的影响,优化了注射腌制工艺条件。结果表明,注射腌制鱼片的腌制效果较静置腌制、真空腌制、超声腌制方式好,其食盐渗透速率较快,产品品质良好,产品出品率高。单因素实验表明食盐水浓度、腌制时间、料液比是主要影响因素,通过Box-Behnken响应面法优化得到的最佳注射工艺为:食盐水浓度2.26 mol·L-1、腌制时间2.5 h、料液比[鱼片质量(g):腌制液体积(mL)]1:3.4,测得优化后的鱼肉食盐质量分数为2.93%,与模型的目标预测值相对误差为2.39%,表明该模型具有实际应用价值。
Abstract:To design a fast brining technology for low-salinity tilapia (Oreochromis mossambicus) fillets, we compared four brining methods (standing brining, saline injection, vacuum brining, ultrasonic-assisted brining) on tilapia fillets quality (salt content, water content, weight changing rate, pH, proteolysis index, texture property). Besides, on the basis of single factor experiment of saline injection and with response surface methodology, we studied the effects of salt concentration, brining time and ratio of fillet mass (g) to brining liquid volume (mL) on the salt content of the saline injection fillets, and then optimized the process. The results show that the saline injection fillets had the best brining effect with high salt permeation rate, good product quality and high product yield rate. The single factor experiment indicates that salt concentration, brining time and ratio of fillet mass (g) to brining liquid volume (mL) were the main influencing factors. The conditions optimized by Box-Behnken design are as follows:salt concentration of 2.26 mol·L-1, brining time of 2.5 h, ratio of fillet mass (g) to brining liquid volume (mL) of 1:3.4. Under these conditions, the actual salt content was 2.93%, and the relative error of the target prediction value was 2.39%, showing feasibility of this optimization.
-
Keywords:
- Oreochromis mossambicus /
- fillet /
- fast brining /
- low-salinity /
- saline injection /
- process optimization
-
在水产养殖生产实践中,合适的养殖方法对于提高经济效益具有重大意义。Dada等[1]认为,投喂方式、投喂频率、投喂量等均会影响养殖生物的生长。研究发现,投喂频率不仅影响水产动物的生长率和死亡率,还会影响养殖系统的水质[2]。过高的投喂频率会降低饲料利用率,残余的饲料溶失到养殖水体中会影响水质,增大了循环水养殖系统的净水负荷和流水养殖系统的换水率,从而增加了养殖人员的劳动强度和生产成本[3-4]。为提高养殖效益,国内外学者对一些水产养殖生物的最佳投喂频率进行了探索性研究,如饲养密度、摄食频率和摄食水平对珍珠龙胆石斑鱼 (Epinephelus fuscoguttatus♀×E. lanceolatus♂) 特定生长速率、饵料转化率和胃蛋白酶活性的综合影响[5],黑鳍髭鲷 (Hapalogenys nigripinnis) 幼鱼的最优投喂频率[6],大白姑鱼 (Argyrosomus japonicas) 幼鱼最佳投喂频率[7]等。
牙鲆 (Paralichthys olivaceus) 隶属于鲽形目、牙鲆科、牙鲆属,俗称牙片、偏口、左鲆等[8],是中国北方主要海水鱼类养殖品种,目前以工厂化养殖为主。对投喂频率的研究通常以饲料系数和特定生长率为指标[5],但这两个指标不能从本质上解释投喂频率对水产动物的影响。水产动物的特定生长率和饲料系数受肠道消化吸收能力的影响[9],肠道结构的完整性和消化酶活性是影响肠道消化吸收能力的重要因素[10],因而肠道结构的完整性和消化酶活性更能从本质上揭示水产动物对食物的消化吸收情况。投喂频率通过影响大黄鱼(Pseudosciaena crocea)胰蛋白酶活性进而能够影响其生长率[3],因此完整、健康的肠道是保证水产动物生长的重要基础。
在牙鲆养殖过程中,疾病是影响成活率的一个重要因素。机体代谢过程中产生的超氧阴离子自由基 (·O2 −) 可诱发一系列病变反应,如机体的抗氧化系统不能及时清除自由基,则会对机体造成严重的氧化损伤[11]。自然环境下,机体通过超氧化物歧化酶 (SOD) 与自由基间发生的歧化反应来清除自由基。SOD是一种广泛存在于动植物、微生物中的金属酶,能将生物体内·O2 −转化为氧气 (O2) 和过氧化氢 (H2O2),在生物体的自我保护系统和免疫系统中发挥极其重要的作用。歧化反应产生的H2O2可穿透大部分细胞膜,比·O2 −有更强的细胞毒性。过氧化氢酶 (CAT) 存在于所有已知动物的各个组织中,在肝脏中的浓度最高[12]。CAT的作用是促使H2O2分解为分子氧和水,使细胞免受H2O2的毒害,维护细胞的稳定性和完整性,起到保护细胞的作用[13]。因此,本研究将SOD和CAT活性作为反映鱼体健康程度的指标。
牙鲆在自然条件下的摄食规律已被充分研究,但在流水养殖条件下,其养成阶段的最佳投喂频率尚未确定。因此,本研究选择1龄牙鲆为研究对象,探讨了流水养殖条件下不同投喂频率对牙鲆肠道组织结构和生理生化指标的影响,旨在从生理生化水平揭示投喂频率对牙鲆生长的影响机制,为提升其养殖管理水平提供理论支撑。
1. 材料与方法
1.1 实验鱼与饲料
实验鱼由烟台市海阳市黄海水产有限公司提供。实验开始前在驯养池驯养15 d,驯养期间每天投喂2次 (07:00和17:00)。待实验鱼状态稳定后,挑选健康鱼360尾,平均体长 (31.21±0.81) cm、平均体质量 (308.71±7.61) g,随机分配到9个养殖缸中,每缸40尾,停食1 d后开始实验。
实验用饲料为黄海水产有限公司饲料车间提供的自制软颗粒饲料。具体加工方法:将冰鲜野杂鱼粉碎,制成鱼浆后混合鱼粉、玉米粉,添加诱食剂、维生素、鱼油等挤压成型,于−20 °C冷库中保存待用。
1.2 实验系统与日常管理
本实验于2019年9—11月在黄海水产有限公司进行。实验用容器为9个半径1.5 m、高1.2 m的圆形玻璃缸,实验用水为天然海水,经砂滤、沉淀处理后通过管道注入实验缸。实验期间连续24 h不间断充气,采用自然光。每天用YSI仪 (556MPS)检测水温[(22.31±2.31) °C]、盐度 (32.14±3.16)、溶解氧质量浓度 [(4.23±0.17) mg·L−1]和pH (8.20±0.62)。
每次投喂0.5 h后彻底换水并清理粪便。实验期间根据实验缸内壁清洁程度清理附着其上的污物,并及时隔离病鱼,清除死鱼。
1.3 实验方法
设置投喂频率为每天2、3、4次3个实验组,分别编号为T2、T3、T4,每组设置3个平行。鲍枳月等[14]研究发现晨昏时段是牙鲆的摄食高峰期,故将实验时间段设置在06:00—18:00。T2组间隔12 h投喂1次,投喂时间分别为06:00和18:00;T3组间隔6 h投喂1次,投喂时间分别为06:00、12:00和18:00;T4组间隔4 h投喂1次,投喂时间分别为06:00、10:00、14:00和18:00。每次均为饱食投喂。
为了计算摄食量 (投喂量−残饵量),在实验开始前对不同数量的饲料称质量 (g),并根据粒数与相应饲料质量建立回归方程:y=0.283x−0.371, R2=0.981,y为残饵质量 (g),x为残饵个数。实验期间严格按照预先设计的投喂策略定时定点投喂饲料,并详细记录每次投喂量。
1.4 样本采集与处理
每15 d记录一次实验鱼的体长和体质量。从每个实验缸中随机抽取10尾鱼,置于已稀释的麻醉液中 [V(MS-222)∶V(水)=1∶30 000],约30 s后从麻醉液中取出,用毛巾擦干鱼体表水分,用刻度尺测量体长,用电子天平 (乐祺电子天平,LQ-C12001,精度0.01 g) 称质量。
实验结束后,所有实验组停食24 h。每缸随机抽取3尾鱼,麻醉擦干后平放于解剖盘中,用注射器从尾静脉取血2 mL,不加抗凝剂,置4 °C冰箱中过夜后,用离心机 (赛洛捷克D3024R台式离心机) 离心10 min (4 °C、1 200 r·min−1) ,取上清液并迅速置于−80 °C冰箱保存,用于检测CAT和总超氧化物歧化酶 (T-SOD)。采血后的解剖样品鱼,分离出胃、肠分别装入密封袋并置于液氮中,然后转移至−80 °C冰箱中保存;实验结束后,将胃、肠解冻后,刮取胃中部和中肠黏液,用预冷后的生理盐水稀释至最佳检测浓度。
每个实验缸随机取3尾鱼解剖取出肠道,立即浸入4%多聚甲醛固定液中固定,送武汉塞维尔生物科技有限公司对中肠切片;将获得的切片在光学显微镜 (WM-9950 )下观察,测量并统计肠道指标。
胃蛋白酶 (PPS)、总蛋白、脂肪酶 (LPS)、CAT和T-SOD均由南京建成生物工程研究所提供的相关试剂盒测定。
1.5 计算与统计分析
成活率 (Survival rate, SR, %)、增重率(Weight gain rate, WGR, %)、饲料系数 (Feed conversion ratio, FCR, %)、摄食量 (Food consumption, FC, g) 和特定生长率 (Specific growth rate, SGR, %·d−1) 等生长指标的计算公式如下:
$$ \mathrm{S}\mathrm{R}=\frac{Q}{40}\times 100{\text{%}} $$ (1) $$ \mathrm{W}\mathrm{G}\mathrm{R}=\frac{{M}_{1}-{M}_{0}}{{M}_{0}}\times 100{\text{%}} $$ (2) $$ \mathrm{F}\mathrm{C}\mathrm{R}=\frac{{M}_{2}}{{M}_{1}-{M}_{0}}\times 100{\text{%}} $$ (3) $$ \mathrm{F}\mathrm{C}={\rm{FQ}}-(0.283x-0.371) $$ (4) $$ \mathrm{S}\mathrm{G}\mathrm{R}=\frac{\mathrm{ln}\left({M}_{1}\right)-\mathrm{ln}\left({M}_{0}\right)}{\mathrm{d}}\times 100{\text{%}} $$ (5) 式中,Q为末期剩余鱼数 (尾),M0为初始平均体质量 (g),FQ为投喂量,M1为末期平均体质量 (g),M2为实验期间总摄食量(g),d为总实验天数 (d),x为残饵粒数(个)。
数据采用OriginPro 2018、IBM SPSS Statistics 25.0 和Excel 2019软件处理,结果以“平均值±标准差 (
$\overline { X}\pm { \rm {SD}} $ )”表示。结果经单因素方差分析 (One-way ANOVA),若结果显著,则进行邓肯事后多重比较 (P<0.05),检验组间差异性。2. 结果
2.1 投喂频率对牙鲆摄食量的影响
投喂频率对牙鲆平均每尾日摄食量有显著影响,T3组最大 [(8.06±1.47) g],且与T2组[ (5.63±1.36) g]、T4组 [(6.07±1.08) g] 之间差异显著(P<0.05);T2与T4组之间差异不显著 (表1,P>0.05)。相同时间点下,不同实验组中每尾鱼的平均摄食量逐渐下降;06:00时,T3和T4组的摄食量分别为 (2.24±0.96) g和 (2.00±0.59) g,两者无显著差异,但均显著低于T2组 [(2.94±0.91) g,P<0.05)];18:00时,T2和T3组的摄食量分别为 (2.70±0.86) g和(2.36±0.82) g,两者差异不显著 (P>0.05),但均显著高于T4组 [(1.11±0.87) g, P<0.05]。
表 1 投喂频率对牙鲆摄食量的影响Table 1. Effect of feeding frequency on feeding of P. olivaceus组别
Group投喂频率
Frequency时间
Time平均每尾摄食量
Average food intake
per fish/g平均每尾日摄食量
Average daily food
intake per fish/g平均日摄食量/平均体质量
Average daily intake/
Average body mass/%T2 2 06:00 2.94±0.91a 5.63±1.36b 1.61a 18:00 2.70±0.86ab T3 3 06:00 2.24±0.96 bc 8.06±1.47a 1.9b 12:00 2.47±0.82 ab 18:00 2.36±0.82b T4 4 06:00 2.00±0.59bc 6.07±1.08b 1.6a 10:00 1.71±0.70c 14:00 1.38±0.82cd 18:00 1.11±0.87d 注:同列中上标不同字母的平均值间差异显著(P<0.05),上标相同字母的平均值间差异不显著(P>0.05),下同 Note: The average values of different superscripts in the same column are significantly different (P<0.05). There is no significant difference in the average values of the same superscripts (P<0.05). The same below. 2.2 投喂频率对牙鲆生长指标的影响
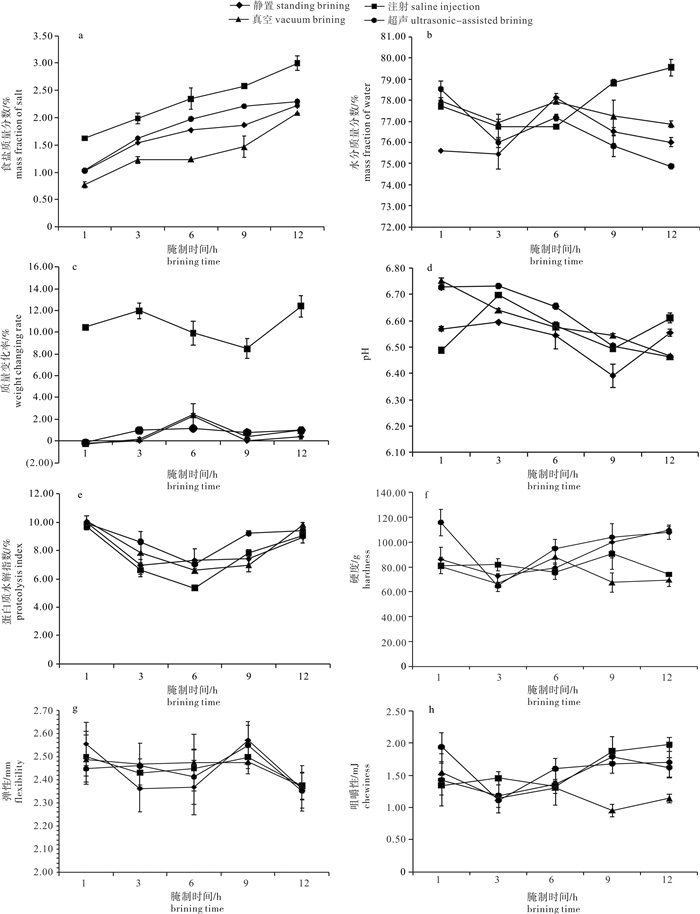
T2和T3组的特定生长率分别为1.13 %·d−1和1.17 %·d−1,显著高于T4组 (P<0.05),T2与T3组间无显著差异 (P<0.05);T4组的饲料系数最大 (1.27%),极显著高于T2和 T3组 (P<0.01),T2和T3组间无显著差异(P>0.05);T3、T2和T4组的增重率依次减小,分别为52.71%、45.37%和32.3%,且3组间差异显著 [P<0.05,其中T3和T4组间差异极显著 (P<0.01)];T2和T3组的成活率分别为95%和94%,两组间无显著差异;T4组的成活率为80%,极显著低于T2和T3组 (P<0.01,图1)。
2.3 投喂频率对牙鲆消化酶和抗氧化酶活性的影响
3组间淀粉酶 (AMY) 活性无显著性差异 (P>0.05)。T4组的LPS活性为8.52 U·mg−1,极显著低于T2和T3组 (P<0.01,图2);T2和T3组间无显著差异(P>0.05)。T4组的CAT活性为2.03 U·mg−1,极显著低于T2和T3组(P<0.01);T2和T3组间无显著差异(P>0.05)。T3、T2和T4组的PPS活性依次减小,分别为37.76、34.72和27.73 U·mg−1,3组间差异显著 (P<0.05),其中T3与T4组间差异极显著 (P<0.01)。T4组的T-SOD活性为118.58 U·mg−1,显著低于T2和T3组 (P<0.05);T2和T3间无显著差异 (P>0.05)。
2.4 投喂频率对牙鲆肠道组织形态的影响
牙鲆肠壁结构由内到外依次为黏膜层、黏膜下层、环肌层、纵肌层和浆膜层[15]。本实验结果显示,不同投喂频率下的牙鲆肠道结构有差异。T4组的肠壁厚度 (IWT) 最小 (202.06 mm),与 T2和T3组间差异极显著 (P<0.01);T2和T3组间差异不显著 (P>0.05)。T4组的环肌厚度 (LMT) 最小 (152.41 mm),与 T2和T3组间差异极显著 (P<0.01);T2和T3组间差异不显著 (P>0.05)。T3组的上皮细胞厚度 (ETC) 最大 (57.26 mm),且与T2和T4组间有显著差异 (P<0.05);T2和T4组间差异不显著 (P>0.05)。T2和T3组的杯状细胞数 (GC) 分别为28.83和31.86,两组间无显著差异,但都极显著高于T4组 (P<0.01,图3)。
在40×显微镜下,T4组肠绒毛较T2和T3组稀疏,且高度参差不齐,出现断裂,分叉少,数量明显少于T2和T3组,且T4组肠绒毛上皮细胞不完整,出现缺刻;T2和T3组黏膜层更厚,肠绒毛数量丰富,排列紧密,分叉多,外侧光滑完整无缺刻,充满整个肠腔 (图4-a, 4-c, 4-e)。在100×显微镜下,T4组环肌层与纵肌层间分界线不明显,肌层明显薄于其他组;T2和T3组环肌层与纵肌层的分界线较T4组明显;T4组肌层和黏膜层间出现空隙 (图4-b, 4-d, 4-f)。
![]() 图 4 不同投喂频率下牙鲆肠道组织切片观察a. T2组(40×);b. T3组(40×);c. T4组(40×);d. T2组(100×);e. T3组(100×);f. T4组(100×)Figure 4. Histological observation of intestinal structure of P. olivaceus at different feeding frequenciesa. T2 group (40×); b. T3 group (40×); c. T4 group (40×); d. T2 group (100×); e. T3 group (100×); f. T4 group (100×); IW. Intestinal wall; CM. Circular muscle; LM. Longitudinal muscle; GC. Goblet cell
图 4 不同投喂频率下牙鲆肠道组织切片观察a. T2组(40×);b. T3组(40×);c. T4组(40×);d. T2组(100×);e. T3组(100×);f. T4组(100×)Figure 4. Histological observation of intestinal structure of P. olivaceus at different feeding frequenciesa. T2 group (40×); b. T3 group (40×); c. T4 group (40×); d. T2 group (100×); e. T3 group (100×); f. T4 group (100×); IW. Intestinal wall; CM. Circular muscle; LM. Longitudinal muscle; GC. Goblet cell3. 讨论
3.1 投喂频率对牙鲆成活率的影响
研究发现,投喂频率会影响大西洋鲑 (Salmo salar)[16]、凡纳滨对虾(Litopenaeus vannamei)[17-18]的成活率。本实验结果也显示投喂频率影响了牙鲆的成活率。生物体自身的抗逆能力是影响其成活率的因素之一。生物体在代谢过程中会产生超氧自由基和H2O2,二者有毒害作用,若未被及时清除,会影响其对不利环境的抗逆能力[12-13]。T-SOD和CAT是生物体产生的、专门清除超氧自由基和H2O2的酶,若活性不足会影响其抗逆能力。本实验结果显示,T4组T-SOD和CAT活性显著低于其他组,因此,较低的T-SOD和CAT活性是导致T4组成活率低的原因之一。
肠黏膜是肠腺和杯状细胞等单细胞腺体生长的组织基础,其完整性在一定程度上决定了腺体数量的多少,肠黏膜越完整,腺体数量则越多[19]。杯状细胞是一种单细胞腺体,其分泌的黏液在肠壁内层形成黏膜以保护上皮细胞,杯状细胞数量减少会破坏黏膜的完整性,导致肠道抵抗外源性刺激和致病菌入侵的能力降低;杯状细胞数量越少,肠道受外源因素侵染的可能性就越大[20]。从牙鲆肠道的石蜡切片可以看出,T4组肠黏膜的完整性明显不及其他组,杯状细胞数量也显著少于其他组。肠道结构不完整是肠道受侵染的结果,肠黏膜是免疫系统的第一道屏障,该屏障受到破坏后会影响成活率,T4组的低成活率也证实了这一点。
3.2 投喂频率对牙鲆消化吸收的影响
不同摄食频率对漠斑牙鲆 (P. lethostigma) 消化道组织结构有显著影响[21]。本研究发现投喂频率越高,对肠道结构和消化酶活性的影响越显著。牙鲆消化道由口咽腔、食道、胃、幽门垂、小肠和直肠等构成[22]。肠壁和肌层起支撑肠道的作用,是肠道消化吸收的组织基础,T4组的肠壁不如其他组厚,而较薄的肠壁会影响肠道的蠕动[22]。肠黏膜中含有大量肠腺,肠腺是一种能够分泌肠液的腺体,肠液中含有淀粉酶、蛋白酶、脂肪酶等消化酶,因此消化酶活性可以反映肠腺数量的多少[23]。T4组的肠道脂肪酶活性显著低于其他组,说明T4组肠黏膜中的肠腺数量不及其他组。消化道中的消化液除少量在肠腺中合成外,大部分由消化腺合成分泌。消化腺是消化系统中具有分泌消化液功能的腺体。胰腺、肝脏、胃腺和肠腺均可分泌消化液,消化液中含有胃蛋白酶、脂肪酶和淀粉酶等消化酶[22]。当投喂频率每天超过3次时,牙鲆胃蛋白酶和脂肪酶活性受到抑制,但淀粉酶活性未受影响。鱼类消化道中淀粉酶活性较低,投喂频率对淀粉酶的影响不显著。鱼体中胰岛素的分泌量不足、受体少,不能对糖代谢进行有效调控,因此相对于畜禽类,鱼类对糖类的利用能力较差[24]。投喂频率对不同水生动物的影响有差异,如投喂频率会引起瓦氏黄颡鱼 (Pseudobagrus vachelli) 消化酶活性变化[25],高投喂频率使凡纳滨对虾的消化酶和抗氧化酶活性更高[26],投喂频率每天超过2次时条石鲷 (Oplegnathus fasciatus) 幼鱼的消化酶活性受到抑制[27]。
肠道蠕动能力和消化酶活性会影响生物体对食物的消化吸收,蠕动能力强、消化酶活性高的生物对食物的消化吸收能力更强[22]。饲料系数反映了生物体对食物的转化能力,T4组的高饲料系数和低摄食量也证明了不完整的肠道结构和低消化酶活性不利于牙鲆消化吸收食物中的营养物质。消化道是生物体从外界获取营养物质的唯一途径[28],消化道受损,生物体无法获取生长所需的营养物质,其生长将受到抑制。T4组的低特定生长率和低增重率也证明了这一点。当投喂频率增加到3次·d−1时,实验鱼的摄食量显著增加,但投喂频率对该组鱼的肠道结构和消化酶活性无显著影响,因此相对于T2组,T3组增加的饲料能够被消化吸收。由于T3组吸收了更多的营养物质,故其增重率显著高于T2组。本实验显示,投喂频率为3 次·d−1时,日摄食量最大。这一结果与Lee等[29]、鲍枳月等[14]和林利民等[30]的研究结果有差异,可能由实验方法和实验鱼规格不同所致,后者研究的是牙鲆仔、稚、幼鱼,实验方法未考虑投喂频率,而本实验使用平均体质量为308.71 g的成年鱼,实验变量即为投喂频率。
鱼类对营养物质的消化和吸收是其生长发育的基础,而消化和吸收主要依靠消化系统完成[31]。消化系统由消化道和消化腺两部分组成。消化酶活性和消化道结构的完整性在一定程度上决定了水生动物对食物的消化吸收能力,消化酶活性高、消化道结构完整的生物对食物有更高的吸收率,营养物质的积累速度更快,因此摄食量也更大。
4. 结论
合适的投喂频率有助于提高饲料利用率、降低饲料系数,但投喂频率过高不利于饲料的转化,且未被摄入的饲料溶解到养殖水体中,会造成水质恶化,从而降低养殖动物的成活率。综上所述,每天投喂2~3次时牙鲆有较高的特定生长率和成活率、较低的饲料系数,但综合考虑增重率,投喂频率为3次·d−1时,牙鲆对营养物质的吸收和增重率达到最大。建议每天在06:00、12:00和18:00共3个时间点投喂3次,日投喂量为体质量的1.9%。
-
表 1 因素水平编码表
Table 1 Factor and level
水平
level因素factor 食盐水浓度/mol·L-1(A)
salt concentration腌制时间/h(B)
brining time料液比/g·mL-1(C)
ratio of fillet mass to bringing liquid volume-1 1.71 2 1:2.5 0 2.05 3 1:3 1 2.40 4 1:3.5 表 2 响应面法优化实验结果
Table 2 Experimental results of Box-Behnken design
序号
No.食盐水浓度/mol·L-1(A)
salt concentration腌制时间/h(B)
brining time料液比/g·mL-1(C)
ratio of fillet mass to bringing liquid volume食盐质量分数/%
mass fraction of salt1 1.71 2 1:3 2.04 2 2.40 2 1:3 2.54 3 1.71 4 1:3 2.25 4 2.40 4 1:3 3.50 5 1.71 3 1:2.5 2.06 6 2.40 3 1:2.5 2.65 7 1.71 3 1:3.5 2.29 8 2.40 3 1:3.5 3.54 9 2.05 2 1:2.5 2.03 10 2.05 4 1:2.5 2.40 11 2.05 2 1:3.5 2.30 12 2.05 4 1:3.5 3.40 13 2.05 3 1:3 2.80 14 2.05 3 1:3 2.85 15 2.05 3 1:3 2.75 16 2.05 3 1:3 2.62 17 2.05 3 1:3 2.68 表 3 回归与方差分析结果
Table 3 Analysis of variance for fitted regression model
方差来源
source of variation平方和
SS自由度
DF均方
MSF P prob>F 显著性
significance模型model 3.69 9 0.41 59.50 < 0.000 1 *** A 1.62 1 1.62 234.08 < 0.000 1 *** B 0.88 1 0.88 126.86 < 0.000 1 *** C 0.71 1 0.71 103.34 < 0.000 1 *** AB 0.14 1 0.14 20.42 0.002 7 ** AC 0.11 1 0.11 15.86 0.005 3 ** BC 0.13 1 0.13 19.31 0.003 2 ** A2 3.117E-003 1 3.117E-003 0.45 0.523 1 B2 0.071 1 0.071 10.33 0.014 8 * C2 0.025 1 0.025 3.65 0.097 5 残差residual 0.048 7 6.900E-003 失拟项lack of fit 0.015 3 4.833E-003 0.57 0.662 8 纯误差pure error 0.034 4 8.450E-003 总和sum 3.74 16 注:***. P<0.001;**. P<0.01;*. P<0.05 -
[1] 赵志霞, 吴燕燕, 李来好, 等.我国罗非鱼加工研究现状[J].食品工业科技, 2017, 38(9):363-367, 373. http://d.wanfangdata.com.cn/Periodical/spgykj201709074 [2] 陈胜军, 李来好, 杨贤庆, 等.罗非鱼综合加工利用与质量安全控制技术研究进展[J].南方水产科学, 2011, 7(4):85-90. http://www.schinafish.cn/CN/abstract/abstract8895.shtml [3] 吴燕燕, 赵志霞, 李来好, 等.传统腌制鱼类产品加工技术的研究现状与发展趋势[J].中国渔业质量与标准, 2017, 7(3):1-9. http://d.wanfangdata.com.cn/Periodical/zgscwz201703001 [4] 魏涯, 钱茜茜, 吴燕燕, 等.栅栏技术在淡腌半干鲈鱼加工工艺中的应用[J].南方水产科学, 2017, 13(2):109-120. http://www.schinafish.cn/CN/abstract/abstract9438.shtml [5] SHEARD P R, TALI A. Injection of salt, tripolyphosphate and bicarbonate marinade solutions to improve the yield and tenderness of cooked pork loin[J].Meat Sci, 2004, 68(2):305-311. doi: 10.1016/j.meatsci.2004.03.012
[6] SIRÓ I, VÉNB C, BALLAB C, et al. Application of an ultrasonic assisted curing technique for improving the diffusion of sodium chloride in porcine meat[J].J Food Engin, 2009, 91(2):353-362. doi: 10.1016/j.jfoodeng.2008.09.015
[7] BHARTI S K, ANITA B, DAS S K, et al. Effect of vacuum tumbling time on physico-chemical, microbiological and sensory properties of chicken tikka[J].J Stor Prod Post Res, 2011, 77(1):35-41.
[8] 中华人民共和国国家质量监督检验检疫总局. GB/T9695. 15—2008肉与肉制品-水分含量测定[S]. 北京: 中华人民共和国国家标准出版社, 2008. [9] 中华人民共和国国家卫生和计划生育委员会. GB/5009. 44—2016食品中氯化物的测定[S]. 北京: 中华人民共和国国家标准出版社, 2016. [10] 中华人民共和国国家质量监督检验检疫总局. GB/T9695. 5—2008肉与肉制品-pH测定[S]. 北京: 中华人民共和国国家标准出版社, 2008. [11] HE Y F, HUANG H, LI L H, et al.Freshness and shelf life of air packaged and modified atmosphere packaged fresh tilapia fillets during freezing-point storage[J].J Nutr Food Sci, 2016, 6(6):564-570.
[12] 中华人民共和国国家卫生和计划生育委员会. GB 5009. 5—2010食品中蛋白质的测定[S]. 北京: 中华人民共和国国家标准出版社, 2010. [13] SZYMCZAK M, KOŁAKOWSKI E, FELISIAK K. Influence of salt concentration on properties of marinated meat from fresh and frozen herring (Clupea harengus L.)[J].Int J Food Sci Technol, 2012, 47(2):282-289. doi: 10.1111/ifs.2012.47.issue-2
[14] MCDONNELL C K, LYNG J G, ALLEN P. The use of power ultrasound for accelerating the curing of pork[J].Meat Sci, 2014, 98(2):142-149. doi: 10.1016/j.meatsci.2014.04.008
[15] 赵品, 林婉玲, 郝淑贤, 等.酒糟罗非鱼间歇真空糟制工艺研究[J].南方水产科学, 2016, 12(3):84-90. http://www.schinafish.cn/CN/abstract/abstract9332.shtml [16] 罗扬, 刘成国, 陈瑶, 等.真空腌制技术及其在食品加工中的应用研究[J].肉类研究, 2010(6):31-34. http://d.wanfangdata.com.cn/Periodical/rlyj201006009 [17] MATHIAS J S, JITTINANDANANA S, KENNEY P B, et al. Effect of vacuum tumbling with direct salting or brining on smoked trout fillets[J].J Aquat Food Prod Technol, 2003, 12(3):33-41. doi: 10.1300/J030v12n03_04
[18] 唐雪燕, 任丽影, 王丽莎, 等.不同腌制方式对猪肉品质的影响[J].食品研究与开发, 2016, 37(23):114-119. doi: 10.3969/j.issn.1005-6521.2016.23.027 [19] 丁玉庭, 胡煌, 吕飞, 等.滚揉腌制方式对鸭肉腌制品质的影响[J].食品与发酵工业, 2013, 39(2):200-204. http://www.cnki.com.cn/Article/CJFDTotal-SPFX201302042.htm [20] JITTINANDNA S, KENNEY B, SLIDER S D, et al. Effect of brine concentration and brining time on quality of smoked rainbow trout fillets[J].J Food Sci, 2002, 67(6):2095-2099. doi: 10.1111/jfds.2002.67.issue-6
[21] BARAT J M, RODRÍGUEZ BARONA S, ANDRÉS A, et al. Influence of increasing brine concentration in the cod-salting process[J].J Food Sci, 2002, 67(5):1922-1925. doi: 10.1111/jfds.2002.67.issue-5
[22] 刘然, 吕飞, 丁玉庭.不同腌制方式对草鱼腌制速率和理化性质的影响[J].食品工业, 2012, 33(12):67-71. doi: 10.3969/j.issn.1006-6195.2012.12.044 [23] 赵良, 岑剑伟, 李来好, 等.高压静电场结合冰温气调保鲜技术对罗非鱼鱼片品质的影响[J].南方水产科学, 2016, 12(3):91-97. http://www.schinafish.cn/CN/abstract/abstract9338.shtml [24] 李娜, 赵永强, 李来好, 等.冰藏过程中罗非鱼鱼片肌肉蛋白质变化[J].南方水产科学, 2016, 12(2):88-94. http://www.schinafish.cn/CN/abstract/abstract9305.shtml [25] LARSENÃ R, OLSEN S H, KRISTOFFERSEN S, et al. Low salt brining of pre-rigor filleted farmed cod (Gadus morhua L.) and the effects on different quality parameters[J].LWT-Food Sci Technol, 2008, 41(7):1167-1172. doi: 10.1016/j.lwt.2007.07.015
[26] 王晶. 干腌羊火腿工艺过程蛋白质水解规律及其相关性研究[D]. 乌鲁木齐: 新疆农业大学, 2008: 36. http://cdmd.cnki.com.cn/Article/CDMD-10758-2008066316.htm [27] 江慧. 酶嫩化及腌制风干工艺对淘汰蛋鸡蛋白质水解与品质特性的影响[D]. 南京: 南京农业大学, 2011: 23. http://cdmd.cnki.com.cn/Article/CDMD-10307-1012490526.htm [28] LARREA V, HERNANDO I, QUILES A, et al. Changes in proteins during Teruel dry-cured ham processing[J].Meat Sci, 2006, 74(3):586-593. doi: 10.1016/j.meatsci.2006.05.009
[29] BERTRAM H C, AASLYNG M D, ANDERSEN H J. Elucidation of the relationship between cooking temperature, water distribution and sensory attributes of pork:a combined NMR and sensory study[J].Meat Sci, 2005, 70(1):75-81. doi: 10.1016/j.meatsci.2004.12.002
[30] MICHALCZYK M, SUROWKA K. Microstructure and instrumentally measured textural changes of rainbow trout (Oncorhynchus mykiss) gravads during production and storage[J].J Sci Food Agric, 2009, 89(11):1942-1949. doi: 10.1002/jsfa.v89:11
[31] TOYOHARA M, MURATA M, ANDO M, et al. Texture changes associated with insolubilization of sarcoplasmic proteins during salt-vinegar curing of fish[J].J Food Sci, 1999, 64(5):804-807. doi: 10.1111/jfds.1999.64.issue-5
[32] 曾少葵, 刘坤, 吴艺堂, 等.脱钙罗非鱼鱼鳞明胶提取工艺优化及其理化性质[J].南方水产科学, 2013, 9(2):38-44. http://www.schinafish.cn/CN/abstract/abstract9011.shtml -
期刊类型引用(10)
1. 曾高雄. 中国圆田螺和梨形环棱螺的形态学分析和繁殖力比较研究. 渔业研究. 2025(02): 203-211 .  百度学术
百度学术
2. 金武,马学艳,彭刚,陈琬雯,闻海波. 梨形环棱螺11个地理种群的几何形态学分析. 中国农学通报. 2024(02): 159-164 .  百度学术
百度学术
3. 王海山,陈治,李由明,叶乐. 西沙群岛两种寄居蟹对定居螺壳的选择偏好的研究. 热带海洋学报. 2024(05): 84-92 .  百度学术
百度学术
4. 荆圆圆,胡凡光,刘广斌,吴海一,孙铭,陈群,张天文. 山东沿海不同地理群体中国蛤蜊形态差异分析. 海洋渔业. 2023(01): 95-104 .  百度学术
百度学术
5. 舒予,史令,赖思琦,田莹,常亚青. 不同水深养殖栉孔扇贝的形态测量学研究和比较. 水生生物学报. 2021(01): 132-139 .  百度学术
百度学术
6. 黄家锐,但小琴,文衍红,罗福广,黄杰,王卫民. 中国圆田螺与中华圆田螺形态比较研究. 中国农学通报. 2021(05): 117-123 .  百度学术
百度学术
7. 邹琰,李莉,王英俊,吴莹莹,刘童,宋爱环,刘洪军. 山东沿海不同地理群体菲律宾蛤仔形态变异分析. 水产学杂志. 2021(03): 28-33 .  百度学术
百度学术
8. 但小琴,程果,文衍红,罗福广,黄杰,王卫民. 三种环棱螺形态学比较研究. 淡水渔业. 2020(03): 50-55 .  百度学术
百度学术
9. 罗虹霞,陈丕茂,黎小国,袁华荣,王莲莲,冯雪. 南海紫海胆6个野生群体的形态差异分析. 广东农业科学. 2015(10): 114-119 .  百度学术
百度学术
10. 罗虹霞,陈丕茂,黎小国,袁华荣,王莲莲,冯雪. 南海紫海胆6个野生群体的形态差异分析(英文). Agricultural Science & Technology. 2015(12): 2774-2778+2808 .  百度学术
百度学术
其他类型引用(1)









 下载:
下载:




 粤公网安备 44010502001741号
粤公网安备 44010502001741号
