Molecular cloning and expression analysis of aspartate aminotransferase (AST) in Penaeus monodon under ambi-ent ammonia stress
-
摘要:
为了探索天门冬氨酸转氨酶(AST)在斑节对虾(Penaeus monodon)氨氮(NH3-N)解毒代谢中的作用, 该研究利用RACE技术获得了斑节对虾AST基因(PmAST)的cDNA全长序列, 进行了相关生物信息学分析, 在此基础上采用荧光定量与氨氮胁迫实验的方法研究了PmAST基因在斑节对虾的不同组织以及不同浓度氨氮胁迫过程中差异表达情况。该序列全长1 957 bp, 开放阅读框(ORF)为1 242 bp, 3′非编码区(UTR)为584 bp, 包括含有30个碱基的poly(A)尾, 5′非编码区(UTR)为131 bp。ORF可编码413个氨基酸, 预测分子量为45.852 kD, 理论等电点为8.85。序列含有1个AAT-like超家族结构域、15个磷酸化位点和2个糖基化位点。PmAST的mRNA在斑节对虾各组织中都有表达, 在肝胰腺中表达量最高, 其次为鳃组织, 在胃和脑组织中的表达量最低。96 h氨氮胁迫后荧光定量PCR分析结果表明, PmAST在肝胰腺和鳃组织中都具有不同程度的表达上调, 显著高于对照组(P < 0.05)。研究结果表明斑节对虾的PmAST基因在氨氮胁迫条件下会出现表达上调, 并且氨氮浓度越高其上调幅度也越大, 所以PmAST参与了斑节对虾的急性氨氮胁迫应答。
Abstract:To explore the function of aspartate aminotransferase gene in the process of the ammonia nitrogen metabolism of black tiger shrimps (Penaeus monodon), the full-length cDNA sequence of aspartate aminotransferase from P.monodon (PmAST) was obtained by high throughput transcriptome sequencing and rapid amplification of cDNA ends.On this basis, the expression of the PmAST in different tissues under different ambient ammonia stress were detected by fluorescence-quantitative real time PCR.The cDNA length of PmAST was 1 957 bp, including a 5′UTR of 131 bp and a 3′UTR of 584 bp.The length of the open reading frame (ORF) was 1 242 bp encoding a polypeptide of 413 amino acid.The molecular mass of the deduced amino acid (aa) sequence was 45.852 kD with an estimated pI of 8.85, and there was a tailing signal (poly A) with 30 bp length.Like other animals′ ASTs, the structure of PmAST protein included an AAT-I superfamily domain.There were 15 phosphorylation sites and 2 glycosylation sites in this protein.Analysis of the tissue expression pattern of the PmAST shows that PmAST mRNA was expressed in all tested tissues, including ovary, haemolymph, brain, lymph, stomach, muscle, thoracic ganglia, heart, hepatopancreas and gill.The PmAST expression reached the maximum value in hepatopancreas and was the lowest in brain.After ambient ammonia stress experiment, the expression of the PmAST in hepatopancreas and gill was significantly higher than that in the control (P < 0.05), and the expression profiles differed between hepatopancreas and gill.The result shows that the higher the ambient ammonia concentration is, the greater the increase of PmAST expression will be.Therefore, the PmAST takes part in acute ammonia stress.
-
Keywords:
- Penaeus monodon /
- AST /
- ambient ammonia stress /
- gene clone /
- tissue expression
-
三疣梭子蟹(Portunus trituberculatus)广泛分布于中国沿海,作为一种重要的大型海产经济蟹类,其营养价值和经济价值较高,并且肉质细嫩,味道鲜美。过去几十年里,研究者在梭子蟹的苗种培育、人工养殖技术及疾病防治等方面做了大量工作。近年来,许多学者在生化和DNA水平上研究梭子蟹野生群体遗传结构及种质资源的鉴定方面,同工酶(isozyme)[1-6]、线粒体DNA(mitochondrial DNA,mtDNA)[7-11]、随机扩增多态性DNA(random amplified polymorphic DNA,RAPD)[12]、扩增片段长度多态性(amplified fragment length polymorphism,AFLP)[13]和简单重复序列间多态性(inter-simple sequence repeat,ISSR)[6]等先进分子标记的应用加速了梭子蟹遗传基础的研究进程,已经分离出能够区分不同种梭子蟹的分子标记[12]。
SRAP是由LI与QUIROS[14]发展而来的一种新型分子标记。SRAP分子标记在许多植物得到成功应用,如甘蓝(Brassica oleracea)[14]、棉花(Gossypium spp.)[15-16]、野牛草(Buchloe dactyloides)[17-18]和西葫芦(Cucurbita pepo)[19-20],足以证明SRAP标记能够有效地评价物种遗传多样性、品系鉴定和构建遗传图谱等。考虑到SRAP-PCR扩增结果易受镁离子(Mg2+)、三磷酸脱氧核苷(dNTPs)、引物、TaqDNA聚合酶、模板等因子及其协同作用的影响,因此,在利用SRAP标记进行梭子蟹遗传差异分析,寻找与性别相关的分子标记前,建立一个最佳的SRAP-PCR反应体系,以期获得稳定、可靠的试验结果。
1. 材料与方法
1.1 材料
2009年7月采自舟山普陀东河菜场,从活蟹的螯肢上取适量肌肉,保存于95%乙醇以备基因组DNA的提取。
从大连宝生物工程有限公司购置TaqDNA聚合酶和标准分子量(Marker)100 bp DNA ladder。
提交SRAP引物序列由上海生工合成,通过引物两两组合筛选,选取引物组合M8E9[14]进行正式扩增,重复3次。
1.2 梭子蟹基因组DNA模板的提取与检测
采用高盐法提取梭子蟹基因组DNA,利用U2100pro核酸蛋白检测仪检测其纯度和浓度,并进行0.8%琼脂糖凝胶检测,验证其是否降解,稀释基因组DNA为10 ng · μL-1以备扩增用。
1.3 反应因素水平的确定与正交表设计
根据王燕青和季孔庶[21]提供的方法,试验中采用正交设计L16 (45)进行试验。反应各因素水平见表 1。
表 1 PCR反应体系的因素水平Table 1 Factors and levels of PCR reaction因素
factors水平(体系终浓度)/levels(final concentration) 1 2 3 4 Mg2+/mmol·L-1 1.60 2.00 2.20 2.40 dNTPs/mmol·L-1 0.10 0.20 0.30 0.40 TaqDNA聚合酶/U TaqDNA polymerase 0.50 1.00 1.50 2.00 引物/μmol·L-1 primer 0.10 0.20 0.30 0.40 模板/ng template 10 30 50 70 在My CyclerTM thermal cycler仪(BIO-RAD,美国产)上进行SRAP-PCR扩增,反应程序参照王燕青和季孔庶[21]提供的程序。
PCR扩增产物用2%琼脂糖凝胶电泳(含EB)分离,电泳缓冲液为0.5×TBE,80 V稳压电泳40 min,电泳结束后在凝胶成像系统中拍照观察。
电泳结果评分标准是依据电泳条带的多少、清晰度及背景颜色进行打分[21-22]。此试验中,条带丰富记为6分;清晰度高记为6分;背景颜色浅记为4分,依此对各引物组合扩增结果进行打分与加和统计。
2. 结果与讨论
2.1 电泳结果评分
根据评分原则和标准,对3次重复试验[3次重复结果差异不大,仅附1次的电泳图谱(图 1)]分别单独进行统计,得分见表 2。从3次重复的得分来看,结果的一致性较好。其中以组合8、10和15效果最好,达到15分,而以组合4效果最差,仅为1.67分,这与图 1中的扩增结果表现大体一致。各因素的极差R与对反应结果的影响程度成正比,当某因素的极差(R)最大时,该因素对PCR反应的影响也最大。由此可知,试验中模板浓度对反应结果影响最大,引物浓度的影响最小,各因素水平变化对PCR结果的影响从大到小依次为模板、Mg2+、dNTPs、TaqDNA聚合酶和引物。
表 2 PCR反应的因素水平正交试验设计Table 2 Factors and levels of PCR reaction based on orthogonal experimental design编号
No.Mg2+
/mmol·L-1dNTPs
/mmol·L-1TaqDNA聚合酶/U
TaqDNA polymerase引物/μmol·L-1
primer模板/ng
template得分score 平均得分
average score1 2 3 1 1.60 0.10 0.50 0.10 10 11 10 10 10.33 2 1.60 0.20 1.00 0.20 30 13 12 11 12.00 3 1.60 0.30 1.50 0.30 50 14 11 10 11.67 4 1.60 0.40 2.00 0.40 70 2 1 2 1.67 5 2.00 0.10 1.00 0.30 70 10 9 9 9.33 6 2.00 0.20 0.50 0.40 50 10 7 14 10.33 7 2.00 0.30 2.00 0.10 30 11 14 10 11.67 8 2.00 0.40 1.50 0.20 10 16 15 14 15.00 9 2.20 0.10 1.50 0.40 30 13 15 13 13.67 10 2.20 0.20 2.00 0.30 10 15 16 14 15.00 11 2.20 0.30 0.50 0.20 70 15 12 13 13.33 12 2.20 0.40 1.00 0.10 50 12 11 12 11.67 13 2.40 0.10 2.00 0.20 50 11 12 11 11.33 14 2.40 0.20 1.50 0.10 70 10 12 12 11.33 15 2.40 0.30 1.00 0.40 10 13 16 16 15.00 16 2.40 0.40 0.50 0.30 30 11 10 10 10.33 T1 35.67 44.67 44.33 45.00 55.33 - - - - T2 46.33 48.67 48.00 51.67 47.67 - - - - T3 53.67 51.67 51.67 46.33 45.00 - - - - T4 48.00 38.67 39.67 40.67 35.67 - - - - t1 8.92 11.17 11.08 11.25 13.83 - - - - t2 11.58 12.17 12.00 12.92 11.92 - - - - t3 13.42 12.92 12.92 11.58 11.25 - - - - t4 12.00 9.67 9.92 10.17 8.92 - - - - R 4.50 3.25 3.00 2.75 4.91 - - - - 注:T1~T4为各水平的平均得分总和;t1~t4分别为T1,T2,T3和T4的平均值Note:T1~T4 represent the sum of average scores of each treatment; t1~t4 represent the mean of T1, T2, T3, T4. 2.2 模板质量浓度对PCR结果的影响
当ρ (模板)为30~50 ng · μL-1时,各水平间差异不明显,其余每2水平间均达到显著差异(图 2)。从图 2明显看出ρ (模板)10 ng · μL-1时,SRAP-PCR扩增效果好,达到了反应体系的最佳效果。在保证有效扩增效果的前提下应尽量降低模板的用量。因此,该试验最终选定10 ng ·μL-1作为最佳反应水平。
2.3 Mg2+对PCR结果的影响
Mg2+作为该试验中的第二关键因子,对PCR反应的影响是多方面的,包括对TaqDNA聚合酶的活性和引物退火温度的影响。当dNTPs和模板同时与Mg2+结合,降低了游离c (Mg2+)。在包含0.20 mmol · L-1 dNTPs的典型PCR反应中,c (Mg2+)以1.50~2.00 mmol · L-1为宜。然而在该试验中,尽管c (Mg2+)(2.00~2.40 mmol · L-1)明显高于常规的c (Mg2+),仍然得到较好的扩增结果。
较高的游离c (Mg2+)可以增加PCR产量,但也会增加非特异性扩增,降低忠实性。浓度过低会降低TaqDNA聚合酶的活性,使反应产物减少。当c (Mg2+)从1.60 mmol · L-1增加到2.40 mmol · L-1的过程中,发现在2.20 mmol · L-1时反应均值最高,随后下降与2.00 mmol · L-1相当。因此,最终确定c (Mg2+)2.20 mmol · L-1为最佳反应水平(图 3)。
2.4 dNTPs浓度对PCR结果的影响
c (dNTPs)在0.10~0.30 mmol · L-1无明显差异,呈现上升的趋势,但与0.40 mmol · L-1差异显著。浓度过高时,错误掺入率大大增加,且dNTPs能与Mg2+结合,降低游离的c (Mg2+)。0.10~0.30 mmol · L-1结果差异不显著,均值几乎相同。为防止浓度过低所导致无扩增产物或扩增产物不稳定或扩增出来的条带模糊不清,再加上经济角度的考虑,选择0.20 mmol · L-1为反应的最佳水平(图 4)。
2.5 TaqDNA聚合酶浓度对PCR结果的影响
TaqDNA聚合酶在0.50~1.50 U水平间差异不显著,与2.00 U水平达到显著差异。当TaqDNA聚合酶用量为1.50 U时,SRAP-PCR扩增效率出现峰值,达到最佳(图 5)。一般来说,在100 μL PCR反应体系中,TaqDNA聚合酶用量约为2.50 U。浓度高可引起非特异性扩增,忠实性降低,浓度低则减少PCR产物,导致扩增模糊。考虑TaqDNA聚合酶在0.50~1.50 U水平间差异不显著的因素,该试验中25 μL反应体系选择0.50 U TaqDNA聚合酶作为最佳反应水平(图 5)。
2.6 引物浓度对PCR结果的影响
c (引物)0.10~0.40 μmol · L-1在水平间无显著差异(图 6)。较高的引物浓度能大量扩增产物,但同时诱发了错配、非特异性扩增和二聚体的生成,降低了PCR反应的忠实度。通常,最佳的引物浓度一般在0.10~0.50 μmol ·L-1,以最低引物量扩增出所需要的产物为好,因此该试验中应选择峰值0.20 μmol · L-1为反应的最佳水平。
3. 结论
SRAP标记是一种新型的分子标记技术,利用17碱基正向引物和18碱基反向引物进行扩增,正向引物的核心引物序列为14个碱基,后接CCGG碱基,反向引物的核心序列后接AATT碱基[23]。SRAP标记比RAPD结果稳定,而同时减少了AFLP繁琐的试验操作,并降低了试验成本。值得一提的是,SRAP的上游和下游引物可以通用,两两搭配组合甚至三引物组合,省却了SSR标记需要进行引物开发的前期工作。与RAPD、AFLP和微卫星DNA(simple sequence repeat,SSR)相比,SRAP标记的这种重复性好、容易操作、引物通用性好和多态性高等优点,在种群遗传多样性、种质鉴定和遗传图谱构建等方面发挥了日益重要的作用。
不同反应体系、扩增程序和物种的差别对SRAP-PCR的扩增效率均有一定影响。该试验结果证明,在扩增程序不变的前提下,不同反应体系对三疣梭子蟹的SRAP-PCR扩增结果影响较大。基于正交试验设计,该试验优化并建立了三疣梭子蟹SRAP-PCR最佳反应体系(25 μL)为TaqDNA聚合酶0.50 U,c (Mg2+)2.20 mmol · L-1,模板10 ng,c (dNTPs)0.20 mmol · L-1,c (引物)0.20 μmol · L-1。这与图 1中条带最优组合8和10(表 2)大体相似。
PCR反应是各因素相互作用的综合结果,一般来说,DNA的提取、扩增体系和扩增产物的检测都有可能影响其结果,特别是反应程序的影响较大。郭大龙和罗正荣[24]在对柿属植物(Diospyros spp.)进行SRAP体系优化时发现,较高的退火温度可以保证更加稳定和理想的结果。该研究采用SRAP-PCR的改进反应程序(即Tm为50 ℃)取得了较好的效果。SRAP一般采用PAGE凝胶检测所扩增的产物,然而在后续的雌、雄梭子蟹遗传差异分析(另文发表)中,利用该优化体系所扩增的产物用较高质量分数(2%)的琼脂糖凝胶电泳检测,同样能获得较丰富的多态性,而且结果清晰稳定,这与FERRIOL等[20]和郭大龙和罗正荣[24]的结论一致。
-
图 1 斑节对虾AST基因的核酸和氨基酸序列
两边每行标注的序号是指核苷酸和氨基酸的位置; 起始密码子(ATG)和终止密码子(TAA)用下划线标出; poly(A)尾巴用斜体字标出; 字体加粗标注为多肽结合位点; 灰色阴影标注为糖基化位点; 方框所示为谷AAT-like超家族结构域; 圆框中为磷酸吡哆醛结合位点; 三角框中为Lys催化残基。
Figure 1. Nucleotid and amino acid sequences of PmAST
The serial numbers on both sides of each row refer to the location of nucleotides and amino acids; start codon (ATG) and termination codon (TAA) are underlined; "*" indicates stop codon; the poly (a) signals are in italics; eight poly peptide sites are highlighted in bold; shadow area indicates two glycosylation sites; the completed AAT-I superfamily domains are shown in the box; ten PLP binding sites are represented by round frames; the catalytic residue is marked by a triangle.
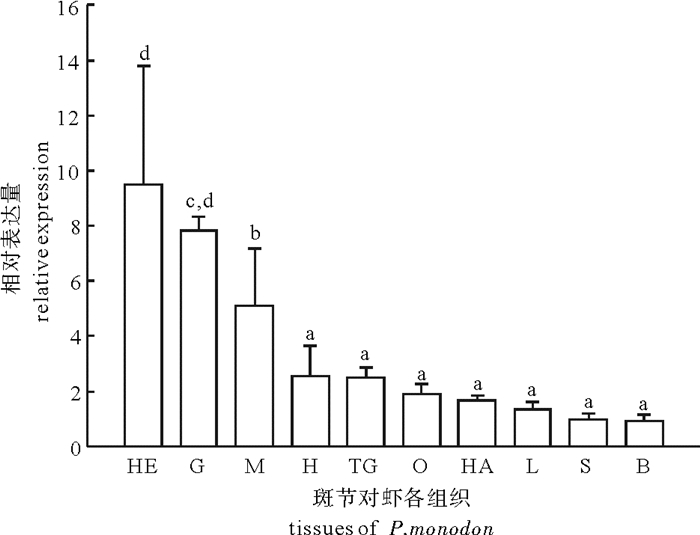
图 5 斑节对虾AST基因在各组织表达情况
HE.肝胰脏; G.鳃; M.肌肉; H.心脏; TG.胸神经; O:卵巢; HA.血淋巴L.淋巴; S.胃; B.脑; 图中数值为平均值±标准差(X ±SD), 小写字母不同表示差异性显著(P < 0.05)。
Figure 5. Expression of P.monodon AST in different tissues
HE.hepatopancreas; G.gill; M.muscle; H.heart; TG.thoracic ganglia; O.ovary; HA.haemolymph; L.lymph; S.stomach; B.brain; values (X ±SD) with different letters are significantly different from one another (P < 0.05).
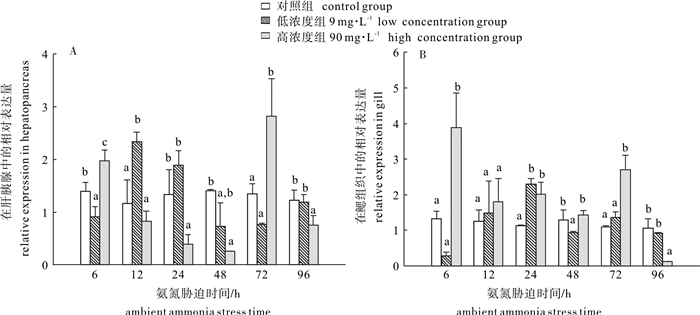
图 6 斑节对虾肝胰腺和腮中PmAST基因在氨氮胁迫过程中表达变化情况
图中数值为“平均值±标准差(X ±SD)”, 同一时间内小写字母不同表示实验组与对照组差异性显著(P < 0.05)。
Figure 6. Expression profiles of PmAST gene in P.monodon hepatopancreas and gill during ambient ammonia stress
Values (X ±SD) with different lowercase letters at the same time are significantly different with the control (P < 0.05).
表 1 斑节对虾AST基因克隆与表达分析所用引物序列
Table 1 Oligonucleotide primers used in the experiment
引物名称
primer引物序列(5′→3′)
primer sequence用途
functionTZ-F AATACGCTTCGCTCCGC 已知片段验证 TZ-R TTGCCTGCTTTGTTTACCAT TZS1 CCATCAGAGACTGGAGTCACATCA 3′RACE TZS2 TTCTGTGTACCTGACAAAGGATGG TZA1 CACCAACGCCAAGATTC 5′RACE TZA2 TGTCACGCTTGAATGCC β-actin-F AGTAGCCGCCCTGGTTGTAGA 内参基因 β-actin-R TTCTCCATGTCGTCCCAGT TZD-F AGCCCAGTTATTGCCGATG 荧光定量 PCR TZD-R GAAGGTGGAGCCAATACGGA -
[1] 李少飞, 何玉英, 李吉涛, 等.中国明对虾天门冬氨酸转氨酶基因的克隆及氨氮胁迫对其时空表达的影响[J].中国水产科学, 2014, 21(6):1125-1133. [2] 王镜岩, 朱胜庚, 徐长法.生物化学[M].3版.北京:高等教育出版社, 2002:306-308. [3] 潘劲劲. 天冬氨酸转氨酶与血小板比值在转氨酶两倍以下慢性乙型肝炎病毒感染患者中的临床应用评价[D]. 安徽: 安徽医科大学, 2014: 8-9. [4] 杜宗孝, 李富荣, 朴文花.血清天门冬氨酸氨基转移酶线粒体同工酶在酒精性肝病中的临床价值[J].检验医学, 2012, 27(9):732-735. http://med.wanfangdata.com.cn/Paper/Detail?id=PeriodicalPaper... [5] LIN L, ZENG X L, ZHANG J.Effect of profenofos poisoning on liver lipid peroxidation and liver function in rabbits[J].Chin J Clin Rehabilit, 2004, 8(21):4380-4381. https://www.researchgate.net/publication/286968630_Effect_of...
[6] 张彬彬.乙草胺对泥鳅肝脏谷丙转氨酶和谷草转氨酶的影响[J].江苏农业科学, 2009 (1):289-290. [7] 李波, 樊启学, 杨凯, 等.慢性氨氮胁迫对黄颡鱼摄食, 生长及血液指标的影响[J].应用与环境生物学报, 2011, 17(6):824-828. [8] 黄忠, 林黑着, 李卓佳, 等.复方中草药投喂策略对凡纳滨对虾生长, 消化及非特异性免疫功能的影响[J].南方水产科学, 2013, 9(5):37-43. http://www.wenkuxiazai.com/doc/4fb642ae7c1cfad6195fa7b2.html [9] MCKENNA M C, HOPKINS I B, LINDAUER S L, et al.Aspartate aminotransferase in synaptic and nonsynaptic mitochondria:differential effect of compounds that influence transient hetero-enzyme complex (metabolon) formation[J].Neurochem Int, 2006, 48(6):629-636. https://www.sciencedirect.com/science/article/pii/S0197018606000623
[10] MCCUTCHEON J P, von DOHLEN C D.An interdependent metabolic patchwork in the nested symbiosis of mealybugs[J].Curr Biol, 2011, 21(16):1366-1372. doi: 10.1016/j.cub.2011.06.051
[11] SCARAFFIA P Y, ISOE J, MURILLO A, et al.Ammonia metabolism in Aedes aegypti[J].Insect Biochem Molec, 2005, 35(5):491-503. doi: 10.1016/j.ibmb.2005.01.012
[12] CHEN J, ZHOU F, HUANG J, et al.Ammonia and salinity tolerance of Penaeus monodon across eight breeding families[J].SpringerPlus, 2016, 5(1):1. doi: 10.1186/s40064-015-1659-2
[13] 韩春艳, 郑清梅, 陈桂丹, 等.氨氮胁迫对奥尼罗非鱼非特异性免疫的影响[J].南方水产科学, 2014, 10(3):47-52. [14] 李少飞. 中国对虾氨氮代谢酶基因的cDNA克隆及其在氨氮解毒代谢过程中的作用[D]. 大连: 大连海洋大学, 2014: 28-30. [15] 刘胜男, 潘鲁青, 刘茂琪.氨氮胁迫对三疣梭子蟹解毒代谢关键基因表达的影响[J].海洋湖沼通报, 2015 (2):97-104. http://www.cqvip.com/QK/95761X/201502/666585651.html [16] 岳峰. 三疣梭子蟹在氨氮胁迫下免疫应答与解毒代谢机制的研究[D]. 青岛: 中国海洋大学, 2010: 11-12. [17] 胡志国, 刘建勇, 袁瑞鹏, 等.凡纳滨对虾高氨氮和低溶氧抗逆性状的杂交配合力分析[J].南方水产科学, 2016, 12(1):43-49. http://www.cqvip.com/QK/60642B/201601 [18] 肖炜, 李大宇, 徐杨, 等.慢性氨氮胁迫对吉富罗非鱼幼鱼生长, 免疫及代谢的影响[J].南方水产科学, 2015, 11(4):81-87. http://www.cqvip.com/QK/60642B/201504/665703414.html [19] 黄建华, 李永, 杨其彬, 等.斑节对虾家系氨氮耐受性的比较[J].南方水产科学, 2012, 8(6):37-43. http://www.oalib.com/paper/4365344 [20] 郑微云, 翁思琪.环境毒理学概论[M].厦门:厦门大学出版社, 1993:57-60. [21] ZANG W L, XU X C, DAI X L, et al.Toxic effects of Zn2+, Cu2+, Cd2+ and NH3 on Chinese prawn[J].Chin J Oceanol Limnol, 1993, 3:254-259.
[22] 荆晓丽. 青岛文昌鱼谷丙转氨酶基因克隆, 表达和功能研究[D]. 青岛: 中国海洋大学, 2010: 56-61. [23] MEHTA P K, HALE T I, CHRISTEN P.Aminotransferases:demonstration of homology and division into evolutionary subgroups[J].Eur J Biochem, 1993, 214(2):549-561. doi: 10.1111/ejb.1993.214.issue-2
[24] 陈玉春, 顾雪飞, 刘敏.5种中草药对鲤血清谷丙转氨酶, 谷草转氨酶及红细胞过氧化氢酶活性的影响[J].淡水渔业, 2007, 37(5):11-13. http://www.wenkuxiazai.com/doc/cd1e180f866fb84ae45c8d81.html [25] 赵杰, 谷子林, 崔青曼, 等."克白克"对中国对虾体内琥珀酸脱氢酶, 磷酸甘油三酯和谷草转氨酶活性的影响[J].中国饲料, 2002(3):14. http://industry.wanfangdata.com.cn/dl/Magazine?magazineId=zgsl&... [26] REGNAULT M.Nitrogen excretion in marine and fresh-water crustacea[J].Biol Rev, 1987, 62(1):1-24. https://www.researchgate.net/publication/229992875_Nitrogen...
[27] CHEN J C, LIN C Y.Responses of oxygen consumption, ammonia-N excretion and urea-N excretion of Penaeus chinensis exposed to ambient ammonia at different salinity and pH levels[J].Aquaculture, 1995, 136(3):243-255. https://es.scribd.com/document/153402238/2009-Rational-pdf
[28] CHEN J M, CHEN J C.Study on the free amino acid levels in the hemolymph, gill, hepatopancreas and muscle of Penaeus monodon exposed to elevated ambient ammonia[J].Aquat Toxicol, 2000, 50(1):27-37.
[29] WALTON D J.Stereochemistry of reduction of D-glyceraldehyde catalyzed by a nicotinamide adenine dinucleotide phosphate dependent dehydrogenase from skeletal muscle[J].Biochemistry, 1973, 12(18):3472-3478. doi: 10.1021/bi00742a018
[30] 李永. 斑节对虾人工选育及氨氮对其免疫, 解毒代谢影响[D]. 上海: 上海海洋大学, 2012: 9. [31] 曾媛媛, 陈曦飞, 艾春香, 等. 氨氮胁迫对拟穴青蟹血淋巴生理生化指标及鳃和肝胰腺显微结构的影响[C]//中国甲壳动物学会第十一届年会暨学术研讨会论文摘要集. 厦门: 中国海洋湖沼学会, 2011: 107. -
期刊类型引用(3)
1. 司梦茹,李运东,杨其彬,姜松,杨丽诗,黄建华,江世贵,周发林. 斑节对虾PP2C基因的克隆及其在急性低盐和氨氮胁迫下表达模式的相关研究. 南方水产科学. 2022(03): 76-85 .  本站查看
本站查看
2. 刘伟,赵超,范嗣刚,王鹏飞,闫路路,邱丽华. 斑节对虾GPx3a基因的分子克隆及表达分析. 海洋科学. 2018(02): 141-149 .  百度学术
百度学术
3. 王文豪,董宏标,孙永旭,曹明,段亚飞,李华,刘青松,张家松. MS-222和丁香酚在大口黑鲈幼鱼模拟运输中的麻醉效果. 南方水产科学. 2018(06): 52-58 .  本站查看
本站查看
其他类型引用(5)



 下载:
下载:








 粤公网安备 44010502001741号
粤公网安备 44010502001741号
