Molecular cloning and expression profiles of matrilin-1 in pearl oyster (Pinctada fucata)
-
摘要:
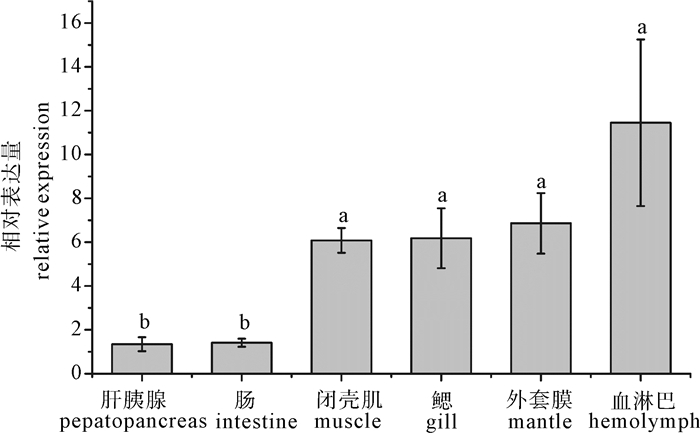
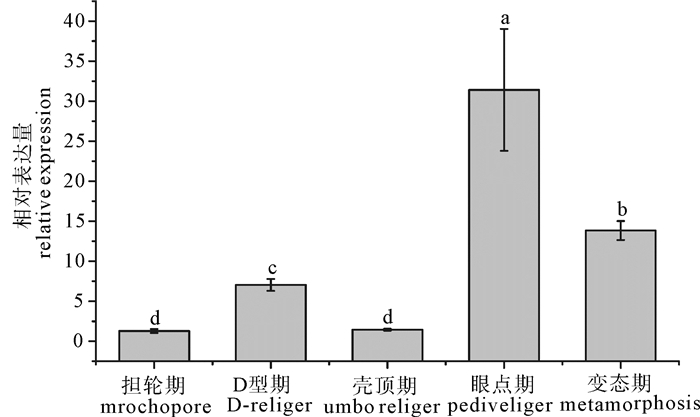
以合浦珠母贝(Pinctada fucata)转录组中的matrilin-1基因片段为基础,开展了matrilin-1的cDNA全长(Pfmatrilin-1)克隆和定量表达分析。Pfmatrilin-1基因cDNA全长2 036 bp,开放阅读框(open reading frame,ORF)1 194 bp,编码397个氨基酸,包括1个信号肽序列和2个血管性血友病因子A(von Willebrand factor A,VWA)样结构域。系统进化分析显示无脊椎动物的matrilins与脊椎动物的matrilins进化关系较远。荧光定量PCR表达分析结果显示,Pfmatrilin-1 mRNA在合浦珠母贝各个组织中均有表达,其中在血液中表达量最高(P < 0.05);Pfmatrilin-1从担轮幼虫期至变态期均有表达,眼点期表达量最高(P < 0.05),而贝类幼虫发育到眼点期就会开始附着,眼点期幼虫原壳生长停滞,次生壳形成,因此推测其可能与次生壳的形成有关。这些结果表明Pfmatrilin-1在合浦珠母贝生物矿化中发挥重要作用。
-
关键词:
- 合浦珠母贝 /
- Pfmatrilin-1 /
- 表达谱 /
- 基因克隆
Abstract:Matrilin-1 gene was cloned from the Pinctada fucata based on its transcriptome sequences and named as Pfmatrilin-1. The whole length of Pfmatrilin-1 was 2 036 bp, including a 1 194 bp ORF encoding 397 amino acids, in which there were a signal peptide and two VWA (von Willebrand factor A) motifs. Phylogeny analysis proves that the matrilins in vertebrates and invertebrates were of distant relationship. The qRT-PCR tissue expression analysis indicates that Pfmatrilin-1 was expressed in all the tested tissues with significantly high expression level in blood cells (P < 0.05).The Pf-matrilin-1 was also continuously expressed from trochophore to metamorphosis stages, reaching the peak at pediveliger stage (P < 0.05).The prodissoconchⅡformed during pediveliger stage, so the Pfmatrilin-1 may be involved in regulating the formation of prodissoconchⅡ. Thus, it is proved that the Pfmatrilin-1 plays an important role of biomineralization in P.fucata.
-
Keywords:
- Pinctada fucata /
- Pfmatrilin-1 /
- expression profile /
- gene cloning
-
大型海藻广泛分布于海岸线潮间带及潮间带以下的透光层,它们在不到海洋面积百分之一的情况下却提供着百分之十的初级生产力[1]。海藻自身具有食用、医用、工业和环境等方面的应用价值,而且还具有净化沿岸水质,吸收利用水体的氮(N)、磷(P)营养盐等功能,增殖海藻是延缓水体富营养化行之有效的措施之一[2-3],同时还具有为海洋生物提供栖息场所[4]等生态功能。秦传新等[5]研究了孔石莼(Ulva pretusa)和角叉菜(Pelvetia siliquosa)对硝酸氮(NO3--N)和P的吸收及组成,证实2种大型海藻对高浓度营养盐有较好的吸收作用;杨宇峰和费修绠[6]、YU和YANG[7]认为龙须菜(Gracilaria lemaneigormis)等大型海藻大规模增养殖是降低富营养化海区水质的有效手段;对海藻场内水流、水温[8]、溶解氧(DO)、pH[9]的分布变化具有缓冲作用。但是高密度的增养殖会产生大量海藻脱落物,其在重力的作用下沉积在海底,腐烂后发生分解。
由于大型海藻场海藻种类普遍单一化,而且其叶片会减缓水流的冲刷,势必会造成外侧的海藻脱落,较缓的水流和不断积累的海藻会通过机械沉降作用下沉入海底后形成泥沙底质,腐烂后的海藻会释放出N、P营养盐,不断吸收水体DO,造成二次污染[10]。2008年4月以来在黄海海域出现了浒苔(Enteromorpha proligera)、孔石莼爆发式增殖情况[11]。因此研究大型海藻脱落物对于海洋水质的影响有着重要的意义。目前国内外主要研究工作集中在大型海藻对沿岸海水净化效果与其最适生长环境方面[12-14],海藻脱落后对海藻场影响的报道较少,因此文章筛选了在广东海域广泛增殖的江蓠(G.confervoides)作为实验对象,通过人工模拟的方法,在实验室中模拟藻类植物沉积、腐烂过程,探讨不同质量海藻脱落物在不同季节对上覆水理化性质的影响,为确定大型海藻的增殖密度以及科学管理等提供参考依据。
1. 材料与方法
1.1 实验材料
实验在中国水产科学研究院南海水产研究所深圳试验基地进行,实验用底泥沉积物采自深圳大亚湾(114.66°E,22.76°N)。在天气情况相近的低潮时,在采样点选取3 m×3 m沉积物相对均匀底泥面,用高度30 cm、内径5 cm的有机玻璃管采集沉积物柱状样4个,供实验室培养用。在运输途中将采集好的底泥放入泡沫箱中,加入冰袋冰冻保存,运回实验室冷冻备用;实验用上覆水采自大亚湾(114.66°E,22.76°N),所采集的海水不做处理,实验期间海水盐度为29~30;实验海藻为广东沿海常见大型海藻江蓠,采自广东汕头南澳海域(116.94°E,23.41°N)。
1.2 实验装置
实验装置为高30 cm,内径5 cm的透明有机玻璃管。管盖有一个可控速的搅拌器插口。搅拌器扇距沉积物—水界面深度约5 cm,搅拌速度为60~80 r·min-1,以保证培养管内水体均匀混合且不会搅动沉积物。上面是可滤过海藻的出水口,用于收集上覆水(图 1)。
1.3 实验方法
大亚湾南澳海域年平均流速为0.24 m·s-1,将位于培养管管口搅拌器转速设置为模拟天然海域流速。模拟天然海藻的脱落物状态,添加天然海藻藻体,分为无海藻区(对照组)、3 g·m-2(低丰度组)、5 g·m-2(中丰度组)和10 g·m-2(高丰度组)。实验在光照培养箱中进行,保持24 h光照,并依照大亚湾常年季节特点,春秋季20 ℃、夏季28 ℃、冬季15 ℃平均水温设置光照培养箱温度。每个季节温度设置1个对照组,3个处理组。实验前将江蓠置于烘箱中80 ℃烘干,干湿质量比例为0.304:1,对照组中不加入烘干海藻,处理组中分别在低丰度组加入0.91 g,中丰度组加入1.52 g,高丰度组加入3.04 g烘干后江蓠,进入培养管进行实验,每组设置3个重复。共培养72 h,定时采集上覆水,采集之后加入等量海水补充。采集后的上覆水在真空抽滤机抽滤冷冻保存。
1.4 分析方法
用YSI参数测量仪测量水中溶氧并记录,分别用靛酚蓝法测定铵态氮(NH4+-N)、重氮-偶氮光度法测定亚硝态氮(NO2--N)、锌-镉还原法测定NO3--N、抗坏血酸还原钼蓝法测定活性磷(PO43--P),联合消化法测定上覆水中总氮(TN)、总磷(TP),参照《海洋监测规范》(GB12763.4—2007)。
1.5 统计分析
实验数据采用Origin 8.0绘图,并应用SPSS 17.0进行数据分析和方差分析,使用LSD多重比较,P<0.05为差异显著。
2. 结果
2.1 水温对DO的影响
不同温度环境对DO质量浓度的影响见图 2。不同温度下各组ρ(DO)差异显著,高温环境(28 ℃)ρ(DO)下降超过低温(15 ℃)环境。15 ℃环境各组中ρ(DO)在第36小时达到底值,中丰度组与高丰度组差异不显著(P>0.05),对照组与低丰度组差异显著(P<0.05)。20 ℃环境各组水体ρ(DO)在第24小时达到底值,而高丰度组ρ(DO)随时间变化逐渐下降至最低0.35 mg·L-1,对照组与低丰度组差异不显著(P>0.05),中丰度组与高丰度组差异不显著(P>0.05)。28 ℃环境除对照组ρ(DO)随时间改变不明显外,其余各组均在8 h后ρ(DO)急剧下降,低丰度组在第12小时降至最低(0.21 mg·L-1),低丰度组、中丰度组和高丰度组ρ(DO)随时间变化均无显著差异(P>0.05)。
2.2 水温对上覆水的影响
2.2.1 对N元素的影响
1) NH4+-N。不同温度环境对NH4+-N质量浓度的影响见图 3。不同温度条件下水体ρ(NH4+-N)显著不同,3个温度下水体ρ(NH4+-N)呈现出先上升后下降趋势,最终下降到与初始值持平或更小。各组中加入江蓠的质量对水体中ρ(NH4+-N)有显著影响(P<0.05)。低温条件(15 ℃)下水体ρ(NH4+-N)持续上升,并且出现峰值时间晚于高温条件(20 ℃和28 ℃)。15 ℃下对照组与低丰度组无显著差异(P>0.05),中丰度组与高丰度组无显著差异(P>0.05),水体ρ(NH4+-N)在12~24 h达到峰值;20 ℃下对照组与另外3组体质量均呈显著影响(P<0.05);28 ℃下对照组中ρ(NH4+-N)与另外3组差异显著(P<0.05)。
2) NO2--N、NO3--N。不同温度环境对NO2--N、NO3--N质量浓度的影响见图 4和图 5。NO2--N、NO3--N表现出较高一致性。水体温度对ρ(NO2--N)、ρ(NO3--N)有显著影响,且低温(15 ℃)ρ(NO2--N)、ρ(NO3--N)出现峰值时间晚于高温(28 ℃),处在峰值时,ρ(NO2--N)、ρ(NO3--N)和添加江蓠的质量呈正相关,高丰度组>中丰度组>低丰度组>对照组。15 ℃下NO2--N对照组与低丰度组无显著差异(P>0.05),中丰度组与高丰度组无显著差异(P>0.05)(图 4);20 ℃下对照组与低丰度组、中丰度组和高丰度组呈较高一致性(P>0.05);28 ℃下低丰度组与另外3组差异显著(P<0.05),对照组与另外3组差异显著(P<0.05),但中丰度组与高丰度组差异不显著(P>0.05)。
15 ℃下,ρ(NO3--N)高丰度组与其余3组差异显著(P<0.05),12~36 h出现峰值(图 5);20 ℃下低丰度组与另外3组差异显著(P<0.05),8~12 h浓度出现峰值;28 ℃下低丰度组与另外3组差异显著(P<0.05),8~12 h浓度出现峰值。
3) TN。不同温度环境对TN质量浓度的影响见图 6。TN释放早于无机氮,低温(15 ℃)时ρ(TN)在4~8 h达到峰值,此后开始逐渐下降,对照组与低丰度组无显著差异(P>0.05),中丰度组与高丰度组无显著差异(P>0.05);20 ℃时在2~4 h达到峰值,对照组与低丰度组无显著性差异(P>0.05),中丰度组与高丰度组无显著差异(P>0.05);28 ℃时对照组在第72小时ρ(TN)达到峰值,低丰度组、中丰度组和高丰度组在2~4 h达到峰值,其中对照组与其余3组差异显著(P<0.05)。
2.2.2 对P元素的影响
1) PO43--P。不同水温条件时水体PO43--P质量浓度变化见图 7。15 ℃、20 ℃和28 ℃下ρ(PO43--P)的变化趋势均为2~4 h出现峰值,显著早于N元素的释放。对照组中峰值出现较晚,后逐渐降低,在第8小时小浮动浓度升高,后逐渐下降至略高于起始值,3个温度环境下均与实验组差异显著(P<0.05)。低温下(15 ℃),中丰度组ρ(PO43--P)为10.61 mg·L-1,显著高于高温条件(28 ℃)下水体浓度,而且加入的江蓠质量与上覆水浓度呈正相关关系。
2) TP。不同水温条件时水体TP质量浓度变化见图 8。3个温度下的ρ(TP)在2~4 h达到峰值,显著高于TN达到峰值时间。对照组峰值出现稍晚于实验组,之后水体营养盐浓度快速下降,至第48小时浓度略有升高,最终至实验结束时浓度略高于起始值。ρ(TP)与加入的江蓠体质量呈正比。水温控制在15 ℃时对照组与各实验组呈显著差异(P<0.05);实验温度20 ℃时对照组晚于实验组出现峰值,之后水体营养盐浓度迅速下降,至第72小时浓度略高于第0小时。4组实验呈显著差异(P<0.05),且对照组与低丰度组无显著差异,低丰度组、中丰度组无显著差异,中丰度组、高丰度组无显著差异;水温控制在28 ℃时对照组在第24小时出现峰值,晚于各实验组,对照组与实验组呈显著差异(P<0.05)。
3. 讨论
大型海藻脱落死亡后,失去生物活性,经过机械沉降作用沉至海底,在微生物的作用下腐烂分解。水生植物的分解较为复杂,包括水生植物的水解、有机成分的酶解、矿质成分的分解、可溶性有机质的溶解、生物的降解和各类有机成分的酶解、微小颗粒的逸散等[15],腐烂后的藻类会对水体产生多方面的影响。沉积物中的有机质发生矿化后耗氧,厌氧代谢的中间产物NO2--N、NO3--N逐渐积累,协同矿化后产生的NH4+-N向水层扩散,P元素不断的积累,导致水体富营养化的发生,进而导致溶解氧的过度消耗,因此大型海藻脱落后对底质的影响得到了越来越多的重视。
3.1 海藻脱落物影响海藻增殖区及周边海域水质
自然状态下水中DO与大气中氧气存在着动态平衡,而江蓠腐烂导致平衡被打破,DO下降。孙连鹏等[16]指出,厌氧环境使污泥中的N、P等营养物质得到了较大程度释放。此实验表明,当ρ(DO)达到最低值,此时的ρ(NO2--N)、ρ(NO3--N)同时达到峰值,并且峰值时间等同于ρ(NH4+-N)达到峰值时间。周劲风等[17]指出,NH4+-N经过硝化和亚硝化等的矿化作用转变为不能直接被海藻吸收的NO2--N和NO3--N,此过程消耗氧气,NO2--N属于中间产物极不稳定,反硝化细菌活跃将他们转化为氮(N2)等气体。而NH4+-N持续上升,是因为底泥中的有机氮分解需要浮游动植物的参与,NH4+-N同时是沉积物需氧量的重要贡献者[18],当水体DO降低,矿化速率减缓,沉积物中的氮以NH4+-N形式溶出[19]。综上所述江蓠腐烂后最直接产物NH4+-N有3支可能的出路:1)进入到水界面直接被藻类吸收;2)发生硝化转变为NO3--N,之后取决于氧气的参与可能发生反硝化,生成N2不会被大多数水生植物所利用;3)进入沉积物铵态氮库中。
在DO降低时,此时的TN、TP也处在较低水平。林旭丹等[20]指出,DO影响着水体环境中不同微生物的呼吸作用,当DO浓度高时,好氧微生物如亚硝化细菌和硝化细菌活跃,浓度低时,厌氧微生物如反硝化细菌活跃。实验显示当DO充足时,江蓠腐烂释放出的有机氮迅速转化为无机氮,ρ(TN)在2~4 h达到峰值,之后快速下降,最终至实验结束时略高于起始值,浓度与加入的江蓠质量呈正相关关系,印证了实验结论。
3.2 不同季节海藻脱落物对水质影响有所不同
通过实验模拟各个季度上覆水营养盐改变,在冬季时ρ(NH4+-N)显著低于夏季,而P元素浓度在冬季显著高于夏季。张亚克等[21]认为夏季蓝绿藻种群占优,与水体NH4+-N变化显著相关,而在冬季时水体硅藻种群增加,与水体P元素增加具有一定相关性。冬季时随着水体悬浮颗粒沉淀,N、P元素浓度较高[22],气温较低限制了藻类的生长,而到次年春季时气温回升,水体中N、P资源丰富,在自然光照下,为机会主义藻类爆发做了准备,爆发式增长的藻类进一步吸收水体中DO,导致局部水域环境恶化。
海藻丰度对无机氮的影响也表现出差异。冬季(15 ℃)和春秋季(20 ℃)时,ρ(NO2--N)、ρ(NO3--N)最大值均随江蓠丰度的增加而增大,夏季(28 ℃)则相反。高温时,主要限制为DO。随江蓠丰度的增加,DO较长时间保持在极低值。故28 ℃时ρ(NO2--N)、ρ(NO3--N)最大值随江蓠丰度的增加而减小。15 ℃和20 ℃时DO下降较慢,所以变化相反。赵志梅[23]指出溶解氧和温度主要是通过改变硝化-反硝化细菌的活性从而影响硝酸盐的通量,论证了实验结论。
TN与PO43--P均在2~4 h营养盐浓度达到峰值,冬季P元素浓度普遍高于夏季。相关研究证实,P元素的释放早于N元素释放[24-28],因为P元素存在于植物体内的生物活性物质内,这些物质更容易分解。植物体内的ATP、核酸等可直接水解为磷酸,无需经过复杂的矿化作用[29],所需时间较短。而PO43--P为藻类的限制因子,夏季时大型海藻场脱落后的藻类会在短时间内释放出PO43--P,可造成甲藻、蓝藻快速生长,而蓝藻通过改变水体pH,而引发底泥沉积物中大量的磷释放,反过来又会促使藻类爆发式生长,竞争水体DO,导致局部水域富营养化加重,从而造成反馈式破坏。而在冬季时气温较低,限制富营养化的爆发,脱落后的藻类逐渐腐烂,营养盐沉积入底泥,在次年春季底泥中营养盐再次扩散入上覆水中又将会刺激藻类的爆发式增长。
3.3 合理设置海藻增殖密度,是良好水质和底质环境指标的保障
综上所述,大型海藻场的沉积物是许多溶解性物质和颗粒性物质的来源,上覆水与沉积物间的营养盐交换活动,直接影响着海藻场的营造。虽然大型海藻场的营造是好的,但是如果海藻密度过高致使海藻脱落,在重力的作用下下沉到海底,会使上覆水TP、TN增加,沉水植物体内的N、P元素70%以上会在较短时间内被释放进入水体,参与水体营养的再生和循环[30],沉积物中的无机物释放至上覆水后会造成水体富营养化,可能招致某些机会主义海藻爆发。如2008年6月~7月,胶州湾浒苔的爆发,导致海藻场不仅没有达到增殖的目的,反而破坏了海藻场海域水质[31]。因此合理地控制海藻密度,并且根据不同海藻季节变化和生活习性,交替进行吊养或放养江蓠、龙须菜、条斑紫菜(P.yezoensis)等经济价值高环境价值高的品种,吸收水体营养盐,既可以满足经济利益,又具有环保价值[6]。
-
图 1 合浦珠母贝Pfmatrilin-1基因cDNA序列及其编码的氨基酸序列
图中加粗字体为起始密码子和终止密码子,阴影部分表示信号肽,下划线和方框分别表示2个VWA结构域,双下划线表示N糖基化位点,斜体部分表示poly(A)尾巴。
Figure 1. Full-length cDNA and protein sequence of Pfmatrilin-1 gene of the P.fucata
The initiation codon and stop codon are in bold.The shadow is the deduced signal peptide.Underlines and boxes indicate two Von Willebrand factor type A (VWA) domains.The glycosylation sites are double-underlined. The poly A signal sequence are italicized.
图 2 Pfmatrilin-1与其他物种matrilin-1氨基酸序列比对
多重序列比较采用GenBank上的序列登录号,长牡蛎EKC38360.1;小家鼠AAH47140.1;人NP_002370.1;非洲爪蟾NP_001079801.1;斑马鱼NP_001093210.1;“*”表示同源性;“:”或者“.”表示相似性。
Figure 2. Multiple sequence alignment of amino acid sequence of Pfmatrilin-1 with matrilin-1 from other organisms
Crassostrea gigas EKC38360.1;Mus musculus AAH47140.1;Homo sapiens NP_002370.1;Xenopus laevis NP_001079801.1; Danio rerio NP_001093210.1;identical and similar sites are shown with sparks (*) and dots (:or.), respectively.
图 4 合浦珠母贝Pfmatrilin-1 mRNA在不同组织中的表达
垂直线表示平均值±标准差(n=3),不同字母表示差异显著(P < 0.05),后图同此。
Figure 4. Relative expression level of Pfmatrilin-1 mRNA in different tissues of P.fucata
Vertical bars are represented as X ±SD (n=3). Significant different letters above vertical bars indicate significant difference (P<0.05). The same case in the following figure.
表 1 实验中所用引物
Table 1 Primers used in this study
引物名称
primer name引物序列(5′→3′)
primer sequence用途
applicationmatrilin-1-F GCTTCGTGTCCTCTTTGGTC cDNA克隆 matrilin-1-R AGTGGTTTCTGCATCGGTTG cDNA克隆 matrilin-1-3′-GSP1 GGTATTTGCGAACAACAGTGTGGGTG 3′RACE matrilin-1-3′-GSP2 CAACAGTGTGGGTGTCAGAAGCGG 3′RACE matrilin-1-5′-GSP1 ATAGGCTGATCCGCTTCTGACACCC 5′RACE matrilin-1-5′-GSP2 ATCCGCTTCTGACACCCACACTG 5′RACE UPM CATGGCTACATGCTGACAGCCTA RACE UPM-short CGCGGATCCACAGCCTACTGATGATCAGTCGATG RACE matrilin-1-qF1 GGCTCTCGCTGCTGATTAT qRT-PCR matrilin-1-qR1 CCGTCGTGTGAAGAATAGT qRT-PCR 18S-f GAGAAACGGCTACCACATCC qRT-PCR 18S-r CACCAGACTTGCCCTCCAA qRT-PCR 表 2 进化树构建所用物种
Table 2 Species used in phylogenetic tree
物种名
species氨基酸序列名称
amino acid name登录号
Accession No.(NCBI)合浦珠母贝Pinctada fucata matrilin-1 KU553226 长牡蛎Crassostrea gigas matrilin-1 EKC38360.1 犬弓蛔虫Toxocara canis matrilin-1 KHN84166.1 斑马贻贝Dreissena polymorpha matrilin-like AM503947 光滑双绮螺Biomphalaria glabrata matrilin AAN61407.1 非洲爪蟾Xenopus laevis matrilin-1 NP_001079801.1 斑马鱼Danio rerio matrilin-1 NP_001093210.1 绿头鸭Anas platyrhynchos matrilin-1 EOB04374.1 眼睛王蛇Ophiophagus hannah matrilin-1 ETE70549.1 原鸡Gallus gallus matrilin-1 NP_001025546.2 小家鼠Mus musculus matrilin-1 AAH47140.1 非洲爪蟾Xenopus laevis matrilin-1 NP_001079801.1 褐家鼠Rattus norvegicus matrilin-1 EDL80602.1 牛Bos taurus matrilin-1 NP_001137338.1 大黄鱼Larimichthys crocea matrilin-1 KKF25140.1 绿海龟Chelonia mydas matrilin-1 EMP29967.1 人Homo sapiens matrilin-1 NP_002370.1 -
[1] ZHANG Y, WANG Z K, LUO J M, et al.Multiple functions of the von Willebrand Factor A domain in matrilins:secretion, assembly, and proteolysis[J].J Orthop Surg Res, 2008, 3(1):21. doi: 10.1186/1749-799X-3-21
[2] PAULSSON M, KLATT A R, KOBBE B, et al. The matrilins:a novel family of extracellular adaptor proteins[M]//HASCALL V C, KUETTNER K E.The many faces of osteoarthritis. Basel:Birkhäuser, 2002:151-158.
[3] LUO J M, WANG Y C, YUAN X, et al. Matrilins family and cartilage diseases[J].Precision Med, 2016, 2:e1233. http://www.smartscitech.com/index.php/pm/article/view/1233
[4] FRESQUET M, JOWITT T A, STEPHEN L A, et al. Structural and functional investigations of Matrilin-1 A-domains reveal insights into their role in cartilage ECM assembly[J].J Biol Chem, 2010, 285(44):34048-34061. doi: 10.1074/jbc.M110.154443
[5] PAULSSON M, HEINEGÅRD D. Matrix proteins bound to associatively prepared proteoglycans from bovine cartilage[J].Biochem J, 1979, 183(3):539-545. doi: 10.1042/bj1830539
[6] WIBERG C, KLATT A R, WAGENER R, et al.Complexes of matrilin-1 and biglycan or decorin connect collagen Ⅵ microfibrils to both collagen Ⅱ and aggrecan[J].J Biol Chem, 2003, 278(39):37698-37704. doi: 10.1074/jbc.M304638200
[7] FORADORI M J, CHEN Q, FERNANDEZ C A, et al.Matrilin-1 is an inhibitor of neovascularization[J].J Biol Chem, 2014, 289(20):14301-14309. doi: 10.1074/jbc.M113.529982
[8] NEACSU C D, KO Y P, TAGARIELLO A, et al.Matrilin-1 is essential for zebrafish development by facilitating collagen Ⅱ secretion[J].J Biol Chem, 2014, 289(3):1505-1518. doi: 10.1074/jbc.M113.529933
[9] JENKINS R N, OSBORNE-LAWRENCE S L, SINCLAIR A K, et al.Structure and chromosomal location of the human gene encoding cartilage matrix protein[J].J Biol Chem, 1990, 265(32):19624-19631. http://www.jbc.org/content/265/32/19624.abstract
[10] KO Y P, KOBBE B, PAULSSON M, et al.Zebrafish (Danio rerio) matrilins:shared and divergent characteristics with their mammalian counterparts[J].Biochem J, 2005, 386(Pt 2):367-379. http://www.jimmunol.org/content/169/4/1936.full
[11] PEDERSEN M E, TAKLE H, YTTEBORG E, et al.Matrilin-1 expression is increased in the vertebral column of Atlantic salmon (Salmo salar L.) individuals displaying spinal fusions[J].Fish Physiol Biochem, 2011, 37(4):821-831. doi: 10.1007/s10695-011-9480-5
[12] 李鑫. Matrilin-1在小鼠胫骨闭合骨折模型愈合过程中的作用研究[D]. 长春: 吉林大学, 2011: 4-7. http://cdmd.cnki.com.cn/article/cdmd-10183-1011098784.htm [13] MONTANARO L, PARISINI P, GREGGI T, et al.Evidence of a linkage between matrilin-1 gene (MATN1) and idiopathic scoliosis[J].Scoliosis, 2006, 1(1):21. doi: 10.1186/1748-7161-1-21
[14] ZHANG H, ZHAO S, ZHAO Z, et al.The association of rs1149048 polymorphism in matrilin-1(MATN1) gene with adolescent idiopathic scoliosis susceptibility:a meta-analysis[J].Mol Biol Rep, 2014, 41(4):2543-2549. doi: 10.1007/s11033-014-3112-y
[15] BAE J W, CHO C H, MIN W K, et al.Associations between matrilin-1 gene polymorphisms and adolescent idiopathic scoliosis curve patterns in a Korean population[J].Mol Biol Rep, 2012, 39(5):5561-5567. doi: 10.1007/s11033-011-1360-7
[16] 刘晓敏, 陈银河, 申才良.Matrilin-1基因rs1149048单核苷酸多态性与青少年特发性脊柱侧凸易感性的Meta分析[J].安徽医药, 2015, 19(10):1933-1936. doi: 10.3969/j.issn.1009-6469.2015.10.026 [17] ZHANG G, FANG X, GUO X, et al.The oyster genome reveals stress adaptation and complexity of shell formation[J].Nature, 2012, 490(7418):49-54. doi: 10.1038/nature11413
[18] BOUCHUT A, ROGER E, COUSTAU C, et al.Compatibility in the Biomphalaria glabrata/Echinostoma caproni model:potential involvement of adhesion genes[J].Int J Parasitol, 2006, 36(2):175-184. doi: 10.1016/j.ijpara.2005.09.009
[19] XU W, FAISAL M.Matrilin-like molecules produced by circulating hemocytes of the zebra mussel (Dreissena polymorpha) upon stimulation[J].Dev Comp Immunol, 2007, 31(12):1205-1210. doi: 10.1016/j.dci.2007.04.005
[20] 龙敏明, 黄桂菊, 邹记兴, 等.育珠对合浦珠母贝N19和Prismalin-14基因表达水平的影响[J].南方水产科学, 2013, 9(5):58-63. http://www.schinafish.cn/CN/abstract/abstract9072.shtml [21] 刘晓军, 李家乐.养殖珍珠贝贝壳基质蛋白研究进展[J].上海海洋大学学报, 2013, 22(2):200-205. http://www.cqvip.com/QK/90212A/201302/45096785.html [22] 王小玉, 喻达辉, 黄桂菊, 等.合浦珠母贝3个家系的AFLP标记分离与遗传多样性研究[J].南方水产, 2007, 3(5):54-60. http://www.cqvip.com/QK/60642A/200705/27484869.html [23] 毕晓敏, 黄桂菊, 范嗣刚, 等.合浦珠母贝矿化基因Pearlin重组蛋白的表达条件优化[J].南方水产科学, 2015, 11(6):100-106. http://www.schinafish.cn/CN/abstract/abstract9277.shtml [24] MARIN F, LUQUET G, MARIE B, et al.Molluscan shell proteins:primary structure, origin, and evolution[J].Curr Top Dev Biol, 2008, 80(3):209-276. https://www.researchgate.net/profile/Benjamin_Marie2/publication/...
[25] 罗会. 合浦珠母贝经济性状的遗传分析[D]. 上海: 上海海洋大学, 2013: 1-52. http://cdmd.cnki.com.cn/Article/CDMD-10264-1014013530.htm [26] 王琦, 何毛贤.合浦珠母贝实时定量PCR内参基因的稳定性比较[J].南方水产科学, 2013, 9(6):33-40. http://www.schinafish.cn/CN/abstract/abstract9081.shtml [27] LIVAK K J, SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J].Methods, 2001, 25(4):402-408. doi: 10.1006/meth.2001.1262
[28] ZHANG Y, CHEN Q.Changes of matrilin forms during endochondral ossification. Molecular basis of oligomeric assembly[J].J Biol Chem, 2000, 275(42):32628-32634. doi: 10.1074/jbc.M002594200
[29] KLATT A R, PAULSSON M, WAGENER R.Expression of matrilins during maturation of mouse skeletal tissues[J].Matrix Biol, 2002, 21(3):289-296. doi: 10.1016/S0945-053X(02)00006-9
[30] HUANG X, BIRK D E, GOETINCK P F.Mice lacking matrilin-1 (cartilage matrix protein) have alterations in type Ⅱ collagen fibrillogenesis and fibril organization[J].Dev Dyn, 1999, 216(4/5):434-441. doi: 10.1002/(ISSN)1097-0177
[31] 张岑. 合浦珠母贝贝壳形成相关蛋白及基因的研究[D]. 北京: 清华大学, 2006: 61-75. http://cdmd.cnki.com.cn/Article/CDMD-10003-2007070663.htm [32] 闫芳. 马氏珠母贝珍珠层形成相关基因的克隆与功能研究[D]. 湛江: 广东海洋大学, 2014: 9-28. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=swjj201603009&dbname=CJFD&dbcode=CJFQ [33] 薛桂英, 郭奕惠, 黄桂菊, 等.合浦珠母贝不同壳基质蛋白基因的表达水平比较[J].广东农业科学, 2013, 40(17):140-142, 145. doi: 10.3969/j.issn.1004-874X.2013.17.043 -
期刊类型引用(7)
1. 胡晓娟,赵秀,杨宇峰,曹煜成. 大型海藻龙须菜(Gracilaria lemaneiformis)藻段凋落分解对环境的影响及细菌群落演替特征. 海洋学报. 2023(08): 130-142 .  百度学术
百度学术
2. 张秀梅,纪棋严,胡成业,徐焕志,王一航,杨晓龙,郭浩宇. 海洋牧场生态系统稳定性及其对干扰的响应——研究现状、问题及建议. 水产学报. 2023(11): 107-121 .  百度学术
百度学术
3. 戴晓娟,胡韧,罗洪添,王庆,胡晓娟,白敏冬,杨宇峰. 大型海藻龙须菜凋落物分解对水质的影响. 热带海洋学报. 2021(01): 91-98 .  百度学术
百度学术
4. 章守宇,刘书荣,周曦杰,汪振华,王凯. 大型海藻生境的生态功能及其在海洋牧场应用中的探讨. 水产学报. 2019(09): 2004-2014 .  百度学术
百度学术
5. 徐姗楠,王爽,张喆,李纯厚. TG-MS联用分析海藻和稻壳的协同耦合热解机制. 太阳能学报. 2018(06): 1696-1703 .  百度学术
百度学术
6. 于杰,戴晓玲,章增林,张紫英,陈日钊,黄国强,苏琼,李文红. 细基江蓠和真江蓠野生种群生长海域水质营养盐特征及富营养化评价. 南方农业学报. 2017(08): 1511-1517 .  百度学术
百度学术
7. 王云祥,秦传新,陈丕茂,袁华荣,佟飞,冯雪,黎小国. 深圳海域造礁石珊瑚分布特点与多样性. 海洋渔业. 2017(02): 131-139 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载:










 粤公网安备 44010502001741号
粤公网安备 44010502001741号
