An exploratory fishing survey of light falling-net fisheries in the central and southern South China Sea in autumn
-
摘要:
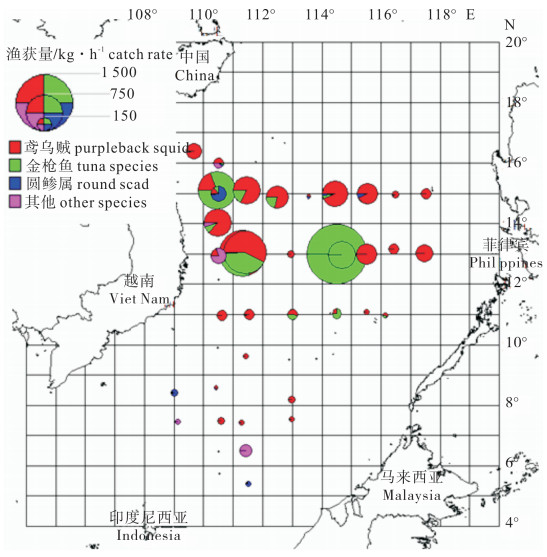
文章根据2012年9月~10月灯光罩网探捕调查的数据,分析了秋季南海中南部海域罩网的渔场分布和主要渔获组成。根据相对重要性指数(IRI),鸢乌贼(Sthenoteuthis oualaniensis)和鲣(Katsuwonus pelamis)是优势种渔获,鲔(Euthynnus affinis)、扁舵鲣(Auxis thazard)和圆舵鲣(A.rochei)是重要种渔获,细鳞圆鲹(Decapterus macarellus)和长体圆鲹(D.macrosoma)等是常见种渔获。鸢乌贼、金枪鱼类和圆鲹属是居前3位的渔获类群,分别占总渔获量的48.35%、48.33%和0.98%,其中小型金枪鱼类占比47.77%;渔获率区域差异明显,西中沙海域411.47 kg · h-1,南沙海域25.66 kg · h-1,中心渔场位于12°30′N~15°30′N、110°30′E~115°00′E海域。结果表明,秋季依然是南海外海深水区灯光罩网主要的作业渔汛期,除了鸢乌贼和大型金枪鱼类以外,还需要加强外海小型金枪鱼类和圆鲹属鱼类的调查研究。
Abstract:Based on the survey data from September to October in 2012, we analyzed the fishing ground and catch composition of large-scale light falling-net fishery in the central and southern South China Sea in autumn. According to the index of relative importance (IRI), Sthenoteuthis oualaniensis and Katsuwonus pelamis were the dominant species; Euthynnus affinis, Auxis thazard and A.rochei were the major species; Decapterus macarellus and D.macrosoma and so on were the common species. Generally, S.oualaniensis, tuna species and round scad were the main species which accounted for 48.35%, 48.33% and 0.98% of the total catches, respectively, and small tunas occupied 47.77% of the total. The catch rate varied significantly among different fishing grounds, which was 411.47 kg · h-1 in Xisha and Zhongsha waters but only 25.66 kg · h-1 in Nansha waters. The central fishing ground was located in waters of 12°30′N~15°30′N, 110°30′E~115°00′E. The results indicate that autumn is a very good fishing season for light falling-net in offshore waters. Besides, S.oualaniensis and larger tuna species, small tuna species and round scad should be further studied.
-
雌雄同体是鱼类较常见的一种繁殖策略,性逆转现象在热带及亚热带的海水鱼类中普遍存在,如马鲅科、鮨科、雀鲷科、隆头鱼科、鲷科及大多数珊瑚礁鱼类等23个科,已发现约500种鱼类存在自然性逆转现象[1-5]。性腺先分化为精巢,待其成熟后通过性逆转过程而转变成卵巢的称为雄性先熟雌雄同体,如黑鲷 (Acanthopagrus schlegeli)[6]、黄鳍鲷 (Sparus latus)[7]等;反之,由卵巢转变成精巢的称为雌性先熟雌雄同体,如石斑鱼 (Epinephelus sp.)[8]、黄牙鲷 (Dentex tumifrons)[9]、黄鳝 (Homopterous albums)[10]等。
四指马鲅 (Eleutheronema tetradactylum) 隶属于鲻形目、马鲅亚目、马鲅科、四指马鲅属,俗称马友、午鱼等[11],广泛分布于热带和温带海区,在澳大利亚、印度、东南亚及中国沿海均有分布[11-14],具有生长快速、营养价值高等特点,现已成为我国的优良水产养殖新品种[15-16]。目前,关于四指马鲅的研究主要集中在种群结构[13]、遗传多样性[17]、发育生物学[18-21]、养殖生物学[22-26]等方面,有关繁殖生物学的研究鲜有报道。马鲅科鱼类中大多数种类为雄性先熟雌雄同体,少数为雌雄异体[3]。早期研究表明,四指马鲅在澳大利亚水域为雄性先熟雌雄同体,但在印度和新加坡水域则是雌雄异体,似乎在不同水域其繁殖策略有明显差异[3,27]。近年来,有详细的组织学证据表明印度沿海的四指马鲅群体同样存在雌雄同体现象,为雄性先熟雌雄同体,与澳大利亚沿海的群体一致[3]。目前,国内关于四指马鲅野生或养殖群体性逆转现象的报道极少,因此,本文从组织学、细胞学方面对人工养殖四指马鲅性逆转现象进行了初步研究,以期了解其性逆转过程中性腺发育变化特征,丰富其繁殖策略的研究资料。
1. 材料与方法
1.1 实验材料
实验用的7月龄四指马鲅采自中国水产科学研究院南海水产研究所在台山市的封闭式工厂化循环水养殖水箱。养殖盐度为10.8~13.0,水温为28.0~30.7 ℃,每日上、下午各投喂1次配合饲料。2019年1月27日采集样本228尾,平均体质量为 (192.69±74.65) g,平均全长为 (26.40±3.15) cm。
1.2 实验方法
用数显游标卡尺 (精度为0.01 mm) 测量样本的全长、体长、体高、尾柄长、尾柄高,测量时鱼体置于水平面上;体质量使用电子天平 (精度为0.01 g) 称量,测量前用吸水纸将鱼体表面的水分吸干。用Excel 2010软件进行统计分析,所有统计值以“平均值±标准差(
$\overline X \pm {\rm{SD}} $ )”表示。测量后立即解剖,观察性腺的形态特点,将性腺取出,分别剪取前、中、后各一小段置于4 %多聚甲醛通用型组织固定液 (BL539A) 中固定24 h后,转至70 %乙醇中保存。将固定的样品进行50%~100%梯度乙醇脱水,二甲苯透明,石蜡包埋,以3~5 μm的厚度分别做横切和纵切,苏木精-伊红 (Hematoxylin-eosin,H-E) 染色,中性树脂封片,在ZEISS型显光学微镜下观察并采集图像分析确定性别。将四指马鲅的雌雄同体性腺切片筛选出来用Tunel法进行细胞凋亡检测,具体过程参照Tunel试剂盒(Roche-11684817910)说明书的实验步骤进行操作,用正置荧光显微镜 (NIKON ECLIPSE C1) 进行观察并采集图像分析。2. 结果
2.1 各形态性状和性别比例统计
7月龄四指马鲅各形态性状和性别比例见表1。四指马鲅在该阶段存在雄性、雌性和雌雄同体 (性逆转时期) 3种类型的个体。在收集的228尾样本中,雄性195尾,占85.53%,具有显著优势;雌性13尾,占5.70%;雌雄同体20尾,占8.77%。测量了该时期3种个体的体质量、全长、体长、体高、尾柄长、尾柄高等形态性状数据并进行统计分析,发现其在形态性状上差异不明显,在外形上无法分辨。将雌雄同体四指马鲅的体质量与全长、体长、体高分别进行相关性分析和曲线拟合,体质量与全长的相关方程为y=0.656 8x2-12.431x+56.718 (R2=0.916 4,图1-a);体质量与体长的相关方程为y=0.014 7x3.075 5(R2=0.869 8,图1-b);体质量与体高的相关方程为y=2.005 4x2.602 9(R2=0.833 3,图1-c)。
表 1 四指马鲅各形态性状和性别比例统计Table 1. Morphometric traits and sex ratio of E. tetradactylumn=228 性别
Sex体质量
Body mass/g全长
Total length/cm体长
Body length/cm体高
Body height/cm样本量
Sample size/尾比例
Percentage/%雄性 (♂)
Male192.69±74.65 26.40±3.15 21.16±2.51 5.64±0.82 195 85.53 雌性 (♀)
Female191.34±79.00 26.54±3.80 21.38±2.93 5.46±0.68 13 5.70 雌雄同体 (♀/♂)
Hermaphrodite193.71±68.76 26.30±2.37 21.32±1.77 5.81±0.85 20 8.77 2.2 性腺的解剖学和组织学特征
7月龄四指马鲅发现有3种个体,即雄性、雌性和雌雄同体,对应的性腺为精巢、卵巢和雌雄同体性腺。
精巢扁平带状,呈灰白色 (图2-A),横切面中间宽两端窄,呈梭形,内部精小叶呈辐射型分布 (图2-a)。早期的卵巢为短棒状,呈橘黄色,表面血管明显 (图2-B),横切面呈圆形或椭圆形,卵巢壁较厚,内部为产卵板,由卵巢壁向内部突起,呈指状 (图2-b)。
![]() 图 2 四指马鲅性腺的解剖结构和组织结构A. 精巢解剖结构;a. 精巢横切面;B. 卵巢;b. 卵巢横切面;C, D. 雌雄同体性腺解剖结构;c, d. 雌雄同体性腺横切面;O. 卵巢;Oc. 卵巢腔;T. 精巢Figure 2. Anatomical and histological structures of gonad in E. tetradactylumA. Anatomical structure of testes; a. Cross section of testes; B. Anatomical structure of ovary; b. Cross section of ovary; C, D. Anatomical structure of transitional gonad; c, d. Cross section of transitional gonad; O. Ovary; Oc. Ovarian cavity; T. Testes
图 2 四指马鲅性腺的解剖结构和组织结构A. 精巢解剖结构;a. 精巢横切面;B. 卵巢;b. 卵巢横切面;C, D. 雌雄同体性腺解剖结构;c, d. 雌雄同体性腺横切面;O. 卵巢;Oc. 卵巢腔;T. 精巢Figure 2. Anatomical and histological structures of gonad in E. tetradactylumA. Anatomical structure of testes; a. Cross section of testes; B. Anatomical structure of ovary; b. Cross section of ovary; C, D. Anatomical structure of transitional gonad; c, d. Cross section of transitional gonad; O. Ovary; Oc. Ovarian cavity; T. Testes雌雄同体性腺有2种类型。第一种性腺呈肉质厚带状或棒状,性腺的两支从头到尾均为雌雄同体,两支大小无明显区别,外表观察可分辨出两背内侧为精巢,呈白色,两腹外侧为卵巢,呈浅黄偏红色 (图2-C),该性腺横切面为长椭圆形,两内侧为精巢,被膜较薄,两外侧为卵巢,被膜较厚,精巢和卵巢间有类似精小叶间质的结缔组织隔开,卵巢部分卵巢腔明显,产卵板指状分布,尚未充满卵巢腔 (图2-c);第二种性腺呈肉质厚带状,一般为乳白色,有卵巢部分为浅黄色;两支性腺其中一支的前端为雌雄同体,中部及后端为精巢,另一支则全为精巢,雌雄同体的一支较为均匀粗大 (图2-D)。精巢一支的横切面为长梭形,雌雄同体一支的横切面为长椭圆形,精卵巢分布与第一种不同,卵巢部分从外侧某一处向内凹陷,中间有狭长的卵巢腔,产卵板指状由外侧向内突起,卵巢部分被膜较厚,卵巢两端为精巢组织,被膜较薄 (图2-d)。
2.3 性逆转过程的组织学变化
根据雌雄同体性腺发育的形态学和组织学特征,可将四指马鲅性逆转过程分为早期、中期和晚期3个阶段。
2.3.1 早期
性逆转早期的性腺解剖学上呈灰白色,扁平带状,与典型的雄性精巢无异。组织学观察显示,该阶段的性腺切面呈长梭形,有一空大的卵巢腔形成,具卵巢腔一侧的被膜较厚,与典型的卵巢壁类似,而精巢一侧则与典型精巢一样 (图3-a);此时卵巢腔中产卵板尚未完全形成,仅一端有呈短指状的结缔组织沿性腺内壁向内突起,呈波浪状分布,在靠近卵巢腔一侧有卵原细胞零散分布,卵原细胞呈圆形,细胞核较大,中位,嗜碱性较强,被染成紫色,而细胞质不着色 (图3-b);与精巢侧交界处有一到两层卵原细胞,精巢与卵巢的界限为一小层结缔组织,与精小叶间质类似,且界限不明显 (图3-c);精巢部分与典型的原始性精巢一样,精小叶中存在精子发生过程中的各级生精细胞,精小叶腔中已有较多的成熟精子形成,部分精小叶中精子已排空 (图3-d)。
![]() 图 3 四指马鲅性逆转过程的组织学观察a. 性逆转早期,示性腺横切面;b. a的局部放大,示卵巢腔、产卵板和卵原细胞;c. a的局部放大,示精巢部分;d. c的局部放大,示精小叶;e. 性逆转中期,示性腺横切面;f. e的局部放大,示卵巢;g. e的局部放大,示精小叶和小叶间质;h. g的局部放大,示精子;i. 示性逆转晚期,示性腺横切面;j. i的局部放大,示性腺边缘的精小叶;Bv. 血管;Ct. 结缔组织;O. 卵巢;Oc. 卵巢腔;Oo. 卵原细胞;P2. 第Ⅱ时相卵母细胞;Sb. 产卵板;Sp. 精子;T. 精巢Figure 3. Histological observation of sex reversal in E. tetradactyluma. Prophase of sex reversal, showing the gonadal cross section; b. Partial magnification of a, showing the spawning board, oviposition plate and oogonia; c. Partial magnification of a, showing the testis; d. Partial magnification of c, showing the seminiferous lobules; e. Metaphase of sex reversal, showing the gonadal cross section; f. Partial magnification of e, showing theovary; g. Partial magnification of e, showing the seminiferous lobules and intralobular interstitium; h. Partial magnification of e, showing the sperm; i. Telophase of sex reversal, showing the gonadal cross section; j. Partial magnification of I, showing the seminiferous lobules at the margin of the gonads; Bv. Blood vessel; Ct. Connective tissue; O. Ovary; Oc. Ovarian cavity; Oo. Oogonia; P2. Oocyte at Phase II; Sb. Spawning board; Sp. Sperm; T. Testis
图 3 四指马鲅性逆转过程的组织学观察a. 性逆转早期,示性腺横切面;b. a的局部放大,示卵巢腔、产卵板和卵原细胞;c. a的局部放大,示精巢部分;d. c的局部放大,示精小叶;e. 性逆转中期,示性腺横切面;f. e的局部放大,示卵巢;g. e的局部放大,示精小叶和小叶间质;h. g的局部放大,示精子;i. 示性逆转晚期,示性腺横切面;j. i的局部放大,示性腺边缘的精小叶;Bv. 血管;Ct. 结缔组织;O. 卵巢;Oc. 卵巢腔;Oo. 卵原细胞;P2. 第Ⅱ时相卵母细胞;Sb. 产卵板;Sp. 精子;T. 精巢Figure 3. Histological observation of sex reversal in E. tetradactyluma. Prophase of sex reversal, showing the gonadal cross section; b. Partial magnification of a, showing the spawning board, oviposition plate and oogonia; c. Partial magnification of a, showing the testis; d. Partial magnification of c, showing the seminiferous lobules; e. Metaphase of sex reversal, showing the gonadal cross section; f. Partial magnification of e, showing theovary; g. Partial magnification of e, showing the seminiferous lobules and intralobular interstitium; h. Partial magnification of e, showing the sperm; i. Telophase of sex reversal, showing the gonadal cross section; j. Partial magnification of I, showing the seminiferous lobules at the margin of the gonads; Bv. Blood vessel; Ct. Connective tissue; O. Ovary; Oc. Ovarian cavity; Oo. Oogonia; P2. Oocyte at Phase II; Sb. Spawning board; Sp. Sperm; T. Testis2.3.2 中期
随着发育进行,性腺呈厚带状或棒状,外观上可分辨出两背内侧呈乳白色,为精巢部分,两腹外侧呈肉红色为卵巢部分。组织学观察显示,性腺的横切面呈椭圆形,性腺外层被膜部分明显增厚,精巢和卵巢的分界结缔组织增厚而变得界限分明,有较多的血管分布,卵巢侧向精巢侧挤压发育而增大,产卵板完全形成,呈分叉的指状,占据2/3的卵巢腔 (图3-e),大部分卵原细胞发育成第Ⅱ时相的卵母细胞,分布在产卵板内部,嗜碱性增强,细胞质被染成深紫色,与典型的Ⅱ期卵巢的组织学特征一致 (图3-f);精巢部分的精小叶间的结缔组织明显增厚,呈紫红色,精小叶腔中成熟精子密度减小 (图3-g),精小叶边缘的精母细胞退化,结构不清晰,界限模糊,连成块状,嗜碱性增强,被染成蓝紫色 (图3-h)。
2.3.3 晚期
性逆转晚期的性腺多为棒状,呈橘黄色,与典型的雌性卵巢外观特征类似。组织切片观察显示,性腺的横切面呈卵圆形,基本转变为卵巢组织,产卵板发达,充满卵巢腔,卵母细胞大部分处于Ⅱ时相阶段,与Ⅱ期卵巢的组织学特征类似 (图3-i);在性腺一侧的边缘有一小层精小叶结构,小叶内精子退化,内部仅有少数的强嗜碱性小颗粒分布 (图3-j)。
2.4 性逆转过程中的细胞凋亡
四指马鲅性逆转早期,精巢侧主要在外侧边缘及内部的精小叶检测到凋亡细胞,可见较强的凋亡信号,且密度较大 (图4-a);在卵巢侧,凋亡细胞主要出现在卵巢壁及向卵巢腔突起的部分结缔组织中,卵巢壁的凋亡信号较强,结缔组织的凋亡信号较弱 (图4-b)。四指马鲅性逆转中期,精巢侧的凋亡细胞主要出现在内部精小叶,信号较早期时减弱,密度减小 (图4-c);卵巢侧主要在卵巢壁和产卵板边缘检测到有少数凋亡细胞,凋亡信号减弱 (图4-d);四指马鲅性逆转晚期,仅在性腺的一侧边缘少部分精巢残迹处检测到较多的凋亡细胞,凋亡信号较强 (图4-e);而在卵巢壁部分未检测到凋亡细胞,内部的产卵板部分仅有极少数的凋亡细胞,且其凋亡信号微弱,几乎很难观察到 (图4-f)。
![]() 图 4 四指马鲅性逆转过程中的细胞凋亡 (绿色荧光)a. 性逆转早期,示精巢侧;b. 性逆转早期,示卵巢侧;c. 性逆转中期,示精巢侧;d. 性逆转中期,示卵巢侧;e. 性逆转晚期,示精巢侧;f. 性逆转晚期,示卵巢侧Figure 4. Apoptosis during sex reversal in E. tetradactylum (Green fluorescence)a. Prophase of sex reversal, showing the testis side; b. Prophase of sex reversal, showing the ovary side; c. Metaphase of sex reversal, showing the testis side; d. Metaphase of sex reversal, showing the ovary side; e. Telophase of sex reversal, showing the testis side; f. Telophase of sex reversal, showing the ovary side
图 4 四指马鲅性逆转过程中的细胞凋亡 (绿色荧光)a. 性逆转早期,示精巢侧;b. 性逆转早期,示卵巢侧;c. 性逆转中期,示精巢侧;d. 性逆转中期,示卵巢侧;e. 性逆转晚期,示精巢侧;f. 性逆转晚期,示卵巢侧Figure 4. Apoptosis during sex reversal in E. tetradactylum (Green fluorescence)a. Prophase of sex reversal, showing the testis side; b. Prophase of sex reversal, showing the ovary side; c. Metaphase of sex reversal, showing the testis side; d. Metaphase of sex reversal, showing the ovary side; e. Telophase of sex reversal, showing the testis side; f. Telophase of sex reversal, showing the ovary side3. 讨论
3.1 四指马鲅性逆转的特点
本研究显示,在水温为28.0~30.7 ℃的循环水养殖的7月龄四指马鲅群体中,经过性腺的形态学和组织学鉴定,该群体同时存在雄性、雌性及雌雄同体3种个体,从外形上不能将其区别开来;经统计发现其性别比例明显偏向于雄性,且占绝对优势;此外,平时在养殖早期的小样本检测中几乎均为雄性个体,这符合顺序性雌雄同体鱼类的一般特征[28]。Chopelet等[28]认为鱼类的雌雄同体和偏性别比例会导致其有效种群大小降低而提高遗传结构。Shihab等[3]对印度沿海四指马鲅野生种群的研究结果显示,雄性个体平均全长约24.0 cm,平均体质量约300 g,雌性个体平均全长约38.0 cm,平均体质量约806 g,雌雄同体的平均全长约32.0 cm,平均体质量约400 g,介于前两者之间,与澳大利亚沿海种群的研究结果类似,其性逆转符合临界年龄-大小阈值理论[5]。而本研究中,3种类型的四指马鲅个体在体质量、全长、体长、体高等形态性状上并无明显差异,基于较高且稳定的养殖水温,推测本研究中观察到的四指马鲅性逆转现象可能是由于高温诱导使其提前发生性逆转,但需要进一步研究验证。另外,本研究观察到有5.70%的雌性个体,可能是在早期性别分化时直接形成,也有可能是后期通过性逆转由雄性转变而来,目前尚未明确其形成方式。
本研究结果表明,四指马鲅雌雄同体性腺有2种类型,大部分为两背内侧呈乳白色,为精巢组织,两腹外侧呈浅黄偏红色,为卵巢组织,这与Frisch[4]对野生四指马鲅种群雌雄同体的研究结果一致;而个别为两支性腺,其中一支全为精巢组织,另一支在前端有一小部分为卵巢组织,中部和后端为精巢组织,这与Frisch[4]报道的结论不同。雌雄同体的性腺中,精巢侧的组织特征与Ⅳ或Ⅴ期的原始性精巢一样,已有成熟的精子形成,达到性成熟状态;而卵巢侧的组织结构与Ⅰ期或Ⅱ期的原始性卵巢一致,主要为卵原细胞和Ⅱ时相早期卵母细胞,产卵板正在发育或已形成。性逆转过程的组织变化特征表现为精巢组织逐渐退化直至消失,卵巢组织逐渐形成并发育至Ⅱ期卵巢;在整个性逆转过程中,在精巢侧组织和卵巢侧的产卵板和结缔组织中均检测到凋亡细胞信号,且精巢侧的凋亡细胞密度较大,凋亡信号较强,而卵巢侧的凋亡细胞密度很小,凋亡信号微弱,这再次证明四指马鲅性逆转过程是精巢退化卵巢增长的过程。本研究结果表明,四指马鲅为雄性先熟雌雄同体,与Shihab等[3]的研究结果一致。
3.2 环境因子对四指马鲅性逆转的影响
野外调查和相关实验表明,社会和行为因素通常会触发该种鱼类从一种性别向另一种性别转变,例如将性别比例占绝对优势的雄鱼或雌鱼从该雌雄同体的鱼类中去除后,将会引发剩余个体合理地发生相应的性别转变[5]。此外,大量研究表明,环境中的温度和激素水平也较易影响鱼类的性别比例并诱导性别转变的发生[29-30]。例如,性成熟的剑尾鱼 (Xiphophorus helleri) 在最适生存温度 (25 ℃) 时,性逆转率为零,在12 ℃时性逆转率最高,35 ℃次之,表明剑尾鱼的性逆转对温度具有较大的依赖性[29]。本研究中,人工养殖四指马鲅从15日龄开始在28.0~30.7 ℃水温较为稳定的环境中生长,在7月龄时出现性逆转现象,此时体质量约 (193.71±68.76) g,体长约 (21.32±1.77) cm。但国外调查报告显示,在澳大利亚沿海的野生种群中,所有的1龄个体几乎为雄性,4龄及以后的个体几乎为雌性,性逆转在2龄或3龄的个体中出现,平均全长约40.19 cm;在印度沿海的野生种群中,性逆转个体的平均全长为32.0 cm,平均体质量约400 g[3]。这表明在不同环境条件下生长的四指马鲅群体,其性逆转发生时的年龄和体型存在差异。本研究中的养殖四指马鲅在较小的年龄和体型时便出现了性逆转现象,并不遵循顺序性雌雄同体性逆转的临界年龄-大小阈值理论,这可能与环境条件有关。因此,关于四指马鲅的性逆转发生规律及其调控机制等仍需更深入的研究。
-
表 1 调查期间渔船作业概况
Table 1 General information of survey
晚次
No.站位
station日期
date作业地点position 水深/m
depth开灯时间
light-on time关灯时间
light-off time作业网次
fishing times渔获量/kg
catch渔获率/kg·h-1
catch rateLat.(N) Long.(E) 1 W2 0904 16°00′ 110°30′ 920 0134 0342 1 190.90 69.84 2 W3 0904 15°00′ 110°31′ 766 1920 2144 1 299.49 124.79 3 W4 0905 15°05′ 111°28′ 1 263 1910 0537 8 3 723.59 356.32 4 W5 0906 14°52′ 112°30′ 2 433 1900 0520 9 2 676.82 259.05 5 W6 0907 14°54′ 113°34′ 3 672 1940 2330 2 272.94 17.24 6 W7 0908 15°00′ 114°27′ 4 289 1856 0501 11 2 998.96 297.42 7 W8 0909 15°00′ 115°32′ 4 115 1850 2358 4 929.51 181.07 8 W9 0910 14°57′ 116°30′ 2 900 1848 2129 1 84.31 31.42 9 W10 0911 14°59′ 117°31′ 2 626 1844 2103 1 159.65 68.91 10 W18 0912 13°01′ 117°28′ 3 985 1832 0349 6 1 331.67 143.45 11 W17 0914 13°10′ 116°25′ 4 287 2240 0207 2 203.45 58.97 12 W16 0915 13°00′ 115°30′ 4 405 1850 0020 4 1 039.43 188.99 13 W15 0916 12°59′ 114°31′ 4 408 1900 0547 8 14 944.77 1 385.91 14 W15 0917 12°57′ 114°41′ 4 385 1855 0147 4 2 550.36 371.41 15 W14 0918 12°59′ 112°58′ 3 934 1901 2342 2 141.37 30.19 16 W13 0919 13°03′ 111°24′ 2 473 1903 0548 9 8 171.67 760.16 17 W13 0920 13°01′ 111°19′ 2 353 1857 0544 10 9 035.47 837.91 18 W12 0921 12°56′ 110°30′ 2 619 1858 2059 1 260.06 128.96 19 W19 0922 12°08′ 110°31′ 2 501 0340 0537 1 11.61 5.95 20 S1 0922 10°58′ 110°38′ 1 748 1857 2117 1 112.63 48.27 21 S2 0923 11°00′ 111°33′ 3 783 1855 2116 1 117.35 49.94 22 S3 0924 11°00′ 113°01′ 4 224 1854 2115 1 163.94 69.76 23 S4 0925 11°01′ 114°31′ 703 1852 2119 1 173.08 70.65 24 S5 0926 11°05′ 115°31′ 2 746 1845 2105 1 29.25 12.54 25 S6 0927 10°59′ 116°08′ 1 228 0222 0437 1 37.32 16.58 26 S11 1001 9°31′ 113°50′ 2 245 0228 0502 1 5.73 2.23 27 S10 1001 9°30′ 112°55′ 1 520 1852 2136 1 23.08 8.44 28 S9 1002 9°37′ 111°26′ 2 620 1855 2110 1 24.05 10.69 29 S7 1003 9°54′ 110°29′ 2 690 1851 2119 1 12.83 5.20 30 S8 1004 9°33′ 110°28′ 2 805 0221 0514 1 3.82 1.33 31 S13 1004 8°35′ 110°26′ 1 422 1947 2140 1 45.63 24.23 32 S12 1005 8°24′ 109°02′ 196 1857 2055 1 67.71 34.43 33 S15 1006 7°28′ 109°08′ 226 1844 2017 1 28.60 18.45 34 S16 1007 7°29′ 110°36′ 1 750 1845 2059 1 68.65 30.74 35 S17 1008 7°26′ 111°17′ 1 908 0227 0524 1 31.57 10.70 36 S20 1008 6°29′ 111°27′ 1 785 1850 2134 1 275.17 100.67 37 S19 1009 6°28′ 110°31′ 1 350 1848 2048 1 8.13 4.07 38 S22 1010 5°43′ 110°33′ 512 0257 0528 1 8.05 3.20 39 S23 1010 5°25′ 111°30′ 160 1850 2210 1 49.84 14.95 40 S21 1011 6°31′ 112°56′ 1 337 2202 0017 1 1.02 0.46 41 S18 1012 7°32′ 112°59′ 1 817 1849 2045 1 38.88 20.11 42 S14 1013 8°11′ 112°59′ 1 833 0235 0513 1 83.46 31.69 43 W11 1015 14°02′ 110°29′ 1 861 1843 0524 8 3 629.93 339.78 44 W3 1016 15°05′ 110°27′ 740 1855 0249 5 4 872.00 616.71 45 W1 1017 16°24′ 109°41′ 818 1839 0305 5 1 085.89 128.76 表 2 主要渔获种类的质量、数量、出现频率和相对重要性指数
Table 2 Catch composition and IRI of main species
种类
species质量/kg
weight数量/尾
quantity质量百分比/%
ratio of weight数量百分比/%
ratio of quantity出现频率/%
frequency of occurrence相对重要性
IRI鸢乌贼Symplectoteuthis oualaniensis 29 022 278 848 48.35 77.43 97.78 12 299.04 鲣Katsuwonus pelamis 19 415 21 987 32.34 6.11 35.56 1367.13 圆舵鲣Auxis rochei 4 187 21 025 6.98 5.84 15.56 199.33 鲔Euthynnus affinis 2 806 8 937 4.68 2.48 42.22 302.19 扁舵鲣A.thazard 1 928 7 770 3.21 2.16 37.78 202.87 黄鳍金枪鱼Thunnus albacaes 528 224 0.88 0.06 42.22 39.74 日本乌鲂Brama japonica 430 1 816 0.72 0.50 33.33 40.69 鲯鳅Coryphaena hippurus 301 1 130 0.50 0.31 24.44 19.92 细鳞圆鲹[18]Decapterus macarellus 298 2 157 0.50 0.60 48.89 53.60 大青鲨Prionace glauca 250 1 0.42 0 2.22 0.93 长体圆鲹[18]D.macrosoma 227 8 581 0.38 2.38 15.56 42.95 大眼金枪鱼T.obesus 145 2 0.24 0.00 4.44 1.08 花斑原海豚Stenella frontalis 115 2 0.19 0.00 2.22 0.43 刺鲅Acanthocybium solandi 62 19 0.10 0.01 26.67 2.88 红尾圆鲹[18]D.akaadsi 61 505 0.10 0.14 2.22 0.54 矛尾翻车鲀Masturus lanceolatus 55 1 0.09 0 2.22 0.20 表 3 主要渔获类群的鱼种、体长和体质量组成
Table 3 Body-length and weight composition of three dominant species
类群group 种类species 抽样数量/尾number of samples 体长body length 体质量body weight 范围/mmrange 均值/mmmean 标准差/mmS.D. 范围/grange 均值/gmean 标准差/gS.D. 鸢乌贼purpleback squid 中型种群S.oualaniensis(medium form) 1 663 79~266 129 22.4 17~957 111 79.5 微型种群S.oualaniensis(dwarf form) 158 56~126 90 14.5 6~68 27 13.7 金枪鱼类tuna species 鲣K.pelamis 171 185~480 343 75.3 94~2 240 883 470.3 圆舵鲣A.rochei 54 79~258 235 29.2 4~278 199 45.1 鲔E.affinis 154 143~500 248 57.9 36~2 510 314 339.7 扁舵鲣A. thazard 168 142~387 239 44.4 32~1 240 248 174.7 黄鳍金枪鱼(幼) T. albacaes (juvenile) 115 55~ 467 307 108.3 3~2 000 800 660.1 黄鳍金枪鱼(成) T. albacaes(adult) 5 1 130~1 310 1 228 68.0 30 000~45 000 38 200 5 630.3 大眼金枪鱼(成) T.obesus(adult) 2 1 502~1 550 1 526 33.9 60 000~85 000 72 500 17 677.7 圆鲹属round scad 细鳞圆鲹D.macarellus 121 45~275 209 45.6 3~287 138 74.0 长体圆鲹D.macrosoma 47 42~192 124 31.9 2~83 26 15.6 红尾圆鲹 D.akaadsi 51 178~212 198 8.4 74~210 121 23.0 锯缘圆鲹[18] D.tabl 3 176~187 180 5.9 71~89 79 9.3 表 4 渔获量和渔获率的分区统计
Table 4 Catch rates and catches of different fishing waters
区域
waters项目
item鸢乌贼
purpleback squid金枪鱼类
tuna species圆鲹属
round scad其他
other species总计
total西中沙海域Xisha and Zhongsha 出现晚次occurrence number 22 20 20 21 22 晚次渔获率/kg·h-1 catch rate per day 0.39~584.23 0~1 384.38 0~90.78 0~102.83 5.95~13 85.91 总渔获率/kg·h-1 total catch rate 198.50 202.12 3.36 7.48 411.47 晚次渔获量/kg catch per day 2.27~6 300.00 0~14 928.00 0-217.86 0~321.47 11.61~14 944.77 总渔获量/kg total catch 28 276.99 28 791.68 479.04 1 066.12 58 613.83 南沙海域Nansha 出现晚次occurrence number 22 14 9 23 23 晚次渔获率/kg·h-1 catch rate per day 0~48.21 0~52.16 0~31.15 0.01~100.45 0.46~100.67 总渔获率/kg·h-1 total catch rate 13.57 3.95 1.96 6.17 25.66 晚次渔获量/kg catch per day 0~112.50 0~127.79 0~61.25 0-274.55 1.02~275.17 总渔获量/kg total catch 745.44 217.24 107.85 339.27 1409.79 -
[1] 杨吝, 卢伙胜, 吴壮, 等. 南海区海洋渔具渔法[M]. 广州: 广东科技出版社, 2002: 164-168. https://www.southchinafish.ac.cn/info/1036/5301.htm [2] 张鹏, 杨吝, 张旭丰, 等. 南海金枪鱼和鸢乌贼资源开发现状及前景[J]. 南方水产, 2010, 6 (1): 68-74. doi: 10.3969/j.issn.1673-2227.2010.01.012 [3] 晏磊, 张鹏, 杨吝, 等. 2011年春季南海中南部海域灯光罩网渔业渔获组成的初步分析[J]. 南方水产科学, 2014, 10 (3): 97-102. doi: 10.3969/j.issn.2095-0780.2014.03.015 [4] 杨吝, 张旭丰, 谭永光, 等. 南海北部灯光罩网渔获组成及其对渔业资源的影响[J]. 南方水产, 2009, 5(4): 41-46. doi: 10.3969/j.issn.1673-2227.2009.04.008 [5] 张鹏, 曾晓光, 杨吝, 等. 南海区大型灯光罩网渔场渔期和渔获组成分析[J]. 南方水产科学, 2013, 9 (3): 74-79. doi: 10.3969/j.issn.2095-0780.2013.03.012 [6] 邹建伟, 陈立峰, 林蒋进, 等. 南海外海灯光罩网主要渔场分布及变动研究——基于广西渔船的生产监测统计[J]. 南方水产科学, 2014, 10 (4): 78-84. doi: 10.3969/j.issn.2095-0780.2014.04.013 [7] 颜云榕, 冯波, 卢伙胜. 中、西沙海域2种灯光作业渔船的捕捞特性及其技术效率分析[J]. 南方水产, 2009, 5(6): 59-64. doi: 10.3969/j.issn.1673-2227.2009.06.011 [8] 冯波, 许永雄, 卢伙胜. 南沙北部灯光罩网与金枪鱼延绳钓联合探捕[J]. 广东海洋大学学报, 2012, 32(4): 54-58. https://xueshu.baidu.com/usercenter/paper/show?paperid=42230c90c74c793caed758cd81c178fc [9] 晏磊, 张鹏, 杨吝, 等. 南海灯光罩网沉降性能研究[J]. 上海海洋大学学报, 2014, 23(1): 146-153. http://shhydxxb.ijournals.cn/shhy/article/abstract/20130800819 [10] 杨权, 李永振, 张鹏, 等. 基于灯光罩网法的南海鸢乌贼声学评估技术研究[J]. 水产学报, 2013, 37(7): 1032-1039. http://qikan.cqvip.com/Qikan/Article/Detail?id=46670930 [11] 张俊, 陈国宝, 张鹏, 等. 基于渔业声学和灯光罩网的南海中南部鸢乌贼资源评估[J]. 中国水产科学, 2014, 21 (4): 822-831. http://www.fishscichina.com/zgsckx/article/abstract/5517?st=article_issue [12] 张俊, 陈作志, 陈国宝, 等. 南海鸢乌贼水声学测量和评估相关技术研究[J]. 南方水产科学, 2014, 10 (6): 1-11. doi: 10.3969/j.issn.2095-0780.2014.06.001 [13] CHEN G B, ZHANG J, YU J, et al. Hydroacoustic scattering characteristics and biomass assessment of the purpleback flying squid[Sthenoteuthis oualaniensis, (Lesson, 1830)] from the deepwater area of the South China Sea[J]. J Appl Ichthyol, 2013, 29(6): 1447-1452. doi: 10.1111/jai.12360
[14] 颜云榕, 冯波, 卢伙胜, 等. 南沙群岛北部海域鸢乌贼(Sthenoteuthis oualaniensis)夏季渔业生物学研究[J]. 海洋与湖沼, 2012, 32(6): 1177-1185. https://d.wanfangdata.com.cn/periodical/hyyhz201206021 [15] 国家海洋局. GB/T 12763.6—2007海洋调查规范[S]. 北京: 中国标准出版社, 2007: 56-157. https://www.doc88.com/p-778380121612.html [16] 农牧渔业部水产局, 农牧渔业部东海区渔业指挥部. 南海区渔业资源调查和区划[M]. 广州: 广东科技出版社, 1989: 190-197. https://xueshu.baidu.com/usercenter/paper/show?paperid=2ff8306a8381c06d86beb53f01099f39 [17] PINKAS L, OLIPHANT M S, IVERSON I L K. Food habits of albacore, bluefin tuna, and bonito in California waters[J]. Calif Dept Fish Game Fish Bull, 1971, 152: 1-105. https://escholarship.org/uc/item/7t5868rd
[18] 孙典荣, 陈铮. 南海鱼类检索上册[M]. 北京: 海洋出版社, 2013: 491-494. https://baike.baidu.com/item/%E5%8D%97%E6%B5%B7%E9%B1%BC%E7%B1%BB%E6%A3%80%E7%B4%A2/16484769 [19] 刘必林. 利用耳石微结构研究印度洋西北海域莺乌贼的年龄和生长[D]. 上海: 上海水产大学, 2006: 13. https://www.doc88.com/p-3999078058671.html [20] ZUYEV G, NIGMATULLIN C, CHESALIN M, et al. Main results of long-term worldwide studies on tropical nektonic oceanic squid genus Sthenoteuthis: an overiew of Soviet investigation[J]. Bul Mar Sci, 2002, 71(2): 1019-1060. https://www.ingentaconnect.com/content/umrsmas/bullmar/2002/00000071/00000002/art00030
[21] 许柳雄, 王学昉, 朱国平, 等. 中西太平洋金枪鱼围网鲣鱼起水鱼群种群结构分析[J]. 海洋湖沼通报, 2010, (2): 22-28. doi: 10.3969/j.issn.1003-6482.2010.02.005 [22] 戴小杰, 许柳雄. 世界金枪鱼渔业渔获物物种原色图鉴[M]. 北京: 海洋出版社, 2007: 1-101. https://xueshu.baidu.com/usercenter/paper/show?paperid=8f676eb842099121b399f292fb6d4d1d [23] 成庆泰, 郑葆珊. 中国鱼类系统检索[M]. 北京: 科学出版社, 1987: 421-423. https://mmcs.cast.org.cn/kxjfc/kxjfc/cwx/zylzml1665/art/2023/art_46257a8c3e27463e92e833465620aa4a.html [24] 国家水产总局南海水产研究所等. 南海诸岛海域鱼类志[M]. 北京: 科学出版社, 1979: 479-485. https://baike.baidu.com/item/%E5%8D%97%E6%B5%B7%E8%AF%B8%E5%B2%9B%E6%B5%B7%E5%9F%9F%E9%B1%BC%E7%B1%BB%E5%BF%97/59112557 [25] MOORE J E, WALLACE B P, LEWISON R L, et al. A review of marine mammal, sea turtle and seabird bycatch in USA fisheries and the role of policy in shaping management[J]. Mar Pol, 2009, 33(3): 435-451. doi: 10.1016/j.marpol.2008.09.003
[26] GASPARI S, SCHEININ A, HOLCER D, et al. Drivers of population structure of the bottlenose dolphin (Tursiops truncatus) in the eastern Mediterranean Sea[J]. Evolution Biol, 2015, 42(2): 177-190. doi: 10.1007/s11692-015-9309-8
[27] 牛富强, 许肖梅, 杨燕明, 等. 圈养瓶鼻海豚对20 kHz连续声信号的行为响应研究[J]. 声学学报, 2012(6): 595-600. doi: 10.15949/j.cnki.0371-0025.2012.06.005 [28] PENNINO M G, ROTTA A, PIERCE G J, et al. Interaction between bottlenose dolphin (Tursiops truncatus) and trammel nets in the Archipelago de La Maddalena, Italy[J]. Hydrobiologia, 2015, 747(1): 69-82. doi: 10.1007/s10750-014-2127-7
[29] 厉瑛, 陶红, 张黎明, 等. 海蛇咬伤的救护进展[J]. 解放军护理杂志, 2003, 20 (11): 55-56. doi: 10.3969/j.issn.1008-9993.2003.11.025 [30] 厉瑛, 张黎明, 桂莉, 等. 抗海蛇毒血清用于海蛇咬伤早期急救与监护的实验研究[J]. 蛇志, 2006, 18 (1): 15-18. doi: 10.3969/j.issn.1001-5639.2006.01.004 -
期刊类型引用(6)
1. 王子涵,曾聪,姜子禺,曹玲. 东海及其邻近海域受胁鱼类保护空缺分析. 热带海洋学报. 2023(01): 66-86 .  百度学术
百度学术
2. 王新月,陈生熬,王程欣,訾方泽,常德胜,许豪,李大鹏. 叶尔羌高原鳅耳石形态探究及群体判别分析. 渔业科学进展. 2023(04): 201-211 .  百度学术
百度学术
3. 谢玉,玄文丹,周永东,朱凯,朱文斌,王忠明,徐开达,王嘉浩. 东海海域带鱼矢耳石形态特征与生长研究. 浙江海洋大学学报(自然科学版). 2023(04): 294-302 .  百度学术
百度学术
4. 潘梦珍,王海山,叶乐,陈治,杨超杰. 崖州湾附近海域金线鱼形态学指标的相关性. 海南热带海洋学院学报. 2020(02): 11-17 .  百度学术
百度学术
5. 蔡研聪,黄梓荣,李佳俊,许友伟,孙铭帅,陈作志,刘维达. 南海北部近海新记录种——苏门答腊金线鱼资源分布特征. 南方水产科学. 2020(06): 1-11 .  本站查看
本站查看
6. 杨超杰,唐婷婷,吴东霞,杜良玉,方馨正. 崖州湾附近海域金线鱼繁殖生物学研究. 海南热带海洋学院学报. 2019(05): 6-11 .  百度学术
百度学术
其他类型引用(5)




 下载:
下载:




 粤公网安备 44010502001741号
粤公网安备 44010502001741号
