Determination of tetrodotoxin in Nassarius by ultra high performance liquid chromatography-tandem mass spectrometry with multi-walled carbon nanotubes purification
-
摘要: 建立了多壁碳纳米管(MWCNTs)固相萃取-超高效液相色谱串联质谱法(UPLC-MS/MS)测定织纹螺中河豚毒素(TTX)的方法,样品用1%乙酸甲醇溶液提取,调节pH至8.5~9.0后,采用碳纳米管净化处理后上机测定。以乙腈和0.1%甲酸水溶液为流动相,经Amide柱梯度洗脱,以电喷雾离子源正离子模式,多反应监测(MRM)测定,外标法定量。在0.3~50 ng·mL–1质量浓度范围内,相关系数(R)大于0.999,加标回收率为83.7%~91.4%,相对标准偏差为2.3%~8.6%,检测限和定量限分别为0.3 μg·kg–1和1 μg·kg–1。该方法适用于织纹螺中TTX的检测。
-
关键词:
- 河豚毒素 /
- 织纹螺 /
- 多壁碳纳米管 /
- 液相色谱-质谱联用检测法 /
- 固相萃取
Abstract: A sensitive and reliable method for determination of tetrodotoxin (TTX) in Nassarius was established using ultra high performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). The sample was extracted by 1% acetic acid-methanol solution, then the pH value was adjusted to 8.5−9.0. After purification with multi-walled carbon nanotubes (MWCNTs), the sample was subjected to an analytical procedure. The mobile phase containing acetonitrile and 0.1% formic acid solution with a linear gradient elution was utilized to separate TTX on an Amide column. The quantitative analysis was carried out with an external standard method in the multiple reaction monitoring mode using positive electrospray ionization. The calibration curve for TTX was linear (R>0.999) from 0.3 ng·mL–1 to 50 ng·mL–1. The recoveries were 83.7%−91.4% with the RSDs of 2.3%−8.6%. The limits of detection and quantification were 0.3 μg·kg–1 and 1 μg·kg–1, respectively. This method is suitable for determination of TTX in Nassarius.-
Keywords:
- tetrodotoxin /
- Nassarius /
- multi-walled carbon nanotubes /
- LC-MS/MS /
- solid phase extraction
-
河豚毒素(TTX)为氨基全氢喹唑啉化合物,是一种典型的非蛋白类神经毒素,能造成神经麻痹,严重患者会因为中枢神经麻痹导致呼吸停止而死亡[1-2]。TTX的毒性是氰化物的1 250多倍[3],最初在河鲀体内发现,后陆续发现产TTX的细菌[4-5],在织纹螺(Nassarius)等多种动物体内也检出TTX[6-8]。织纹螺为腐食性生物,可通过食物链富集TTX,近年来,在中国台湾[9]、福建[10]、江苏[11]等沿海地区发生多起因食用织纹螺引起的中毒事件,导致多人死亡,引起了相关部门的高度关注,通过从织纹螺体内分离出产TTX菌株确认TTX为其主要毒素[12]。由于织纹螺中常含有较高浓度的TTX,中毒后没有特效解毒剂,因此需要建立织纹螺中TTX的检测方法,对螺类生物的TTX含量进行监控,减少食物中毒事件的发生。
TTX生物检测存在一定的局限性,其检测结果不稳定,重复性较差。免疫检测法主要有酶联免疫吸附法(ELISA)[13]和免疫层析法(ICA)[14]2种,在食品和农产品残留检测中较为常用[15]。目前液相色谱-质谱联用检测法(LC-MS/MS)是检测的热点[16-17],其灵敏度和准确性都要优于其他方法,但其对检测样品的纯化要求高。样品本底基质复杂,如果样品净化不理想,在上机检测过程易受基质干扰,会出现灵敏度低和回收率低等问题。严忠雍等[18]和Guo等[19]都采用免疫亲和柱对样品进行净化,显著降低了基质效应,后用LC-MS/MS检测,前者的定量限为0.3 μg·kg–1,回收率达到88.7%~102.3%;后者的定量限为1 μg·kg–1,回收率为75.8%~107%。虽然免疫亲和柱特异性强,作为前处理净化方法效果良好,但是价格昂贵,检测成本高[20]。
传统的TTX样品前处理方法较少,且净化效果一般,存在基质干扰严重和假阳性等问题,会对检测结果造成影响。功能性纳米材料能够弥补该不足,其高效、经济的优点让其成为食品检测领域的热点,并已经取得一定研究进展。碳纳米管具有特殊物理结构和化学性质,其表面积大,吸附力强,性质稳定,在检测领域有广泛前景[21]。Taghizadeh等[22]利用纳米管复合材料萃取鱼类、沉积物、土壤和水样中的重金属离子,对3种重金属离子的检测限分别达到了0.09 ng·mL–1、0.72 ng·mL–1和1.0 ng·mL–1,该方法适用于样品中微量重金属离子的萃取;Wang等[23]利用多壁碳纳米管(multi-walled carbon nanotubes,MWCNTs)萃取水样和牛奶样品中的多溴联苯醚,用气相色谱进行分析,检测限为3.6~8.6 ng·L–1,回收率为90%~119%,多壁碳纳米管对多溴联苯醚的吸附效率高;陈啟荣等[24]以乙腈提取茶叶样品中的26种农药成分,用多壁碳纳米管进行净化和富集,用气相色谱进行分析,采用外标法定量,检出限为0.005~0.05 mg·kg–1,定量限为0.015~0.15 mg·kg–1,回收率为66.6%~125.5%,与其他用于检测分析茶叶中残留农药的方法相比,该方法简单方便且回收率和准确性较高。同时,市面上还有多个有关多壁碳纳米管对样品进行检测分析的专利,通过多壁碳纳米管进行吸附,经过洗脱、浓缩,对组分进行定量分析;廖且根等[25]建立了多壁碳纳米管检测水样中的微囊藻毒素含量方法;陈黎等[26]建立了多壁碳纳米管检测烟草中残留农药的方法。这些专利方法均利用多壁碳纳米管材料吸附能力强的特点,且具有用量少、检测成本低等优点。
本研究建立了碳纳米管固相萃取-超高效液相色谱串联质谱法测定织纹螺中河豚毒素的方法,样品经过碳纳米管富集与净化后,经LC-MS/MS测定,用外标法定量。本方法前处理过程简单,结果灵敏度高、准确性好,适用于织纹螺中TTX的残留检测。
1. 材料与方法
1.1 主要仪器与装置
Acquity UPLC I-Class/Xevo TQS超高效液相色谱仪串联三重四级杆质谱仪(美国Waters公司);5810型台式离心机(德国Eppendorf公司);MS3旋涡混合器(德国IKA公司);Milli Q去离子水发生器(美国Millipore公司);N-EVAP氮吹仪(美国Organomation公司);PHS-25 pH计(上海仪电科学仪器股份有限公司)。
1.2 主要材料与试剂
实验材料为氨水(分析纯,广州化学试剂厂)、乙腈、甲醇(均为色谱纯或分析纯,美国Sigma公司),TTX标准品纯度≥99.0% (美国Sigma公司),羧基化碳纳米管CNT303 50 μm (北京德科岛科技有限公司),羟基化碳纳米管CNT203 10~30 μm (北京德科岛科技有限公司),河豚毒素免疫亲和柱3 mL(江苏美正生物科技有限公司)。织纹螺采自广东湛江。
试剂配制:1%乙酸,1%乙酸甲醇,0.1%氨水,0.1%甲酸-乙腈(1∶1,V/V )。流动相为0.1%甲酸水;TTX标准贮备溶液(100 μg·mL–1)为取TTX冻干标准品1.00 mg,加入0.1%甲酸-乙腈(1∶1,V/V )定容至10 mL,于4 ℃保存;碳纳米管洗脱液为0.1%乙酸-乙腈(8∶2,V/V );标准工作液为取TTX标准储备液,用0.1%甲酸-乙腈(1∶1,V/V )逐级稀释成质量浓度分别为0.5 ng·mL–1、1 ng·mL–1、5 ng·mL–1、10 ng·mL–1和50 ng·mL–1的梯度标准工作液。
1.3 实验条件
1.3.1 色谱条件
色谱柱为Waters ACQUITY UPLC BEH Amide柱(100 mm×2.1 mm,1.7 μm);柱温40 ℃;进样量为5 μL;流速为0.3 mL·min–1;流动相为乙腈(A)和0.1%甲酸水(B)。梯度洗脱条件见表1。
表 1 梯度洗脱条件Table 1. Gradient elution conditiont/min 流动相A/%
mobile phase A流动相B/%
mobile phase B0 95 5 1.0 40 60 3.0 40 60 3.2 95 5 5.0 95 5 1.3.2 质谱条件
电喷雾离子源,正离子扫描;检测方式为多反应监测( MRM );毛细管电压为3.0 kV;离子源温度150 ℃;脱溶剂气温度400 ℃;锥孔气流量为150 L·h–1;脱溶剂气流量为900 L·h–1;TTX的MRM离子对见表2。
表 2 TTX的多反应监测条件Table 2. Conditions of multiple reaction monitoring for tetrodotoxin分析物
analyte母离子/(m/z)
parent ion子离子/(m/z)
daughter ion锥孔电压/V
cone voltage碰撞能量/eV
collision energyTTX 320.1 161.9 35 35 302.0* 35 20 注:*. 定量离子 Note: *. quantitative ion 1.4 样品处理
1.4.1 提取
用自来水清洗织纹螺2~3遍,洗去表面泥沙。用钳子夹碎织纹螺外壳,取织纹螺全部组织充分均质备用。取织纹螺肉匀浆样品2.00 g于50 mL离心管中,加入5 mL 1%乙酸甲醇溶液,在60 ℃水浴中超声15 min,待其冷却至室温,在6 000 r·min–1下离心5 min,转移上清液,在残渣中加入5 mL 1%乙酸甲醇,重复提取1次,合并上清液。取5 mL上清液,在样液中逐滴加入氨水并充分搅拌,调节pH至8.5,过碳纳米管小柱净化。
1.4.2 碳纳米管净化
取250 mg羧基化多壁碳纳米管,湿法装填于空的6 mL小柱中,依次加入5 mL 0.1%乙酸-乙腈(8∶2,V/V )、5 mL 0.1%氨水活化和平衡小柱,挤干柱中残留液体,将5 mL提取液全部上样,挤干柱中液体后用5 mL甲醇、5 mL纯水依次淋洗,挤干小柱,用3 mL 0.1%乙酸-乙腈(8∶2,V/V )洗脱。收集3 mL洗脱液,涡旋后过0.22 μm滤膜,供LC-MS/MS分析。
1.4.3 免疫亲和柱净化
取出冷藏保存的免疫亲和柱,自然恢复至室温,取下柱头,放出柱内保存的PBS溶液。将5 mL提取液全部上样,用10 mL超纯水淋洗,挤干小柱后用5 mL 2%乙酸甲醇溶液洗脱,洗脱液于45 ℃下氮吹至干,残渣用1 mL 0.1%甲酸-乙腈(1∶1,V/V )复溶,过0.22 μm滤膜,供LC-MS/MS分析(参照GB 5009.206—2016)。
2. 结果与分析
2.1 提取条件的优化
织纹螺样品中蛋白质、色素和脂肪等杂质多,TTX不溶于有机试剂,易溶于酸性水溶液或酸性醇溶液,因此需要选取适当的萃取溶剂提取样品中的TTX。分别用1%乙酸水溶液和1%乙酸甲醇溶液提取样品中的TTX,回收率相近,均能有效提取TTX。用乙酸水溶液提取织纹螺肉时会提取出部分蛋白质成分,对仪器检测造成干扰。乙酸甲醇溶液提取能力强,能有效穿透组织,使蛋白质发生沉降,可降低上机检测时蛋白质对仪器产生的累积性干扰效应。在用乙酸甲醇溶液提取样品后,可用二氯甲烷除去脂肪和蛋白质。而吴佳俊等[27]认为用二氯甲烷处理并没有降低基质效应,也不能提高回收率。由于织纹螺样品蛋白质和脂肪含量低,因此本实验在用1%乙酸甲醇提取后,经高速离心吸取上清液过柱,上清液澄清,上样过程速率适当,没有出现堵柱情况。
2.2 碳纳米管的选择
碳纳米管吸附力强,对样品的净化效果好[22-23]。本实验比较了2种碳纳米管对样液中TTX的吸附和净化能力,发现羟基化碳纳米管在上样和淋洗阶段不能很好保留样品中的TTX,均有不同程度的丢失,造成回收率下降;羧基化碳纳米管在上样、淋洗阶段能很好保留TTX,洗脱后其回收率达到85%~90%。在选择装填小柱规格时,若选用3 mL空小柱装填,装填后碳纳米管间会出现空隙使得吸附效果减弱,因此选用6 mL的小柱进行湿法装填。
2.3 上样条件优化
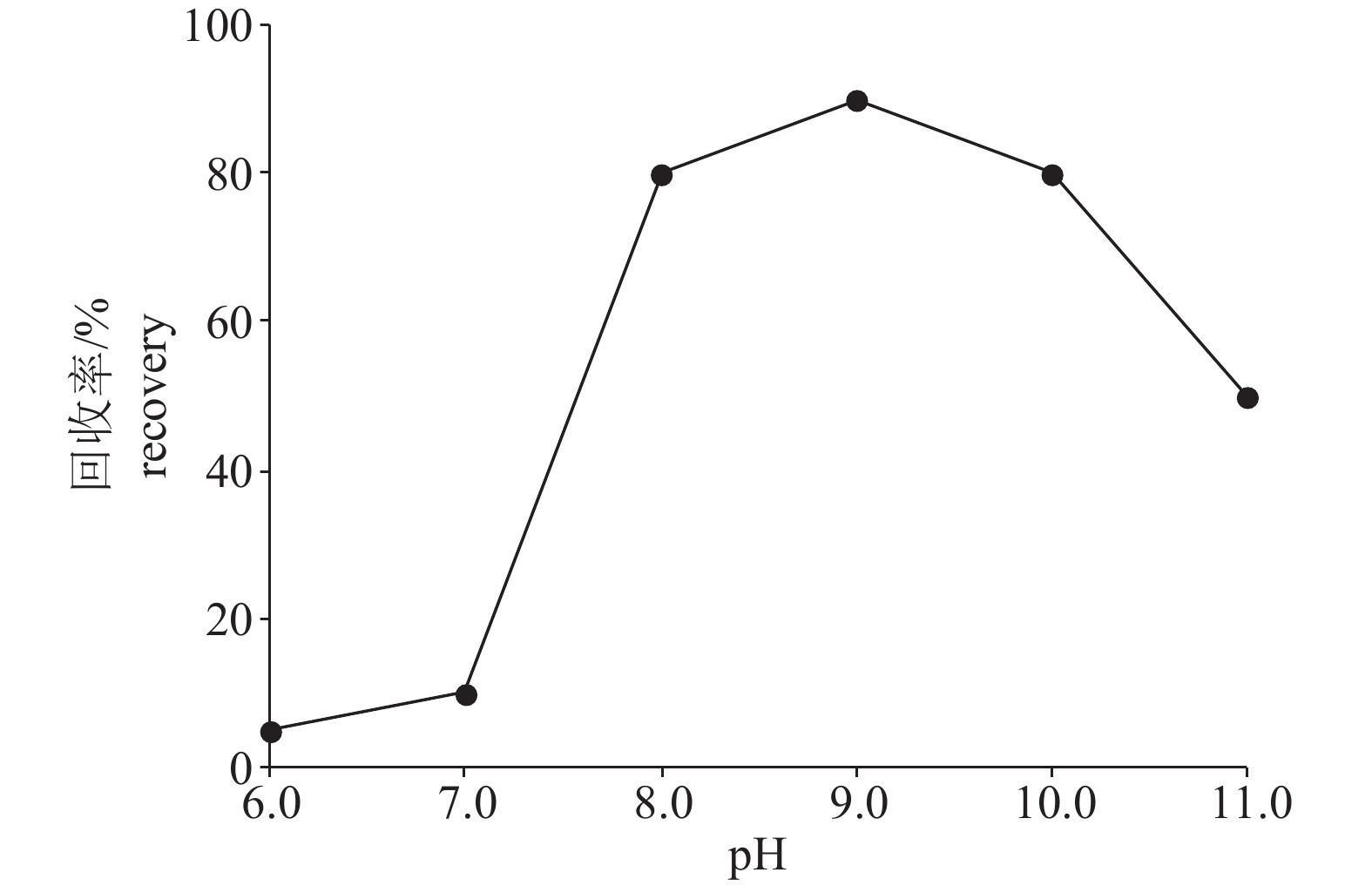
TTX与碳纳米管的结合作用力与样液的pH有关,在酸性或中性条件下结合能力较弱,需要在碱性条件下上样。本实验用氨水调节样液的pH,通过比较不同pH下加标样品的回收率,优化上样液的pH (图1)。上样液pH 为8.5~9.0时,其吸附能力最强,pH≥9.0时TTX不稳定,易分解,回收率下降,因此确定上样液的pH为8.5~9.0。
2.4 不同小柱吸附净化效果比较
与WCX柱和MCX柱相比,多壁碳纳米管小柱对生物样品中TTX的承载量更大,净化效果更好。之前的研究[28-29]用WCX小柱净化河鲀鱼肉样品时,加标回收率为75%~86%,但实际上样量仅为1 mL,在之后的淋洗过程中,甲醇和氨水均会造成样品中TTX的损失。黄清发等[30]用2%乙酸甲醇提取TTX,样液经过KOH碱解处理,最终上样液只有0.3 mL,之后过MCX柱,用BSTFA衍生,采用气相色谱进行分析。使用MCX柱与WCX柱净化样品时,均存在上样量偏少的问题,而加大实际样品的上样量又会造成上样过程中TTX漏穿,对检测的灵敏度和定量的准确性造成影响。羧基化多壁碳纳米管小柱相较于WCX柱和MCX柱,对样液中的TTX吸附量大、结合能力强,上样时能有效吸附TTX,在淋洗过程中也没有丢失。洗脱时用3 mL 0.1%乙酸-乙腈(8∶2,V/V)即可将TTX完全洗脱,洗脱液过膜后可直接上机检测,减少浓缩步骤,节省检测时间,提高工作效率。
2.5 基质效应的影响
生物样品基质复杂,净化效果不佳时会产生较强的基质抑制效应,造成灵敏度降低和定量不准确。本方法评价了基质效应的影响,在空白提取液中加入一定浓度的TTX标准溶液,比较其与相应浓度标准溶液的色谱峰面积,比值为0.41~0.67。免疫亲和柱特异性强,经过净化处理,能有效除去基质干扰[18]。骆和东等[31]用C18柱净化织纹螺样品,检测结果为0.50 mg·kg–1和0.38 mg·kg–1,小鼠生物法结果为0.73 mg·kg–1和0.58 mg·kg–1;吴佳俊等[27]用乙酸溶液提取河鲀鱼肉中的TTX后上机,对比4根色谱柱的绝对回收率,TSK-GEL Amide 80柱和ACQUITY UPLC BEH Amide柱的回收率达到50%左右,Kinetex HILIC柱与ZIC-HILIC柱的回收率仅为5%左右。上述2种方法的回收率均偏低,这是由样品中的基质抑制效应造成的。而羧基化多壁碳纳米管在碱性条件下能很好地吸附结合样品中的TTX,且承载量高,之后用甲醇和纯水淋洗去除杂质,用LC-MS/MS分析时可减少因基质干扰对检测结果造成的影响。
2.6 方法学研究
2.6.1 线性范围和定量限
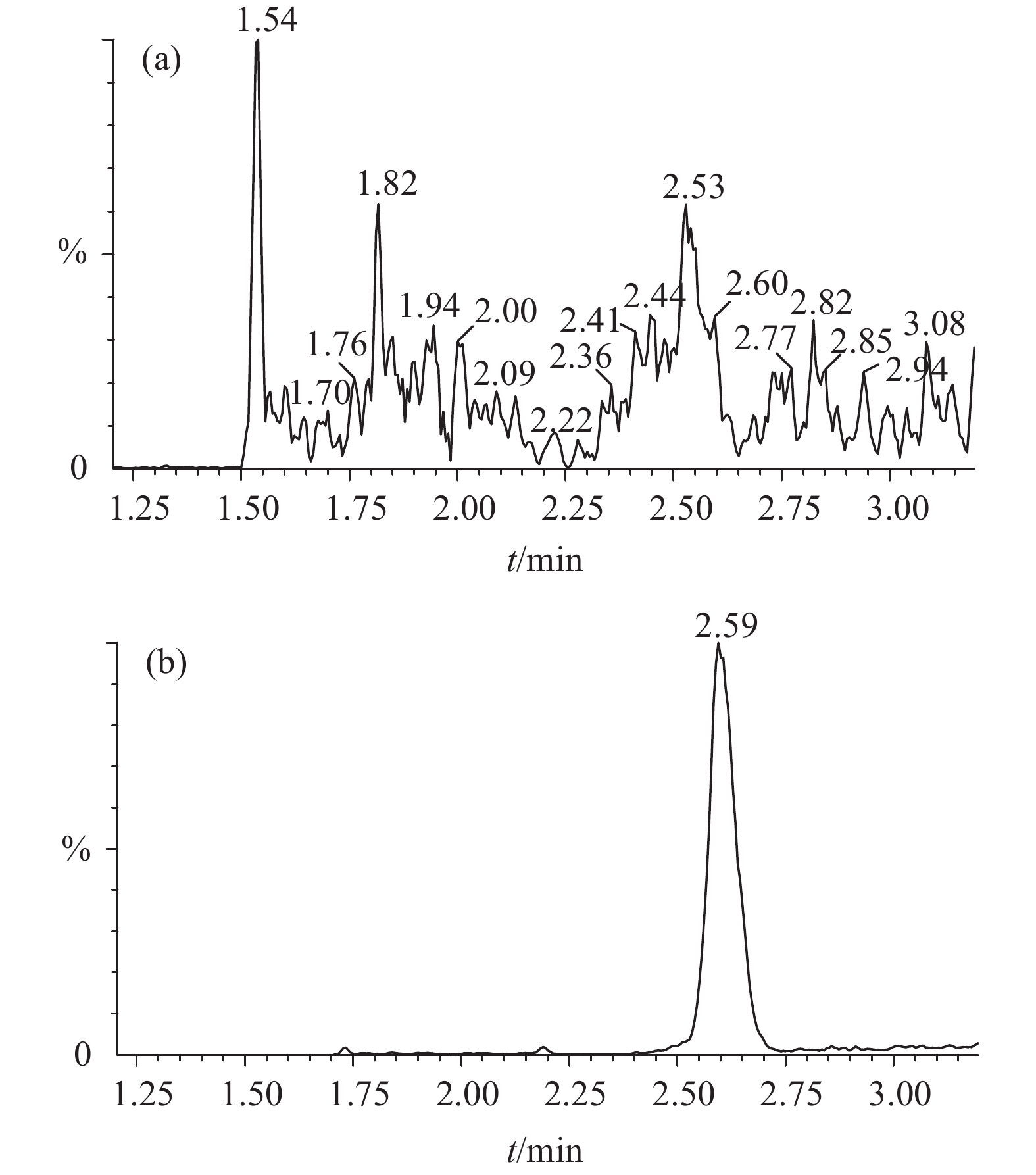
用0.1%甲酸-乙腈(1∶1,V/V )将TTX标准工作液逐级稀释成质量浓度分别为0.5 ng·mL–1、1 ng·mL–1、5 ng·mL–1、10 ng·mL–1和50 ng·mL–1的梯度标准工作液。以峰面积为纵坐标,标准溶液浓度为横坐标,绘制工作曲线,线性回归方程为y=58 264.5x–4 145.33 (R2=0.999 7),TTX在0.3~50 ng·mL–1范围内表现良好。采用阴性样品加标方法,以3倍信噪比确定检出限(LOD)为0.3 μg·kg–1,以10倍信噪比确定定量限(LOQ)为1 μg·kg–1,空白样品与加标样品的MRM图谱见图2。
2.6.2 回收率和相对标准偏差
本研究的阴性织纹螺样品均采用GB 5009.206—2016的液相色谱-串联质谱法测定。称取2.00 g阴性织纹螺分别添加水平为1.00 μg·kg–1、10.00 μg·kg–1和100.00 μg·kg–1的TTX标准溶液,每个平行测定5次,其回收率见表3。加标样品在1.00~100.00 μg·kg–1添加水平的平均回收率为83.7%~91.4%,相对标准偏差为2.3%~8.6%。
表 3 样品加标回收率与相对标准偏差Table 3. Recovery of standard addition and relative standard deviation for tetrodotoxinn=5 添加水平/μg·kg–1
added amount回收率/%
recovery相对标准偏差/%
RSD1 91.4 2.3 10 83.7 3.4 100 84.8 8.6 2.7 实际样品测定
本文用碳纳米管固相萃取-超高效液相色谱串联质谱法对采自广东省湛江市的30个织纹螺样品进行检测,TTX毒素的质量分数为1.87~3.34 mg·kg–1,与TTX免疫亲和柱作对比参照结果相近,本方法回收率高,精密度好,适用于螺肉样品TTX的检测。
3. 结论
在TTX样品检测分析工作中,通常采用SPE柱对样品进行上机前处理,但是TTX样品成分复杂,SPE净化效果并不理想[27]。本研究建立了一种高效、灵敏的检测织纹螺中TTX的LC-MS/MS方法。以1%乙酸甲醇溶液作为萃取剂,结合超声水浴法,对织纹螺样品中的TTX进行提取,在碱性条件下样品经过羧基化多壁碳纳米管净化,洗脱液用量少,可直接过滤膜上机检测,结合LC-MS/MS准确定量分析样品中的TTX。本方法步骤简单方便,洗脱液用量少,减少了洗脱液浓缩步骤,大大节省了样品处理和净化时间,在保证灵敏度的同时降低了实验成本,适用于对织纹螺样品中的TTX进行定量分析,是一种安全可靠的检测手段,为织纹螺的TTX检测提供新方法。但碳纳米管应用于TTX检测的研究还不多,许多条件仍需进一步深入探究。
-
表 1 梯度洗脱条件
Table 1 Gradient elution condition
t/min 流动相A/%
mobile phase A流动相B/%
mobile phase B0 95 5 1.0 40 60 3.0 40 60 3.2 95 5 5.0 95 5 表 2 TTX的多反应监测条件
Table 2 Conditions of multiple reaction monitoring for tetrodotoxin
分析物
analyte母离子/(m/z)
parent ion子离子/(m/z)
daughter ion锥孔电压/V
cone voltage碰撞能量/eV
collision energyTTX 320.1 161.9 35 35 302.0* 35 20 注:*. 定量离子 Note: *. quantitative ion 表 3 样品加标回收率与相对标准偏差
Table 3 Recovery of standard addition and relative standard deviation for tetrodotoxin
n=5 添加水平/μg·kg–1
added amount回收率/%
recovery相对标准偏差/%
RSD1 91.4 2.3 10 83.7 3.4 100 84.8 8.6 -
[1] 郭瑞霞, 李力更, 王磊, 等. 天然药物化学史话: 河豚毒素[J]. 中草药, 2014, 45(9): 1330-1335. [2] GOLDIN A L. Resurgence of sodium channel research[J]. Annu Rev Physiol, 2001, 63(1): 871-894.
[3] 伍汉霖. 中国有毒及药用鱼类新志[M]. 北京: 中国农业出版社, 2002: 79-90. [4] MATSUMURA K. Reexamination of tetrodotoxin production by bacteria[J]. Appl Environ Microbiol, 1995, 61(9): 3468-3470.
[5] HASHIMOTO K, NOGUCHI T, WATABE S. New aspects of Tetrodotoxin[M]//Microbial toxins in foods and feeds: cellular and molecular modes of action. New York: Springer US, 1990: 575-588.
[6] HANIFIN C T. The chemical and evolutionary ecology of tetrodotoxin (TTX) toxicity in terrestrial vertebrates[J]. Mar Drugs, 2010, 8(3): 577-593.
[7] GAGE P W, MOORE J W, WESTERFIELD M. An octopus toxin, maculotoxin, selectively blocks sodium current in squid axons[J]. J Physiol, 1976, 259(2): 427-443.
[8] NOGUCHI T, ARAKAWA O, TAKATANI T. TTX accumulation in pufferfish[J]. Comp Biochem Physiol D, 2006, 1(1): 145-152.
[9] HWANG P A, TSAI Y H, DENG J F, et al. Identification of tetrodotoxin in a marine gastropod (Nassarius glans) responsible for human morbidity and mortality in Taiwan[J]. J Food Prot, 2005, 68(8): 1696-1701.
[10] 于仁成, 周名江, 李爱峰, 等. 中国沿海两例食用织纹螺中毒事件中织纹螺体内毒素分析[J]. 中国水产科学, 2007, 14(5): 801-806. [11] 林祥田, 张明生, 王志坚, 等. 连云港海州湾麻痹性贝类毒素中毒分析[J]. 中国食品卫生杂志, 2005, 17(3): 243-246. [12] 王晓杰. 织纹螺(Nassarius spp.)体内河豚毒素来源的研究[D]. 青岛: 中国科学院海洋研究所, 2008: 28-29. [13] REVERTÉ L, RAMBLA-ALEGRE M, LEONARDO S, et al. Development and validation of a maleimide-based enzyme-linked immunosorbent assay for the detection of tetrodotoxin in oysters and mussels[J]. Talanta, 2018, 176: 659-666.
[14] SHEN H C, ZHANG S W, FU Q Q, et al. A membrane-based fluorescence-quenching immunochromatographic sensor for the rapid detection of tetrodotoxin[J]. Food Control, 2017, 81: 101-106.
[15] DZANTIEV B B, BYZOVA N A, URUSOV A E. Immunochromatographic methods in food analysis[J]. TrAC Trend Anal Chem, 2014, 55: 81-93.
[16] BANE V, HUTCHINSON S, SHEEHAN A, et al. LC-MS/MS method for the determination of tetrodotoxin (TTX) on a triple quadruple mass spectrometer[J]. Food Addit Contam Pt A, 2016, 33(11): 1728-1740.
[17] JEN H C, NGUYEN T A, WU Y J, et al. Tetrodotoxin and paralytic shellfish poisons in gastropod species from Vietnam analyzed by high-performance liquid chromatography and liquid chromatography-tandem mass spectrometry[J]. J Food Drug Anal, 2014, 22(2): 178-188.
[18] 严忠雍, 张小军, 李奇富, 等. 免疫亲和柱净化-液相色谱-串联质谱法测定海洋生物中河豚毒素[J]. 分析化学, 2015, 43(2): 277-281. [19] GUO M M, WU H Y, JIANG T, et al. Simultaneous identification and quantification of tetrodotoxin in fresh pufferfish and pufferfish-based products using immunoaffinity columns and liquid chromatography/quadrupole-linear ion trap mass spectrometry[J]. Chin J Oceanol Limnol, 2017, 35(4): 883-893.
[20] 李来好, 孙博伦, 赵东豪. 河豚毒素的检测与制备方法研究进展[J]. 南方水产科学, 2018, 14(3): 126-132. [21] 宋鑫. 单壁碳纳米管的制备、提纯及拉曼光谱研究[D]. 北京: 首都师范大学, 2007: 10-21. [22] TAGHIZADEH M, ASGHARINEZHAD A A, SAMKHANIANY N, et al. Solid phase extraction of heavy metal ions based on a novel functionalized magnetic multi-walled carbon nanotube composite with the aid of experimental design methodology[J]. Microchim Acta, 2014, 181(5/6): 597-605.
[23] WANG J X, JIANG D Q, GU Z Y, et al. Multiwalled carbon nanotubes coated fibers for solid-phase microextraction of polybrominated diphenyl ethers in water and milk samples before gas chromatography with electron-capture detection[J]. J Chromatogr A, 2006, 1137(1): 8-14.
[24] 陈啟荣, 杨明, 梁颖, 等. 多壁碳纳米管固相萃取净化-气相色谱质谱联用同时测定茶叶中26种农药[J]. 食品安全质量检测学报, 2016, 7(4): 1686-1693. [25] 廖且根, 罗林广, 张大文, 等. 一种利用多壁碳纳米管检测水体中微蘘藻毒素的方法: 2013103213804[P]. 2013-10-19. [26] 陈黎, 余斐, 崔华鹏, 等. 一种利用多壁碳纳米管检测烟草中多种农药残留的方法: 2015101706223[P]. 2015-07-15. [27] 吴佳俊, 黄文雯, 肖陈贵, 等. 高效液相色谱-串联质谱法检测河豚毒素的方法研究[J]. 食品安全质量检测学报, 2014, 5(11): 3529-3536. [28] 岑剑伟, 李来好, 杨贤庆, 等. 水产品中河鲀毒素的高效液相紫外测定法[J]. 中国水产科学, 2010, 17(5): 1036-1044. [29] 魏涯, 李来好, 杨贤庆, 等. 超声波提取-固相萃取联用检测河鲀毒素的研究[J]. 热带海洋学报, 2012, 31(6): 115-120. [30] 黄清发, 孙振中, 戚隽渊, 等. 河鲀毒素固相萃取-气相色谱-质谱法研究[J]. 上海海洋大学学报, 2012, 21(6): 1058-1063. [31] 骆和东, 贾玉珠, 朱宝平. 固相萃取-超过滤-液相色谱/质谱联用法测定织纹螺中的河豚毒素[J]. 色谱, 2007, 25(6): 917-921. -
期刊类型引用(9)
1. 沈晓娜,陈小红,罗方方,陈慧斌,刘智禹. 超高效液相色谱-串联质谱法测定织纹螺中河豚毒素的方法优化. 渔业研究. 2025(01): 64-73 .  百度学术
百度学术
2. 赵凌国,孙健,刘勇,雷蕾,尹江伟. HILIC-UPLC-MS/MS在两起河豚中毒事件病因确证和病情预测中的应用研究. 检验医学与临床. 2023(07): 880-883 .  百度学术
百度学术
3. 高榕冬,孙磊龙,章敏敏,彭骢. 液相色谱质谱联用测定中毒样品中河豚毒素. 食品安全导刊. 2022(24): 101-105 .  百度学术
百度学术
4. 卢宗桂. 分散固相萃取结合UPLC-MS/MS测定闽东地区贝类中河豚毒素. 福建农业科技. 2022(09): 24-29 .  百度学术
百度学术
5. 万嘉峻,曹瑛. 海洋贝类生物毒素检测前处理技术研究进展. 防化研究. 2022(01): 72-80 .  百度学术
百度学术
6. 黄连琴. 超高效液相色谱-串联质谱法测定闽东地区织纹螺中河豚毒素. 食品安全质量检测学报. 2021(23): 9260-9265 .  百度学术
百度学术
7. 刘铭丽,孔聪,杨光昕,沈晓盛. 河鲀中河鲀毒素检测研究进展. 食品安全质量检测学报. 2020(05): 1400-1407 .  百度学术
百度学术
8. 王兴龙,蔡强,桂文锋,倪晓锋,蔡增轩,许娇娇,任一平. 河鲀毒素及其检测技术研究进展. 水产科学. 2020(03): 447-457 .  百度学术
百度学术
9. 李春青,付志茹,高丽娜,时文博,陈永平. 液相色谱串联质谱法测定河豚毒素标准品. 食品安全导刊. 2020(18): 101 .  百度学术
百度学术
其他类型引用(4)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
