Molecular characteristics and expression analysis of AQP1a from Trachinotus ovatus under acute salinity stress
-
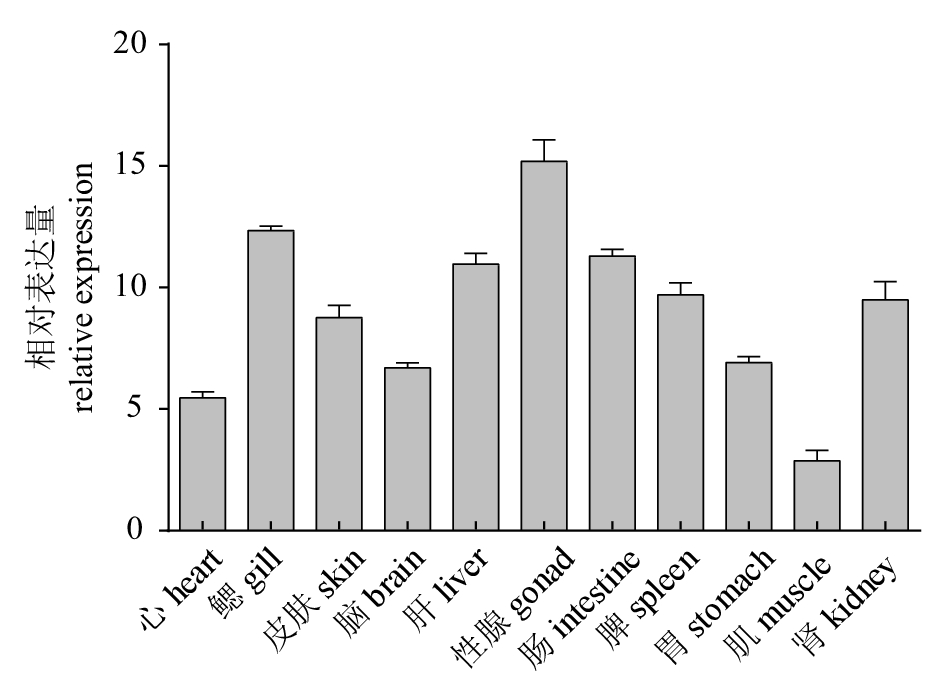
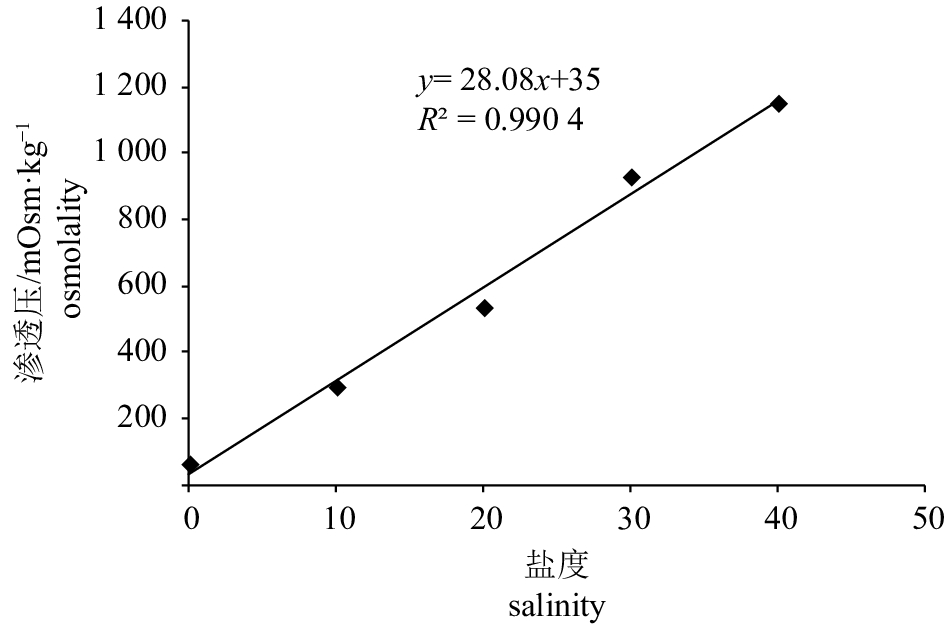
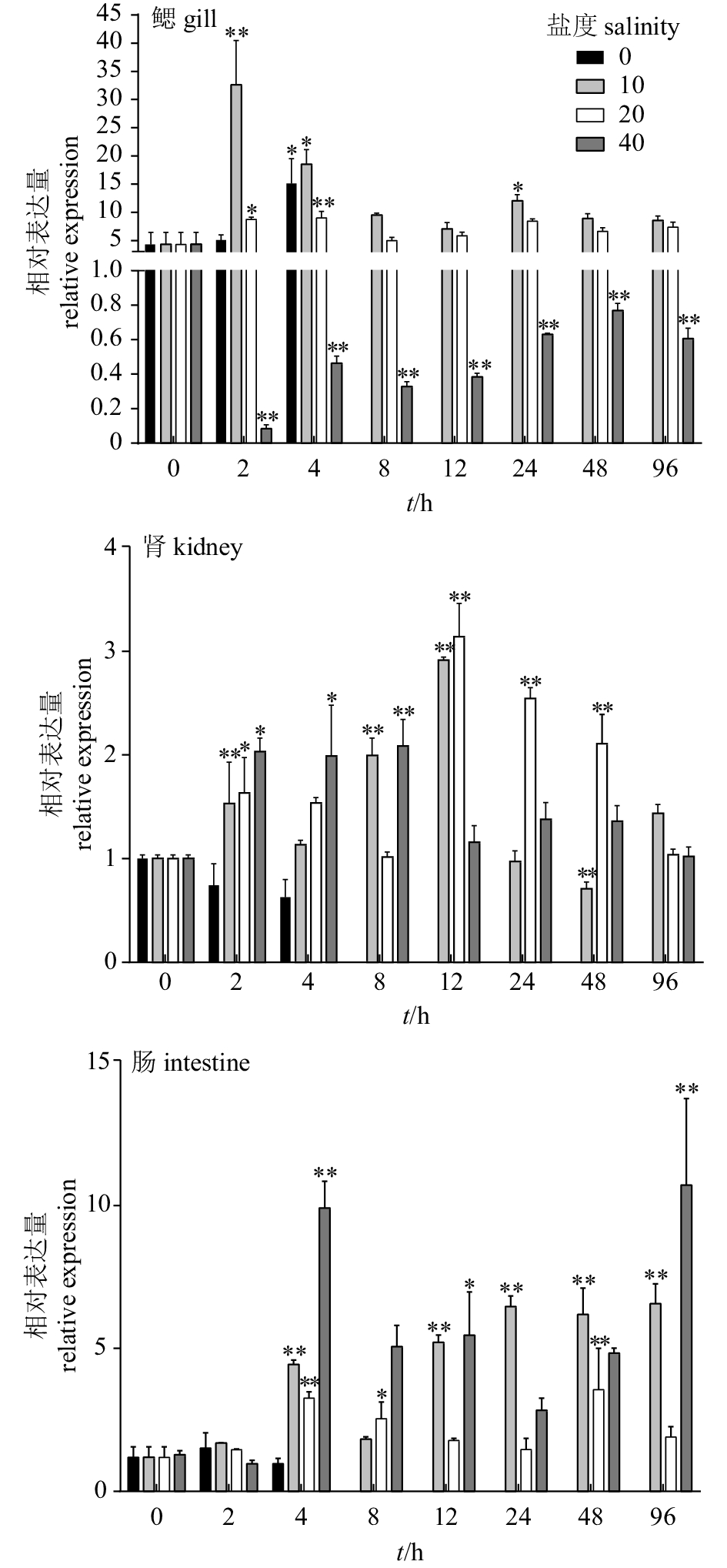
摘要: 水通道蛋白(aquaporin,AQPs)是由内在膜蛋白组成的超家族,介导水分子的跨膜运输,对渗透压调节具有重要作用。为研究AQP1a在急性盐度胁迫下对卵形鲳鲹 (Trachinotus ovatus)的渗透压调节作用,该研究获得AQP1a基因。基因全长1 078 bp,开放阅读框786 bp,编码261个氨基酸,具有MIP家族特有序列(HINPAVTLG)和2个天冬酰胺−脯氨酸−丙氨酸蛋白基序。qRT-PCR结果显示,AQP1a在11个被测组织中均有表达,在性腺中的表达量最高,其次是鳃和肠,在肌肉中表达量最低。在急性盐度胁迫下,当转入淡水时,AQP1a在鳃的表达量在第4小时显著上升,而在肾和肠中没有显著变化;当转入盐度10和20海水时,鳃中AQP1a的表达量在第2和第4小时显著升高,然后下降趋于稳定;转入盐度10海水时,肠中AQP1a的表达量均上升,肾中AQP1a的表达量呈先上升后下降趋势;转入盐度20海水时,肠中AQP1a的表达量仅在第4、第8和第48小时显著上升,肾中AQP1a的表达量在第12小时达到最大;转入盐度40海水中,鳃中AQP1a的表达量明显下降,相反,在肾和肠中AQP1a的表达量均明显上调。这些结果反映了AQP1a在不同组织中的功能特异性,证实了AQP1a在卵形鲳鲹盐度适应中起重要作用。Abstract: Aquaporin, a superfamily of internal membrane proteins that mediate transmembrane transport of water molecules, plays an important role in osmotic adjustment. AQP1a gene was obtained in order to study the role of AQP1a in osmoregulation of Trachinotus ovatus under acute salinity stress. The sequence of AQP1a gene was 1 078 bp with an open reading frame of 786 bp encoding 261 amino acids. The structural analysis shows that it has the structural characteristics of MIP family-specific sequence (HINPAVTLG) and two asparagine-proline-alanine (NPA) motifs. The qRT-PCR results show that AQP1a was distributed in the 11 tested tissues, highest in gonads and then in gill, intestine and liver, lowest in muscle. Under acute salinity stress, after being transfered to fresh water, the expression of AQP1a in gill increased at 4th hour, while there was no significant change in the expression in kidney and intestine. After being transfered to 10‰ and 20‰ salinity seawater, the expression of AQP1a in gill increased significantly at 2nd and 4th hour, and then decreased gradually. When being transferred to 10‰ salinity seawater, the expression of AQP1a in intestine increased. In kidney, the expression of AQP1a first increased and then decreased. When being transferred to 20‰ salinity seawater, the expression of AQP1a in intestine only increased significantly at 4th, 8th and 48th hour. In kidney, the expression of AQP1a reached the maximum at 12th hour. In 40‰ salinity seawater, the expression of AQP1a in gill decreased significantly. On the contrary, the expression of AQP1a in kidney and intestine were significantly up-regulated. The results reveal that the specificity of AQP1a functions in different tissues and plays an important role in T.ovatus salinity adaptation.
-
Keywords:
- Trachinotus ovatus /
- aquaporin /
- osmoregulation /
- acute salinity stress
-
合浦珠母贝(Pinctada fucata)是海产软体动物,隶属瓣鳃纲、珍珠贝目、珍珠贝科,广泛分布于热带、亚热带沿海。在中国主要分布于广东、广西、海南及福建沿海一带,是中国最主要的海水珍珠育珠贝,其所产海水珍珠质量蜚声中外[1-5]。而基质蛋白是一类存在于贝壳和珍珠矿化结构中的蛋白,在贝壳和珍珠形成过程中碳酸钙(CaCO3)在基质蛋白的作用下形成高度复杂有序的生物矿化结构,即贝壳和珍珠是在基质蛋白的指导下形成的[6-11]。研究发现,壳基质蛋白不仅在贝壳与珍珠形成的生物矿化过程中起着关键的调控作用,同时赋予珍珠质许多优异的生物学和力学性能,与珍珠贝的生长和珍珠的品质有着密切的关系[12-17]。
2000年,日本学者MIYASHITA等[18]用0.3 mol·L-1乙二胺四乙酸(EDTA)/8 mol·L-1尿素从珍珠粉中萃取出一种新的不溶于EDTA的蛋白Pearlin并克隆得到其cDNA序列,其由129个氨基酸构成,并含有高比例的甘氨酸(Gly,10.8%)、酪氨酸(Tyr,10.0%)、半胱氨酸(Cys,8.5%)、天冬酰胺(Asn,7.7%)、氨基丁二酸(Asp,7.7%)和精氨酸(Arg,7.7%)。Northern Blot分析表明其mRNA在外套膜上皮细胞特定表达,但关于其功能却并不清楚。直到2003年MATSUSHIRO等[19]从珍珠和贝壳珍珠层分离得到一种由Pearlin和角蛋白组成的复合蛋白,发现在含镁离子(Mg2+)的饱和碳酸溶液中加入少量的此蛋白复合体能够诱导文石晶体结晶化。在EDTA和尿素存在的情况下此复合体能够被分离,但被分离的组分混合物失去了诱导文石结晶化的功能。而通过钙离子(Ca2+)和尿素的诱导被分离的复合体组件又被重造成复合体并且重新获得了诱导文石结晶化的功能。这说明复合体是诱导文石结晶化不可或缺的重要功能元件,表明复合体的存在可能是壳基质蛋白执行矿化功能的前提。
由于受壳基质蛋白含量极少、分离难度大等条件限制,使壳基质蛋白的功能分析与开发利用比较困难。若能通过基因工程技术在体外大量获得壳基质蛋白,就能为壳基质蛋白的功能分析与研发利用提供材料。笔者通过基因重组技术构建了壳基质蛋白Pearlin基因的重组质粒,并成功表达出重组融合蛋白,以期对壳基质蛋白基因的进一步研究提供参考依据。
1. 材料与方法
1.1 实验材料
合浦珠母贝由中国水产科学研究院南海水产研究所热带水产研究开发中心陵水新村试验场提供。取合浦珠母贝外套膜组织样品快速保存于RNA样品保存液中,带回实验室-80 ℃冻存。质粒转化受体菌大肠杆菌(E.coli)DH5α、E.coli BL21(DE3)、原核表达载体pET32a均为笔者实验室保存,感受态细菌为笔者实验室自制。
1.2 重组原核表达载体pET32a-Pearlin的构建
根据GenBank上注册的合浦珠母贝壳基质蛋白基因Pearlin的基因序列(AB020779.1)设计引物。上游引物的5′端加保护性碱基CGC、酶切位点BamHⅠ:CGC GGATTC ATGACGTGCACACTTCGTTG;下游引物的5′端加保护性碱基CCC、酶切位点HindⅢ:CCC AAGCTT CTTGTCATACCGTTCATCGA。以合浦珠母贝外套膜cDNA为模板,在20 μL的反应体系中扩增目的基因。PCR反应体系为10×ExTaqBuffer 2 μL,2.5 mmol·L-1 dNTP Mixture 0.4 μL,正、反向引物各0.5 μL,ExTaqDNA polymerase 0.1 μL,cDNA 0.5 μL,无菌ddH2O 16 μL。反应条件为94 ℃预变性5 min,94 ℃变性30 s,59.9 ℃退火30 s,72 ℃延伸1 min,35个循环后,72 ℃延伸10 min。目的基因PCR产物和表达载体pET32a用TaKaRa公司的限制性内切酶BamHⅠ、HindⅢ进行双酶切反应,并以Magen公司的Hipure Gelpure DNA Micro Kit试剂盒从凝胶中回收,目的片段Pearlin与载体pET32a连接后转化感受态细胞DH5α。从阳性克隆中筛选正确插入外源基因的重组克隆,并送上海生工生物技术公司测序鉴定,将测序正确的阳性克隆命名为pET32a-Pearlin。
1.3 重组蛋白pET32a-Pearlin的诱导表达与条件优化
1.3.1 重组表达菌株的培养与诱导表达
将原核重组质粒pET32a-Pearlin与空载体pET32a分别转化到表达宿主菌E.coli BL21(DE3)感受态细胞中,分别挑取单菌落于3 mL LB/Amp液体培养基中,37 ℃摇床培养过夜。将过夜培养的菌液按体积比1 : 100转接至5 mL LB/Amp液体培养基中,37 ℃摇菌培养至光密度(OD600)=0.4~0.6,取2 mL菌液作为未诱导对照,再往剩下的菌液中加入IPTG至终浓度为l mmol·L-1,继续振荡培养4~6 h。分别取未诱导菌液1 mL、IPTG诱导后菌液l mL,进行SDS-PAGE电泳分析全菌蛋白。
1.3.2 IPTG诱导浓度的优化
取8管3 mL OD600=0.6的pET32a-Pearlin菌液分别加入100 mmol·L-1 IPTG至终浓度分别为0 mmol·L-1、0.2 mmol·L-1、0.4 mmol·L-1、0.6 mmol·L-1、0.8 mmol·L-1、1.0 mmol·L-1、1.2 mmol·L-1和1.4 mmol·L-1,取1管3 mL OD600=0.6的空载体pET32a菌液加100 mmol·L-1 IPTG至终浓度为1.4 mmol·L-1。37 ℃诱导6 h,分别取菌液1 mL,对样品进行处理,SDS-PAGE电泳分析全菌蛋白。
1.3.3 诱导温度的优化
分别取3管3 mL OD600=0.6的pET32a-Pearlin菌液,均加入100 mmol·L-1 IPTG至终浓度为1.0 mmol·L-1(同时以空载体pET32a菌液为对照)。分别在37 ℃、28 ℃下诱导培养6 h,20 ℃下诱导过夜(16~18 h)。各取菌液1 mL,对样品进行处理,SDS-PAGE电泳分析全菌蛋白。
1.3.4 培养基pH的优化
分别取3管3 mL OD600=0.6的pET32a-Pearlin菌液(培养基pH分别为6.0、7.0、8.0),均加入100 mmol·L-1 IPTG至终浓度为1.0 mmol·L-1(同时以空载体pET32a菌液和未加IPTG的pET32a-Pearlin菌液为对照)。37 ℃下诱导培养6 h,各取菌液1 mL,对样品进行处理,SDS-PAGE电泳分析全菌蛋白。
1.3.5 诱导时间的优化
分别取6管3 mL OD600=0.6的pET32a-Pearlin菌液,均加入100 mmol·L-1 IPTG至终浓度为1.0 mmol·L-1(同时以空载体pET32a菌液和未加IPTG的pET32a-Pearlin菌液为对照)。37 ℃下分别诱导培养1 h、2 h、3 h、4 h、5 h、6 h,各取菌液1 mL,对样品进行处理,SDS-PAGE电泳分析全菌蛋白。
1.3.6 诱导时机的优化
分别取3 mL转接后培养了2 h、3 h、4 h的pET32a-Pearlin菌液,均加入100 mmol·L-1 IPTG至终浓度为1.0 mmol·L-1(同时以空载体pET32a菌液和未加IPTG的pET32a-Pearlin菌液为对照)。37 ℃下分别诱导培养6 h,各取菌液1 mL,对样品进行处理,SDS-PAGE电泳分析全菌蛋白。
1.4 重组蛋白的可溶性检测
取10 mL重组蛋白表达菌pET32a-Pearlin,IPTG诱导培养6 h,4℃,12 000 g离心10 min,弃上清。用PBS洗涤一次后,加入10 mL PBS重悬菌体,进行超声波裂解。4 ℃,12 000 g离心10 min,分别收集上清和沉淀,进行SDS-PAGE电泳,比较确定表达产物是以可溶性形式存在(上清中),还是以包涵体形式存在(沉淀中)。
2. 结果
2.1 重组原核表达载体pET32a-Pearlin的构建
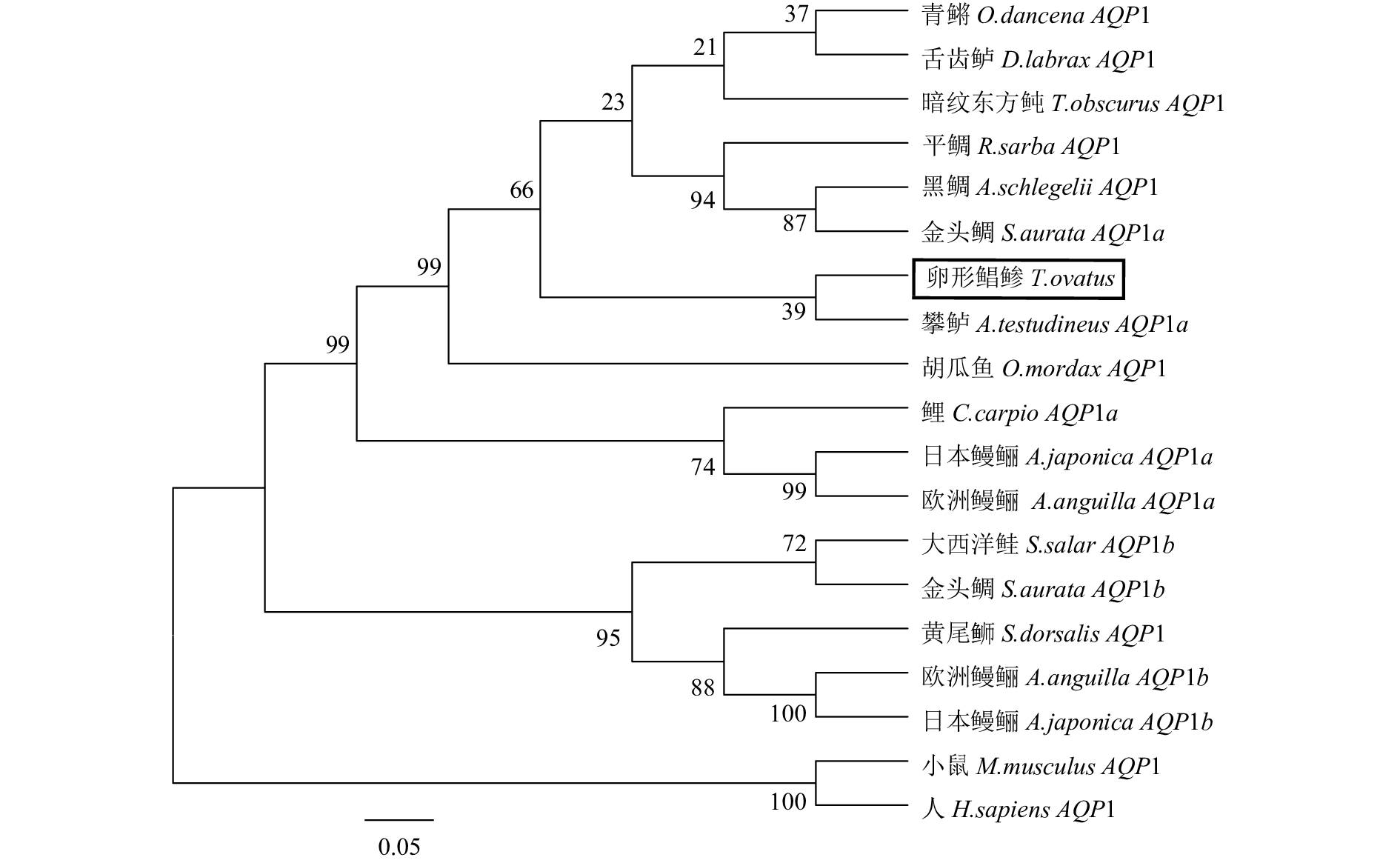
测序结果表明重组质粒pET32a-Pearlin中插入的基因片段与GenBank上注册的合浦珠母贝Pearlin基因ORF序列(ID: AB020779.1)一致性为93%。经BLAST分析,中国海南地区合浦珠母贝Pearlin ORF与日本等其他地区珍珠贝Pearlin ORF的核苷酸序列一致性为85%~99%(表 1),用邻位相连法(neighbor-joining,NJ)构建系统进化树见图 1,置信度检验1 000次。
表 1 Pearlin基因核苷酸序列间的一致性及变异性Table 1. Consistency and variability of Pearlin between nucleotide sequences登录号Genbank ID PearlinORF AB020779.1 JQ962975.1 DQ665305.3 Pearlin ORF 0.090 0.323 0.345 AB020779.1 93% 0.277 0.297 JQ962975.1 87% 87% 0.012 DQ665305.3 85% 85% 99% 注:Pearlin ORF. 合浦珠母贝(中国海南);AB020779.1. 合浦珠母贝(日本);JQ962975.1. Pteria sterna(墨西哥);DQ665305.3. 珠母贝(法国波利尼西亚)
Note:Pearlin ORF. P.fucata(Hainan, China);AB020779.1. P.fucata(Japan);JQ962975.1. Pteria sterna(Mexico);DQ665305.3. P.margaritifera(French Polynesia)2.2 重组蛋白pET32a-Pearlin原核表达的SDS-PAGE电泳检测
经IPTG诱导的重组质粒pET32a-Pearlin表达出相对分子质量约为34.19 kD的融合蛋白,而对照组的空载体pET32a则无此特异性条带(图 2)。由于合浦珠母贝Pearlin蛋白分子量约为14.19 kD,且pET32a自带的蛋白分子量约为20 kD,故其融合蛋白约为34.19 kD。表明增加的蛋白条带就是外源基因Pearlin被诱导表达的融合蛋白产物,与预期结果相符。
![]() 图 2 pET32a-Pearlin重组质粒在BL21细菌中的IPTG诱导表达0. 未经IPTG诱导的BL21(pET32a-Pearlin)全菌蛋白;P. IPTG诱导的BL21(pET32a)全菌蛋白;M. 蛋白质分子质量标准Marker;1~7. IPTG诱导的BL21(pET32a-Pearlin)全菌蛋白Figure 2. IPTG inducing expression of PET32a-Pearlin recombinant plasmid in BL21 bacteria0. whole cell protein without IPTG-induced BL21 (pET32a-Pearlin); P. whole cell protein with IPIG-induced BL21 (pET32a); M. protein molecular weight standard; 1~7. whole cell protein with IPIG-induced BL21(pET32a-Pearlin)
图 2 pET32a-Pearlin重组质粒在BL21细菌中的IPTG诱导表达0. 未经IPTG诱导的BL21(pET32a-Pearlin)全菌蛋白;P. IPTG诱导的BL21(pET32a)全菌蛋白;M. 蛋白质分子质量标准Marker;1~7. IPTG诱导的BL21(pET32a-Pearlin)全菌蛋白Figure 2. IPTG inducing expression of PET32a-Pearlin recombinant plasmid in BL21 bacteria0. whole cell protein without IPTG-induced BL21 (pET32a-Pearlin); P. whole cell protein with IPIG-induced BL21 (pET32a); M. protein molecular weight standard; 1~7. whole cell protein with IPIG-induced BL21(pET32a-Pearlin)2.3 pET32a-Pearlin重组蛋白表达所需IPTG诱导浓度的优化
基因工程菌BL21(pET32a-Pearlin)经不同的IPTG浓度诱导培养6 h后,将全菌蛋白进行SDS-PAGE电泳检测,筛选最优IPTG浓度。结果显示,IPTG的终浓度为0 mmol·L-1时重组蛋白表达量较低。随着IPTG浓度的提高,蛋白表达量也随之提高。但在0.6~1.4 mmol·L-1的浓度范围内,表达量无明显变化(图 3)。考虑到《pET System Manual》建议带有T7lac启动子的载体(如pET32a)需要终浓度为1 mmol·L-1的IPTG才能完全诱导,并且IPTG对菌体有一定的毒性,因此选用终浓度为1.0 mmol·L-1的IPTG诱导重组蛋白。
![]() 图 3 不同IPTG诱导浓度下pET32a-Pearlin表达产物的SDS-PAGE分析M. 蛋白质分子质量标准Marker;P. BL21(pET32a)的IPTG终浓度为1.4 mmol·L-1;0~7. BL21(pET32a-Pearlin) 的IPTG终浓度依次为0 mmol·L-1、0.2 mmol·L-1、0.4 mmol·L-1、0.6 mmol·L-1、0.8 mmol·L-1、1.0 mmol·L-1、1.2 mmol·L-1和1.4 mmol·L-1Figure 3. SDS-PAGE analysis of pET32a-Pearlin expression product at different concentrations of IPTGM. protein molecular weight standard; P. IPTG concentration of BL21 (pET32a) was 1.4 mmol·L-1; 0~7. IPTG concentrations of BL21(pET32a-Pearlin) were 0 mmol·L-1, 0.2 mmol·L-1, 0.4 mmol·L-1, 0.6 mmol·L-1, 0.8 mmol·L-1, 1.0 mmol·L-1, 1.2 mmol·L-1 and 1.4 mmol·L-1, respectively.
图 3 不同IPTG诱导浓度下pET32a-Pearlin表达产物的SDS-PAGE分析M. 蛋白质分子质量标准Marker;P. BL21(pET32a)的IPTG终浓度为1.4 mmol·L-1;0~7. BL21(pET32a-Pearlin) 的IPTG终浓度依次为0 mmol·L-1、0.2 mmol·L-1、0.4 mmol·L-1、0.6 mmol·L-1、0.8 mmol·L-1、1.0 mmol·L-1、1.2 mmol·L-1和1.4 mmol·L-1Figure 3. SDS-PAGE analysis of pET32a-Pearlin expression product at different concentrations of IPTGM. protein molecular weight standard; P. IPTG concentration of BL21 (pET32a) was 1.4 mmol·L-1; 0~7. IPTG concentrations of BL21(pET32a-Pearlin) were 0 mmol·L-1, 0.2 mmol·L-1, 0.4 mmol·L-1, 0.6 mmol·L-1, 0.8 mmol·L-1, 1.0 mmol·L-1, 1.2 mmol·L-1 and 1.4 mmol·L-1, respectively.2.4 pET32a-Pearlin重组蛋白表达所需诱导温度的优化
SDS-PAGE电泳结果(图 4)表明,IPTG终浓度为1.0 mmol·L-1时,相同培养时间(6 h)下工程菌BL21(pET32a-Pearlin)在37 ℃表达蛋白相对较多。20 ℃低温下需过夜诱导(16~18 h)且表达量远低于37 ℃下的表达量。所以考虑到诱导时间的长短以及仪器设备的便捷性,选择37 ℃下诱导4~6 h。
![]() 图 4 不同诱导温度下pET32a-Pearlin表达产物的SDS-PAGE分析M. 蛋白质分子质量标准Marker;1、3、5. BL21(pET32a) 分别在20 ℃(16~18 h)、28℃(6 h)、37℃(6 h)下表达;2、4、6. BL21(pET32a-Pearlin)分别在20 ℃(16~18 h)、28 ℃(6 h)、37 ℃(6 h)下表达Figure 4. SDS-PAGE analysis of pET32a-Pearlin induced expression product at different temperaturesM. protein molecular weight standard; 1, 3, 5. BL21(pET32a) was expressed at 20 ℃ (16~18 h), 28 ℃ (6 h) and 37 ℃ (6 h), respectively; 2, 4, 6. BL21(pET32a-Pearlin)was expressed at 20 ℃ (16~18 h), 28 ℃(6 h) and 37 ℃ (6 h), respectively.
图 4 不同诱导温度下pET32a-Pearlin表达产物的SDS-PAGE分析M. 蛋白质分子质量标准Marker;1、3、5. BL21(pET32a) 分别在20 ℃(16~18 h)、28℃(6 h)、37℃(6 h)下表达;2、4、6. BL21(pET32a-Pearlin)分别在20 ℃(16~18 h)、28 ℃(6 h)、37 ℃(6 h)下表达Figure 4. SDS-PAGE analysis of pET32a-Pearlin induced expression product at different temperaturesM. protein molecular weight standard; 1, 3, 5. BL21(pET32a) was expressed at 20 ℃ (16~18 h), 28 ℃ (6 h) and 37 ℃ (6 h), respectively; 2, 4, 6. BL21(pET32a-Pearlin)was expressed at 20 ℃ (16~18 h), 28 ℃(6 h) and 37 ℃ (6 h), respectively.2.5 pET32a-Pearlin重组蛋白表达培养基pH的优化
工程菌BL21(pET32a-Pearlin)经不同pH的培养基培养和IPTG诱导后,将全菌蛋白进行SDS-PAGE电泳检测,结果显示如图 5。pET32a-Pearlin在实验pH分别为6.0、7.0、8.0的培养基中表达量相差不大。
![]() 图 5 不同pH培养基中pET32a-Pearlin表达产物的SDS-PAGE分析M. 蛋白质分子质量标准Marker;1、4、7. 未经IPTG诱导的BL21(pET32a-Pearlin)全菌蛋白;2、5、9. IPTG诱导的BL21(pET32a)全菌蛋白;3、6、8. IPTG诱导的BL21 (pET32a-Pearlin)全菌蛋白(1~3培养基pH为6.0;4~6培养基pH为7.0;7~9培养基pH为8.0)Figure 5. SDS-PAGE analysis of pET32a-Pearlin expression product with different pHs of mediumM. protein molecular weight standard; 1, 4, 7. whole cell protein without IPIG-induced BL21 (pET32a-Pearlin); 2, 5, 9. whole cell protein with IPIG-induced BL21(pET32a); 3, 6, 8. whole cell protein with IPTG-induced BL21 (pET32a-Pearlin) (1~3. pH of medium was 6.0;4~6. pH of medium was 7.0;7~9. pH of medium was 8.0)
图 5 不同pH培养基中pET32a-Pearlin表达产物的SDS-PAGE分析M. 蛋白质分子质量标准Marker;1、4、7. 未经IPTG诱导的BL21(pET32a-Pearlin)全菌蛋白;2、5、9. IPTG诱导的BL21(pET32a)全菌蛋白;3、6、8. IPTG诱导的BL21 (pET32a-Pearlin)全菌蛋白(1~3培养基pH为6.0;4~6培养基pH为7.0;7~9培养基pH为8.0)Figure 5. SDS-PAGE analysis of pET32a-Pearlin expression product with different pHs of mediumM. protein molecular weight standard; 1, 4, 7. whole cell protein without IPIG-induced BL21 (pET32a-Pearlin); 2, 5, 9. whole cell protein with IPIG-induced BL21(pET32a); 3, 6, 8. whole cell protein with IPTG-induced BL21 (pET32a-Pearlin) (1~3. pH of medium was 6.0;4~6. pH of medium was 7.0;7~9. pH of medium was 8.0)2.6 pET32a-Pearlin重组蛋白表达所需诱导时间的优化
SDS-PAGE电泳结果表明(图 6),IPTG终浓度为1.0 mmol·L-1时,随着诱导时间的增长,蛋白表达量也随之提高。但在4~6 h蛋白表达量变化不大。所以诱导pET32a-Pearlin蛋白表达的最佳时长为2~4 h。
![]() 图 6 不同诱导时间下pET32a-Pearlin表达产物的SDS-PAGE分析0. 未经IPTG诱导的BL21(pET32a-Pearlin)全菌蛋白;P. IPTG诱导的BL21(pET32a)全菌蛋白;M. 蛋白质分子质量标准Marker;1~6. IPTG分别诱导1 h、2 h、3 h、4 h、5 h、6 h后的BL21(pET32a-Pearlin)全菌蛋白Figure 6. SDS-PAGE analysis of pET32a-Pearlin expression products with different induction time0. whole cell protein without IPIG-induced BL21 (pET32a-Pearlin); P. whole cell protein with IPIG-induced BL21(pET32a); M. protein molecular weight standard; 1~6. whole cell protein BL21 (pET32a-Pearlin) with IPTG induction time of 1 h, 2 h, 3 h, 4 h, 5 h and 6 h, respectively.
图 6 不同诱导时间下pET32a-Pearlin表达产物的SDS-PAGE分析0. 未经IPTG诱导的BL21(pET32a-Pearlin)全菌蛋白;P. IPTG诱导的BL21(pET32a)全菌蛋白;M. 蛋白质分子质量标准Marker;1~6. IPTG分别诱导1 h、2 h、3 h、4 h、5 h、6 h后的BL21(pET32a-Pearlin)全菌蛋白Figure 6. SDS-PAGE analysis of pET32a-Pearlin expression products with different induction time0. whole cell protein without IPIG-induced BL21 (pET32a-Pearlin); P. whole cell protein with IPIG-induced BL21(pET32a); M. protein molecular weight standard; 1~6. whole cell protein BL21 (pET32a-Pearlin) with IPTG induction time of 1 h, 2 h, 3 h, 4 h, 5 h and 6 h, respectively.2.7 pET32a-Pearlin重组蛋白表达诱导时机的优化
转接pET32a-Pearlin 2~4 h后加IPTG诱导蛋白表达,SDS-PAGE电泳显示见图 7。在同样的诱导时间(6 h)下,转接2 h后再进行诱导表达的蛋白表达量远不如转接3~4 h再进行IPTG诱导的表达量。
![]() 图 7 不同诱导时机下pET32a-Pearlin表达产物的SDS-PAGE分析0. 未经iptg诱导的bl21(pet32a-pearlin)全菌蛋白;p. iptg诱导的bl21(pet32a)全菌蛋白;m. 蛋白质分子质量标准marker;1~3. 分别培养了2 h、3 h、4 h的pet32a-pearlin菌液经iptg诱导6 h后的bl21(pet32a-pearlin)全菌蛋白Figure 7. SDS-PAGE analysis of pET32a-Pearlin expression product with different induction timing0. whole cell protein without IPIG-induced BL21 (pET32a-Pearlin); P. whole cell protein with IPIG-induced BL21 (pET32a); M. protein molecular weight standard; 1~3. whole cell protein BL21 (pET32a-Pearlin) with induction of 2 h, 3 h and 4 h, respectively.
图 7 不同诱导时机下pET32a-Pearlin表达产物的SDS-PAGE分析0. 未经iptg诱导的bl21(pet32a-pearlin)全菌蛋白;p. iptg诱导的bl21(pet32a)全菌蛋白;m. 蛋白质分子质量标准marker;1~3. 分别培养了2 h、3 h、4 h的pet32a-pearlin菌液经iptg诱导6 h后的bl21(pet32a-pearlin)全菌蛋白Figure 7. SDS-PAGE analysis of pET32a-Pearlin expression product with different induction timing0. whole cell protein without IPIG-induced BL21 (pET32a-Pearlin); P. whole cell protein with IPIG-induced BL21 (pET32a); M. protein molecular weight standard; 1~3. whole cell protein BL21 (pET32a-Pearlin) with induction of 2 h, 3 h and 4 h, respectively.2.8 重组蛋白pET32a-Pearlin的可溶性检测
把工程菌BL21(pET32a-Pearlin)经超声波破碎后的沉淀和上清进行SDS-PAGE,在不同的诱导温度及诱导时间下,融合蛋白pET32a-Pearlin都主要以包涵体形式存在,极少部分存在于上清中(图 8)。根据《pET System Manual》建议,pET系统能很容易地通过降低诱导物的浓度来削弱蛋白表达,并且降低表达水平可能可以提高某些目的蛋白的可溶部分产量,所以调整IPTG诱导浓度为0.8 mmol·L-1。
![]() 图 8 融合蛋白pET32a-Pearlin的存在形式M. 蛋白质分子质量标准Marker;1. 未经IPTG诱导的BL21 (pET32a-Pearlin)在16 ℃表达菌体裂解液上清;2. 未经IPTG诱导的BL21(pET32a-Pearlin)菌体在16 ℃表达裂解液沉淀;3、5、7. IPTG诱导的BL21(pET32a-Pearlin)分别在16 ℃、28 ℃、37 ℃表达菌体裂解液上清;4、6、8、9. IPTG诱导的BL21(pET32a-Pearlin分别)在16 ℃、28 ℃、37 ℃表达菌体裂解液沉淀Figure 8. Form of fusion protein pET32a-PearlinM. protein molecular weight standard; 1. bacteria pyrolysis liquid supernatant of BL21(pET32a-Pearlin) without IPIG-induced at 16 ℃; 2. bacteria pyrolysis liquid precipitation of BL21 (pET32a-Pearlin) without IPIG-induced at 16 ℃; 3, 5, 7. bacteria pyrolysis liquid supernatant of BL21 (pET32a-Pearlin) IPIG-induced at 16 ℃, 28 ℃ and 37 ℃, respectively; 4, 6, 8, 9. bacteria pyrolysis liquid precipitation of BL21 (pET32a-Pearlin) IPIG-induced at 16 ℃, 28 ℃ and 37 ℃, respectively.
图 8 融合蛋白pET32a-Pearlin的存在形式M. 蛋白质分子质量标准Marker;1. 未经IPTG诱导的BL21 (pET32a-Pearlin)在16 ℃表达菌体裂解液上清;2. 未经IPTG诱导的BL21(pET32a-Pearlin)菌体在16 ℃表达裂解液沉淀;3、5、7. IPTG诱导的BL21(pET32a-Pearlin)分别在16 ℃、28 ℃、37 ℃表达菌体裂解液上清;4、6、8、9. IPTG诱导的BL21(pET32a-Pearlin分别)在16 ℃、28 ℃、37 ℃表达菌体裂解液沉淀Figure 8. Form of fusion protein pET32a-PearlinM. protein molecular weight standard; 1. bacteria pyrolysis liquid supernatant of BL21(pET32a-Pearlin) without IPIG-induced at 16 ℃; 2. bacteria pyrolysis liquid precipitation of BL21 (pET32a-Pearlin) without IPIG-induced at 16 ℃; 3, 5, 7. bacteria pyrolysis liquid supernatant of BL21 (pET32a-Pearlin) IPIG-induced at 16 ℃, 28 ℃ and 37 ℃, respectively; 4, 6, 8, 9. bacteria pyrolysis liquid precipitation of BL21 (pET32a-Pearlin) IPIG-induced at 16 ℃, 28 ℃ and 37 ℃, respectively.3. 讨论
目前中国珍珠生产过程中普遍存在珍珠品质下降的问题,严重制约了珍珠产业的可持续发展。然而珍珠形成的分子机理目前尚不清楚,相关的研究也还处于起步阶段。由于贝壳和珍珠在微观结构和化学组成上被认为是相同的物质,学者们普遍认为通过贝壳形成机理的研究可以阐明珍珠的形成机理[20-21]。贝壳和珍珠都是在基质蛋白的指导下形成,展开对壳基质蛋白的研究对揭示珍珠形成机理尤为重要。珍珠质形成基因的高表达与棱柱层形成基因的低表达有利于提高珍珠的品质,所以对珍珠层形成相关蛋白进行研究对珍珠品质的提升意义重大[22-25]。
随着分子克隆技术的普遍应用,大量有价值的蛋白在大肠杆菌中获得高效表达。而珍珠层壳基质蛋白Pearlin在贝壳和珍珠矿化结构中含量很低,用传统的生化分离技术很难大量获得。利用DNA重组技术在大肠杆菌中进行原核表达,为大量获得此类有价值的蛋白因子提供了可能性。外源目的基因在大肠杆菌中的表达量受诱导表达条件的影响较大[26]。因此,对不同的目的基因必须对其诱导条件进行优化,寻找适宜的表达条件,才能获得最大程度的表达。该研究采用单因子实验方法,通过SDS-PAGE电泳图谱分析表达条件如IPTG诱导浓度、培养温度、培养基pH及IPTG诱导时间、时机等因素对pET32a-Pearlin基因工程重组菌表达的影响。结果表明重组融合蛋白pET32a-Pearlin在IPTG诱导终浓度大于0.6 mmol·L-1后目的蛋白表达量不会继续升高。在IPTG终浓度为1.0 mmol·L-1,相同诱导时间(6 h)下,37 ℃表达蛋白最多。大肠杆菌生长的最适pH为6.8~7.6,有报道指出表达外源蛋白的最佳pH约为7.0[27],但该研究中重组蛋白在pH分别为6.0、7.0、8.0的培养基中表达量变化不大,原因可能是稍偏酸或碱的环境都有利于重组融合蛋白pET32a-Pearlin的表达。在IPTG诱导浓度一定的条件下,诱导4~6 h时蛋白表达量最多。在IPTG诱导浓度和诱导时间一定的条件下,在转接3~4 h后进行IPTG诱导蛋白表达量较理想。以上结果为重组蛋白pET32a-Pearlin的生产制备奠定了重要基础。
在整个研究过程中笔者发现,无论低温过夜诱导(16 ℃,16~18 h)还是改变诱导剂(IPTG)浓度等措施均不能实现融合蛋白pET32a-Pearlin由包涵体转向可溶性蛋白表达。这可能是由于表达水平过高导致蛋白合成速度过快,致使蛋白没有足够时间进行折叠、二硫键不能正确配对,同时还会导致蛋白间的非特异性结合增加,致蛋白无法达到原有的溶解度,最终形成不可溶的失去原始空间结构的包涵体[28-30]。
-
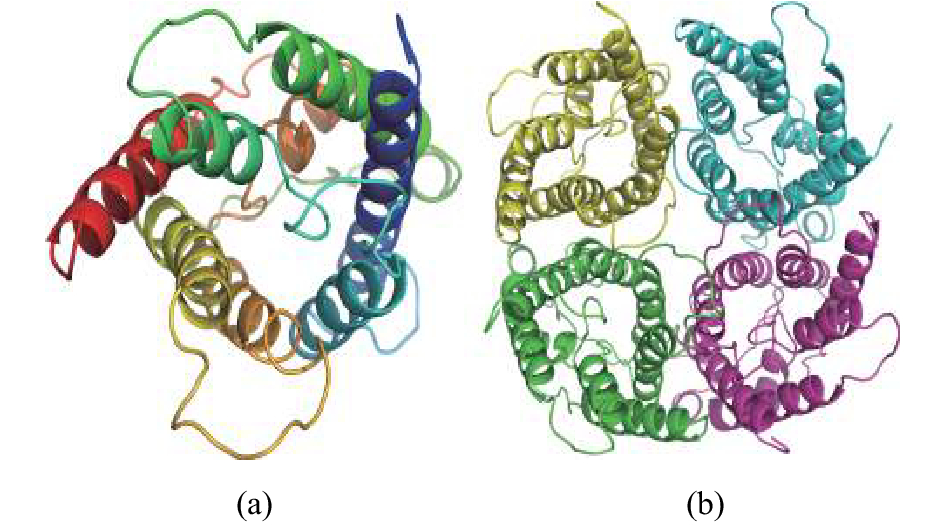
图 1 AQP1a的cDNA序列及预测的氨基酸序列
起始密码子ATG在细线方框内,终止密码子以*表示;糖基化位点用灰色阴影表示;蛋白激酶A用直线下划线表示;蛋白激酶C加波浪线表示;胰岛素受体用间断下划线表示;细胞周期蛋白依赖性激酶用双下划线表示
Figure 1. Full cDNA sequence and predicted amino acid sequence of AQP1a
The start codon (ATG) is marked with box, and the stop codon is marked with an asterisk. The glycosylation sites are shown in shadow. The protein kinase A is underlined. The protein kinase C is wavy underlined. The insulin receptor is discontinuous underlined. The cyclin-dependent kinases is double underlined.
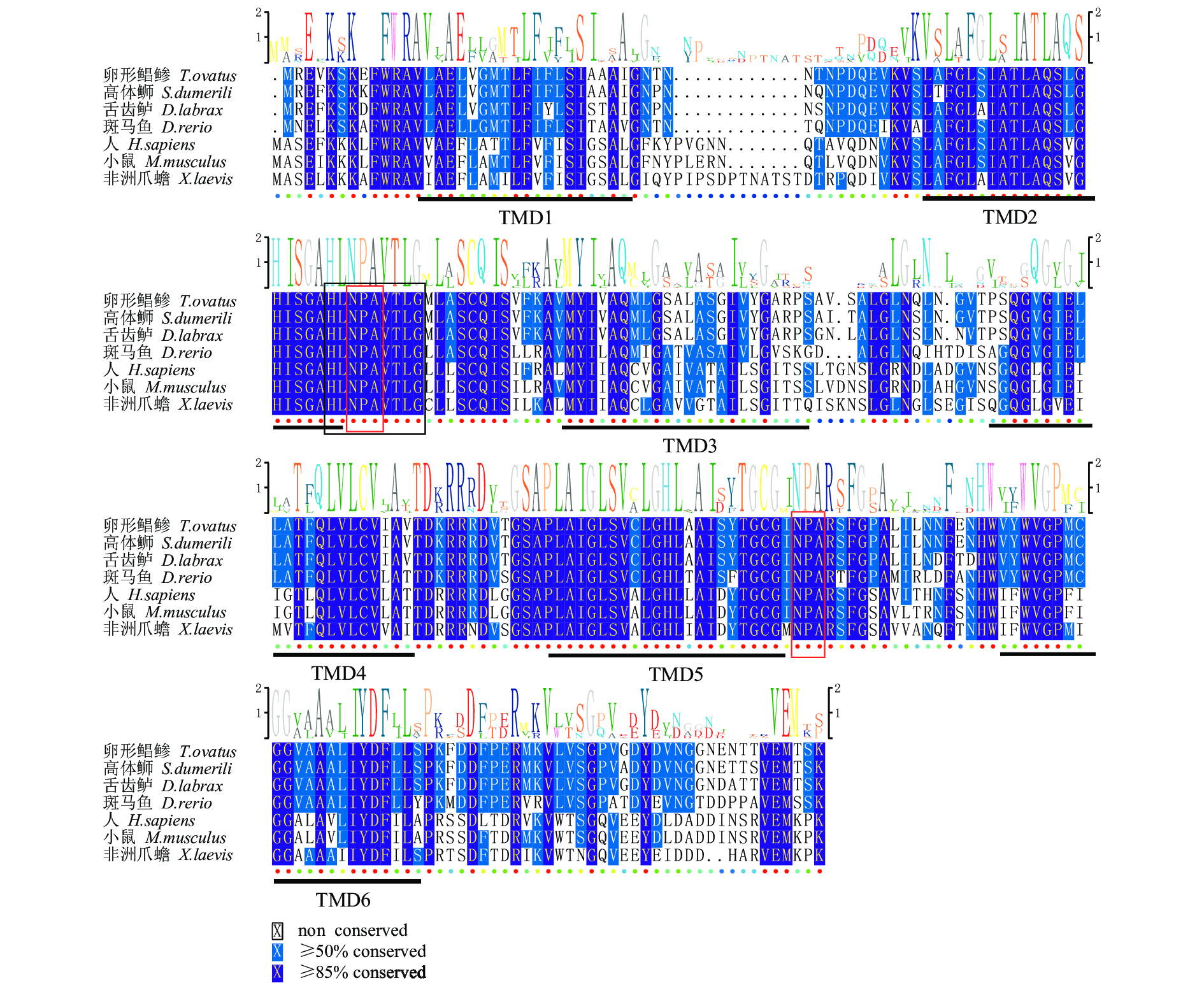
图 3 卵形鲳鲹AQP1a氨基酸序列与其他物种氨基酸对比
下横线为6个跨膜结构域(TMD1~6);红框为天冬酰胺–脯氨酸–丙氨酸(NPA)基序;黑框为MIP家族特有的保守序列HINPAVTLG;各物种AQP1a的序列号:高体 (XP_022613743.1);舌齿鲈(ABI95464.2);斑马鱼(NP_996942.1);非洲爪蟾(NP_001085391.1);小鼠(EDK98728.1);人(CAQ51480.2)
Figure 3. Alignment of amino acid sequence of T.ovatus AQP1a in comparison with those of other species
Horizontal lines indicate six predicted transmembrane helical structure (TMD1–6); red box indicates the structural characteristics of asparagine-proline-alanine (NPA) motifs; black box indicates the unique conserved sequence of the MIP family: HINPAVTLG; the AQP1a sequence No. of each species: S. dumerili (XP_022613743.1) ; D.labrax (ABI95464.2); D.rerio (NP_996942.1); X.laevis (NP_001085391.1); M.musculus (EDK98728.1); H.sapiens (CAQ51480.2)
图 7 鳃、肾和肠中AQP1a在急性盐度胁迫后时空表达
EF-1α为内参基因;*. 差异显著(P<0.05);**. 差异极显著(P<0.01);0 h为空白对照
Figure 7. Spatiotemporal expression of AQP1ɑ in gill, kidney and intestine after acute salinity stress
EF-1α expression was used as an internal control for real-time PCR; *. significant difference at P<0.05; **. very significant difference at P<0.01. The untreated (0 h) group was used as the control.
表 1 实验所用引物
Table 1 Primer sequences used in this study
引物
primer引物序列 (5′–3′)
primer sequence用途
applicationAQP1a-F
AQP1a-RAAACCCAGACCAAGAGGTGAAG
TGCTGCTACACCACCGCACATT验证开放阅读框 AQP1a-qF
AQP1a-qRAGTTACCCTCGGGATGCTTGC
GCTGCTACACCACCGCACATT实时荧光定量 PCR EF-1α-F
EF-1α-RCCCCTTGGTCGTTTTGCC
GCCTTGGTTGTCTTTCCGCTA内参基因 表 2 卵形鲳鲹AQP1a氨基酸与其他物种的同源性
Table 2 Homology of AQP1a amino acids of T.ovatus to other species
1 2 3 4 5 6 7 1 卵形鲳鲹 T.ovatus 100 2 高体 S.dumerili 95.7 100 3舌齿鲈 D.labrax 93.1 93.1 100 4 斑马鱼 D.rerio 76.7 75.9 75.1 100 5 人 H.sapiens 59.1 58.3 56.8 57.6 100 6 小鼠 M.musculus 60.2 58.7 57.2 58.3 94.0 100 7 非洲爪蟾 X.laevis 56.8 56.1 56.1 56.5 73.5 74.2 100 表 3 构建系统进化树的物种
Table 3 Species used in phylogenetic tree
物种
species基因
gene登录号
accession No.舌齿鲈 D.labrax AQP1 ABI95464.2 攀鲈 A.testudineus AQP1a AGF30363.1 欧洲鳗鲡 A.anguilla AQP1a CAD92027.1 欧洲鳗鲡 A.anguilla AQP1b ABM26906.1 暗纹东方鲀 T.obscurus AQP1 ADG86337.1 大西洋鲑 S.salar AQP1b NP_001133472.1 黄尾 S. dorsalis AQP1 XP_023259499.1 日本鳗鲡 A.japonica AQP1a BAC82109.1 日本鳗鲡 A.japonica AQP1b BAK53383.1 青鳉 O.dancena AQP1 BAN17349.1 金头鲷 S.aurata AQP1a ABM26907.1 金头鲷 S.aurata AQP1b ABM26908.1 鲤 Cyprinus carpio AQP1 BAS18938.1 平鲷 R.sarba AQP1 AEG78286.1 胡瓜鱼 O.mordax AQP1 ACO09149.1 黑鲷 A.schlegelii AQP1 ABO38816.1 人 H.sapiens AQP1 CAQ51480.2 小鼠 M.musculus AQP1 EDK98728.1 -
[1] AN K W, KIM N N, CHOI C Y. Cloning and expression of aquaporin 1 and arginine vasotocin receptor mRNA from the black porgy, Acanthopagrus schlegeli: effect of freshwater acclimation[J]. Fish Physiol Biochem, 2008, 34(2): 185-194.
[2] CHNG Y R, ONG J L, CHING B, et al. Molecular characterization of aquaporin 1 and aquaporin 3 from the gills of the African lungfish, Protopterus annectens, and changes in their branchial mRNA expression levels and protein abundance during three phases of aestivation[J]. Front Physiol, 2016, 7: 532.
[3] ABASCAL F, IRISARRI I, ZARDOYA R. Diversity and evolution of membrane intrinsic proteins[J]. Biochim Biophys Acta, 2014, 1840(5): 1468-1481.
[4] FINN R N, CERDÀ J. Evolution and functional diversity of aquaporins[J]. Biol Bull, 2015, 229(1): 6-23.
[5] AGRE P, SASAKI S, CHRISPEELS M J. Aquaporins: a family of water channel proteins[J]. Am J Physiol, 1993, 265(3 Pt 2): F461.
[6] TINGAUD-SEQUEIRA A, CHAUVIGNÉ F, FABRA M, et al. Structural and functional divergence of two fish aquaporin-1 water channels following teleost-specific gene duplication[J]. BMC Evol Biol, 2008, 8(1): 259.
[7] CHEN L M, ZHAO J, MUSA-AZIZ R, et al. Cloning and characterization of a zebrafish homologue of human AQP1: a bifunctional water and gas channel[J]. Am J Physiol Regul Integr Comp Physiol, 2010, 299(5): R1163-R1174.
[8] DEANE E E, LUK J C Y, WOO N Y S. Aquaporin 1a expression in gill, intestine, and kidney of the euryhaline silver sea bream[J]. Front Physiol, 2011, 2: 39.
[9] GUO H, WEI M, LIU Y, et al. Molecular cloning and expression analysis of the aqp1aa gene in half-smooth tongue sole (Cynoglossus semilaevis)[J]. PLoS One, 2017, 12(4): e175033.
[10] TIPSMARK C K, SØRENSEN K J, MADSEN S S. Aquaporin expression dynamics in osmoregulatory tissues of Atlantic salmon during smoltification and seawater acclimation[J]. J Exp Biol, 2010, 213(3): 368-379.
[11] MARTINEZ A S, CUTLER C P, WILSON G D, et al. Regulation of expression of two aquaporin homologs in the intestine of the European eel: effects of seawater acclimation and cortisol treatment[J]. Am J Physiol Regul Integr Comp Physiol, 2005, 288(6): R1733-R1743.
[12] JEONG S Y, KIM J H, LEE W O, et al. Salinity changes in the anadromous river pufferfish, Takifugu obscurus, mediate gene regulation[J]. Fish Physiol Biochem, 2014, 40(1): 205-219.
[13] KIM Y K, LEE S Y, KIM B S, et al. Isolation and mRNA expression analysis of aquaporin isoforms in marine medaka Oryzias dancena, a euryhaline teleost[J]. Comp Biochem Physiol A, 2014, 171(5): 1-8.
[14] IP Y K, SOH M M, CHEN X L, et al. Molecular characterization of branchial aquaporin 1aa and effects of seawater acclimation, emersion or ammonia exposure on its mRNA expression in the gills, gut, kidney and skin of the freshwater climbing perch, Anabas testudineus[J]. PLoS One, 2013, 8(4): e61163.
[15] GIFFARD-MENA I, BOULO V, AUJOULAT F, et al. Aquaporin molecular characterization in the sea-bass (Dicentrarchus labrax): the effect of salinity on AQP1 and AQP3 expression[J]. Comp Biochem Physiol A, 2007, 148(2): 430-444.
[16] 于文博, 朱克诚, 郭华阳, 等. 卵形鲳鲹MHCⅡβ基因的克隆与表达分析[J]. 南方水产科学, 2017, 13(4): 69-79. [17] GEYER R R, MUSA-AZIZ R, QIN X, et al. Relative CO(2)/NH(3) selectivity's of mammalian aquaporins 0-9[J]. Am J Physiol Cell Physiol, 2013, 304(10): C985-C994.
[18] FINN R N, CHAUVIGNÉ F, HLIDBERG J B, et al. The lineage-specific evolution of aquaporin gene clusters facilitated tetrapod terrestrial adaptation[J]. PLoS One, 2014, 9(11): e113686.
[19] KONG Y, MA J. Dynamic mechanisms of the membrane water channel aquaporin-1(AQP1)[J]. Proc Natl Acad Sci USA, 2001, 98(25): 14345-14349.
[20] FUJIYOSHI Y, MITSUOKA K, de GROOT B L, et al. Structure and function of water channels[J]. Curr Opin Struct Biol, 2002, 12(4): 509-515.
[21] De GROOT B L, GRUBMÜLLER H. Water permeation across biological membranes: mechanism and dynamics of aquaporin-1 and GlpF[J]. Science, 2001, 294(5550): 2353-2357.
[22] BEITZ E, WU B, HOLM L M, et al. Point mutations in the aromatic/arginine region in aquaporin 1 allow passage of urea, glycerol, ammonia, and protons[J]. Proc Natl Acad Sci USA, 2006, 103(2): 269-274.
[23] 姜勇, 麻彤辉. NPA motif在水通道蛋白AQP1表达和转水功能中的重要性[J]. 科学通报, 2007, 52(4): 426-431. [24] WALZ T, HIRAI T, MURATA K, et al. The three-dimensional structure of aquaporin-1[J]. Nature, 1997, 387(6633): 624-627.
[25] 丁炜东. 黄鳝性别分化相关候选基因的筛选及相关功能研究[D]. 南京: 南京农业大学, 2016: 76-83 [26] 姚小皓, 李学军. 水孔蛋白1的结构与功能[J]. 生理科学进展, 2000, 31(4): 345-348. [27] BOJ M, CHAUVIGNÃ F, ZAPATER C, et al. Gonadotropin-activated androgen-dependent and independent pathways regulate aquaporin expression during teleost (Sparus aurata) spermatogenesis[J]. PLoS One, 2015, 10(11): e0142512.
[28] AOKI M, KANEKO T, KATOH F, et al. Intestinal water absorption through aquaporin 1 expressed in the apical membrane of mucosal epithelial cells in seawater-adapted Japanese eel[J]. J Exp Biol, 2003, 206(19): 3495-3505.
[29] 丁炜东, 曹丽萍, 曹哲明, 等. 黄鳝AQP1 cDNA的克隆与表达分析[J]. 华北农学报, 2012, 27(S1): 6-11. [30] SANG Y L, NAM Y K, YI K K. Characterization and expression profiles of aquaporins (AQPs) 1a and 3a in mud loach Misgurnus mizolepis after experimental challenges[J]. Fish Aquat Sci, 2017, 20(1): 23.
[31] 王美垚, 杨健, 徐跑, 等. 刀鲚水通道蛋白1的分子克隆及高盐作用下的表达分析[J]. 中国水产科学, 2017, 24(3): 449-458.



 下载:
下载:









 粤公网安备 44010502001741号
粤公网安备 44010502001741号
