Content and distribution characteristics of petroleum hydrocarbons in Daya Bay waters and sediments
-
摘要: 为探讨大亚湾海域水体和沉积物中石油烃的含量及其分布特征,2015年4月(春季)、8月(夏季)、10月(秋季)和12月(冬季)对大亚湾海域的石油烃进行了4个季度调查。结果显示,大亚湾表层水体石油烃质量浓度为0.005~0.268 mg·L–1,均值为0.067 mg·L–1,水质为国家三类海水,平均污染指数(Pi)为1.34,水体已经受到石油烃的污染。水体中石油烃的分布主要受湾内顺时针方向水平环流的影响,春季石油烃的高值区位于湾内东部海域,夏季位于湾内南部海域,秋季位于湾内西南部海域,冬季则位于湾内北部海域。表层沉积物中石油烃质量分数为7~559 mg·kg–1,均值为183.4 mg·kg–1,平均Pi为0.367,表明大亚湾表层沉积物除了A9站位受污染之外,整体未受石油烃污染。表层沉积物中石油烃呈点源分布,高值区位于中央列岛区、南澳镇东北海域以及大辣甲东面海域,主要分布于石化排污区、进港航道和油码头附近。Abstract: We investigated the content and distribution characteristics of petroleum hydrocarbon in Daya Bay waters and sediments in spring, summer, autumn and winter of 2015. The mass concentrations of petroleum in surface waters ranged from 0.005 mg·L–1 to 0.268 mg·L–1 (average: 0.067 mg·L–1). According to the National Seawater Standard, the water quality was at Grade Ⅲ. The average pollution index (Pi) was 1.34, indicating that the seawater had been polluted by petroleum hydrocarbons. The distribution of petroleum hydrocarbons in surface waters was mainly affected by the horizontal clockwise circulation. The petroleum hydrocarbons high value area was located in the eastern part in spring, southern part in summer, southwest in autumn and northern part in winter. The range of petroleum hydrocarbons mass fraction in surface sediments was 7−559 mg·kg–1 (average:183.4 mg·kg–1). The average Pi was 0.367, indicating that the surface sediments in Daya Bay were not polluted by petroleum hydrocarbon, except Station A9. Petroleum hydrocarbon was a point source in surface sediments, and the high value area was located in the central archipelagic region, northeastern Nan'ao Town and eastern Dalajia Island, and all of those areas were distributed in the petrochemical sewage area, near the channel and the petroleum terminal.
-
Keywords:
- Daya Bay /
- sediments /
- petroleum hydrocarbon /
- petroleum pollution index
-
大亚湾是中国亚热带海洋生物种质资源库和华南沿海重要的渔业水域[1]。自20世纪80年代后期开始,大亚湾经济发展迅速,人类活动日益频繁,核电工业建设和运营、工农业污水排放、石化产业、港口物流业及2006年以中海壳牌石化项目为龙头的大亚湾石化工业区建设等,导致排海石化污水的污染物迅速增加,使得石油烃成为环境的主要潜在污染物之一。石油烃的成分十分复杂,由多种烷烃、芳烃、烯烃和杂环芳烃等复杂分子结构组成[2]。海洋环境中的石油烃主要来自石油开采、溢油事故、船舶运输、大气沉降和陆源排放等[3-5],人为活动是石油烃进入海洋环境的主要途径,尤其是在近岸及河口区域[6-7]。石油烃进入海洋后,会在海面形成一层厚度不均匀的薄膜,阻碍海气界面间的气体、能量和水分交换,影响浮游植物的光合作用,毒害海洋生物[2]。
Gilde和Pinckney[8]研究结果表明,浮游植物的生物量(如叶绿素a)随着石油浓度的增加而下降;长丝异鳃鲶(Heterobranchus longifilis)的受精卵和幼体在水体中随着石油浓度升高,死亡率增大[9];石油中的有毒物质能够引起银汉鱼(Odontesthes argentinensis)幼体的组织病理学异常[10];水体中的石油烃组分能诱导鳗鲡(Anguilla anguilla)的肝脏发生病变[11]。同时,石油烃内含有的多种难以被微生物降解的致癌物质会通过食物链的传递作用危害人体健康[6,12-13]。尽管有部分石油烃经过蒸发、光化学作用、微生物降解等过程进入大气,但大部分石油烃最终以溶解组分或相应的降解组分存在于海洋中,并且有相当部分通过吸附、絮凝和沉淀作用进入沉积物[14]。由于海底低温、缺氧,底泥中的微生物对沉积物中的石油烃降解速度缓慢,不仅对活动能力较差的各种底栖生物造成短期或长期的毒害,在某些特定环境下,还能够成为水体二次污染的主要“源”[15]。鉴于石油污染是我国近海最主要的污染问题之一,且大亚湾是我国最为重要的水产种质资源宝库之一,因此研究该典型海湾海域水体和沉积物中石油类含量和分布特征显得尤为重要,可为海湾生态环境保护提供数据支持。
1. 材料与方法
1.1 样品采集和分析方法
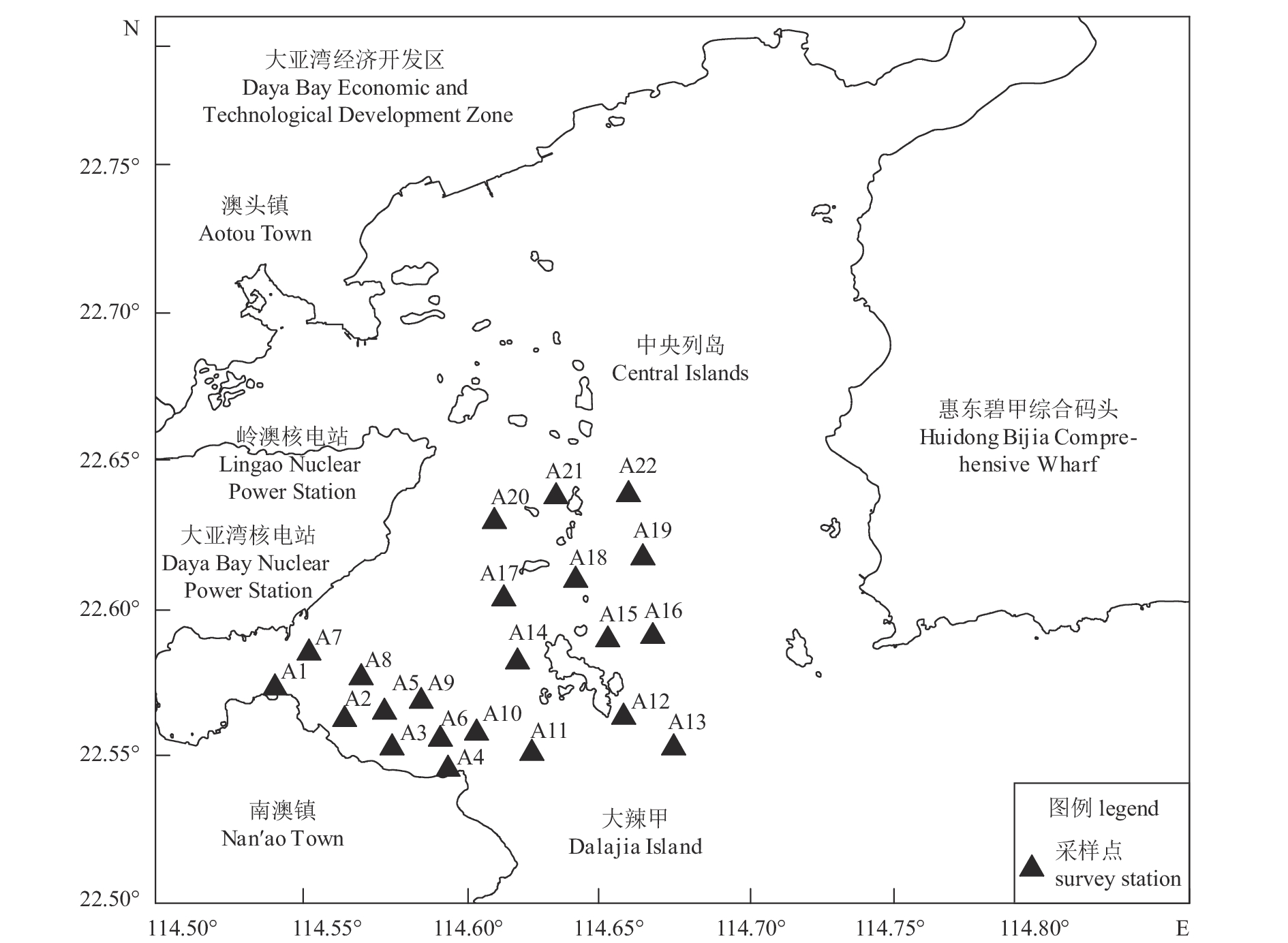
本研究于2015年对大亚湾(114.54°E~114.68°E,22.55°N~22.64°N)进行了4月(春季)、8月(夏季)、10月(秋季)和12月(冬季) 4个航次的调查,共设22个调查站位(图1)。22个站位均采集海水样品,表层沉积物样品仅采集站位A1、A3、A5、A7、A9、A12、A15、A17、A18、A19和A21。样品的采集和分析参照GB 12763.9—2007和GB 17378.7—2007海洋调查规范进行。海水石油烃采用抛浮式无油采水器采集表层(0.5 m)海水,取500 mL水样于棕色玻璃瓶中,现场立即加入5 mL硫酸(H2SO4,ρ=0.46 mg·L–1)酸化保存,水样带回实验室经正己烷萃取后,以油标准做参比,采用岛津UV-2501紫外分光光度仪测定石油烃质量浓度,最低检出限为3.5×10–3 mg·L–1。表层沉积物用抓斗式采泥器采集,取其中央未受干扰的表层0~5 cm泥样,冷藏密封保存,运送回实验室。沉积物样品在室温下自然风干,去除碎石等杂物,研磨粉碎后过160目筛,正己烷萃取,用硫酸钠(Na2SO4)洗涤萃取液,弃去水相。沉积物中石油烃的含量采用紫外分光光度法进行分析测定,测定仪器为紫外可见分光光度计YQ-122,最低检出限为3.0 mg·kg–1。油标由国家海洋环境监测中心提供。
1.2 数据处理与评价方法
1.2.1 数据处理
水体和沉积物中石油烃的平面分布图使用Surfer 12.0软件(Golden Software,美国)绘制,统计分析使用SPSS 19.0。
1.2.2 评价方法
分别以GB 3097—1997 海水水质标准一(二)类标准和GB 18668—2002海洋沉积物质量标准一类标准作为评价标准,采用单因子污染指数评价法对大亚湾的水体和表层沉积物中石油烃质量进行评价。评价公式[16]为:
$$\quad\quad\quad\quad\quad\quad\quad \quad\quad P_i = C_i/S_i$$ (1) Pi为评价因子的污染指数,Ci为评价因子的实测浓度值,Si为GB 3097—1997海水水质标准和GB 18668—2002海洋沉积物质量标准第一类石油类含量的限定值(分别为0.05 mg·L–1和500.0 mg·kg–1)。以Pi=1.0作为该因子是否对环境产生污染的分界线,Pi>1.0表明环境已经受到该因子污染;0.5<Pi<1.0表明环境受到该因子污染;Pi<0.5表明环境未受到该因子污染[6]。
2. 结果
2.1 表层水体中石油烃变化特征
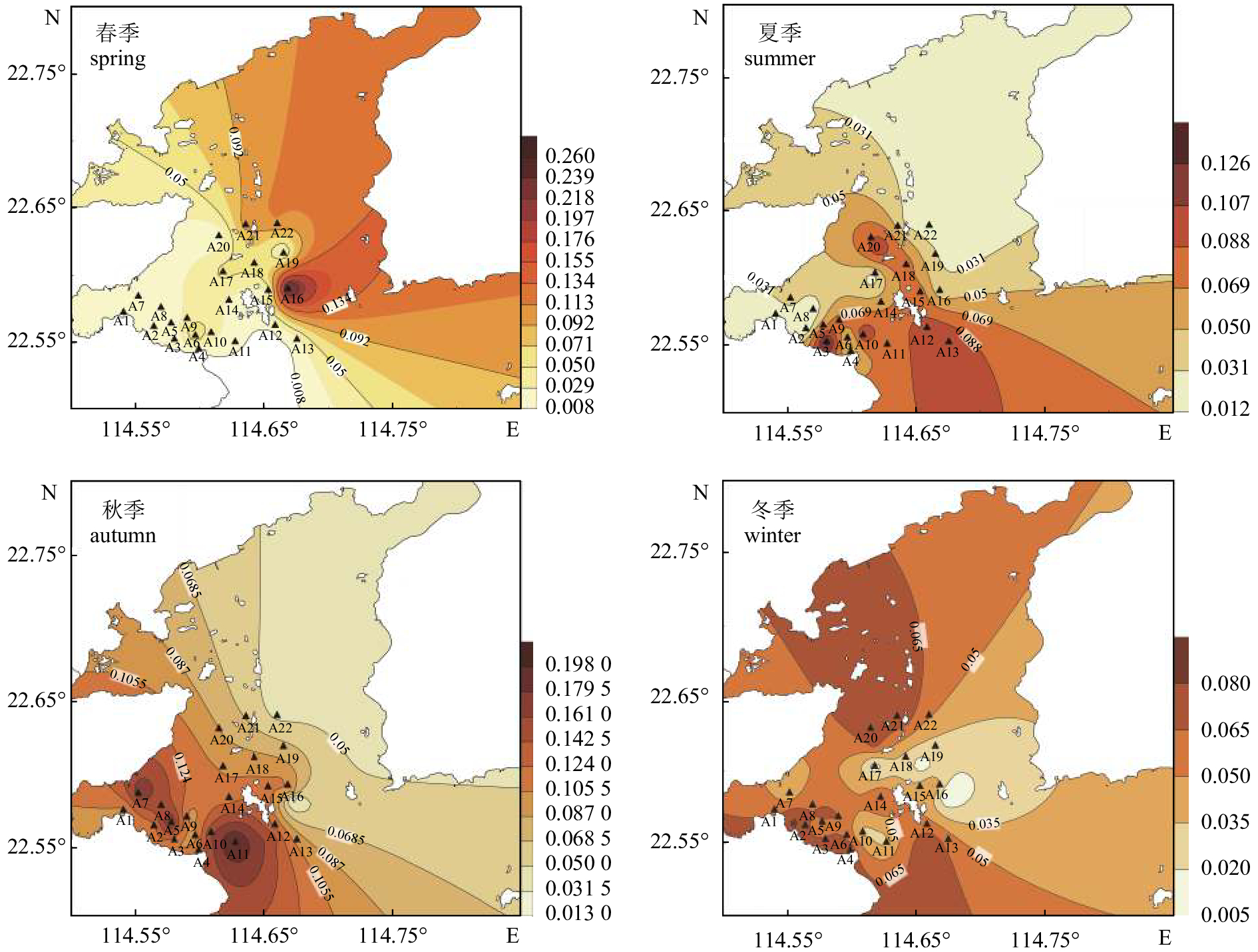
大亚湾海水中的石油烃质量浓度为0.008~0.268 mg·L–1,均值为0.067 mg·L–1,呈现显著季节变化(秋季>夏季>冬季>春季)。Bonferroni (B)多重检验结果显示,秋季与其他三季呈显著差异(P<0.05),其他季节之间差异不显著。四季的石油烃污染核心区由湾口向湾内呈顺时针分布(图2)。四季石油烃平均Pi为1.34,超出国家一(二)类海水水质标准(GB 3097—1997海水水质标准),属于三类海水水质,水体已经受到石油烃污染。
春季水体石油烃质量浓度为0.008~0.268 mg·L–1,均值为0.047 mg·L–1,标准差为0.057。最大值出现在大辣甲东面的A16站位,最小值出现在南澳镇沿岸A4站位,呈东高西低的分布规律。春季平均Pi为0.94 (>0.5),超标率 (>0.05 mg·L–1)为27%,水体受到石油烃污染(表1)。
表 1 大亚湾表层海水石油烃浓度的季节变化Table 1 Seasonal variation of petroleum hydrocarbons in surface waters of Daya Bay季节
season质量浓度/mg·L–1
mass concentration平均值/mg·L–1
average污染指数
pollution index平均污染指数
average pollution index超标率 (>0.05 mg·L–1)/%
over-standard percentage春季 spring 0.008~0.268 0.047 0.160~5.360 0.940 27.27 夏季 summer 0.012~0.143 0.060 0.240~2.860 1.200 50.00 秋季 autumn 0.013~0.201 0.112 2.600~4.020 2.240 86.36 冬季 winter 0.005~0.084 0.049 0.100~1.680 0.980 54.55 夏季石油烃质量浓度为0.012~0.143 mg·L–1,均值为0.060 mg·L–1,标准差为0.037。最大值在南澳镇沿岸A3站位,最小值在其西侧A2站位。夏季大亚湾海水中石油烃遵循从湾内到湾外逐渐升高的分布规律。夏季平均Pi为1.2 (>0.5),超标率(>0.05 mg·L–1)为50%,水体已经受到石油烃污染(表1)。
秋季石油烃整体水平较高,质量浓度为0.013~0.201 mg·L–1,均值为0.112 mg·L–1,标准差为0.049。最大值在大辣甲南面A11站位,最小值在A16站位。石油烃的平面分布规律与春季相反,呈西高东低的分布规律。秋季平均Pi为2.24 (>0.5),超标率(>0.05 mg·L–1)高达86%,石油烃污染现象严重(表1)。
冬季石油烃质量浓度为0.005~0.084 mg·L–1,均值为0.049 mg·L–1,标准差为0.027。最大值在A2站位,最小值在A16站位。石油烃呈湾顶、湾内西部和湾口高,湾东部低的分布规律。冬季平均Pi为0.98 (>0.5),超标率(>0.05 mg·L–1)为55%,水体受到石油烃污染(表1)。
2.2 表层沉积物中石油烃变化特征
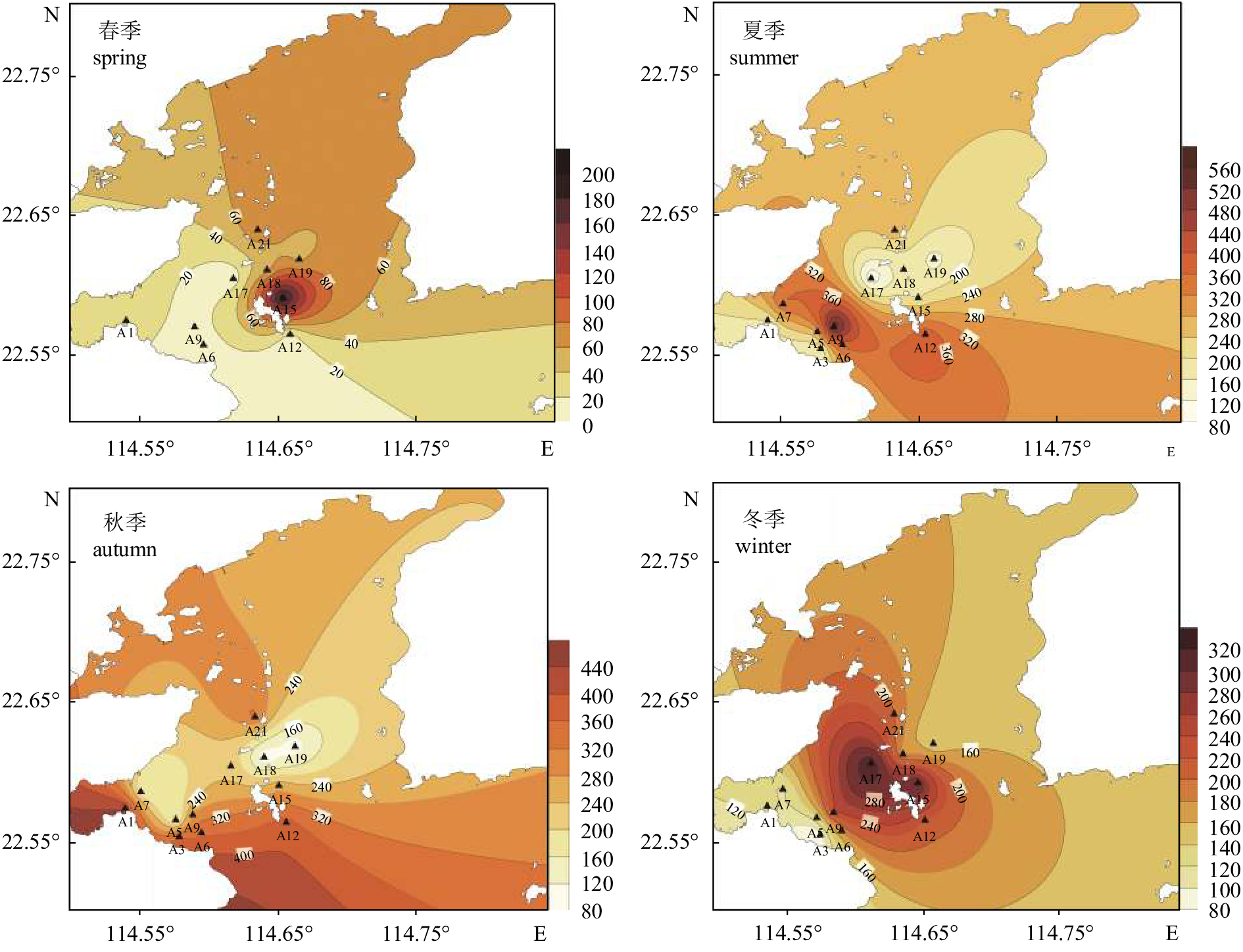
大亚湾表层沉积物中石油烃质量分数为7~559 mg·kg–1,均值为183.4 mg·kg–1。Bonferroni多重检验表明,石油烃含量在夏、秋、冬季节变化差别不显著,春季因缺少A3、A5和A7站位数据,导致与另外三季相差较为显著。石油烃的高值区集中在大鹏澳海域A9站位,大辣甲东面的A12、A15站位以及中央列岛区A21站位。总体上石油烃平面分布呈湾口高湾内低、湾中部高两侧低的格局(图3)。表层沉积物油Pi为0.376,未超出国家一类海洋沉积物质量标准(GB 18668—2002),沉积物并未受到石油烃污染(表2)。
表 2 大亚湾表层沉积物中石油烃含量的季节变化Table 2 Seasonal variation of petroleum hydrocarbons in surface sediments of Daya Bay季节
season质量分数/mg·kg–1
mass fraction平均值/mg·kg–1
average污染指数
pollution index平均污染指数
average pollution index超标率 (>500 mg·kg–1)/%
over-standard percentage春季 spring 7~202 51.300 0.014~0.404 0.103 0 夏季 summer 85.3~559 258.027 0.170 6~1.118 0.516 9.09 秋季 autumn 85.4~448 254.291 0.170 8~0.896 0.509 0 冬季 winter 84.2~324 187.382 0.168 4~0.648 0.375 0 沉积物中石油烃的平均含量呈现夏季>秋季>冬季>春季的季节分布特征,与水体的分布规律相似,即水体中石油烃含量高,其对应沉积物中石油烃的含量也高。夏季沉积物中的石油烃质量分数为85.3~559 mg·kg–1,均值为258.027 mg·kg–1,超标率(>500 mg·kg–1)为9.09%,平均Pi为0.516,其中A7、A9和A12站位含量较高,A9站位最高,石油烃质量分数为559 mg·kg–1(表2)。秋季石油烃质量分数为85.4~448 mg·kg–1,均值为254.291 mg·kg–1,平均质量分数为187.382 mg·kg–1,平均Pi为0.375;春季(7~202 mg·kg–1)平均质量分数为51.3 mg·kg–1,平均Pi为0.103。春季沉积物中石油烃含量最低,是因为水体中石油烃含量低,所以凝聚、沉降的含量低;另外也是因为春季沉积物缺少A3、A5和A7这3个高值站位,因此整体石油烃含量最低。春、夏、秋、冬季均未超出国家海洋沉积物质量一类标准(表2)。
3. 讨论
3.1 大亚湾海域石油烃的来源
3.1.1 大亚湾水体中石油烃的来源
大亚湾地处亚热带,属于半封闭型海湾。气候受东亚季风控制,夏季盛行西南季风,秋季盛行东北季风,其他月份为转换期,在粤东沿岸流影响下,在湾内形成反气旋式的顺时针方向的水平环流[17]。大亚湾全年平均海水交换率为14.75%[18],水体更新周期为91 d,东南部首先开始交换,污染物浓度最先降低,其次是中东部,然后是范和港和大亚湾西南部,湾顶、哑铃湾、大鹏澳稀释交换最慢[19]。本研究大亚湾四季石油烃浓度大小依次为秋季>夏季>冬季>春季。春季大亚湾海域水体中的石油烃污染源主要在大辣甲东侧(A16站位),此处是南海石化的排污区,且位于马鞭洲进港航道,春季船舶来往最为繁忙,故含油废水排放量大;夏季由于受到湾内顺时针水平环流的影响,石油烃高值区转移至湾口处,同时,夏季是渔业繁忙季节,海上养殖作业频繁,产生较多含油的养殖污水和船舶废水,所以中央列岛水产资源增殖区 (A20站位)和南澳镇沿岸的东山陆地海水养殖区 (A3站位)附近石油烃含量高;秋季由于受到西南季风的后续影响,石油烃转移到大辣甲西侧 (A11站位),并在大鹏镇受到阻拦堆积于大鹏澳海域 (A7和A8站位),又因秋季大鹏澳水体交换速率最慢,且邻近岭澳核电站和大亚湾核电站,核电站排放的含油废水进一步增加了此处石油烃的含量,因此秋季的石油烃含量明显高于春、夏、冬3个季节。秋季大亚湾水体与外海水更新,石油烃经过对流输运与稀释扩散等物理过程,到了冬季浓度降低,并且在水平环流的作用下水体沿着大辣甲西侧向湾顶推进,导致石油烃也随着水体向湾顶转移同时受到稀释,含量降低,使大亚湾海域水体中的石油烃含量整体较低;到了春季,随着水平环流的输运,与外海水的水体交换及降雨量的增大,石油烃进一步稀释,浓度再次降低,为4个季节最低。
3.1.2 大亚湾沉积物中石油烃的来源
大亚湾表层沉积物中石油烃的高值区集中在大鹏澳海域A9站位、大辣甲东面的A12、A15站位及中央列岛区A21站位。秋季大鹏澳水体中的石油烃浓度高,通过凝聚、沉降增加了此处(A9站位)沉积物中石油烃的含量。惠东碧甲综合码头是南海石油化工专用排污区,同时它与大辣甲之间是马鞭洲进港航道,船舶来往频繁,大量排放的石化污水和含油船舶废水增加了A12和A15站位沉积物中石油烃的含量。A21站位在中海壳牌石油化工有限公司的马鞭洲油码头附近,船舶排放的含油洗舱水、机舱水以及意外的泄油事故等都会增加此处沉积物中石油烃的含量。
3.2 大亚湾海域石油烃的污染评价
大亚湾水体石油烃的Pi为0.10~5.36,均值为1.34,表明大亚湾海水总体已受到石油烃污染。而大亚湾表层沉积物除了A9站位污染之外,整体上未受到石油烃的污染,Pi为0.014~1.118,均值为0.367。这可能是因为大亚湾水体石油烃迅速增高并达到石油烃污染水平。20世纪90年代大亚湾海水的石油类含量很低,范围为检测限~0.032 mg·L–1,均值为0.018 mg·L–1[24];2008年大亚湾海域水体中石油烃的质量浓度为0.030~0.069 mg·L–1,均值为0.041 mg·L–1[25];本研究水体中石油烃的质量浓度高达0.067 mg·L–1,较2011—2012年丰、枯水期均值0.077 mg·L–1稍偏低[26],这可能与没调查全年导致整个数值水平升高有关;同样,沉积物中石油烃质量分数(183.4 mg·kg–1)显著高于2010年大亚湾排污区及其邻近区域污染物的调查结果,沉积物中石油烃的质量分数为11~95 mg·kg–1,均值为39.2 mg·kg–1[23],也显著高于2011—2012年的质量分数 (31.3~109.8 mg·kg–1)和均值 (60.4 mg·kg–1)[22]。大亚湾水体受石油类污染正在加剧,刚刚达到或超过污染水平,为保护大亚湾水体环境,需要控制工业和船舶的石油类排放。
大亚湾水体中石油烃的含量虽然低于十年前经济发达的珠江口[25]、长江口[26,34]和山东近海[27],但与近年调查的经济较为发达的胶州湾[27]和内伶仃洋[30]较为接近,同时大亚湾水体中石油烃的含量远高于福建沿岸[33]、东山湾[6]、渤海[32]、湄洲湾[31],也高于国外的众多海湾(除经济特别发达的美国亚历山大港外),这表明大亚湾的石油类污染可能已经非常严重,本研究结果也证实大亚湾海水石油类甚至达到了三类水质标准水平。同时间调查的水体中无机氮、无机磷、溶解氧及化学需氧量均表明大亚湾海水为Ⅰ类水,较2008年[21]和2011—2012年[22]调查的相同指标虽有所增高,但增加幅度很小,这不仅说明大亚湾石油类污染加剧过快,也说明石油类已经成为了大亚湾海水的主要污染物,原因主要与石化项目的开发、工业废水和船舶含油污水的排放有较大关系。南海石化项目排污区实行管道深海排放,排污管道在2006年中海壳牌投产前已建成,一直使用至今。
大亚湾沉积物中石油烃的含量虽然远低于十年前的长江口[12]、珠江口[24]、珠江口广州海域[25]、泉州湾[38]以及厦门港[3]等国内发达地区,但远高于国外的几个海区,特别是高于发达国家的法国和迪拜,表明大亚湾沉积物中存在一定程度的石油烃污染,与本研究结果大亚湾沉积物中的石油烃出现A9站位夏季超标一致;而其余各站位各季节均远低于限定值,处于Ⅰ类标准,未受到石油烃的污染,说明大亚湾沉积物中的石油烃仅在个别位点的某个季节出现污染,可能是水体的运动导致石油类在这一区域聚集。大亚湾沉积物几乎未受到石油烃污染,而水体却污染较为严重,这可能是悬浮颗粒物对水体中的石油烃污染物有着很高的富集系数,两者之间存在正相关关系[44]。沉积物粒度越大,拥有的比表面积越小,絮凝作用越弱[2],大亚湾的沉积物属于黏土,对水体中的石油烃吸附能力弱,加上大亚湾的水体更新速率快,因此,大亚湾水体中的石油烃形成了污染而沉积物并未受到石油烃的污染。
表 3 国内外近海海域水体中石油烃质量浓度比较Table 3 Comparison of petroleum hydrocarbon mass concentrations in water bodies at home and abroad调查海区
survey area质量浓度/mg·L–1
mass concentration平均值/mg·L–1
average参考文献
Reference胶州湾 Jiaozhou Bay 0.025~0.114 0.053 [27] 山东近海 Shandong inshore 0.010~1.890 0.114 [27] 珠江口 Pearl River Estuary 0.020~0.810 0.130 [25] 内伶仃洋 Inner Ling Dingyang 0.039~0.108 0.069 [30] 湄洲湾 Meizhou Bay 0.004~0.342 0.037 [31] 东山湾 Dongshan Bay 0.010~0.060 0.026 [6] 渤海 Bohai Sea 0.004~0.065 0.026 [32] 福建沿岸 Seawater near Fujian 0.005~0.037 0.015 [33] 长江口 Yangtze Estuary 0.006~0.187 0.079 [26, 34] 泰米尔纳德邦海岸 Tamilnadu Coast, India 0.002~0.014 [35] 阿拉伯海湾及阿曼湾 Arabian Gulf and Gulf of Oman 0.002~0.013 [45] 亚历山大湾 Alexandria coastal area 0.009~1.250 [46] 埃及红海海岸 Egyptian Red Sea coastal waters 0.000 2~0.007 [47] 大亚湾 Daya Bay 0.005~0.268 0.067 本研究 表 4 国内外近海沉积物中石油烃质量分数比较Table 4 Comparison of petroleum hydrocarbon mass fraction in offshore sediments at home and abroad调查海区
survey area质量分数/mg·kg–1
mass fraction平均值/mg·kg–1
average参考文献
Reference湄洲湾 Meizhou Bay 20.0~87.0 40.0 [36] 长江口 Yangtze Estuary 61.2~1 062.4 246.1 [12] 珠江口 Pearl River Estuary 15.0~923.0 208.0 [24] 珠江口广州海域 Pearl River Estuary Guangzhou area 51~1 910 544.9 [25] 温州近海 Wenzhou inshore 10.0~33.9 20.7 [37] 泉州湾 Quanzhou Bay 42.4~1 290 615 [38] 厦门港 Xiamen Port 133.3~1 397 569.8 [3] 渤海湾 Bohai Bay 6.3~535 158 [28] 泰米尔纳德邦海岸 Tamilnadu Coast, India 1.48~4.23 [39] 泰国金奈海岸 Chennai Coast, India 1.8~39.72 [40] 阿布扎比 Abu Dhabi, UAE 6.14~62.7 [41] 法国福斯湾 Gulf of Fos, France 7.8~180 [42] 突尼斯比塞大湖 Bizerte Lagoon, Tunisia 0.05~19.5 [43] 大亚湾 Daya Bay 7~559 183.4 本研究 -
表 1 大亚湾表层海水石油烃浓度的季节变化
Table 1 Seasonal variation of petroleum hydrocarbons in surface waters of Daya Bay
季节
season质量浓度/mg·L–1
mass concentration平均值/mg·L–1
average污染指数
pollution index平均污染指数
average pollution index超标率 (>0.05 mg·L–1)/%
over-standard percentage春季 spring 0.008~0.268 0.047 0.160~5.360 0.940 27.27 夏季 summer 0.012~0.143 0.060 0.240~2.860 1.200 50.00 秋季 autumn 0.013~0.201 0.112 2.600~4.020 2.240 86.36 冬季 winter 0.005~0.084 0.049 0.100~1.680 0.980 54.55 表 2 大亚湾表层沉积物中石油烃含量的季节变化
Table 2 Seasonal variation of petroleum hydrocarbons in surface sediments of Daya Bay
季节
season质量分数/mg·kg–1
mass fraction平均值/mg·kg–1
average污染指数
pollution index平均污染指数
average pollution index超标率 (>500 mg·kg–1)/%
over-standard percentage春季 spring 7~202 51.300 0.014~0.404 0.103 0 夏季 summer 85.3~559 258.027 0.170 6~1.118 0.516 9.09 秋季 autumn 85.4~448 254.291 0.170 8~0.896 0.509 0 冬季 winter 84.2~324 187.382 0.168 4~0.648 0.375 0 表 3 国内外近海海域水体中石油烃质量浓度比较
Table 3 Comparison of petroleum hydrocarbon mass concentrations in water bodies at home and abroad
调查海区
survey area质量浓度/mg·L–1
mass concentration平均值/mg·L–1
average参考文献
Reference胶州湾 Jiaozhou Bay 0.025~0.114 0.053 [27] 山东近海 Shandong inshore 0.010~1.890 0.114 [27] 珠江口 Pearl River Estuary 0.020~0.810 0.130 [25] 内伶仃洋 Inner Ling Dingyang 0.039~0.108 0.069 [30] 湄洲湾 Meizhou Bay 0.004~0.342 0.037 [31] 东山湾 Dongshan Bay 0.010~0.060 0.026 [6] 渤海 Bohai Sea 0.004~0.065 0.026 [32] 福建沿岸 Seawater near Fujian 0.005~0.037 0.015 [33] 长江口 Yangtze Estuary 0.006~0.187 0.079 [26, 34] 泰米尔纳德邦海岸 Tamilnadu Coast, India 0.002~0.014 [35] 阿拉伯海湾及阿曼湾 Arabian Gulf and Gulf of Oman 0.002~0.013 [45] 亚历山大湾 Alexandria coastal area 0.009~1.250 [46] 埃及红海海岸 Egyptian Red Sea coastal waters 0.000 2~0.007 [47] 大亚湾 Daya Bay 0.005~0.268 0.067 本研究 表 4 国内外近海沉积物中石油烃质量分数比较
Table 4 Comparison of petroleum hydrocarbon mass fraction in offshore sediments at home and abroad
调查海区
survey area质量分数/mg·kg–1
mass fraction平均值/mg·kg–1
average参考文献
Reference湄洲湾 Meizhou Bay 20.0~87.0 40.0 [36] 长江口 Yangtze Estuary 61.2~1 062.4 246.1 [12] 珠江口 Pearl River Estuary 15.0~923.0 208.0 [24] 珠江口广州海域 Pearl River Estuary Guangzhou area 51~1 910 544.9 [25] 温州近海 Wenzhou inshore 10.0~33.9 20.7 [37] 泉州湾 Quanzhou Bay 42.4~1 290 615 [38] 厦门港 Xiamen Port 133.3~1 397 569.8 [3] 渤海湾 Bohai Bay 6.3~535 158 [28] 泰米尔纳德邦海岸 Tamilnadu Coast, India 1.48~4.23 [39] 泰国金奈海岸 Chennai Coast, India 1.8~39.72 [40] 阿布扎比 Abu Dhabi, UAE 6.14~62.7 [41] 法国福斯湾 Gulf of Fos, France 7.8~180 [42] 突尼斯比塞大湖 Bizerte Lagoon, Tunisia 0.05~19.5 [43] 大亚湾 Daya Bay 7~559 183.4 本研究 -
[1] 吴风霞, 黄洪辉, 戴明, 等. 大鹏澳浮游纤毛虫群落与环境因子间的关系[J]. 南方水产科学, 2017, 13(1): 1-9. [2] 李磊, 蒋玫, 王云龙, 等. 长江口及邻近海域沉积物中石油烃污染特征[J]. 中国环境科学, 2014, 34(3): 752-757. [3] OU S M, ZHENG J H, ZHENG J S, et al. Petroleum hydrocarbons and polycyclic aromatic hydrocarbons in the surficial sediments of Xiamen Harbour and Yuan Dan Lake, China[J]. Chemosphere, 2004, 56(2): 107-112.
[4] YE B X, ZHANG Z H, MAO T. Petroleum hydrocarbon in surficial sediment from rivers and canals in Tianjin, China[J]. Chemosphere, 2007, 68(1): 140-149.
[5] LYLA S, MANOKARAN S, KHAN A. Petroleum hydrocarbon distribution in continental shelf region of southeast coast of India[J]. Int J Sediment Res, 2012, 27(1): 73-83.
[6] 陈财珍, 林静, 许贻斌, 等. 福建省东山湾海洋生态环境中石油烃类分布特征与评价[J]. 海洋开发与管理, 2015, 32(10): 73-77. [7] VEERASINGAM S, VENKATACHALAPATHY R, SUDHAKAR S, et al. Petroleum hydrocarbon concentrations in eight mollusc species along Tamilnadu Coast, Bay of Bengal, India[J]. J Environ Sci, 2011, 23(7): 1129-1134.
[8] GILDE K, PINCKNEY J L. Sublethal effects of crude oil on the community structure of estuarine phytoplankton[J]. Estuar Coast, 2012, 35(3): 853-861.
[9] EWAOBOHO I, AMU O. Effect of crude oil extracts on early stages of African catfish Heterobranchus longifilis (val.) reared under controlled condition[J]. Global J Environ Sci, 2010, 8(2): 23-28.
[10] RODRIGUES R V, MIRANDA-FILHO K C, GUSMÃO E P, et al. Deleterious effects of water-soluble fraction of petroleum, diesel and gasoline on marine pejerrey Odontesthes argentinensis larvae[J]. Sci Total Environ, 2010, 408(9): 2054-2059.
[11] PACHECO M, SANTOS M A. Biotransformation, endocrine, and genetic responses of Anguilla Anguilla L. to petroleum distillate products and environmentally contaminated waters[J]. Ecotoxicol Environ Saf, 2001, 49(1): 64-75.
[12] 马继臻, 袁骐, 蒋玫, 等. 长江口及其邻近水域油污染分布特征及其评价[J]. 海洋渔业, 2007, 29(3): 251-256. [13] 侯俊妮, 张传松, 石晓勇. 北黄海石油烃含量的季节变化和分布特征[J]. 渔业科学进展, 2011, 32(5): 121-125. [14] 陈勇民. 港口水域石油污染生物降解及生物修复技术的基础研究[D]. 西安: 长安大学, 2002: 21-27. [15] VENTURINI N, MUNIZ P, BICEGO M C, et al. Petroleum contamination impact on macrobenthic communities under the influence of an oil refinery: integrating chemical and biological multivariate data[J]. Estuar Coast Shelf Sci, 2008, 78(3): 457-467.
[16] 周爱国, 蔡鹤生. 地质环境质量评价理论与应用[M]. 武汉: 中国地质大学出版社, 1998: 70-83. [17] 姜犁明, 董良飞, 杨季芳, 等. 大亚湾海域N、P营养盐分布特征研究[J]. 常州大学学报(自然科学版), 2013, 25(2): 12-15. [18] 韩舞鹰, 林洪瑛, 黄西能. 广东省大亚湾海水交换的研究[J]. 海洋通报, 1988, 7(3): 1-7. [19] 王聪, 林军, 陈丕茂, 等. 大亚湾水交换的数值模拟研究[J]. 南方水产, 2008, 4(4): 8-15. [20] 中国水产科学研究院南海水产研究所, 惠州市海洋与渔业局. 惠州市海洋渔业发展规划(1998—2010)[R]. 1999: 50-100. [21] 陈文静, 周劲风, 李耀初. 大亚湾海域水质变化趋势及成因分析[J]. 环境科学与技术, 2010, 33(s2): 28-32. [22] 徐娇娇. 大亚湾石化排污对邻近海域生态环境的影响及生态系统健康评价[D]. 上海: 上海海洋大学, 2013: 32-34. [23] 易华. 大亚湾海域重金属变化趋势分析[J]. 广东化工, 2012, 39(14): 111-113, 129. [24] 潘建明, 扈传昱, 刘小涯, 等. 珠江河口沉积物中石油烃分布及其与河口环境的关系[J]. 海洋环境科学, 2002, 21(2): 23-27. [25] 魏鹏, 黄良民, 冯佳和, 等. 珠江口广州海域石油烃的分布特征[J]. 海洋环境科学, 2010, 29(4): 473-476. [26] 唐洪杰, 杨茹君, 张传松, 等. 东海赤潮频发区石油烃的季节分布特征[J]. 海洋环境科学, 2007, 26(5): 446-449. [27] 谭丽菊, 张哲, 王江涛, 等. 山东近海水体石油烃的分布特征研究[J]. 中国海洋大学学报 (自然科学版), 2009(s1): 203-206. [28] ZHOU R, QIN X B, PENG S T, et al. Total petroleum hydrocarbons and heavy metals in the surface sediments of Bohai Bay, China: long-term variations in pollution status and adverse biological risk[J]. Mar Pollut Bull, 2014, 83(1): 290-297.
[29] 秦华伟, 刘霞, 张娟, 等. 莱州湾海域水质石油类的分布特征[J]. 海洋环境科学, 2016, 35(5): 739-742. [30] 贺玉林, 刘泽伟, 卢伟华. 珠江口内伶仃洋水体和沉积物石油烃的分布特征[J]. 农业与技术, 2012(3): 125-127. [31] 王宪, 田春雨, 郑盛华. 湄洲湾表层海水石油烃的分布特征分析[J]. 华侨大学学报(自然科学版), 2008, 29(2): 241-244. [32] 王修林, 邓宁宁, 李克强, 等. 渤海海域夏季石油烃污染状况及其环境容量估算[J]. 海洋环境科学, 2004, 23(4): 14-18. [33] 王宪, 张元标, 李凌云, 等. 福建省沿岸水体与沉积物中油的分布特征[J]. 厦门大学学报(自然科学版), 2000, 39(3): 369-374. [34] 张传松, 王修林, 石晓勇, 等. 东海赤潮高发区COD和石油烃分布特征及其与赤潮发生关系的初步研究[J]. 应用生态学报, 2003, 14(7): 1093-1096. [35] VEERASINGAM S, VENKATACHALAPATHY R, RAJA P, et al. Petroleum hydrocarbon concentrations in ten commercial fish species along Tamilnadu Coast, Bay of Bengal, India[J]. Environ Sci Pollut Res, 2011, 18(4): 687-693.
[36] 陈凯. 湄洲湾海域表层沉积物石油类分布特征[J]. 福建水产, 2009(3): 27-29. [37] 张树刚, 黄小烽, 陈雷, 等. 温州近岸海域石油烃分布特征[J]. 海洋湖沼通报, 2011(3): 105-110. [38] 丁光茂. 泉州湾表层海水和沉积物中油类的分布特征[J]. 福建水产, 2012, 34(1): 43-47. [39] VEERASINGAM S, RAJA P, VENKATACHALAPATHY R, et al. Distribution of petroleum hydrocarbon concentrations in coastal sediments along Tamilnadu Coast, India[J]. Carpath J Earth Environ Sci, 2010, 5(2): 5-8.
[40] VENKATACHALAPATHY R, VEERASINGAM S, RAMKUMAR T. Petroleum hydrocarbon concentrations in marine sediments along Chennai Coast, Bay of Bengal, India[J]. Bull Environ Contamin Toxicol, 2010, 85(4): 397-401.
[41] ABD E A, GAWAD E, LOTFY M M, et al. Assessment of the oil pollution extent in the offshore sediments, Abu Dhabi, UAE[J]. Aust J Basic Appl Sci, 2008, 2(3): 561-574.
[42] MILLE G, ASIA L, GUILIANO M, et al. Hydrocarbons in coastal sediments from the Mediterranean Sea (Gulf of Fos area, France)[J]. Mar Poll Bull, 2007, 54(5): 566-575.
[43] MZOUGHI N, DACHRAOUI M, VILLENEUVE J P. Evaluation of aromatic hydrocarbons by spectrofluorometry in marine sediments and biological matrix: what reference should be considered?[J]. Comptes rendus Chimie, 2005, 8(1): 97-102.
[44] 李磊, 蒋玫, 沈新强, 等. 长江口及邻近海域水体中石油烃分布特征及其污染评价[J]. 环境化学, 2014(8): 1366-1372. [45] SHRIADAH M. Levels and distribution of petroleum hydrocarbons in the coastal waters and sediments of the United Arab Emirates in the Arabian Gulf and the Gulf of Oman[J]. Water Air Soil Poll, 2000, 119(1/2/3/4): 247-256.
[46] AHMED O E, MAHMOUD S A, NADY M E. Organic sources in the Egyptian seawater around Alexandria coastal area as integrated from polycyclic aromatic hydrocarbons (PAHs)[J]. Egypt J Petr, 2016, 26(3): 817-826.
[47] FAHMY M A, FATTAH L A, ABDEL-HALIM A M, et al. Evaluation of the quality for the Egyptian Red Sea coastal waters during 2011–2013[J]. J Environ Prot, 2016, 7(12): 1810-1834.
-
期刊类型引用(8)
1. 鲁超,刘炜,马祖友,樊立静,兰旺荣,温冬,程宏,陈拥,李允,郇凤. 近岸沉积物油类紫外分光光度法检测中硫单质干扰清除研究. 环境污染与防治. 2025(02): 108-113+156 .  百度学术
百度学术
2. 王赛男,许赞,刘亮,孙茜,赵文奎,王震. 一种便携式荧光测油仪在海上溢油应急监测中的适用性研究. 中国环境监测. 2023(03): 190-196 .  百度学术
百度学术
3. 张婉萍,樊敏,陶伟,谌书,彭晓鹃,董燕红. 基于正定矩阵因子模型的大亚湾海域污染特征解析研究. 海洋环境科学. 2022(06): 872-880 .  百度学术
百度学术
4. 刘荣林,孔小丽,王志远,孙妮,于红兵. 琼州海峡东部石油类污染特征研究. 环境科学与技术. 2021(S2): 210-215 .  百度学术
百度学术
5. 刘芳,柯盛,周立喜,陈成琼,陈耀. 广东雷州珍稀海洋生物国家级自然保护区水体和沉积物中石油类含量与分布特征. 海洋开发与管理. 2020(01): 69-74 .  百度学术
百度学术
6. 杨文超,黄道建,陈继鑫,陈晓燕,王宇珊,孙丽梅. 大亚湾2010—2018年表层沉积物中重金属含量时空分布及生态风险评价. 南方水产科学. 2020(04): 39-46 .  本站查看
本站查看
7. 杨文超,黄道建,陈继鑫,陈晓燕,王宇珊,孙丽梅. 大亚湾海域2009—2018年重金属时空分布及污染评价. 华南师范大学学报(自然科学版). 2020(05): 65-75 .  百度学术
百度学术
8. 杨文超,黄道建,陈继鑫,陈晓燕,刘旺,王宇珊. 大亚湾石化区第2条排污管线排污口海域生态环境质量研究. 海洋学研究. 2019(04): 85-91 .  百度学术
百度学术
其他类型引用(5)



 下载:
下载:
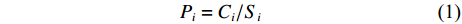
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
