Estimation of disease resistance and growth in F5 generation families of GIFT tilapia
-
摘要: 为评估吉富罗非鱼(GIFT Oreochromis niloticus)抗病F5代的选育效果,以F0代群体和奥尼罗非鱼(Oreochromis aureus×O.niloticus)作为对照组,对F5代42个家系的抗病性能及生长性能进行评估。对42个家系进行人工腹腔注射感染无乳链球菌 (Streptococcus agalactiae)后,分别有36个和22个家系的感染成活率比F0代和奥尼罗非鱼高,各家系的抗病育种值为 – 0.158~0.086;生长性能测定发现,42个家系中有27个家系的绝对增长率大于F0代;感染成活率与体质量之间的遗传相关系数为 – 0.033。综合分析各个家系的感染成活率、抗病育种值和绝对增长率,筛选出抗病力强且生长速度快的家系7个(2#、3#、4#、6#、28#、31#和35#),可作为F6代选育和苗种扩繁的亲本。结果表明,经过5个世代的针对性选育,吉富罗非鱼的抗病性能和生长性能均得到了明显改善,选育效果显著。Abstract: To assess the effects of selective breeding in GIFT tilapia (Oreochromis niloticus), we measured the disease resistance and growth performance of 42 families of GIFT tilapia F5 generation, taking F0 generation and hybrid tilapia (Oreochromis aureus×O.niloticus) as control groups. The results show that the survival rates of 36 families of F5 generation were higher than that of F0 generation, and the survival rates of 22 families were higher than that of hybrid tilapia after Streptococcus agalactiae infection. The disease-resistant breeding value was – 0.158 – 0.086 among different families. The absolute growth rates of 27 families were higher than that of F0 generation. The correlation coefficient between the survival rate and the body mass was negative, and the quantitative value was – 0.033. According to the comprehensive comparison among the survival rate, disease-resistant breeding value and absolute growth rate for 42 families of F5 generation, we have screened seven families (2#, 3#, 4#, 6#, 28#, 31#, 35#) which were best-performing and can be used as breeding parents of F6 generation. The results indicate that the disease resistance and growth performance of GIFT tilapia were improved significantly after five generations' selective breeding.
-
Keywords:
- GIFT tilapia /
- family selection /
- disease resistance /
- growth performance /
- breeding value
-
华贵栉孔扇贝(Chlamys nobilis)属于热带海水贝类,具有肉质鲜美、营养价值高等优点,自20世纪70年代起,有关其人工育苗和规模化养殖迅速在南方各沿海省份展开,并取得了较好的经济效益,但由于长期养殖,华贵栉孔扇贝也面临种质质量退化的问题,严重影响了该产业的健康发展。目前相关机构已经对其开展了选育研究,并取得了初步成效。数量遗传学作为一种新型研究遗传育种的学科,在水产动物遗传育种中展现了很大的优越性,但将此方法运用于华贵栉孔扇贝良种选育的相关研究尚不多见。该研究在此方向作了初步探索,解决华贵栉孔扇贝养殖产业健康发展的关键所在是建立有效的良种选育方法[3-4]。
三亚崖州湾海区是海南省华贵栉孔扇贝主养区之一,已有5年养殖经历。笔者通过对该海区养殖的华贵栉孔扇贝数量性状的测量和分析,采用多元分析和回归方法,建立形态性状与质量性状间的多元线性回归方程[5],以期为华贵栉孔扇贝通过数量性状辅助选择育种提供相关理论依据。
1. 材料与方法
1.1 材料
受测的华贵栉孔扇贝来自于三亚崖州湾养殖海区,由三亚意源养殖有限公司提供。
1.2 取样和测量方法
2010年3月30日一次性随机选取各年龄阶段526个扇贝标本测量其数量性状。测量前清除其表面附着物。5个形态性状(壳高、壳长、绞合线长、壳厚和贝柱直径)用数显游标卡尺测量(精度为0.02 mm),6个质量性状(总质量、壳质量、贝柱鲜质量、鲜肉质量、干肉质量和贝柱干质量)用电子天平测量(精度为0.01 g)。鲜肉质量指活体去壳后含水分的质量,干肉质量指将鲜肉放入烘箱去除水分后的质量。
1.3 数据分析方法
测量的数据使用SPSS 13软件进行数据分析,对数据采用t检验,用多元回归分析法,分析5个测量指标[壳高(x1)、壳长(x2)、绞合线长(x3)、壳厚(x4)和总质量(x5)]对扇贝3个经济性状[鲜肉质量(y1)、肉柱鲜质量(y2)和肉柱干质量(y3)]的影响,同时作通径分析。
2. 结果与分析
2.1 各性状的参数分析
华贵栉孔扇贝壳高、壳长、绞合线长、壳厚、贝柱直径、总质量、壳质量、鲜肉质量、贝柱鲜质量、干肉质量和贝柱干质量等11个数量性状的各种参数见表 1。其中不同性状的参数单位有所不同,不能进行性状间比较。变异系数的单位相同,因而可以进行性状间比较。性状的变异系数越大,表明品种相应指标可供选择的范围越大,选择的潜力就越大。11个性状的变异系数由大到小依次为贝柱干质量>干肉质量>贝柱鲜质量>鲜肉质量>总质量>壳质量>贝柱直径>壳厚>绞合线长>壳长>壳高。因此,在华贵栉孔扇贝高产品种培育中对这些性状进行选择时,应首先考虑贝柱干质量,其次是干肉质量、贝柱鲜质量、鲜肉质量、总质量、壳质量、贝柱直径、壳厚、绞合线长和壳长,最后是壳宽。
表 1 各性状的表型统计量(n=526)Table 1. Phenotypic statistics of various quantitative traits参数parameter 壳高/mm SH 壳长/mm SL 绞合线长/mm HL 壳厚/mm ST 贝柱直径/mm CP 总质量/g TW 壳质量/g WWAM 鲜肉质量/g FW 贝柱鲜质量/g CFW 干肉质量/g DFW 贝柱干质量/g DWAM max 76.00 72.30 42.00 26.30 23.10 54.01 29.93 24.74 5.32 3.66 1.30 min 44.10 41.00 21.90 13.10 8.90 10.23 7.28 1.33 0.55 0.40 0.07 mean 60.52 55.57 32.58 18.97 15.83 27.86 17.07 10.79 2.40 1.46 0.53 R 31.90 31.30 20.10 13.20 14.20 43.78 22.65 23.41 4.77 3.26 1.23 SD 5.52 5.44 3.32 2.04 2.46 7.08 4.17 3.29 0.87 0.57 0.22 SE 0.24 0.24 0.14 0.09 0.11 0.31 0.18 0.14 0.04 0.02 0.01 CV 9.12% 9.80% 10.19% 10.77% 15.56% 25.43% 24.42% 30.51% 36.31% 38.99% 42.19% 2.2 5个数量性状的回归分析及通径分析
2.2.1 鲜肉质量
分析5个测量指标[壳高(x1)、壳长(x2)、绞合线长(x3)、壳厚(x4)和总质量(x5)]对扇贝鲜肉质量(y)的影响(表 2)。总质量与鲜肉质量为极显著的正相关(相关系数为0.839 4,P < 0.01),壳厚与贝柱鲜质量为显著的负相关(相关系数为-0.110 7,0.01 < P < 0.05)。y=1.295-0.033 15x1-0.091 6x4+0.474 9x5,决定系数R2=0.878 563,剩余标准差SSE=1.150 2。
表 2 5个数量性状对鲜肉质量的逐步回归分析Table 2. Stepwise regression analysis between 5 quantitative traits and shell-free weight变量variable 回归系数regression coefficient 标准回归系数standard regression coefficient 偏相关partial correlation t P x1 -0.033 1 -0.055 5 -0.092 8 2.126 9 0.033 9 x4 -0.091 6 -0.056 8 -0.107 4 2.464 6 0.014 0 x5 0.474 9 1.022 5 0.839 4 35.246 5 0.000 0 通径系数反映自变量对依变量的直接影响,总质量对鲜肉质量的影响最为明显,直接系数为1.024 9(表 3)。x5与鲜肉质量的相关系数最大,而x1和x4与鲜肉质量呈负相关,x5与鲜肉质量呈正相关。
表 3 5个数量性状对鲜肉质量的通径分析Table 3. Path analysis between 5 quantitative traits and shell-free weight变量variable 直接系数direct factor 通过x1 by x1 通过x4 by x4 通过x5 by x5 总影响total impact x1 -0.055 5 - -0.037 8 0.822 6 0.729 3 x4 -0.056 8 -0.036 9 - 0.757 1 0.663 4 x5 1.024 9 -0.044 7 -0.042 1 - 0.935 7 2.2.2 贝柱鲜质量
分析5个测量指标[壳高(x1)、壳长(x2)、绞合线长(x3)、壳厚(x4)和总质量(x5)]对扇贝贝柱鲜质量(y)的影响(表 4),总质量与贝柱鲜质量呈极显著的正相关(相关系数为0.622 9,P < 0.01),绞合线长与贝柱鲜质量呈极显著的负相关(相关系数为-0.196 6,P < 0.01)。y=-0.168 8+0.027 34x2-0.046 04x3+0.091 4x5,决定系数R2=0.617 847,剩余标准差SSE=0.539 5。
表 4 5个数量性状对贝柱鲜质量的逐步回归分析Table 4. Stepwise regression analysis between 5 quantitative traits and adductor muscle weight变量variable 回归系数regression coefficient 标准回归系数standard regression coefficient 偏相关partial correlation t P x2 0.027 3 0.171 0 0.154 5 3.569 8 0.000 4 x3 -0.046 0 -0.175 7 -0.196 6 4.576 6 0.000 0 x5 0.091 4 0.744 1 0.629 9 18.513 1 0.000 0 从表 5中可以看出,通径系数反映自变量对依变量的直接影响。结果显示,总质量对贝柱鲜质量的影响最为明显,直接系数为0.744 1;x2和x5与贝柱鲜质量呈正相关,x3与贝柱鲜质量呈负相关; x5的总体影响最大(0.775 4),x2其次(0.596 0)。
表 5 5个数量性状对贝柱鲜质量的通径分析Table 5. Path analysis between 5 quantitative traits and adductor muscle weight变量variable 直接系数direct factor 通过x1 by x1 通过x4 by x4 通过x5 by x5 总影响total impact x2 0.171 0 - -0.124 4 0.549 5 0.596 0 x3 -0.175 7 0.121 1 - 0.402 1 0.347 5 x5 0.744 1 0.126 3 -0.094 9 - 0.775 4 2.2.3 贝柱干质量
分析5个测量指标[壳高(x1)、壳长(x2)、绞合线长(x3)、壳厚(x4)和总质量(x5)]对扇贝贝柱干质量(y)的影响(表 6)。总质量与贝柱干质量为极显著的正相关(相关系数为0.743 0,P < 0.01),壳长与贝柱干质量为显著的负相关(相关系数为-0.092 2,P < 0.05),绞合线长与贝柱干质量为极显著的负相关(相关系数为-0.141 1,P < 0.01)。y=0.228 7-0.005 0x2-0.007 8x3+0.029 9x5,决定系数R2=0.664 705,剩余标准差SSE=0.129 1。
表 6 5个数量性状对贝柱干质量的逐步回归分析Table 6. Stepwise regression analysis between 5 quantitative traits and adductor muscle dry weight变量variable 回归系数regression coefficient 标准回归系数standard regression coefficient 偏相关partial correlation t P x2 -0.005 0 -0.123 7 -0.119 9 2.756 7 0.006 0 x3 -0.007 8 -0.117 0 -0.141 1 3.253 9 0.001 2 x5 0.029 9 0.954 0 0.743 0 25.341 1 0.000 0 从表 7可以看出,通径系数反映自变量对依变量的直接影响。结果显示,总质量对贝柱鲜质量的影响最为明显,直接系数为0.954 0。
表 7 5个数量性状对贝柱干质量的通径分析Table 7. Path analysis between 5 quantitative traits and adductor muscle dry weight变量variable 直接系数direct factor 通过x1 by x1 通过x4 by x4 通过x5 by x5 总影响total impact x2 -0.123 7 - -0.082 9 0.704 5 0.497 9 x3 -0.117 0 -0.087 6 - 0.515 5 0.310 9 x5 0.954 0 -0.091 3 -0.063 2 - 0.799 4 x5与贝柱干质量呈正相关,x2和x3与贝柱干质量呈负相关,x5对贝柱干质量产生的影响最为明显。
3. 讨论
3.1 通径分析的运用
性状间的相关系数是进行多元分析的基础,但相关系数是两变量间关系的综合体现,其既包括变量间的直接关系,又包括通过其他变量影响的间接关系。单纯采用性状间的相关系数不能正确表述两性状间的真实关系。通径分析可用于分析多个自变量与变量之间的线性关系,是回归分析的拓展,不仅可以处理较为复杂的变量关系,而且能把性状间相关性分成直接影响和间接影响[6-8]。该研究中华贵栉孔扇贝壳高、壳长、绞合线长、壳厚和总质量与扇贝的鲜肉质量、贝柱鲜质量及贝柱干质量的相关系数均极显著,建立回归方程时将其余几个对经济性状相关系数影响不显著的予以剔除以建立理想的回归方程。
3.2 数量性状的选育
衡量华贵栉孔扇贝生长状况的数量性状一般包括长度(高度)和质量,该研究选取长度和质量2个性状来探讨华贵栉孔扇贝数量性状间的相关性。以相关形态性状和总质量为自变量,对3个主要经济性状的回归相关性极显著。把简单易测的性状作为自变量是符合期望的[9-11]。因此,在华贵栉孔扇贝的遗传育种中把壳长和总质量作为重要生长指标即可。通径分析在水产动物的遗传育种中运用非常广泛[12-16],如王爱民等[17]对马氏珠母贝(Pinctada martensii)不同地理种群内自繁和种群间杂交子一代形态性状参数进行了相关分析,郑怀平等[18]对近江牡蛎(Ostrea rivularis gould)养殖群体数量性状间的相关性进行了通径分析,喻子牛等[19]对香港巨牡蛎(Crassostrea hongkongensis)雌雄群体数量性状进行了通径分析。
3.3 选育对加工产业的意义
选育优质的良种对华贵栉孔扇贝加工产业具有相当重要的意义。加工企业需用扇贝的贝柱来加工产品,因而对贝柱的质量格外关注。该研究中对扇贝贝柱鲜质量和贝柱干质量均作了相关分析[20]与通径分析,研究结果显示,总质量对于3个经济性状的正面影响最大。因此,在高产选育时应选择总质量大的品种来进行选育,使获得的优良品种能够产生大的贝柱。
-
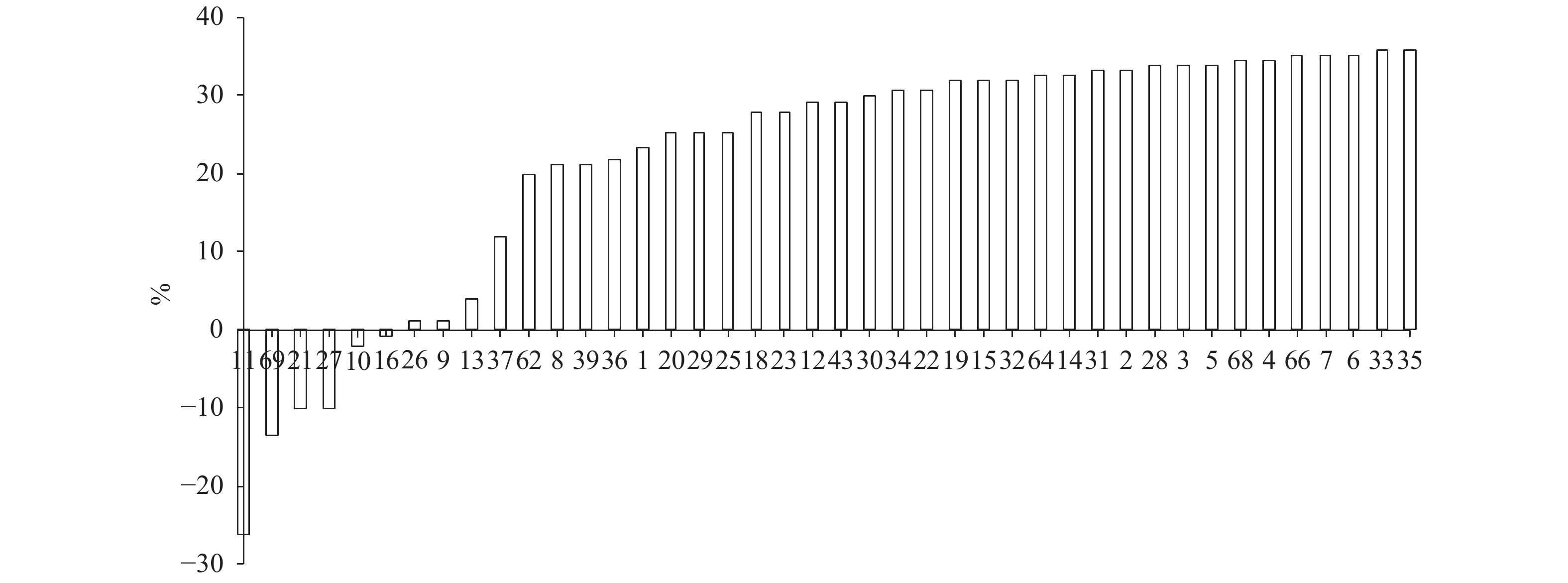
表 1 吉富罗非鱼F5代抗无乳链球菌的成活率及其育种值
Table 1 Survival rate and breeding value of resistance to S.agalactiae for F5 generation of GIFT tilapia
选育系号
family No.成活率/%
survival rate育种值
breeding value排名
No.选育系号
family No.成活率/%
survival rate育种值
breeding value排名
No.12 93.33 0.086 1 39 85.45 0.005 22 6 99.40 0.081 2 20 89.09 0.004 23 4 98.98 0.076 3 23 92.02 – 0.001 24 15 95.57 0.075 4 5 98.14 – 0.002 25 19 95.54 0.069 5 37 75.91 – 0.009 26 34 94.55 0.067 6 33 100.00 – 0.015 27 28 97.60 0.062 7 66 99.00 – 0.017 28 36 85.56 0.053 8 16 63.32 – 0.017 29 31 97.05 0.050 9 68 98.70 – 0.023 30 32 95.68 0.049 10 64 96.72 – 0.031 31 7 99.38 0.048 11 9 65.32 – 0.040 32 62 84.00 0.047 12 43 93.33 – 0.046 33 14 96.95 0.043 13 27 54.07 – 0.052 34 29 89.33 0.040 14 10 61.69 – 0.067 35 2 97.48 0.038 15 1 87.10 – 0.068 36 18 91.72 0.031 16 21 53.59 – 0.090 37 22 94.67 0.028 17 69 50.98 – 0.090 38 3 97.94 0.023 18 26 65.19 – 0.096 39 30 94.08 0.023 19 11 37.71 – 0.132 40 25 89.44 0.019 20 8 85.03 – 0.157 41 35 100.00 0.016 21 13 68.12 – 0.158 42 表 2 吉富罗非鱼不同家系生长性能比较
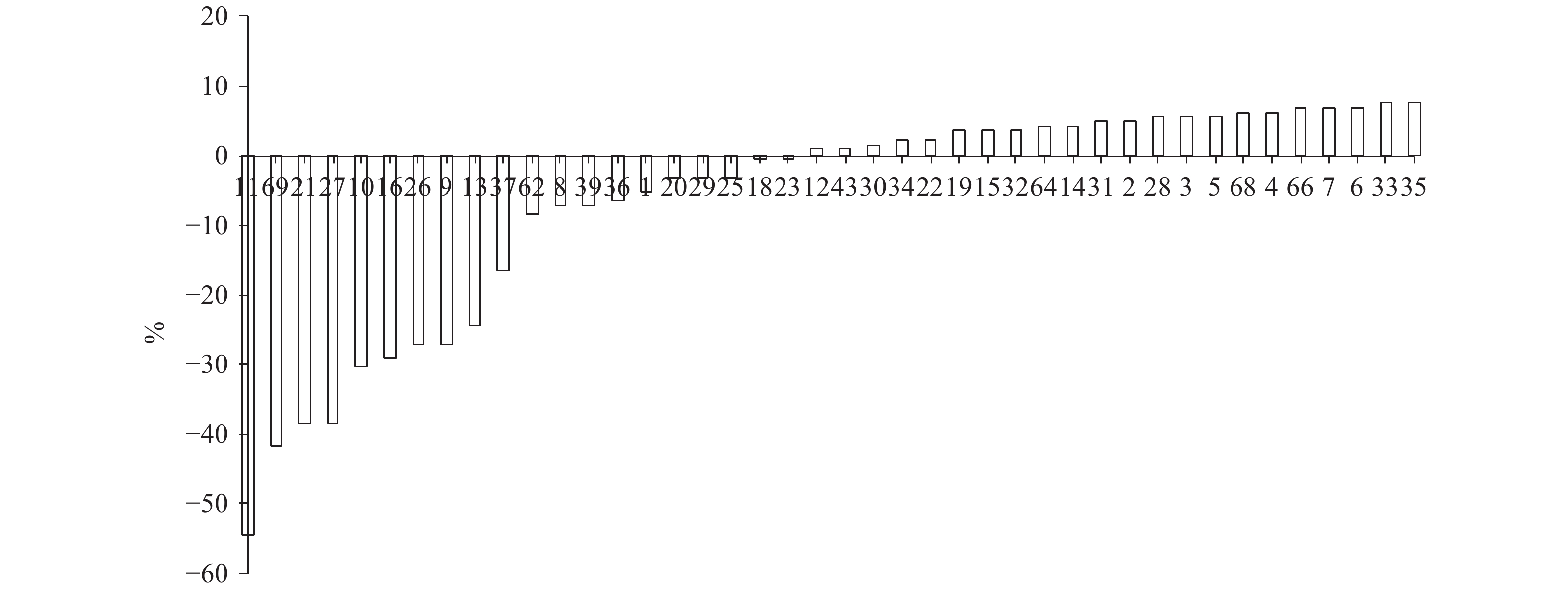
Table 2 Comparison of growth characteristics of different GIFT tilapia families
家系编号
family No.体质量/g
body mass体长/cm
body length体高/cm
body height体宽/cm
body width绝对增长率/g·d–1
absolute growth rate23 449.5±79.8 13.2±1.5 4.5±0.7 2.2±0.3 2.50 43 441.7±97.1 10.0±1.9 3.1±0.8 1.5±0.3 2.45 39 421.2±96.8 13.1±2.4 4.7±0.9 2.1±0.4 2.34 3 418.3±96.2 10.2±1.4 3.1±0.8 1.4±0.4 2.32 9 403.9±106.7 11.8±1.9 3.5±1.0 1.5±0.4 2.24 29 397.6±93.9 13.1±1.9 4.1±0.8 1.8±0.4 2.21 31 390.9±96.5 12.3±1.7 3.7±0.9 1.9±0.4 2.17 28 389.7±75.4 12.7±1.5 4.2±0.7 2.0±0.3 2.17 1 389.3±94.9 10.9±2.2 3.3±0.8 1.5±0.4 2.16 25 387.0±86.4 11.2±2.0 3.8±1.7 1.8±0.3 2.15 36 386.9±84.9 11.0±1.6 3.6±0.7 1.8±0.4 2.15 6 386.5±75.1 11.9±1.4 3.5±0.6 1.7±0.3 2.15 11 384.0±96.3 9.5±2.4 2.7±1.0 1.1±0.4 2.13 4 380.2±87.8 10.9±1.6 3.4±0.9 1.4±0.3 2.11 13 374.0±94.5 10.2±2.6 3.0±1.4 1.3±0.4 2.08 20 373.1±51.9 13.8±2.9 4.5±0.4 2.2±0.4 2.07 37 366.8±92.8 9.8±2.1 3.3±0.9 1.6±0.4 2.04 2 365.8±68.3 11.6±1.4 3.6±0.6 1.6±0.3 2.03 22 364.8±74.5 11.9±1.7 4.0±0.7 2.0±0.4 2.03 27 356.6±57.3 10.9±1.4 3.7±0.6 1.9±0.3 1.98 8 355.6±92.7 12.0±2.6 3.6±0.9 1.6±0.5 1.98 18 354.7±64.4 10.8±1.4 3.0±7.0 1.9±0.3 1.97 33 354.5±92.8 9.9±1.6 2.7±0.8 1.3±0.4 1.97 30 353.2±74.4 12.5±1.5 3.6±0.7 1.8±0.3 1.96 26 351.0±72.7 10.8±1.2 3.6±0.5 1.8±0.3 1.95 21 350.5±89.3 9.2±1.7 3.1±0.9 1.5±0.4 1.95 35 349.2±52.4 11.0±2.1 3.6±0.6 1.8±0.4 1.94 16 327.4±85.8 10.4±1.9 3.1±0.7 1.6±0.4 1.82 34 325.8±58.5 13.5±1.8 3.9±0.5 2.0±0.3 1.81 12 324.5±90.0 12.0±1.6 3.6±0.9 1.7±0.4 1.80 5 316.3±86.7 9.2±2.1 2.7±1.3 1.1±0.4 1.76 14 302.4±83.4 11.7±1.5 3.6±0.7 1.6±0.3 1.68 40 301.5±59.9 12.7±1.5 4.4±0.6 2.1±0.3 1.68 19 296.1±54.4 10.5±1.5 3.5±0.6 1.7±0.3 1.65 10 291.9±98.4 10.7±3.1 3.2±1.0 1.4±0.4 1.62 32 280.2±55.7 12.6±1.8 3.7±0.6 1.8±0.3 1.56 15 277.3±82.8 10.7±2.0 3.1±0.9 1.5±0.4 1.54 表 3 吉富罗非鱼F5代各表型性状间的遗传相关性分析
Table 3 Genetic correlation among different phenotypic traits of F5 generation of GIFT tilapia
性状
trait体质量
body mass体长
body length体高
body height体宽
body width成活率
survival rate体质量 body mass 1 体长 body length 0.625** 1 体高 body height 0.537** 0.888** 1 体宽 body width 0.519** 0.840** 0.899** 1 成活率 survival rate – 0.033 0.219 0.177 0.172 1 注:**. 极显著相关(P<0.01) Note: **. very significant at 0.01 level (P<0.01) -
[1] TENDENCIA E A, FERMIN A C, DELA P M R, et al. Effect of Epinephelus coioides, Chanos chanos, and GIFT tilapia in polyculture with Penaeus monodon on the growth of the luminous bacteria Vibrio harveyi[J]. Aquaculture, 2006, 253(1/2/3/4): 48-56.
[2] 李莉萍, 王瑞, 黄婷, 等. 广西罗非鱼链球菌病流行菌株PCR鉴定和PFGE基因型分析[J]. 水产学报, 2013, 37(6): 927-935. [3] 吴南, 郭佳, 熊丽, 等. 罗非鱼链球菌病疫苗的研究进展[J]. 南方水产科学, 2013, 9(6): 90-96. [4] MAHAPATRA K D, GJERDE B, SAHOO P K, et al. Genetic variations in survival of rohu carp (Labeo rohita, Hamilton) after Aeromonas hydrophila infection in challenge tests[J]. Aquaculture, 2008, 279(1/2/3/4): 29-34.
[5] 肖广侠, 孔杰, 孟宪红, 等. 中国明对虾WSSV携带量、生长和抗WSSV育种值的相关性分析[J]. 水产学报, 2013, 37(7): 1009-1014. [6] KJØGLUM S, HENRYON M, AASMUNDSTAD T, et al. Selective breeding can increase resistance of Atlantic salmon to furunculosis, infectious salmon anaemia and infectious pancreatic necrosis[J]. Aquacult Res, 2008, 39(5): 498-505.
[7] 张英平, 陈松林, 孙何军, 等. 牙鲆抗迟缓爱德华菌病家系建立与抗病性能评价[J]. 水产学报, 2014, 38(11): 1917-1925. [8] 王炳谦, 姜再胜, 户国, 等. 虹鳟 (Oncorhynchus mykiss) 传染性造血器官坏死病(IHN)抗病力遗传参数估计及其抗病家系筛选[J]. 东北农业大学学报, 2013, 44(9): 120-126. [9] XIONG X M, CHEN Y L, LIU L F, et al. Estimation of genetic parameters for resistance to Aeromonas hydrophila in blunt snout bream (Megalobrama amblycephala)[J]. Aquaculture, 2017, 479(1): 768-773.
[10] 马爱军, 郭建丽, 王新安, 等. 大菱鲆选育家系抗鳗弧菌性能[J]. 中国水产科学, 2014, 21(3): 484-493. [11] 林明雪, 杨洁, 岳武成, 等. “吉富”系列罗非鱼生长性状的配合力、杂种优势与遗传相关分析[J]. 南方水产科学, 2016, 12(2): 1-6. [12] 张志敏, 李庆勇, 梁浩亮, 等. 不同亲本组合罗非鱼的繁殖性能及其子代雄性率的研究[J]. 中国农学通报, 2015, 31(8): 64-70. [13] PANDIT N P, BHANDARI R K, KOBAYASHI Y, et al. High temperature-induced sterility in the female Nile tilapia, Oreochromis niloticus[J]. Gen Comp Endocr, 2015, 213(1): 110-117.
[14] 赵丽慧, 筴金华, 张艳红, 等. 不同盐、碱度下3品系尼罗罗非鱼幼鱼网箱养殖的生长比较[J]. 南方水产科学, 2013, 9(4): 1-7. [15] 朱佳杰, 周宇, 谭芸, 等. 不同品系罗非鱼抗无乳链球菌病性能的评估[J]. 安徽农业科学, 2015, 43(10): 168-170. [16] 朱佳杰, 周宇, 敖秋桅, 等. 吉富罗非鱼抗病选育品系的养殖效果评估[J]. 安徽农业科学, 2015, 43(16): 157-158, 207. [17] 罗伟, 甘西, 敖秋桅, 等. 吉富罗非鱼选育系生长性能的评估[J]. 西南农业学报, 2016, 29(11): 2758-2762. [18] 朱佳杰, 李莉萍, 唐瞻杨, 等. 吉富罗非鱼家系构建及抗病力检测[J]. 南方水产科学, 2012, 8(6): 22-27. [19] 邱宏端, 陈智伟, 袁重桂, 等. 耐盐红螺菌对水产养殖病害细菌的拮抗作用[J]. 水产学报, 2003, 27(1): 69-74. [20] 李学军, 胡灿灿, 王磊, 等. 鱼类家系选育的研究进展[J]. 水产科学, 2016, 35(1): 81-86. [21] HENRYON M, JOKUMSEN A, BERG P, et al. Genetic variation for growth rate, feed conversion efficiency, and disease resistance exists within a farmed population of rainbow trout[J]. Aquaculture, 2002, 209(1/2/3/4): 59-76.
[22] WETTEN M, AASMUNDSTAD T, KJOGLUM S, et al. Genetic analysis of resistance to infectious pancreatic necrosis in Atlantic salmon (Salmo salar L.)[J]. Aquaculture, 2007, 272(1/2/3/4): 111-117.
[23] 陈松林, 田永胜, 徐田军, 等. 牙鲆抗病群体和家系的建立及其生长和抗病性能初步测定[J]. 水产学报, 2008, 32(5): 665-673. [24] XU T J, CHEN S L, JI X S, et al. MHC polymorphism and disease resistance to Vibrio anguillarum in 12 selective Japanese flounder (Paralichthys olivaceus) families[J]. Fish Shellfish Immun, 2008, 25(3): 213-221.
[25] QIANG J, YANG H, WANG H, et al. Interacting effects of water temperature and dietary protein level on hematological parameters in Nile tilapia juveniles, Oreochromis niloticus (L.) and mortality under Streptococcus iniae infection[J]. Fish Shellfish Immun, 2013, 34(1): 8-16.
[26] 樊敏. 刘忠强: 奥尼罗非鱼的坚守者[J]. 海洋与渔业, 2009, 1(10): 44-45. [27] HE Y Y, WANG Q Y, TAN L Y, et al. Estimates of heritability and genetic correlations for growth traits in Chinese shrimp Fenneropenaeus chinensis[J]. Agric Sci Technol, 2011, 12(4): 613-616.
[28] 唐瞻杨, 肖俊, 李莉萍, 等. 尼罗罗非鱼 (Oreochromis niloticus) 不同月龄性状的主成分与判别分析[J]. 海洋与湖沼, 2012, 43(2): 288-293. [29] GITTERLE T, SALTE R, GJERDE B, et al. Genetic (co)variation in resistance to White Spot Syndrome Virus (WSSV) and harvest weight in Penaeus (Litopenaeus) vannamei[J]. Aquaculture, 2005, 246(1/2/3/4): 139-149.
[30] 强俊, 杨弘, 马昕羽, 等. 吉富罗非鱼与奥里亚罗非鱼自繁与杂交F1遗传特性与抗病力分析[J]. 水产学报, 2015, 39(1): 32-41. [31] ARGUE B J, ARCE S M, LOTZ J M, et al. Selective breeding of Pacific white shrimp (Litopenaeus vannamei) for growth and resistance to Taura Syndrome Virus[J]. Aquaculture, 2002, 204(3/4): 447-460.
-
期刊类型引用(10)
1. 刘永新,邵长伟,郑先虎. 中国淡水重要养殖鱼类抗病和抗逆性状育种研究进展. 水产学报. 2025(02): 4-21 .  百度学术
百度学术
2. 张元,刘志刚,王春德,姚高友,张柯馨,展建强,陈麟广,吕文刚,钟茂程,刘付少梅. 扇贝新品系“紫海墨”F_4的生长特征和生产性能分析. 南方水产科学. 2022(01): 68-76 .  本站查看
本站查看
3. 申奔龙,薛宝宝,孟德龙,沈和定. 缢蛏早期耐高温家系建立及抗氧化能力测定. 浙江农业学报. 2022(02): 266-274 .  百度学术
百度学术
4. 朱佳杰,敖秋桅,谭芸,罗永巨,蒋和生. 吉富罗非鱼组蛋白酶B基因克隆及无乳链球菌感染后的表达分析. 南方农业学报. 2022(08): 2294-2301 .  百度学术
百度学术
5. 周欣,高风英,卢迈新. 鱼类抗病育种研究进展. 大连海洋大学学报. 2021(03): 510-523 .  百度学术
百度学术
6. 严楚,彭凯,张志妮. 罗非鱼链球菌综合防控技术研究进展. 广东畜牧兽医科技. 2021(06): 13-16 .  百度学术
百度学术
7. 敖秋桅,朱佳杰. 3个罗非鱼种群对4种病原菌的抗病力差异比较. 南方农业学报. 2020(03): 695-701 .  百度学术
百度学术
8. 付璐璐,王峥,王磊,李学军. 近10年水产动物抗逆育种研究进展. 江苏农业科学. 2020(16): 52-58 .  百度学术
百度学术
9. 方佳峰,李琪. 长牡蛎壳橙品系幼虫和稚贝的生长性状遗传参数评估. 中国海洋大学学报(自然科学版). 2020(11): 38-44 .  百度学术
百度学术
10. 郑雄,赵立朝,吴志强,张洁,黄亮亮,汪开成,张曼. 广西右江流域野生罗非鱼种群及其杂合性研究. 南方农业学报. 2019(12): 2797-2805 .  百度学术
百度学术
其他类型引用(8)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
