Comparison of phytoplankton community structure and water quality in different modes of abalone mariculture
-
摘要:
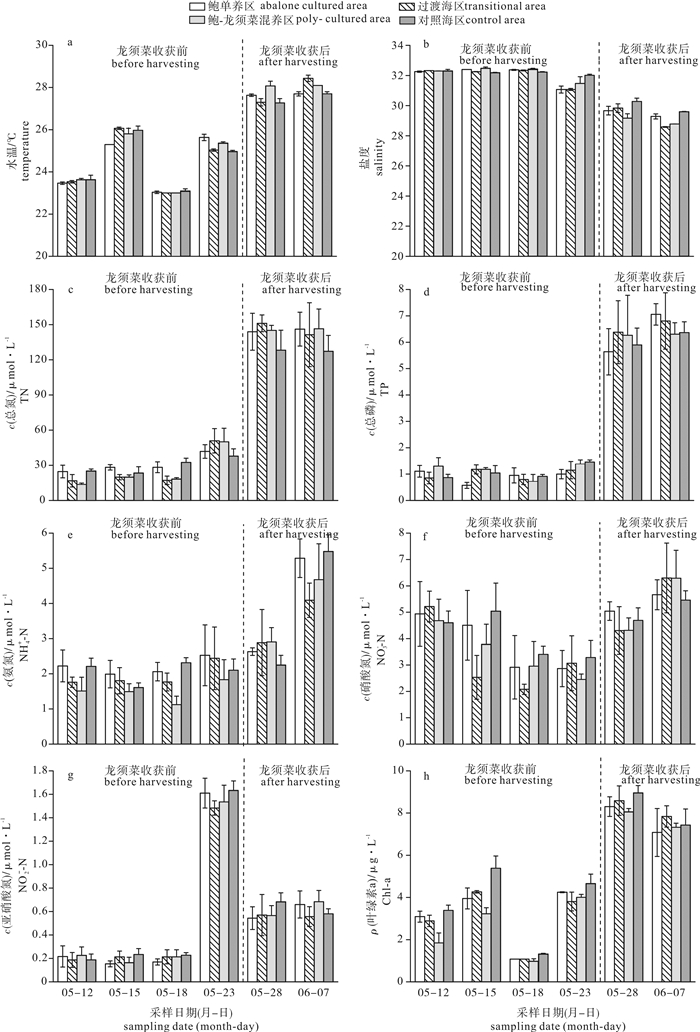
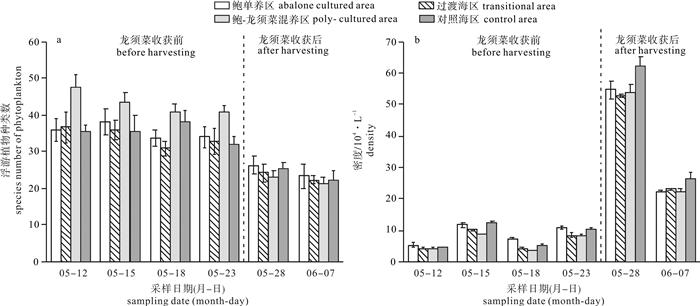
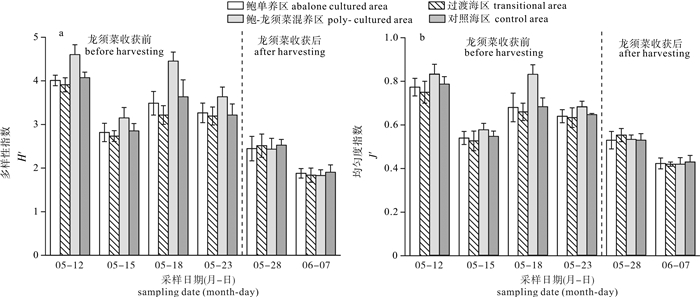
为研究不同鲍养殖模式对浮游植物群落结构和水环境的影响,于2016年5月至6月初大型海藻龙须菜(Gracilaria lemaneiformis)收获前后,选取汕头市南澳县深澳湾海域鲍单养区(A)、鲍与龙须菜混养区(GA)、过渡海区(M)和对照海区(C),对浮游植物群落及水体理化因子进行了6次高频调查。结果表明,调查海区共记录浮游植物4门45属84种,其中硅藻为优势类群,共37属71种。时间上比较,龙须菜收获后所有调查海区浮游植物细胞密度都显著高于龙须菜收获前(P < 0.05);各养殖区域间比较,龙须菜收获前鲍单养区浮游植物细胞密度显著高于鲍-龙须菜混养区(P < 0.05)。龙须菜收获前,鲍-龙须菜混养区总氮(TN)、总磷(TP)、氨氮(NH4+-N)和叶绿素a(Chl-a)浓度最低,多样性指数(H′)及均匀度指数(J′)最高; 龙须菜收获后各区无显著差异(P>0.05)。影响浮游植物群落结构特征的理化因子为TN、TP、水温和叶绿素a。该研究表明,鲍-大型海藻复合养殖模式可降低鲍养殖水体中氮、磷的浓度,并维持浮游植物群落结构相对的稳定。
Abstract:To study the effects of different modes of abalone mariculture on phytoplankton community structure and water environment, we carried out six surveys on the phytoplankton community and environmental factors in four mariculture areas (abalone culture area, Gracilaria lemaneiformis-abalone polyculture area, transition area and control area) in Shen′ao Bay, Nan′ao Island of Shantou City, from May to June, 2016. Altogether 84 species belonging to 45 genera of 4 phyla were recorded. The diatoms were the most dominant population with 37 genera and 71 species. For all culture areas, the average density of phytoplankton in after-harvest-period was higher than that in before-seaweed-harvest-period significantly (P < 0.05).The average density of phytoplankton in abalone culture area in before-harvest-period was higher than that in G.lemaneiformis-abalone polyculture area in after-harvest-period significantly (P < 0.05).In before-harvest-period, the concentrations of total nitrogen (TN), total phosphorus (TP), ammonia nitrogen (NH4+-N) and chlorophyll-a (Chl-a) in G.lemaneiformis-abalone polyculture area were the lowest, while the values of Shannon-Wiener index and Pielou′s were the highest. No significant difference was found in different culture areas in after-harvest-period. The phytoplankton community structure was affected by TN, TP, water temperature (T) and chlorophyll a significantly. It is indicated that G.lemaneiformis-ablone polyculture system can reduce the concentrations of nitrogen and phosphorus, maintaining relative stable community structure of phytoplankton.
-
Keywords:
- Gracilaria lemaneiformis /
- abalone /
- phytoplankton /
- integrated aquaculture /
- water quality
-
肠道细菌在鱼类生长发育 (包括免疫反应、消化代谢等) 过程中发挥着重要作用[1-2]。鱼类肠道细菌主要来自于周围的水环境及其进食[3]。随着鱼类的生长发育及其周围水环境的变化,其肠道菌群也不断变化[4-5]。鱼类物种[6]、食性[7]和生活水体环境[8]均可影响其肠道细菌的组成。有研究表明季节变化是影响鱼类肠道菌群结构的关键因素,对湖红点鲑 (Salvelinus namaycush) 肠道细菌的研究显示,季节变化解释了1/3的肠道细菌差异,致病性假单胞菌 (Pseudomonas) 在冬季最为丰富[9]。有研究发现,夏季和冬季的鱼类肠道菌群组成存在差异:冬季以革兰氏阳性发酵菌 (如乳酸菌) 为主,夏季以革兰氏阴性弧菌科细菌为主,表明季节因素对鱼类肠道菌群的组成有一定影响[10]。季节变化也会影响鱼类周围的水体环境,使水体物理、化学因子和细菌组成等发生变化。太湖水体中菌群结构存在显著的季节性变化,主要与水体的温度、总氮等因素有关[11]。Ward等[12]对温带沿海区域的研究表明,海水细菌群落在夏季和冬季形成了明显不同的特征,且年际间的季节变化相同。
珠江口是我国三大河口之一,生物饵料丰富,是许多经济鱼、虾、蟹和珍稀水生动物的产卵场、索饵场及洄游通道,珠江口内的万山渔场是我国六大渔场之一[13-14]。笔者团队前期分析了珠江口4种优势种鱼类—凤鲚 (Coilia mystus)、棘头梅童鱼 (Collichthys lucidus)、鳓 (Ilisha elongata) 和短吻鲾 (Leiognathus brevirostris) 的肠道细菌组成,发现不同鱼类物种中的肠道菌群存在差异,并且通过共现网络分析鱼类及其生活水环境的菌群关系发现,鱼类肠道与水体的菌群网络关系也存在物种差异[15]。然而,季节变化下鱼类肠道细菌与周围水环境细菌的关系尚缺乏研究。
棘头梅童鱼属鲈形目、石首鱼科,是一种底栖性的小型低级肉食性鱼类,体长一般为9~14 cm,主要以虾类等小型甲壳类动物为食,是珠江口常见的优势种和经济鱼类物种[16-18]。2017—2020年春季和秋季的底拖网调查发现,棘头梅童鱼在珠江口的种群整体生长发育良好,但其栖息地较1988年有所退化并处于过度捕捞状态[19]。本研究采用16S rRNA基因的高通量测序方法,比较分析了棘头梅童鱼肠道细菌群落结构的季节差异,以及季节变化对鱼类肠道细菌与水体细菌关系的影响,为揭示棘头梅童鱼的生物生态学特征提供基础资料。
1. 材料与方法
1.1 样品采集
2019年12月 (冬季) 、2020年8月 (夏季) 、2021年4月 (春季) 和2021年10月 (秋季) 4个季节均在珠江口内伶仃洋站点 (113°44.767'E, 22°24.022'N) 开展渔业资源调查,捕获棘头梅童鱼样品。在各个季节选取规格相近、体长约12 cm的棘头梅童鱼,每个季节9条。用75% (φ) 乙醇对鱼体进行消毒,用无菌剪刀从肛门沿腹部进行解剖,从靠近尾部与肛门部将肠剪断,将肠道内容物用无菌镊子挤出,主要分析肠道中的过路菌群。每3条棘头梅童鱼的肠道内容物混合后放入2 mL无菌离心管中,形成1个样本,每个季节获得3个样本。所有采集到的样品立即放入液氮中快速冷冻,直到实验室中进行DNA提取。与此同时,在相同地点采集表层和底层海水各5 L,考虑到采样站点的水深较浅 (仅6.8 m) ,因此将表、底层水样混合均匀后置于无菌采水袋中,然后立即用0.2 μm孔径的Millipore滤膜过滤,每张滤膜过滤1 L混合海水,每个季节收集3份滤膜,放入无菌离心管并置入液氮中保存,与肠道样品一同带回实验室。样品采集时间春季、夏季、秋季和冬季分别用Spr、Sum、Fal和Win表示,CL和W分别代表棘头梅童鱼和水样,数字代表样品标号。
1.2 DNA提取与高通量测序分析
利用QIAmp© Fast DNA stool mini kit试剂盒 (QIAGEN,美国) 提取鱼类肠道细菌总DNA,使用E.Z.N.A® Water DNA Kit试剂盒 (Omega,美国) 从海水滤膜中提取总DNA。然后,使用提取的肠道细菌总DNA和水样总DNA作为模板,通过带有Barcode的特异性引物341F (5'-CCTACGGGNGGCWGCAG-3') 和806R (5'-GGACTACHVGGGTATCTAAT-3') 对细菌16S rRNA基因的V3—V4区域进行PCR扩增。扩增后的PCR产物通过AMPure XP Beads进行纯化,并经过建库检测,将符合条件的样本文库送至Illumina HiSeq 2500平台进行高通量测序,测序服务由广州基迪奥生物科技有限公司提供。测序后的4个季节的棘头梅童鱼肠道细菌和水体细菌序列分别提交至NCBI的Sequence Read Archive (SRA) 数据库,其中鱼类肠道细菌序列号为SAMN39512587—SAMN39512598和SAMN35618142—SAMN35618150,水体细菌序列号为SRR27665057—SRR27665049和SRR12277938—SRR12277940。
1.3 数据分析
通过使用FASTP和FLASH工具对测序数据进行质量控制和序列拼接,进而通过UCHIME算法去除嵌合体,并使用Uparse软件进行OTUs聚类分析及物种注释,最后利用QIIME软件计算α多样性指标。根据样品中的OTUs的Bray-Curtis距离,进行主坐标分析 (Principal coordinate analysis, PCoA) 探讨不同季节棘头梅童鱼肠道及其所在水域的细菌组成变化。同时,通过相似性分析 (Analysis of similarities, ANOSIM) 比较了基于细菌Bray-Curtis距离的水体与鱼类肠道细菌组成的显著性差异。根据测序得到每个季节棘头梅童鱼肠道样品中OTUs个数的平均值,<1的值不纳入统计分析,采用Upset图分析肠道样品间的OTUs组成交互关系。
分析水环境中相对丰度大于1%的细菌优势属对棘头梅童鱼肠道菌群结构的影响,通过R4.3.1软件中vegdist函数将鱼类肠道细菌物种矩阵和水环境菌群结构数据矩阵转换为距离矩阵,随后使用Mantel函数对这两类矩阵进行Spearman相关性分析获得相关系数r值和p值,最后通过vegan和ggcor程序包完成Mantel检验,并进行可视化绘图。通过共现网络图分析鱼类肠道和水体环境中细菌优势属的关系,为了降低细菌网络关系的复杂性,在分析过程中保留了样品中相对丰度高于0.01%,且在2个及以上样本中出现的细菌优势属,然后在R 4.3.1软件中用cor函数计算Pearson相关系数,保留了相关系数r>0.7、p<0.05的数据,最后将这些数据导入Cytoscape软件中绘制网络图。
2. 结果
2.1 肠道和水体中的细菌组成
使用Illumina HiSeq平台对16S rRNA基因进行高通量测序,从肠道样品和水样中共获取3 408 215条原始序列。经过一系列的质量控制和过滤步骤后,保留2 992 669条有效序列 (Effective tags) ,这些有效序列占总原始序列的87.81%,经分类鉴定分析发现共有6 433个OTUs。
在门分类水平上,春季和夏季鱼类肠道细菌组成相似,均以变形菌门为优势类群,其相对丰度均高于90%,其次为拟杆菌门和厚壁菌门;秋季,鱼类肠道细菌以变形菌门 (98.97%) 占绝对优势,其余门类细菌的相对丰度均较低 (<0.1%);冬季,变形菌门是最主要的细菌门类,相对丰度为44.90%,其次是拟杆菌门 (13.02%) 和蓝细菌门 (12.39%),其余门类细菌相对丰度均低于10%。水环境菌群的季节变化与鱼类肠道细菌变化相似:春、夏两季水体菌群组成相似,均以拟杆菌门占据优势;秋季以变形菌门 (74.34%) 占绝对优势,冬季相对丰度最高的是放线菌门 (37.24%) 和变形菌门 (34.93%) (图1)。
![]() 图 1 门分类水平下棘头梅童鱼肠道和水环境中优势细菌的相对丰度注:春季、夏季、秋季、冬季分别用Spr、Sum、Fal、Win表示;CL和W分别代表棘头梅童鱼和水样;数字代表样品标号。Figure 1. Relative abundance of dominant bacteria in intestine of C. lucidus and water environment on phyla levelNote: Spring, summer, fall and winter are denoted by Spr, Sum, Fal, and Win, respectively; CL and W represent C. lucidus and water samples, respectively; and the numbers represent sample labels.
图 1 门分类水平下棘头梅童鱼肠道和水环境中优势细菌的相对丰度注:春季、夏季、秋季、冬季分别用Spr、Sum、Fal、Win表示;CL和W分别代表棘头梅童鱼和水样;数字代表样品标号。Figure 1. Relative abundance of dominant bacteria in intestine of C. lucidus and water environment on phyla levelNote: Spring, summer, fall and winter are denoted by Spr, Sum, Fal, and Win, respectively; CL and W represent C. lucidus and water samples, respectively; and the numbers represent sample labels.在属的分类水平上,春季和夏季的鱼类肠道中主要的细菌为嗜冷杆菌 (Psychrobacter),其相对丰度分别为88.34%和84.96%。秋季鱼类肠道中的优势菌属为发光杆菌 (Photobacterium, 89.74%)。然而,嗜冷杆菌和发光杆菌在冬季棘头梅童鱼肠道中极少发现,其相对丰度均低于0.1%。冬季鱼类肠道中相对丰度较高的属为假单胞菌 (Pseudomonas, 6.72%)、Sva0996 marine group (5.12%)、弧菌 (Vibrio, 4.90%) 和甲基杆菌 (Methylobacterium, 4.65%),其相对丰度均显著高于其余3个季节 (p<0.01)。
春季和夏季水环境中的细菌优势属为嗜冷杆菌和黄杆菌 (Tenacibaculum);秋季水环境中相对丰度最高的属为嗜冷杆菌,其次为交替单胞菌 (Alteromonas)、Salinimonas和假交替单胞菌(Pseudoalteromonas),而黄杆菌相对丰度较低;冬季水环境细菌组成与其余3个季节差异显著 (p<0.05),Candidatus_Actinomarina占据绝对优势。春、夏和秋3个季节中水环境的细菌优势属在冬季相对丰度均较低 (图2)。4个季节中棘头梅童鱼肠道样品中共有细菌属94个,春、夏和秋季特有的细菌属分别为15、23和11个,而冬季特有的属为134个,远高于其他3个季节 (图3)。
![]() 图 2 属水平下棘头梅童鱼肠道和水环境中优势菌群结构注:春季、夏季、秋季、冬季分别用Spr、Sum、Fal、Win表示;CL和W分别代表棘头梅童鱼和水样;数字代表样品标号。Figure 2. Composition of dominant bacterial genus in intestines of C. lucidus and water environment on genera levelNote: Spring, summer, fall and winter are denoted by Spr, Sum, Fal and Win, respectively; CL and W represent C. lucidus and water samples, respectively; and the numbers represent sample labels.
图 2 属水平下棘头梅童鱼肠道和水环境中优势菌群结构注:春季、夏季、秋季、冬季分别用Spr、Sum、Fal、Win表示;CL和W分别代表棘头梅童鱼和水样;数字代表样品标号。Figure 2. Composition of dominant bacterial genus in intestines of C. lucidus and water environment on genera levelNote: Spring, summer, fall and winter are denoted by Spr, Sum, Fal and Win, respectively; CL and W represent C. lucidus and water samples, respectively; and the numbers represent sample labels.![]() 图 3 不同季节棘头梅童鱼肠道中菌属数量 (a) 和肠道特有及共有的属数量 (b)注:春季、夏季、秋季、冬季分别用Spr、Sum、Fal、Win表示;CL代表棘头梅童鱼。Figure 3. Number of bacterial genera in intestines of C. lucidus in different seasons (a) and number of unique and common genera in intestines in different seasons (b)Note: Spring, summer, fall and winter are denoted by Spr, Sum, Fal, and Win, respectively; CL represent C. lucidus.
图 3 不同季节棘头梅童鱼肠道中菌属数量 (a) 和肠道特有及共有的属数量 (b)注:春季、夏季、秋季、冬季分别用Spr、Sum、Fal、Win表示;CL代表棘头梅童鱼。Figure 3. Number of bacterial genera in intestines of C. lucidus in different seasons (a) and number of unique and common genera in intestines in different seasons (b)Note: Spring, summer, fall and winter are denoted by Spr, Sum, Fal, and Win, respectively; CL represent C. lucidus.2.2 不同季节鱼类肠道和水环境中细菌多样性的变化
在4个季节中,冬季鱼类肠道菌群的Shannon指数 (4.88±0.18)、Simpson指数 (0.97±0.01) 和Pielou均匀度指数 (0.7±0.02) 均最高,而春、夏和秋季鱼类肠道菌群的多样性指数相对较低。水体菌群的多样性指数变化与鱼类肠道菌群变化相类似。在4个季节中,冬季水体中菌群多样性指数均最高,而春、夏和秋季水体菌群多样性指数差别较小(图4)。
![]() 图 4 棘头梅童鱼肠道和水体中的细菌群落多样性指数的季节变化注:春季、夏季、秋季、冬季分别用Spr、Sum、Fal、Win表示;CL和 W分别代表棘头梅童鱼和水样;不同字母表示存在显著性差异 (p<0.05)。Figure 4. Seasonal variation of bacterial diversity in intestines of C. lucidus and water environmentNote: Spring, summer, fall and winter are denoted by Spr, Sum, Fal and Win, respectively; CL and W represent C. lucidus and water samples, respectively; Different letters represent significant differences (p<0.05).
图 4 棘头梅童鱼肠道和水体中的细菌群落多样性指数的季节变化注:春季、夏季、秋季、冬季分别用Spr、Sum、Fal、Win表示;CL和 W分别代表棘头梅童鱼和水样;不同字母表示存在显著性差异 (p<0.05)。Figure 4. Seasonal variation of bacterial diversity in intestines of C. lucidus and water environmentNote: Spring, summer, fall and winter are denoted by Spr, Sum, Fal and Win, respectively; CL and W represent C. lucidus and water samples, respectively; Different letters represent significant differences (p<0.05).PCoA分析发现,春、夏季的棘头梅童鱼肠道样品细菌组成差异较小,基本重合在一起,但是这2个季节的肠道菌群组成与秋、冬季之间存在差异。不同季节水样细菌群落组成与肠道菌群的季节变化规律类似,说明春季与夏季的细菌组成结构相似,同时肠道样品和水样中春、夏季和秋、冬季之间的差异相对较大 (图5)。ANOSIM分析发现,春季和夏季肠道中细菌组成无显著性差异 (p=0.154),而其余季节间肠道菌群组成均存在显著性差异 (p<0.05);与此同时,相同季节中的棘头梅童鱼肠道和水环境之间的细菌组成差异显著 (p<0.05,表1)。
![]() 图 5 基于Bray-Curtis距离的水体和肠道细菌群落的主坐标分析注:春季、夏季、秋季、冬季分别用Spr、Sum、Fal、Win表示;CL和W分别代表棘头梅童鱼和水样;* 表示存在显著性差异 (p<0.05)。Figure 5. Principal coordinate analysis (PCoA) of bacterial composition in intestines of C. lucidus and water environment based on Bray-Curtis distanceNote: Spring, summer, fall and winter are denoted by Spr, Sum, Fal, and Win, respectively; CL and W represent C. lucidus and water samples, respectively; * represents significant differences (p<0.05).表 1 不同季节棘头梅童鱼肠道与水体中的细菌组成差异分析Table 1. Difference of bacterial composition between intestines of C. lucidus and water environment in different seasons
图 5 基于Bray-Curtis距离的水体和肠道细菌群落的主坐标分析注:春季、夏季、秋季、冬季分别用Spr、Sum、Fal、Win表示;CL和W分别代表棘头梅童鱼和水样;* 表示存在显著性差异 (p<0.05)。Figure 5. Principal coordinate analysis (PCoA) of bacterial composition in intestines of C. lucidus and water environment based on Bray-Curtis distanceNote: Spring, summer, fall and winter are denoted by Spr, Sum, Fal, and Win, respectively; CL and W represent C. lucidus and water samples, respectively; * represents significant differences (p<0.05).表 1 不同季节棘头梅童鱼肠道与水体中的细菌组成差异分析Table 1. Difference of bacterial composition between intestines of C. lucidus and water environment in different seasons分组Group r2 p Spr_CL-vs-Sum_CL 0.939 0.154 Spr_CL-vs-Fal_CL 0.814 0.030* Spr_CL-vs-Win_CL 0.871 0.025* Sum_CL-vs-Fal_CL 0.766 0.032* Sum_CL-vs-Win_CL 0.818 0.041* Fal_CL-vs-Win_CL 0.923 0.028* Spr_CL-vs-Spr_W 0.854 0.018* Sum_CL-vs-Sum_W 0.929 0.022* Fal_CL-vs-Fal_W 0.740 0.025* Win_CL-vs-Win_W 0.029* 注:春季、夏季、秋季、冬季分别用Spr、Sum、Fal、Win表示;CL和W分别代表棘头梅童鱼和水样;* 表示存在显著性差异 (p<0.05)。 Note: Spring, summer, fall and winter are denoted by Spr, Sum, Fal, and Win, respectively; CL and W represent C. lucidus and water samples, respectively; * represents significant differences (p<0.05). 2.3 水环境细菌优势种和肠道菌群的相互关系
利用Mantel 检验分析了4个季节中珠江口水体细菌 (平均相对丰度大于1%的属) 与棘头梅童鱼肠道细菌群落组成的相关性 (图6)。水环境中黄杆菌、嗜冷杆菌、Candidatus_Actinomarina、Salinimonas和OM60NOR5_clade 5个菌属与棘头梅童鱼肠道细菌组成之间存在显著相关性,是与棘头梅童鱼肠道菌群相互关系最高的细菌 (r>0.4, p<0.01)。在水环境中的其他优势属,如Salinimicrobium、革兰菌 (Gramella)、栖砂杆菌 (Arenibacter)、比齐奥氏菌 (Bizionia) 和赤杆菌 (Erythrobacter) 等与棘头梅童鱼肠道菌群之间的相关性较低 (r<0.2, p>0.05)。
春、夏、秋、冬4个季节中珠江口棘头梅童鱼肠道菌群和水环境菌群之间的网络图中,4个季节鱼类肠道和水体中共有属分别为38、54、50和27个,分别占相应季节总节点数量的47.72%、63.53%、58.14%和19.15%,冬季鱼类肠道和水环境的共有菌群比例最低,而夏季最高 (图7)。
3. 讨论
3.1 棘头梅童鱼肠道菌群多样性和优势属的季节性差异
细菌α多样性指数、PCoA分析和ANOSIM分析均表明不同季节棘头梅童鱼肠道菌群结构存在差异。α多样性指数越高,意味着肠道内的细菌种类越丰富,每种细菌的数量分布也相对均衡,说明肠道菌群抗干扰能力更强,有利于宿主适应外界环境[20]。以往研究也表明鱼类肠道菌群结构存在季节性差异,这可能与鱼类因季节变化而调整其活动模式、生理需求、摄食行为和生态习性有关[21-22]。珠江口棘头梅童鱼在春季和夏季产卵繁殖[19],饱食率低于其他季节[23],这可能是导致其春、夏季肠道菌群多样性低的原因。有研究表明,夏季黑鳊 (Megalobrama terminalis) 通过调节肠道微生物组成和降解酶的活动,为产卵和迁移提供能量,该时期肠道菌群多样性显著降低,这被认为是一种关键的生理策略[24]。秋季棘头梅童鱼肠道菌群多样性低,可能与其生长发育有关。秋季是珠江口棘头梅童鱼补充群体的育肥期,生物量明显增加[25]。以往研究表明,棘头梅童鱼在9—10月生长迅速,入冬后生长速率变缓[26]。鱼类不同的发育阶段也是影响肠道菌群结构的重要因素[27]。对草食性的草鱼 (Ctenopharyngodon idellus)、肉食性的鳜 (Siniperca chuatsi) 和南方鲇 (Silurus meridionalis) 3种鱼类,从孵化后到成年阶段的肠道微生物群落的变化研究发现,在鱼类快速发育时期,肠道菌群结构开始显著变化,肠道菌群多样性显著下降[28]。同样,对斑马鱼 (Danio rerio) 的研究也发现,快速发育时期其肠道菌群多样性最低[29]。湖红点鲑的肠道菌群多样性在秋季同样最低[9],与此同时生长速率较高[30]。不同季节鱼类的生长速率存在显著性差异[31],这可能是秋季棘头梅童鱼肠道菌群多样性最低的原因之一。冬季棘头梅童鱼肠道菌群多样性显著高于其他季节,可能与其摄食强度高有关。已有研究表明,虽然冬季棘头梅童鱼生长缓慢[26],但摄食等级和饱食率均高于其他季节[23,32]。珠江口棘头梅童鱼在春、夏季产卵,在冬季表现出较高的摄食强度,可能与其储备能量,为来年春季的洄游繁殖提供必要的能量有关[33-34]。摄食强度会影响宿主的营养状态和代谢活动,从而影响肠道微生物群落的组成,例如可促进某些有益微生物的生长[35]。研究发现,摄食后双棘双锯鱼 (Premnas biaculeatus) 的肠道菌群多样性会显著增加[36]。
以往的研究也表明,季节变化是影响鱼类肠道中细菌优势属发生变化的重要因素。不同季节奥尼罗非鱼 (Oreochromis niloticus×O. aureus) 肠道内的细菌总数和优势细菌属均有所不同,春季和夏季肠道中优势属均为气单胞菌 (Aeromonas),秋季为发光杆菌,而冬季为假单胞菌[37]。不同季节湖红点鲑的肠道细菌优势属也发生变化,春季为为寡单胞菌 (Stenotrophomonas),夏季为溶酪大球菌 (Macrococcus),秋季为梭菌科 (Clostridiaceae),而冬季为假单胞菌[9]。在本研究中,春季和夏季中棘头梅童鱼肠道细菌以嗜冷杆菌占绝对优势,秋季发光杆菌相对丰度最高,而冬季假单胞菌、弧菌、Sva0996_marine_group、甲基杆菌、芽孢杆菌 (Bacillus) 和Candidatus_Actinomarina相对丰度高于其他3个季节。研究发现嗜冷杆菌在促进鱼类生长、显著降低饵料系数、提高对食物的利用率等方面发挥重要作用[38]。在大西洋鲑 (Salmo salar) 的肠道菌群研究中,发光杆菌丰度同样在秋季最高[21]。有研究也发现发光杆菌是棘头梅童鱼肠道中常见的优势属[39]。假单胞菌作为肠道益生菌可改善水产动物的营养消化、生长以及提升动物的抗逆能力[40]。草鱼和鲫 (Carassius auratus) 肠道内的假单胞菌可分泌胞外消化酶,如蛋白酶、脂肪酶、淀粉酶和纤维素酶,促进了鱼类对饵料的消化吸收[41]。军曹鱼 (Rachycentron canadum) 体内也分离出具有较强的产蛋白酶能力的假单胞菌[42]。Sva0996_marine_group这种放线菌与宿主利用溶解性蛋白的能力有关[43]。甲基杆菌可以降解碳水化合物和短链脂肪酸[44]。芽胞杆菌具有抑制宿主的致病菌、加速生长和增强免疫力等作用,它们还产生各种细胞外酶,如淀粉酶、蛋白酶、脂肪酶,进一步帮助消化[45]。
3.2 季节变化对棘头梅童鱼肠道细菌和水体细菌关系的影响
本研究发现4个季节中冬季水体细菌的α多样性最高。以往研究表明,北半球的海水细菌多样性峰值出现在12月,南半球则出现在6月,全球海水细菌群落多样性均在冬季最高[46],并在夏季和冬季之间形成了明显的不同特征,这种年际变化每年都在重复[12],本研究结果与之一致。鱼类肠道菌群受水体细菌的影响,同时肠道环境能够塑造独特的细菌群落,从而形成一个复杂的微生物群落[47-48]。以往的研究表明肠道细菌与环境菌群结构之间存在相互联系,季节变化下的水环境细菌组成差异可能影响鱼类肠道菌群结构变化[49]。从Mantel t检验分析中发现水环境中的黄杆菌、嗜冷杆菌、Candidatus_Actinomarina、Salinimonas和OM60NOR5_clade 5个菌属对棘头梅童鱼肠道细菌组成影响最大。由共现网络图可以看出,春、夏季肠道和水体细菌共有的数量和比例较高,反映出更活跃的关系。春、夏季棘头梅童鱼肠道菌群更易受到水体菌群的影响,同时也是鱼类水体病原菌感染的高发期。春、夏季水体中高丰度的黄杆菌是一种致病菌,会导致海洋生物感染“烂皮病”,而且研究表明鱼类的“烂皮病”主要在春、夏季爆发[50]。在水温较高的季节,鱼体内菌群失调更频繁,鱼类感染疾病的风险增加,水体中的细菌更容易影响鱼类[51]。对凡纳滨对虾 (Litopenaeus vannamei) 养殖水环境和肠道细菌的研究也发现,季节变化会导致水环境中的细菌变化,夏季水体中病原体的生长更快,如念珠菌 (Candida) 等,会直接改变虾类肠道菌群的组成;当病原体数量增加时,Didymella、线黑粉菌 (Filobasidium) 等有益菌可能会被抑制,导致肠道环境更有利于病原体生存,从而增加了虾类疾病发生的风险、干扰了肠道菌群的稳定性[52]。已有研究表明,在繁殖期前后,鱼类脾脏的相对大小和头肾粒细胞的迁移活动均有所下降,可能会使鱼类对病原体的抵抗力下降,从而增加病原体感染的风险[53]。此外,研究发现在鲫生殖期间无法产生针对新抗原的抗体反应,繁殖所需能量的增加可能降低鱼类的免疫功能[54]。斑马鱼在繁殖期间,更容易摄入水体中的一些致病菌,如埃希氏菌 (Escherichia) 和拟杆菌 (Bacteroides) 等[55]。上述研究表明,春、夏季时棘头梅童鱼免疫力降低,同时水体中病原体的生长更快,可能是棘头梅童鱼肠道细菌群落组成在春、夏季更容易受到周围水体细菌群落影响的原因。秋季棘头梅童鱼肠道中相对丰度最高的属为发光杆菌。研究发现发光杆菌病是欧洲鲈 (Dicentrarchus labrax) 最严重的细菌性疾病之一,通常由水体中的发光杆菌感染鱼类[56]。冬季棘头梅童鱼摄食强度高,肠道菌群比较稳定。以往研究表明,摄食强度对鱼类的健康、抵抗力至关重要,低摄食率会导致鱼类免疫功能受损更容易感染疾病[57]。因此冬季棘头梅童鱼肠道菌群不易受水体细菌组成的影响。
4. 结论
通过16S rRNA基因高通量测序技术分析了珠江口梅童鱼肠道和水体环境中细菌组成的季节变化。棘头梅童鱼肠道菌群的多样性和肠道优势菌属均存在季节变化,冬季肠道菌群多样性最高。季节变化对珠江口棘头梅童鱼肠道菌群结构和水环境细菌组成均能产生影响,水环境中的黄杆菌、嗜冷杆菌、Candidatus_Actinomarina、Salinimonas 和OM60NOR5_clade 5个菌属对棘头梅童鱼肠道细菌组成的影响最大。未来将开展鱼类体表细菌和鱼鳃细菌等与水体细菌关系的研究,同时加强细菌功能方面的探讨。
-
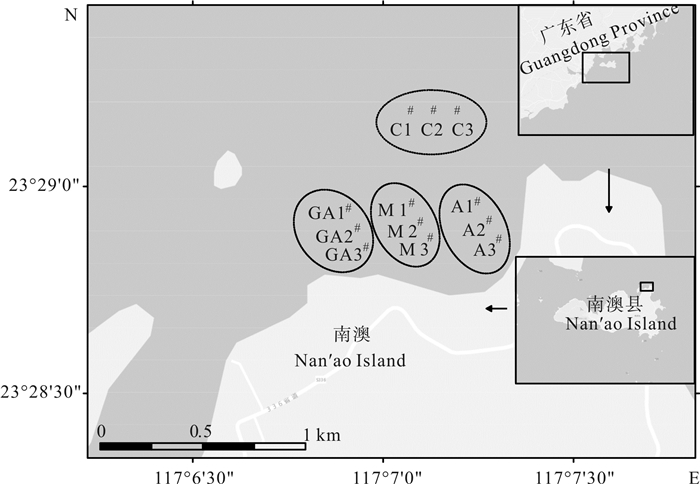
表 1 深澳湾浮游植物优势种类名录
Table 1 Catalogue of phytoplankton species in Shen′ao Bay
编号No. 种名species name 龙须菜收获前before harvesting 龙须菜收获后after harvesting 1 中肋骨条藻Skeletonema costatum + + 2 旋链角毛藻Chaetoceros curvisetus + + 3 尖刺拟菱形藻Pseudo-nitzschia pungens + + 4 海链藻Thalassiosira sp. + + 5 菱形藻Nitzschia sp. + + 6 劳式角毛藻Chaetoceros lorenzianus + 7 冕胞角毛藻Chaetoceros diadema + 8 丹麦细柱藻Leptocylindrus danicus + 9 刚毛根管藻Rhizosolenia setigera + 10 柔弱角毛藻Chaetoceros debilis + 11 笔尖形根管藻Rhizosolenia styliformis + 12 短角弯角藻Eucampia zodiacus + 13 具槽直链藻Melosira sulcata + 14 优美旭式藻Schroderella delicatula + + 15 海洋原甲藻Prorocentrum micans + 16 多甲藻Peridinium sp. + 注:+.优势种
Note:+. dominant species -
[1] 柯才焕.我国鲍鱼养殖产业现状与展望[J].中国水产, 2013(1):27-30. http://d.wanfangdata.com.cn/Periodical/zhongguosc201301010 [2] 杨宇峰.近海环境生态修复与大型海藻资源利用[M].北京:科学出版社, 2016:14-21. [3] 王朝晖, 韩博平, 胡韧, 等.广东省典型水库浮游植物群落特征与富营养化研究[J].生态学杂志, 2005, 24(4):402-405. http://d.wanfangdata.com.cn/Periodical/stxzz200504012 [4] 张学成, 费修绠, 王广策, 等.江蓠属海藻龙须菜的基础研究与大规模栽培[J].中国海洋大学学报(自然科学版), 2009, 39(5):947-954. http://d.wanfangdata.com.cn/Periodical/qdhydxxb200905017 [5] 陈宇炜, 高锡云.浮游植物叶绿素a含量测定方法的比较测定[J].湖泊科学, 2000, 12(2):185-188. doi: 10.18307/2000.0215 [6] SHANNON C E. The mathematical theory of communication (Reprinted)[J].Q Rev Biol, 1997, 14(4):306-317.
[7] PIELOU E C. An introduction to mathematical ecology[J].Bioscience, 1969, 24(2):7-12.
[8] 孙军, 刘东艳.多样性指数在海洋浮游植物研究中的应用[J].海洋学报, 2004, 26(1):62-75. http://d.wanfangdata.com.cn/Periodical/hyxb200401007 [9] YANG Y F, LIU Q, CHAI Z Y, et al. Inhibition of marine coastal bloom-forming phytoplankton by commercially cultivated Gracilaria lemaneiformis (Rhodophyta)[J].J Appl Phycol, 2015, 27(6):2341-2352. doi: 10.1007/s10811-014-0486-0
[10] 赖龙玉, 严正凛, 钟幼平. 4种不同藻类与鲍混养的初步试验[J].集美大学学报(自然科学版), 2014, 19(2):89-94. http://d.wanfangdata.com.cn/Periodical/jmdxxb-zr201402002 [11] 孙伟, 张涛, 杨红生, 等.龙须菜在滩涂贝藻混养系统中的生态作用模拟研究[J].海洋科学, 2006, 30(12):72-76. doi: 10.3969/j.issn.1000-3096.2006.12.015 [12] 周凯, 黄长江, 姜胜, 等. 2000-2001年拓林湾浮游植物群落结构及数量变动的周年调查[J].生态学报, 2003, 22(5):688-698. http://www.cnki.com.cn/Article/CJFDTotal-STXB200205010.htm [13] 王亮根, 杜虹, 陈伟洲, 等.深澳湾浮游植物群落特征及其多样性研究[J].生态科学, 2010, 29(3):200-206. http://d.wanfangdata.com.cn/Periodical/stkx201003002 [14] 张俊梅, 刘擎, 王庆, 等.汕头南澳白沙湾浮游植物群落结构及水体营养盐分布特征[J].水生态学杂志, 2012, 33(2):61-68. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=scan201202011&dbname=CJFD&dbcode=CJFQ [15] 汤坤贤, 游秀萍, 林亚森, 等.龙须菜对富营养化海水的生物修复[J].生态学报, 2005, 25(11):3044-3051. doi: 10.3321/j.issn:1000-0933.2005.11.035 [16] 陈露, 李纯厚, 戴明, 等.西沙永兴岛附近海域秋末氮磷营养盐加富对浮游植物生长限制的影响[J].南方水产科学, 2016, 12(4):125-130. http://www.schinafish.cn/CN/abstract/abstract9348.shtml [17] 王璐, 李冰, 孙盛明, 等.复合养殖系统中浮游植物群落结构及其与水环境因子的关系[J].水生态学杂志, 2015, 36(5):81-88. http://d.wanfangdata.com.cn/Periodical/sstxzz201505013 [18] GOLDMAN J C, MANN R. Temperature-influenced variations in speciation and chemical composition of marine phytoplankton in outdoor mass cultures[J].J Exp Mar Bio Ecol, 1980, 46(1):29-39. doi: 10.1016/0022-0981(80)90088-X
[19] 王妍, 张永, 王玉珏, 等.胶州湾浮游植物的时空变化特征及其与环境因子的关系[J].安全与环境学报, 2013, 13(1):163-170. http://d.wanfangdata.com.cn/Periodical/aqyhjxb201301036 [20] 杨晓改, 薛莹, 昝肖肖, 等.海州湾及其邻近海域浮游植物群落结构及其与环境因子的关系[J].应用生态学报, 2014, 25(7):2123-2131. http://d.wanfangdata.com.cn/Periodical/yystxb201407038 [21] MIYAHARA K, NAGAI S, ITAKURA S, et al. First record of a bloom of Thalassiosira diporocyclus in the Eastern Seto Inland Sea[J].Fish Sci, 1996, 62(6):878-882. doi: 10.2331/fishsci.62.878
[22] 陈善文, 高亚辉, 杜虹, 等.双环海链藻(Thalassiosira diporocyclus Hasle)赤潮[J].海洋与湖沼, 2004, 35(2):130-137. http://www.cnki.com.cn/Article/CJFDTotal-HYFZ200402003.htm [23] YAMAMOTO T, TSUCHIYA H. Physiological responses of Si-limited Skeletonema costatum to silicate supply with salinity decrease[J].Bull Plankton Soc Jpn, 1995, 42(1):1-17.
[24] 郭永坚, 罗昭林, 朱长波, 等.水产养殖对流沙湾浮游植物群落特征的影响[J].南方水产科学, 2015, 11(2):57-65. http://www.schinafish.cn/CN/abstract/abstract9197.shtml [25] ABREU M H, PEREIRA R, YARISH C, et al. IMTA with Gracilaria vermiculophylla:productivity and nutrient removal performance of the seaweed in a land-based pilot scale system[J].Aquaculture, 2011, 312(1/2/3/4):77-87.
[26] NEORI A, KROM M D, ELLNER S P, et al. Seaweed biofilters as regulators of water quality in integrated fish-seaweed culture units[J].Aquaculture, 1996, 141(3):183-199.
[27] 岳维忠, 黄小平, 黄良民, 等.大型藻类净化养殖水体的初步研究[J].海洋环境科学, 2004, 23(1):13-15. http://d.wanfangdata.com.cn/Periodical/hyhjkx200401004 [28] KEMP J, BRITZ P J, AGUEERO P. The effect of macroalgal, formulated and combination diets on growth, survival and feed utilisation in the red abalone Haliotis rufescens[J].Aquaculture, 2015, 448:306-314. doi: 10.1016/j.aquaculture.2015.06.016
[29] MULDERIJ G, SMOLDERS A P, DONK E. Allelopathic effect of the aquatic macrophyte, Stratiotes aloides, on natural phytoplankton[J].Freshw Biol, 2006, 51(3):554-561. doi: 10.1111/fwb.2006.51.issue-3
[30] 杨宇峰, 宋金明, 林小涛, 等.大型海藻栽培及其在近海环 境的生态作用[J].海洋环境科学, 2005, 24(3):77-80. http://d.wanfangdata.com.cn/Periodical/hyhjkx200503020 [31] 刘婷婷, 杨宇峰, 叶长鹏, 等.大型海藻龙须菜对两种海洋赤潮藻的生长抑制效应[J].暨南大学学报(自然科学与医学版), 2006, 27(5):754-759. http://d.wanfangdata.com.cn/Periodical/jndxxb200605022 [32] 李雅婷, 陈明, 曾帅霖, 等.饲料中添加龙须菜对眼斑拟石首鱼生长、脂肪酸组成、免疫及肠道的影响[J].南方水产科学, 2016, 12(1):85-93. http://www.schinafish.cn/CN/abstract/abstract9290.shtml [33] 李宵, 杨宇峰, 陈伟洲.大型海藻龙须菜对浮游植物群落结构影响的实验研究[J].生态科学, 2009, 28(2):102-106. http://d.wanfangdata.com.cn/Periodical/stkx200902002 [34] 李顺志, 张言怡, 王宝捷, 等.扇贝海带间养试验研究[J].海洋湖沼通报, 1983(4):71-77. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hyfb198304009&dbname=CJFD&dbcode=CJFQ [35] 欧俊新, 严正凛.南方鲍藻混养技术研究及其效益分析[J].集美大学学报(自然版), 2011, 16(3):172-177. http://d.wanfangdata.com.cn/Periodical/jmdxxb-zr201103003 [36] 赵素芬, 孙会强.杂色鲍与2种海藻混养效果研究[J].水产养殖, 2017, 38(1):40-46. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=scyz201701014&dbname=CJFD&dbcode=CJFQ -
期刊类型引用(4)
1. 高玉倩,夏苏东,高燕,高丽,李茂哲,蒋泽昊,薛东秀. 松江鲈幼鱼性腺分化的组织学观察. 海洋科学. 2024(10): 22-32 .  百度学术
百度学术
2. 杨育凯,黄小林,舒琥,林黑着,王岚,荀鹏伟,虞为,黄忠,李涛. 不同生境下黄斑篮子鱼肌肉营养成分比较分析. 南方水产科学. 2023(01): 128-135 .  本站查看
本站查看
3. 韩庆,刘可可,黄艳飞,田汉,王文彬,刘良国. 鲇繁殖生物学特征分析. 南方水产科学. 2023(05): 154-161 .  本站查看
本站查看
4. 邝杰华,陈刚,马骞,毛非凡,周启苓,黄建盛,施钢,张健东. 军曹鱼(Rachycentron canadum)性腺分化及首周年发育的组织学观察. 海洋学报. 2021(08): 128-138 .  百度学术
百度学术
其他类型引用(5)




 下载:
下载:






 粤公网安备 44010502001741号
粤公网安备 44010502001741号
