Phytoplankton community structure and its environmental adaptation in Fangcheng coastal waters
-
摘要:
于2014年9月~2015年8月按季度对防城港海域浮游植物进行4个航次的综合调查,结果显示,该海域共鉴定出浮游植物130种,其中硅藻门106种、甲藻门19种、金藻门2种、蓝藻门2种和绿藻门1种。浮游植物各站位的丰度为1.50×106~797.18×106个· m-3,均值为122.91×106个· m-3,且季节差异极显著(P < 0.01),呈秋季>夏季>冬季>春季的特征。群落Shannon-Wiener多样性指数为0.37~4.00,均值为2.60,处于轻度污染水平。该海域浮游植物依种类组成的相似性可划分为10 m以浅和10~20 m水深的2个类群(P=0.001)。冗余分析表明,4个季度中,所调查的8个环境因子共解释了57.51%~72.65%浮游植物丰度的空间变化;水深、水温、溶解氧(DO)和磷酸盐浓度是影响防城港海域浮游植物群落格局的主要环境因子且各因子影响程度存在季节差异。
Abstract:The seasonal surveys on phytoplankton community and their environmental variables were conducted in Fangcheng coastal waters from September 2014 to August 2015. A total of 130 species of phytoplankton were identified (106 species of Bacillariophyta, 19 species of Pyrrhophyta, 2 species of Chrysophyta, 2 species of Cyanophyta and 1 species of Chlorophyta). The abundance of phytoplankton ranged from 1.50×106 cells · m-3 to 797.18×106 cells · m-3 (average:122.91×106 cells · m-3) and had significant difference among seasons(P < 0.01)in a descending order of autumn>summer >winter >spring. The Shannon-Wiener diversity index ranged from 0.37 to 4.00 with an average of 2.60, indicating slight environmental pollution. The cluster analysis of species similarity between sites has found a coastal group with water depth of less than 10 m and a middle group with water depth between 10 m and 20 m (P=0.001). The result of redundancy analysis (RDA) shows that the eight environmental factors explained 57.51%~72.65% spatial variation of phytoplankton abundance. Depth, water temperature, dissolved oxygen and concentrations of phosphates were the dominant factors affecting the phytoplankton community in Fangcheng coastal waters and their importance varied with seasons.
-
Keywords:
- phytoplankton /
- community structure /
- redundancy analysis /
- Fangcheng coastal waters
-
浮游植物是海洋初级生产力的重要组成部分,在海洋食物网的物质循环和能量转化、维持海洋生态系统功能中扮演重要角色[1]。浮游植物丰度的分布格局及其时空变动受多种海洋环境因子的影响,同时该变动亦是水域生态环境、气候变化的重要响应指标之一[2];此外,浮游植物是许多植食性鱼类的重要饵料来源,对渔业资源动态管理具有重要参考价值[3]。
气候条件、海洋因子等驱动力因素对浮游植物地理分布格局的影响是海洋生态学研究的重要内容之一[4],浮游植物分布和环境的相关性与研究尺度紧密相关[5],如底质类型在小尺度比例上对海洋种类的分布具有重要影响,而大尺度上物种的分布中季风、洋流等气候条件则是主要影响因子[6-7]。北部湾北部海域是二长棘鲷[Paerargyrops edita(Tanaka)]幼鱼、幼虾及其他多种经济鱼类的关键栖息地[8],而防城港海域是北部湾东北部的重要水域,与越南海域交界,具有独特的地理与生态特征,对北部湾的渔业资源补充起重要作用[9]。随着沿岸海洋经济的不断发展,防城港沿海港口与旅游等产业分布越来越密集,近海人类活动对防城港海域生态环境压力日益增加。有关防城港海域浮游植物群落的生态学研究范围主要集中于防城港湾内[10],而对湾外及其邻近海域的系统研究较少[11]。研究防城港等北部湾近岸重要水域的浮游植物群落结构,有助于深入了解近岸海湾与整个北部湾、南海北部浮游植物空间格局在不同时空尺度下的演变进程,为近海生态保护、水产资源增殖潜力整体规划及渔业资源变动机制的研究提供理论支撑。
浮游植物栖息生境中的多种环境变量如温度、盐度、溶解氧(DO)等共同影响其分布与变化,但这些因子的影响力大小不尽相同[12]。典范对应分析(canonical correspondence analysis,CCA)和冗余分析(redundancy analysis,RDA)能够将物种分布格局的梯度变化与环境因子的变化进行整合分析,即能够反映物种分布的梯度变化与环境变量的相关性,在浮游生物、鱼类群落生态学研究中已多有应用,笔者应用RDA方法解析防城港海域浮游植物群落结构与环境因子的关系,以了解其分布格局的季节变动。
1. 材料与方法
1.1 调查方法
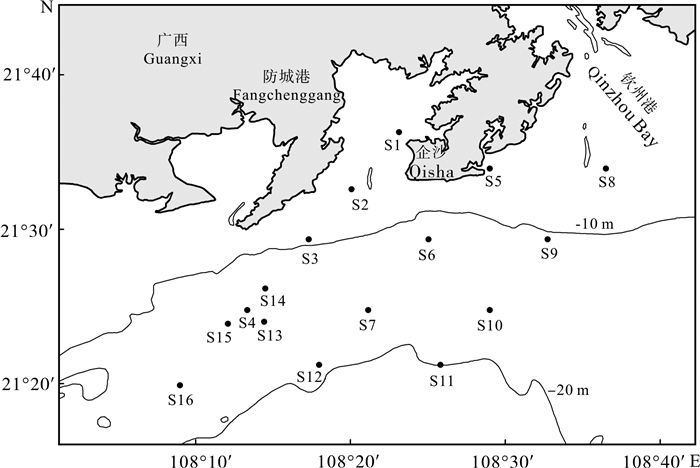
于2014年9月~2015年8月按季度对防城港海域浮游植物进行4次采样,共设16个(S1~S16)调查站位(图 1)。
现场调查采样和分析依《海洋监测规范》[13]与《海洋调查规范》[14]进行,各站位采集表层海水1 L于样品瓶中,立即加入15 mL鲁哥氏液摇匀固定,带回实验室静置48 h后,用恒流泵吸取上清液进行浓缩,约浓缩至100 mL,之后在Leica显微镜下完成浮游植物分类鉴定、计数。同步调查各个站位相关环境参数,用船载探鱼仪测水深,透明度盘测透明度,YSI 556MPS测水温、盐度、pH和DO,水样经现场0.45 μm孔径滤膜过滤后,冷冻运至实验室测定营养盐。
1.2 数据处理与统计分析
1.2.1 多样性分析
优势度用Y [15]:
$ Y = \frac{{{n_i}}}{N} \times {f_i}(\mathit{Y} \ge 0.02\;视为优势种) $
(1) 多样性用Shannon-Wiener指数[16]:
$ H' =-\sum\limits_{i = 1}^S {{P_i} \times {\rm{lo}}{{\rm{g}}_2}{P_i}} $
(2) 丰富度用Margalef指数[17]:
$ D = \frac{{S-1}}{{{\rm{lo}}{{\rm{g}}_2}N}} $
(3) 均匀度用Pielou指数[18]:
$ J' = \frac{{H'}}{{{\rm{lo}}{{\rm{g}}_2}S}} $
(4) 上式中ni为第i种的总个数,N为样品中所有物种的总个数,fi为该种在样品中的出现频率,S为样品中的物种总种数,Pi为第i种的个数占样品中总个数的比例(Pi=ni/N)。多样性指数评价标准[19]:当H′ < 1为重污染,H′=1~2为中度污染,H′=2~3为轻度污染,H′=3~4为清洁区域。
1.2.2 多元统计分析
根据各站位浮游植物出现与否,将4个季度的物种数据转化为0和1,以16个站位的浮游植物种类作为矩阵的变量,指标间距离采用欧几里得距离,通过SPSS 19.0用离差平方和法(Ward′s method)进行分层聚类[20]。采用相似性分析(analysis of similarities,ANOSIM)检验不同类群种类组成差异的显著性[21]。
对各季浮游植物物种数据进行筛选,选取出现频率≥20%,且至少在一个站位的相对丰度≥1%的物种。为了减少丰度较高种与罕见种对分析的影响,使物种数据和环境数据趋于正态分布,对物种矩阵与环境矩阵(pH除外)均进行lg(x+1)转换[22-23]。
应用R 3.2.3软件的Vegan程序包[24]分别对各季筛选出的浮游植物种类×丰度矩阵进行去趋势对应分析(detrended correspondence analysis,DCA)[25],如果DCA分析前4个轴的最大值小于3,选线性模型(RDA)更合适;介于3~4之间,RDA和单峰模型(CCA)均适用;大于4,选CCA更好。选出合适模型进行分析,之后对排序结果采样用999次蒙特卡罗(Monte Carlo)置换检验分析环境因子对浮游植物分布的影响是否具有统计学意义[26]。
2. 结果与分析
2.1 种类组成
防城港海域4个季度共鉴定出浮游植物5门47属130种(包含变种与变型),其中硅藻门37属106种、甲藻门6属19种、金藻门2属2种、蓝藻门1属2种和绿藻门1属1种。从季节变化来看,秋季2门48种(含1个变型),硅藻(46种)占总种类数的95.83%,甲藻(2种)占4.17%,以角毛藻属(15种)和根管藻属(7种)最多;冬季1门40种,全为硅藻种类,以角毛藻属(9种)和根管藻属(7种)最多;春季5门99种(含1个变型),硅藻(58种)占78.79%,甲藻(18种)占18.18%,金藻、蓝藻和绿藻(均为1种)各占1.01%,以角毛藻属(10种)、根管藻属(8种)和甲藻的原多甲藻属(7种)最多;夏季4门48种(含1个变种),硅藻(39种)占78.08%,甲藻(6种)占17.81%,蓝藻(2种)占2.74%,金藻(1种)占1.37%,以角毛藻属和根管藻属(均为8种)最多。综上,防城港海域浮游植物以硅藻类群为主、有一定比例的甲藻、偶尔出现其他门类。
2.2 优势种类
防城港海域浮游植物优势种的变化存在季节更替(表 1)。秋季浮游植物优势种有9种,第一优势种是并基角毛藻单胞变型(Chaetoceros decipiens f.singularis),优势度为0.186,丰度为0.9×106~184×106个· m-3,平均为44.41×106个· m-3,在16个站位均出现;冬季有8种,第一优势种是柔弱角毛藻(C.debilis),优势度为0.178,丰度为0~38.22×106个· m-3,平均为15.04×106个· m-3,累计在14个站位出现;春季有4种,第一优势种是日本角毛藻(C.nipponicus),优势度为0.355,丰度为0~54×106个· m-3,平均为10.54×106个·m-3,在14个站位出现;夏季有2种,第一优势种是旋链角毛藻(C.curvisetus),优势度为0.244,丰度为0~488×106个· m-3,平均为99.06×106个· m-3。
表 1 浮游植物优势种及优势度Table 1. Dominant species and dominance of phytoplankton物种species 秋季autumn 冬季winter 春季spring 夏季summer 变异辐杆藻Bacteriastrum furcatum 0.028 窄隙角毛藻Chaetoceros affinis 0.053 绕孢角毛藻Chaetoceros cinctus 0.028 旋链角毛藻Chaetoceros curvisetus 0.244 柔弱角毛藻Chaetoceros debilis 0.178 并基角毛藻单胞变型Chaetoceros decipiens f. singularis 0.186 劳氏角毛藻Chaetoceros lorenzianus 0.098 短刺角毛藻Chaetoceros messanense 0.021 日本角毛藻Chaetoceros nipponicus 0.355 0.058 根状角毛藻Chaetoceros radicans 0.043 冕孢角毛藻Chaetoceros subsecundus 0.028 脆根管藻Dactyliosolen fragilissimus 0.049 印度半管藻Hemiaulus indicus 0.077 柔弱伪菱形藻Pseudo-nitzschia delicatissima 0.039 0.111 刚毛根管藻Rhizosolenia setigera 0.094 中华根管藻Rhizosolenia sinensis 0.084 中肋骨条藻Skeletonema costatum 0.042 菱形海线藻Thalassionema nitzschioides 0.040 圆海链藻Thalassiosira gravida 0.090 伏氏海毛藻Thalassiothrix frauenfeldii 0.083 0.176 2.3 丰度与时空变化
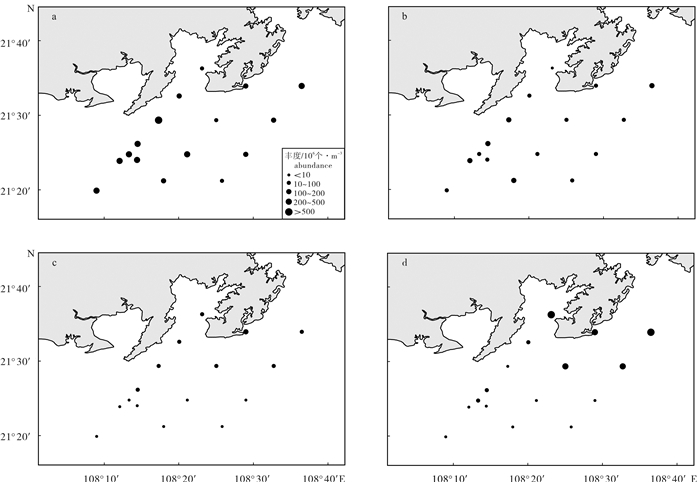
调查结果表明,各站位浮游植物丰度年变化为1.50×106~797.18×106个· m-3,平均丰度为122.91×106个· m-3。秋季浮游植物平均丰度为239.30×106个· m-3,受并基角毛藻单胞变型影响,S3站位丰度最高;冬季平均丰度为73.90×106个· m-3,受伏氏海毛藻(Rhizosolenia setigera)和印度半管藻(Hemiaulus indicus)影响,S14站位丰度最高;春季平均丰度为25.96×106个· m-3,受刚毛根管藻(Rhizosolenia setigera)和日本角毛藻的影响,S5站位丰度特别高;夏季平均丰度为152.48×106个· m-3,受旋链角毛藻和日本角毛藻影响,S8站位丰度最高。单因素方差分析(ANOVA)表明防城港海域各站位浮游植物丰度季节差异极显著(P < 0.01),呈秋季>夏季>冬季>春季的特征;从空间上看,防城港海域浮游植物丰度秋冬季随水深呈递增趋势,春夏季则反之(图 2)。
2.4 多样性水平
各站位浮游植物H′年变化为0.37~4.00,平均为2.60,处于轻度污染水平;J′年变化为0.10~1.00,平均为0.75;D年变化为0.09~1.75,平均为0.78。单因素方差分析表明,防城港海域各站位浮游植物多样性水平季节差异极显著(P < 0.01),H′为秋季(3.03)>冬季(2.88)>春季(2.73)>夏季(1.74);J′为冬季(0.82)>秋季(0.78)>春季(0.72)>夏季(0.69);D为春季(1.08)>秋季(0.87)>冬季(0.69)>夏季(0.47)。综上,夏季H′、J′、D平均值均为最低。
2.5 群落结构
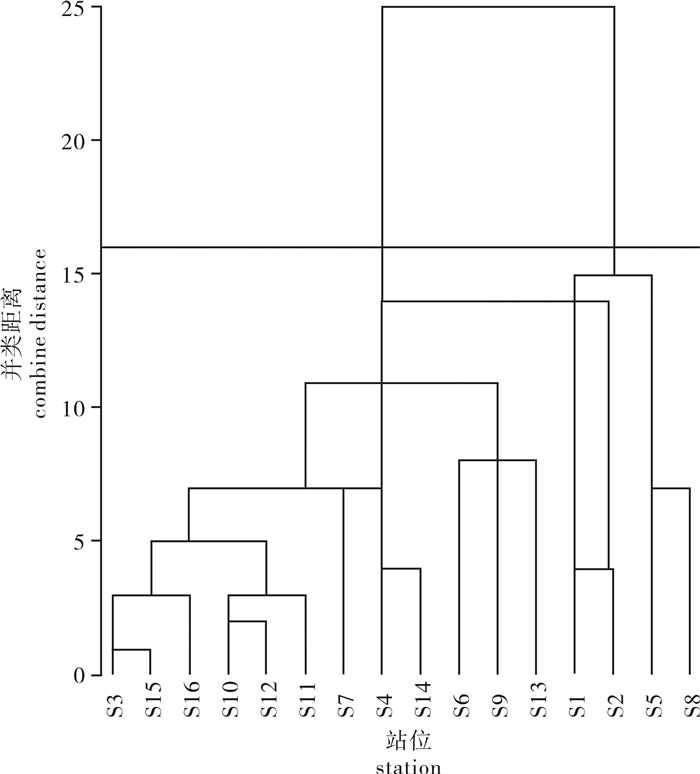
浮游植物种类组成相似性聚类结果表明(图 3),空间地理位置分布相近的站位具有较高的相似性。防城港海域浮游植物群落可划分为两类,S1、S2、S5和S8站位归为类群Ⅰ,主要分布于10 m等深线以浅的近岸海域,仅在类群Ⅰ出现的种类主要有大西洋角毛藻(C.atlanticus)、拟旋链角毛藻(C.pseudocurvisetus)、扭链角毛藻(C.tortissimus)、热带骨条藻(Skeletonema tropicum)、细柱藻(Leptocylindrus sp.)和嘴状角毛藻(C.rostratus);其余12个站位归为类群Ⅱ,主要分布于10~20 m等深线之间的离岸海域,仅在类群Ⅱ出现的种类主要有并基角毛藻(C.decipiens)、东海原甲藻(Prorocentrum donghaiense)、霍氏半管藻(H.hauckii)、洛氏角毛藻(C.lorenzianus)、奇异角毛藻(C.paradoxus)和斯氏根管藻(R.stolterforthii)。ANOSIM检验表明类群间的种类组成差异极显著(R=0.789,P=0.001)。
2.6 环境适应分析
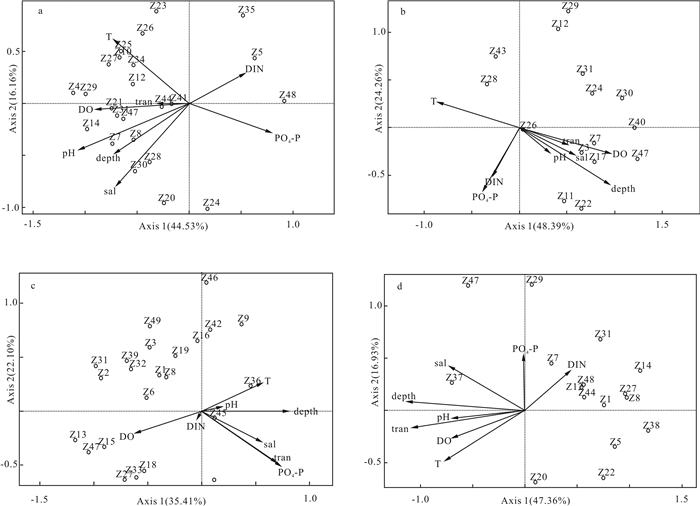
DCA结果表明各季排序轴最大长度分别为2.63(秋季)、1.85(冬季)、2.89(春季)、3.29(夏季),其中有3个季节小于3,故选择RDA线性排序。参与排序的浮游植物有49种(附录1),环境指标有8个。从RDA结果来看(图 4),首先,防城港海域浮游植物主要受到水深、水温、DO和磷酸盐的影响,这些环境因子在第一、第二排序轴上共解释了57.51%~72.65%的各站位浮游植物的丰度变化。其次,各因子对浮游植物空间格局的影响程度存在季节差异(表 2),秋季影响极显著的因子是pH和盐度,冬季则是水深和DO,春季是磷酸盐和透明度,夏季是水深和透明度。此外,环境因子对不同季节优势种的影响存在较大差异,有时甚至完全相反,秋季第一优势种并基角毛藻单胞变型(Z4)与DO呈正相关,但与氮磷营养盐呈负相关;冬季第一优势种柔弱角毛藻(Z30)与DO呈正相关,与水温和营养盐呈负相关;春季第一优势种日本角毛藻(Z27)与DO呈正相关,与水温和水深呈负相关;夏季第一优势种旋链角毛藻(Z38)与无机氮呈正相关,与温度和水深呈负相关。
附录1 RDA分析的浮游植物名录附录1. List of phytoplankton for RDA编号No. 物种species Z1 北方劳德藻Lauderia borealis Z2 笔尖形根管藻Rhizosolenia styliformis Z3 变异辐杆藻Bacteriastrum furcatum Z4 并基角毛藻单胞变型Chaetoceros decipiens f. singularis Z5 叉角藻Tripos furca Z6 叉状多甲藻Peridinium furca Z7 脆根管藻Dactyliosolen fragilissimus Z8 丹麦细柱藻Leptocylindrus danicus Z9 东海原甲藻Prorocentrum donghaiense Z10 短刺角毛藻Chaetoceros messanense Z11 短角弯角藻Eucampia zodiacus Z12 伏氏海毛藻Thalassiothrix frauenfeldii Z13 刚毛根管藻Rhizosolenia setigera Z14 根状角毛藻Chaetoceros radicans Z15 海洋角毛藻Chaetoceros pelagicus Z16 海洋原甲藻Prorocentrum micans Z17 霍氏半管藻Hemiaulus hauckii Z18 劳氏角毛藻Chaetoceros lorenzianus Z19 里昂多甲藻Peridinium leonis Z20 菱形海线藻Thalassionema nitzschioides Z21 洛氏角毛藻Chaetoceros lorenzianus Z22 冕孢角毛藻Chaetoceros subsecundus Z23 膜状舟形藻Meuniera membranacea Z24 平滑角毛藻Chaetoceros laevis Z25 奇异角毛藻Chaetoceros paradoxus Z26 绕孢角毛藻Chaetoceros cinctus Z27 日本角毛藻Chaetoceros nipponicus Z28 日本星杆藻Asterionellopsis glacialis Z29 柔弱根管藻Guinardia delicatula Z30 柔弱角毛藻Chaetoceros debilis Z31 柔弱伪菱形藻Pseudo-nitzschia delicatissima Z32 斯氏几内亚藻Guinardia striata Z33 梭形多甲藻Peridinium fusus Z34 太阳双尾藻Ditylum sol Z35 细弱海链藻Thalassiosira subtilis Z36 小形圆筛藻Coscinodiscus minor Z37 新月菱形藻Nitzschia closterium Z38 旋链角毛藻Chaetoceros curvisetus Z39 翼鼻状藻Proboscia alata Z41 优美辐杆藻Bacteriastrum delicatulum Z40 印度半管藻Hemiaulus indicus Z42 原多甲藻Protoperidinium sp. Z43 圆海链藻Thalassiosira gravida Z44 窄隙角毛藻Chaetoceros affinis Z45 长菱形藻Nitzschia longissima Z46 针杆藻Synedra sp. Z47 中华根管藻Rhizosolenia sinensis Z48 中肋骨条藻Skeletonema costatum Z49 舟形藻Navicula sp. 表 2 各环境因子对浮游植物丰度影响的显著性Table 2. Significance of effect of environmental factors on phytoplankton abundance环境因子
environmenatal factor秋季autum 冬季winter 春季spring 夏季summer R2 P R2 P R2 P R2 P 水深depth 0.39 0.043* 0.78 0.001** 0.42 0.025* 0.67 0.002** 透明度transparancy 0.06 0.675 0.18 0.252 0.57 0.005** 0.64 0.004** 温度temperature 0.50 0.013* 0.48 0.013* 0.26 0.133 0.41 0.034* 溶解氧DO 0.45 0.019* 0.59 0.006** 0.29 0.091 0.29 0.102 盐度salinity 0.60 0.003** 0.26 0.133 0.28 0.118 0.37 0.038* pH 0.73 0.002** 0.11 0.422 0.03 0.848 0.27 0.132 无机氮DIN 0.22 0.176 0.19 0.252 0.00 0.996 0.27 0.119 磷酸盐PO4-P 0.41 0.040* 0.31 0.082 0.62 0.002** 0.15 0.338 注:R2.环境因子与物种的相关系数;*.P < 0.05表示显著差异;* *. P < 0.01表示极显著差异 Note:R2. correlation coefficient between environmental factors and species;*. significant difference (P < 0.05);* *. very significant difference (P < 0.01) 3. 讨论
3.1 浮游植物群落特征与优势种变化
防城港海域浮游植物以硅藻类群为主,硅藻占总种类数的81.54%,这与中国黄海、南海其他近海海域相似[27-30],虽然此次调查浮游植物种类数量丰富,但四季均出现的种类仅8种,为北方劳德藻(Lauderia borealis)、伏氏海毛藻、刚毛根管藻、菱形海线藻(Thalassionema nitzschioides)、日本角毛藻、柔弱伪菱形藻(Pseudo-nitzschia delicatissima)、圆海链藻(Thalassiosira gravida)和中华根管藻(R.sinensis),均属于硅藻门;3个季节出现的有17种;其余种2个或1个季节出现。
防城港海域浮游植物优势种变化存在季节更替,秋季最主要的优势种是并基角毛藻单胞变型,冬季是伏氏海毛藻和柔弱角毛藻,春季是日本角毛藻,夏季是旋链角毛藻。2014年徐姗楠等[11]研究得出防城港海区丰水期主要优势种是柔弱伪菱形藻,枯水期主要优势种是伏氏海毛藻,而此研究发现柔弱伪菱形藻虽是秋、冬季的优势种但不是最主要的优势种(优势度较小),伏氏海毛藻则是冬季主要优势种,不同之处可能是采样方法(网采和水采)以及调查站位之间的差异引起的,但总体上优势种的组成相似;2007年庄军莲等[10]研究提到防城港湾内优势种是中肋骨条藻(S.costatum)和菱形海线藻,尤其在夏季中肋骨条藻丰度很高,可能会引发赤潮,而此研究发现这2种藻类虽是秋季的优势种但不是最主要的优势种,且中肋骨条藻丰度所占比例并不足以引发赤潮,说明防城港湾内和湾外及其附近海域水质状况存在很大差异,可能原因是湾内受水体营养盐浓度、入海径流、温盐等因素的影响较湾外更大;湾内的水质通常劣于湾外,很可能导致中肋骨条藻大量繁殖,而湾外及其附近海域的环境并没有使中肋骨条藻出现大量繁殖,说明水质污染较轻,这与此研究的Shannon-Wiener多样性指数评价结果吻合。
3.2 浮游植物多样性及其污染指示作用
多样性指数常被用来监测淡水、海水中生物群落结构的变化,同时与水域污染程度密切相关,被认为是能较好评价水域污染程度的工具[31-32]。在淡水浮游植物调查中,黄祥飞[33]提到3种多样性指数评价标准,H′=0~1为重度污染,1~2为中度污染,2~3为轻度污染;J′=0~0.3为重度污染,0.3~0.5为中度污染,0.5~0.8为轻度污染;D=0~1为重度污染,1~3为中度污染,大于3为轻度污染或无污染。若依上述标准,防城港海域分别达到了轻度污染(H′=2.60)、轻度污染(J′=0.75)和重度污染(D=0.78)水平,显然三者评价结果不一致,相关研究[34-35]亦有类似结论,这进一步表明淡水评价标准不适于海洋;而在海洋浮游植物调查中,2007年编写的《海洋监测规范》第7部分-近海污染生态调查和生物监测[19]只是提到1种多样性指数评价标准,H′ < 1为重污染,H′=1~2为中度污染,H′=2~3为轻度污染,H′=3~4为清洁区域,目前尚未发现在海洋调查中有3种多样性指数综合评价的标准。因此,笔者认为海洋浮游植物具有其自身的特点,3个指数的综合评价会比单个指数较为可靠,可制定出适合海洋调查的3个多样性指数综合评价标准,鉴于此文研究重点在于浮游植物群落结构与环境因子的关系,后续将对该海域浮游植物进行长时间观测,以期确定各污染水平的阈值,结合其他水体指标不断验证和修正,制定出3个多样性指数综合评价标准,用来对水体健康状况做初步的判断。
3.3 浮游植物丰度与环境因子的关系
浮游植物群落结构复杂且对环境变化较为敏感,因此成为反映水域变化状况的自然指标[36]。此文采用RDA分析浮游植物的空间格局及其与环境的梯度变化,从定量的角度进一步揭示了防城港海域各季浮游植物与环境因子之间的关系。
一直以来,水温被认为是影响近海浮游植物的最主要环境因子。杜虹等[37]研究发现温度、盐度和pH是影响汕头港浮游植物群落变化的主要因子;宋伦等[38]研究表明温度、盐度、化学需氧量(chemical oxygen demand,COD)等是影响大亚湾浮游植物多样性的主要因子;王迪等[39]研究发现钦州湾浮游植物丰度主要受温度、盐度、无机氮和磷酸盐的影响,而不同季节引起浮游植物群落差异的环境因子不同;傅明珠等[15]研究发现锦州湾春季和夏季影响浮游植物的环境因子分别是温度和硝酸盐;周然等[40]研究认为影响渤海湾浮游植物分布的因子春季是营养盐,夏季是水温与氨氮(NH3-N)。此研究表明,秋、冬季pH、DO和水温是影响防城港海域浮游植物群落结构的关键因子,可能原因是秋、冬季近海温度下降,海水中DO升高,为适应温度变化,浮游植物新陈代谢加快,需氧量增加,同时水体的酸碱性对浮游生物细胞活性和代谢起着重要的作用;而春、夏季水深、透明度和营养盐成为影响防城港海域浮游植物群落结构的关键因子,可能原因是春、夏季降雨充沛,陆源径流输入和人类活动干扰增强,营养盐给浮游植物提供了丰富的物质基础,近岸海水透明度发生变化,而水深较深的离岸海域受到这些影响较小。
由于浮游植物群落结构与环境因子的响应规律复杂,今后还需要长期对其进行监测,以积累更多资料,进一步分析完善防城港海域浮游植物群落演变趋势及其与环境因子的响应机制。
-
表 1 浮游植物优势种及优势度
Table 1 Dominant species and dominance of phytoplankton
物种species 秋季autumn 冬季winter 春季spring 夏季summer 变异辐杆藻Bacteriastrum furcatum 0.028 窄隙角毛藻Chaetoceros affinis 0.053 绕孢角毛藻Chaetoceros cinctus 0.028 旋链角毛藻Chaetoceros curvisetus 0.244 柔弱角毛藻Chaetoceros debilis 0.178 并基角毛藻单胞变型Chaetoceros decipiens f. singularis 0.186 劳氏角毛藻Chaetoceros lorenzianus 0.098 短刺角毛藻Chaetoceros messanense 0.021 日本角毛藻Chaetoceros nipponicus 0.355 0.058 根状角毛藻Chaetoceros radicans 0.043 冕孢角毛藻Chaetoceros subsecundus 0.028 脆根管藻Dactyliosolen fragilissimus 0.049 印度半管藻Hemiaulus indicus 0.077 柔弱伪菱形藻Pseudo-nitzschia delicatissima 0.039 0.111 刚毛根管藻Rhizosolenia setigera 0.094 中华根管藻Rhizosolenia sinensis 0.084 中肋骨条藻Skeletonema costatum 0.042 菱形海线藻Thalassionema nitzschioides 0.040 圆海链藻Thalassiosira gravida 0.090 伏氏海毛藻Thalassiothrix frauenfeldii 0.083 0.176 附录1 RDA分析的浮游植物名录
附录1 List of phytoplankton for RDA
编号No. 物种species Z1 北方劳德藻Lauderia borealis Z2 笔尖形根管藻Rhizosolenia styliformis Z3 变异辐杆藻Bacteriastrum furcatum Z4 并基角毛藻单胞变型Chaetoceros decipiens f. singularis Z5 叉角藻Tripos furca Z6 叉状多甲藻Peridinium furca Z7 脆根管藻Dactyliosolen fragilissimus Z8 丹麦细柱藻Leptocylindrus danicus Z9 东海原甲藻Prorocentrum donghaiense Z10 短刺角毛藻Chaetoceros messanense Z11 短角弯角藻Eucampia zodiacus Z12 伏氏海毛藻Thalassiothrix frauenfeldii Z13 刚毛根管藻Rhizosolenia setigera Z14 根状角毛藻Chaetoceros radicans Z15 海洋角毛藻Chaetoceros pelagicus Z16 海洋原甲藻Prorocentrum micans Z17 霍氏半管藻Hemiaulus hauckii Z18 劳氏角毛藻Chaetoceros lorenzianus Z19 里昂多甲藻Peridinium leonis Z20 菱形海线藻Thalassionema nitzschioides Z21 洛氏角毛藻Chaetoceros lorenzianus Z22 冕孢角毛藻Chaetoceros subsecundus Z23 膜状舟形藻Meuniera membranacea Z24 平滑角毛藻Chaetoceros laevis Z25 奇异角毛藻Chaetoceros paradoxus Z26 绕孢角毛藻Chaetoceros cinctus Z27 日本角毛藻Chaetoceros nipponicus Z28 日本星杆藻Asterionellopsis glacialis Z29 柔弱根管藻Guinardia delicatula Z30 柔弱角毛藻Chaetoceros debilis Z31 柔弱伪菱形藻Pseudo-nitzschia delicatissima Z32 斯氏几内亚藻Guinardia striata Z33 梭形多甲藻Peridinium fusus Z34 太阳双尾藻Ditylum sol Z35 细弱海链藻Thalassiosira subtilis Z36 小形圆筛藻Coscinodiscus minor Z37 新月菱形藻Nitzschia closterium Z38 旋链角毛藻Chaetoceros curvisetus Z39 翼鼻状藻Proboscia alata Z41 优美辐杆藻Bacteriastrum delicatulum Z40 印度半管藻Hemiaulus indicus Z42 原多甲藻Protoperidinium sp. Z43 圆海链藻Thalassiosira gravida Z44 窄隙角毛藻Chaetoceros affinis Z45 长菱形藻Nitzschia longissima Z46 针杆藻Synedra sp. Z47 中华根管藻Rhizosolenia sinensis Z48 中肋骨条藻Skeletonema costatum Z49 舟形藻Navicula sp. 表 2 各环境因子对浮游植物丰度影响的显著性
Table 2 Significance of effect of environmental factors on phytoplankton abundance
环境因子
environmenatal factor秋季autum 冬季winter 春季spring 夏季summer R2 P R2 P R2 P R2 P 水深depth 0.39 0.043* 0.78 0.001** 0.42 0.025* 0.67 0.002** 透明度transparancy 0.06 0.675 0.18 0.252 0.57 0.005** 0.64 0.004** 温度temperature 0.50 0.013* 0.48 0.013* 0.26 0.133 0.41 0.034* 溶解氧DO 0.45 0.019* 0.59 0.006** 0.29 0.091 0.29 0.102 盐度salinity 0.60 0.003** 0.26 0.133 0.28 0.118 0.37 0.038* pH 0.73 0.002** 0.11 0.422 0.03 0.848 0.27 0.132 无机氮DIN 0.22 0.176 0.19 0.252 0.00 0.996 0.27 0.119 磷酸盐PO4-P 0.41 0.040* 0.31 0.082 0.62 0.002** 0.15 0.338 注:R2.环境因子与物种的相关系数;*.P < 0.05表示显著差异;* *. P < 0.01表示极显著差异 Note:R2. correlation coefficient between environmental factors and species;*. significant difference (P < 0.05);* *. very significant difference (P < 0.01) -
[1] 路娜, 尹洪斌, 邓建才, 等.巢湖流域春季浮游植物群落结构特征及其与环境因子的关系[J].湖泊科学, 2010, 22(6):950-956. http://www.wenkuxiazai.com/doc/69c1948171fe910ef12df8a8.html [2] 粟丽, 黄梓荣, 陈作志.水东湾春、秋季浮游植物群落结构特征[J].南方水产科学, 2015, 11(4):27-33. http://www.cnki.com.cn/Article/CJFDTotal-NFSC201504005.htm [3] 杨姣, 刘正文, 钟萍, 等.广东惠州湖泊浮游植物群落对鱼类去除的响应[J].安徽农业科学, 2009, 37(7):3193-3195. http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CJFQ&dbname=CJFD2009&filename=AHNY200907139&v=MjAxODBlWDFMdXhZUzdEaDFUM3FUcldNMUZyQ1VSTDJlWmVkdUZ5L2tWNzNMSkNYRmQ3RzRIdGpNcUk1R2JZUjg= [4] SUNDAY J, BATES A, DULVY N. Thermal tolerance and the global redistribution of animals[J].Nat Clim Change, 2012, 9(2):686-690. http://adsabs.harvard.edu/abs/2012NatCC...2..686S
[5] CUSHMAN S A, MCGARIGAL K. Patterns in the species-environment relationship depend on both scale and choice of response variables[J].Oikos, 2004, 105(1):117-124. doi: 10.1111/oik.2004.105.issue-1
[6] PINSKY M L, WORM B, FOGARTY M J, et al. Marine taxa track local climate velocities[J].Science, 2013, 341(6151):1239-1242. doi: 10.1126/science.1239352
[7] MOORE C, HARVEY E, NIEL K. The application of predicted habitat models to investigate the spatial ecology of demersal fish assemblages[J].Mar Biol, 2010, 157(12):2717-2729. doi: 10.1007/s00227-010-1531-4
[8] 农业部南海区渔政局. 南海渔场作业图集[Z]. 广州: 广东省地图出版社, 1994: 6-7. [9] 李凤华, 赖春苗.广西海域赤潮调查及对策建议[J].环境科学与管理, 2007, 32(9):76-77, 109. http://www.wenkuxiazai.com/doc/0eeed4d64028915f804dc2ec.html [10] 庄军莲, 许铭本, 张荣灿, 等.广西防城港湾周年浮游植物生态特征[J].应用生态学报, 2011, 22(5):1309-1315. http://www.cjae.net/CN/abstract/abstract12386.shtml [11] 徐姗楠, 林华剑, 戴明, 等.广西近岸海域浮游植物群落的生态特征[J].生态学杂志, 2014, 33(10):2733-2739. http://www.cnki.com.cn/Article/CJFDTotal-STXZ201410022.htm [12] MCGARIGAL K, CUSHMAN S, STAFFORD S. Multivariate statistics for wildlife and ecology research[M].New York:Springer Science, 2000:189-194.
[13] 国家海洋局. 海洋监测规范第3部分: 样品采集、贮存与运输(GB17378. 3—2007)[S]. 北京: 中国标准出版社, 2007: 2-13. http://dbpub.cnki.net/grid2008/dbpub/detail.aspx?dbcode=SCSD&dbname=SCSD&filename=SCSD000000367549 [14] 国家海洋局. 海洋调查规范第6部分: 海洋生物调查(GB/T12763. 6—2007)[S]. 北京: 中国标准出版社, 2007: 34-40. http://dbpub.cnki.net/grid2008/dbpub/detail.aspx?dbcode=SCSF&dbname=SCSF&filename=SCSF00001255 [15] 傅明珠, 孙萍, 孙霞, 等.锦州湾浮游植物群落结构特征及其对环境变化的响应[J].生态学报, 2014, 34(13):3650-3660. http://www.ecologica.cn/stxb/ch/html/2014/13/stxb201305151068.htm [16] SHANNON C E, WEAVER W. The mathematical theory of communication[M].Urbana:University of Illinois Press, 1949:1-125.
[17] MARGALEF D R. Perspectives in ecological theory[M].Chicago:Univ Chicago Press, 1968:1-111.
[18] PIELOU E C. An introduction to mathematical ecology[M].New York:Wiley Interscience, 1969:1-286.
[19] 国家海洋局. 海洋监测规范第7部分: 近海污染生态调查和生物监测(GB17378. 7—2007)[S]. 北京: 中国标准出版社, 2007: 45-47. http://dbpub.cnki.net/grid2008/dbpub/detail.aspx?dbcode=SCSF&dbname=SCSF&filename=SCSF00001274 [20] 郭东晖, 黄加祺, 李少菁, 等. 北部湾夏、冬两季浮游动物生态学研究Ⅳ. 群落结构[G]//胡建宇, 杨圣云. 北部湾海洋科学研究论文集(第1辑). 北京: 海洋出版社, 2008: 249-256. [21] 王雪辉, 杜飞雁, 邱永松, 等.大亚湾鱼类群落格局分析[J].生态科学, 2015, 34(6):64-70. http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CJFQ&dbname=CJFDLAST2016&filename=STKX201506010&v=MjIxMTdXTTFGckNVUkwyZVplZHVGeS9sVXI3S05qbkFkckc0SDlUTXFZOUVaSVI4ZVgxTHV4WVM3RGgxVDNxVHI= [22] 戴明, 巩秀玉, 刘华雪, 等. 2013年春季南沙海域不同水团中网采浮游植物群落特征[J].南方水产科学, 2015, 11(5):38-46. http://www.cqvip.com/QK/60642B/201505/666359928.html [23] 栾青杉, 孙军, 宋书群, 等.长江口夏季浮游植物群落与环境因子的典范对应分析[J].植物生态学报, 2007, 31(3):445-450. https://www.researchgate.net/profile/Jun_Sun7/... [24] DIXON P. Vegan, a package of R functions for community ecology[J].J Veg Sci, 2003, 14(6):927-930. doi: 10.1111/j.1654-1103.2003.tb02228.x
[25] 赖江山, 米湘成. 基于Vegan软件包的生态学数据排序[C]//国际生物多样性计划中国委员会. 第九届全国生物多样性保护与持续利用研讨会论文集. 北京: 气象出版社, 2010: 332-343. [26] 方丽娟, 刘德富, 张佳磊, 等.三峡水库175 m蓄水前后香溪河库湾浮游植物的群落结构[J].水生态学杂志, 2014, 35(3):1-9. http://www.cnki.com.cn/Article/CJFDTOTAL-SCAN201403001.htm [27] 赖廷和, 邱绍芳.北海近岸水域浮游植物群落结构及数量周年变化特征[J].海洋通报, 2005, 24(5):27-32. http://www.wenkuxiazai.com/doc/1fd3591c59eef8c75fbfb3b4.html [28] 孙翠慈, 王友绍, 孙松, 等.大亚湾浮游植物群落特征[J].生态学报, 2006, 26(12):3948-3958. doi: 10.3321/j.issn:1000-0933.2006.12.005 [29] 曲静. 青岛南部近海浮游植物群落结构研究[D]. 青岛: 中国海洋大学, 2009: 7-16. http://cdmd.cnki.com.cn/Article/CDMD-10423-2009172802.htm [30] 刘述锡, 樊景凤, 王真良.北黄海浮游植物群落季节变化[J].生态环境学报, 2013, 22(7):1173-1181. http://d.wanfangdata.com.cn/Periodical/hbnykx201406011 [31] 房英春, 田春, 肖友红.苏子河浮游藻类多样性与水质的生物评价[J].水利渔业, 2007, 27(1):57-58. http://www.cqvip.com/QK/91056X/200701/23685658.html [32] 彭昆仑, 贾后磊.湛江港外海水富营养化水平与浮游植物多样性[J].海洋通报, 2007, 26(2):113-116. http://www.docin.com/p-8896949.html [33] 黄祥飞.湖泊生态调查观测与分析[M].北京:中国标准出版社, 2000:1-247. [34] 柳丽华, 左涛, 陈瑞盛, 等. 2004年秋季长江口海域浮游植物的群落结构和多样性[J].海洋水产研究, 2007, 28(3):112-119. http://d.wanfangdata.com.cn/Periodical/hyscyj200703017 [35] 叶朝放, 梁丽君.防城港东西湾浮游植物的多样性分布和水质评价[J].大众科技, 2014, 16(8):62-65. http://www.cnki.com.cn/Article/CJFDTotal-DZJI201408022.htm [36] LIVINGSTON R J. Eutrophication processes in coastal systems:origin and succession of plankton blooms and effects on secondary production in Gulf Coast Estuaries Center for Aquatic Research and Resource Management[M].Boston:CRC Press, 2001:1-329.
[37] 杜虹, 王亮根, 曹会彬, 等.汕头港浮游植物组成特征及其与环境的关系[J].生态学杂志, 2011, 30(8):1757-1765. http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CJFQ&dbname=CJFD2011&filename=STXZ201108028&v=MTMwMDVMMmVaZWR1RnkvbFU3N0lOam5UZExHNEg5RE1wNDlIYklSOGVYMUx1eFlTN0RoMVQzcVRyV00xRnJDVVI= [38] 宋伦, 周遵春, 王年斌, 等.辽东湾浮游植物多样性及与海洋环境因子的关系[J].海洋环境科学, 2007, 26(4):365-368. http://industry.wanfangdata.com.cn/dl/Detail/Periodical?id=... [39] 王迪, 陈丕茂, 逯晶晶, 等.钦州湾浮游植物周年生态特征[J].应用生态学报, 2013, 24(6):1686-1692. http://www.oalib.com/paper/4376280 [40] 周然, 彭士涛, 覃雪波, 等.渤海湾浮游植物与环境因子关系的多元分析[J].环境科学, 2013, 34(3):864-873. http://www.oalib.com/paper/4741539 -
期刊类型引用(8)
1. 粟丽,徐姗楠,李纯厚,陈作志. 七连屿浮游植物群落特征及其影响因子. 中国水产科学. 2024(06): 693-703 .  百度学术
百度学术
2. 黄朔,陈远超,李丹洁,李连翔. 泸沽湖浮游生物多样性及垂直变化规律研究. 南方水产科学. 2022(01): 22-32 .  本站查看
本站查看
3. 何斌源,赖廷和,宁秋云,黄中坚,朱婷,林金兰,钟云旭,李英花,曾思华. 防城河口湾浮游植物群落结构及其与环境因子的关系. 海洋环境科学. 2021(05): 766-775+804 .  百度学术
百度学术
4. 纪东平,裴琨,杨润琼,曾俊华,赵乃乾. 防城港市海洋牧场的建设思路和发展策略分析. 中国渔业经济. 2020(03): 33-39 .  百度学术
百度学术
5. 狄瑜,高何凤,陈何潇,李杨,覃炳醒. 南丹县天生桥水库浮游植物与水环境营养状态分析. 四川环境. 2020(04): 64-68 .  百度学术
百度学术
6. 纪东平,于海涛,李茜薇,吴洁,赵乃乾. 防城港现代海洋渔业发展研究. 海洋开发与管理. 2020(10): 79-83 .  百度学术
百度学术
7. 梁淼,孙丽艳,姜倩,陈兆林,李德鹏,路波. 曹妃甸近岸海域网采浮游植物群落结构特征及其与环境因子的相关性研究. 应用海洋学学报. 2019(02): 252-265 .  百度学术
百度学术
8. 张静,严武科,吕少梁,曾嘉维,王学锋. 2015年防城港近岸海域浮游桡足类群落结构的季节变化. 广东海洋大学学报. 2018(06): 18-28 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
