Microstructure and texture characteristics analysis of grass carp (Ctenopharyngodon idellus) muscle at different stages of crispness
-
摘要:
脆肉鲩作为广东特色水产品之一,其养殖中常出现“不脆”、“半脆”现象,严重制约其产业发展。为探索可鉴定脆度的指标,文章结合生产(饲喂120 d蚕豆+30 d饲料),每30 d采集1次肌肉,检测其感官脆度、肌纤维结构、质构特性的变化。随着脆化时间增加,蚕豆组草鱼感官脆度不断增加(P < 0.05),肌纤维直径逐渐减小、密度逐渐增大(P < 0.05);60 d后蚕豆组草鱼质构特性(硬度、弹性、咀嚼性、内聚性、胶黏性)均显著高于对照组(P < 0.05)。转投30 d饲料对感官脆度、肌纤维结构、质构特性均无显著影响(P>0.05)。相关性分析表明,硬度、弹性、咀嚼性、胶黏性与感官脆度的相关性更高(R2 >0.90,P < 0.05)。结果表明,硬度、弹性、咀嚼性、胶黏性可用于脆肉鲩的脆度评价,转投30 d饲料不影响其脆度。
Abstract:Crisp grass carp (Ctenopharyngodon idellus) is one of the characteristic fishery products in Guangdong Province, but its "no crispness" and "semi crispness" have seriously restricted the industry′s development. In order to explore the evaluation method of crispness, we combined a production process (120 d faba bean + 30 d artificial feed). The muscle samples were collected once every 30 d, and the changes of sensory crispness, texture characteristics and muscle fiber structure were detected. The results demonstrate that sensory crispness of grass carp increased continuously with the increase of production time (before 120 d) in faba bean group, while the diameter of muscle fiber decreased and the density increased gradually (P < 0.05);after 60 d, the texture characteristics (hardness, springiness, chewiness, cohesiveness and gumminess) in faba bean group were significantly better than those of the control (P < 0.05). Feeding artificial diet of 30 d did not affect the sensory crispness, texture characteristics and muscle fiber structure (P>0.05). The correlation analysis shows that the correlation among hardness, springiness, chewiness, gumminess and sensory crispness was much higher (R2>0.90, P < 0.05). It is concluded that the hardness, springiness, chewiness and gumminess can be used to evaluate the crispness, and 30-day feed did not affect the crispness.
-
Keywords:
- crisp grass carp /
- grass carp /
- crispness /
- muscle fiber /
- microstructure /
- texture characteristics
-
鱼类的游泳运动是维持其捕食、逃避敌害、洄游和生殖等生存活动的根本[1]。其中,野生鱼类在捕食、逃逸、穿越急流、洄游等,以及在养殖或增殖放流的捕捞和运输等过程中,通常做爆发性运动,这会导致乳酸(LD)的大量累积和糖原的迅速消耗,属于无氧代谢运动,也称力竭运动或力竭性运动,即一种由白肌糖酵解代谢提供能量,以力竭状态作为运动终点的高强度的游泳运动方式[2-4]。相较于哺乳动物,鱼类力竭运动后的代谢紊乱更大,恢复需要的时间更长,因此以鱼类作为模型进行探讨有利于其恢复过程及其调节机制[5]的研究。李黎等[6]对鲶(Silurus asotus)幼鱼力竭运动后的肌肉、血液和肝脏3种组织中乳酸、糖原和葡萄糖的浓度水平进行研究发现,鲶幼鱼力竭运动后肌乳酸和血乳酸浓度均快速上升且即刻达到峰值,而肝乳酸的峰值却出现在运动后1 h。朱晏苹等[7]发现瓦氏黄颡鱼(Pelteobagrus vachelli) 力竭运动后肌组织的乳酸迅速上升同时血糖快速下降。彭姜岚等[8]将鲶放入环形水道内,用手不断追逐使其被迫做持续5 min的力竭运动,力竭运动后其耗氧率(VO2)峰值在第2分钟出现,随后逐渐恢复到稳定状态,表明鱼类体质量的增加可能会使有氧代谢适应性的变化程度降低,而无氧代谢能力却可能有较大提高。He等[9]发现鲤(Cyprinus carpio) 在力竭运动训练后,肌肉中乳酸清除率提高但肝中糖原极度降低。Karlsson-Drangsholt等[10]对野生黑线鳕(Melanogrammus aeglefinus)进行力竭性游泳训练发现,训练后其血液中血糖和乳酸水平均高于对照组,直至第6小时仍未能恢复。鱼类力竭运动后其恢复速度和恢复程度与其成活率密切相关,然而关于黑鲷(Sparus inacrocephalus)力竭运动后代谢能力的恢复情况尚未见报道。
黑鲷隶属于鲈形目、鲷科、鲷属,因其具有广温性、广盐性、杂食性、抗病能力强、生长快且不作长距离洄游等诸多适合养殖的生物学特性,不但是沿海增殖放流的优良品种之一[11],也是继罗非鱼(Oreochromis spp.)之后联合国粮农组织(FAO)向全世界推广的优良品种之一[12]。本研究以黑鲷幼鱼为实验对象,研究其力竭运动后在机能恢复期间相关代谢能力的变化,以期为黑鲷养殖生产及增殖放流提供参考。
1. 材料与方法
1.1 材料
实验黑鲷幼鱼购于广东大亚湾南澳养殖场,选取128尾健康活泼的幼鱼,全长为8.9~9.9 cm [平均为(9.5±0.3) cm],体质量为15.8~26.3 g [平均为(21.7±2.8) g]。暂养于可控温循环水池中7 d,暂养水体为过滤海水 [(26.7±0.5) ℃,盐度27,pH 8.04,溶氧(8.8±0.6) mg·L–1]。每天8:00投喂一次饵料(金鲳料1号),每天换水50%。力竭运动实验前禁食24 h,整个实验过程中禁食。力竭运动实验装置为自行设计的环形水道(外径为1 004 mm,内置隔离装置直径为604 mm,内置隔离装置高为395 mm,容量为500 L)。
1.2 实验方法
实验黑鲷幼鱼禁食24 h后,随机从暂养池选取16尾黑鲷鱼苗为对照组,分2个平行。随机从暂养池选取112尾为处理组,分7组,每组16尾。将处理组分7批放入环形水道,每批8尾,实验水体流速为0.47 m·s–1,用手不断逆流追赶惊吓实验鱼,使鱼做持续力竭运动,观察到其尾部摆动频率明显变慢,机体失去平衡,尾部肌肉僵硬,直至再追逐时不再有明显反应为止。然后立即取出16尾放在冰盘中,用5#无菌注射器在尾静脉取血,此为力竭运动后第0小时的样品。血样装入无菌的1.5 mL离心管,室温静置1.5 h,置于4 ℃冷藏8 h后,在4 ℃下用高速台式冷冻离心机(TGL-20bR) 3 500 r·min–1离心10 min,所得血清置于– 80 ℃超低温冰箱冻存待测。其他样品的取样方式为:将其他力竭运动后的处理组放入暂养池网箱中 [(26.7±0.5) ℃,盐度27,pH 8.04,溶氧(8.8±0.6) mg·L–1)],分别在第0.5、第1、第2、第4、第8和第16 小时取样。对照组为随机从暂养池中选取未经力竭运动实验的黑鲷鱼苗16尾,用5#无菌注射器在尾静脉取血。取血时,用冰水混合物浸后的毛巾轻轻辅助以减少样品鱼的应激反应。取血过程不超过1 min。
血清中LD水平、血糖(GLU)水平、谷草转氨酶(AST)活性、谷丙转氨酶(ALT)活性、琥珀脱氢酶(SDH)活性、乳酸脱氢酶(LDH)活性、丙酮酸激酶(PK)活性和己糖激酶(HK)活性,均采用南京建成生物工程试剂盒测定。
1.3 数据处理
实验数据经Excel 2010处理后,以急性力竭运动后恢复时间,用SPSS 19.0软件进行单因素方差分析(One-Way ANOVA),如果分析结果出现组间极显著(P<0.01)或显著(P<0.05)差异,则用邓肯(Duncan)分析进行组间差异显著性检验。数据以“平均值±标准差(
$ \overline X \pm {\rm SD}$ )”表示。2. 结果
2.1 力竭运动后不同恢复时间血清中代谢相关酶活性
单因素方差分析显示,黑鲷幼鱼力竭运动后不同恢复时间对血清中LD和GLU浓度,以及AST、ALT、SDH、LDH、PK和HK活性均有极显著影响(P<0.01,表1)。
表 1 黑鲷幼鱼力竭运动后不同恢复时间下血清中代谢指标单因素分析结果Table 1. Analysis of metabolic indices in serum after exhaustive exercise by One-Way ANOVA因变量
dependent variable自由度
df均方
mean squareF P LD浓度 LD concentration 7 4.129 20.802 0.000 GLU浓度 GLU concentration 7 3.840 21.465 0.000 AST活性 AST activity 7 37.964 11.280 0.000 ALT活性 ALT activity 7 2.393 33.610 0.000 LDH活性 LDH activity 7 899 051.171 143.657 0.000 SDH活性 SDH activity 7 177.810 35.268 0.000 PK活性 PK activity 7 86.672 6.404 0.001 HK活性 HK activity 7 11 567.016 16.575 0.000 2.2 力竭运动后血清中代谢相关指标的变化
2.2.1 血清中LD浓度
黑鲷幼鱼力竭运动后第0小时,处理组血清中LD浓度显著高于对照组(P<0.05);力竭运动后的第0.5小时升至峰值 [(5.90±0.66) mmol·L–1] (P<0.05),而后缓缓下降;力竭运动后第4小时与对照组基本持平(P>0.05),且第8和第16小时的LD浓度水平无显著差异(P>0.05,图1-A)。
2.2.2 血清中GLU浓度
黑鲷幼鱼力竭运动后第0小时,血清中GLU浓度略高于对照组(P<0.05);力竭运动后的第0.5、第1和第2小时处理组血清中GLU呈规律性降低;力竭运动后的第8小时降至最低 [(2.41±0.42) mmol·L–1] (P<0.05),而在第16小时稍有恢复趋势(P>0.05,图1-B)。
2.2.3 血清中LDH活性
黑鲷幼鱼力竭运动后第0小时,处理组血清中LDH活性迅速升高(P<0.05);而在第0.5小时快速下降(P<0.05);在力竭运动后的第1、第2、第4、第8和第16 小时呈缓慢下降趋势,其中在第16小时降至最低 [(1 325.72±42.67) U·L–1] (P<0.05,图1-C)。
2.2.4 血清中SDH活性
黑鲷幼鱼力竭运动后,处理组的不同恢复时间血清中SDH活性先缓慢上升后恢复至对照组水平。首先,力竭运动后第0小时,处理组血清中SDH活性明显增强(P<0.05);在第0.5小时达最高 [(126.67±1.54)U·mL–1];随后的第1、第2、第4和第8小时逐渐下降;在力竭运动后的第16小时恢复至对照组水平(P>0.05,图1-D)。
2.2.5 血清中AST活性
黑鲷幼鱼力竭运动后,处理组不同恢复时间血清中AST活性呈小幅度波动趋势。其中,力竭运动后第0小时,处理组血清中AST活性明显高于对照组(P<0.05);力竭运动后的第0.5、第1、第2、第4和第8小时逐渐降低;而在力竭运动后的第16小时出现回升趋势(图1-E)。
2.2.6 血清中ALT活性
黑鲷幼鱼力竭运动后,处理组不同恢复时间血清中ALT活性先升后降,整体维持较低水平。力竭运动后第0小时,处理组血清中ALT活性明显高于对照组(P<0.05);力竭运动后的第0.5小时迅速下降(P<0.05);而力竭运动后的第1、第2、第4、第8和第16小时未有显著变化且维持较低水平(P>0.05,图1-F)。
2.2.7 血清中PK活性
整体上看,黑鲷幼鱼力竭运动后,处理组不同恢复时间血清中PK活性呈小幅度波动趋势。力竭运动后第0小时,处理组血清中PK活性明显高于对照组(P<0.05);而在力竭运动的第0.5小时迅速降低且显著低于对照组(P<0.05);在力竭运动后的第1、第2、第4和第8小时保持了较低水平(P>0.05);至第16小时出现恢复趋势,但略低于对照组(P<0.05,图1-G)。
2.2.8 血清中HK活性
黑鲷幼鱼力竭运动后,处理组不同恢复时间血清中HK活性先迅速升高后缓缓下降,且在实验时间内恢复至对照组水平。力竭运动后第0小时,处理组血清中HK活性迅速升高(P<0.05);随后在第0.5、第1、第2和第4小时有微小波动;而在力竭运动后第8小时已恢复至对照组水平(P>0.05),且在第16 小时也与对照组水平相近(P>0.05,图1-H)。
3. 讨论
3.1 黑鲷幼鱼力竭运动后血乳酸浓度的变化
鱼类对组织缺氧有一种普遍的适应机制,即以无氧代谢的方式代替有氧代谢产能。在此过程中由于没有氧气作为最终电子受体,体内葡萄糖在代谢过程中产生的中间产物乳酸会被累积[13]。研究证明,鱼类乳酸的产生和清除主要在肌组织[14]。诸多研究将力竭运动训练作为揭示机体无氧代谢机制的重要实验方法,而乳酸的相关参数则是反映机体无氧代谢能力的一个重要指标[15]。另外,Moraes等[16]根据力竭运动后血乳酸是否上升将鱼类划分为“乳酸非释放(lactate non-releasers)”和“乳酸释放(lactate releasers)”2种类型。许多鱼类力竭运动后乳酸浓度立刻升至峰值,其峰值水平是衡量该鱼种无氧运动能力的重要指标[7]。本研究中,黑鲷幼鱼力竭运动后血乳酸浓度迅速上升,力竭运动后的第0.5小时升至峰值 [(5.90±0.66) mmol·L–1],推测是因为血乳酸相对肌乳酸有一定滞后性。乳酸透过肌纤维细胞膜进入血液,稀释了局部肌乳酸浓度,使黑鲷避免了高浓度乳酸可能造成的伤害,为肝脏等其他组织清除乳酸提供了可能,这表明黑鲷属于 “乳酸释放”型鱼类,该“乳酸泄漏”现象有利于提高黑鲷的无氧代谢能力和生存适合度[6,16]。此外,本研究中黑鲷血清中乳酸峰值水平高于鲶幼鱼,力竭运动后第4小时,黑鲷幼鱼血清中的乳酸浓度基本恢复至对照组水平,这与鲶相同[6],说明黑鲷在首次力竭的第4小时后,可再次做力竭运动。但鲣(Katsuwonus pelamis)的血乳酸清除所需时间更短,这是由于黑鲷和鲶都喜栖于沙泥底部和礁石,黑鲷是不做长距离洄游的沿岸性鱼类,而鲣是有季节洄游的大洋性鱼类,为捕食或逃避敌害需经常做无氧运动且无氧代谢速度快[17]。
3.2 黑鲷幼鱼力竭运动后血糖浓度的变化
Franklin等[13]认为,鱼类肌乳酸的清除需要通过3种途径:合成肌糖原、合成葡萄糖或被彻底氧化并提供能量。而血乳酸代谢则是通过氧化,如在心脏和肝等场所氧化供能[26-27]。已有研究显示,肌乳酸下降的同时糖原和葡萄糖浓度会有不同程度的上升,因此乳酸清除的主要途径是合成糖原[18],但血乳酸会被肌肉重新摄取,主要被用于糖原再合成过程中的氧化供能,但再次摄取的血乳酸和肌乳酸的代谢在肌肉中有分隔现象[1]。本研究中,黑鲷幼鱼血清中血糖浓度在力竭运动后第0小时略有上升,其后一直低于对照组水平,推测黑鲷幼鱼力竭运动后血清中的乳酸清除主要是被其他有氧代谢组织(如心脏、红肌)氧化[5]。同时,黑鲷幼鱼在力竭运动后第4小时血糖浓度降至最低,至第16小时血清中血糖维持较低水平,可能是因为黑鲷喜躲在水底礁石后方伏击捕食,这对能量的快速储存需要较少。血糖水平低下可导致中枢供能不足,并引发中枢疲劳,因此推测黑鲷幼鱼力竭运动后第4至第16小时,可能出现严重的代谢疲劳现象[19],且未能在本实验恢复期恢复,说明虽然黑鲷在力竭运动后第4小时可再次做力竭运动,但其无氧运动能力会降低,力竭状态出现更快。
3.3 黑鲷幼鱼力竭运动后血清中相关代谢酶活性的变化
研究表明,力竭运动训练还会对鱼体有氧或无氧代谢酶活性产生显著影响,如无氧运动训练后虹鳟(Oncorhynchus mykiss)肌肉糖酵解酶系中PK活性增加[20],斑马鱼(Barchydanio rerio var) LDH活性显著增强,乌鳢(Channa argus)红肌中SDH水平显著增加[17]等。本研究中,黑鲷幼鱼力竭运动后第0小时,血清中LDH、HK、PK和SDH活性也显著升高。HK和PK均为无氧糖酵解过程中的限速酶和调控酶,而LDH是衡量无氧酵解能力的重要指标,是无氧代谢终产物乳酸的直接催化酶。LDH作为无氧代谢的标志酶,可使PK和LD之间相互转化,其活性高低在一定程度上反映了无氧代谢能力的高低[21]。SDH则是有氧代谢中唯一嵌在线粒体内膜上的酶,催化琥珀酸氧化生成延胡索酸释放 ATP[22]。本研究结果显示,黑鲷幼鱼力竭运动后第0小时,血清中HK、PK和LDH活性显著升高,说明其限速酶在糖酵解过程中有效地调控了糖酵解速度,使其产生了适应性变化。力竭运动训练促使糖酵解能力加强,同时使得细胞内氧分压降低,LDH合成加快,活力增强[23],而且有研究表明,爆发式游泳后鳙(Aristichthys nobilis)的有氧代谢能力短期内会降低,说明该阶段黑鲷的代谢方式为无氧代谢[24]。本研究结果表明,在第0小时往后的恢复时间中,LDH活性不断下降且低于对照组水平,而SDH活性变化幅度较小且略高于对照组水平,说明黑鲷幼鱼在力竭运动后的第0.5至第16小时的有氧代谢能力得到了提高。表明低氧条件下,有氧代谢受到抑制而无氧代谢增强;恢复期后期有氧代谢恢复,无氧代谢受到抑制[25],推测这也与黑鲷生活习性相关,力竭运动训练后有洄游习性的虹鳟,无氧代谢能力显著升高,而黑鲷和瓦氏黄颡鱼(Pseudobagrus vachellii)[25]、南方鲶(Peltebagrus vachelli)[26]等喜栖息于沙泥无需洄游鱼类的有氧代谢能力升高,无氧代谢无显著性变化。
AST和ALT是氨基酸代谢中的2个关键酶,其活性强弱不仅反映了氨基酸代谢程度的强弱,也可显示肝功能是否正常[27-28]。转氨酶(AST和ALT)主要作用是催化氨基酸生成酮酸,进而保持机体稳态[29]。正常情况下,ALT和AST主要存在于细胞内,血清中极少;一般情况下,各组织器官中以心肌细胞和肝细胞内的活性最高,但当这些组织细胞受损时,便可能有大量的AST和ALT从细胞内进入血液,使血清中的2种转氨酶活性升高[30]。因此,血清中转氨酶活性的变化,是目前判断肝脏等组织器官功能状况的最具特异性和应用最广泛的指标[31]。张全江等[32]研究发现,小鼠(Mus musculus)在力竭运动后其血清中的AST和ALT活性明显升高;王转丁等[33]发现,小鼠进行不同强度游泳后血清中AST和ALT活性也明显上升。本研究结果与以上实验结果一致,黑鲷幼鱼很快恢复且至实验时间结束AST和ALT活性仍保持低于对照组水平,说明其力竭运动后心肌和肝脏细胞受到一定的损伤,但机体代谢能够及时有效地恢复。
4. 小结
黑鲷幼鱼力竭运动后,不同恢复时间血清中相关代谢因子均存在极显著差异。黑鲷幼鱼力竭运动后处于应激反应中,其无氧和有氧代谢能力得以短时增强。在力竭运动后的第4小时,黑鲷鱼苗已出现代谢疲劳现象,至力竭运动后的第16小时仍未能完全恢复;从乳酸水平上看,力竭运动后第4小时后可再次进行力竭运动,但血糖检测结果显示,再次进行力竭运动的耐力下降;从氨基酸代谢水平上看,黑鲷幼鱼力竭运动后心肌和肝脏有一定损伤,但能够迅速恢复。综上,在实际的黑鲷养殖生产或增殖放流过程中,应尽量避免或减少短时间内的多次捕捞、追赶等活动,以保障黑鲷健康,获得更好的放养成活率。
-
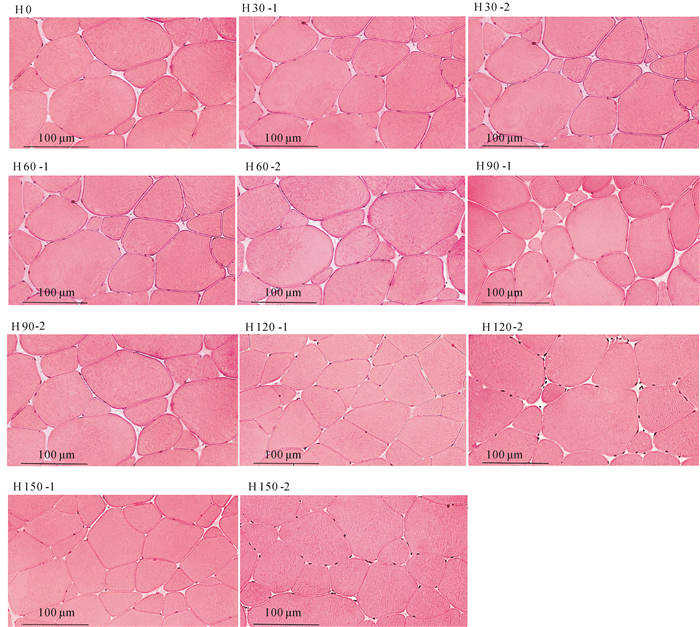
图 1 草鱼肌肉的横切面显微结构(×400)
H0、H30、H60、H90、H120、H150分别代表第0、第30、第60、第90、第120、第150天的肌肉横切;-1代表蚕豆组,-2代表对照组。
Figure 1. Transverse section microstructure of grass carp muscle (×400)
H0, H30, H60, H90, H120 and H150 denote transverse section microstructure on the 0th, 30th, 60th, 90th, 120th, 150th day, respectively; "-1" stands for faba bean group; "-2" stands for control group.
图 2 草鱼肌肉的纵切显微结构(×400)
Z0、Z30、Z60、Z90、Z120、Z150分别代表第0、第30、第60、第90、第120、第150天的肌肉纵切;-1代表蚕豆组,-2代表对照组。
Figure 2. Longitudinal section microstructure of grass carp muscle (×400)
Z 0, Z30, Z60, Z90, Z120 and Z150 denote longitudinal section microstructure on the 0th, 30th, 60th, 90th, 120th, 150th day, respectively; "-1" stands for faba bean group; "-2" stands for control group.
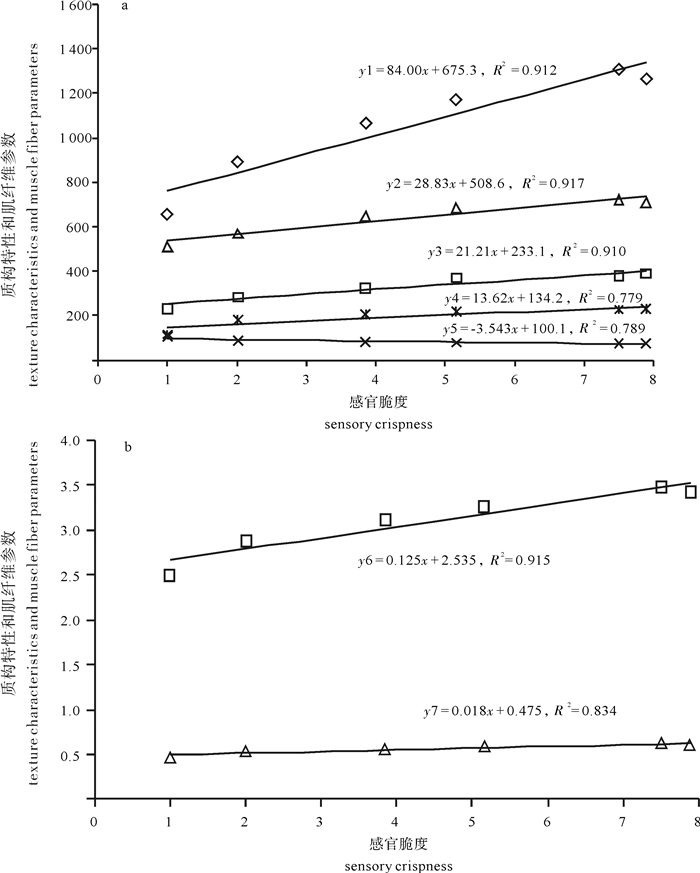
图 3 感官脆度和质构特性及肌纤维参数的线性关系
y1.咀嚼性;y2.硬度;y3.胶黏性;y4.肌纤维密度;y5.肌纤维直径;y6.弹性; y7.内聚性
Figure 3. Linear correlation between sensory crispness and parameters of texture characteristics and muscle fiber parameters
y1. chewiness; y2. hardness; y3. gumminess; y4. muscle fiber density; y5. muscle fiber diameter; y6. springiness; y7. cohesiveness
表 1 不同脆化阶段草鱼肌纤维直径和密度
Table 1 Diameter and density of muscle fiber of grass carp at different crisping periods
项目item 脆化时间/d crisping time 0 30 60 90 120 直径/μm diameter 对照组 104.58±6.54a 105.26±4.00a 103.59±6.65a 103.42±3.12a 104.98±7.21a 蚕豆组 88.20±2.87b 82.12±3.50c 78.01±4.87d 75.17±1.92d 密度/No.·mm-2 density 对照组 116±11e 117±7e 114±8e 116±5e 117±7e 蚕豆组 181±11d 204±10c 219±13b 231±14a 注:同一行上标字母不同表示差异性显著(P<0.05),后表同此。
Note:Different superscript letters in the same row indicate significant difference between treatments (P<0.05).The same case in the following table.表 2 不同脆化阶段草鱼肌肉TPA指标值
Table 2 TPA index values of grass carp muscle at different crisping periods
项目item 脆化时间/d crisping time 0 30 60 90 120 硬度/g hardness 对照组 508.52±66.89c 504.47±59.54c 510.54±66.43c 506.38±67.53c 511.36±59.22c 蚕豆组 569.60±67.02bc 646.00±45.95b 685.28±73.02ab 710.73±60.79a 弹性springiness 对照组 2.50±0.19c 2.34±0.13c 2.67±0.24c 2.55±0.33c 2.47±0.17c 蚕豆组 2.88±0.06b 3.11±0.04ab 3.26±0.31a 3.43±0.42a 咀嚼性/g chewiness 对照组 655.14±83.66c 644.86±54.24d 654.25±84.76d 658.11±53.34d 662.63±64.12d 蚕豆组 890.32±21.89c 1 067.11±214.14b 1 170.85±127.10ab 1 263.61±122.06a 内聚性cohesiveness 对照组 0.46±0.04c 0.46±0.02c 0.45±0.04c 0.48±0.03c 0.46±0.09c 蚕豆组 0.53±0.02b 0.57±0.02ab 0.59±0.05a 0.60±0.06a -
[1] 谢骏, 郁二蒙, 王广军, 等."脆肉鲩"的养殖关键技术及其产业化开发[J].科学养鱼, 2009(5):41-42. http://www.wenkuxiazai.com/doc/c807c8c86137ee06eff91813.html [2] 刘庆营.草鱼脆化养殖新技术[J].农村实用技术, 2008(6):53. http://www.wenkuxiazai.com/doc/5a621127a32d7375a4178050.html [3] 李忠铭, 冷向军, 李小勤, 等.脆化草鱼生长性能、肌肉品质、血清生化指标和消化酶活性分析[J].江苏农业科学, 2012, 40(3):186-189. http://www.docin.com/p-527044645.html [4] 程纯明.微变革, 脆肉鲩要从13斤进入15斤的新历程, 凭借的是什么?[J].当代水产, 2015, 40(9):48-49. http://industry.wanfangdata.com.cn/yj/Magazine?magazineId=nlsc&... [5] 刘怡.《海洋与渔业》走进"中国脆肉鲩之乡"中山东升镇[J].海洋与渔业, 2014(3):30-33. http://www.cnki.com.cn/Article/CJFDTotal-HYUY201403024.htm [6] 林婉玲, 杨贤庆, 李来好, 等.脆肉鲩质构与感官评价的相关性研究[J].现代食品科技, 2013, 29(1):1-7. http://www.cqvip.com/QK/92448A/201301/44546154.html [7] YU E M, LIU B H, WANG G J, et al. Molecular cloning of type I collagen cDNA and nutritional regulation of type I collagen mRNA expression in grass carp[J]. J Anim Physiol Anim Nutr (Berl), 2014, 98(4):755-765. doi: 10.1111/jpn.2014.98.issue-4
[8] 肖调义, 刘建波, 陈清华, 等.脆肉鲩肌肉营养特性分析[J].淡水渔业, 2004, 34(3):28-30. http://www.cnki.com.cn/Article/CJFDTOTAL-DSYY200403008.htm [9] 朱志伟, 李汴生, 阮征, 等.脆肉鲩鱼肉与普通鲩鱼鱼肉理化特性比较研究[J].现代食品科技, 2008, 24(2):109-112, 119. http://www.doc88.com/p-6015982449717.html [10] 甘承露, 郭姗姗, 荣建华, 等.脆肉鲩肌肉主要营养成分的分析[J].营养学报, 2010, 32(5):513-515. http://www.cqvip.com/QK/95640X/201005/35713240.html [11] 伦峰, 冷向军, 李小勤, 等.投饲蚕豆对草鱼生长和肉质影响的初步研究[J].淡水渔业, 2008, 38(3):73-76. http://www.cqvip.com/qk/93836X/200803/27676191.html [12] 陈清华, 肖调义, 吴松山, 等.脆肉鲩肌肉游离氨基酸初步分析[J].水利渔业, 2004, 24(6):8-10. http://www.wenkuxiazai.com/doc/63a284f1f8c75fbfc77db2db.html [13] 谭乾开, 黎华寿.脆化草鱼(Ctenopharyngodon idellus C.et V)的病理生理生态学[J].生态学报, 2006, 26(8):2749-2756. http://www.cnki.com.cn/Article/CJFDTOTAL-STXB200608044.htm [14] 谭乾开, 黎华寿.食物与水环境因子对草鱼(Ctenopharyngodon idellus C.et V)脆化过程的影响[J].生态学报, 2006, 26(7):2409-2415. http://www.cnki.com.cn/Article/CJFDTOTAL-STXB200607045.htm [15] YANG S L, LI L H, QI B, et al.Quality evaluation of crisp grass carp (Ctenopharyngodon idellus C. et V) based on instrumental texture analysis and cluster analysis[J].Food Anal Methods, 2015, 8(8):2107-2114. doi: 10.1007/s12161-015-0101-2
[16] 郁二蒙, 谢骏, 卢炳国, 等.脆肉鲩与普通草鱼肌肉显微结构观察[J].南方农业学报, 2014, 45(4):671-675. http://www.cqvip.com/QK/90177A/201404/50011561.html [17] LIN W L, ZENG Q X, ZHU Z W.Different changes in mastication between crisp grass carp (Ctenopharyngodon idellus C.et V) and grass carp (Ctenopharyngodon idellus) after heating:the relationship between texture and ultrastructure in muscle tissue[J].Food Res Int, 2009, 42(2):271-278. doi: 10.1016/j.foodres.2008.11.005
[18] 李道友. 草鱼脆化养殖过程中的肌肉特性及脆性表征[D]. 武汉: 华中农业大学, 2011: 39-48. http://cdmd.cnki.com.cn/Article/CDMD-10504-1011405247.htm [19] 关磊, 朱瑞俊, 李小勤, 等.普通草鱼与脆化草鱼的肌肉特性比较[J].上海海洋大学学报, 2011, 20(5):748-753. http://www.wenkuxiazai.com/doc/636bdd3516fc700abb68fc8c.html [20] 林婉玲, 关熔, 曾庆孝, 等.影响脆肉鲩鱼背肌质构特性的因素[J].华南理工大学学报(自然科学版), 2009, 37(4):134-137. http://industry.wanfangdata.com.cn/dl/Detail/Periodical?id=... [21] 刘建波, 陈开健, 佘曙明, 等.脆肉鲩肌肉超微结构分析[J].水利渔业, 2005, 25(3):65-67. http://www.cnki.com.cn/Article/CJFDTOTAL-SCAN200503031.htm [22] JOHNSTON I A, ALDERSON R, SANDHAM C, et al. Muscle fibre density in relation to the colour and texture of smoked Atlantic salmon (Salmo salar L.)[J].Aquaculture, 2000, 189(3/4):335-349. https://www.sciencedirect.com/science/article/pii/S0308814603005417
[23] GAO J C, PIGOTT G M, REINE B.Gel forming additive effects on properties of thermally induced minced fish gel[J]. J Food Sci, 1999, 64(3):414-417. doi: 10.1111/jfds.1999.64.issue-3
[24] URESTI R M, TELLEZ L J, RAMIREZ J A, et al.Use of dairy proteins and microbial transglutaminase to obtain low-salt fish products from filleting waste from silver carp(Hypophthalmichthys molitrix)[J].Food Chem, 2004, 86(2):257-262. doi: 10.1016/j.foodchem.2003.09.033
[25] HUIDOBRO F R, MIGUEL E, BLAZQUEZ B, et al. A comparison between two methods (Warner-Bratzler and texture profile analysis) for testing either raw meat or cooked meat[J].Meat Sci, 2005, 69(3):527-536. doi: 10.1016/j.meatsci.2004.09.008
[26] 伍芳芳, 林婉玲, 李来好, 等.草鱼脆化过程中肌肉品质变化[J].南方水产科学, 2014, 10(4):70-77. http://www.schinafish.cn/CN/abstract/abstract9140.shtml [27] AYALA M D, ALBORS O L, BLANCO A, et al. Structural and ultrastructural changes on muscle tissue of sea bass, Dicentrarchus labrax L., after cooking and freezing[J].Aquaculture, 2005, 250(1/2):215-231.
[28] HURLING R, RODELL J B, HUNT H D. Fiber diameter and fish texture[J].J Texture Stud, 1996, 27(6):679-685. doi: 10.1111/jts.1996.27.issue-6
[29] BUGEON J, LEFEVRE F, FAUCONNEAU B. Fillet texture and muscle structure in brown trout (Salmo trutta) subjected to long-term exercise[J].Aquacult Res, 2003, 34(14):1287-1295. doi: 10.1046/j.1365-2109.2003.00938.x
[30] PERIAGO M J, AYALA M D, LOPEZ A O, et al. Muscle cellularity and flesh quality of wild and farmed sea bass, Dicentrarchus labrax L[J].Aquaculture, 2005, 249(1):175-188.
[31] JOHNSTON I A, MANTHRI S, BICKERDIKE R, et al. Growth performance, muscle structure and flesh quality in out-of-season Atlantic salmon (Salmo salar) smolts reared under two different photoperiod regimes[J].Aquaculture, 2004, 237(1):281-300. https://www.researchgate.net/profile/Tom_Hansen3/2?page=2&sorting=...
[32] JOHNSTON I A, LI X, VIEIRA V A, et al. Muscle and flesh quality traits in wild and farmed Atlantic salmon[J].Aquaculture, 2006, 256(1):323-336. https://www.sciencedirect.com/science/article/pii/S0044848606001517




 下载:
下载:


 粤公网安备 44010502001741号
粤公网安备 44010502001741号
