Tissue distribution and response to infection of Photobacterium damselae subsp. piscicida of Tf, TNFα and C-Lys in Trachinotus ovatus
-
摘要:
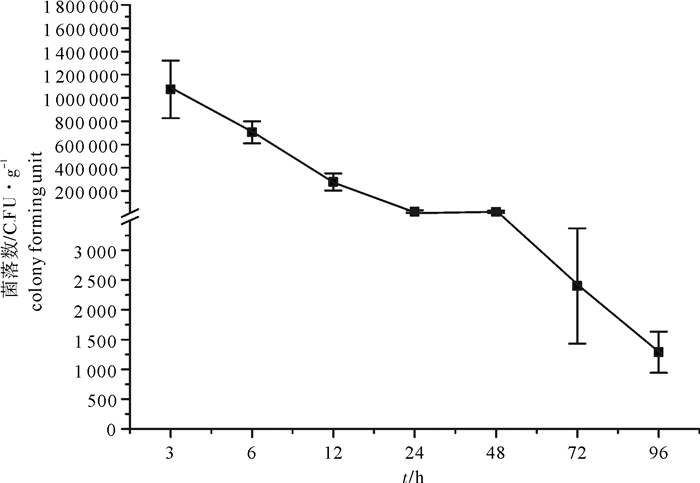
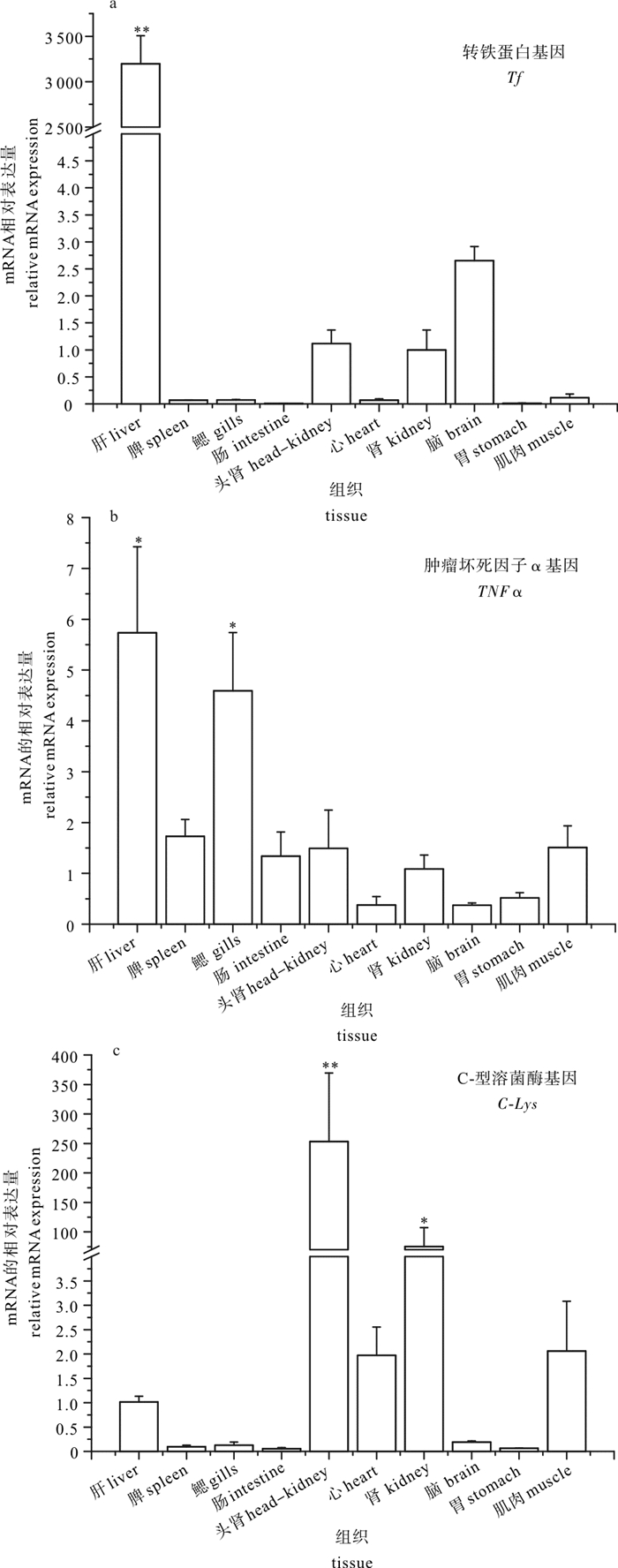
研究了卵形鲳鲹(Trachinotus ovatus)中免疫相关因子转铁蛋白(Tf)、肿瘤坏死因子α(TNFα)、C-型溶菌酶(C-Lys)的组织表达分布,并分析了这3种基因在人工感染美人鱼发光杆菌杀鱼亚种(Photobacterium damselae subsp. piscicida )后在卵形鲳鲹肾脏中的表达变化,探讨其对美人鱼发光杆菌感染的反应。结果显示, 感染后第48小时卵形鲳鲹累计死亡率最高(76.4%);卵形鲳鲹肾脏中细菌数量从第3~第96小时一直处于下降趋势,从1.07×106 CFU·g-1下降到1.29×103 CFU·g-1。健康卵形鲳鲹中Tf和TNFα在肝脏中表达量最高,C-Lys在头肾中表达量最高。美人鱼发光杆菌感染后卵形鲳鲹肾脏中Tf表达量在第3~第12小时实验组高于对照组,其中第6小时的表达量最高,是对照组的17.99倍;TNFα在感染后的第3、第6、第24小时实验组的表达量高于对照组,第24小时组相对于对照组的表达量最高,是对照组的6.05倍。C-Lys在感染后感染组表达量均低于对照组。以上结果表明,美人鱼发光杆菌感染能促进卵形鲳鲹肾脏组织中Tf、TNFα的表达,而抑制C-Lys的表达。
Abstract:The study investigates the tissue expression of transferrin (Tf), tumor necrosis factor alpha (TNFα) and C-type lysozyme (C-Lys) in healthy Trachinotus ovatus after it was infected with Photobacterium damselae subsp. piscicida in kidney. The results show that after infection, the accumulative mortalities of T.ovatus reached the maximum in 48 h (76.4%); and the colony of P.damselae in T.ovatus′ kidney continued to decline in 3~96 h from 1.07×106 CFU·g-1to 1.29×103 CFU·g-1. The Tf and TNFα expressions were the highest in the liver, and the C-Lys expression was the highest in the head kidney in healthy T.ovatus. After TOS1 infected, the Tf expression in 3~12 h in test group was higher than that of control and was the highest in 6 h (17.99 times as high as that of control). The TNFα expression of the test group was higher than that of the control after infection of 3 h, 6 h and 24 h. The TNFα expression was the highest in 24 h (6.05 times higher than that of control). The C-Lys expression in infection group was lower than that in control in 3~96 h. The study indicates that the Tf and TNFα expressions can be promoted while C-Lys will be suppressed after TOS1 infection in T.ovatus′ kidney.
-
Keywords:
- Trachinotus ovatus /
- transferrin /
- tumor necrosis factor alpha /
- C-type lysozyme /
- gene expression
-
尖翅燕鱼 (Platax teira) 又称长鳍蝙蝠鱼,属鲈形目、刺尾鱼亚目、白鲳科,原产于印度-太平洋,广泛分布于亚热带和热带沿海地区,是一种杂食性鱼类[1]。其幼鱼体色黑白相间,背鳍、臀鳍和腹鳍较长,鱼体边缘线呈弧形,形态优美,有较高的观赏价值;其肉质鲜美,生长较快,具有较高的经济价值[2]。随着人工繁育技术的发展,尖翅燕鱼在中国和东南亚等国成功实现人工养殖,成为深海网箱养殖最具发展潜力的鱼类之一。
鱼类早期胚胎发育的脆弱性,是制约鱼种成活率的重要因素之一,并容易受水质[3]、饵料适口性[4]、营养来源 (内源性到外源性营养的过渡)[5]、食物丰富度、光照强度[6]和放养密度[7]等因素的影响。目前对于尖翅燕鱼的研究相对较少,仅见于消化器官发育[8]、肌肉成分[9]和幼鱼异速生长[2]等方面,而对其发育生物学的相关研究尚未深入。本研究系统阐述了尖翅燕鱼早期胚胎发育及仔稚鱼形态学发育,详细记录了各发育时期及形态变化,并确定仔稚鱼的异速生长模式,旨在为尖翅燕鱼人工催产和苗种繁育提供理论依据。
1. 材料与方法
1.1 亲鱼培育
实验亲鱼选自海南省陵水培育的3龄以上尖翅燕鱼亲鱼。催产前挑选健康无伤、体表完整、活力好的亲鱼于新村港网箱 (长6 m×宽3 m×高3 m) 进行45 d营养强化。亲鱼促熟期间以投喂冰鲜鱿鱼和小杂鱼为主,同时加入强化剂 (鱼油、维生素等),日投喂3次,投喂量约为鱼体质量的3%;定期观察亲鱼性腺发育情况,以亲鱼腹部圆润 (轻轻挤压腹部,精液或卵子从生殖孔流出) 为标准,确定亲鱼性腺是否发育成熟。亲鱼催产期持续30 d左右,培育水温24~27 ℃。
1.2 受精与孵化
挑选性腺发育成熟的雌鱼[平均体质量 (2 120±155) g]和雄鱼[平均体质量(1 600±112) g]各10尾用于人工催产。催产前,将绒毛膜促性腺激素 (HCG, 500 IU·kg−1) 和丘脑下部促黄体素释放激素的类似物3号 (LRH-A3, 3.5 μg·kg−1) 溶于生理盐水,制备成标准注射剂。用丁香酚 (30~50 mg·L−1)对尖翅燕鱼进行麻醉后,利用注射器吸入催产剂进行背鳍肌肉注射,剂量根据鱼体质量确定。
根据催产剂效应时间18~22 h,人工催产后20 h左右,采用人工挤卵的方式收集精液和卵子,进行干法受精。将受精卵放入500 L锥形底孵化桶孵化,充分曝气,每隔30 min分卵1次,取上浮优质受精卵转入新的孵化桶进行孵化。孵化温度 (26±0.3) ℃、溶解氧质量浓度>6.5 mg·L−1、盐度和pH分别为34~36和7.8±0.5。
受精卵孵化至初孵仔鱼后,将仔鱼转移到室内水泥池进行工厂化育苗。前10 d水体保持为静态 (可添加适量小球藻净化水质),10 d后,每天更换10%的海水。保证水体饵料充足,2~10日龄 (Days after hatching, dah)投喂轮虫 (5~10个·mL−1);7~15 dah投喂卤虫无节幼体 (2~3个·mL−1);15 dah 以后开始投喂鳗鱼粉及微囊颗粒饲料。每天从育苗桶中抽出残饵、粪便和死亡的仔鱼。
1.3 取样与观察
从孵化桶捞取受精卵,用2 mL移液管吸取受精卵将其置于玻璃皿上,在光学显微镜 (Nikon Eclipse E100)下观察和拍摄。每5 min观察一次受精卵,每次随机选取50粒。根据硬骨鱼发育阶段的划分,各时期的发育时间以观察视野中50%以上受精卵发育至该时期的时间为准[10],观察胚胎发育的形态变化,并记录发育时间、温度和发育特征。
受精卵孵化为初孵仔鱼后,每天10:00时取30尾仔稚鱼,通过解剖镜观察其生长发育特征 (观察前用丁香酚进行麻醉)。观察记录仔稚鱼形态变化和器官发育情况,并对其全长、体长、体高、头长、眼径和卵黄囊进行测量。参照杨建等[11]的方法计算卵黄囊体积 (V):
$$ V=(R \cdot r^{2} \cdot \pi)/6 $$ (1) 式中:R为长径;r为短径。
1.4 数据处理与分析
采用Photoshop 2020软件对尖翅燕鱼胚胎发育和仔稚鱼发育照片进行处理,通过Image View软件对其形态学指标进行测量,用SPSS 20.0 软件对数据进行单因素方差分析,并以“平均值±标准差 (
$\overline X $ ±SD)”表示,用Excel 2020软件对测量数据进行分析,推算出仔稚鱼阶段生长特性的回归方程。尖翅燕鱼仔稚鱼全长、体长、体高、头长、眼径以及卵黄囊的体积与日龄的关系用多项式表示:$$ y = {\rm{a}}{x^3} + {\rm{b}}{x^2} + {\rm{c}}x + {\rm{d}} $$ (2) 式中:x为生长天数 (d);y代表全长 (mm) 、体长 (mm)、体高 (mm)、头长 (mm)、眼径 (mm)、卵黄囊体积 (mm3)中的一种;a、b、c、d为常数,且a≠0。
方程 (2) 的一阶导数表示为:
$$ y{\text{'}}=3{\rm{a}}x^{2}+2{\rm{b}}x+{\rm{c}} $$ (3) 当y'> 0时,表示y随着日龄的增加而正增长;当y'<0时,则表现为负增长。方程 (2) 的二阶导数如下:
$$ y{\text{'}}{\text{'}} =6{\rm{a}}x+2{\rm{b}} $$ (4) 当y''>0时,表示y随着日龄的增加而加速增长;当y''<0时,则表现为减速增长。
若y' 和y'' 总是满足y'>0且y''>0时,则说明尖翅燕鱼仔稚鱼的全长、体长、体高、头长和眼径随着日龄的增加在加速生长。若y'和y'' 总是满足y'<0且y''>0时,则说明尖翅燕鱼仔稚鱼的卵黄囊体积随着日龄的增加而加速减小。
2. 结果
2.1 胚胎发育
尖翅燕鱼胚胎发育经历了合子期、卵裂期、囊胚期、原肠胚期、神经胚期、器官形成期和孵化出膜7个阶段,共27个时期,历时27 h 45 min,所需积温721.5 h·℃ (表1和图1)。
表 1 尖翅燕鱼胚胎发育过程Table 1 Embryonic development of P. teira发育阶段
Developmental
stage发育期
Developmental
period受精后时间
Time after
fertilization持续时间
Duration积温
Accumulative
Temperature/
(h·℃)图1
Fig. 1合子期 Zygo phase 受精卵 Fertilized egg 30 min 30 min 13 a 卵裂期 Cleavage stage 2细胞期 2-cell stage 60 min 30 min 13 b 4细胞期 4-cell stage 1 h 6 min 16 min 7 c 8细胞期 8-cell stage 1 h 40 min 36 min 15.6 d 16细胞期 16-cell stage 1 h 50 min 10 min 4.3 e 32细胞期 32-cell stage 2 h 10 min 20 min 8.6 f 64细胞期 64-cell stage 2 h 30 min 20 min 8.6 g 多细胞期 Multicellular stage 2 h 58 min 28 min 12.1 h 桑葚期 Morula 3 h 23 min 25 min 12.1 i 囊胚期 Blastula stage 高囊胚期 High blastula 4 h 7 min 44 min 19.1 g 低囊胚期 Low blastula 4 h 58 min 51 min 22.1 k 原肠胚期 Gastrula stage 原肠早期 Early-gastrula stage 5 h 41 min 1 h 13 min 31.6 l 原肠中期 Mid-gastrula stage 6 h 45 min 34 min 14.7 m 原肠晚期 Late-gastrula stage 8 h 8 min 1 h 23 min 36 n 神经胚期 Neurula stage 胚体形成期 Embryogenesis period 9 h 49 min 1 h 41 min 43.8 o 胚孔封闭期 Closure of blastopore stage 11 h 1 h 11 min 30.8 p 器官形成期 Organogenesis stage 眼泡出现期 Tail vesicle period 11 h 28 min 28 min 12.1 q 肌节出现期 Appearance of myomere 12 h 4 min 36 min 15.6 r 色素形成期 Formation of pigment 13 h 25 min 1 h 21 min 35.1 s 晶体形成期 Crystal stage of eyes 14 h 42 min 1 h 17 min 33.4 t 尾芽期 Tail-bud period 16 h 55 min 2 h 13 min 57.6 u 心跳期 Heart beating period 19 h 18 min 2 h 23 min 62 v 肌肉效应期 Muscular contraction period 20 h 36 min 1 h 18 min 33.8 w 耳石形成期 Appearance of statolith 22 h 20 min 2 h 14 min 58.1 x 孵化前期 Pre-hatching stage 25 h 30 min 2 h 40 min 69.3 y 孵化期 Hatching stage 26 h 55 min 1 h 25 min 36.0 z 孵化期 Hatching stage 初孵仔鱼 Newly hatched larvae 27 h 20 min 25 min 10.8 za 注:受精卵孵化温度为 (26±0.3) ℃、盐度34~36、pH 7.8±0.5。 Note: The temperature of hatching seawater was (26±0.3)℃; the salinity was 34−36; pH was 7.8±0.5. ![]() 图 1 尖翅燕鱼胚胎发育注:a. 受精卵;b. 2 细胞期;c. 4 细胞期;d. 8 细胞期;e. 16 细胞期;f. 32 细胞期;g. 64 细胞期;h. 多细胞期;i. 桑葚期;j. 高囊胚期;k. 低囊胚期;l. 原肠早期;m. 原肠中期;n. 原肠晚期;o. 胚体形成;p. 胚孔封闭;q. 眼泡出现期;r. 肌节出现期;s. 色素形成;t. 晶体形成;u. 尾芽期;v. 心跳期;w. 肌肉效应期;x. 耳石形成;y. 孵化前期;z. 孵化期;za. 初孵仔鱼。Fig. 1 Embryonic development of P. teiraNone:a. Fertilized egg; b. 2-cell stage; c. 4-cell stage; d. 8-cell stage; e. 16-cell stage; f. 32-cell stage; g. 64-cell stage; h. Multi-cell stage; i. Morula stage; j. High blastula stage; k. Low blastula stage; l. Early gastrula; m. Middle gastrula; n. Late gastrula; o. Embryo body formation; p. Closure of blastopore; q. Eye vesicle stage; r. Muscle burl stage; s. Formation of pigment; t. Formation of eye lens; u. Caudal bud stage; v. Heart beating stage; w. Muscle contraction; x. Formation of otolish; y. Pre-hatching stage; z. hatching stage; za. Newly hatched larvae.
图 1 尖翅燕鱼胚胎发育注:a. 受精卵;b. 2 细胞期;c. 4 细胞期;d. 8 细胞期;e. 16 细胞期;f. 32 细胞期;g. 64 细胞期;h. 多细胞期;i. 桑葚期;j. 高囊胚期;k. 低囊胚期;l. 原肠早期;m. 原肠中期;n. 原肠晚期;o. 胚体形成;p. 胚孔封闭;q. 眼泡出现期;r. 肌节出现期;s. 色素形成;t. 晶体形成;u. 尾芽期;v. 心跳期;w. 肌肉效应期;x. 耳石形成;y. 孵化前期;z. 孵化期;za. 初孵仔鱼。Fig. 1 Embryonic development of P. teiraNone:a. Fertilized egg; b. 2-cell stage; c. 4-cell stage; d. 8-cell stage; e. 16-cell stage; f. 32-cell stage; g. 64-cell stage; h. Multi-cell stage; i. Morula stage; j. High blastula stage; k. Low blastula stage; l. Early gastrula; m. Middle gastrula; n. Late gastrula; o. Embryo body formation; p. Closure of blastopore; q. Eye vesicle stage; r. Muscle burl stage; s. Formation of pigment; t. Formation of eye lens; u. Caudal bud stage; v. Heart beating stage; w. Muscle contraction; x. Formation of otolish; y. Pre-hatching stage; z. hatching stage; za. Newly hatched larvae.2.1.1 合子期 (0~30 min)
尖翅燕鱼受精卵的胚盘呈帽状,颜色较深,未受精的卵呈白色浑浊状且静止后逐渐下沉。受精卵为浮性卵,直径 (1.29±0.09) mm,呈圆球形,黄色透明,卵膜坚韧,含1个油球,油球直径为 (0.42±0.02) mm (图1-a)。
2.1.2 卵裂期 (30 min~4 h 7 min)
受精1 h后,胚盘顶部出现裂沟,开始第1次卵裂形成2个对等的细胞 (图1-b)。受精1 h 6 min后进行第2次卵裂,分裂沟与第1次分裂面垂直,形成4个细胞 (图1-c)。1 h 40 min后进行第3次卵裂,进入8细胞期 (图1-d)。1 h 50 min后进行第4次卵裂,进入16细胞期 (图1-e)。2 h 10 min后进行第5次卵裂,形成32个大小形状不规则的细胞 (图1-f)。2 h 30 min后进行第6次卵裂,进入64细胞期 (图1-g)。从32细胞期开始,细胞进行不规则卵裂,细胞体积随着卵裂次数增加而逐渐变小。2 h 58 min进入多细胞期 (图1-h),细胞排成多层。受精后3 h 23 min发育至桑葚期 (图1-i),细胞数量剧增,接近模糊,胚胎外观类似于桑椹球状。
2.1.3 囊胚期 (4 h 7 min~5 h 41 min)
受精后4 h 7 min进入第3阶段囊胚期。高囊胚期囊胚呈帽状堆积在原胚盘处,细胞数量多且体积小 (图1-j)。51 min后胚盘高度降低,变扁平,进入低囊胚期 (图1-k)。
2.1.4 原肠胚期 (5 h 41 min~9 h 49 min)
受精后5 h 41 min胚盘开始下包,形成胚环,进入了原肠早期 (图1-l)。34 min后,部分细胞集中加厚形成胚盾雏形,进入原肠中期 (图1-m)。8 h 8 min胚层下包4/5,胚盾继续膨大,开始出现胚体雏形,进入原肠晚期 (图1-n)。
2.1.5 神经胚期 (9 h 49 min~11 h 28 min)
受精后9 h 49 min发育至胚体形成期 (图1-o),胚环缩小,胚层细胞包围着植物极,未包部分形成卵黄栓。11 h进入胚孔封闭期 (图1-p)。
2.1.6 器官形成期 (11 h 28 min~27 h 20 min)
器官形成期持续时间最长,共持续15 h 52 min。受精后11 h 28 min,胚体前端膨大形成头部,两侧向外隆起,形成眼泡,进入眼泡出现期 (图1-q)。12 h 36 min肌节出现,开始出现零星色素,进入肌节出现期 (图1-r)。13 h 25 min胚胎进入色素形成期,胚体背部出现点状色素细胞 (图1-s)。14 h 42 min后视杯中逐渐形成圆形晶体,肌节增多,进入晶体形成期 (图1-t)。16 h 55 min胚体后端出现圆锥状突起,卵黄囊与尾部分离,进入尾芽期 (图1-u)。受精卵发育至19 h 18 min,心脏开始不规则搏动,进入心跳期 (图1-v)。受精后的20 h 36 min,胚体不断抽搐,尾从卵黄上分离,进入肌肉效应期 (图1-w)。22 h 20 min肌肉收缩剧烈,心跳速度加快,每个听囊中各形成2个钙质耳石,此阶段为耳石形成期 (图1-x)。25 h 30 min后胚体颤动更加剧烈,卵膜显得松弛,进入孵化前期 (图1-y)。孵化期尾部剧烈摆动,头部使卵膜逐渐出现隆起,仔鱼头部先破膜而出 (图1-z)。
2.1.7 孵化出膜 (27 h 20 min~27 h 45 min)
受精后27 h 20 min进入最后一个阶段,胚体脱离卵膜,悬浮静止在水面,持续时间25 min。初孵仔鱼全长为 (3.120±0.349) mm,呈透明状,头部、体部、卵黄囊以及背鳍表面散布着大量分枝叶黄素 (图1-za)。
2.2 仔稚鱼生长发育
根据尖翅燕鱼胚后发育卵黄囊、体色、鳍条以及其他形态结构变化,将其划分为3个时期 (仔鱼期、稚鱼期和幼鱼期),其中仔鱼期和稚鱼期的划分以各鳍条是否形成为依据,同时可根据卵黄囊的吸收情况将仔鱼期划分为仔鱼前期和仔鱼后期;幼鱼期判定标准为鱼体表面有3条黑色条带,身体呈雪白银色,且形态与成鱼相似。
2.2.1 仔鱼期
1日龄时,仔鱼全长 (3.220±0.729) mm,有24个肌节,眼睛无色素 (图2-a),卵黄囊体积 (0.099±0.004) mm3,此阶段的仔鱼仍浮在水面。2日龄仔鱼全长 (3.358±0.895) mm,卵黄囊逐渐减小,身体背侧和腹侧的叶黄素比侧面更密集,身体的后部和躯干的腹侧开始出现小的黑色素细胞 (图2-b)。3日龄仔鱼全长 (3.518±0.851) mm,此时的卵黄囊体积已经缩小到 (0.068±0.005) mm3,仔鱼开口,开始摄食轮虫无节幼体,黑色素细胞散布在身体的后部、躯干的腹侧和消化道的背面,眼睛有色素沉积 (图2-c)。4日龄时,仔鱼长出了小牙齿,卵黄囊和油球几乎消失,此时的卵黄囊体积为 (0.003±0.003) mm3 (图2-d)。5日龄时,鱼体中卵黄囊消失进入后仔鱼阶段,仔鱼前鳃盖骨处形成短的、针状的棘,游泳能力增强,具有趋光性 (图2-e)。在7日龄时,肠道开始弯曲,仔鱼鳃盖前棘发育良好,鳃盖、腹腔以及口腔顶部出现黄体,眼球发亮轮廓清晰 (图2-f)。9日龄时,仔鱼全长达到 (4.180±1.116) mm,背部黄色素堆积,硬棘数量增多,此阶段出现残食和攻击行为 (图2-g)。11日龄时,仔鱼全长为 (4.990±1.296) mm,鱼体颜色加深,但尾部仍未有颜色,背鳍鳍条尚未形成 (图2-h)。13日龄时,仔鱼全长 (6.320±1.160) mm,躯干部开始附着黑色素细胞,尾鳍鳍条开始分化呈扇形,摄食和游泳能力明显增强 (图2-i)。15日龄时,仔鱼全长 (8.451±1.278) mm,尾鳍与背鳍和臀鳍开始分开,身体变得圆润,身体表面黑色素细胞明显增多 (图版2-j)。
![]() 图 2 尖翅燕鱼仔稚鱼形态发育注:a. 1 龄仔鱼;b. 2 日龄仔鱼;c. 3 日龄仔鱼;d. 4 日龄仔鱼;e. 5 日龄仔鱼;f. 7 日龄仔鱼;g. 9 日龄仔鱼;h. 11 日龄仔鱼; i. 13 日龄仔鱼;j. 15 日龄仔鱼;k. 17 日龄仔鱼;l. 19 日龄稚鱼;m. 21 日龄稚鱼;n. 23 日龄稚鱼;o. 25 日龄幼鱼。Fig. 2 Morphological development of larvae and juvenile of P. teiraNone: a. 1 dah larvae; b. 2 dah larvae; c. 3 dah larvae; d. 4 dah larvae; e. 5 dah larvae; f. 7 dah larvae; g. 9 dah larvae; h. 11 dah larvae; i. 13 dah larva;j. 15 dah larva; k. 17 dah larva; l. 19 dah juvenile; m. 21 dah juvenile; n. 23 d ah juvenile; o. 25 dah juvenile.
图 2 尖翅燕鱼仔稚鱼形态发育注:a. 1 龄仔鱼;b. 2 日龄仔鱼;c. 3 日龄仔鱼;d. 4 日龄仔鱼;e. 5 日龄仔鱼;f. 7 日龄仔鱼;g. 9 日龄仔鱼;h. 11 日龄仔鱼; i. 13 日龄仔鱼;j. 15 日龄仔鱼;k. 17 日龄仔鱼;l. 19 日龄稚鱼;m. 21 日龄稚鱼;n. 23 日龄稚鱼;o. 25 日龄幼鱼。Fig. 2 Morphological development of larvae and juvenile of P. teiraNone: a. 1 dah larvae; b. 2 dah larvae; c. 3 dah larvae; d. 4 dah larvae; e. 5 dah larvae; f. 7 dah larvae; g. 9 dah larvae; h. 11 dah larvae; i. 13 dah larva;j. 15 dah larva; k. 17 dah larva; l. 19 dah juvenile; m. 21 dah juvenile; n. 23 d ah juvenile; o. 25 dah juvenile.2.2.2 稚鱼期
17日龄时,仔鱼全长 (10.470±1.135) mm,胸鳍、尾鳍、背鳍和臀鳍明显增大,鳃盖张合明显,开始进入稚鱼期阶段 (图2-k)。19日龄后,鱼体呈橙色,第1条黑带从眼部穿过,鳍条分化明显,进入幼鱼期后,鱼体色由橙色转为雪白银色 (图2-l)。21日龄时,稚鱼全长 (16.151±1.081) mm,胸鳍、尾鳍、背鳍和臀鳍继续伸长,身体变得狭窄,胸部开始出现白点 (图2-m)。23日龄时,稚鱼全长为(23.248±1.399) mm,此阶段的鱼体生长差异明显,第2条黑色条带从鳃盖后缘穿过,腹部白点增多 (图2-n)。
2.2.3 幼鱼期
在25日龄时,鱼全长 (31.066±1.998) mm,此阶段鱼的鳍棘和鳍条发育完成,其典型特征为头部、躯干部和尾部各有3条黑色条带,受到外界刺激,体色瞬间变为黑色,形态与成鱼无异 (图2-o)。
2.3 生长特性
对尖翅燕鱼初孵仔鱼至25日龄的鱼体全长、体长、体高、头长、眼径和卵黄囊的体积与日龄的关系进行回归方程拟合,结果表明,尖翅燕鱼仔稚鱼阶段全长 (图3-a)、体长 (图3-b)、体高 (图3-c)、头长 (图3-d) 和眼径 (图3-e) 与日龄之间的变化规律分别符合公式 (5)、 (6)、 (7)、 (8)和 (9):
![]() 图 3 尖翅燕鱼早期生长曲线注:a. 全长与孵化日龄的关系;b. 体长与孵化日龄的关系; c. 体高与孵化日龄的关系;d. 头长与孵化日龄的关系;e. 眼径与孵化日龄的关系;f. 卵黄囊体积与孵化日龄的关系Fig. 3 Early growth curve of P. teiraNote: a. Relationship between total length and dah; b. Relationship between body length and dah; c. Relationship between body height and dah; d. Relationship between head length and dah; e. Relationship between eye diameter and dah; f. Relationship between yolk sac volume and dah.
图 3 尖翅燕鱼早期生长曲线注:a. 全长与孵化日龄的关系;b. 体长与孵化日龄的关系; c. 体高与孵化日龄的关系;d. 头长与孵化日龄的关系;e. 眼径与孵化日龄的关系;f. 卵黄囊体积与孵化日龄的关系Fig. 3 Early growth curve of P. teiraNote: a. Relationship between total length and dah; b. Relationship between body length and dah; c. Relationship between body height and dah; d. Relationship between head length and dah; e. Relationship between eye diameter and dah; f. Relationship between yolk sac volume and dah.$$ y = 0.003\;5x^{3}-0.063\;2 x^{2}+0.506\;6x+2.440\;1\text{,}\; R^{2} = 0.995\;7$$ (5) $$ y = 0.003\;1x^{3}-0.053\;3x^{2}+0.342\;4x+2.679\;6\text{,}\;R^{2} = 0.997\;9 $$ (6) $$ y = 0.003\;8x^{3}-0.085\;6x^{2}+0.600\;1x+0.086\;3\text{,}\;R^{2} = 0.994\;5 $$ (7) $$ y = 0.001\;0x^{3}-0.019\;8x^{2}+0.209\;9x+0.176\;1\text{,}\;R^{2} = 0.993\;1 $$ (8) $$ y = 0.000\;5x^{3}-0.014\;2x^{2}+0.135\;7x+0.027\;3\text{,}\; R^{2} = 0.980\;7 $$ (9) 式中:y分别为全长、体长、体高、头长和眼径;x为日龄且x∈[1,25] 。
尖翅燕鱼仔稚鱼阶段卵黄囊的体积(图3-f)与日龄之间的变化规律符合公式 (10):
$$ y = 0.001\;5x^{3}-0.015\;6x^{2}+0.023\;7x+0.087\;7\text{,}\; R^{2}=0.968\;6 $$ (10) 式中:y为卵黄囊体积;x为日龄且x∈[1,5] 。
尖翅燕鱼仔稚鱼的全长、体长、体高、头长和眼径在发育过程中均表现出异速生长,在7日龄前生长较为缓慢,7日龄后各生长指标均加速生长。卵黄囊的体积随日龄的增加逐渐减小,在5日龄时完全消失。
3. 讨论
3.1 胚胎发育特征比较
本研究观察发现,尖翅燕鱼卵裂方式为盘状分裂,与其他鲈形目基本相同;受精卵为浮性卵,卵壳较坚韧,呈黄色透明球状,为单个油球,无黏性。一般具有油球的受精卵为浮性卵,卵的沉浮性主要取决于油球大小和孵化水体盐度高低。云纹石斑鱼 (Epinehelus moara)×鞍带石斑鱼 (E. lanceolatus)[12]的受精卵在盐度低于25时为沉性卵,盐度30左右为半沉性,盐度35以上为浮性卵。军曹鱼 (Rachycentron canadum)[13]受精卵在盐度26以下为沉性卵,盐度29左右为半沉性,盐度32以上为浮性卵。然而,黄小林等[14]观察到黄斑篮子鱼 (Siganus oramin)的受精卵为沉性黏性卵。表明鱼类受精卵的沉浮性可能与外部环境和物种繁殖行为模式有关。
尖翅燕鱼受精卵在水温 (26±0.3) ℃、盐度34~36 和pH 7.8±0.5条件下,历时27 h 45 min完成孵化。有研究表明,海水鱼类受精卵孵化速率与卵径呈正相关,卵径越大,孵化时间越久,且初孵仔鱼越大[15]。本研究结果显示,尖翅燕鱼的卵径和油球直径较大,略小于黄条鰤 (Seriolaaureovi ttata)[16],也即卵径和油球直径相近,但尖翅燕鱼受精卵的孵化速率却高于黄条鰤,这与先前的研究相一致。物种间卵径和油球的大小因产卵时间和环境等因素不同而有所差异,且卵子、油球和卵黄囊大小对初孵仔鱼的发育起关键作用[17]。卵黄囊和油球作为内源性营养物质,其体积越大则营养越充足,这对仔鱼早期器官发育、摄食、成活率有重要意义[18]。
鱼类孵化速率与孵化温度密切相关,温度低则孵化速率相对较慢;在最适孵化温度下,水温越高,孵化速率越高。黑棘鲷 (Acanthopagrus schlegelii)[19]在水温23 ℃下的孵化时间为32 h,卵形鲳鲹 (Trachinotus ovatus)[20]在水温26 ℃下的孵化时间为44 h 48 min,金钱鱼 (Scatophagus argus)[21]受精卵在水温24 ℃下经历28.5 h孵化出膜,比尖翅燕鱼略慢。然而,在温度相近的条件下,黄条鰤从受精卵到出孵仔鱼历时73 h 40 min[16],这可能受物种本身发育特点的影响,也可能与栖息环境和繁殖条件有关。有研究表明,孵化水温与孵化速率呈正相关,温度升高可以促进鱼的新陈代谢从而提高胚胎的发育速度,但温度过高会导致畸形率增加[22-23]。因此,温度对尖翅燕鱼孵化的影响还有待进一步研究。
3.2 形态特征分析
尖翅燕鱼在孵化出膜前已完成了部分器官的分化,25日龄进入幼鱼期,其仔稚鱼的胚后发育速率相对较快,在形态、生理和功能系统 (感觉、消化和运动) 方面均经历了剧烈的变化。已有研究中,多纹钱蝶鱼 (Selenotoca multifasciata)[24]出膜后33 d进入幼鱼期,相对较慢;鞍带石斑鱼[25] 21日龄开始已具备幼鱼的特征。影响鱼类胚后发育的因素很多,如温度[26]、盐度[27]和pH[28]等环境因素均会影响鱼的呼吸、消化、代谢和免疫系统发育,进而影响胚后发育的时长。
在影响胚后发育的所有因素中,早期阶段内源性营养单一、消化系统发育不完善,是制约仔鱼生长的根本因素[29],随着外源性营养的增加和器官发育,尖翅燕鱼仔稚鱼在发育后期生长速度明显加快。此外,在孵化后5 d左右,仔鱼的死亡率较高,该阶段仔鱼正处于由内源性营养向外源性营养转变的时期,饵料的适口性与丰富度对仔鱼的发育起决定性作用[30-31]。尖翅燕鱼初孵仔鱼的全长和卵黄囊体积略大于其他鱼类,这些因素均有利于其对内源性营养的吸收,促进早期器官发育。4日龄时仔鱼长出小的牙齿,7日龄时各器官的生长速度加快,眼睛、肠道、鳃盖和鳍条,作为消化、呼吸和运动的主要功能器官变化最明显[32]。肠道弯曲有利于摄食轮虫,促进对外源性营养的吸收,鳍的形成与其四处游动寻找食物和逃避捕食的能力密切相关,鳍条和眼睛的发育可提高鱼的游泳和捕食能力。上述研究表明卵的质量和外源性食物的差异会影响器官发育,导致仔稚鱼生长速率产生差异[33]。
3.3 异速生长特性分析
与其他硬骨鱼类一样[16],尖翅燕鱼仔稚鱼全长、体长、体高、头长和眼径均与日龄呈正相关关系。其头部的发育优先于体长和体高,头部为鱼类视觉、呼吸、摄食等重要器官部位,在早期发育阶段尤显重要。眼径大小是衡量鱼类神经元和感觉器官发育的重要指标,直接影响光刺激下幼鱼捕猎的反应能力[23]。尖翅燕鱼在孵化初期头长和眼径发育较缓,5日龄后快速生长,此阶段仔鱼开始具有趋光性且逐渐出现残食和攻击行为,这可能与其生活习性、养殖密度及饵料供应不足有关[34]。
鱼类体长和体高的发育通常与内脏器官发育有关,如消化系统和呼吸系统。尖翅燕鱼体高的正异速发育在7日龄后,此阶段消化系统逐渐完善,各鳍条快速发育,游泳能力和摄食能力逐渐增强。仔鱼从孵化至卵黄囊消失持续5 d,这与营养方式由内源性营养向外源性营养过渡相适应,进入外源性营养期后,鱼类运动器官的发育相一致。
尖翅燕鱼早期胚胎发育特点及异速生长特性,保证了其呼吸、消化、生长和摄食等功能的发育,以提高其适应外界环境的能力。因此,深入研究尖翅燕鱼早期发育阶段生物学特性对于提高其苗种成活率具有重要意义。
-
表 1 荧光定量PCR引物序列
Table 1 Primers of real time PCR
引物名称
primer核酸序列(5′→3′)
nucleotide sequenceβ-actinF β-actinR
TfF
TfR
TNFF
TNFR
C-LyzF
C-LyzRAGCCCACAACACCTCTTCC
TCCTCACATTCACACCGCC
CCCACCTCTCCATTCTGT
TACCATCGCTGTTTTCGC
GAGTTGGAGTGGAAGAA
TGAGAGGTGTGAAGCGT
GGACAAACGCCCACTTCA
CACCACATCCTGCCACAT -
[1] 夏立群, 黄郁葱, 鲁义善.卵形鲳鲹主要病害及其研究进展[J].安徽农学通报:上半月刊, 2012, 18(23):140-143, 150. http://www.cqvip.com/QK/98504X/201223/44195030.html [2] 苏友禄, 冯娟, 郭志勋, 等.美人鱼发光杆菌杀鱼亚种感染卵形鲳鲹的病理学观察[J].海洋科学, 2012, 36(2):75-81. http://d.wanfangdata.com.cn/periodical_hykx201202014.aspx [3] 苏友禄, 冯娟, 郭志勋, 等.3种美人鱼发光杆菌疫苗对卵形鲳鲹的免疫效果[J].华南农业大学学报, 2011, 32(3):105-110. http://www.cqvip.com/QK/90891X/201103/38729166.html [4] 蔡文超, 区又君, 李加儿, 等.卵形鲳鲹免疫器官的早期发育[J].南方水产科学, 2012, 8(5):39-45. http://www.schinafish.cn/CN/abstract/abstract8975.shtml [5] 但学明, 李安兴, 林小涛, 等.卵形鲳鲹对刺激隐核虫的免疫应答和免疫保护研究[J].水生生物学报, 2008, 32(1):13-18. http://www.wenkuxiazai.com/doc/ba6443d5bb4cf7ec4afed06c.html [6] 许海东, 区又君, 郭志勋, 等.神经坏死病毒对卵形鲳鲹的致病性及外壳蛋白基因序列分析[J].上海海洋大学学报, 2010, 19(4):482-488. http://www.cqvip.com/QK/90212A/201004/34631492.html [7] 黄郁葱, 简纪常, 吴灶和, 等.卵形鲳鲹结节病病原的分离与鉴定[J].广东海洋大学学报, 2008, 28(4):49-53. doi: 10.3969/j.issn.1673-9159.2008.04.011 [8] 张飞, 苏永全, 王军, 等.大黄鱼(Pseudosciaena crocea)源美人鱼发光杆菌(Photobacterium damselae)的分离鉴定及致病性研究[J].海洋与湖沼, 2012, 43(6):1202-1208. doi: 10.11693/hyhz201206025025 [9] 张晓君, 秦国民, 陈翠珍, 等.龙胆石斑鱼源美人鱼发光杆菌的生物学特性与系统发育学分析[J].渔业科学进展, 2009, 30(3):38-43. http://www.wenkuxiazai.com/doc/6d2f32d280eb6294dd886c3b.html [10] 任燕, 石存斌, 常藕琴, 等.五条鰤源美人鱼发光杆菌杀鱼亚种的分离鉴定及药物敏感试验[J].广东农业科学, 2012, 39(22):148-152. doi: 10.3969/j.issn.1004-874X.2012.22.049 [11] WANG Y, HAN Y, LI Y, et al.Isolation of Photobacterium damselae subsp.piscicida from diseased tongue sole(Cynoglossus semilaevis Gunther) in China[J].微生物学报, 2007, 47(5):763-768. [12] LÓPEZ-DÓRIGA M V, BARNES A C, DOS SANTOS N M, et al.Invasion of fish epithelial cells by Photobacterium damselae subsp.piscicida: evidence for receptor specificity, and effect of capsule and serum[J].Microbiology, 2000, 146(Pt 1):21-30. http://downloads.hindawi.com/journals/jir/2014/273284.xml
[13] 龙华, 郑英.转铁蛋白生理功能及其动态模型[J].湖北农学院学报, 2004, 24(1):30-35. http://www.cnki.com.cn/Article/CJFDTOTAL-HBNX200401008.htm [14] 高春萍. 黑鲷肿瘤坏死因子cDNA的克隆与体外表达的研究[D]. 青岛: 中国海洋大学, 2004: 2. http://cdmd.cnki.com.cn/Article/CDMD-10423-2004131525.htm [15] 朱占英. 草鱼免疫细胞和免疫相关基因研究: 自然杀伤细胞杀伤活性和溶菌酶mRNA的表达[D]. 上海: 上海海洋大学, 2012: 5. http://cdmd.cnki.com.cn/Article/CDMD-10264-1013000340.htm [16] 徐永平, 汪婷婷, 孙永欣, 等.水产动物溶菌酶研究的最新进展[J].水产科学, 2011, 30(5):307-310. http://industry.wanfangdata.com.cn/dl/Detail/Periodical?id=... [17] 王瑞旋, 冯娟, 苏友禄, 等.卵形鲳鲹美人鱼发光杆菌杀鱼亚种的分离鉴定[J].中国水产科学, 2010, 17(5):1020-1027. http://www.cqvip.com/qk/98270X/201005/35237841.html [18] 周小秋, 冯琳, 姜维丹, 等.营养与鱼类免疫研究进展[J].动物营养学报, 2014, 26(10):3175-3184. doi: 10.3969/j.issn.1006-267x.2014.10.032 [19] 王娜, 陈琼, 胡成钰.草鱼转铁蛋白基因的克隆及其组织表达[J].水生生物学报, 2010, 34(1):51-56. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper... [20] LUCK A N, MASON A B.Structure and dynamics of drug carriers and their interaction with cellular receptors: focus on serum transferrin[J].Adv Drug Deliv Rev, 2013, 65(8):1012-1019. doi: 10.1016/j.addr.2012.11.001
[21] GAO J, DING S, HUANG X, et al.Cloning and expression characterization of the serum transferrin gene in the Chinese black sleeper (Bostrichthys sinensis)[J].Gene, 2013, 515(1):89-98. doi: 10.1016/j.gene.2012.11.022
[22] OPPENHEIMER S J. Iron and its relation to immunity and infectious disease[J]. J Nutr, 2001, 131(2): 616S-635S.
[23] 高明英. 黄喉拟水龟转铁蛋白基因的克隆、表达及重组蛋白的抗菌性分析[D]. 上海: 上海海洋大学, 2011: 20-22. http://cdmd.cnki.com.cn/Article/CDMD-10264-1011305208.htm [24] 李伟, 史燕, 赵建, 等.中华鳖转铁蛋白基因序列特征及表达研究[J].水生生物学报, 2014, 39(3):482-489. http://industry.wanfangdata.com.cn/yj/Detail/Periodical?id=... [25] 张志伟, 李忠, 梁宏伟, 等.鲢转铁蛋白基因cDNA的克隆及其在胚胎期的表达分析[J].华中农业大学学报, 2011, 30(3):352-357. http://www.cqvip.com/QK/90088X/201103/38292877.html [26] RONZA P, LOSADA A P, VILLAMARÍN A, et al.Immunolocalization of tumor necrosis factor alpha in turbot (Scophthalmus maximus, L.) tissues[J].Fish Shellfish Immunol, 2015, 45(2):470-476. doi: 10.1016/j.fsi.2015.04.032
[27] 邱丽华, 宋林生, 蔡中华, 等.花鲈肿瘤坏死因子基因cDNA的克隆、分析与表达[J].中国水产科学, 2003, 10(5):370-375. http://www.cnki.com.cn/Article/CJFDTotal-ZSCK200305004.htm [28] KIM M S, HWANG Y J, YOON K J, et al.Molecular cloning of rock bream (Oplegnathus fasciatus) tumor necrosis factor-α and its effect on the respiratory burst activity of phagocytes[J].Fish Shellfish Immunol, 2009, 27(5):618-624. doi: 10.1016/j.fsi.2009.07.007
[29] ZOU J, WANG T, HIRONO I, et al.Differential expression of two tumor necrosis factor genes in rainbow trout, Oncorhynchus mykiss[J].Dev Comp Immunol, 2002, 26(2):161-172. doi: 10.1016/S0145-305X(01)00058-1
[30] KINOSHITA S, BISWAS G, KONO T, et al.Presence of two tumor necrosis factor (tnf)-α homologs on different chromosomes of zebrafish (Danio rerio) and medaka (Oryzias latipes)[J].Mar Genomics, 2014, 13:1-9. doi: 10.1016/j.margen.2013.10.004
[31] GRAYFER L, WALSH J G, BELOSEVIC M.Characterization and functional analysis of goldfish (Carassius auratus L.) tumor necrosis factor-alpha[J].Dev Comp Immunol, 2008, 32(5):532-543. doi: 10.1016/j.dci.2007.09.009
[32] LAING K J, WANG T, ZOU J, et al.Cloning and expression analysis of rainbow trout Oncorhynchus mykiss tumour necrosis factor-α[J].Eur J Biochem, 2001, 268(5):1315-1322. doi: 10.1046/j.1432-1327.2001.01996.x
[33] GARCÍA-CASTILLO J, PELEGRÍN P, MULERO V, et al.Molecular cloning and expression analysis of tumor necrosis factor α from a marine fish reveal its constitutive expression and ubiquitous nature[J].Immunogenetics, 2002, 54(3):200-207. doi: 10.1007/s00251-002-0451-y
[34] 钱曦, 华雪铭, 黄旭雄, 等.异育银鲫c型溶菌酶全长cDNA序列的生物信息学分析及其组织表达分析[J].中国生物化学与分子生物学报, 2008, 24(4):337-347. http://cjbmb.bjmu.edu.cn/CN/abstract/abstract19063.shtml [35] MINAGAWA S, HIKIMA J, HIRONO I, et al.Expression of Japanese flounder c-type lysozyme cDNA in insect cells[J].Dev Comp Immunol, 2001, 25(5/6):439-445. https://www.sciencedirect.com/science/article/pii/S0145305X01000131
[36] 章琼, 孙盛明, 李冰, 等.团头鲂g型溶菌酶基因全长cDNA的克隆与表达分析[J].南方水产科学, 2015, 2(2):41-49. http://www.schinafish.cn/CN/abstract/abstract9202.shtml [37] 杨勇. 日本鳗鲡的C-型和g-型溶菌酶基因及其功能研究[D]. 厦门: 集美大学, 2015: 42-43. http://cdmd.cnki.com.cn/Article/CDMD-10390-1015350253.htm [38] JIMÉNEZ-CANTIZANO R M, INFANTE C, MARTINANTONIO B, et al.Molecular characterization, phylogeny, and expression of c-type and g-type lysozymes in brill (Scophthalmus rhombus)[J].Fish Shellfish Immunol, 2008, 25(1/2):57-65. https://www.peertechz.com/Aquaculture-Fishery-Sciences/epub/IJAFS...
[39] YE X, ZHANG L, TIAN Y, et al.Identification and expression analysis of the g-type and c-type lysozymes in grass carp Ctenopharyngodon idellus[J].Dev Comp Immunol, 2010, 34(5):501-509. doi: 10.1016/j.dci.2009.12.009
[40] 潘宝平, 宋欣, 罗凯娅, 等.青蛤(Cyclina sinensis)溶菌酶基因在鳗弧菌(Vibrio anguillarum)刺激下的表达[J].海洋与湖沼, 2010, 41(6):901-906. doi: 10.11693/hyhz201006016016 [41] HIKIMA J, HIRONO I.Molecular cloning and novel repeated sequences of a C-type lysozyme gene in Japanese flounder (Paralichthys olivaceus)[J].Mar Biotechnol (NY), 2000, 2(3):241-247. doi: 10.1007/s101269900028
[42] 张士璀, 许娜.动物型溶菌酶研究新进展[J].中国海洋大学学报(自然科学版), 2014, 44(6):46-51. http://www.docin.com/p-1157415327.html [43] 王美娟. 淇河鲫c型和g型溶菌酶基因克隆及表达分析[D]. 新乡: 河南师范大学, 2015: 46. http://cdmd.cnki.com.cn/Article/CDMD-10476-1015416434.htm -
期刊类型引用(6)
1. 朱文婷,李文嘉,宣雄智,赵娟. 渔用中草药种类、作用机理及应用效果研究进展. 中国饲料. 2024(05): 94-100 .  百度学术
百度学术
2. 杨希文,祁效林,戴衍朋,金国栋,李爱堂,张金霞,冯坤蓉,覃志江. 黄芪中有效成分的提取、生物活性功能及其在动物生产中的应用. 饲料研究. 2024(03): 149-153 .  百度学术
百度学术
3. 张燕,贾阳,杜涓,刘娜,王园,齐景伟,安晓萍. 偏最小二乘法和近红外光谱技术快速测定发酵黄芪茎叶中黄酮含量及抗氧化活性. 饲料研究. 2024(18): 70-75 .  百度学术
百度学术
4. 孟睦涵,马林,尤宏争,李明泽,夏苏东,孙学亮,毕相东. 黄芪及其多糖在水产养殖中的应用研究进展. 现代畜牧兽医. 2024(12): 77-81 .  百度学术
百度学术
5. 章晓磊,毕相东,王鑫宇,戴伟. 复方中草药茎叶好氧发酵条件优化研究. 饲料研究. 2024(23): 119-124 .  百度学术
百度学术
6. 曹雪,孙佳,杨质楠,梁爽,李月红. 中草药在水产动物养殖中的研究进展. 饲料研究. 2023(24): 133-137 .  百度学术
百度学术
其他类型引用(1)








 下载:
下载:











 粤公网安备 44010502001741号
粤公网安备 44010502001741号
