Spatial and temporal pattern of planktonic ciliate community and its relationship with its environment in Dapeng Cove, the South China Sea
-
摘要:
为了解大鹏澳浮游纤毛虫时空分布特征及与环境因子间的关系,于2014年冬季、春季、夏季和秋季对大鹏澳海域进行了浮游纤毛虫的调查,并采用多元分析方法研究了环境因子对其的影响。结果显示,共检出纤毛虫31种,隶属于4纲、8目、18属。纤毛虫平均丰度为1 487个· L-1(10~5 040个· L-1),以砂壳目(Tintinnida)、急游目(Stombidiid)和环毛目(Cyclotrichida)为主。浮游纤毛虫群落结构时空差异较大。浮游纤毛虫丰度在春季最高,冬季最低;种类在夏季最多,春季最少。此外,在鱼类网箱养殖区浮游纤毛虫丰度最高,而在王母河入海口最低。通过冗余分析(redundancy analysis,RDA)发现,大鹏澳浮游纤毛虫群落结构差异主要与水体营养盐水平、温度和叶绿素a含量有关,且在不同季节有不同的主要影响因子。
Abstract:To reveal spatial and seasonal pattern of planktonic ciliate communities and its relationship with environmental variables, we investigated the planktonic ciliate composition, abundance and response to environmental changes during four seasons of 2014 in Dapeng Cove, the South China Sea. A total of 31 species belonging to eight orders were identified, 11 of which were dominant species. The average abundance of ciliate was 1 487 ind · L-1 (10~5 040 ind · L-1), and Tintinnida, Strombidium and Cyclotrichida were the most abundant in terms of number and abundance. Planktonic ciliate communities showed a distinct seasonal pattern of ciliate abundance and a clear seasonal shift of the taxonomic composition. The highest number of ciliate species occurred in summer, whereas the highest abundance peaked in spring, mainly due to the strombidium. Spatially, planktonic ciliate was more abundant and diverse in the cage fish culture area and oyster-algae mixed culture area, but the lowest abundance and species occurred in the estuary of Wangmu River. Multivariate analyses illustrate that ciliate abundance was significantly correlated with water temperature, nutrient level and chlorophyll-a concentration. Moreover, the dominant abiotic environmental factors affecting the seasonal pattern of ciliate communities were different between seasons.
-
浮游纤毛虫是一类营浮游生活的单细胞原生动物,其个体粒径大多在5~200 μm之间,主要为砂壳类和无壳类两大类。浮游纤毛虫通常以微型和微微型浮游植物为食物来源,然后又被浮游动物、鱼类、虾类和贝类所摄食,是联系微型食物网和经典食物链的关键环节[1-2]。因此,浮游纤毛虫群落结构的变化往往会影响到整个海洋生态系统结构的变动[3]。此外,纤毛虫对环境的各种胁迫反应敏感,可以反映出该群落所在水体的环境状况。目前,浮游纤毛虫已作为河流、湖泊、水库和沿海的水质监测指示生物得到了应用[4-7]。因此,进行浮游纤毛虫群落结构与环境间关系的研究,不仅有助于了解该类群的构成与分布,而且可为深入了解微型食物网的能量流动提供帮助。
大亚湾(114°30′E~114°50′E,22°31′N~22°50′N)是中国南海北部一个典型的亚热带半封闭的山地溺谷型海湾。大亚湾海域地处珠江河口低盐水与南海外海高盐水的交汇区,水域初级生产力高,饵料生物丰富,生境类型多样,是许多经济鱼类、贝类和甲壳类繁殖和索饵育肥的重要场所,也是中国重要的水产种质资源库和重要的海水养殖区。大鹏澳位于大亚湾西南部的一个半封闭式的浅海小湾内,面积约14 km2,平均水深约7 m,海水交换条件较差。大鹏澳是大亚湾内主要海水养殖区[8],已有20多年的网箱养殖历史,目前其养殖面积已超过30 hm2[9]。近年来,随着大鹏工业区规模日益扩大,人口不断增加,大量生活污水、工农业废水经河流进入海湾,对大鹏澳海域生态环境造成了巨大影响。大鹏澳作为大亚湾调查的重点区域之一,已积累了大量的海洋调查资料,但仍缺乏有关浮游纤毛虫群落与环境因子间关系的研究。该研究对大鹏澳不同区域纤毛虫的种类组成、数量变化和时空分布特征及其与环境影响因素间的关系进行了研究,以为大鹏澳浮游纤毛虫生态学提供基础资料。
1. 材料与方法
1.1 采样位点设置和样品采集
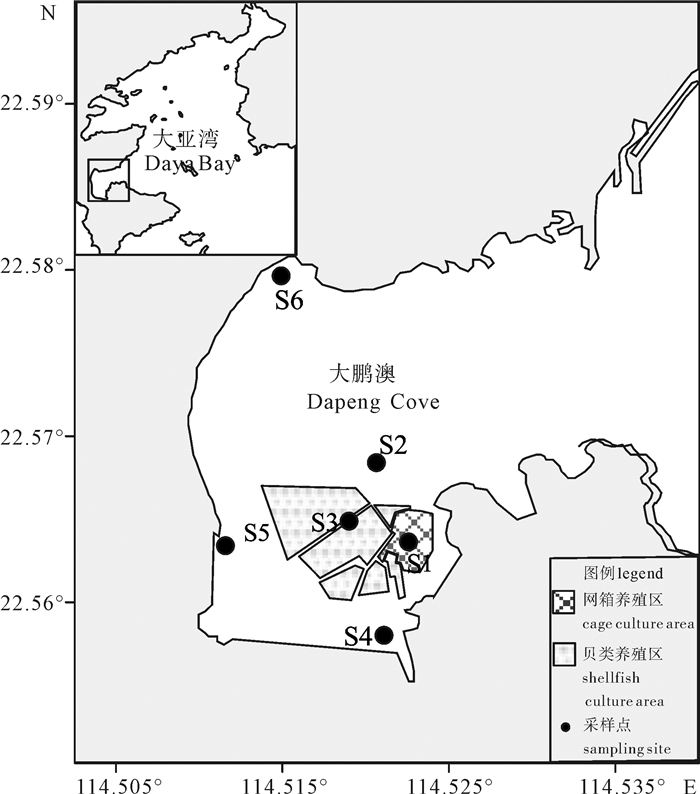
在大鹏澳海域共布设6个站位(图 1),分别于2014年1月(冬季)、4月(春季)、8月(夏季)和11月(秋季)进行浮游纤毛虫调查。其中站位S1位于鱼类网箱养殖区、S2位于非养殖区、S3位于贝类养殖区、S4位于南涌河入海口、S5位于王母河入海口、S6位于龙岐河入海口。
用niskin采水器采集各站位表层水(水下0.5 m)。温度、盐度、pH采用美国YSI Professional Plus便携式水质分析仪现场测定。将2.5 L表层水倒入白色塑桶,甲醛固定(终体积分数1%),在实验室内静止48 h以上,吸去上清液,浓缩至50 mL,用于浮游纤毛虫定性和定量分析[10]。取500 mL水样经GF/F滤膜过滤用以测定叶绿素a浓度(Chl-a),滤膜吸干后置于-20 ℃冰箱保存。另取1 L水样(保温箱保存),带回实验室分析其他水化学指标。
1.2 样品分析及鉴定
溶解氧(DO)、营养盐(NO2-、NO3-、NH4+和PO43-)等按《海洋监测规范》规定方法进行。GF/F滤膜用90%的丙酮在黑暗中于4 ℃下萃取24 h后,用荧光光度计(Tuner-10-AU)测定Chl-a。
浮游纤毛虫的鉴定分析,从均匀混合的50 mL浓缩样品中吸取0.1 mL样品于计数框中,在200×或400×光学显微镜下观察。每个样品全片计数6次,取平均值,控制标准差(SE) < 8%,换算成单位水体的个体数量(个· L-1)。种类鉴定和分类主要参照宋微波[11]、刘瑞玉等[12]、KOFOID和CAMPBELL[13-14]及LYNN[15]。
1.3 数据处理与分析
浮游纤毛虫优势种以优势度(Y) ≥0.02为划分标准[16]。群落结构多样性指数包括种类多样性指数(Shannon-Winner指数H′)、种类均匀度指数(J′)和种类丰富度指数(d)[6]。计算公式如下:
$ \begin{array}{l} H' =-\sum\limits_{i = 1}^S {{P_i}\ln {P_i}} \\ J' = H'/\ln S\\ d=(S\text{-1})/\text{ln}N\\ Y = ({\mathit{n}_i}/\mathit{N}) \times {f_i} \end{array} $
式中Pi为样品中属于i种的丰度的比例;S为总种数;N为总个体丰度;ni为第i种的丰度;fi为第i种的出现频率。
采用大型多元统计软件PRIMER 5.0软件包进行聚类分析(CLUSTER)、多维尺度分析(MDS)、相似性分析(ASOSIM)[17]。利用CANOCO 4.5软件包的去趋势对应分析(DCA)来确定生物数据适用于线性模型还是单峰型模型,通过冗余分析(redundancy analysis,RDA)获得纤毛虫群落与环境变量的关系。纤毛虫数据矩阵由出现频率≥3个站位和丰度比例≥1%的纤毛虫种类组成,分析前先用平方根转换。
2. 结果
2.1 大鹏澳水环境因子
大鹏澳海域水环境因子呈现明显的季节性变化(表 1)。温度、盐度、NO2-、NH4+、PO43-均在夏季最高。pH的变化不明显。DO、NO3-和DIN浓度在冬季相对较高,而叶绿素a质量浓度在秋季最高。水平分布,盐度河口区较低,DO在贝类养殖区和非养殖区较高(P < 0.05)。氮(NO2-、NH4+、NO3-和DIN)、磷(PO43-)营养盐浓度在河口入海处最高,并且在4个季节最高值均出现在站位S5(王母河入海口,P<0.05),其次是S6(龙岐河入海口)和S4(南涌河入海口)。叶绿素a质量浓度以站位S5最高,而S4和S2均较低(P < 0.05)。
表 1 2014年大鹏澳海域浮游纤毛虫采样点环境因子状况Table 1. Variation of environmental parameters at six sampling stations of Dapeng Cove in 2014环境因子
environmental factor冬季(1月)
winter (Jan.)春季(5月)
spring (May)夏季(8月)
summer (Aug.)秋季(11月)
autumn (Nov.)温度/℃ temperature 16.5(15.3~17.8) 25.5(25.0~26.1) 29.7(28.6~30.8) 27.7(27.0~29.3) 盐度salinity 31.1(28.5~32.4) 30.5(26.6~31.6) 32.4(29.2~33.7) 30.6(27.2~33.1) pH 8.3(8.2~8.4) 8.3(8.1~8.7) 7.9(7.8~8.2) 8.2(8.1~8.3) ρ(DO)/mg·L-1 7.8(7.3~8.2) 6.0(4.0~7.4) 5.6(2.0~8.1) 6.2(5.5~7.8) c(NO2-)/μmol·L-1 0.5(0.2~1.0) 0.5(0.1~1.8) 1.5(0.1~5.4) 0.3(0.1~1.1) c(NO3-)/μmol·L-1 22.6(7.2~71.5) 15.4(2.5~60.8) 9.6(1.2~39.7) 9.1(0.6~37.9) c(NH4+)/μmol·L-1 5.5(0.6~14.6) 4.9(1.9~11.7) 15.7(2.8~39.5) 6.1(0.6~16.3) c(DIN)/μmol·L-1 28.5(9.8~85.7) 20.8(5.4~27.6) 26.8(4.2~81.9) 15.5(0.1~54.1) c(PO43-)/μmol·L-1 0.6(0.3~1.4) 0.3(0.2~0.8) 0.9(0.4~2.0) 0.6(0.1~1.3) ρ(Chl-a)/μg·L-1 1.6(0.7~2.3) 1.8(0.8~3.2) 3.7(2.3~9.0) 5.6(0.9~13.4) 2.2 大鹏澳浮游纤毛虫种类组成
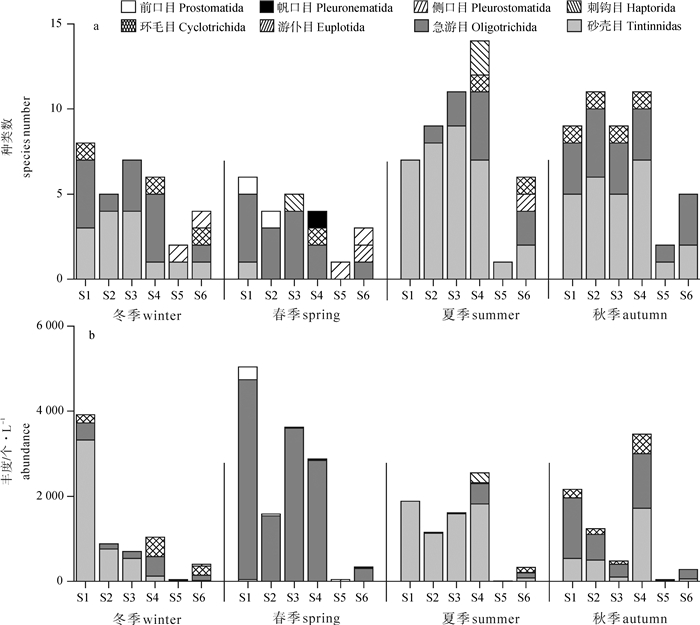
该调查共采集到浮游纤毛虫31种(属),隶属于4纲、8目、18属,其中26种鉴定到种水平,5种到属水平(表 2)。砂壳目(Tintinnida)种类最多,共19种,占总种数的61.3%;其次是急游目(Stombidiid),共5种,占总种数的16.1%;刺钩目(Haptorida)出现2种,占总种数的6.5%;游仆目(Euplotida)、环毛目(Cyclotrichida)、侧口目(Pleurostomatida)、帆口目(Pleuronematida)、前口目(Prostomatida)均出现1种,占总种数的3.2%。种类数以夏季最多,21种;秋季次之,17种;冬季和春季相对较少,分别出现13种和11种(图 2-a)。
表 2 2014年大鹏澳浮游纤毛虫种名录Table 2. List of ciliate species recorded in Dapeng Cove in 2014编号No. 种名species 1 尖底类瓮虫Amphorellopsis acuta 2 佛氏真铃虫Eutintinnus fraknoii 3 杆状真铃虫Eutintinnus stramentus 4 钟状网纹虫Favella campanula 5 诺氏薄铃虫Leprotintinnus nordqvistii 6 简单薄铃虫Leprotintinnus simplex 7 卵形类杯虫Metacylis oviformis 8 小拟铃虫Tintinnopsis minuta 9 根突拟铃虫Tintinnopsis radix 10 妥肯丁拟铃虫Tintinnopsis tocantinensis 11 百乐拟铃虫Tintinnopsis beroidea 12 有角拟铃虫Tintinnopsis corniger 13 指状拟铃虫Tintinnopsis digita 14 坚果拟铃虫Tintinnopsis nucula 15 触角拟铃虫Tintinnopsis tentaculata 16 膨大拟铃虫Tintinnopsis turgida 17 双厚领铃虫Wangiella dicollaria 18 盾形拟铃虫Tintinnopsis urnula 19 长形旋口虫Helicostomella longa 20 锥形急游虫Strombidium conicum 21 球形急游虫Strombidium globosaneum 22 急游虫Strombidium sp. 23 锥形曳尾虫Spirotontonia turbinata 24 球果螺体虫Laboea strobila 25 稀毛游仆虫Euplotes rariseta 26 红色中缢虫Mesodinium rubrum 27 双环栉毛虫Didinium nasutum 28 长吻虫Lacrymaria sp. 29 裂口虫Amphileptus sp. 30 膜袋虫Cyclidium sp. 31 前管虫Prorodon sp. 浮游纤毛虫优势种(Y≥0.02)具有显著的季节变化(表 3)。冬季浮游纤毛虫群落的优势种为小拟铃虫(Tintinnopsis minuta)、锥形急游虫(Strombidium conicum)、球形急游虫(S.globosaneum)和红色中缢虫(Mesodinium rubrum)。春季,锥形急游虫、球形急游虫仍然为群落的优势种,并且锥形急游虫贡献最大。与此同时,还出现了新的优势种—螺体虫(Laboea strobila)。夏季,除了锥形急游虫外,群落的优势种完全被新的种类尖底类瓮虫(Amphorellopsis acuta)、杆状真铃虫(Eutintinnus stramentus)、妥肯丁拟铃虫(T.tocantinencis)、有角拟铃虫(T.corniger)和长形旋口虫(Helicostomella longa)所代替。到了秋季,除妥肯丁拟铃虫和锥形急游虫仍然为群落的优势种外,又出现了新的优势种触角拟铃虫(T.tentaculata)、球形急游虫、锥形曳尾虫(Spirotontonia turbinata)和红色中缢虫。
表 3 2014年大鹏澳浮游纤毛虫优势种Table 3. List of dominant ciliate species recorded in Dapeng Cove in 2014季节
season优势种
dominant species冬季winter 小拟铃虫、锥形急游虫、球形急游虫、红色中缢虫 春季spring 锥形急游虫、锥形曳尾虫、球果螺体虫 夏季summer 尖底类翁虫、杆状真铃虫、妥肯丁拟铃虫、有角拟铃虫、长形旋口虫、锥形急游虫 秋季autumn 妥肯丁拟铃虫、触角拟铃虫、锥形急游虫、球形急游虫、锥形曳尾虫、红色中缢虫 2.3 大鹏澳浮游纤毛虫丰度的季节变动
浮游纤毛虫丰度存在显著的季节和空间差异(图 2-b)。冬季浮游纤毛虫丰度为40~3 920个·L-1,平均1 163个· L-1,最大值出现在鱼类网箱养殖区的站位S1(主要为小拟铃虫,3 920个· L-1);其次是贝类养殖区,非养殖区及南涌河入海口附近;而低值区出现在王母河与龙岐河入海口附近,尤其是王母河入海口附近的站位S5出现最小丰度(40个· L-1)。春季平均丰度达2 250个· L-1,最高丰度(5 040个· L-1)同样出现在鱼类养殖区的S1站位;另外在贝类养殖区(S3站位)和南涌河入海口附近(S4站位)也有较高的丰度;最低丰度(40个· L-1)出现在王母河入海口附近(S5站位)。夏季浮游纤毛虫平均丰度为1 255个· L-1,最大丰度为2 550个· L-1,出现在贝类养殖区的S3站位;最小值(10个·L-1)同样出现在王母河入海口处的S5站位。秋季表层浮游纤毛虫丰度为35~3 460个· L-1,最大值出现在南涌河入海口处的S4站位,主要是触角拟铃虫和球形急游虫。
2.4 大鹏澳浮游纤毛虫群落结构
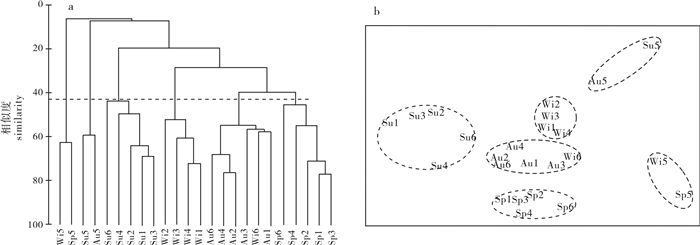
浮游纤毛虫样品在42%相似水平上可聚为6组(图 3-a)。第1组包括冬季和春季站位S5(王母河入海口附近)样品。第2组包括夏季与秋季站位S5样品。第3组包括夏季各站位样品(站位S5除外)。第4组包括冬季各站位样品(除站位S5和S6外)。第5组包括秋季各站位样品(除站位S5外)和冬季站位S6样品。第6组包括春季各站位样品(站位S5除外)。通过多维尺度分析(MDS)得出了与聚类分析一致的结果(图 3-b)。相似性分析(ANOSIM)对组群间的差异进行显著性检验,得到global R=0.789,显著水平P < 0.001,表明各组之间存在极显著差异。
2.5 大鹏澳浮游纤毛虫丰度与环境因子的关系
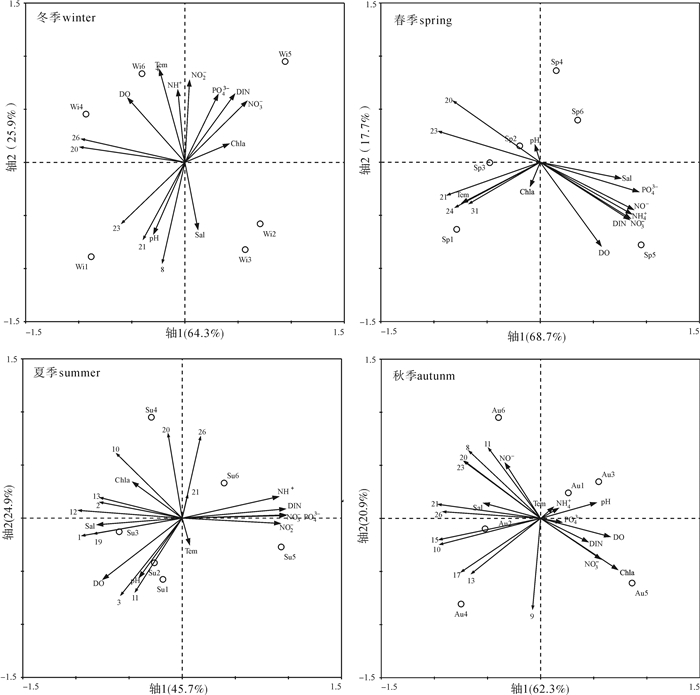
对4个季节的样品分布进行冗余分析(RDA)(图 4),影响冬季浮游纤毛虫群落空间分布的环境因子主要是NO3-、DIN、PO43-、Chl-a和温度,其次是NO2-、NH4+、盐度和pH。站位S5(王母河入海口)营养盐和Chl-a含量最高,但浮游纤毛虫丰度最低;相反,站位S1(鱼类网箱养殖区)营养盐含量比站位S5相对偏低,但纤毛虫丰度最高,其中小拟铃虫为主要的贡献者。在春季,环境因子NO3-、DIN、PO43-、NO2-和NH4+是浮游纤毛虫群落变化的主要影响因子,其次是盐度、DO和温度。站位S5营养盐水平最高,纤毛虫丰度最低;站位S1和S3(贝类养殖区)营养水平相对较低,而浮游纤毛虫丰度最大,且锥形急游虫和锥形曳尾虫为主要的贡献者。夏季的主要影响因子有NO3-、DIN、NH4+、NO2-、PO43-、DO和Chl-a。站位S4(南涌河入海口处)有较高的Chl-a,该站位的纤毛虫丰度最高;站位S5营养盐水平最高,但纤毛虫丰度却最低。秋季影响最显著的环境因子是Chl-a、NO3-、DO和NO2-等。站位S5营养盐水平最高,纤毛虫丰度却最低;站位S4营养盐水平尽管不是最高,其纤毛虫丰度却最大。
![]() 图 4 2014年大鹏澳浮游纤毛虫群落与环境因子关系的RDA二维排序图Wi.冬季;Sp.春季;Su.夏季;Au.秋季;1.尖底类瓮虫;3.杆状真铃虫;8.小拟铃虫;9.根突拟铃虫;10.妥肯丁拟铃虫;11.百乐拟铃虫;12.有角拟铃虫;13.指状拟铃虫;15.触角拟铃虫;17.双厚领铃虫;19.长形旋口虫;20.锥形急游虫;21.球形急游虫;23.锥形曳尾虫;24.球果螺体虫;26.红色中缢虫;Tem.温度;Sal.盐度Figure 4. RDA two-dimensional plot showing relationship between ciliate community and environmental variables in Dapeng Cove in 2014Wi. winter; Sp. spring; Su. summer; Au. Autumn; 1.Amphorellopsis acuta; 3.Eutintinnus stramentus; 8.Tintinnopsis minuta; 9.T.radix; 10.T.tocantinencis; 11.T.beroidea; 12.T.corniger; 13.T.digita; 15.T.tentaculata; 17.Wangiella dicollaria; 19.Helicostomella longa; 20.Strombidium conicum; 21.S.globosaneum; 23.Spirotontonia turbinate; 24.Laboea strobili; 26.Mesodinium rubrum; Tem.temperature; Sal.salinity
图 4 2014年大鹏澳浮游纤毛虫群落与环境因子关系的RDA二维排序图Wi.冬季;Sp.春季;Su.夏季;Au.秋季;1.尖底类瓮虫;3.杆状真铃虫;8.小拟铃虫;9.根突拟铃虫;10.妥肯丁拟铃虫;11.百乐拟铃虫;12.有角拟铃虫;13.指状拟铃虫;15.触角拟铃虫;17.双厚领铃虫;19.长形旋口虫;20.锥形急游虫;21.球形急游虫;23.锥形曳尾虫;24.球果螺体虫;26.红色中缢虫;Tem.温度;Sal.盐度Figure 4. RDA two-dimensional plot showing relationship between ciliate community and environmental variables in Dapeng Cove in 2014Wi. winter; Sp. spring; Su. summer; Au. Autumn; 1.Amphorellopsis acuta; 3.Eutintinnus stramentus; 8.Tintinnopsis minuta; 9.T.radix; 10.T.tocantinencis; 11.T.beroidea; 12.T.corniger; 13.T.digita; 15.T.tentaculata; 17.Wangiella dicollaria; 19.Helicostomella longa; 20.Strombidium conicum; 21.S.globosaneum; 23.Spirotontonia turbinate; 24.Laboea strobili; 26.Mesodinium rubrum; Tem.temperature; Sal.salinity3. 讨论
3.1 浮游纤毛虫群落的季节和空间变化
目前,有关浮游纤毛虫丰度变化的研究主要集中在温带海湾等近岸海域,并且各个海域的周年变化情况不一致。此研究中浮游纤毛虫的种类和丰度均具有显著的季节变化。纤毛虫种类在夏季和秋季较多,而在冬季和春季较少;丰度在春季较高,而在冬季偏低。同样,胶州湾浮游纤毛虫的丰度只出现一个峰值,通常在晚春-夏季,冬季丰度较低[6, 18]。而有的海区如卡斯特拉湾[19],纤毛虫丰度一年之中出现双峰值,分别在春季和夏季,冬季丰度最低。
空间上,浮游纤毛虫种类数和丰度在鱼类网箱养殖区、南涌河入海口、贝类养殖区及非养殖区均较高,而在王母河和龙岐河入海口偏低。这可能与环境、饵料的可利用性有关。在鱼类网箱养殖区,由于高密度养殖活动使该区域营养盐水平相对较高,浮游植物生物量(Chl-a)也相对较高,从而给纤毛虫提供了较高水平的饵料[20-23]。在南涌河入海口处,南涌河流经区域主要为农作物种植区、村庄和水产养殖区[24],由于受陆源物质输入的影响,浮游植物的大量生长,细菌丰度升高等,因此浮游纤毛虫丰度也相应较高。王母河流经区域为大鹏澳人口最为密集的大鹏镇和工业区,龙岐河的流经区域则为农田、小规模工业区和城镇生活区。因此,王母河及龙岐河入海口处水质很差,在环境胁迫(如重金属污染,严重富营养化)条件下,浮游纤毛虫的物种多样性或种类丰度均较低。
3.2 浮游纤毛虫群落与环境因子的关系
在该研究中,无论是聚类分析还是RDA排序法分析都显示,环境因子是纤毛虫群落结构时空分布变化的主要影响因子,而在不同季节对浮游纤毛虫群落起主导作用的环境因子则不尽相同。如冬季主要为NO3-、DIN、PO43-、Chl-a和温度,春季为温度、DO、NO3-、NO2-、DIN、NH4+和PO43-,夏季为DO、NO3-、DIN、NH4+、NO2-和PO43-,而秋季为Chl-a、NO3-、DO和NO2-等。可以看出,温度、溶解氧、营养盐水平和叶绿素a含量是影响浮游纤毛虫群落季节和空间分布的重要因素。温度是影响水生生物生长和发育的一个重要因素[25]。冬季由于温度偏低,浮游植物生长慢且丰度较低,而大多数纤毛虫(砂壳类)的食物来源是浮游植物,因此海水温度和浮游植物的丰度(Chl-a)是影响冬季大鹏澳海域纤毛虫群落和丰度的重要因素。除了受温度和饵料影响外,营养盐也是影响纤毛虫群落结构变化的一个重要因素。JIANG等[6]对胶州湾海域调查表明,纤毛虫群落结构与环境状况特别是硝态氮和可溶性活性磷显著正相关。WANG等[25]对北部湾纤毛虫的研究发现,纤毛虫丰度与氮磷营养盐的含量显著正相关。但是,在此研究中纤毛虫丰度与营养盐水平之间的关系相对比较复杂。比如在鱼类网箱养殖区,其营养盐水平比贝类养殖区和非养殖区高,纤毛虫丰度也较高。但是在王母河与龙岐河入海口处,尽管营养盐水平很高,纤毛虫丰度却最低。这主要与两条河流入海口处水质状况差有关。另外,纤毛虫丰度与其群落组成也有关系。众所周知,大多急游类纤毛虫是自养或兼养种类,而砂壳类纤毛虫均为异养[26]。异养种类主要食物来源是浮游植物和细菌,而自养纤毛虫可以直接吸收营养盐。该研究发现春季Chl-a水平虽然偏低,但是纤毛虫的丰度最高。这可能主要是因为急游类纤毛虫无论在种类还是丰度上,均是春季最为优势的种群。此外,纤毛虫的竞争者(如轮虫)和捕食者(如桡足类、仔鱼)的数量等也都对纤毛虫群落起着不可忽视的作用,然而这些因素并未纳入此研究中,有待将来进一步研究。总之,影响浮游纤毛虫群落的因素是多样的[27-28],并且纤毛虫群落与其栖息地的环境状况密切相关。
-
图 4 2014年大鹏澳浮游纤毛虫群落与环境因子关系的RDA二维排序图
Wi.冬季;Sp.春季;Su.夏季;Au.秋季;1.尖底类瓮虫;3.杆状真铃虫;8.小拟铃虫;9.根突拟铃虫;10.妥肯丁拟铃虫;11.百乐拟铃虫;12.有角拟铃虫;13.指状拟铃虫;15.触角拟铃虫;17.双厚领铃虫;19.长形旋口虫;20.锥形急游虫;21.球形急游虫;23.锥形曳尾虫;24.球果螺体虫;26.红色中缢虫;Tem.温度;Sal.盐度
Figure 4. RDA two-dimensional plot showing relationship between ciliate community and environmental variables in Dapeng Cove in 2014
Wi. winter; Sp. spring; Su. summer; Au. Autumn; 1.Amphorellopsis acuta; 3.Eutintinnus stramentus; 8.Tintinnopsis minuta; 9.T.radix; 10.T.tocantinencis; 11.T.beroidea; 12.T.corniger; 13.T.digita; 15.T.tentaculata; 17.Wangiella dicollaria; 19.Helicostomella longa; 20.Strombidium conicum; 21.S.globosaneum; 23.Spirotontonia turbinate; 24.Laboea strobili; 26.Mesodinium rubrum; Tem.temperature; Sal.salinity
表 1 2014年大鹏澳海域浮游纤毛虫采样点环境因子状况
Table 1 Variation of environmental parameters at six sampling stations of Dapeng Cove in 2014
环境因子
environmental factor冬季(1月)
winter (Jan.)春季(5月)
spring (May)夏季(8月)
summer (Aug.)秋季(11月)
autumn (Nov.)温度/℃ temperature 16.5(15.3~17.8) 25.5(25.0~26.1) 29.7(28.6~30.8) 27.7(27.0~29.3) 盐度salinity 31.1(28.5~32.4) 30.5(26.6~31.6) 32.4(29.2~33.7) 30.6(27.2~33.1) pH 8.3(8.2~8.4) 8.3(8.1~8.7) 7.9(7.8~8.2) 8.2(8.1~8.3) ρ(DO)/mg·L-1 7.8(7.3~8.2) 6.0(4.0~7.4) 5.6(2.0~8.1) 6.2(5.5~7.8) c(NO2-)/μmol·L-1 0.5(0.2~1.0) 0.5(0.1~1.8) 1.5(0.1~5.4) 0.3(0.1~1.1) c(NO3-)/μmol·L-1 22.6(7.2~71.5) 15.4(2.5~60.8) 9.6(1.2~39.7) 9.1(0.6~37.9) c(NH4+)/μmol·L-1 5.5(0.6~14.6) 4.9(1.9~11.7) 15.7(2.8~39.5) 6.1(0.6~16.3) c(DIN)/μmol·L-1 28.5(9.8~85.7) 20.8(5.4~27.6) 26.8(4.2~81.9) 15.5(0.1~54.1) c(PO43-)/μmol·L-1 0.6(0.3~1.4) 0.3(0.2~0.8) 0.9(0.4~2.0) 0.6(0.1~1.3) ρ(Chl-a)/μg·L-1 1.6(0.7~2.3) 1.8(0.8~3.2) 3.7(2.3~9.0) 5.6(0.9~13.4) 表 2 2014年大鹏澳浮游纤毛虫种名录
Table 2 List of ciliate species recorded in Dapeng Cove in 2014
编号No. 种名species 1 尖底类瓮虫Amphorellopsis acuta 2 佛氏真铃虫Eutintinnus fraknoii 3 杆状真铃虫Eutintinnus stramentus 4 钟状网纹虫Favella campanula 5 诺氏薄铃虫Leprotintinnus nordqvistii 6 简单薄铃虫Leprotintinnus simplex 7 卵形类杯虫Metacylis oviformis 8 小拟铃虫Tintinnopsis minuta 9 根突拟铃虫Tintinnopsis radix 10 妥肯丁拟铃虫Tintinnopsis tocantinensis 11 百乐拟铃虫Tintinnopsis beroidea 12 有角拟铃虫Tintinnopsis corniger 13 指状拟铃虫Tintinnopsis digita 14 坚果拟铃虫Tintinnopsis nucula 15 触角拟铃虫Tintinnopsis tentaculata 16 膨大拟铃虫Tintinnopsis turgida 17 双厚领铃虫Wangiella dicollaria 18 盾形拟铃虫Tintinnopsis urnula 19 长形旋口虫Helicostomella longa 20 锥形急游虫Strombidium conicum 21 球形急游虫Strombidium globosaneum 22 急游虫Strombidium sp. 23 锥形曳尾虫Spirotontonia turbinata 24 球果螺体虫Laboea strobila 25 稀毛游仆虫Euplotes rariseta 26 红色中缢虫Mesodinium rubrum 27 双环栉毛虫Didinium nasutum 28 长吻虫Lacrymaria sp. 29 裂口虫Amphileptus sp. 30 膜袋虫Cyclidium sp. 31 前管虫Prorodon sp. 表 3 2014年大鹏澳浮游纤毛虫优势种
Table 3 List of dominant ciliate species recorded in Dapeng Cove in 2014
季节
season优势种
dominant species冬季winter 小拟铃虫、锥形急游虫、球形急游虫、红色中缢虫 春季spring 锥形急游虫、锥形曳尾虫、球果螺体虫 夏季summer 尖底类翁虫、杆状真铃虫、妥肯丁拟铃虫、有角拟铃虫、长形旋口虫、锥形急游虫 秋季autumn 妥肯丁拟铃虫、触角拟铃虫、锥形急游虫、球形急游虫、锥形曳尾虫、红色中缢虫 -
[1] AZAM F, FEBCHEL T, FIELD J G, et al. The ecological role of water-column microbes in the sea[J].Mar Ecol Prog Ser, 1983, 10(3):257-263. https://www.researchgate.net/publication/200146439
[2] PIERCE R W, TURNER J T. Ecology of planktonic ciliates in marine food webs[J]. Rev Aquat Sci, 1992, 6(2):139-181. http://www.oalib.com/references/8366667
[3] FINLAY B J, ESTEBAN G F. Freshwater protozoa:biodiversity and ecological function[J].Biol Conserv, 1998, 7:1163-1186. https://www.researchgate.net/profile/Bland_Finlay/publication/...
[4] 许木启, 朱江, 曹宏.白洋淀原生动物群落多样性变化与水质关系研究[J].生态学报, 2001, 21(7):1114-1120. http://www.wenkuxiazai.com/doc/d1c0d2cd77232f60dccca143-3.html [5] 李静, 戴曦, 孙颖, 等.太湖浮游纤毛虫群落结构及其与环境因子的关系[J].生态学报, 2014, 34(16):4672-4681. http://d.wanfangdata.com.cn/Periodical/stxb201416024 [6] JIANG Y, XU H, HU X, et al. An approach to analyzing spatial patterns of planktonic ciliate communities for monitoring water quality in Jiaozhou Bay, northern China[J].Mar Pollut Bull, 2011, 62(2):227-235. doi: 10.1016/j.marpolbul.2010.11.008
[7] XU H, SONG W, WARREN A, et al. Planktonic protist communities in a semi-enclosed mariculture pond:structural variation and correlation with environmental conditions[J].J Mar Biol Assoc UK, 2008, 88:1353-1362. doi: 10.1017/S0025315408002129
[8] 王肇鼎, 彭云辉, 孙丽华, 等.大鹏澳网箱养鱼水体自身污染及富营养化研究[J].海洋科学, 2003, 27(2) :77-81. http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CJFQ&dbname=CJFD2003&filename=HYKX200302021&v=MDIyNDNMdXhZUzdEaDFUM3FUcldNMUZyQ1VSTDJlWmVkdEZpRG1WYjNNTFRUQWRyRzRIdExNclk5SFpZUjhlWDE= [9] 黄洪辉, 林钦, 王文质, 等.大鹏澳海水鱼类网箱养殖对水环境的影响[J].南方水产, 2005, 1(3):9-17. http://www.oalib.com/paper/4365752 [10] UTERMÖHL H. Zur vervolkommung der quantitativen phytoplankton Methodik. Mitteilungen der Inernationale Vereinigung für Theoretische und Angewandte[J].Limnologie, 1958, 9:1-38. doi: 10.1007/s10750-015-2406-y
[11] 宋微波.中国黄渤海的自由生纤毛虫[M].北京:科学出版社, 2008:1-518. [12] 刘瑞玉, 徐奎栋.中国海洋生物名录[M].北京:科学出版社, 2008:216-241. [13] KOFOID C A, CAMPBELL A S. A conspectus of the marine and freshwater Ciliata belonging to the suborder Tintinnoinea, with descriptions of new species principally from the Agassiz expedition to the eastern tropical Pacific 1904-1905[J].Univ Calif Pub Zool, 1929, 34:1-403. http://www.worldcat.org/title/conspectus-of-the-marine-and-fresh-water...
[14] KOFOID C A, CAMPBELL A S. The tintinnoinea of the eastern tropic pacific[J].Bull Mus Comp Zool, 1939, 84:1-473. http://www.worldcat.org/title/conspectus-of-the-marine-and-fresh-water...
[15] LYNN D H. The Ciliated Protozoa:characterization, classification, and guide to the literature[M].. New York:Springer, 2008:1-605.
[16] 徐兆礼, 陈亚瞿.东黄海秋季浮游动物优势种聚集强度与给势渔场的关系[J].生态学杂志, 1989, 8(4):13-15. http://www.docin.com/p-17106741.html [17] 廖秀丽, 陈丕茂, 马胜伟, 等.大亚湾杨梅坑海域投礁前后浮游植物群落结构及其与环境因子的关系[J].南方水产科学, 2013, 9(5):109-119. http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CJFQ&dbname=CJFDHIS2&filename=NFSC201305023&v=MjAyODZHNEg5TE1xbzlIWjRSOGVYMUx1eFlTN0RoMVQzcVRyV00xRnJDVVJMMmVaZWR0RmlEbVZickFLeXZZYmI= [18] 于莹, 张武昌, 赵楠, 等.胶州湾浮游纤毛虫丰度和生物量的周年变化[J].海洋与湖沼, 2011, 42(5):690-701. doi: 10.11693/hyhz201105010010 [19] BOJANIḈ N, ŠOLIḈ M, KRSTULOVIḈ N, et al. Temporal variability in abundance and biomass of ciliates and copepods in the eutrophicated part of Kastela Bay (Middle Adriatic Sea)[J].Helgoland Mar Res, 2005, 59:107-120. doi: 10.1007/s10152-004-0199-x
[20] SONG X Y, HUANG L M, ZHANG J L, et al. Variation of phytoplankton biomass and primary production in Daya Bay during spring and summer[J].Mar Poll Bull, 2004, 49(11/12):1036-1044. https://www.sciencedirect.com/science/article/pii/S0025326X04002735
[21] LI K, YIN J, TAN Y, et al. Short-term variation in zooplankton community from Daya Bay with outbreaks of Penilia avirostris [J].Ocenonlogia, 2014, 56(3):583-602. http://www.doc88.com/p-4377722950097.html
[22] PITTA P, TSAPAKIS M, APOSTOLAKI E T, et al. ′Ghost nutrients′ from fish farms are transferred up the food web by phytoplankton grazers[J].Mar Ecol Prog Ser, 2009, 374:1-6. doi: 10.3354/meps07763
[23] SILVA C, YÁÑEZ E, MARTÍN-DÍAZ M L, et al. Assessing a bioremediation strategy in a shallow coastal system affected by a fish farm culture-application of GIS and shellfish dynamic models in the Rio San Pedro, SW Spain[J].Mar Poll Bull, 2012, 64:751-765. doi: 10.1016/j.marpolbul.2012.01.019
[24] 孙丽华, 陈浩如, 彭云辉, 等.大亚湾大鹏澳周边河流中营养盐的分布及如海通量的估算[J].台湾海峡, 2003, 2(2):211-217. http://edu.wanfangdata.com.cn/Periodical/Detail/twhx200302014 [25] WANG Y, ZHANG W, LIN Y, et al. Spatial pattern of the planktonic ciliate community and its relationship with the environment in spring in the northern Beibu Gulf, South China Sea[J].Oceanol Hydrobiol St, 2013, 42 (4):470-479. doi: 10.2478/s13545-013-0103-x
[26] TAN Y, HUANG L, HUANG X, et al. The relationships between ciliate composition, abundance, and environmental factors in Sanya Bay coral reef waters[J].Acta Ecol Sin, 2010, 30(24):6835-6844. https://www.researchgate.net/publication/286396572_The...
[27] WANG Y, ZHANG W, LIN Y, et al. Spatial and seasonal variations of large tintinnid ciliates in Shenhu Bay of China[J].Oceanol Hydrobiol St, 2014, 43(3):292-302. doi: 10.2478/s13545-014-0144-9
[28] SANDERS R W. Seasonal distributions of the photosynthesizing ciliates Laboea strobila and Myrionecta rubra (= Mesodinium rubrum) in an estuary of the Gulf of Maine[J].Aquat Microb Ecol:Int J, 1995, 9:237-242. doi: 10.3354/ame009237
-
期刊类型引用(4)
1. 赵连玲,刘华雪,饶义勇,廖秀丽,戴明,黄洪辉. 基于改进灰色关联度聚类的海水质量状况评价方法研究:以大亚湾为例. 南方水产科学. 2024(01): 141-150 .  本站查看
本站查看
2. 杨清,张鹏,安瑞志,乔楠茜,达珍,巴桑. 拉萨河中下游纤毛虫群落时空分布模式及其驱动机制. 生物多样性. 2022(06): 136-150 .  百度学术
百度学术
3. 杨文超,黄道建,陈继鑫,陈晓燕,王宇珊. 大亚湾海域2009—2015年氮、磷营养盐时空分布及富营养化评价. 南方水产科学. 2020(02): 54-61 .  本站查看
本站查看
4. 孙涛,肖雅元,王腾,刘永,付亚男,李纯厚. 大亚湾海域水体和沉积物中石油类含量与分布特征. 南方水产科学. 2018(04): 1-9 .  本站查看
本站查看
其他类型引用(0)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
