Reproductive biology of purpleback flying squid (Symplectoteuthis oualaniensis) in the south-central South China Sea in spring and autumn
-
摘要:
以2012年9月(秋季)与2013年3月(春季)在南海中南部采集的4 016尾鸢乌贼(Sthenoteuthis oualaniensis)样本为基础,对南海中南部鸢乌贼繁殖生物学特征进行研究分析。结果显示,春、秋两季鸢乌贼雌雄个体比例均为1 : 1;性腺发育为春季Ⅰ、Ⅱ期所占比例较高,秋季Ⅱ、Ⅲ期所占比例较高;性腺成熟度指数(GSI)表现为秋季高于春季,雄性高于雌性的变化规律;在成熟雌性个体中,当胴长 < 141 mm或>150 mm时,GSI均随胴长的增长而升高,其中121~140 mm胴长组GSI最高,高达9.71;春、秋两季鸢乌贼个体绝对繁殖力变动范围分别为63~97 074粒和24~60 378粒,均值分别为8 635粒和10 234粒,秋季鸢乌贼繁殖能力较春季强;鸢乌贼个体绝对繁殖力与胴长、体质量、纯体质量均呈显著正相关关系(P < 0.01)。鸢乌贼成熟卵径范围为400~1 200 μm,均值为(769±261)μm。结果表明,鸢乌贼的卵径小,属异步成熟、分批产卵类型,具有较强的繁殖潜力。
Abstract:We studied the reproductive biology of Sthenoteuthis oualaniensis in the south-central South China Sea using a total of 4 016 specimens collected in September 2012 and March 2013. The sex ratio of S.oualaniensis was about 1 : 1. The proportion of StageⅠand StageⅡ was higher in spring, while that of StageⅡ and StageⅢ was higher in autumn. Gonad somatic index (GSI) was higher in autumn and male. For mature female, when mantle length was less than 141 mm or more than 150 mm, GSI increased with increasing mantle length. The highest GSI was 9.71 when the mantle length was 121~140 mm. The individual absolute fecundity was 63~97 074 eggs and 24~60 378 eggs, the average was 8 635 eggs and 10 234 eggs in spring and autumn, respectively. The fecundity was stronger than that in autumn. The individual absolute fecundity was positively correlated with mantle length, body weight and net body weight very significantly (P < 0.01). The mature egg diameter distribution range was 400~1 200 μm with an average of (769±261) μm. The results indicate that the reproductive strategy characteristics of S.oualaniensis were small eggs, asynchronous mature, batch spawning and high fecundity.
-
Keywords:
- Sthenoteuthis oualaniensis /
- fecundity /
- reproductive biology /
- the South China Sea
-
鸢乌贼(Sthenoteuthis oualaniensis,Lesson 1830)为暖水大洋性头足类,隶属于头足纲、枪形目、柔鱼科、鸢乌贼属[1],广泛分布于印度洋、太平洋的赤道和亚热带海域,其中在南海和印度洋西北海域最为丰富[2]。南海鸢乌贼俗称深海红鱿,因其生命周期短,资源量高,是目前南海外海最具开发潜力的生物资源之一[3]。中国目前对印度洋西北海域的鸢乌贼研究的相对较多,对南海海域的则较少。研究主要集中在鸢乌贼的生长摄食[4]、耳石形态[5-6]、资源评估[7-8]、遗传多样性[9]及营养加工[10-11]等方面,而在繁殖生物学方面仅颜云榕等[4]和张宇美等[12]分别对南沙海域和西沙海域的鸢乌贼做过报道。
种群的补充、生长和死亡是决定种群数量及其变动的3个相互联系的过程,繁殖力是影响种群补充量的原因之一,也是资源评估的重要参数之一[13]。因此,研究鸢乌贼的繁殖力对评估其种群数量及变化规律,合理开发与可持续利用其资源有着重要意义,该研究旨在为今后南海鸢乌贼资源的开发、利用及管理提供基础数据。
1. 材料与方法
1.1 调查海域与调查船
鸢乌贼样本分别采集于2012年9月~10月(秋季)和2013年3月~4月(春季)2个季度,采集海域为5°N~16°N,108°E~118°E,取样区域见图 1。调查船是租用钢质灯光罩网渔船,总吨位400 GT,总长43.6 m,型宽7.60 m,型深4.10 m,双主机,每台功率201.0 kW,海上自持力70 d。
1.2 样品采集与分析
样本采集采用灯光罩网作业(主尺度为281.60 m×80.18 m,网口网目尺寸为35 mm,网囊最小网目尺寸为17 mm)。共采集到样本4 016尾,样本现场低温速冻后运回实验室进行生物学测定,测量过程均按照《海洋调查规范》(GB/T 12763.6—2007)[14]分别测定其胴长(ML)、体质量(BW)、纯体质量(W)以及性腺成熟度等生物学参数。性腺成熟度划分参照茎柔鱼性成熟度分期标准,分为Ⅰ~Ⅴ期[15]。
鸢乌贼繁殖力的测定:随机采集Ⅲ~Ⅳ期雌性卵巢样品进行繁殖力的测定。采用质量法进行卵粒的计数,先用电子天平(精确到0.01 g)分别称量卵巢内未成熟卵子和输卵管内成熟卵子质量,然后再分别取其中1 g,对其计数,最后换算为卵巢卵子数和输卵管内成熟卵子数,对少于1 g的样本进行全部计数。
成熟卵径的测定。卵径的测定采用贝克曼库尔特Multisizer 3颗粒计数及粒度分析仪进行。取2 g成熟卵于培养皿中,加少量0.9%生理盐水,用弯头解剖针将其分开,待细胞个体完全分开后,加适量的生理盐水,然后置于调试好的仪器中进行分析测定。
个体潜在繁殖力(potential fecundity)用未成熟卵子数与成熟卵子数之和表示。个体绝对繁殖力(absolute fecundity)是指雌性个体在一个生殖季节可能排出的卵子数,用输卵管中的成熟卵子数作为绝对繁殖力[16]。该研究用成熟卵粒数来代表个体绝对繁殖力。个体绝对繁殖力与体质量或胴长的比值作为个体相对繁殖力,即为单位体质量(g)或胴长(mm)的繁殖力。该研究以Fa表示个体绝对繁殖力,以Faml表示单位胴长的相对繁殖力,以Faw表示单位纯体质量的相对繁殖力。
1.3 数据统计与分析
用性腺成熟度指数(gonosomatic index,GSI)判断鸢乌贼性腺发育情况[17]。计算公式如下:
$$ {\text { GSI }}=(\text { 性腺质量 } / \text { 纯体质量 }) \times 100 $$ 将2个季度鸢乌贼个体绝对繁殖力与胴长、体质量、纯体质量等生物学参数的关系作比较并对回归方程的差异性进行F检验。
卵径数据分析。卵径测量数据的分析使用测量仪器(贝克曼库尔特Multisizer 3颗粒计数及粒度分析仪)自带的数据分析处理软件,文章主要分析了卵径的体积百分比和数量百分比分布。
2. 结果与分析
2.1 鸢乌贼的性腺发育情况
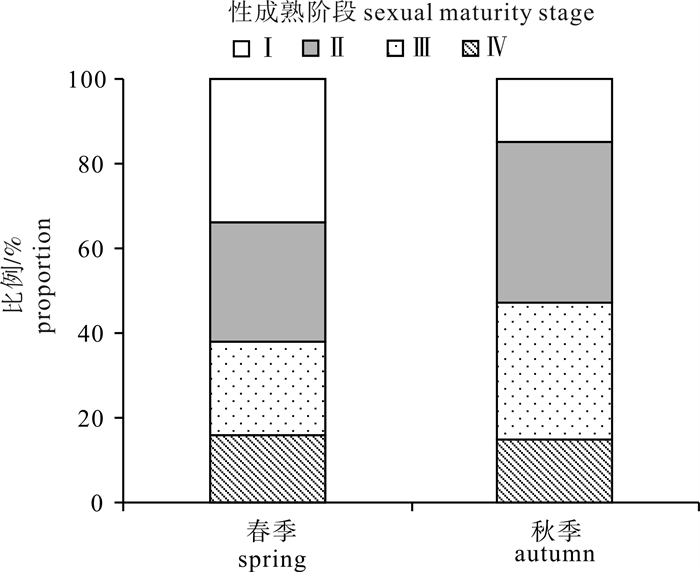
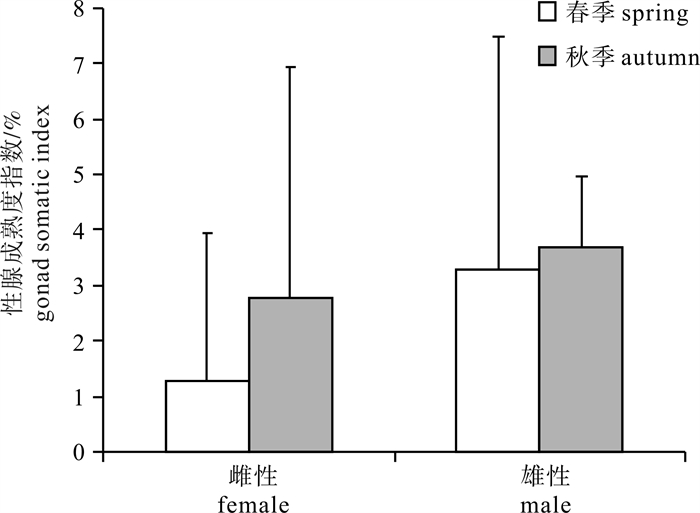
调查发现南海中南部海域鸢乌贼雌雄个体性腺发育存在较大差异,即便为同一胴长的不同个体,其性腺成熟度也存在较大差异。该海域春、秋季鸢乌贼雌雄比例均接近1 : 1,2个季度均发现有性成熟个体。不同季节鸢乌贼性腺成熟情况存在差异,其中春季Ⅰ期个体所占比例较大,秋季则Ⅱ、Ⅲ期所占比例较大,2个季节Ⅳ期个体所占比例基本相同(图 2)。从鸢乌贼性腺成熟度指数看,鸢乌贼性腺成熟度存在季节差异和性别差异,秋季性腺成熟度高于春季(图 3)。
2.2 成熟雌性鸢乌贼性腺成熟随胴长的变化
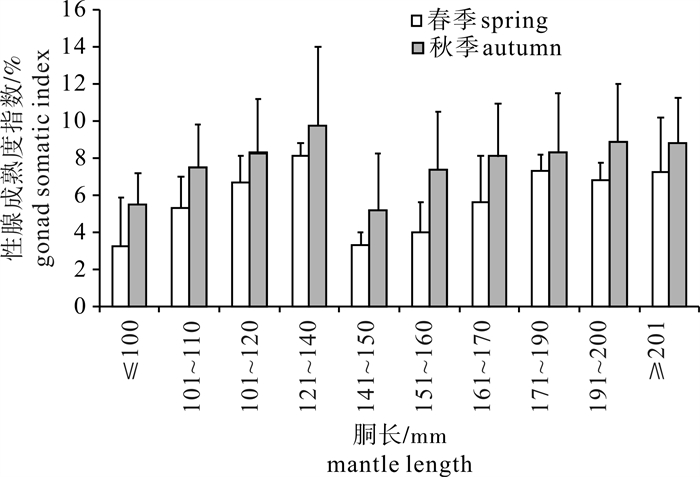
成熟的雌性鸢乌贼性腺成熟度指数随胴长变化呈现一定的规律,其中春、秋季变化趋势基本一致(图 4)。性腺成熟度指数在胴长为141~150 mm处出现一个转折点,当胴长小于141 mm时性腺成熟度指数随胴长增长呈上升趋势,当胴长大于150 mm时性腺成熟度指数同样随着胴长的增长有缓慢升高的趋势;胴长为121~140 mm处性腺成熟度指数最高,高达9.71;各胴长组性腺成熟度指数均为秋季高于春季。
2.3 鸢乌贼个体繁殖力
鸢乌贼个体潜在繁殖力春、秋季波动范围分别为756~146 017粒和1 441~130 113粒,均值分别为20 585粒和32 956粒。个体绝对繁殖力春季变动范围为63~97 074粒,平均为8 635粒;秋季变动范围为24~60 378粒,均值为10 234粒。总体来说,秋季鸢乌贼绝对繁殖力较春季高。
春、秋季鸢乌贼相对繁殖力Faml分别为47粒·mm-1与58粒· mm-1,波动范围分别为1~393粒·mm-1与1~311粒· mm-1;相对繁殖力Faw分别为48粒· g-1与54粒· g-1,波动范围为2~201粒· g-1与1~223粒· g-1。
2.3.1 个体绝对繁殖力随胴长的变化
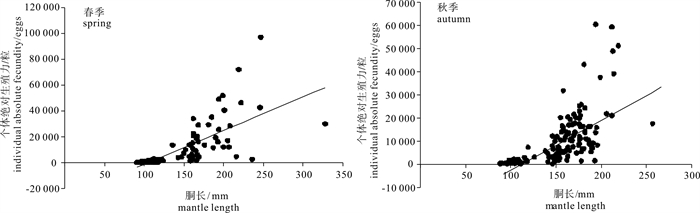
春、秋季鸢乌贼个体绝对繁殖力Fa(粒)随胴长ML(mm)的变化见图 5,通过线性回归得到个体绝对繁殖力与胴长的关系式春季为Fa=261.27ML-27 434(R=0.730,n=120,P < 0.01);秋季为Fa=222.9ML-24 029(R=0.655,n=139,P < 0.01)。两季个体绝对繁殖力与胴长均呈显著正相关关系,即个体绝对繁殖力随胴长的增长而增强。
2.3.2 个体绝对繁殖力随体质量的变化
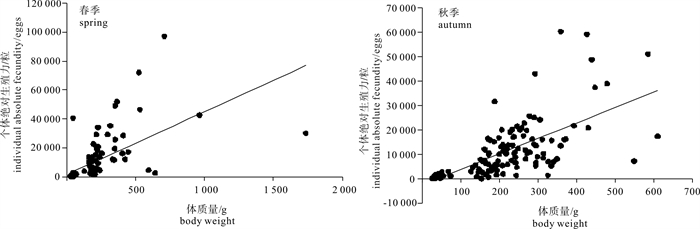
春、秋季鸢乌贼个体绝对繁殖力随体质量变化关系见图 6。通过线性回归得到个体绝对繁殖力Fa(粒)与体质量BW(g)的关系式春季为Fa=43.379BW+1 708.3(R=0.620,n=120,P < 0.01);秋季为Fa=63.531BW-2 549.3(R=0.684,n=139,P < 0.01)。两季个体绝对繁殖力与体质量均呈显著正相关关系,即个体绝对繁殖力随体质量的增加而增强。
2.3.3 个体绝对繁殖力随纯体质量的变化
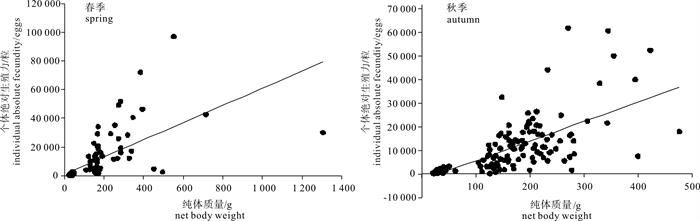
春、秋季鸢乌贼个体绝对繁殖力随纯体质量变化关系见图 7。通过线性回归得到个体绝对繁殖力Fa(粒)与纯体质量W(g)的关系式春季为Fa=59.882W+1 115.2(R=0.650,n=120,P < 0.01);秋季为Fa=81.108W-2 734(R=0.675,n=139,P < 0.01)。两季个体绝对繁殖力与纯体质量均呈显著正相关关系,即个体绝对繁殖力随纯体质量的增加而增强。
2.4 鸢乌贼成熟卵径分布情况
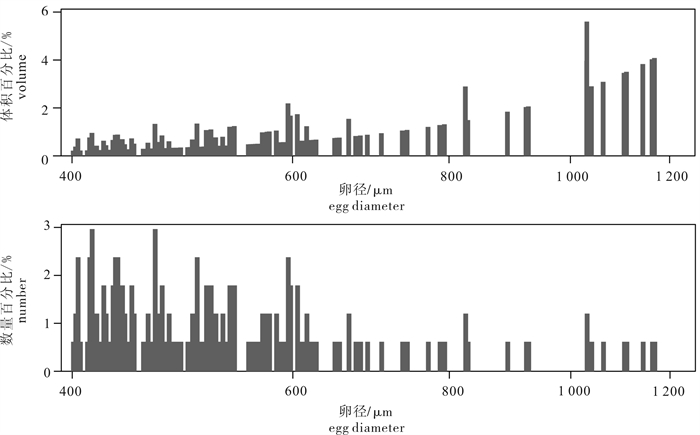
通过分析鸢乌贼成熟卵径得出其粒径为400~1 200 μm,均值为(769±261)μm;其中90%的成熟卵粒卵径小于800 μm(图 8)。
3. 讨论
2个航次采集的鸢乌贼样本雌雄比例均接近1 : 1,表明南海中南部海域鸢乌贼雌雄个体分布较均衡。叶旭昌和陈新军[18]、CHEN等[19]和陆化杰等[20]对印度洋西北海域和赤道公海的研究发现鸢乌贼雌性个体比例远远高于雄性个体,与该次调查结果存在较大的差异,其原因可能是采样方法和调查海域不同,上述学者采用的是鱿鱼钓具,其具有较强的选择性,这应当是与该次调查结果存在较大差异的原因之一。该次调查结果也表明灯光罩网作业方式能够较全面地反映南海鸢乌贼的群体分布状态。颜云榕等[3]对夏季南沙群岛鸢乌贼的研究也发现,灯光罩网渔获的鸢乌贼雌雄比为1.4,同样认为灯光罩网选择性差,可较真实地反映鸢乌贼渔业资源生物学特性。
调查发现,南海鸢乌贼雌雄个体性腺发育均存在个体差异和季节差异,可能是因为南海鸢乌贼为异步成熟、连续产卵群体。张宇美等[11]对西沙群岛海域鸢乌贼的研究也发现各个季节都有性成熟个体;HARMAN等[21]发现鸢乌贼持续产卵。叶旭昌等[18]秋季(9月~11月)对印度洋西北海域鸢乌贼的研究发现雌雄性腺成熟度以Ⅰ和Ⅳ期为主,其结果与该次调查有所差异,可能与调查海域不同有关。
通过对Ⅳ~Ⅴ期雌性样本性腺成熟度指数随胴长变化的研究发现,当胴长小于141 mm时性腺成熟度指数随胴长增长呈上升趋势;当胴长大于150 mm时性腺成熟度指数同样随着胴长的增长有缓慢升高的趋势,出现这种变化规律可能是因为采集的样本中存在2个产卵群体。颜云榕等[3]夏季对南沙群岛北部海域鸢乌贼的分析结果也认为该海域存在2个不同胴长组的产卵群体;张鹏等[22]春季对南沙海域鸢乌贼种群结构的分析认为南沙海域存在中型和微型2个种群。因此,出现这种现象的原因应当是南海存在中型群和微型群2个种群。鸢乌贼秋季成熟度指数高于春季,可能与雌性性成熟高峰期为冬季有关[11]。该调查鸢乌贼个体潜在繁殖力春、秋季分别为756~146 017粒和1 441~130 113粒;个体绝对繁殖力分别为63~97 074粒和24~60 378粒;HARMAN等[21]对夏威夷鸢乌贼的研究发现胴长大于290 mm的个体其绝对繁殖力变动范围为10 000~250 000粒;LAPTIKHOVSKY等[23]对大西洋海域鸢乌贼相近种S.pteropus的研究发现成熟雌性胴长为155~558 mm,成熟卵粒数为10 000~1 000 000粒,HARMAN等[21]和LAPTIKHOVSKY等[23]结果均高于该次调查结果,可能与该次调查鸢乌贼个体较小(胴长为80~250 mm)有关。该次调查鸢乌贼样本胴长远远小于HARMAN等[21]和LAPTIKHOVSKY等[23]采用的样本。此外,研究发现鸢乌贼绝对繁殖力与胴长呈显著正相关关系(P < 0.01),因此胴长较小也是影响其繁殖能力的因素之一。这在大西洋东北部及邻近海域鱿鱼(Alloteuthis subulata)中得到体现,其(成熟雌性胴长为30~50mm)潜在繁殖力仅为2 200~13 500粒[24],小于该次调查结果。由于鸢乌贼的繁殖策略为多次产卵,一次产卵后将继续生长,然后产生额外卵细胞,成熟后再次产卵,HARMAN等[21]还发现鸢乌贼个体成熟后卵巢持续产卵,成熟的卵储存在输卵管中,而输卵管的丰满度与胴长无关,表明为重复产卵。综上说明鸢乌贼有较强的繁殖能力。
该次调查发现鸢乌贼成熟卵粒的卵径范围为0.4~1.2 mm,而MOHAMED等[2]的研究得到的鸢乌贼卵径范围为0.7~0.9 mm;此次得到的卵径范围较MOHAMED等[2]的大,可能与测量方法不同有关。该研究采用的是颗粒计数分析仪进行测量,该仪器有可能把连在一起的2个细胞或同时进入小孔管的细胞当成一个细胞进行分析,从而得出较大的粒径数据。LAPTIKHOVSKY等[23]对鸢乌贼的相近种S.pteropus的成熟卵粒卵径进行了研究得出卵径范围为0.73~0.87 mm,他们认为其卵径小[23]。鸢乌贼的平均卵径为0.77 mm,表明鸢乌贼的卵径也较小。
-
-
[1] 董正之. 中国动物志. 软体动物门, 头足纲[M]. 北京: 科学出版社, 1988: 77-80. [2] MOHAMED K S, JOSEPH M, ALLOYCIOUS P S. Population charateristics and some aspects of the biology of oceanic squid Sthenoteuthis oualaniensis (Lesson, 1830) [J]. J Mar Biol Ass India, 2006, 48(2): 256-259.
[3] 张鹏, 杨吝, 张旭丰, 等. 南海金枪鱼和鸢乌贼资源开发现状及前景[J]. 南方水产, 2010, 6(1): 68-74. doi: 10.3969/j.issn.1673-2227.2010.01.012 [4] 颜云榕, 冯波, 卢伙胜, 等. 南沙群岛北部海域鸢乌贼(Sthenoteuthis oualaniensis)夏季渔业生物学研究[J]. 海洋与湖沼, 2012, 43(6): 1177-1186. [5] 江艳娥, 陈作志, 林昭进, 等. 南海中部海域鸢乌贼耳石形态特征分析[J]. 南方水产科学, 2014, 10(4): 85-90. doi: 10.3969/j.issn.2095-0780.2014.04.014 [6] 刘必林, 陈新军, 钟俊生. 印度洋西北海域鸢乌贼耳石的形态特征分析[J]. 上海水产大学学报, 2008, 17(5): 604-609. [7] 张俊, 陈作志, 陈国宝, 等. 南海鸢乌贼水声学测量和评估相关技术研究[J]. 南方水产科学, 2014, 10(6): 1-11. doi: 10.3969/j.issn.2095-0780.2014.06.001 [8] 杨权, 李永振, 张鹏, 等. 基于灯光罩网法的南海鸢乌贼声学评估技术研究[J]. 水产学报, 2013, 37(7): 1032-1039. [9] LIN L, LI C H, CHEN Z Z, et al. Development and characterization of twenty-three microsatellite markers for the purpleback flying squid (Symplectoteuthis oualaniensis)[J]. Conserv Genet Resour, 2015, 7: 161-163. doi: 10.1007/s12686-014-0318-1
[10] 于刚, 张洪杰, 杨少玲, 等. 南海鸢乌贼营养成分分析与评价[J]. 食品工业科技, 2014, 35(18): 358-361, 372. [11] 王进勉, 薛长湖, 刘鑫, 等. 印度洋鸢乌贼加工特性的初步研究[J]. 食品工业科技, 2007, 28(6): 128-130. [12] 张宇美, 颜云榕, 卢伙胜, 等. 西沙群岛海域鸢乌贼摄食与繁殖生物学初步研究[J]. 广东海洋大学学报, 2013, 33(3): 56-64. doi: 10.3969/j.issn.1673-9159.2013.03.010 [13] LASKER R. An egg production method for estimating spawning biomass of pelagic fish: application to the northern anchovy, Engraulis mordax [R]. NOAA Techn Rep NMFS, 1985: 36.
[14] 国家技术监督局. 海洋生物调查[M]. 北京: 中国标准出版社, 2007: 60-61. [15] 陈新军. 世界头足类[M]. 北京: 海洋出版社, 2009: 68. [16] 李星颉, 戴健寿, 唐志跃. 曼氏无针乌贼Sepiella maindroni de Rochebrune怀卵量及生殖力[J]. 浙江水产学院学报, 1985, 4(1): 1-5, 7. [17] HTU-HAN M. The reproductive biology of the dab Limanda limanda (L. ) in the North Sea: gonosomatic index, hepatosomatic index and condition factor [J]. J Fish Biol, 1978, 13(3): 369-378. doi: 10.1111/j.1095-8649.1978.tb03445.x
[18] 叶旭昌, 陈新军. 印度洋西北海域鸢乌贼生物学特征初步研究[J]. 上海水产大学学报, 2004, 13(4): 316-322. [19] CHEN X J, LIU B L, TIANS Q, et al. Fishery biology of purpleback squid, Sthenoteuthis oualaniensis, in the northwest Indian Ocean[J]. Fish Res, 2007, 83(1): 98-104. doi: 10.1016/j.fishres.2006.09.005
[20] 陆化杰, 王从军, 陈新军. 4-6月东太平洋赤道公海鸢乌贼生物学特性初步研究[J]. 上海海洋大学学报, 2014, 23(3): 441-447. [21] HARMAN R F, YOUNG R E, REID S B, et al. Evidence for multiple spawning in the tropical oceanic squid Stenoteuthis oualaniensis (Teuthoidea: Ommastrephidea) [J]. Mar Biol, 1989, 101: 513-519. doi: 10.1007/BF00541653
[22] 张鹏, 晏磊, 杨炳忠, 等. 春季南沙海域鸢乌贼种群结构特征的研究[J]. 南方水产科学, 2015, 11(5): 11-19. doi: 10.3969/j.issn.2095-0780.2015.05.002 [23] LAPTIKHOVSKY V V, NIGMATULLIN C M. Aspects of female reproductive biology of the orange-back squid, Sthenoteuthis pteropus (Steenstup) (Oegopsina: Ommastrephidae) in the eastern tropical Atlantic [J]. Scientia Marina, 2005, 69(3): 383-390. doi: 10.3989/scimar.2005.69n3383
[24] HASTIE L C, NYEGAARD M, COLLINS M A, et al. Reproductive biology of the loliginid squid, Alloteuthis subulata, in the north-east Atlantic and adjacent waters [J]. Aquat Living Resour, 2009, 22: 35-44. doi: 10.1051/alr/2009002
-
期刊类型引用(14)
1. 唐峰华,巴尧骥,肖戈,石永闯,赵国庆,郭爱,张衡,崔雪森,陈峰. 西北印度洋公海鸢乌贼的繁殖生物学及其与环境要素的关系. 上海海洋大学学报. 2025(02): 350-364 .  百度学术
百度学术
2. 赵艺翔,朱凯,王孟佳,王嘉浩,陈峰,朱文斌. 西北印度洋雌性鸢乌贼繁殖生物学特性研究. 海洋渔业. 2025(02): 273-282 .  百度学术
百度学术
3. 温利红,张衡,方舟,陈新军. 鸢乌贼渔业资源研究进展. 水产科学. 2023(03): 527-537 .  百度学术
百度学术
4. 郭有俊,张丽姿,刘毅,曾笑薇,招春旭,李渊,颜云榕. 基于内壳生长纹的秋季东印度洋鸢乌贼生长特性. 水产学报. 2022(11): 2076-2083 .  百度学术
百度学术
5. 颜云榕,邱星宇,张丽姿,钟亚娜,周倍合,招春旭,李忠炉. 南沙海域鸢乌贼繁殖生物学特性. 广东海洋大学学报. 2021(03): 20-27 .  百度学术
百度学术
6. 陆化杰,宁欣,刘维,张羽翔,陈子越,陈新军. 不同气候条件下南海西沙海域鸢乌贼(Sthenoteuthis oualaniensis)渔业生物学比较研究. 海洋与湖沼. 2021(04): 1029-1038 .  百度学术
百度学术
7. 朱凯,张立川,肖楚源,陈新军,林东明,朱俊磊. 南海鸢乌贼微型群雌性个体繁殖力研究. 渔业科学进展. 2020(06): 140-148 .  百度学术
百度学术
8. 郭有俊,吴文秀,凌炜琪,招春旭,冯波,颜云榕. 海南东南部海域春季鸢乌贼CPUE与海洋环境关系. 广东海洋大学学报. 2020(06): 63-70 .  百度学术
百度学术
9. 黄佳兴,龚玉艳,徐姗楠,陈作志,张俊,于文明. 南海中西部海域鸢乌贼中型群和微型群的营养生态位. 应用生态学报. 2019(08): 2822-2828 .  百度学术
百度学术
10. 江淼,马胜伟,吴洽儿. 鸢乌贼资源综合利用技术研究现状. 食品工业科技. 2018(06): 340-344 .  百度学术
百度学术
11. 江淼,马胜伟,吴洽儿. 南海鸢乌贼资源探捕与开发. 中国渔业经济. 2018(02): 65-70 .  百度学术
百度学术
12. 粟丽,陈作志,张鹏,李杰,王欢欢,黄佳兴. 2017年南海中南部渔场灯光罩网渔获物组成及渔获率时空分布. 南方水产科学. 2018(05): 11-20 .  本站查看
本站查看
13. 冯菲. 大数据技术在南海鸢乌贼资源调查上的研究进展. 安徽农业科学. 2018(33): 12-13+18 .  百度学术
百度学术
14. 黄卉,杨丽芝,杨贤庆,李来好,郝淑贤,魏涯,王锦旭. 南海鸢乌贼墨汁多糖分离纯化及组分分析. 食品科学. 2017(24): 118-123 .  百度学术
百度学术
其他类型引用(18)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
