Toxic effect of heavy metal ions of Cu2+, Cd2+ and Hg2+ on embryo development of zebrafish (Danio rerio)
-
摘要:
在半静态水的条件下,研究了铜离子(Cu2+)、镉离子(Cd2+)和汞离子(Hg2+)对斑马鱼(Danio rerio)胚胎发育的单一和联合毒性效应。采用48 h、72 h、96 h致死率和72 h、96 h孵化抑制率作为生理毒性终点,以其半数致死浓度(LC50)值作为毒性评价标准。结果表明:Cu2+、Cd2+和Hg2+对斑马鱼胚胎的48 h-LC50分别为0.58 mg ·L-1、0.72 mg·L-1和0.000 46 mg·L-1, 72 h-LC50分别为0.39 mg·L-1、1.15 mg·L-1和0.000 30 mg·L-1,96 h-LC50分别为0.08 mg·L-1、0.19 mg·L-1和0.000 18 mg·L-1;Cu2+、Cd2+和Hg2+的72 h孵化抑制率的LC50分别为0.05 mg·L-1、0.01 mg·L-1和0.000 04 mg·L-1,96 h孵化抑制率的LC50分别为0.06 mg·L-1、0.05 mg·L-1和0.000 11 mg·L-1;Cu2+、Cd2+和Hg2+对斑马鱼胚胎毒性大小顺序为Hg2+>Cu2+>Cd2+。Cu2+、Cd2+和Hg2+对斑马鱼胚胎的致死率和孵化抑制率均具有明显的剂量-效应关系,72 h孵化抑制率可以作为斑马鱼胚胎最敏感的毒性终点指标。分别用单一毒性Cu2+、Cd2+和Hg2+的96 h-LC50值,按毒性单位1 : 1两两混合,对斑马鱼胚胎在第48、第72、第96小时的联合毒性均为协同作用;按毒性单位1 : 1 : 1混合共存时,对斑马鱼胚胎在第48、第72、第96小时的联合毒性均为拮抗作用。
Abstract:Under semi-static water conditions, we studied the effects of single and joint toxicity of copper ion (Cu2+), cadmium ion (Cd2+) and mercury ion (Hg2+) on zebrafish embryonic development. The mortality rates at 48th hour, 72nd hour and 96th hour as well as hatching inhibition rates at 72nd hour, 96th hour were used as end point of physiological toxicity, and the half lethal concentration (LC50) was used as standard of toxicity evaluation. The results show that the LC50s of Cu2+, Cd2+ and Hg2+on zebrafish embryos at 48th hour were 0.58 mg·L-1, 0.72 mg·L-1 and 0.000 46 mg·L-1; 72 h-LC50s were 0.39 mg·L-1, 1.15 mg·L-1and 0.000 30 mg·L-1; 96 h-LC50s were 0.08 mg·L-1, 0.19 mg·L-1 and 0.000 18 mg·L-1. The LC50s of hatching inhibition rates of Cu2+, Cd2+ and Hg2+ at 72nd hour were 0.05 mg·L-1, 0.01 mg·L-1 and 0.000 04 mg·L-1, and were 0.06 mg·L-1, 0.05 mg·L-1 and 0.000 11 mg·L-1 at 96th hour, respectively. The toxicity of those heavy metal ions on zebrafish embryos was Hg2+ >Cu2+ >Cd2+.The toxicity of Cu2+, Cd2+and Hg2+on zebrafish embryos hatch inhibition rate or mortality had significant dose-response relationship, so hatching inhibition rate at 72nd hour can be used as the most sensitive indicator for toxicity of zebrafish embryos. With a single toxic Cu2+, Cd2+ and Hg2+ of 96 h-LC50 value, mixed unit 1 : 1 between two components at 48th hour, 72nd hour and 96th hour, the combined toxicity showed synergies on zebrafish embryos; but mixed toxicity unit 1 : 1 : 1 coexistence of Cu2+, Cd2+ and Hg2+on zebrafish embryos at 48th hour, 72nd hour and 96th hour showed toxicity antagonism.
-
Keywords:
- zebrafish /
- embryo development /
- heavy metal /
- toxic effect
-
热激蛋白(HSPs)是一类广泛存在的分子伴侣,主要分为组成型热激蛋白(heat shock cognate protein,HSC)和诱导型热激蛋白(inducible heat shock protein,HSP),帮助蛋白质和受损蛋白质重新折叠、装配以及错误折叠蛋白和不稳定蛋白降解[1-2]。热激蛋白基因的表达水平与生长紧密相关。肌肉增长会引起分子伴侣基因如热激蛋白的表达量增加[3]。饥饿后再复喂食的斑马鱼(Danio rerio)快肌中多种热激蛋白基因(HSP90、HSDP1和HSPA5等)的转录水平显著上调[4]。生长快的大口黑鲈(Micropterus salmoides)中,热激蛋白基因(如HSP90 alpha、HSP70、HSP47、HSP30和HSPB1)的转录表达水平相比生长慢的大口黑鲈显著升高[5]。热激蛋白基因多态性与动物生长性状显著相关。Rocha和Junior[6]分析亚马孙河虾(Macrobrachium amazonicum) HSC70基因的单核苷酸多态性(SNP),发现C256T和T907C位点组成的H10双倍型与体质量显著相关。Chen等[7]分析杜洛克猪(Sus scrofa) HSP70.2基因启动子区域多态性,筛选到1个与背膘厚度显著相关的SNP位点。猪HSP70.2基因5′侧翼区存在5个SNP位点,其中2个位点与体质量和肉质性状显著相关[8-9]。目前有关大口黑鲈热激蛋白基因多态性与生长性状的相关研究尚未见报道。
大口黑鲈是一种从北美洲引进的广温性鱼类,在分类学上隶属鲈形目、太阳鱼科。因其肉质鲜美且不含肌间剌,适合高密度养殖和活鱼长途运输,深受消费者和养殖者欢迎。大口黑鲈在我国众多省份都有规模化养殖,年产量超35×104 t[10],成为我国重要的淡水养殖经济品种之一。大口黑鲈属于肉食性鱼类,苗种培育阶段的相互残杀会影响基于表型性状的传统选育的准确性。分子标记辅助育种技术不受环境影响且结果可靠,在选育早期可进行选择,大幅提高选育效率[11]。候选功能基因多态性与表型性状相关的关联分析是实现分子标记辅助育种的有效方法[12]。鉴于HSC70基因是影响生长的候选功能基因,本研究采用PCR技术获得大口黑鲈HSC70-1基因的cDNA序列和基因全序列,从中发掘与大口黑鲈生长性状相关的SNP标记,以期应用于大口黑鲈分子标记辅助育种研究,加快良种选育进程。
1. 材料与方法
1.1 实验鱼和试剂
用于筛选SNP和关联分析的大口黑鲈成鱼为约5 000 组大口黑鲈“优鲈1 号”亲本同批次繁殖的子代,来自佛山市九江镇新旭养殖场。本实验鱼群体在相同养殖条件下培育,然后在同一个池塘中进行养殖,全程投喂冰冻野杂鱼,11月龄时从群体中随机取430尾并测量体质量、全长、体高、头长和尾柄长等性状值,同时以抗凝剂与血液体积比为6∶1的比例进行尾静脉活体取血,按天根生化科技(北京)有限公司试剂盒说明书提取血液DNA,并使用琼脂糖凝胶电泳和紫外分光光度计(Eppendorf,德国)检测DNA质量,于 − 20 ℃保存备用。用剪刀和镊子从采自中国水产科学研究院珠江水产研究所广州良种基地的1尾大口黑鲈背部取肌肉组织约30 mg,按照Trizol试剂盒(TaKaRa公司,大连)提供的方法提取总RNA,并用1%琼脂糖电泳检测其质量。
1.2 HSC 70-1基因cDNA序列和基因全序列扩增
根据从大口黑鲈转录组数据库(SRA436296)中获取的HSC70-1基因序列设计引物扩增cDNA序列,引物序列为Hsc70-1F: 5'-AAACCACATATTCTGAATTTAACGG-3'和Hsc70-1R: 5'-AAACCACATATTCTGAATTTAACGG-3'。大口黑鲈肌肉总RNA的反转录反应参照RNA PCR Kit (AMV) Ver.3.0试剂盒(TaKaRa公司,大连)说明书进行,以反转录产物为模板进行PCR扩增,反应程序为94 ℃变性3 min;94 ℃变性30 s,54 ℃复性30 s,72 ℃延伸1 min,35个循环;72 ℃延伸7 min。
根据已获得的大口黑鲈HSC70-1 cDNA序列和NCBI数据库中登录的鳜(Siniperca chuatsi) HSC70-1基因全序列(KF500540.1)设计5对引物(表1),委托广州艾基生物技术有限公司合成。以1尾大口黑鲈基因组DNA为模板,采用PCR技术分别扩增HSC70-1基因的各个片段。PCR扩增反应总体积为50 μL,PCR反应体系包括25 μL 2×Taq PCR master mix (TaKaRa公司,大连),上下游引物各1 μL,模板DNA 1 μL,加ddH2O至50 μL。PCR扩增程序除退火温度改为56~60 ℃和循环数为32之外,其余同上。采用琼脂糖凝胶电泳检测扩增产物,并委托广州艾基生物公司完成序列测定,用Vector NTI Suite 11.0软件进行序列分析和比对。
表 1 大口黑鲈HSC70-1基因全序列扩增所用的引物名称及序列Table 1. Primer sequences applied in amplification of largemouth bass HSC70-1 gene上游引物
forward primer引物序列 5'−3'
primer sequence下游引物
reverse primer引物序列 5'−3'
primer sequence产物长度/bp
product lengthF139 AGTGAGAGGCTGATCGGAGATG R783 TAGGCTTCAGCAATCTCCTTCATC 645 F672 ATAACACCCGCCCCAAGGTTCAAG R1294 CCATGCGGTTGTCGAAATCCTCAC 623 F1226 GCATCTTTGAGGTCAAGTCCACTG R2022 GTAGGTGGTGAAGGTCTGCGTCTG 797 F1923 TCTCTCCCTGGGAATTGAGACCGC R2684 CCAGCCAGCCAATAACCTCGTTGC 762 F2589 AGTCGACCGTGGAGGATGAAAAGC R3382 CCTCCTCAATGGTTGGTCCAGAGG 793 1.3 突变位点筛选
从关联分析群体中随机取20个样品基因组DNA,利用上述5对引物扩增HSC70-1基因,PCR产物经纯化后委托广州艾基生物公司进行测序,用Vector NTI Suite 11.0软件比对分析序列并查找SNP位点。
1.4 SNaPshot方法检测基因型
用SNaPshot分型方法检测SNP位点的基因型,首先根据SNP位点附近序列设计扩增引物(表2),然后对430个样品DNA进行多重PCR扩增,从中取3 μL PCR产物用Exo I和FastAP分别去除反应产物中的剩余引物和dNTP,37 ℃下反应15 min,80 ℃高温灭活Exo I和FastAP 15 min。用延伸引物进行延伸反应,最后在ABI公司的PRISM 3730测序仪上完成基因型分析,具体委托上海捷瑞生物工程有限公司完成。
表 2 SNP位点分型所用引物名称及序列Table 2. Primer sequences applied in each SNP genotyping位点
SNP locus上游引物
forward primer下游引物
reverse primer延伸引物
extension primerC-821G TGAAGCCTACCTCGGAAAAGT AGCATCCTTAGTGGCCTGGCGC TTACTTAGCATAGCTCTGGACA A1105 TCTCTGGCCTCAATGTCCTG GGTTGTCGAAATCCTCACCG TTTTTTTTTTCATCTTGAATTGAGGTAATAAA C-1200T TCATCTTTGATCTTGGTGGTGG ACGGACAGCTCTCTTGTTGT TTTTTTTTTTTTTTTTTTTTCCTCGATGGTCAAGATGGAAAC A-2804T TCCACCAGCTTATCAGACTGT GGTCAACCCTCCAAGTAACTT CTGTAGGGGGTAACTGAAGGGT 1.5 数据统计分析
利用POPGENE V1.32软件分析观测杂合度(Ho)、有效等位基因数(Ne)和期望杂合度(He)等遗传参数,并估计各位点是否在群体中符合Hardy-Weinberg平衡定律。数据分析软件采用SPSS 19.0,各基因型与大口黑鲈生长性状之间的相关性分析中所用的一般线性分析模型为Yij=μ+Bi+eij,Yij为某个性状第i个标记第j个个体上的观测值;μ为实验观测所有个体的表型平均值;Bi为第i个标记的效应值;eij为对应于观察值的随机误差效应[13]。
2. 结果
2.1 大口黑鲈HSC 70-1基因序列分析
大口黑鲈肌肉总RNA经反转录后,对引物Hsc70-1F和Hsc70-1R扩增获得的片段进行测序,序列长度为1 961 bp。分析结果表明,HSC70-1基因cDNA序列全长为1 953 bp,共编码650个氨基酸,其蛋白等电点为5.2,分子量为71 kD。该基因包含非细胞器特征的蛋白基序RARFEEL和位于C-端的细胞质定位特征基序EEVD,以及推测的双分型核定位信号KRKYKKDISDNKRAVRRLRTACERAKRT (图1)。
![]() 图 1 大口黑鲈HSC70-1 cDNA序列及其推测的氨基酸序列碱基序列在上,氨基酸序列在下;非细胞器基序RARFEEL用方框表示;C末端的EEVD基序用单下划线标出;2个GGMP基序用双下划线标出;双分型核定位信号用波浪线表示Figure 1. Nucleotide and deduced amino acid sequences of largemouth bass HSC70-1 cDNAThe nucleotide sequence is in upper row and the amino acid in lower row. The non-organelle eukaryotic consensus motif is boxed. The C-terminal EEVD motif is indicated by “__”. Two consecutive repeats of the tetrapeptide motif GGMP are double-underlined. The NLS is indicated by “~~”.
图 1 大口黑鲈HSC70-1 cDNA序列及其推测的氨基酸序列碱基序列在上,氨基酸序列在下;非细胞器基序RARFEEL用方框表示;C末端的EEVD基序用单下划线标出;2个GGMP基序用双下划线标出;双分型核定位信号用波浪线表示Figure 1. Nucleotide and deduced amino acid sequences of largemouth bass HSC70-1 cDNAThe nucleotide sequence is in upper row and the amino acid in lower row. The non-organelle eukaryotic consensus motif is boxed. The C-terminal EEVD motif is indicated by “__”. Two consecutive repeats of the tetrapeptide motif GGMP are double-underlined. The NLS is indicated by “~~”.将测得的大口黑鲈HSC70-1基因全序列进行拼接,然后与其cDNA序列进行比对,结果表明,大口黑鲈HSC70-1基因序列全长为3 390 bp,由8个外显子和7个内含子构成,8个编码外显子的长度分别为205 bp、206 bp、153 bp、556 bp、203 bp、199 bp、233 bp和198 bp,编码区内7个内含子的长度分别为382 bp、85 bp、115 bp、147 bp、125 bp、86 bp和497 bp。
2.2 序列同源性比较
大口黑鲈HSC70-1基因序列与GenBank中已登录的鱼类HSC70-1基因进行比较,与鳜(AGS83421.1)、尖吻鲈(Lates calcarifer,XP_018546814.1)、尼罗罗非鱼(Oreochromis niloticus,XP_003448938.1)和真鲷(Pagrus major,AKS36893.1)的氨基酸同源性为99%;与鳙(Hypophthalmichthys nobilis,ADK27718.1)、大黄鱼(Larimichthys crocea,XM_019279481.1)和翘嘴红鲌(Erythroculter ilishaeformis,EU693910.1)的氨基酸同源性为97%;与斑马鱼(L77146.2)、半滑舌鳎(Cynoglossus semilaevis,XM_008332615.2)和大西洋鲑(Salmo salar,XM_014162783.1)的氨基酸同源性依次为96%、96%和93%,表明鱼类HSC70-1基因的保守性很高。
2.3 突变位点筛查结果
5对引物在20个个体中的PCR扩增产物经测序和比对后,共获得4个SNP位点,分别位于HSC70-1基因核苷酸序列中的第821、第1 105、第1 200和第2 804碱基处,均处于内含子中。
2.4 HSC70-1基因突变位点在群体中的遗传结构分析
大口黑鲈“优鲈1号”群体在4个SNP位点上的多样性比较丰富,平均Ne、平均Ho和平均He分别为1.67、0.688和0.602 (表3)。C-821G和A-2804T位点在群体中符合Hardy-Weinberg定律,其余2个位点均偏离Hardy-Weinberg定律(表3)。
表 3 HSC70-1基因上4个SNP位点的遗传参数Table 3. Genetic parameters of 4 SNPs in HSC70-1 geneSNP位点
SNP locus碱基类型
nucleotide type有效等位基因数
Ne期望杂合度
He观测杂合度
Ho哈温平衡 (P)
HWEC-821G G/C 1.55 0.645 0.684 0.063 8 A1105 A/− 1.91 0.524 0.951 0.000 0* C-1200T C/T 1.69 0.592 0.430 0.019 3* A-2804T T/A 1.54 0.648 0.688 0.416 3 平均值 average 1.67 0.602 0.688 注:*. 偏离Hardy-Weinberg定律(P<0.05) Note: *. deviation from Hardy-Weinberg equilibrium (P<0.05) 2.5 SNPs与性状的关联分析
对用于关联分析的实验鱼群体的体质量进行正态分布检验,结果呈正态分布。各标记与不同生长性状的相关分析结果表明,C-821G位点的CC基因型个体的平均表型值均高于CG型和GG型,CC基因型与CG和GG基因型个体在体质量和全长上均存在显著差异(P<0.05)。A-2804T位点的TT基因型个体分别与AT和AA基因型个体在体质量和全长上存在显著差异(P<0.05)。其他位点不同基因型个体间的生长性状均不存在显著差异(P>0.05,表4)。
表 4 HSC70-1基因中各SNP位点与生长性状的关联分析 (平均值±标准差)Table 4. Correlation analysis between different SNP loci of HSC70-1 gene and various growth traits ($ {\overline {\mathit{\boldsymbol{X}}}} \pm {\bf SD}$ )SNP位点
SNP site基因型
genotype样本数
number of sample体质量/g
body mass全长/cm
total length头长/cm
head length体高/cm
body depth尾柄长/cm
caudal peduncle lengthC-821G CC 31 573.26±22.87a 30.26±0.45a 7.57±0.28 8.75±0.18 8.57±0.17 CG 136 512.49±10.92b 29.22±0.21b 7.36±0.13 8.48±0.09 8.33±0.08 GG 263 523.32±7.85b 29.32±0.15b 7.46±0.10 8.48±0.06 8.28±0.06 A1105 −− 157 524.01±10.23 29.44±0.2 7.41±0.13 8.54±0.08 8.38±0.07 A− 21 540.70±27.96 29.69±0.55 7.47±0.34 8.66±0.22 8.34±0.20 AA 252 521.75±8.07 29.28±0.16 7.45±0.10 8.46±0.06 8.28±0.06 C-1200T CC 185 521.324±9.41 29.24±0.18 7.55±0.12 8.49±0.07 8.30±0.07 CT 245 525.14±8.18 29.45±0.16 7.35±0.10 8.51±0.06 8.34±0.06 A-2804T AA 265 523.05±7.82b 29.34±0.15b 7.45±0.10 8.49±0.06 8.28±0.06 AT 134 512.86±11.00b 29.20±0.22b 7.37±0.14 8.46±0.09 8.33±0.08 TT 31 573.26±22.88a 30.26±0.45a 7.57±0.28 8.75±0.18 8.57±0.17 注:同列中上标字母不同表示差异显著(P<0.05),表5同此 Note: Different superscripts within the same column denote significant difference (P<0.05). The same case in Tab.5. 将4个SNPs位点不同基因型合并成双倍型进行分析(表5),共组合成15种双倍型,去掉频率小于2.5%的10种,将其余5种进行关联性分析发现,双倍型D1的各个生长性状表现最优,其全长和体高显著高于D5,在实际的育种应用中,应选择此双倍型个体,以加快育种进程。
表 5 HSC70-1基因双倍型与大口黑鲈生长性状的关联性分析 (平均值±标准差)Table 5. Diplotype of HSC70-1 gene associated with growth traits in largemouth bass (${\overline {\mathit{\boldsymbol{X}}}} \pm {\bf SD}$ )双倍型
diplotype基因型 (样本数)
genotype (n)体质量/g
body mass全长/cm
total length体高/cm
body depthD1 CC−−CCTT (28) 552.01±103.53 30.14±2.33a 8.7±0.91a D2 GGAACTAA (225) 524.99±139.51 29.47±2.42 8.51±1.05 D3 GGA−CTAA (11) 522.11±84.45 29.53±1.33 8.51±0.73 D4 CG−−CCAT (117) 516.74±102.55 29.29±1.98 8.51±0.89 D5 GGAACCAA (16) 484.46±102.8 27.28±5.27b 8.08±0.86b 3. 讨论
序列对比分析后发现大口黑鲈HSC70-1基因的氨基酸序列中含有HSP70家族基因特有的细胞质定位特征基序(EEVD)和双分型核定位信号标签(KRKYKKDISDNKRAVRRLRTACERAKRT),表明本研究获得的确实是HSP70家族成员基因的cDNA序列[14-15]。将大口黑鲈HSC70-1基因氨基酸序列与GenBank中已登录的其他鱼类HSC70-1基因序列进行比较,相互间的序列同源性为93%~99%,较高的同源性反映了HSC70家族在进化过程中的结构和功能都很保守[16-17]。在HSC70-1基因序列中发现了非细胞器应激蛋白元件(RARFEEL)和细胞质特异性的C末端EEVD和GGMP调控元件,表明该基因位于细胞液和细胞质中[18-19]。此外,编码区中含有内含子被认为是组成型HSC70的典型特征,不同于诱导型HSP70基因[20-21],其缺少内含子;因此在应激条件下不需要进行RNA剪接而直接快速表达和累积。
He可用来评估物种不同群体的遗传多样性高低,杂合度越高表明群体的遗传变异越多,群体遗传多样性越高,对环境适应能力越强[22-23]。大口黑鲈“优鲈1号”群体中HSC70-1基因筛选到的4个SNPs位点的He从0.524到0.648,表明大口黑鲈“优鲈1号”群体的遗传多样性较高,这与李镕等[24]的研究结果相似。C-821G和A-2804T位点处于Hardy-Weinberg平衡状态,而A1105和C-1200T位点显著偏离Hardy-Weinberg定律。引起这2个位点在群体中处于不平衡状态的原因可能与人工选育对亲本的定向选择有关。大口黑鲈“优鲈1号”群体经历了长时间的高强度选育,可能导致位点偏离Hardy-Weinberg平衡状态。
热激蛋白基因的表达水平与生长密切相关。肌肉增长会引起分子伴侣基因如热激蛋白的表达量增加[3]。美洲螯龙虾(Homarus americanus)蜕皮前期和蜕皮过程中HSC70和HSP90基因mRNA表达水平显著上升,参与肌肉萎缩[25]。将斑马鱼饥饿7 d后再喂饱,发现斑马鱼快肌中多种热激蛋白基因的转录表达水平显著上调[4]。在相同养殖条件下,与生长慢大口黑鲈相比,HSP90 alpha、HSP70、HSP47、HSP30和HSPB1基因在生长快速大口黑鲈肌肉组织中的转录表达水平显著升高[5]。本研究分析了大口黑鲈HSC70-1基因多态性与生长性状的关联性,在鱼类HSC70基因中找到2个与生长性状显著关联的SNP位点,这与之前在亚马孙河虾[6]和猪[8-9]热激蛋白基因中均发掘到与生长相关的SNP标记的研究结果一致,表明HSC70-1基因对大口黑鲈生长性状发挥重要作用。
大口黑鲈HSC70-1基因中的2个与生长性状关联的SNP位点均位于内含子中。已有类似研究报道,赵宪林等[26]在藏羊(Ovis aries) MC4R基因第一内含子上筛选到1个与生长性状密切相关的SNP位点;张世勇等[27]发现位于斑点叉尾鮰 (Ictalures punctatus) MSTN基因第二内含子上的1个SNP标记与体质量和体长显著相关;谢淑媚等[28]在缢蛏(Sinonovacula constricta) IGFBP基因第1个内含子中发现1个与体质量和壳长显著相关的SNP位点。内含子中SNPs位点可能与基因组区域中相邻的关键突变位点连锁[29]。此外,内含子中的突变虽不参与蛋白质的合成,但与基因转录调控有关[30-31]。内含子中的突变位点可能会影响到大口黑鲈HSC70-1的翻译、结构和功能,进而影响大口黑鲈的生长速度。
生长性状是数量性状,受主效基因控制,同时也受多个基因和多个位点的相互调控[32-33]。C-821G位点中C等位基因频率为优势等位基因,CC基因型个体的生长性状最佳,A-2804T位点中T等位基因频率为优势等位基因,TT基因型个体的生长性状最佳。4个SNP位点组成的双倍型分析中,CC和TT基因型组合成的双倍型个体(CC−−CCTT)的生长性状最优,进一步支持了单个SNP与生长性状的关联分析结果。在后续的选育研究工作中,可通过人为定向选择基因型为CC−−CCTT的纯合子亲本,培育生长性状优良的纯合子品系,从而提高养殖产量和经济效益。
-
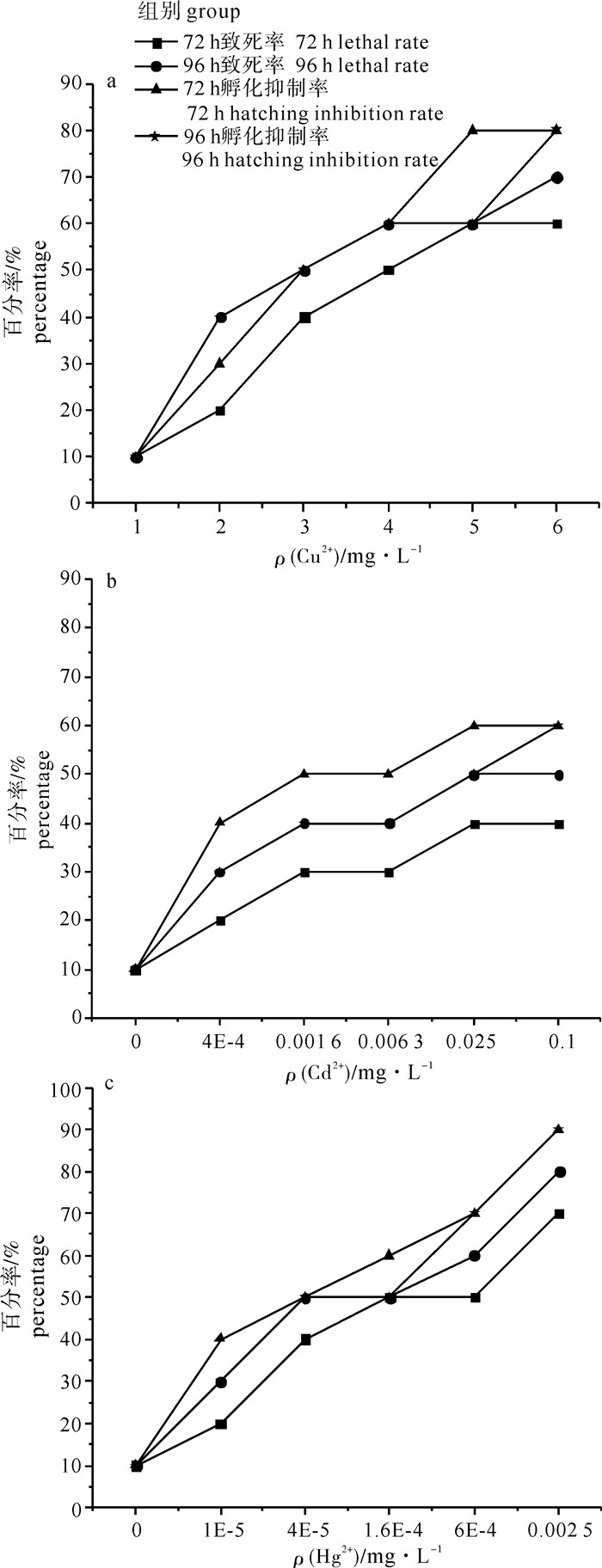
表 1 Cu2+、Cd2+、Hg2+对斑马鱼胚胎的急性毒性
Table 1 Acute toxicity of Cu2+, Cd2+ and Hg2+ on zebrafish embryos
重金属
heavy metal质量浓度/mg·L-1
concentration胚胎死亡率/% lethal rate 心率/bpm
heart rate孵化抑制率/% hatching inhibition rate 48 h 72 h 96 h 72 h 96 h 铜离子
Cu2+0 10 10 10 196 10 10 0.004 6 20 20 40 182 30 40 0.021 0 40 40 50 135 50 50 0.095 0 50 50 60 110 60 60 0.436 5 50 60 60 115 80 60 2.000 0 60 60 70 90 80 80 镉离子
Cd2+0 10 10 10 190 10 10 0.000 4 20 20 30 152 40 30 0.001 6 20 30 40 120 50 40 0.006 3 30 30 40 110 50 40 0.025 0 40 40 50 110 60 50 0.100 0 40 40 50 106 60 60 汞离子
Hg2+0 0 10 10 192 10 10 0.000 01 10 20 30 186 40 30 0.000 04 20 40 50 145 50 50 0.000 16 30 50 50 126 60 50 0.000 60 40 50 60 96 70 70 0.002 50 70 70 80 65 90 90 表 2 Cu2+、Cd2+、Hg2+对斑马鱼胚胎的急性毒性分析
Table 2 Acute toxicity analysis of Cu2+, Cd2+and Hg2+on zebrafish embryos
重金属
heavy metal染毒时间/ h
exposure time直线回归方程
linear regression equation相关系数
R标准误
SE半致死质量浓度/mg·L-1
LC5095%置信区间
95% confidence interval铜离子
Cu2+48 Y=5.107 0+0.456 6X 0.911 0 0.73 0.58 0.05~6.86 72 Y=5.206 0+0.499 0X 0.920 8 0.40 0.39 0.05~2.99 96 Y=5.337 3+0.303 6X 0.970 4 0.11 0.08 0.01~1.14 镉离子
Cd2+48 Y=5.056 1+0.395 4X 0.958 0 2.25 0.72 0.003~327.95 72 Y=4.980 5+0.319 6X 0.931 8 4.47 1.15 0.003~3 700.2 96 Y=5.184 8+0.257 3X 0.940 4 0.64 0.19 0.004~132.32 汞离子
Hg2+48 Y=7.387 0+0.715 0X 0.944 6 0.001 0.000 46 0.000 09~0.002 3 72 Y=7.188 7+0.621 6X 0.924 0 0.003 0.000 30 0.000 06~0.001 5 96 Y=7.101 6+0.559 9X 0.955 7 0.001 0.000 18 0.000 04~0.000 7 表 3 Cu2+、Cd2+、Hg2+对斑马鱼胚胎72 h孵化抑制分析
Table 3 Analysis of Cu2+, Cd2+and Hg2+on zebrafish embryos hatch inhibition at 72nd hour
毒性指标
toxicity index重金属
heavy metal直线回归方程
linear regression equation相关系数
R标准误
SE半数致死质量浓度/mg·L-1
LC5095%置信区间
95% confidence interval72 h孵化抑制
hatching inhibition rate at 72nd hourCu2+ Y=5.765 2+0.600 9X 0.967 9 0.040 0.05 0.01~0.23 Cd2+ Y=5.435 4+0.237 2X 0.943 8 0.030 0.01 0.002~0.60 Hg2+ Y=8.848 0+0.938 8X 0.940 2 0.001 0.000 04 0.000 01~0.000 18 96 h孵化抑制
hatching inhibition rate at 96th hourCu2+ Y=5.507 3+0.405 0X 0.953 8 0.060 0.06 0.01~0.46 Cd2+ Y=5.446 1+0.350 7X 0.973 1 0.100 0.05 0.001 58~1.812 33 Hg2+ Y=8.015 6+0.760 9X 0.963 3 0.001 0.000 11 0.000 03~0.000 35 表 4 Cu2+、Cd2+、Hg2+二元混合物对斑马鱼胚胎的联合毒性
Table 4 Binary mixtures joint toxicity of Cu2+, Cd2+ and Hg2+ on zebrafish embryos
毒性配比
toxicity ratio染毒时间/h
exposure time混合物联合毒性LC50及其95%置信区间
mixture toxicity LC50 (95% confidence interval)生物活性
S相加指数
AIAm 95% confidence interval Bm 95% confidence interval 铜离子-镉离子
Cu2+-Cd2+1:148 0.04 0.02~0.08 0.06 0.03~0.13 0.150 5.67 72 0.03 0.01~0.08 0.05 0.02~0.13 0.120 7.33 96 0.03 0.01~0.05 0.04 0.02~0.08 0.580 0.70 铜离子-汞离子
Cu2+-Hg2+1:148 0.05 0.02~0.15 0.000 23 0.000 07~0.000 7 0.586 0.70 72 0.03 0.01~0.08 0.000 16 0.000 07~0.000 4 0.130 6.69 96 0.02 0.003~0.1 0.000 07 0.000 02~0.000 3 0.886 0.123 镉离子-汞离子
Cd2+-Hg2+1:148 0.06 0.02~0.14 0.000 16 0.000 07~0.000 4 0.43 1.30 72 0.05 0.02~0.13 0.000 12 0.000 05~0.000 3 0.44 1.27 96 0.02 0.003~0.1 0.000 05 0.000 01~0.000 2 0.56 0.79 表 5 Cu2+、Cd2+、Hg2+混合对斑马鱼胚胎72 h孵化抑制的联合毒性
Table 5 Combined with toxicity of Cu2+, Cd2+ and Hg2+ on zebrafish embryos hatch inhibition at 72nd hour
毒性配比
toxicity ratio混合物联合毒性LC50 (95%置信区间)
mixture toxicity LC50 (95% confidence interval)生物活性
S相加指数
AIAm Bm Cm 铜离子-镉离子Cu2+-Cd2+ 1:1 0.01 (0.006~0.02) 0.01 (0.008~0.03) 0.034 28.40 铜离子-汞离子Cu2+-Hg2+ 1:1 0.003 4 (0.000 3~0.031 9) 0.000 02 (0~0. 000 15) 0.075 12.30 镉离子-汞离子Cd2+-Hg2+ 1:1 0.003 3 (0.000 13~0.087 7) 0.000 1(0~0.000 25) 0.036 26.70 汞离子-镉离子-铜离子Hg2+-Cd2+~Cu2+ 1:1:1 0.000 05 (0.000 01~0.0002) 1.00(0.002~0.04) 0.01 (0.002~0.04) 1.060 -0.06 表 6 Cu2+、Cd2+、Hg2+三者共存对斑马鱼胚胎致死的联合毒性
Table 6 Three coexist joint toxicity lethal of Cu2+, Cd2+ and Hg2+ on zebrafish embryos
毒性配比
toxicity ratio染毒时间/h
exposure time混合物联合毒性LC50 (95%置信区间)
mixture toxicity LC50 (95% confidence interval)生物活性
S相加指数
AIAm Bm Cm 汞离子-镉离子-铜离子
Hg2+-Cd2+ -Cu2+1:1:148 0.000 50 (0.000 05~0.005 16) 1.00(0.18~1.84) 0.11(0.01~1.1) 2.67 -1.67 72 0.000 42 (0.000 03~0.005 10) 1.00 (0.15~1.82) 0.09(0.01~1.1) 2.42 -1.42 96 0.000 18 (0.000 03~0.001 02) 1.00 (0.06~0.36) 0.04(0.01~0.2) 7.40 -6.40 -
[1] FU J, WANG H, BILLAH S M, et al. Heavy metals in seawater, sediments, and biota from the coastal area of Yancheng City, China[J]. Environ Toxicol Chem, 2014, 33(8): 1697-1704. doi: 10.1002/etc.2575
[2] 孙维萍, 于培松, 潘建明. 灰色聚类法评价长江口、杭州湾海域表层海水中的重金属污染程度[J]. 海洋学报(中文版), 2009, 31(1): 79-84. doi: 10.3321/j.issn:0253-4193.2009.01.010 [3] BERTIN G, AVERBECK D. Cadmium: cellular effects, modifications of biomolecules, modulation of DNA repair and genotoxic consequences (a review)[J]. Biochimie, 2006, 88(11): 1549-1559. doi: 10.1016/j.biochi.2006.10.001
[4] CLARK R. Marine pollution[M]. New York: Oxford University Press, 2001: 62-69. https://www.amazon.com/Marine-Pollution-R-B-Clark/dp/0198792921
[5] GAETKE L M, CHOW C K. Copper toxicity, oxidative stress, and antioxidant nutrients[J]. Toxicology, 2003, 189(1/2): 147-163. doi: 10.1016/S0300-483X(03)00159-8
[6] 暨卫东. 中国近海海洋环境质量现状与背景值研究[M]. 北京: 海洋出版社, 2011: 153. https://xueshu.baidu.com/usercenter/paper/show?paperid=17c0ac5b35a09daabfc43788b0947a15 [7] WEHMAS L C, ANDERS C, CHESS J, et al. Comparative metal oxide nanoparticle toxicity using embryonic zebrafish[J]. Toxicol Rep, 2015, 2: 702-715. doi: 10.1016/j.toxrep.2015.03.015
[8] KU T T, YAN W, JIA W, et al. Characterization of synergistic embryotoxicity of nickel and buprofezin in zebrafish[J]. Environ Sci Technol, 2015, 49(7): 4600-4608. doi: 10.1021/es506293t
[9] NAGEL R. Dar T: the embryo test with the zebrafish Danio rerio: a general model in ecotoxicology and toxicology[J]. ALTEX, 2002, 19: 38-48. https://pubmed.ncbi.nlm.nih.gov/12096329/
[10] DAVE G, XIU R Q. Toxicity of mercury, copper, nickel, lead, and cobalt to embryos and larvae of zebrafish, Brachydanio rerio[J]. Arch Environ Contam Toxicol, 1991, 21(1): 126-134. doi: 10.1007/BF01055567
[11] 张亚辉, 刘征涛, 王一喆, 等. Cu2+和Cd2+对斑马鱼胚胎早期发育的联合毒性[J]. 环境科学研究, 2010, 23(11): 1415-1420. doi: 10.13198/j.res.2010.11.86.zhangyh.010 [12] HASSAN S A, MOUSSA E A, ABBOTT L C. The effect of methylmercury exposure on early central nervous system development in the zebrafish (Danio rerio) embryo[J]. J Appl Toxicol, 2012, 32(9): 707-713. doi: 10.1002/jat.1675
[13] STRMAC M, BRAUNBECK T. Effects of triphenyltin acetate on survival, hatching success, and liver ultrastructure of early life stages of zebrafish (Danio rerio)[J]. Ecotoxicol Environ Safe, 1999, 44(1): 25-39. doi: 10.1006/eesa.1999.1781
[14] 周永欣, 章宗涉. 水生生物毒性实验方法[M]. 北京: 农业出版社, 1989: 1-157. http://www.irgrid.ac.cn/handle/1471x/205581 [15] MARKING L L. Method for assessing additive toxicity of chemical mixtures. Aquatic toxicology and hazard evaluation[J]. ASTM STP Publ, 1977, 634: 99-108. doi: 10.1520/STP32392S
[16] 修瑞琴, 许永香, 傅迎春, 等. 水生毒理联合效应相加指数法[J]. 环境化学, 1994, 13(3): 269-271. https://kns.cnki.net/kcms2/article/abstract?v=8iF5fUaBjd7-FfzyuUIUvhXBJVkicfm0nmh__DG1nzjaFl37Ci_02aBPzia6yydEKJZuFiKUACJbbw9TGxwLIDi4lkJdzLeHiM0IgoVKvDHCW3C0OsEEqPNjWOoV7u2r6R58T9d5DL80ATT_6LQm0TDO9i6avZZUbUsSOpBQZCTa4koRiO258HBlLkmWdSiX&uniplatform=NZKPT&language=CHS [17] 宋志慧, 王庆伟. Cu2+、Cd2+和Cr6 +对斑马鱼联合毒性作用和生物预警的研究[J]. 生态毒理学报, 2011, 6(4): 361-366. https://kns.cnki.net/kcms2/article/abstract?v=8iF5fUaBjd4D6K-SF-bNoYHtJ2YSCA8rvsc64qLedQiSXl6Wlq3HC2sqVOYL4qa46DPhMG_7yNG-WPKk__u4NVQ5dJdmvF9EfdTGqOpv7vm3UicFfjhY3uHEhsefFAleOk8QorC0olbOeb4hoIIqwZUZW6xZwyoaM-YRV3G8WWFApUo2P2Pj0GS7tyl3bpAu&uniplatform=NZKPT&language=CHS [18] 孙振兴, 王晶, 刘金川, 等. 汞, 镉, 硒对刺参幼参的单一与联合毒性[J]. 海洋与湖沼, 2009, 40(2): 228-234. doi: 10.3321/j.issn:0029-814X.2009.02.019 [19] 赵岩, 孔强, 付荣恕. Cu2+、Cd2+和Cr6+对孔雀鱼的单一与联合毒性效应[J]. 供水技术, 2009, 3(6): 10-12, 20. doi: 10.3969/j.issn.1673-9353.2009.06.003 [20] 姚庆祯, 臧维玲, 戴习林, 等. 铜、镉、敌敌畏和甲胺磷对南美白对虾幼虾的急性致毒及相互关系[J]. 上海水产大学学报, 2003, 12(2): 117-122. doi: 10.3969/j.issn.1004-7271.2003.02.005 [21] 柳学周, 徐永江, 兰功刚. 几种重金属离子对半滑舌鳎胚胎发育和仔稚鱼的毒性效应[J]. 海洋水产研究, 2006, 27(2): 33-42. doi: 10.3969/j.issn.1000-7075.2006.02.005 [22] 隋国斌, 杨凤, 孙丕海, 等. 铅、镉、汞对皱纹盘鲍幼鲍的急性毒性试验[J]. 大连水产学院学报, 1999, 14(1): 22-26. doi: 10.3969/j.issn.1000-9957.1999.01.004 [23] 柳敏海, 陈波, 罗海忠, 等. 五种重金属对早繁 
[24] JOHNSON A, CAREW E, SLOMAN K A. The effects of copper on the morphological and functional development of zebrafish embryos[J]. Aquat Toxicol, 2007, 84(4): 431-438. doi: 10.1016/j.aquatox.2007.07.003
[25] KOMJAROVA I, BLUST R. Multimetal interactions between Cd, Cu, Ni, Pb, and Zn uptake from water in the zebrafish Danio rerio[J]. Environ Sci Technol, 2009, 43(19): 7225-7229. doi: 10.1021/es900587r
[26] SAMSON J C, GOODRIDGE R, OLOBATUYI F, et al. Delayed effects of embryonic exposure of zebrafish(Danio rerio)to methyl mercury (MeHg)[J]. Aquat Toxicol, 2001, 51(4): 369-376.
[27] 苏永红, 唐柱云, 曾科. 重金属联合毒性研究进展[J]. 现代农业科技, 2007(10): 174-175, 178. doi: 10.3969/j.issn.1007-5739.2007.10.122 [28] 程霄玲, 郑永华, 唐洪玉, 等. Cu2+、Zn2+、Cd2+对厚颌鲂幼鱼的联合致毒效应研究[J]. 淡水渔业, 2009, 39(2): 54-59. doi: 10.3969/j.issn.1000-6907.2009.02.010 [29] 高晓莉, 齐凤生, 罗胡英, 等. 铜、汞、铬对泥鳅的急性毒性和联合毒性实验[J]. 水利渔业, 2003, 23(2): 63-64. https://kns.cnki.net/kcms2/article/abstract?v=8iF5fUaBjd7aRDdb_RbWULEMdXrUFCLXoF4pY2yz0BP1WSkvlIWawXwWjq47yBT40wzPzpUA4jW0ABUKz8HuQQ3TQYGx25XTh041tVC2XZByXoNZoKshdbjPrle6VNhFnmZ9_KslVvcMieV-quupolp-AF-2zNDI4NMGBE5Lio1HtElPcs2pzymu6ZVMT5kG&uniplatform=NZKPT&language=CHS [30] 胡晓磐, 周建华, 时夕金, 等. 汞、镉、铅联合染毒对小鼠DNA损伤的研究[J]. 苏州大学学报(医学版), 2004(5): 595-597. doi: 10.3969/j.issn.1673-0399.2004.05.003 [31] 戚平平. 硫酸铜、氯化汞和溴氰菊酯联合作用下对斑马鱼AChE的影响[D]. 济南: 山东师范大学, 2015: 38. https://kns.cnki.net/kcms2/article/abstract?v=WStw-PbchoxszyNT0bf51rosjSBO-rbraubf35M2unY4HVRMJ2ySDESxzuKAniq0NDqX8eECPnMIV_NVjCDBDE5fELKm-sY3IlCD-SnyicumFCVqR_djh1yaOXgERd_JCQwtIy_a3ky25piN9FDyXXxsA9AD7H2bY0DyaMGqc6UBvDd1XtXjSM5Lg_UFjn7Pq_inBRc336U=&uniplatform=NZKPT&language=CHS [32] 房燕, 杨红生. 镉和汞两种重金属离子对四角蛤蜊血细胞DNA损伤的初步研究[J]. 海洋科学, 2011, 35(2): 1-5. http://qdhys.ijournal.cn/hykx/ch/reader/view_abstract.aspx?file_no=20110201&flag=1 [33] KHACHIK F, CARVALHO L, BERNSTEIN P S, et al. Chemistry, distribution, and metabolism of tomato carotenoids and their impact on human health[J]. Exp Biol Med (Maywood), 2002, 227(10): 845-851. doi: 10.1177/153537020222701002
[34] 陈志伟, 李兴华, 周华松. 铜、镉单一及复合污染对蚯蚓的急性毒性效应[J]. 浙江农业学报, 2007, 19(1): 20-24. doi: 10.3969/j.issn.1004-1524.2007.01.005 [35] 梁秋燕, 谢勇平, 方展强. Zn2+和Cd2+对斑马鱼早期胚胎发育阶段的单一与联合毒性[J]. 中国水产科学, 2012, 19(2): 283-293. doi: 10.3724/SP.J.1118.2012.00283 [36] 王志铮, 王伟定, 杨阳, 等. 4种金属离子对彩虹明樱蛤的急性致毒效应[J]. 海洋与湖沼, 2007, 38(4): 373-378. doi: 10.3321/j.issn:0029-814X.2007.04.013 [37] 李璐, 何滨, 江桂斌. 高效液相色谱-电感耦合等离子体质谱研究Medaka体内水溶性汞结合蛋白[J]. 分析化学, 2011, 39(5): 623-627. doi: 10.3724/SP.J.1096.2011.00623



 下载:
下载:



 粤公网安备 44010502001741号
粤公网安备 44010502001741号
