Microbial community structure in sediment of high-density aquaculture enclosures of grass carp and hybrid snakehead
-
摘要:
为了探讨不同鱼种的养殖模式对养殖池塘沉积物微生物结构的影响,利用聚合酶链反应-变性梯度凝胶电泳(PCR-DGGE)技术分析了珠三角地区2种常见养殖鱼种草鱼(Ctenopharyngodon idellus)和乌鳢(Channa maculate♀×Channa arguss♂)养殖池塘围隔中沉积物的微生物。结果显示,2种养殖模式PCR-DGGE电泳样品共获得72个条带,草鱼模式有67个条带,乌鳢模式有70个条带。克隆测序了37个条带,共获得48条序列,其中变形菌门为优势类群,占总序列的52.80%。微生物群落结构分析结果表明草鱼和乌鳢2种养殖模式间差异显著,2种养殖模式微生物的Shannon-Weiner指数和Simpson指数存在显著性差异,乌鳢模式的微生物多样性指数高于草鱼模式,说明微生物群落结构的差异可能受不同营养成分的饲料及鱼种的生活方式的影响。每种养殖模式月间差异性分析得出2种养殖模式差异均不显著,说明微生物群落结构在养殖过程中变化不大。
-
关键词:
- 草鱼 /
- 乌鳢 /
- 沉积物 /
- 聚合酶链反应-变性梯度凝胶电泳 /
- 细菌群落结构
Abstract:To investigate the effect of fish aquaculture on microbial community structure in sediments of aquaculture pond, we selected two common types of aquaculture fish, grass carp (Ctenopharyngodon idellus) and hybrid snakehead (Channa maculate♀×Channa arguss♂), to analyze the microorganisms of the sediment by PCR and denaturing gel gradient electrophoresis (DGGE). Seventy-two DGGE bands were found in the sediments of the two aquaculture fish, among which 67 bands were found in grass carp enclosures and 70 bands in hybrid snakehead enclosures. Thirty-seven bands were sequenced, and a total of 48 sequences were obtained. Proteobacteria dominated the microbial community in species richness (52.8%). Microbial community structure analysis shows significant difference between the two aquaculture patterns. The Shannon-Weiner index and Simpson index were different between these two fish, with Shannon-Weiner index higher in hybrid snakehead aquaculture than in grass carp aquaculture. Thus, different nutrient feeds and lifestyles of species also influence microbial community structure. The monthly changes of the two fish exhibited no significant difference, which shows that the microbial community structure changes little in breeding process.
-
Keywords:
- grass carp /
- hybrid snakehead /
- sediment /
- PCR-DGGE /
- microbial community structure
-
随着生活水平的不断提高,人们越来越追求健康饮食,尤其对食物中的脂肪酸组成越来越重视。鱼类营养丰富,富含多不饱和脂肪酸,特别是DHA和EPA。中国对淡水鱼的需求量不断增加,因此,研究淡水鱼在贮藏加工过程中品质(特别是脂肪酸组成)的变化具有重大意义。
鳙(Aristichthys nobilis)又名花鲢、胖头鱼,是中国四大家鱼之一,也是目前国内水产品市场中主要的商业化淡水鱼种之一,其2011年的年产量达到266.8×104 t[1]。目前,国内学者对鲤(Cyprinus carpio)、草鱼(Ctenopharyngodon idellus)、鳙等淡水鱼在贮藏过程中的品质变化进行了一些研究[2-4],HONG等[5]报道了低浓度的盐和糖对鳙冷藏过程中品质变化的影响,指出低浓度的盐和糖不仅能够改善鱼片的食用口感,还能延缓品质变化、延长货架期,但是没有将脂肪酸作为品质变化的内容进行研究。脂肪酸的氧化对鱼的品质有重要的影响。国外学者对沙丁鱼(Sardinella gibbosa)、马鲛(Trachurus trachurus)、鲱(Clupea harengus)等海水鱼类在贮藏加工过程中脂肪的变化规律进行过一些报道[6-8],发现随着贮藏时间的延长,鱼的品质下降速度加快,脂肪酸(尤其是不饱和脂肪酸)的氧化程度加剧。食盐腌制是水产品保藏中应用较为广泛的一种方式,但是腌制对淡水鱼贮藏中脂肪酸变化的影响以及对鱼整体品质的影响尚不清楚,为此笔者选择鳙作为试验用鱼,通过测定感官指标和pH、硫代巴比妥酸(TBA)值、色泽、脂肪酸组成等理化指标,研究腌制鳙鱼片在冷藏过程中的品质变化规律。
1. 材料与方法
1.1 试样及预处理
鳙购于北京小月河农贸市场,其平均体质量和体长分别为(1 923.04±173.67)g和(52.13±1.93)cm,活体运至实验室后击毙,去鳞、去内脏,将洗净沥干后的鱼片随机均分为2组并装于聚乙烯保鲜袋内,一组用质量分数为2%的氯化钠(NaCl)干腌,另一组不做任何处理作为对照组。将2组鱼片分别置于4 ℃的冰箱中冷藏,每隔2 d从2组鱼片中随机选取3块进行各项指标的测定,每个指标重复3次。
1.2 测定方法
1.2.1 感官评定
分为生鲜和水煮2种评价方式,生鲜鱼片以色泽、气味、组织形态和肌肉弹性为检验指标,水煮鱼片以气味、滋味和汤汁浑浊度为检测指标,各项指标分为好、较好、一般、较差和差五个级别,分值分别为5、4、3、2、1分,由10名评定人员对鱼片的各项指标进行评分,感官分值为7项指标之和。具体的评分标准参照黄晓春等[9]的评定方法。
1.2.2 pH的测定
取绞碎的鱼背部肌肉10 g于烧杯中,加入100 mL蒸馏水,搅拌30 min后过滤,取其滤液用FE-20酸度计进行测定。
1.2.3 TBA值的测定
参照ERKAN等[10]的方法并稍作修改。取2 g绞碎的鱼肉样品于50 mL的离心管中,加入16 mL 50 g · L-1的三氯乙酸溶液和100 μL 2 g · L-1的BHT乙醇溶液,高速匀浆2 min,常温5 000 r · min-1离心3 min,取上清液5 mL与1 mL 0.01 mol · L-1的TBA溶液混合,振荡后沸水浴40 min; 对照组用5 mL蒸馏水代替样品上清液,将经过水浴的反应管置于冷水中冷却5 min后,于532 nm下测定吸光度值(OD)。TBA值由样品中丙二醛(MDA)的质量分数(mg · kg-1)表示,计算公式为TBA值(mg · kg-1)=10.2×OD。
1.2.4 色泽的测定
鳙肌肉色泽变化用全自动色差仪(ADCI-60-C)测定。测量前用制造商提供的白色和黑色标准瓷板对仪器进行校准,将鱼背部肌肉绞碎,均匀的填进测量杯内进行测量。色泽的测量结果用亮度(L*)、红绿色值(a*)和黄蓝色值(b*)表示[11]。
1.2.5 总脂肪的提取
参照FOLCH等[12]的方法并稍作修改,取4 g绞碎的鱼肉样品于50 mL离心管中,加入20 mL V(氯仿) : V(甲醇)=2 : 1的混合液,静置浸提24 h,过滤后加蒸馏水10 mL并摇匀,常温2 000 r · min-1离心5 min,取下层氯仿层,用氮气吹干备用。
1.2.6 脂肪酸的甲酯化
参照AOAC[13]方法,取0.1 g的脂肪提取物于离心管中,加入3 mL 0.5 mol · L-1氢氧化钠(NaOH)/甲醇溶液,沸水浴10 min使其进行皂化反应,冷却至室温加入5 mL V(BF3) : V(甲醇)=14 : 86的混合液并沸水浴加热2 min,待冷却至室温加入5 mL庚烷来提取酯化了的脂肪酸,同时加入NaCl至溶液饱和来防止乳化,最后,庚烷提取的部分用氮吹干,贮存于-20 ℃下备用。
1.2.7 脂肪酸组成的分析
将脂肪酸甲酯(FAMES)样品溶于0.1 mL的正己烷,每次进样量为4 μL,用气相色谱仪进行脂肪酸组成的分析。气相色谱条件为气相色谱使用SPTM-2560毛细管柱(100 m×0.25 mm ID.;Supelco Inc.,Bellefonte,PA),火焰离子检测器(FID);进样器和检测器的温度都设置在250 ℃,毛细管柱的初始温度为140 ℃,保持5 min,以4 ℃ · min-1升至240 ℃,保持40 min;载氮气,流速为1.5 mL ·min-1。
1.3 数据统计分析
采用Excel 2010进行数据处理与作图,用面积归一化法计算各种脂肪酸的含量,用SAS 9.0软件进行差异显著性分析,采用最小显著差异法(LSD)进行显著性检验(显著性水平为P < 0.05)。
2. 结果与分析
2.1 感官分值的变化
腌制和未腌制鳙鱼片在冷藏过程中的感官分值变化见图 1-a。2组鳙鱼片的感官分值均随冷藏时间的延长而下降,HONG等[5]在研究低浓度的盐和糖对鳙鱼片冷藏过程中的品质变化时也得到了类似的结论。对照组与腌制组鳙鱼片的感官分值变化具有明显差异,前者的感官分值下降速率明显大于后者。对照组鱼片贮藏至第9天的感官分值为13,而腌制组鱼片贮藏至第15天仅为12。ZHANG等[14]认为鱼的感官分值小于12消费者已无法接受,因此,未经处理的鱼片在贮藏9 d后就几乎达到了感官接受限度,而经腌制处理的鱼片在贮藏15 d后才达到感官接受限度。结果表明,腌制处理能明显延缓鱼片感官分值的变化(P < 0.05)。对照组和腌制组鳙鱼片的货架期分别为9 d和15 d。
2.2 pH的变化
贮藏过程中2组鳙鱼片的pH变化均呈先下降后上升的趋势(图 1-b)。贮藏初期pH的下降主要是由于二氧化碳(CO2)溶于鱼肉组织[15]和鱼肉中糖原的分解[16]所导致,NAKAGAWA等[17]认为pH的下降还有可能是由于脂肪水解产生的游离脂肪酸所致,随后pH的上升主要是由于微生物的分解作用所产生的碱性胺类物质所致[18]。对照组鱼片的pH在第3天就降到了最小值(6.81),然后开始上升;而腌制组鱼片的pH一直下降到第9天才达到最小值(6.73),随后也开始上升。显然,经过2%盐腌制处理的鳙鱼片其pH下降的时间明显长于对照组,这可能是因为腌制促进了脂质的分解进而使更多的游离脂肪酸不断产生。贮藏结束时腌制组鱼片的pH(6.89)低于对照组(7.18),这可能是因为腌制能够抑制鱼肉中微生物的生长,降低微生物的代谢速率,抑制内源酶的活性,进而延缓了pH的上升。
2.3 TBA值的变化
腌制与未腌制鳙鱼片在4 ℃冷藏过程中的TBA值变化见图 1-c。总体来说,2组鱼片的TBA值均随着贮藏时间的延长而升高(P < 0.05),这是因为随着贮藏时间的增加鱼片的腐败加剧,脂肪酸的氧化加快,从而形成的二级脂肪氧化产物(如醛类)增多[19]。对照组的TBA值在前9 d缓慢上升,之后快速增加,表明鱼肉中脂肪酸的氧化主要发生在贮藏后期。而经过腌制处理的鱼片,其TBA值在贮藏前6 d变化较平缓,从第6天就开始迅速上升一直到贮藏结束(P < 0.05),说明腌制使脂肪的氧化提前。CHAIJAN等[6]对沙丁鱼冰藏过程中的脂肪变化情况进行研究时指出,其TBA值从第3天就开始迅速上升,这可能是由于沙丁鱼所含的脂肪较鳙要多。第6天以后腌制组鳙鱼片在每个时间点的TBA值都大于对照组,如第9天时腌制鱼片的TBA值(2.46 mg ·kg-1)显著高于对照组(1.02 mg · kg-1)(P < 0.05),表明腌制能够促进脂肪的氧化。因此,与对照组相比,腌制处理不仅能够促进鱼片脂肪的氧化,还能够使脂肪的氧化提前。
2.4 色泽的变化
2%盐腌制和未经腌制的鳙鱼片在冷藏过程中各项色泽指标的变化见表 1。2组鳙鱼片的L*和b*随着贮藏时间的延长呈下降趋势,a*随着贮藏时间的增加呈上升趋势,但腌制鳙鱼片的这些指标变化幅度明显大于对照组(P < 0.05)。贮藏结束时腌制处理鱼片的L*、b*分别为36.83、-0.71,明显低于对照组的47.07、3.70(P < 0.05),而腌制鳙鱼片的a*为8.79,明显高于对照组的6.12(P < 0.05)。与对照组相比,腌制鱼片的亮度低,肉色偏红、偏蓝,表明腌制处理对冷藏过程中鳙鱼片的色泽品质有显著的影响。HONG等[5]在研究低浓度的盐和糖对冷藏过程中鳙鱼的品质影响时也得出了相似的结论。而OCAÑO-HIGUERA等[20]研究发现(Potamotrygon)在冰藏过程中其L*并没有随贮藏时间出现明显变化,但a*和b*却发生了显著变化(P < 0.05)。关于色泽变化的原因主要有:1)L*的变化可能是由于腌制加速了鱼片的汁液流失进而使亮度降低;2)随着脂肪氧化程度的提高,氧化产生的羰基化合物(如醛和酮)增多,这些化合物能够与游离氨基酸或肽发生非酶促褐变反应,进而促进了b*的变化,还可能是腌制加速了鱼片的失水进而引起b*的变化[21]。究竟是单个因素引起,还是多个因素共同作用的结果尚需深入研究;3)关于a*的变化原因还有待进一步研究。
表 1 腌制和未腌制鳙鱼片在冷藏过程中的色泽变化(X ±SD,n=3)Table 1. Colour changes of bighead carp fillets with salt and unsalted treatment during storage at 4 ℃参数parameters 贮藏时间/d storage time 对照组control 2%盐处理组treated with 2% salt 亮度L* 0 52.55±1.40Aa 52.55±1.40Aa 3 48.14±1.25Abc 40.33±2.09Bb 6 48.69±1.39Ab 38.43±0.42Bc 9 47.76±0.25Abc 33.90±2.03Be 12 46.73±0.86Ac 36.59±2.25Bd 15 47.07±0.85Ac 36.83±1.16Bcd 红绿色值a* 0 5.82±0.90Acd 5.82±0.90Ad 3 5.27±0.70Bd 8.14±2.11Ac 6 5.79±0.68Bcd 8.93±0.50Abc 9 6.99±0.37Ba 13.03±2.04Aa 12 6.78±0.27Bab 9.71±1.44Ab 15 6.12±0.62Bbc 8.79±0.94Abc 黄蓝色值b* 0 6.82±0.47Aa 6.82±0.47Aa 3 6.93±0.79Aa 3.50±0.47Bb 6 6.61±0.55Aa 1.34±0.96Bc 9 5.52±0.27Ab -2.18±1.36Be 12 3.75±0.68Ac 0.13±1.85Bd 15 3.70±0.24Ac -0.71±0.42Bd 注:A~B. 同一指标下同一行的数值上标有相同字母表示它们没有差异显著性(P>0.05);a~e. 同一指标下同一列的数值上标有相同字母则表示它们没有差异显著性(P>0.05);后表同此
Note:A~B. values with same superscript letters in the same column have no significant difference under the same parameter (P>0.05);a~e. values with same superscript letters in the same row have no significant difference under the same parameter (P>0.05). The same case in the following table.2.5 脂肪酸组成的变化
腌制和未腌制鳙鱼片在冷藏过程中的脂肪酸组成变化见表 2。新鲜鳙鱼片的总脂肪酸由34.13%的饱和脂肪酸(SFA)、19.95%的单不饱和脂肪酸(MUFA)和37.17%的多不饱和脂肪酸(PUFA)组成,其中含量较高的脂肪酸有棕榈酸(C16:0)、油酸(C18:1 n-9)、EPA(C20:5 n-3)、硬脂酸(C18:0) 和DHA(C22:6 n-3)。腌制鳙鱼片在贮藏期间总多不饱和脂肪酸(∑PUFA)的变化范围是34.82%~39.29%,总饱和脂肪酸(∑SFA)的变化范围为33.57%~38.20%;对照组鳙鱼片∑PUFA和∑SFA的变化范围分别为37.17%~45.09%和30.37%~34.13%。腌制鳙鱼片∑PUFA的平均含量(37.25%)明显低于对照组(41.53%)(P < 0.05),而∑SFA含量则明显高于对照组(P < 0.05),这可能是由于腌制最先促进了多不饱和脂肪酸的氧化,从而提高了饱和脂肪酸的相对含量。KANNER等[22]认为,NaCl能够增强铁离子的活性进而促进脂肪酸的氧化。另外,腌制处理的鳙鱼片其总n-3系列多不饱和脂肪酸(∑n-3)的平均含量(25.39%)明显低于对照组(28.40%)(P < 0.05),而2组鱼片∑n-6的平均含量分别为9.99%和11.77%,没有显著性差异(P>0.05),这表明腌制处理更容易促进n-3系列脂肪酸的氧化。因此,腌制能够促进鱼片脂肪酸的氧化,更容易促进PUFA尤其是n-3系列多不饱和脂肪酸的氧化,从而降低了鱼片的营养品质。
表 2 腌制和未腌制鳙鱼片在冷藏过程中的脂肪酸组成变化(X ±SD,n=3)Table 2. Changes in fatty acid profile of bighead carp fillets with salt and unsalted treatment during storage at 4 ℃% 脂肪酸fatty acids 贮藏时间/d storage time 0 3 6 9 12 肉豆蔻酸C14:0 1.22±0.26Aa 1.17±0.38Aa 0.76±0.13Ab 0.76±0.03Bb 0.86±0.18Aab 1.22±0.26Aa 1.02±0.15Aa 0.97±0.11Aa 1.01±0.01Aa 1.13±0.23Aa 棕榈酸C16:0 20.13±0.96Aa 19.88±0.29Bab 19.09±1.16Bab 18.90±0.22Bb 19.42±0.44Aab 20.13±0.96Ac 22.55±1.01Aa 22.05±1.14Aab 21.36±1.42Aabc 20.52±0.85Abc 硬脂酸C18:0 9.86±0.21Aa 8.91±1.03Bab 8.63±0.43Bbc 8.20±0.34Abc 7.90±0.43Ac 9.86±0.21Aab 11.85±1.04Aa 11.29±1.58Aab 9.83±1.20Aab 9.40±2.37Aab 总饱和脂肪酸∑SFA 34.13±1.49Aa 33.87±1.19Ba 31.64±0.99Bb 30.37±0.44Ab 31.21±0.50Ab 34.13±1.49Ac 38.2±2.36Aa 37.96±1.32Aab 34.74±2.70Abc 34.43±2.10Ac 棕榈油酸C16:1 5.43±0.22Aa 4.91±1.39Aab 3.30±0.79Ac 3.52±0.29Abc 4.52±0.94Aabc 5.43±0.22Aa 3.97±1.12Aa 3.75±0.60Aa 4.03±0.25Aa 4.54±1.30Aa 油酸C18:1 n-9 12.68±1.30Aa 11.15±1.58Aa 12.13±0.59Aa 10.65±1.38Aa 11.74±0.21Aa 12.68±1.30Aab 11.83±2.58Aab 10.16±0.51Bb 11.02±0.38Aab 13.07±2.97Aab 总单不饱和脂肪酸∑MUFA 19.95±1.22Aa 18.28±3.22Aab 17.15±0.23Aab 15.67±1.60Ab 18.13±0.93Aab 19.95±1.22Aab 17.41±3.85Aab 15.55±0.89Bb 16.47±0.26Aab 19.43±4.64Aab 亚油酸C18:2 n-6 2.97±0.75Aab 2.30±0.15Ab 6.07±3.78Aa 3.71±1.42Aab 3.11±1.18Aab 2.97±0.75Aa 4.00±3.64Aa 2.46±0.64Aa 1.09±0.58Aa 2.35±0.89Aa γ-亚麻酸C18:3 n-6 0.12±0.04Aa 0.10±0.03Aa 0.08±0.02Aa 0.11±0.01Aa 0.09±0.04Aa 0.12±0.04Aa 0.07±0.00Ab 0.06±0.01Ab 0.09±0.03Aab 0.08±0.02Aab α-亚麻酸C18:3 n-3 3.12±0.34Aa 3.19±0.38Aa 2.38±0.15Ab 2.90±0.22Aa 2.91±0.31Aa 3.12±0.34Aa 2.11±0.09Bc 2.55±0.28Ab 2.61±0.11Ab 2.51±0.11Ab DH-γ亚麻酸C20:3 n-6 0.49±0.02Aa 0.47±0.01Aa 0.50±0.09Aa 0.46±0.02Ab 0.47±0.01Aa 0.49±0.02Aa 0.49±0.08Aa 0.39±0.02Ab 0.40±0.02Bb 0.44±0.04Aab 花生四烯酸C20:4 n-6 4.32±0.52Ab 4.86±0.74Aab 4.74±0.25Aab 5.37±0.50Aa 4.77±0.13Aab 4.32±0.52Aa 4.27±0.78Aa 4.72±0.14Aa 4.66±0.37Aa 4.08±1.20Aa EPA C20:5 n-3 9.97±0.30Ab 10.46±1.43Ab 10.07±1.63Ab 12.31±1.05Aa 11.71±0.44Aab 9.97±0.30Aab 8.28±1.61Ab 10.26±1.07Aab 10.75±0.79Aa 9.76±1.49Aab DHA C22:6 n-3 9.62±1.43Ac 11.00±0.78Abc 12.55±0.57Aa 12.92±0.16Aa 12.34±0.85Aab 9.62±1.43Ac 10.43±2.13Aabc 10.05±0.62Bbc 10.73±1.48Aabc 12.48±1.23Aab 总多不饱和脂肪酸∑PUFA 37.17±1.53Ad 39.27±2.70Acd 42.87±2.08Aab 45.09±0.39Aa 42.92±1.30Aab 37.17±1.53Aab 34.82±1.54Ab 36.52±2.31Bab 39.29±2.95Ba 38.14±2.95Aab n-3系列多不饱和脂肪酸∑n-3 25.28 27.35 27.61 31.16 29.97 25.28 22.71 25.20 26.44 27.20 n-6系列饱和脂肪酸∑n-6 10.35 10.42 14.33 12.64 11.48 10.35 10.85 10.11 8.66 9.42 n-3/n-6比值n-3/n-6 ratio 2.44 2.62 1.95 2.47 2.61 2.44 2.09 2.49 3.05 2.89 注:每一种脂肪酸下第一行为对照组,第二行为腌制组
Note:Values in the first row are of the control and in the second row are of the treated with 2% salt under the same parameter.3. 结论
2组鱼片的感官分值都随着贮藏时间的延长而下降,但腌制鱼片比未腌制鱼片下降缓慢。与未腌制鱼片相比,腌制鱼片的TBA值增加更快、色泽变化更大、多不饱和脂肪酸含量下降更快。因此,2%盐腌制鳙鱼片虽然能够延长冷藏货架期,增强鱼片的口感,但会加速鱼片变色,促进脂肪酸尤其是n-3系列多不饱和脂肪酸的氧化。所以,2%食盐腌制不是一种保藏鳙的较好方法。
-
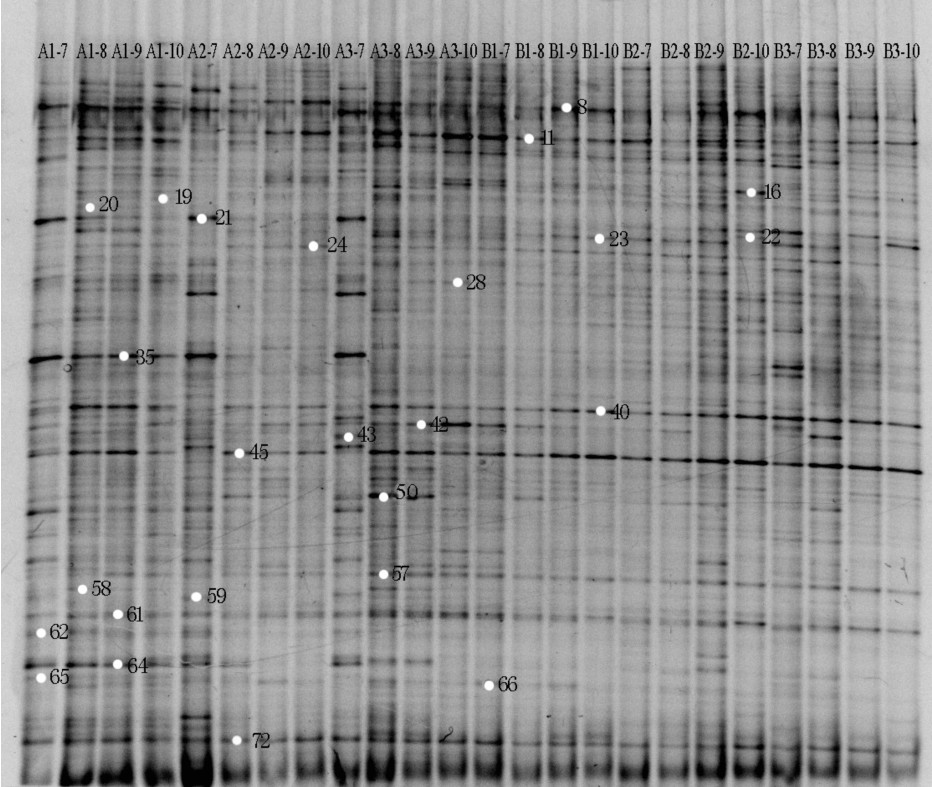
图 1 2种高产养殖模式围隔沉积物微生物在养殖过程中的变性梯度凝胶电泳技术图谱分析
A1-7~A3-10与B1-7~B3-10分别表示3个乌鳢与草鱼围隔2014年7月~10月沉积物样品,胶中数字代表主要条带
Figure 1. Image of DGGE gels from sediment samples in enclosures of two aquaculture species in different months
A1-7~A3-10 and B1-7~B3-10 stand for the samples collected from grass carp and hybrid snakehead intensive aquaculture enclosures. Numbers in DGGE profile represent the main sequenced bands.
表 1 沉积物微生物变性梯度凝胶电泳条带测序结果
Table 1 Sequencing result of prokaryote DGGE bands from sediment samples
条带号
band No.序列长度
sequence sizeGenBank最相似性序列(编号)
closest relative found in GenBank database (access No.)发育地位
phylogenetic affiliation相似性/%
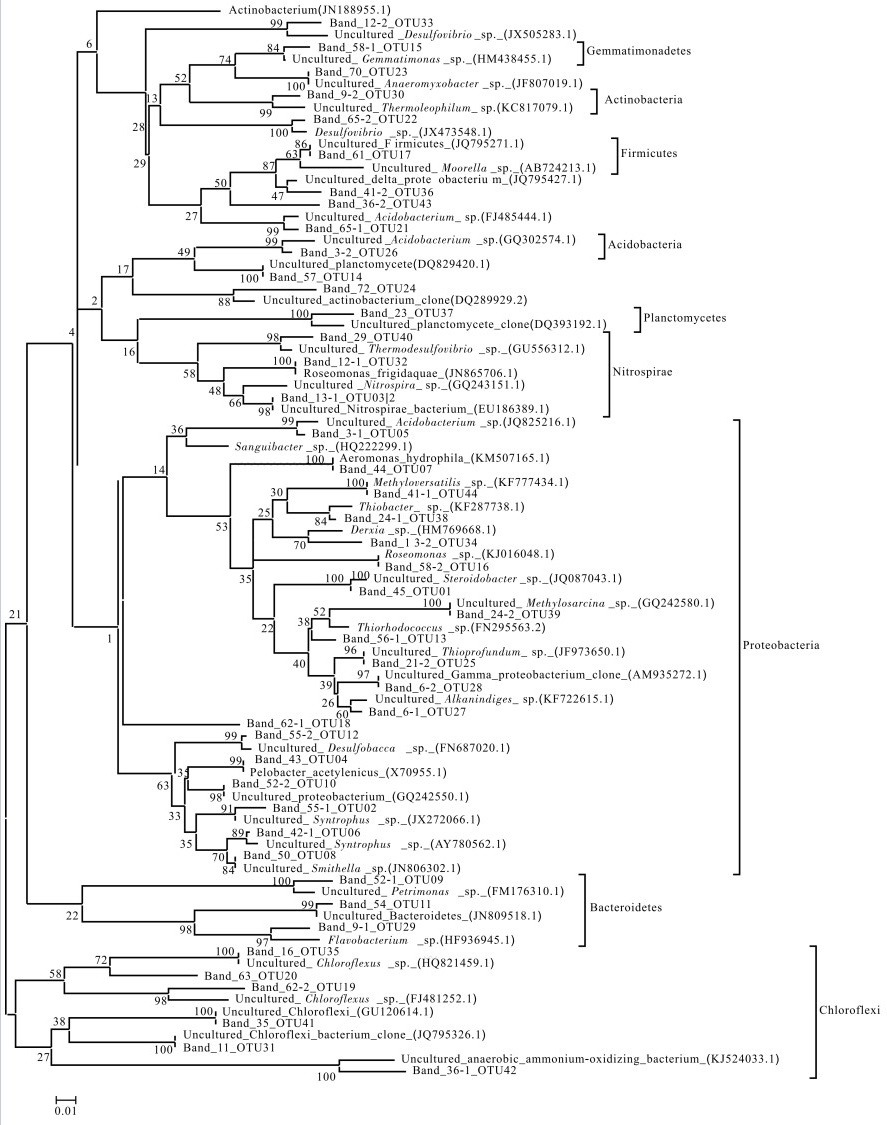
similarityBand 3-1 172 uncultured Acidobacterium sp. (JQ825216.1) 酸杆菌门(Acidobacteria) 99 Band 3-2 197 uncultured Acidobacterium sp. (GQ302574.1) 酸杆菌门(Acidobacteria) 97 Band 6-1 197 uncultured Alkanindiges sp. (KF722615.1) γ-变形菌门(γ-Proteobacteria) 97 Band 6-2 197 uncultured Gamma proteobacterium (AM935272.1) γ-变形菌门(γ-Proteobacteria) 98 Band 9-1 192 Flavobacterium sp. (HF936945.1) 拟杆菌门(Bacteroidetes) 96 Band 9-2 198 uncultured Thermoleophilum sp. (KC817079.1) 放线菌门(Actinobacteria) 96 Band 11 173 uncultured Chloroflexi bacterium (JQ795326.1) 绿弯菌门(Chloroflexi) 99 Band 12-1 172 Roseomonas frigidaquae isolate PW-31. (JN865706.1) α-变形菌门(α-Proteobacteria) 100 Band 12-2 198 uncultured Desulfovibrio sp. (JX505283.1) δ-变形菌门(δ-Proteobacteria) 93 Band 13-1 169 uncultured Nitrospirae bacterium (EU186389.1) 硝化螺旋菌门(Nitrospirae) 100 Band 13-2 196 Derxia sp. (HM769668.1) β-变形菌门(β-Proteobacteria) 94 Band 16 171 uncultured Chloroflexus sp. (HQ821459.1) 绿弯菌门(Chloroflexi) 100 Band 21-1 171 uncultured Nitrospira sp. (GQ243151.1) 硝化螺旋菌门(Nitrospirae) 98 Band 21-2 197 uncultured Thioprofundum sp. (JF973650.1) γ-变形菌门(γ-Proteobacteria) 94 Band 23 192 uncultured planctomycete (DQ393192.1) 浮霉菌门(Planctomycetes) 92 Band 24-1 197 Thiobacter sp. (KF287738.1) β-变形菌门(β-Proteobacteria) 98 Band 24-2 196 uncultured Methylosarcina sp. (GQ242580.1) γ-变形菌门(γ-Proteobacteria) 98 Band 29 172 uncultured Thermodesulfovibrio sp. (GU556312.1) 硝化螺旋菌门(Nitrospirae) 98 Band 35 173 uncultured Chloroflexi (GU120614.1) 绿弯菌门(Chloroflexi) 99 Band 36-1 168 uncultured anaerobic ammonium-oxidizing bacterium (KJ524033.1) 浮霉菌门(Planctomycetes) 90 Band 36-2 184 uncultured Moorella sp. (AB724213.1) 厚壁菌门(Firmicutes) 94 Band 40 197 uncultured Steroidobacter sp. (JQ087043.1) γ-变形菌门(γ-Proteobacteria) 100 Band 41-1 197 Methyloversatilis sp. (KF777434.1) β-变形菌门(β-Proteobacteria) 100 Band 41-2 184 uncultured delta proteobacterium (JQ795427.1) δ-变形菌门(δ-Proteobacteria) 97 Band 42-1 198 uncultured Syntrophus sp. (AY780562.1) δ-变形菌门(δ-Proteobacteria) 97 Band 42-2 197 uncultured Steroidobacter sp. (JQ087043.1) γ-变形菌门(γ-Proteobacteria) 98 Band 43 198 Pelobacter acetylenicus (X70955.1) δ-变形菌门(δ-Proteobacteria) 98 Band 44 197 Aeromonas hydrophila strain PM 92 (KM507165.1) γ-变形菌门(γ-Proteobacteria) 100 Band 45 197 uncultured Steroidobacter sp. (JQ087043.1) γ-变形菌门(γ-Proteobacteria) 99 Band 50 198 uncultured Smithella sp. (JN806302.1) δ-变形菌门(δ-Proteobacteria) 99 Band 52-1 190 uncultured Petrimonas sp. (FM176310.1) 拟杆菌门(Bacteroidetes) 96 Band 52-2 199 uncultured proteobacterium (GQ242550.1) 变形菌门(Proteobacteria) 98 Band 54 192 uncultured Bacteroidetes (JN809518.1) 拟杆菌门(Bacteroidetes) 97 Band 55-1 198 uncultured Syntrophus sp. (JX272066.1) δ-变形菌门(δ-Proteobacteria) 97 Band 55-2 197 uncultured Desulfobacca sp. (FN687020.1) δ-变形菌门(δ-Proteobacteria) 98 Band 56-1 197 Thiorhodococcus sp. (FN295563.2) γ-变形菌门(γ-Proteobacteria) 95 Band 56-2 198 uncultured Syntrophus sp. (JX272066.1) δ-变形菌门(δ-Proteobacteria) 97 Band 57 196 uncultured planctomycete (DQ829420.1) 浮霉菌门(Planctomycetes) 99 Band 58-1 174 uncultured Gemmatimonas sp. (HM438455.1) 芽单胞菌门(Gemmatimonadetes) 99 Band 58-2 172 Roseomonas sp. (KJ016048.1) α-变形菌门(α-Proteobacteria) 100 Band 61 184 uncultured Firmicutes (JQ795271.1) 厚壁菌门(Firmicutes) 100 Band 62-1 177 Sanguibacter sp. (HQ222299.1) 变形菌门(Proteobacteria) 93 Band 62-2 171 uncultured Chloroflexus sp. (FJ481252.1) 绿弯菌门(Chloroflexi) 93 Band 63 180 Actinobacterium (JN188955.1) 变形菌门(Proteobacteria) 86 Band 65-1 186 uncultured Acidobacterium sp. (FJ485444.1) 酸杆菌门(Acidobacteria) 99 Band 65-2 172 Desulfovibrio sp. (JX473548.1) δ-变形菌门(δ-Proteobacteria) 99 Band 70 198 uncultured Anaeromyxobacter sp. (JF807019.1) δ-变形菌门(δ-Proteobacteria) 99 Band 72 197 uncultured actinobacterium (DQ289929.2) 变形菌门(Proteobacteria) 95 表 2 不同围隔沉积物样品的Shannon-Wiener指数和Simpson指数
Table 2 Shannon-Wiener index and Simpson index from sediments samples in different enclosures
样品编号
No.香农-威纳指数H′
Shannon-Wiener index辛普森指数D
Simpson index样品编号
No.香农-威纳指数H′
Shannon-Wiener index辛普森指数D
Simpson indexA1 3.490 0.040 B1 3.330 0.053 A2 3.498 0.038 B2 3.388 0.045 A3 3.498 0.040 B3 3.340 0.055 表 3 2种养殖模式主要差异性条带及其贡献率
Table 3 Difference of main bands in average peak value between two groups of aquaculture enclosures
条带
band平均条带丰度 average peak value 贡献率/%
contribution乌鳢
hybrid snakehead草鱼
grass carpband 09 2.60 0.56 3.52 band 12 2.09 0.50 2.88 band 51 2.00 0.43 2.85 band 15 1.64 0.00 2.74 band 56 1.89 0.58 2.45 band 35 2.07 1.43 2.45 band 64 2.27 1.49 2.19 band 06 2.19 1.08 2.03 band 44 1.57 0.69 1.94 band 47 0.73 1.23 1.92 band 67 1.20 0.12 1.92 band 17 0.80 1.12 1.84 band 70 1.59 0.87 1.82 band 01 1.38 0.75 1.78 band 53 1.27 0.87 1.77 band 26 1.67 1.16 1.76 band 36 0.47 0.95 1.72 band 29 1.49 1.91 1.71 band 03 1.18 1.35 1.69 band 04 1.45 1.14 1.66 band 58 1.36 0.84 1.66 band 71 1.27 1.27 1.66 band 31 1.04 1.37 1.60 band 60 0.33 0.94 1.60 band 48 1.30 1.39 1.58 -
[1] COLEMAN D C, WHITMAN W B. Linking species richness, biodiversity and ecosystem function in soil systems[J]. Pedobiologia, 2004, 49: 479-497. doi: 10.1016/j.pedobi.2005.05.006
[2] MEGHARAJ M, RAMAKRISHNAN B, VENKATESWARLU K, et al. Bioremediation approaches for organic pollutants: a critical perspective[J]. Environ Int, 2011, 37(8): 1362-1375. doi: 10.1016/j.envint.2011.06.003
[3] PANDEY B, FULEKAR M H. Bioremediation technology: a new horizon for environmental clean-up[J]. Biol Med, 2012, 4(1): 51-59. https://xueshu.baidu.com/usercenter/paper/show?paperid=0e07c17bc3655a4c984b0912d2e362ae&site=xueshu_se
[4] 程莹寅, 吴山功, 郑英珍, 等. 主养草鱼池塘底泥微生物群落多样性研究[J]. 淡水渔业, 2011, 41(6): 43-49. doi: 10.3969/j.issn.1000-6907.2011.06.008 [5] BLANCHETON J P, ATTRAMADAL K J K, MICHAUD L, et al. Insight into bacterial population in aquaculture systems and its implication[J]. Aquacult Eng, 2013, 53: 30-39. doi: 10.1016/j.aquaeng.2012.11.009
[6] TORSVIK V, DAAE F L, RA S, et al. Novel techniques for analysing microbial diversity in natural and perturbed environments[J]. J Biotechnol, 1998, 64(1): 53-62. doi: 10.1016/S0168-1656(98)00103-5
[7] KENNEDYA C. Bacterial diversity in agroecosystems[J]. Agric Ecosys Environ, 1999, 74(1/3): 65-76. doi: 10.1016/S0167-8809(99)00030-4
[8] 李晓, 李冰, 董玉峰, 等. 高产团头鲂池塘表层沉积物微生物群落的结构特征及组成多样性分析[J]. 水产学报, 2014, 38(2): 218-227. https://www.cnki.com.cn/Article/CJFDTOTAL-SCKX201402008.htm [9] BOWMAN J, MCCUAIG R. Biodiversity, community structural shifts, and biogeography of prokaryotes within Antarctic continental shelf sediment[J]. Appl Environ Microbiol, 2003, 69(5): 2463-2483. doi: 10.1128/AEM.69.5.2463-2483.2003
[10] SHI S, QU Y, ZHOU H, et al. Characterization of a novel cometabolic degradation carbazole pathway by a phenol-cultivated Arthrobacter sp. W1[J]. Bioresour Technol, 2015, 193: 281-287. doi: 10.1016/j.biortech.2015.06.106
[11] BULL A T, STACH J E M, WARD A C, et al. Marine actinobacteria: perspectives, challenges, future directions[J]. Antonie Van Leeuwenhoek, 2005, 87(1): 65-79. doi: 10.1007/s10482-004-6562-8
[12] SØRENSEN K B, CANFIELD A D E, TESKE A P, et al. Community composition of a hypersaline endoevaporitic microbial mat[J]. Appl Environ Microbiol, 2005, 71(11): 7352-7365. doi: 10.1128/AEM.71.11.7352-7365.2005
[13] MULDER A, VANDEGRAAF A A, ROBERTSON L A, et al. Anaerobicc ammonium oxidation discovered in a denitrifying fluidized bed reactor[J]. FEMS Microbiol Ecol, 1995, 16(3): 177-184. doi: 10.1111/j.1574-6941.1995.tb00281.x
[14] SLIKERS A O, DERWORT N, GOMEZ J L, et al. Completely autotrophic nitrogen removal over nitrite in one single reactor[J]. Water Res, 2002, 36(10): 2475-2482. doi: 10.1016/S0043-1354(01)00476-6
[15] THAMDRUP B, DALSGAARD T. Production of N2 through anaerobic ammonium oxidation coupled to nitrate reduction in marine sediments[J]. Appl Environ Microbiol, 2002, 68(3): 1312-1318. doi: 10.1128/AEM.68.3.1312-1318.2002
[16] DONG Y M, ZHANG Z J, JIN Y W, et al. Nitrification characteristics of nitrobacteria immobilized in waterborne Polyurethane in wastewater of corn-based ethanol fuel production[J]. J Environ Sci, 2012, 24(6): 999-1005. doi: 10.1016/S1001-0742(11)60893-0
[17] DWOKIN M. The prokaryotes: an evolving electronic resource for the microbiological community[M]. 3rd ed. New York: Springer, 2005: 3-19. doi: 10.1007/0-387-30742-7
[18] KOECK D E, PECHTL A, ZVERLOV V V, et al. Genomics of cellulolytic bacteria[J]. Curr Opin Biotechnol, 2014, 29: 171-183. doi: 10.1016/j.copbio.2014.07.002
[19] SALOMO S, MUNCH C, ROSKE I. Evaluation of the metabolic diversity of microbial communities in four different filter layers of a constructed wetland with vertical flow by BiologTM analysis[J]. Water Res, 2009, 43(18): 4569-4578. doi: 10.1016/j.watres.2009.08.009
[20] 孙刚, 房岩. 底栖动物的生物扰动效应[M]. 北京: 科学出版社, 2013: 16-17. https://xueshu.baidu.com/usercenter/paper/show?paperid=c5af07e0d213d554e7a5b845ae255428&site=xueshu_se [21] 闫法军, 填相利, 董双林, 等. 刺参养殖池塘水体微生物群落功能多样性的季节变化[J]. 应用生态学报, 2014, 25(5): 1499-1505. doi: 10.5846/stxb201211231655 [22] PAPASPYROU S, GREGERSEN T, KRISTENSEN E, et al. Microbial reaction rates and bacterial communities in sediment surrounding burrows of two nereidid polychaetes (Nereis diversicolor and N. virens)[J]. Mar Biol, 2005, 148(3): 541-550. doi: 10.1007/s00227-005-0105-3
[23] ZHOU H D, JIANG C L, ZHU L Q, et al. Impact of pond and fence aquaculture on reservoir environment[J]. Water Sci Eng, 2011, 4(1): 92-100. doi: 10.3882/j.issn.1674-2370.2011.01.009
[24] 牛宇峰. 刺参养殖池塘异养菌数量变动及区系组成的初步研究[D]. 青岛: 中国海洋大学, 2009: 8-10. https://www.docin.com/p-912963184.html [25] COLORN A, DIAMANT A, ELDAR A, et al. Streptococcus iniae infections in Red Sea cage-cultured and wild fishes[J]. Dis Aquat Organ, 2002, 49(3): 165-170. doi: 10.3354/dao049165
-
期刊类型引用(21)
1. 李金星,吴燕燕,王悦齐,杨少玲,王迪,麦志成. 响应面法优化海鲈鱼小片的品质改良工艺技术. 上海海洋大学学报. 2022(05): 1283-1294 .  百度学术
百度学术
2. 关睿,李琳,王建辉,蒙荣,黄轶群. 不同食盐添加量对冷藏草鱼品质的影响. 食品科学技术学报. 2020(05): 100-108+126 .  百度学术
百度学术
3. 贾成霞,曲疆奇,李永刚,胡庆杰,刘盼,杨慕,张清靖. 密云水库鲢鱼、鳙鱼营养成分分析与评价. 水产科学. 2019(01): 40-47 .  百度学术
百度学术
4. 刘书来,张振宇,唐文燕,赵丹丹,陈善平,隋闯,丁玉庭. 不冻液冻结乌鳢块冻藏过程中品质变化. 食品科学. 2019(01): 256-262 .  百度学术
百度学术
5. 吴燕燕,赵志霞,李来好,林婉玲,邓建朝,岑剑伟. 不同包装与贮藏条件对两种低盐腌制罗非鱼片的品质影响. 食品科学. 2019(09): 241-247 .  百度学术
百度学术
6. 林婉玲,丁莫,杨贤庆,王锦旭,李来好,翟红蕾,吴燕燕,马学军. 紫苏水提物联合蒸煮处理对脆肉鲩鱼片冻藏过程中品质的影响. 食品科学. 2019(13): 237-244 .  百度学术
百度学术
7. 魏涯,黄卉,李来好,杨贤庆,翟红蕾,林婉玲,郝淑贤. 宰前预冷处理对大口黑鲈冰藏品质的影响. 南方水产科学. 2019(06): 81-87 .  本站查看
本站查看
8. 吴燕燕,朱小静,李来好,杨贤庆,胡晓,林婉玲,荣辉. 比较调理啤酒鲈鱼片在不同贮藏条件下的品质变化. 食品科学. 2018(11): 214-220 .  百度学术
百度学术
9. 冯静,林婉玲,李来好,杨贤庆,王锦旭,黄卉,胡晓,郝淑贤,吴燕燕. 草鱼脆化过程中腹内脂肪酸组成变化. 食品工业科技. 2017(02): 63-68 .  百度学术
百度学术
10. 丁莫,林婉玲,李来好,杨贤庆,王锦旭,胡晓,吴燕燕,郝淑贤,黄卉. 紫苏叶水提物对调理脆肉鲩鱼片冷藏过程中品质的影响. 食品工业科技. 2017(23): 250-255 .  百度学术
百度学术
11. 曹松敏,吴燕燕,李来好,林婉玲,陈胜军,赵永强. 蓝圆鲹传统腌干过程中内源脂肪酶和脂质降解氧化的变化分析. 食品科学. 2017(07): 36-42 .  百度学术
百度学术
12. 郝淑贤,刘奇,李来好,林婉玲,魏涯,赵永强,岑剑伟,袁小敏. 鲟鱼肉冷藏期间腥味及品质变化. 食品与发酵工业. 2016(07): 242-246 .  百度学术
百度学术
13. 何丹,郝淑贤,魏涯,李来好,杨贤庆,黄卉,林婉玲. 鲟鱼籽酱(Huso dauricus × Acipenser schrenckii)冷藏期间脂肪酸组成的变化. 食品工业科技. 2015(11): 319-323 .  百度学术
百度学术
14. 游刚,吴燕燕,李来好,杨贤庆,陈胜军,戚勃. 接种乳酸菌对腌干鱼总脂肪及游离脂肪酸的影响. 食品工业科技. 2015(11): 292-295+340 .  百度学术
百度学术
15. 李晓燕,郝淑贤,李来好,杨贤庆,黄卉,魏涯. 热熏鲟鱼加工过程中的品质变化. 食品工业科技. 2015(19): 73-77 .  百度学术
百度学术
16. 董艺伟,郭全友,李保国,姜朝军,顾天生. 加工过程与贮藏温度对淡腌青鱼品质变化与优势腐败菌种群变化的影响. 食品工业科技. 2015(23): 306-310+315 .  百度学术
百度学术
17. 伍芳芳,林婉玲,李来好,杨贤庆,郝淑娴,杨少玲,胡晓,王锦旭,魏涯. 草鱼脆化过程中肌肉胶原蛋白、矿物质含量和脂肪酸组成变化. 食品科学. 2015(10): 86-89 .  百度学术
百度学术
18. 蔡秋杏,吴燕燕,李来好,杨贤庆,赵永强,王悦齐. 厦门白姑鱼腌制加工过程中的脂肪酸变化分析. 食品科学. 2015(12): 76-81 .  百度学术
百度学术
19. 胡晓亮,王易芬,郑晓伟,沈建. 抗冻剂在水产品冻藏中的应用研究. 中国农学通报. 2015(35): 38-42 .  百度学术
百度学术
20. 林婉玲,杨贤庆,宋莹,胡晓,李来好,魏涯,杨少玲,郝淑贤,吴燕燕,黄卉. 浸渍冻结对调理草鱼块冻藏过程中品质的影响. 现代食品科技. 2014(10): 80-87 .  百度学术
百度学术
21. 武华,洪惠,罗永康,沈慧星. 冻藏温度对鳙鱼片脂质特性变化的影响. 中国农业大学学报. 2014(06): 173-178 .  百度学术
百度学术
其他类型引用(8)




 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
