Cloning and expression analysis of PmUbS27 gene of black tiger shrimp (Penaeus monodon)
-
摘要:
从构建的斑节对虾(Penaeus monodon)肝胰腺转录组数据中筛选出泛素核糖体融合蛋白UbS27基因(ubiquitin/ribosomal S27 fusion protein,PmUbS27)片段,利用SMART-RACE技术克隆出PmUbS27基因cDNA全长,并利用软件对其结构进行分析;利用实时荧光定量技术检测PmUbS27基因在斑节对虾不同组织及卵巢不同发育期的表达情况。结果显示,PmUbS27基因cDNA全长为514 bp,开放阅读框465 bp,编码154个氨基酸,含有泛素(1~72 aa)和核糖体蛋白(101~147 aa)2个结构域。以DNA为模板克隆得到的基因序列由3个内含子和4个外显子组成。实时荧光定量结果显示, PmUbS27基因在斑节对虾各组织中均有表达,但是在卵巢中表达量最高,其次为肝胰腺、血淋巴和精巢。PmUbS27在卵巢发育前期(Ⅱ期)和成熟期(Ⅴ期)的表达量显著高于其他各期(P < 0.05)。结果表明,PmUbS27参与斑节对虾卵巢发育的过程并可能在卵巢发育进程中起到重要的调控作用。
Abstract:We screened the ubiquitin/ribosomal S27 fusion protein (PmUbS27) from hepatopancreas transcriptome data of Penaeus monodon and cloned the full-length PmUbS27 cDNA sequence by SMART-RACE technology. Besides, we studied the expression of ovaries of PmUbS27 gene at different developmental stages and in different tissues by real-time quantitative detection. The PmUbS27 cDNA was 514 base pairs (bp) long, containing a 3′-UTR of 39 nucleotides and a 465 bp open reading frame (ORF) encoding a 154 amino acid polypeptide. The PmUbS27 protein contained the conserved Ub domain and ribosome structure. The DNA-cloned gene sequence consisted of four exons and three introns. PmUbS27 mRNA was ubiquitously detected in all tested tissues, comparatively high in the ovary, hepatopancreas and lymph. The expression level of PmUbS27 mRNA was significantly higher in ovary at Stage Ⅱ and Stage Ⅴ (P < 0.05). It is showed that PmUbS27 had an important role in oogenesis of P. monodon.
-
泛素-蛋白酶体途径(ubiquitin/proteasome pathway,UPP)是由以色列科学家HERSHKO、CIECHANOVER和美国科学家ROSE发现的泛素调节蛋白质降解的途径[1]。在UPP途径中泛素通过分别与泛素激活酶(E1)、泛素结合酶(E2)、泛素连接酶(E3)之间进行一系列级联反应,最后以单体或不同结构的多泛素聚合链的形式结合在底物蛋白上,再经过蛋白酶体26S将蛋白降解[2]。同时UPP途径对蛋白的选择性降解是通过蛋白泛素化区域和多泛素链结构来完成的[3]。UPP参与多种细胞活动,如细胞周期调控、膜受体内吞作用、基因的转录与表达等,它通过降解细胞活动中各个通路的抑制因子或激活因子发挥相应的调节作用。泛素是一个由76个氨基酸组成的高度保守的蛋白,广泛存在于真核和原核生物细胞中,是UPP通路中的重要组成部分。泛素前体有3种形式:1种是相同泛素单体串联形成的泛素聚合体;另外2种是泛素分子N-端分别与L40或S27核糖体融合形成的泛素融合蛋白[4]。融合蛋白UbS27是泛素前体中一种,由泛素结构域和核糖体S27结构域两部分组成,泛素融合蛋白UbS27碳末端的双甘氨肽能被特定的肽链内切酶识别并剪切,释放出成熟的泛素单体[5],释放的泛素单体进一步参与生物细胞内蛋白质的降解。
目前泛素在动物生殖繁育调控中的研究取得了较大的进展。有研究证明UPP参与一些动物配子的发生。失活的泛素结合DNA修复酶HR6B会导致雄性小鼠不育,说明这种失活泛素的结合作用在小鼠的生殖活动中具有重要的作用[6]。IHARA等[7]在生长和发育过程中的小鼠卵母细胞核小体中发现了UBE2I表达,UBE2I可以诱导基因的转录,并对卵母细胞中基因表达调控蛋白起到SUMO作用。GU等[8]发现UCHL1蛋白在小鼠青春早期异常的卵母细胞中的表达量变化显著,推测UCHL1在介导异常卵母细胞凋亡中具有重要的作用。周鹏等[9]在大黄鱼(Larimichthys crocea)性腺中中筛选出性腺发育相关基因UBE2D和UBC9基因,发现该基因在性腺中表达量明显高于其他组织。同时,泛素在甲壳动物中的研究也相继展开,WANG等[10]研究发现泛素融合蛋白UbL40和UbS27基因在中华绒螯蟹(Eriocheir sinensis)性腺中均有较高的表达量,并推测这两种基因与中华绒螯蟹的性腺发育有密切关系。戴燕彬等[11]研究发现拟穴青蟹(Scylla paramamosain)泛素基因对其生殖细胞的生长和发育有重要作用。韩坤煌[12]在拟穴青蟹的EST文库筛选出UB、UCE2、UCHL3和UCHL5等泛素相关基因,表达结果显示这些基因可能与性腺发育有密切关系。
目前,泛素融合蛋白基因在斑节对虾(Penaeus monodon)性腺发育中的作用未见报道。该实验从斑节对虾转录组数据中筛选获得泛素核糖体融合蛋白PmUbS27基因,通过对PmUbS27的基因克隆、序列分析及定量分析,初步了解PmUbS27基因在卵巢发育中的表达特征,其结果可为探讨PmUbS27及其介导的UPP途径在斑节对虾卵巢发育中的作用提供基础资料。
1. 材料与方法
1.1 材料
从海南省三亚市购买的斑节对虾(平均体质量80~200 g),卵巢发育阶段判断依据黄建华等[13]的研究,室内暂养3 d后取样,冰浴麻醉后取脑、心脏、胃、肌肉、胸腹神经、肝胰腺、肠、鳃、血、淋巴、精巢、卵巢组织, 并分各时期取卵巢组织,每组设5个平行(每组平行取3份备用),取出的样品立即放入液氮速冻,然后置-80 ℃冰箱中保存备用。
1.2 方法
1.2.1 斑节对虾RNA的提取及逆转录
根据TRIzol(Life Technology)说明书提取斑节对虾的卵巢发育各期总RNA和各组织总RNA,取2 μL总RNA样品用1.2%琼脂糖凝胶电泳检测所提取的RNA的质量。用核酸蛋白分析仪Nanodrop 2000(Thermo)检测其浓度及光密度OD260/OD280比值以验证其纯度。取5 μg从肝胰腺中提取的总RNA用SMARTTM cDNA kit(TaKaRa公司)进行逆转录合成cDNA,用于基因片段的克隆,用TaKaRa公司的Prime ScriptTMReal-time PCR Kit逆转录试剂盒进行cDNA的合成,用于实时荧光定量PCR。
1.2.2 RACE获得PmUbS27全长
斑节对虾的泛素核糖体融合蛋白S27序列从斑节对虾肝胰腺转录组数据文库中筛选出来,得到了该基因5′端部分序列,并验证了5′端部分序列正确性。实验中以斑节对虾3′RACE cDNA为模板,UbS27-rF1(表 1)和试剂盒中的UPM为引物进行第一次特异性扩增。25 μL反应体系为16 μL RNase Free dH2O,2.5 μL 10×PCR Buffer,2 μL dNTP Mix(2.5 mmol · L-1),1 μL 3′cDNA,0.5 μL UbS27-rF1 (10 mmol · L-1), 2.5 μL UPM,0.5 μL ExTaq。PCR反应条件为94 ℃预变性3 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸3 min,5个循环;94 ℃变性30s,63 ℃退火30 s,72 ℃延伸3 min,5个循环;94 ℃变性30 s,61 ℃退火30 s,72 ℃延伸3 min,25个循环;72 ℃延伸3 min, 4 ℃保存。第一次扩增产物稀释50倍,以该稀释产物为模板,UbS27-rF2和NUP为引物进行第二次特异扩增。反应体系和反应条件同第一次扩增(退火温度为61 ℃)。取5 μL第二次扩增产物用1.5%的琼脂糖凝胶进行电泳检测,割胶回收PCR产物,然后将胶回收产物与pMD18-T载体(TaKaRa公司)16 ℃连接过夜,转化到感受态细胞(DH5α)中,涂板,37 ℃培养过夜,挑取阳性克隆进行测序。
表 1 所用引物序列Table 1 Primers used in this study引物名称primer 引物序列primer sequence UbS27-F CCATGCAGATCTTCGTTA UbS27-R CATCAACTTTATTCTGGCT UbS27-rF1 CGTGAGTGTCCCAGTGACGAGTG UbS27-rF2 TGGAAGATGCCACTTGACTTTTGTCT UbS27-qF GTGAGTGTCCCAGTGACGAGTG UbS27-qR AAAGACAAAAGTCAAGTGGCATC β-actin-qF GCCCTTGCTCCTTCCACTATC β-actin-qR CCGGACTCTTCGTACTCATCCT 1.2.3 PmUbS27的cDNA及DNA克隆
以斑节对虾cDNA和DNA为模板, 以UbS27-F、UbS27-R (表 1)为引物,分别在25 μL的体系中进行PCR扩增,扩增体系为去离子水18.2 μL,10×Ex buffer 2.5 μL,dNTP 2 μL,引物各0.5 μL,cDNA模板1 μL,ExTaq 0.3 μL。PCR的扩增条件为94 ℃预变性3 min;94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min;4 ℃保存。按上述步骤进行PCR产物回收,克隆及测序。
1.2.4 序列及系统发生分析
利用NCBI数据库中VecScreen (http://www.ncbi.nlm.nih.gov/VecScreen/VecScreen.html)、Blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi)、ORF Finder (http://www.ncbi.nlm.nih.gov/projects/gorf/orfig.cgi) 等软件分析测序结果,利用DNAman软件进行序列拼接,利用ExPASY软件(http://web.expasy.org/compute_pi/) 进行等电点及分子量的预测,使用NCBI BLAST工具栏分析所得序列和其他物种的蛋白质序列相似度(http://www.ncbi.nlm.nih.gov/BLAST/),使用Expasy软件(http://prosite.expasy.org/)进行功能位点的分析,利用NetPhos 2.0 server程序查找磷酸化位点,用SMART软件进行蛋白结构域和功能域的预测和分析,用PSIPRED Protein Structure Prediction Server网站(http://bioinf.cs.ucl.ac.uk/psipred/)进行蛋白质二级结构的预测,采用SWISS-MODEL(http://swissmodel.expasy.org/)进行蛋白质三级结构的预测。在NCBI的Protein Blast数据库中搜索其他物种的UBS27蛋白序列,用Clustal X软件进行多序列比对,MEGA 5.0进行聚类分析, 并采用Neighbour-Joining方法构建系统发生树。
1.2.5 PmUbS27在斑节对虾各组织中的表达情况
以各组织和卵巢发育各期的cDNA第一条链为模板,设计扩增产物为95 bp的定量PCR引物,以EF1α为内参基因,每个样品进行3次重复。按照2-△△CT来计算各组织表达水平。反应体系为20 μL,10 μL 2× SYBR Premix Ex Taq,0.5 μL UbS27-qF,0.5 μL UbS27-qR,2 μL cDNA模板,16.7 μL RNase Free dH2O。反应条件为95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火20 s,40个循环;65 ℃延伸15 s;40 ℃冷却5 min。实验数据用平均值±标准差(X±SD)表示,采用SPSS 18.0软件进行单因素方差分析(One-Way ANOVA),当P < 0.05表示为显著性差异。
2. 结果
2.1 斑节对虾PmUbS27基因的克隆与序列分析
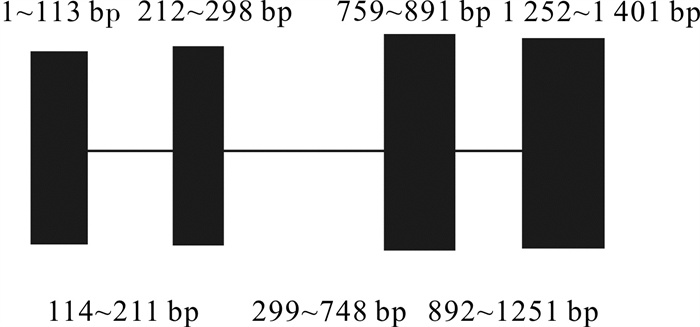
斑节对虾PmUbS27基因cDNA全长514 bp(GenBank:KR106186),开放阅读框长465 bp,编码154个氨基酸,其蛋白分为泛素(1~72 aa)和核糖体蛋白(101~147 aa)2个结构域,5′非编码区10 bp,3′非编码区39 bp,在27 bp的poly(A)尾前10 bp处有个加尾信号。预测等电点为9.78,分子量为41.042 kD(图 1)。序列含有5个磷酸化位点(Thr22、Ser57、Tyr85、Thr87和Ser123),1个由4个的半胱氨酸残基构成的C2-C2型锌指结构,在泛素结构域末端有一个由2个甘氨酸形成的双甘氨肽(Gly74-Gly75)。利用UbS27-F/R引物,在基因组DNA上扩增出PmUbS27基因序列全长为1 401 bp,由3个内含子和4个外显子组成(图 2)。其中114~211 bp、299~760 bp、892~1 251 bp分别为3个内含子。第一、第二个内含子区域符合GT-AG规律,第三个内含子为AT-AT。
![]() 图 1 斑节对虾PmUbS27基因cDNA全长序列及编码的氨基酸序列cDNA序列长度在两侧标注,泛素蛋白结构域用下划线表明,核糖体蛋白结构域用双下划线表明,波浪线标注的是双甘氨肽,磷酸化位点加粗斜体表示,构成C2-C2锌指结构的半胱氨酸残基用黑色圆圈标明,AATAAA磷酸化信号序列用黑色方框标注,Poly(A)用阴影字体表示Fig. 1 Nucleotide and deduced amino acid sequences of PmUbS27Numbers on both sides are the lengths of cDNA. Ubiquitin domains are underlined and ribosomal S27 domains are double-underlined. Glycylglycine is wavy lined. Phosphorylation sites are in bold font. Black circles represent C2-C2 zinc finger constituted by cysteine residue. Black box indicates AATAAA polyadenylation signal sequence. Poly (A) signal sequence is in shadow.
图 1 斑节对虾PmUbS27基因cDNA全长序列及编码的氨基酸序列cDNA序列长度在两侧标注,泛素蛋白结构域用下划线表明,核糖体蛋白结构域用双下划线表明,波浪线标注的是双甘氨肽,磷酸化位点加粗斜体表示,构成C2-C2锌指结构的半胱氨酸残基用黑色圆圈标明,AATAAA磷酸化信号序列用黑色方框标注,Poly(A)用阴影字体表示Fig. 1 Nucleotide and deduced amino acid sequences of PmUbS27Numbers on both sides are the lengths of cDNA. Ubiquitin domains are underlined and ribosomal S27 domains are double-underlined. Glycylglycine is wavy lined. Phosphorylation sites are in bold font. Black circles represent C2-C2 zinc finger constituted by cysteine residue. Black box indicates AATAAA polyadenylation signal sequence. Poly (A) signal sequence is in shadow.2.2 PmUbS27的二级结构及三级结构预测
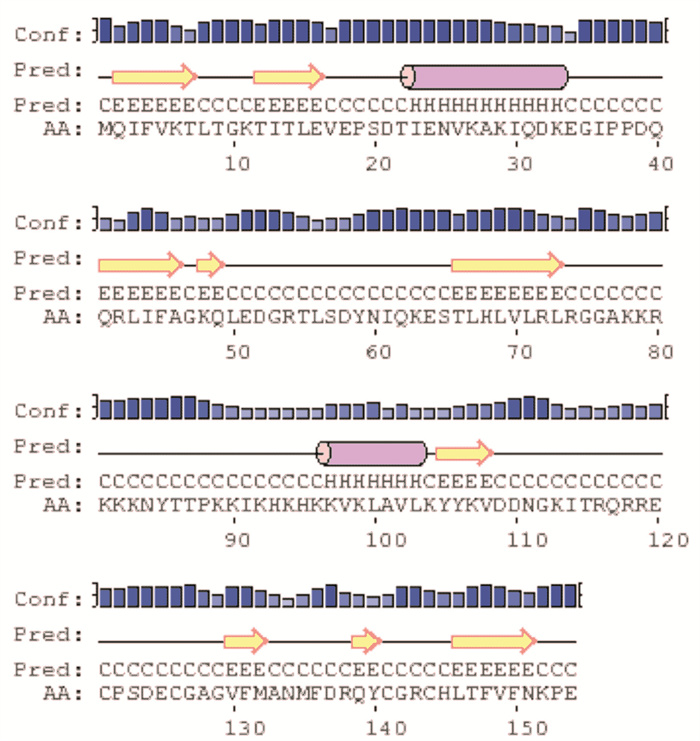
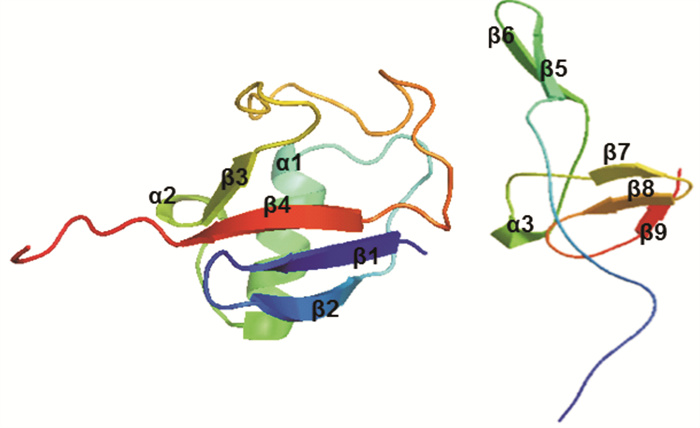
利用二级结构预测网站对斑节对虾的PmUbS27氨基酸序列进行二级结构的预测,分析结果发现PmUbS27的二级结构主要是由α-螺旋、β-片层和无规则卷曲组成(图 3)。泛素结构域主要由5个β-片层、1个α-螺旋和连接的无规则卷曲构成,而核糖体蛋白S27结构域由4个β-片层、1个α-螺旋和连接的无规则卷曲构成。利用SWISS-MODEL网站进行PmUbS27蛋白质三级结构的预测。泛素结构域的三维结构由2个α-螺旋和4个β-折叠构成一个“泛素折叠”,并在结构末端伸出泛素碳末端的延伸部分;核糖体S27结构域由5个β-折叠和1个α-螺旋构成(图 4)。
2.3 多重序列比对
利用MEGE 5.0软件,将PmUBS27与NCBI上其他物种的该蛋白序列进行序列比对(图 5),结果显示不同物种的泛素-核糖体融合蛋白基因的前76 aa的泛素结构域保守性特别高,仅有4个氨基酸存在差异。后面的羧基末端核糖体蛋白序列相似度虽然不是很高,但其构成C2-C2锌指结构的4个半胱氨酸残基高度保守。与斑节对虾的UbS27氨基酸序列同源性最高的是克氏原螯虾(Procambarus clarkii,AEB54653),同源性达到99.35%;其次是中华绒螯蟹(ADF45325), 同源性为98.05%;与文昌鱼(Branchiostoma belcheri tsingtauense, AAL55470)的同源性为93.51%;与长牡蛎(Crassostrea gigas, AFI80900)的同源性为92.86%;与肩突硬蜱(Ixodes scapularis, AAY66925)的同源性为91.56%;与人类(Homo sapiens, NP_ 002945)、啄木鸟(Picoides pubescens, KFV68543)、小家鼠(Mus musculus, NP_ 077239)、斑马鱼(Danio rerio, NP_ 9S6796)、变异革蜱(Dermacentor variabilis, ACF35544)的同源性为90.91%。
2.4 进化树构建
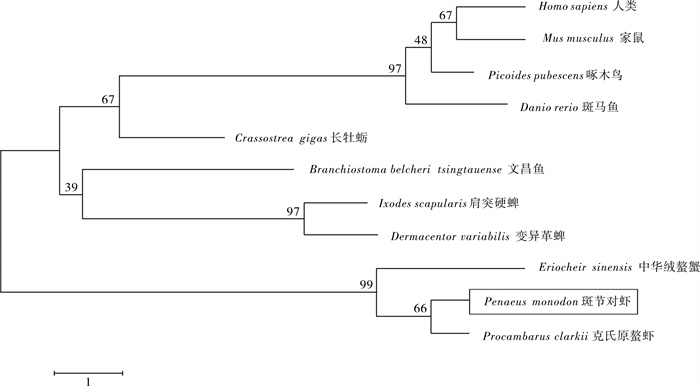
用MEGA 5.0软件构建斑节对虾UbS27与其他物种的系统发育树(所用序列同图 5),如图 6所示该进化树中甲壳纲中斑节对虾和克氏原螯虾、中华绒螯蟹聚为一支,具有较近的亲缘关系,与人类的亲缘关系最远,符合生物群体进化的规律。
2.5 斑节对虾PmUbS27基因的表达情况
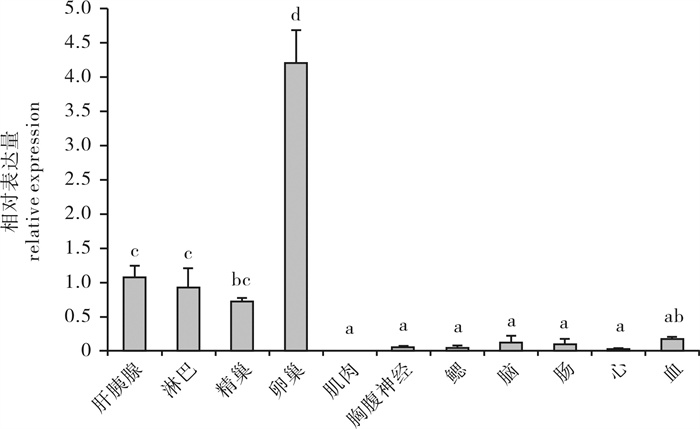
2.5.1 斑节对虾PmUbS27基因在各组织中的表达情况
实时荧光定量PCR检测斑节对虾PmUbS27基因在不同组织中的表达水平(图 7),以β-actin为内参基因,设定肝胰腺组织表达水平为1,PmUbS27基因在斑节对虾所检测的11种组织(脑、胸腹神经、心脏、肝胰腺、肠、肌肉、血、淋巴、鳃、精巢和卵巢等)中均有表达,在卵巢中表达水平最高,肝胰腺和淋巴次之,与其他组织的表达水平有显著性差异(P < 0.05)。
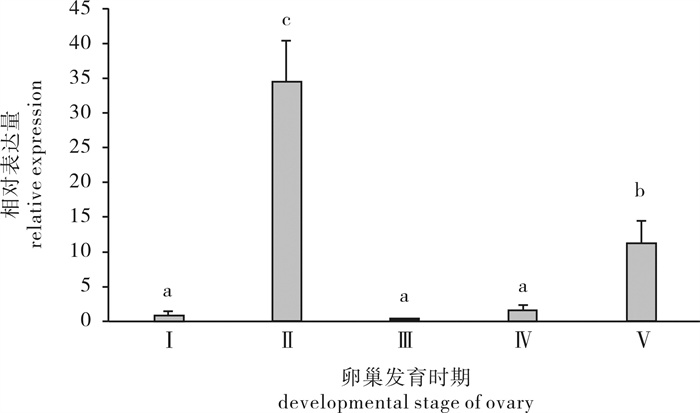
2.5.2 斑节对虾PmUbS27基因在卵巢发育各期的表达情况
用实时荧光定量PCR检测PmUbS27基因在斑节对虾不同的卵巢发育时期的表达水平变化,设定卵巢发育Ⅰ期PmUbS27基因表达水平为1,结果显示在斑节对虾卵巢的不同发育时期PmUbS27基因的表达呈现周期性变化(图 8)。PmUbS27在Ⅰ期时表达量很低,在卵巢发育前期Ⅱ期中表达骤然升高(P < 0.05),并达到峰值,为Ⅰ期的36倍,随后在Ⅲ期和Ⅳ期显著下降,恢复发育前的水平,但在成熟期Ⅴ期又显著升高,为Ⅰ期的12倍。
3. 讨论
UPP途径是生物重要的蛋白水解途径,UbS27作为UPP途径重要的组成部分——泛素的前体形式之一,对于UPP途径参与的细胞活动具有重要的作用。实验克隆了PmUbS27基因并预测了该基因编码的蛋白,其结构上存在5个磷酸化位点(Thr22、Ser57、Tyr85、Thr87、Ser123)和1个由4个半胱氨酸残基构成的C2-C2型锌指结构,在泛素结构域末端有一个由2个甘氨酸形成的双甘氨肽结构(Gly74-Gly75),这种结构与中华绒螯蟹泛素融合蛋白UbS27结构相似[14]。核糖体蛋白S27结构域行使分子伴侣功能,可以促进核糖体结构的组装,研究发现在出芽生殖的酵母细胞中,核糖体结构S27负责游离泛素的聚集[15-16]。在特异性的肽链内切酶剪切下泛素核糖体融合蛋白S27能释放出成熟的泛素分子,而S27核糖体部分会成为80S核糖体的组分。同时,锌指结构是一种调控基因转录的重要功能结构[17],表明PmUbS27可能参与斑节对虾卵巢发育中功能蛋白的转录调控。
UbS27在不同物种之间高度保守,进化树分析结果与多重序列比对结果一致,同属于甲壳动物纲的几个物种亲缘关系较近,聚为一支,与传统分类学和进化观点相统一。表明PmUbS27在序列进化上的高度保守性。人类泛素蛋白为球状结构,主要由5个β-折叠和1个α-螺旋构成,其中α-螺旋与β-折叠呈对角线形式结合[18],该实验中预测PmUbS27蛋白的二级结构和三级结构空间模拟图结果与其他人预测结果相似(图 3,图 4),这表明泛素蛋白在各物种间功能上也是高度保守的。
泛素蛋白广泛分布在机体内,在各组织中均有表达,约占细胞总蛋白含量的0.1%~5%[19]。已有研究发现在中华绒螯蟹各组织中,类泛素蛋白(EsSUMO)、泛素活化酶基因(EsUba2)和泛素结合酶基因(EsUbc9)在性腺组织中表达显著较高[20];陈丽丽[14]研究了中华绒螯蟹中泛素融合蛋白EsUbS27和EsUbL40基因在中华绒螯蟹各组织中的表达,发现两种基因在精巢、卵巢和副性腺中表达量显著较高,这些研究可以说明泛素相关蛋白在性腺发育过程中可能具有某种重要的作用。该实验中对PmUbS27基因在斑节对虾各组织的定量结果显示,在卵巢中的表达显著高于其他组织,其次为肝胰腺、淋巴和精巢。肝胰腺是卵巢发育过程中的重要支持组织,研究表明,卵黄蛋白原在卵巢发育初期的肝胰腺中大量表达并在发育过程中转运至卵巢中。PmUbS27在性腺及性腺支持组织中显著高表达,提示该基因与斑节对虾性腺发育可能具有一定相关性。
斑节对虾卵巢发育过程是卵子形成和卵黄物质积累的过程,在卵巢发育从Ⅰ期开始到Ⅱ期过程中,卵原细胞大量增殖并形成卵母细胞[13],卵母细胞的形成是通过减数分裂和有丝分裂来带动,同时减数分裂和有丝分裂是在一系列细胞周期蛋白调控下完成的。已有研究表明,细胞周期过程是一个精密而复杂的过程,其中细胞周期蛋白依赖激酶(CDKs)对于细胞周期进程具有重要的作用,CDKs能磷酸化并调节数百种蛋白的活性[23-25],同时CDKs功能的发挥也是在多种蛋白调控下完成的,如cyclins E[26]、CKIs、Wee1、Cdc25等。有研究发现,在细胞周期过程中大多数的细胞周期调控蛋白是通过UPP途径进行降解的[27],如细胞周期G1期细胞周期蛋白(cyclins)周期性的降解[28-29]。SAKAGUCHI等[30]发现泛素结合酶Ubp9在真菌的减数分裂和有丝分裂过程中具有调控作用。涂华玉[29]研究发现染色质组蛋白H2B泛素化修饰会影响酵母细胞减数分裂的进程,朱虎[30]发现泛素融合蛋白UFP与人的精子发生相关。ZHANG等[31]克隆了中华绒螯蟹泛素结合酶Ubc9基因,发现该基因在卵巢和精巢中表达显著且在卵巢发育Ⅲ-2期表达最高,并通过原位杂交在精子细胞和卵母细胞中发现了EsUbp9表达。以上研究表明泛素相关基因参与的泛素化作用与配子的发生具有紧密的联系。该实验的定量结果显示,PmUbS27基因在卵巢发育Ⅱ期表达量最高,在斑节对虾卵巢发育Ⅱ期大量的卵原细胞进行减数分裂和有丝分裂并形成卵母细胞,推测这个过程中PmUbS27作为成熟泛素单体的供体,大量表达并释放出泛素单体参与泛素化进程对细胞周期活动的调控, 对于斑节对虾卵母细胞的减数分裂和有丝分裂具有重要作用。与其他结果不同,实验中斑节对虾PmUbS27基因在卵巢发育Ⅱ期后开始降低,在卵巢发育Ⅴ期(成熟期)又显著升高且低于Ⅱ期,说明该基因可能参与了斑节对虾卵巢成熟期蛋白的表达调控,对斑节对虾卵巢成熟的进程具有一定作用。
综上所述,此实验克隆了斑节对虾UbS27基因的全长cDNA序列并分析了其DNA序列,初步了解了UbS27在组织中和卵巢发育期的表达特征,为进一步研究UbS27及其介导的UPP途径在卵巢发育中的作用与功能提供了参考,同时可以推测出PmUbS27基因对斑节对虾卵巢的发育、卵子发生可能具有一定的影响,但其具体的分子机制尚未清晰,需要进一步的研究与探索。
-
图 1 斑节对虾PmUbS27基因cDNA全长序列及编码的氨基酸序列
cDNA序列长度在两侧标注,泛素蛋白结构域用下划线表明,核糖体蛋白结构域用双下划线表明,波浪线标注的是双甘氨肽,磷酸化位点加粗斜体表示,构成C2-C2锌指结构的半胱氨酸残基用黑色圆圈标明,AATAAA磷酸化信号序列用黑色方框标注,Poly(A)用阴影字体表示
Figure 1. Nucleotide and deduced amino acid sequences of PmUbS27
Numbers on both sides are the lengths of cDNA. Ubiquitin domains are underlined and ribosomal S27 domains are double-underlined. Glycylglycine is wavy lined. Phosphorylation sites are in bold font. Black circles represent C2-C2 zinc finger constituted by cysteine residue. Black box indicates AATAAA polyadenylation signal sequence. Poly (A) signal sequence is in shadow.
表 1 所用引物序列
Table 1 Primers used in this study
引物名称primer 引物序列primer sequence UbS27-F CCATGCAGATCTTCGTTA UbS27-R CATCAACTTTATTCTGGCT UbS27-rF1 CGTGAGTGTCCCAGTGACGAGTG UbS27-rF2 TGGAAGATGCCACTTGACTTTTGTCT UbS27-qF GTGAGTGTCCCAGTGACGAGTG UbS27-qR AAAGACAAAAGTCAAGTGGCATC β-actin-qF GCCCTTGCTCCTTCCACTATC β-actin-qR CCGGACTCTTCGTACTCATCCT -
[1] 李炎武, 谭卫兵, 邝雪英, 等. 泛素调节的蛋白质降解——2004年诺贝尔化学奖简介[J]. 化学教育, 2004(11): 6-7, 32. doi: 10.3969/j.issn.1003-3807.2004.11.003 [2] KLEIGER G, MAYOR T. Perilous journey: a tour of the ubiquitin-proteasome system[J]. Trends Cell Biol, 2014, 24(6): 352-359. doi: 10.1016/j.tcb.2013.12.003
[3] XU P, DUONG D M, SEYFRIED N T, et al. Quantitative proteomics reveals the function of unconventional ubiquitin chains in proteasomal degradation[J]. Cell, 2009, 137(1): 133-145. doi: 10.1016/j.cell.2009.01.041
[4] NENOI M, ICHIMURA S, MITA K. Interspecific comparison in the frequency of concerted evolution at the polyubiquitin gene locus[J]. J Mol Evol, 2000, 51(2): 161-165. doi: 10.1007/s002390010076
[5] JONES D, CANDIDO E P. Novel ubiquitin-like ribosomal protein fusion genes from the nematodes Caenorhabditis elegans and Caenorhabditis briggsae[J]. J Biol Chem, 1993, 268(26): 19545-19551. doi: 10.1016/S0021-9258(19)36550-0
[6] ROEST H P, van KLAVEREN J, de WIT J, et al. Inactivation of the HR6B ubiquitin-conjugating DNA repair enzyme in mice causes male sterility associated with chromatin modification[J]. Cell, 1996, 86(5): 799-810. doi: 10.1016/S0092-8674(00)80154-3
[7] IHARA M, STEIN P, SCHULTZ R M. UBE2I (UBC9), a SUMO-conjugating enzyme, localizes to nuclear speckles and stimulates transcription in mouse oocytes[J]. Biol Reprod, 2008, 79(5): 906-913. doi: 10.1095/biolreprod.108.070474
[8] GU Y Q, CHEN Q J, GU Z, et al. Ubiquitin carboxyl-terminal hydrolase L1 contributes to the oocyte selective elimination in prepubertal mouse ovaries[J]. Acta Physiologica Sinica, 2009, 61(2): 175-184. https://pubmed.ncbi.nlm.nih.gov/19377830/
[9] 周鹏. 若干大黄鱼性腺发育相关基因的克隆与表达[D]. 厦门: 集美大学, 2009: 56-62. 10.7666/d.d161698 [10] WANG Q, CHEN L, WANG Y, et al. Expression characteristics of two ubiquitin/ribosomal fusion protein genes in the developing testis, accessory gonad and ovary of Chinese mitten crab, Eriocheir sinensis[J]. Mol Biol Rep, 2012, 39(6): 6683-6692. doi: 10.1007/s11033-012-1474-6
[11] 戴燕彬, 韩坤煌, 颜素芬, 等. 拟穴青蟹泛素基因的克隆及其在性腺发育过程中的表达[J]. 中国水产科学, 2012, 19(6): 946-955. https://lib.cqvip.com/Qikan/Article/Detail?id=43899732 [12] 韩坤煌. 拟穴青蟹细胞周期及泛素系统若干基因参与性腺发育的研究[D]. 厦门: 集美大学, 2010: 75-80. 10.7666/d.D350631 [13] 黄建华, 马之明, 周发林, 等. 南海北部野生斑节对虾卵巢解剖结构及组织学的研究[J]. 南方水产, 2005, 1(3): 49-53. doi: 10.3969/j.issn.2095-0780.2005.03.008 [14] 陈丽丽. 中华绒螯蟹泛素融合蛋白基因的克隆及表达分析[D]. 上海: 华东师范大学, 2012: 36-53. https://cdmd.cnki.com.cn/Article/CDMD-10269-1012434236.htm [15] CATIC A, PLOEGH H L. Ubiquitin-conserved protein or selfish gene?[J]. Trends Biochem Sci, 2005, 30 (11): 600-604. doi: 10.1016/j.tibs.2005.09.002
[16] FINLEY D, BARTEL B, VARSHAVSKY A. The tails of ubiquitin precursors are ribosomal-proteins whose fusion to ubiquitin facilitates ribosome biogenesis[J]. Nature, 1989, 338(6214): 394-401. doi: 10.1038/338394a0
[17] 余晓丹, 沈晓明, 颜崇淮. 锌指蛋白结构和功能研究进展[J]. 国外医学卫生学分册, 2004, 31(3): 171-175. https://d.wanfangdata.com.cn/periodical/Ch9QZXJpb2RpY2FsQ0hJTmV3UzIwMjQxMTA1MTcxMzA0EhFnd3l4LXdzeDIwMDQwMzAxMBoIcXM0OThsbWY%3D [18] BYSTROFF C, THORSSON V, BAKER D. HMMSTR: a hidden Markov model for local sequence-structure correlations in proteins[J]. J Mol Biol, 2000, 301(1): 173-190. doi: 10.1006/jmbi.2000.3837
[19] OSAKA H, WANG Y L, TAKADA K, et al. Ubiquitin carboxy-terminal hydrolase L1 binds to and stabilizes monoubiquitin in neuron[J]. Hum Mol Genet, 2003, 12(16): 1945-1958. doi: 10.1093/hmg/ddg211
[20] 王莹. 中华绒整蟹类泛素化修饰(SUMOylation)途径相关基因的克隆及表达分析[D]. 上海: 华东师范大学, 2012: 52-64. http://xueweilunwen.com/doc/1667935 [21] HOLT L J, TUCH B B, VILLEN J, et al. Global Analysis of Cdk1 substrate phosphorylation sites provides insights into evolution[J]. Science, 2009, 325(5948): 1682-1686. doi: 10.1126/science.1172867
[22] UBERSAX J A, WOODBURY E L, QUANG P N, et al. Targets of the cyclin-dependent kinase Cdk1[J]. Nature, 2003, 425(6960): 859-864. doi: 10.1038/nature02062
[23] DEPHOURE N, ZHOU C S, VILLÉN J, et al. A quantitative Atlas of mitotic phosphorylation[J]. Proc Natl Acad Sci, 2008, 105(31): 10762-10767. doi: 10.1073/pnas.0805139105
[24] 戴文婷, 傅明骏, 赵超, 等. 斑节对虾CDK2基因全长cDNA克隆及表达分析[J]. 南方水产科学, 2015, 11(2): 1-11. doi: 10.3969/j.issn.2095-0780.2015.02.001 [25] YEN H C, XU Q, CHOU D M, et al. Global protein stability profiling in mammalian cells[J]. Science, 2008, 322(593): 918-923. doi: 10.1126/science.1160489
[26] BLOOM J, CROSS F R. Multiple levels of cyclin specificity in cell-cycle control[J]. Nat Rev Mol Cell Biol, 2007, 8(2): 149-160. doi: 10.1038/nrm2105
[27] MALUMBRES M, BARBACID M. Cell cycle, CDKs and cancer: a changing paradigm[J]. Nat Rev Cancer, 2009, 9(3): 153-166. doi: 10.1038/nrc2602
[28] SAKAGUCHI K, KOSHIYAMA A, IWABATA K. Meiosis and small ubiquitin-related modifier (SUMO)-conjugating enzyme, Ubc9[J]. FEBS J, 2007, 274(14): 3519-3531. doi: 10.1111/j.1742-4658.2007.05905.x
[29] 涂华玉. 组蛋白H2B泛素化修饰在减数分裂过程中作用的初步研究[D]. 合肥: 中国科学技术大学, 2011: 36-41. 10.7666/d.y2029950 [30] 朱虎. 精子发生相关基因的克隆及功能研究[D]. 南京: 南京医科大学, 2002: 73-82. https://d.wanfangdata.com.cn/thesis/ChhUaGVzaXNOZXdTMjAyNDA5MjAxNTE3MjUSB1k0NTM2MTMaCHFtc2VicDNz [31] ZHANG F, CHEN L, WU P, et al. cDNA cloning and expression of Ubc9 in the developing embryo and ovary of Oriental river prawn, Macrobrachium nipponense[J]. Comp Biochem Physiol B, 2010, 155(3): 288-293. doi: 10.1016/j.cbpb.2009.11.013
-
期刊类型引用(0)
其他类型引用(3)



 下载:
下载:


 粤公网安备 44010502001741号
粤公网安备 44010502001741号
