Influence of dissolved aluminum on marine phytoplankton community structure and growth of Synechococcus sp.
-
摘要:
通过现场一次性和半连续培养实验研究了溶解态铝(Al3+)对海洋浮游植物的影响。结果表明,Al通过抑制束毛藻(Trichodesmium sp.)的生长使micro级浮游植物的总丰度下降,导致硅藻和甲藻的比重增加,进而改变micro级浮游植物的群落结构。而对pico级浮游植物的生长则具有先抑制后促进的作用,在培养后期通过促进聚球藻(Synechococcus sp.)的生长使总丰度增加。并且,在溶解态Al的长期作用下聚球藻的生长仍受到了明显的促进作用,尤其20 μmol · L-1的Al显著促进了pico级浮游植物的总丰度及聚球藻的生长(P < 0.05)。溶解态Al对聚球藻生长的促进作用是通过促进其藻红蛋白、藻蓝蛋白、别藻蓝蛋白和叶绿素a 4种光色素的合成,使光合系统Ⅱ(PSⅡ)的最大光能转化效率增大,进而使聚球藻的比生长速率及总丰度升高。同时,Al在促进聚球藻分裂生长的同时也促进了单位细胞内有机碳的积累。
-
关键词:
- 溶解态铝 /
- micro级浮游植物 /
- pico级浮游植物 /
- 聚球藻 /
- 光合作用
Abstract:We investigated the preliminary mechanisms of dissolved aluminum (Al3+) on marine phytoplankton through field and laboratory incubation experiments. Results from in situ experiments indicate that dissolved Al decreased the total abundance of micro-phytoplankton by inhibiting the growth of cyanophyta Trichodesmium sp.; the ratio of diatoms and dinoflagellates to total phytoplankton increased, leading to the change of micro-phytoplankton community structure. Whereas, the growth of Synechococcus was promoted after initial inhibition by Al, which resulted in the increasing of total abundance of pico-phytoplankton. Additionally, the stimulatory effects of Al on Synechococcus was observed under semi-continuous culture condition; especially in 20 μmol · L-1 Al-treated group, the significant promotion of total pico-phytoplankton abundance and growth of Synechococcus were detected (P < 0.05). The growth of Synechococcus and the maximum quantum efficiency of photosynthesis II after long-term cultivation in dissolved Al were promoted by enhancing photosynthesis due to the increase of four photosynthetic pigments including phycoerythrin, phycocyanin, allophycocyanin and chlorophyll a. The higher Al conditions resulted in higher growth rate in exponential phase and biomass in stationary phases as well as intracellular organic carbon accumulation.
-
Keywords:
- dissolved aluminum /
- micro-phytoplankton /
- pico-phytoplankton /
- Synechococcus /
- photosynthesis
-
虽然铝(Al)在海洋中属痕量元素,但自20世纪80年代以来,酸沉降和工业酸性废水的排放导致海洋沉积物和陆地土壤释放出大量可溶态Al,使海水中的Al浓度升高,并且Al在海表的滞留期约为4周到4年[1-2]。王琼等[3-4]于2012年测得珠江口和南海北部表层海水中溶解态Al浓度范围分别为48.6 ~852.2 nmol · L-1和82.4 ~470 nmol ·L-1,显著高于太平洋表层海水的0.1 nmol · L-1。另外,有研究表明沙尘暴爆发期间,气溶胶携带的Al是普通天气的7倍[5],这可能是导致沙尘暴后部分海域初级生产力提高的原因之一[6-7]。已有研究表明,Al会被硅藻整合到细胞膜中,并且可以通过影响海洋浮游植物对营养盐的吸收进而影响浮游植物的生长[8-10],表明Al可能通过影响浮游植物的生长参与海洋生物地球化学循环。但溶解态Al对海洋浮游植物群落结构影响的研究较少,且影响机制尚不清楚。因此,研究海洋中溶解态Al浓度的变化对浮游植物群落结构的影响具有重要意义。
聚球藻(Synechococcus sp.)是全球碳循环的主要参与者和初级生产力的主要贡献者之一,其对总初级生产力的贡献率达20%以上,并且在海洋微食物网中生物量循环迅速,能量转换效率高,是微型浮游动物最重要的食物源之一[11-12]。但溶解态Al对聚球藻生长影响的研究几乎未见报道。因此,文章通过现场短期(一次性培养)及长期(半连续培养)的Al加富培养实验,研究海洋中Al的变化对不同粒级浮游植物群落结构的影响,结合室内Al对聚球藻光合作用的影响研究,进一步分析Al对浮游植物的作用机制,以期更深入的了解溶解态Al对海洋浮游植物生长的影响机理。
1. 材料与方法
1.1 实验材料
聚球藻WH7803(Synechococcus sp. WH7803),由厦门大学藻种保藏中心提供,采用f/2培养基[13]于24 ℃,光照强度1 325 lx,光暗循环比12 h : 12 h的光照培养箱中培养。
1.2 实验设计
1.2.1 溶解态Al短期作用下对海洋浮游植物生长的影响实验
藻类培养实验均在PC瓶中进行以消除容器壁对Al的吸附作用。现场一次性培养实验于2014年5月15日,在南海碳专项航次的S33站(21°30.127′N,119°29.892′E)进行,采表层海水经筛绢(孔径为200 μm)滤除浮游动物后分装至PC瓶中,添加氮(NO3--N)和磷(PO43--P)营养盐使其终浓度分别为1.0 μmol · L-1和0.1 μmol · L-1,分别加入铝(AlCl3)母液配制成3个水平梯度,使Al的终浓度分别为0.5 μmol · L-1、5.0 μmol · L-1和20.0 μmol · L-1作为处理组,并设2个平行实验,对照组为仅加氮磷营养盐而未添加Al的藻液。将培养瓶置于甲板上的水箱中水浴培养4 d,每隔2 d定时采集pico级和micro级浮游植物样品。
1.2.2 溶解态Al长期作用下对海洋浮游植物生长的影响实验
2012年10月11日,在南海北部基金委航次的S7站(18°28.922′N,115°29.190′E)进行现场Al加富长期培养实验。按1.2.3的实验步骤采集海水及设置对照组和处理组,培养3 d后以1:3的比例将藻液接种至含有营养盐及对应Al浓度的培养液中(所用海水为经0.22 μm孔径聚碳酸脂滤膜过滤后的S7站表层海水),重复操作。第5代的藻液培养3 d后,采集pico级浮游植物和总叶绿素a样品。
1.2.3 溶解态Al长期作用下对聚球藻生长的影响实验
将处于对数生长期的聚球藻接种于f/2培养基中,使藻的终密度为(2±1)×105个· mL-1。培养2 d后混匀分装至PC瓶中,分别加入Al母液配制成3个水平梯度,使其终浓度分别为0.5 μmol · L-1、5.0 μmol · L-1和20.0 μmol · L-1作为处理组,并设3个平行实验,对照组为未添加Al的藻液。培养瓶置于24 ℃,光照强度1 325 lx,光暗循环比12 h : 12 h的光照培养箱中培养,培养2 d后将藻液接种至含有对应Al浓度的培养基中使藻的终密度为(2±1)×105个· mL-1。同条件培养4 d后重新接种培养。重复操作。将第8代的聚球藻接种于含对应Al浓度的新鲜培养基中,使藻的终密度均为(2.3±0.1)×105个· mL-1,每个处理设3个平行。培养瓶置于光照培养箱中培养10 d。分别于第4和第9天实时测定光合系统的最大量子效率,并采集叶绿素a、有机碳和藻胆蛋白含量的测定样品,而聚球藻密度的样品则为每隔2 d采集并测定。
1.2.4 样品的测定
1) pico级浮游植物和聚球藻密度的测定利用流式细胞仪(FACS Calibur,USA)。micro级浮游植物采用显微镜鉴定并计数[14]。叶绿素a的测定采用荧光法[15]。有机碳的测定采用干式燃烧法[16]。单位藻细胞内叶绿素a和有机碳的含量分别通过总叶绿素a和总有机碳除以藻细胞数计算得出。2)光合系统的最大量子效率测定。将藻液置于暗室30 min后,利用荧光计(Turner Designs 10,USA)测荧光值为F0,加入25 μL的二甲基脲(DCMU,3 mmol · L-1)静置30 s后测得荧光值为Fm。3)藻胆蛋白的测定采用分光光度法。向载有藻体的滤膜中加入1.3 mL溶有溶菌酶(2 mg · mL-1)的PBS缓冲液(pH 7.2),重悬藻体后经超声波细胞破碎仪冰浴破碎6 min(破碎功率400 W,破碎时间3 s,间隔3 s)。破碎液在4 ℃条件下12 000 r · min-1离心5 min,上清液利用分光光度计(721可见分光光度计,中国产)于562 nm、615 nm和652 nm处测吸光值(PBS缓冲液为空白)。
1.3 数据处理
现场实验数据以“平均值±标准差”(X ±SD)表示(n=2)。室内实验数据以“平均值±标准误”(X ±SE)表示(n=3)。采用SPSS 18.0(USA)进行单因素方差分析(One-Way ANOVA),显著性设为P < 0.05。
聚球藻比生长速率(μ)的计算公式为[17]μ=(lnN2 -lnN1)/(T2 -T1),其中T代表培养时间,而N1 和N2则分别代表在T1和T2时的藻细胞密度。光合系统的最大量子效率(Fv/Fm)= (Fm-F0)/Fm。其中F0是暗适应后的最小荧光值,Fm是加入DCMU后的最大荧光值[18]。藻胆蛋白的计算公式为[19]:
藻红蛋白(PE,mg · mL-1)= (A562-2.41×PC-0.849×APC)/9.62
藻蓝蛋白(PC,mg · mL-1)= (A615-0.474×A652)/5.34
别藻蓝蛋白(APC,mg · mL-1)= (A652-0.208×A615)/5.09
单位细胞内的藻胆蛋白为蛋白浓度除以藻细胞密度。
2. 结果
2.1 浮游植物群落结构对Al的应激响应
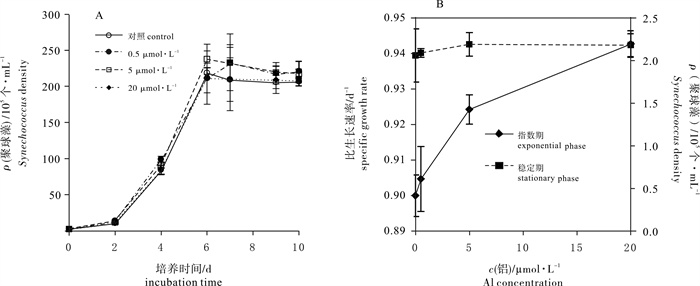
此次现场培养实验中,micro级浮游植物包括硅藻、甲藻和束毛藻三类(图 1-A)。其中束毛藻属蓝藻,但由于其聚集成束或团,显微镜下可计数,故将其归类于micro级浮游植物。各组中束毛藻在最初2 d内为micro级总丰度的主要贡献者。培养至第4天时,对照组的主要贡献者仍是束毛藻,但Al处理组则变为硅藻或甲藻。培养至第2天时,对照组和低浓度处理组(0.5 μmol · L-1)中micro级浮游植物的总丰度明显增加,而中浓度和高浓度处理组(5.0 μmol · L-1和20.0 μmol · L-1)中的藻细胞数则显著下降。但至第4天时Al处理组的丰度明显低于对照组。
pico级浮游植物主要包括聚球藻与真核藻类,其中聚球藻为总丰度的主要贡献者(图 1-B)。培养至第2天时对照组和低浓度处理组中pico级浮游植物的总丰度显著增加(P < 0.05),而中和高浓度处理组中的藻细胞数则显著下降(P < 0.05)。同时,聚球藻对pico级浮游植物总丰度的贡献率随Al浓度的增加而下降,至第4天时则呈上升趋势,分别为90.0%、92.1%、96.6%和95.7%。pico级浮游植物的总丰度在第4天时随着Al浓度的增加而上升,尤其是高浓度处理组中的pico级浮游植物总丰度和聚球藻数均显著高于对照组及其他处理组(P < 0.05)。
2.2 Al长期作用下对海洋浮游植物的影响
培养初期pico级浮游植物主要包括聚球藻、原绿素藻与真核藻类,其中原绿球藻的贡献率约为76.5%,是总丰度的主要贡献者(图 2-A)。半连续培养15 d后对照组及处理组中原绿球藻均死亡,pico级浮游植物仅包括聚球藻和真核藻类。对照组、低、中和高浓度处理组中聚球藻对pico级浮游植物总丰度的贡献率分别为38.3%、96.1%、99.0%和99.5%,随Al浓度的增加而上升。并且高浓度处理组中的pico级浮游植物总丰度和聚球藻数均显著高于对照组(P < 0.05)。但Al对总叶绿素a的影响较小,对照组和各处理组间无显著性差异(P>0.05)(图 2-B)。
![]() 图 2 现场半连续培养15 d后pico级浮游植物总丰度及各类藻的相对贡献率(A)和浮游植物总叶绿素a质量浓度(B)的变化图中相同字母表示无显著差异(P>0.05)Fig. 2 Total picophytoplankton abundance and relative contribution of various algal tapes (A) and chlorophyll a content of total phytoplankton (B) in subculture field testThe same letters indicate no significant difference (P>0.05).
图 2 现场半连续培养15 d后pico级浮游植物总丰度及各类藻的相对贡献率(A)和浮游植物总叶绿素a质量浓度(B)的变化图中相同字母表示无显著差异(P>0.05)Fig. 2 Total picophytoplankton abundance and relative contribution of various algal tapes (A) and chlorophyll a content of total phytoplankton (B) in subculture field testThe same letters indicate no significant difference (P>0.05).2.3 Al对聚球藻生长及其光合作用的影响
2.3.1 Al长期作用下对聚球藻生长的影响
对照组与处理组中的聚球藻在培养的前6 d均处于对数生长期,第6~第10天进入稳定生长期(图 3-A)。因此,以第4和第9天分别代表对数期和稳定期研究Al对聚球藻生长的影响。在Al的长期作用下,聚球藻的比生长速率随Al浓度的增加而升高(图 3-B),尤其中和高浓度(5.0 μmol · L-1和20.0 μmol · L-1)处理组显著高于对照及低浓度(0.5 μmol · L-1)处理组(P < 0.05)。至稳定生长期时,Al的浓度越高,藻密度越大,但各处理组间无显著性差异(P>0.05)。
2.3.2 Al长期作用下对聚球藻光合色素合成的影响
对数生长期内单位细胞内藻红蛋白的含量随Al浓度的增加而升高,处理组均显著高于对照组(P < 0.05),但处理组间无显著性差异(P>0.05);藻细胞进入稳定生长期后,各组间单位细胞内藻红蛋白含量的变化趋势与对数期相似,但各组间无显著差异(P>0.05)(图 4-A)。对数生长期内,单位细胞内藻蓝蛋白和别藻蓝蛋白含量的变化趋势与藻红蛋白相似,均随Al浓度的增加而增大,但各组间无显著性差异(P>0.05);进入稳定期后,单位藻蓝蛋白的含量随Al浓度的增加而增大,尤其是高浓度处理组显著高于对照组及其余处理组(P < 0.05),但对照组及处理组中别藻蓝蛋白含量的变化较小,无显著性差异(P>0.05)(图 4-B~C)。对数生长期内Al的浓度越高,则聚球藻单位细胞内叶绿素a含量越高,但各组间无显著性差异(P>0.05),而稳定期单位细胞内叶绿素a的含量随Al浓度的增加而下降,其中高浓度处理组显著低于对照组及低浓度处理组(P < 0.05)(图 4-D)。
2.3.3 Al长期作用下对聚球藻光系统Ⅱ(PSⅡ)最大光能转化效率(Fv/Fm)和有机碳含量的影响
Al处理组中聚球藻在对数期的Fv/Fm显著高于对照组(P < 0.05),但各处理组间无显著差异(P>0.05)。当培养液中Al浓度增加至0.5 μmol · L-1时,Fv/Fm由0.25急剧增至0.37,之后随着Al浓度的增加而变化缓慢。聚球藻生长进入稳定生长期后,Fv/Fm的变化与对数期相似,随着Al浓度的增加呈上升趋势,但各组间无显著性差异(P>0.05)(图 5-A)。与聚球藻在对数期时Fv/Fm的变化相似,聚球藻单位细胞内有机碳含量随Al浓度的增加而小幅上升,但各组间无显著性差异(P>0.05)。当藻进入稳定期时,单位细胞内的有机碳含量显著增加(P < 0.05),且处理组的含量均高于对照组(图 5-B)。
3. 讨论
此实验中溶解态Al促进了pico级浮游植物总丰度的增加,对micro级浮游植物却具有抑制作用,导致Al对总初级生产力的影响尚无法确定。主要原因是溶解态Al对海洋浮游植物生长的影响具有特异性。VRIELING等[20]的研究表明Al对硅藻Navicula salinarum的生长具有促进作用,但对Thalassiosira weissflogii则无影响。而GOLDING等[21]则认为Al对绿色鞭毛藻(Tetraselmis sp.)有毒性作用,但即使达到较高浓度(37 μmol · L-1)时对褐藻Hormosira banksii也无影响。因此,Al对海洋浮游植物的影响的特异性可能会导致其对具有不同浮游植物群落结构海区的初级生产力的影响也不一致。但现场实验表明,海洋中溶解态Al浓度一旦升高(如升高0.5 μmol · L-1)便会引起浮游植物群落结构的显著变化,进而影响海洋初级生产力及全球碳循环。
王琼等[15]分析了南海溶解态Al与micro级浮游植物群落结构之间的关系,发现表层溶解态Al的分布与甲藻丰度具有显著的正相关性,推测溶解态Al对甲藻生长具有促进作用。笔者的结论与其一致,现场溶解态Al加富实验中,micro级浮游植物主要包括硅藻、甲藻和束毛藻三大类(图 2-B)。在培养期内(4 d),对照组的主要贡献者一直为束毛藻,而Al处理组在后期变为硅藻或甲藻,表明溶解态Al通过抑制束毛藻的生长,增加了硅藻和甲藻的比重,进而改变了micro级浮游植物的群落结构。由于束毛藻的生长受到抑制,导致micro级浮游植物的总丰度下降。
海洋pico级浮游植物是一类粒径在0.2~2.0 μm的光能自养型浮游生物,它由原核浮游植物(聚球藻和原绿球藻)及真核浮游植物(主要包括定鞭藻类、金藻类、隐藻类和绿藻类)组成[22-23]。pico级浮游植物在海洋生态系统的物质循环和能量流动中起着十分重要的作用[24-25]。此实验中,溶解态Al的突然增加对pico级浮游植物的生长具有先抑制后促进的作用,在培养后期通过促进聚球藻的生长使其总丰度增加。在Al的长期作用下,聚球藻的生长受到明显的促进作用,尤其高浓度Al(20 μmol · L-1)显著促进了pico级浮游植物的总丰度及聚球藻的生长(P < 0.05)。
现场实验表明,Al对pico级浮游植物总丰度的影响主要取决其对聚球藻的影响,Al在海洋表层的滞留期约为4周到4年[2],因此,研究溶解态Al长期作用下对聚球藻的影响机制对研究Al对海洋pico级浮游植物群落结构的影响具有重要意义。聚球藻的光合色素是叶绿素a和藻胆蛋白。藻胆蛋白包括藻红蛋白(PE)、藻蓝蛋白(PC)和别藻蓝蛋白(APC)三大类[26]。藻胆蛋白能高效率地捕获光能并传递给PSⅡ,光能传递的方向为藻红蛋白→藻蓝蛋白→别藻蓝蛋白→叶绿素a[27]。其中藻红蛋白位于藻胆体的外围,直接吸收光能,作为天线色素参与光合作用,并且容易受环境因素的影响,为适应生态环境的生存竞争而不断调整自身结构以保证光能的高效传递。而PSⅡ的最大光能转化效率(Fv/Fm)表示PSⅡ的最大光化学量子产量,与光合色素、激发能在光反应中心的传递效率以及有活性的或开放的光反应中心的数量有关[18, 28]。
对数生长期内聚球藻的4种光合色素合成量与Fv/Fm均随溶解态Al浓度的增加而增大,尤其是Al处理组中藻红蛋白和Fv/Fm显著高于对照组(P < 0.05),表明Al通过促进聚球藻光合色素的合成,使PSⅡ的最大光能转化效率增大,进而使聚球藻的光合作用增强而使其比生长速率增大。溶解态Al在促进聚球藻分裂生长的同时也促进了单位细胞内有机碳的积累。而藻细胞进入稳定生长期后,除叶绿素a含量随Al浓度的增加而下降外,其余3种光合色素及Fv/Fm和有机碳的变化均与对数生长期时相似。表明此阶段内溶解态Al依旧促进了聚球藻的生长,使藻细胞密度随Al浓度的增加而升高。而叶绿素a含量随Al浓度的增加而下降的原因,可能是Al处理组中藻细胞的快速生长使其在稳定期时受到环境(如营养盐)的压力较大所导致,但其他色素如类胡萝卜素(C40H56)、叶黄素(C40H56O2)等可取代叶绿素a的部分功能,短期内对聚球藻的生长、繁殖不会产生大的影响[29-30]。总之,溶解态Al通过促进聚球藻光合色素的合成以及光合作用的增强,进而使海洋pico级浮游植物总丰度升高,改变海洋浮游植物群落结构。
-
图 2 现场半连续培养15 d后pico级浮游植物总丰度及各类藻的相对贡献率(A)和浮游植物总叶绿素a质量浓度(B)的变化
图中相同字母表示无显著差异(P>0.05)
Figure 2. Total picophytoplankton abundance and relative contribution of various algal tapes (A) and chlorophyll a content of total phytoplankton (B) in subculture field test
The same letters indicate no significant difference (P>0.05).
-
[1] 王趁义, 罗明标, 毕树平. 环境中羟基聚合铝型体的形成和形态转化规律[J]. 分析科学学报, 2003, 19(4): 383-388. doi: 10.3969/j.issn.1006-6144.2003.04.025 [2] ORIANS K J, BRULAND K W. The biogeochemistry of Aluminum in the Pacific Ocean[J]. Earth Planet Sci Lett, 1986, 78(4): 397-410. doi: 10.1016/0012-821X(86)90006-3
[3] 王琼. 南海溶解态铝的分布及其对浮游植物群落结构影响的研究[D]. 广州: 中国科学院大学南海海洋研究所, 2013: 22. https://xueshu.baidu.com/usercenter/paper/show?paperid=2275264a12d3e5ec227a61f3fbd26540 [4] MEASURES C I, BROWN M T, VINK S. Dust deposition to the surface waters of the western and central North Pacific inferred from surface water dissolved aluminum concentrations[J]. Geochem Geophy Geosy, 2005, 6(9): Q09M03. doi: 10.1029/2005GC000922
[5] CHUNG C C, CHANG J, GONG G C, et al. Effects of Asian dust storms on Synechococcus population in the subtropical Kuroshio Current[J]. Mar Biotechnol, 2011, 13(4): 751-763. doi: 10.1007/s10126-010-9336-5
[6] JICKELLS T D. Atmospheric inputs of metals and nutrients to the oceans: their magnitude and effects[J]. Mar Chem, 1995, 48(3/4): 199-214. https://www.semanticscholar.org/paper/Atmospheric-inputs-of-metals-and-nutrients-to-the-Jickells/3466b40fd8d99c17cf9b089af139da17ebe51470
[7] HERUT B, ZOHARY T, KROM M D, et al. Response of East Mediterranean surface water to Saharan dust: on-board microcosm experiment and field observations[J]. Deep Sea Res Ⅱ, 2005, 52(22/23): 3024-3040. https://www.semanticscholar.org/paper/Response-of-East-Mediterranean-surface-water-to-and-Herut-Zohary/5517861e97db238e35c55f349c00decb5b52bbe8
[8] STOFFYN M. Biological control of dissolved Al in seawater: experimental evidence[J]. Science, 1979, 203(4381): 651-653. doi: 10.1126/science.203.4381.651
[9] KONING E, GEHLEN M, FLANK A M. Rapid post-mortem incorporation of Al in diatom frustules: evidence from chemical and structural analyses[J]. Mar Chem, 2007, 106(1/2): 208-222. https://www.semanticscholar.org/paper/Rapid-post-mortem-incorporation-of-aluminum-in-from-Koning-Gehlen/ddcc32bfa51b1ae9106695e664d9a57ad4fe094d
[10] SAçAN M T, OZTAY F, BOLKENT S. Exposure of Dunaliella tertiolecta to lead and aluminum: toxicity and effects on ultrastructure[J]. Biol Trace Elem Res, 2007, 120(1/2/3): 264-272. https://pubmed.ncbi.nlm.nih.gov/17916979/
[11] WATERBURY J B, WATSON S W, VALOIS F W. Biological and ecological characterization of the marine unicellular cyanobacterium Synechococcus[J]. Can Bull Fish Aquat Sci, 1986, 214: 71-120. https://www.semanticscholar.org/paper/Biological-and-ecological-characterization-of-the-Waterbury/b0a95f54ed8a9bba614731941dd58771961366c5
[12] SHARMA N K T S. Cyanobacteria. (blue-green algae): facts and challenges[J]. J Appl Phycol, 2011, 23(6): 1059-1081. doi: 10.1007/s10811-010-9626-3
[13] 李丹. 六种细菌对赤潮藻Scrippsiella trochoidea的抑制效应研究[D]. 广州: 暨南大学, 2004: 15-16. https://apps.wanfangdata.com.cn/thesis/article:D463663 [14] 谭激扬. 南海北部海区夏季浮游植物群落结构及其对中尺度过程的响应[D]. 广州: 中国科学院大学南海海洋研究所, 2013: 9. doi: 10.12362/j.issn.1671-6647.20230306002 [15] 王琼, 谭烨辉, 周林滨, 等. 南海中南部溶解态铝初探: 促进甲藻生长?[J]. 热带海洋学报, 2014, 33(2): 78-86. https://lib.cqvip.com/Qikan/Article/Detail?id=50004226&from=Qikan_Article_Detail [16] 严宏强, 余克服, 谭烨辉. 夏季南海北部水体中颗粒有机碳的分布特征[J]. 热带地理, 2011, 31(2): 133-137, 145. https://www.rddl.com.cn/CN/Y2011/V31/I2/133 [17] 张宝玉, 李夜光, 李中奎, 等. 温度、光照强度和pH对雨生红球藻光合作用和生长速率的影响[J]. 海洋与湖沼, 2003, 34(5): 558-565. doi: 10.3321/j.issn:0029-814X.2003.05.011 [18] PARKHILL J P, MAILLET G, CULLEN J J. Fluorescence-based maximal quantum yield for PSⅡ as a diagnostic of nutrient stress[J]. J Phycol, 2001, 37(4): 517-529. doi: 10.1046/j.1529-8817.2001.037004517.x
[19] SIMEUNOVIć J, BEŠLIN K, SVIRčEV Z, et al. Impact of Nitrogen and drought on phycobiliprotein content in terrestrial cyanobacterial strains[J]. J Appl Phycol, 2013, 25(2): 597-607. doi: 10.1007/s10811-012-9894-1
[20] VRIELING E G, POORT L, BEELEN T P, et al. Growth and silica content of the diatoms Thalassiosira weissflogii and Navicula salinarum at different salinities and enrichments with aluminium[J]. Eur J Phycol, 1999, 34(3): 307-316. doi: 10.1080/09670269910001736362
[21] GOLDING L A, ANGEL B M, BATLEY G E, et al. Derivation of a water quality guideline for aluminium in marine waters[J]. Environ Toxicol Chem, 2014, 34(1): 141-151. doi: 10.1002/etc.2771
[22] WATERBURY J B, WATSON S W, GUILLARD R, et al. Widespread occurrence of a unicellular, marine planktonic, cyanobacterium[J]. Nature, 1979, 277(5694): 293-294. doi: 10.1038/277293a0
[23] GUO C, LIU H, ZHENG L, et al. Seasonal and spatial patterns of picophytoplankton growth, grazing and distribution in the East China Sea[J]. Biogeosciences, 2014, 11(7): 1847-1862. doi: 10.5194/bg-11-1847-2014
[24] 陈纪新, 黄邦钦, 郑微云. 海洋超微型浮游植物多样性研究方法进展[J]. 海洋科学, 2002, 26(8): 34-39. https://xueshu.baidu.com/usercenter/paper/show?paperid=00a80c2b7f99caee19a7c3d6c73a672d [25] LEE Y, CHOI J K, YOUN S, et al. Influence of the physical forcing of different water masses on the spatial and temporal distributions of picophytoplankton in the northern East China Sea[J]. Cont Shelf Res, 2014, 88(1): 216-227. https://www.semanticscholar.org/paper/Influence-of-the-physical-forcing-of-different-on-Lee-Choi/c649f5ad73ff9e45b0198f4081fbc8c9bf147883
[26] 史修周, 徐燕, 梁艳, 等. 坛紫菜藻胆蛋白及叶绿素a的测定与分析[J]. 集美大学学报(自然科学版), 2008, 13(3): 221-226. https://xueshu.baidu.com/usercenter/paper/show?paperid=c4d2586e93f7588f324244a98e4d5d0d [27] 隋正红, 张学成. 藻红蛋白研究进展[J]. 海洋科学, 1998, 3(4): 24-27. https://xueshu.baidu.com/usercenter/paper/show?paperid=e0c304c177a2c30867efa5e9b555475b [28] CAMPBELL D, HURRY V, CLARKE A K, et al. Chlorophyll fluorescence analysis of cyanobacterial photosynthesis and acclimation[J]. Microbiol Mol Biol Rev, 1998, 62(3): 667-683. https://pubmed.ncbi.nlm.nih.gov/9729605/
[29] 曾艳艺, 黄翔鹄. 温度、光照对小环藻生长和叶绿素a含量的影响[J]. 广东海洋大学学报, 2007, 27(6): 36-40. https://xueshu.baidu.com/usercenter/paper/show?paperid=1de68bd0bf3e8b20ef998a426ec1bfdd [30] 曾艳艺, 黄翔鹄. 氮、磷、硅对条纹小环藻生长和叶绿素a含量的影响[J]. 广东海洋大学学报, 2011, 31(4): 46-51. https://xueshu.baidu.com/usercenter/paper/show?paperid=2f5078422503d95f2ff5b37ff741cd99 -
期刊类型引用(2)
1. 周林滨,黄良民,谭烨辉. 铁铝假说与海洋铝施肥增汇潜力展望. 热带海洋学报. 2023(03): 1-18 .  百度学术
百度学术
2. 刘甲星,周林滨,柯志新,李刚,史荣君,谭烨辉. 铝对海洋固氮蓝藻Crocosphaera watsonii生长及固氮速率的影响. 热带海洋学报. 2017(02): 12-18 .  百度学术
百度学术
其他类型引用(4)




 下载:
下载:



 粤公网安备 44010502001741号
粤公网安备 44010502001741号
