Synergistic effect of temperature and salinity on antioxidant enzymes activities of Chlamys nobilis
-
摘要:
采用中心复合设计(CCD)和响应曲面分析法(RSM),研究了温度(19~31 ℃)和盐度(22~38)对华贵栉孔扇贝(Chlamys nobilis)超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-PX)3种抗氧化酶活性的联合效应。结果显示,温度的一次、二次效应对SOD、CAT和GSH-PX活性的影响显著(P < 0.05)。盐度的一次效应对SOD和CAT活性的影响显著(P < 0.05),但对GSH-PX活性影响不显著(P>0.05),盐度的二次效应对SOD、CAT和GSH-PX活性的影响均显著(P < 0.05)。温度和盐度的互作效应对SOD、CAT活性的影响显著(P < 0.05),但对GSH-PX活性的影响不显著(P>0.05)。采用响应曲面法建立模型方程决定系数分别为0.950 1、0.981 5和0.967 9,表明建立的模型拟合度极高,可用于预测华贵栉孔扇贝3种抗氧化酶活性的变化。模型优化和验证试验表明,26.4 ℃和盐度27.7时,SOD、CAT和GSH-PX活性达最大值,分别为33.02 U · mg-1、35.73 U · mg-1和27.94 U · mg-1,满意度为0.989。
Abstract:By using two-factor central composite design (CCD) and response surface methodology(RSM), we studied the synergistic effect of temperature (19~31 ℃) and salinity (22~38) on the superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GSH-PX) activities of Chlamys nobilis. The results show that the linear and quadratic effects of temperature on SOD, CAT and GSH-PX activities were significant (P < 0.05). The linear effects of salinity on SOD and CAT activities were significant (P < 0.05), but the linear effect of salinity on GSH-PX activity was not significant (P>0.05). Salinity had significant quadratic effect on SOD, CAT and GSH-PX activities (P < 0.05). The interactive effects of temperature and salinity were significant on SOD and CAT activities (P < 0.05), but there was no significant effect on GSH-PX activity (P>0.05). By response surface methodology, we established a model equation for the relationship of antioxidant enzyme activities to the two factors, with the R2 of 0.950 1, 0.981 5 and 0.967 9. It is suggested that the fitting capability of the model was satisfactory and could be practicably applied for prediction. The antioxidant enzyme activities reached their maximum (33.02 U · mg-1, 35.73 U · mg-1 and 27.94 U · mg-1) when the 2-factor combination was 26.4 ℃/27.7, with the desirability value being 0.989.
-
Keywords:
- Chlamys nobilis /
- central composite design /
- response surface method /
- temperature /
- salinity /
- antioxidant enzyme
-
浮游动物既是初级消费者又是次级消费者,通过对浮游植物和微型浮游动物的摄食,将其固定的能量和物质向高营养层次传递,是联系微食物网和经典食物链的中间环节[1]。生物体氮稳定同位素技术广泛应用于生态系统的研究中。在食物链传递中,氮稳定同位素(15N)通常随着营养等级升高而富集,一般被用于研究生物之间的营养级关系,是一种方便、有效的研究浮游食物网结构的方法[2]。国外学者采用分粒径法对浮游动物稳定同位素展开了研究[3-5],而中国使用稳定同位素技术开展浮游食物网粒级结构的研究较少见。
蔡德陵等[6]研究渤海分粒级浮游动物的碳稳定同位素时发现中型浮游生物的碳稳定同位素随粒径的增大而增加;金鑫[7]对黄东海不同粒级浮游动物的稳定同位素研究发现浮游动物的稳定同位素存在季节差异,稳定同位素随粒径增大而增加且呈线性相关;柯志新等[8]以浮游生物的生物量与氮稳定同位素所构建的大亚湾营养级谱可比较不同区域生态系统结构的稳定性;刘华雪等[9-10]发现南海南部不同粒级浮游动物碳和氮稳定同位素值存在季节差异。
南海是中国最大的边缘海,海底地形自西北向东南方向下倾,西面为宽广的大陆架,并有珠江径流的输入,东面的吕宋海峡则是南海与大洋及邻近边缘海连接通道中的唯一深水通道,物理过程复杂。关于南海北部浮游动物的研究已取得一定进展,但研究区域多集中在珠江河口、海湾以及近岸海域[11-13],研究内容多为浮游动物的某一类群[1, 14]。虽然也有对南海北部大尺度海区浮游动物群落的调查[15],但主要还是对浮游动物优势种和多样性的研究,而对于南海北部分粒级浮游动物氮稳定同位素的研究尚未见报道。笔者根据2015年夏季和冬季采集的南海北部浮游动物样本,探讨了不同粒级浮游动物生物量和氮稳定同位素的时空分布特征,以为南海的生态系统结构研究提供基础材料。
1. 材料与方法
在2015年夏季(7月27日-8月16日)和冬季(12月3日-12月23日)对南海北部海域(112°E~120°E,18.5°N~21.5°N)进行大面调查,采样站位见图 1。由于冬季采样期间受到天气的影响,冬季采样站位与夏季有所不同。夏季有10个采样站位,冬季有8个站位,共同站位5个。其中C1站水深小于200 m,其余站位水深均超过200 m。2个航次均使用中国水产科学研究院南海水产研究所“南锋”号调查船。
1.1 样品采集与处理
浮游动物粒级的划分参考ROLFF[16]、柯志新等[8]和刘华雪等[9]的方法,将浮游生物粒级梯度分为180~380 μm(小型)、380~500 μm(中型)和>500 μm(大型)。使用Ⅱ型浮游生物网(孔径160 μm)自水深200 m处垂直拖至表层(水深小于200 m时,从底层垂直拖至表层),将采集到的浮游动物样品置于盛有已过滤海水的水桶中,阴凉处排空2 h,然后将排空后的样品依次用500 μm、380 μm和180 μm的筛网过滤分离,用蒸馏水反洗之后用GF/F滤膜收集(用于样品富集的GF/F膜预先在马弗炉中450 ℃灼烧4 h以去除可能的有机质影响),滤膜用锡纸包裹后置于-20 ℃冰箱保存。
实验室中将载有浮游动物样品的滤膜于60 ℃下烘干至恒质量。将烘干后的样品研磨成均匀粉末,过筛后放入干燥器中保存。分析仪器为Finnigan delta plus和Flash EA1112联用仪,为了保证测试结果的准确性,每测试10个样品后加测1个标准样,并且对个别样品进行2~3次的复测。
1.2 数据分析
氮稳定同位素δ15N值计算如下[17]:
$ \delta =({{R}_{\rm{sample}}}-{{R}_{\rm{standard}}})/{{R}_{\rm{standard}}}\times 1\rm{ }000 $
式中δ为氮同位素值;Rsample为所测样品的同位素比值(15N/14N);Rstandard为国际上通用的标准物(氮同位素标准物采用大气氮)的重轻同位素丰度之比。使用SPSS 19.0软件进行统计学分析。
2. 结果与分析
2.1 环境参数
南海北部海水物理性质的时空差异非常明显(图 2)。夏季5 m层海水平均温度为29.71 ℃,显著高于冬季(25.31 ℃,P < 0.01)。而夏季200 m层水温的平均值为14.10 ℃,低于冬季(15.36 ℃,P < 0.05),说明夏季水温随深度增加变化显著。冬季5 m和50 m层平均水温分别为25.31 ℃和25.00 ℃,变化不大,表层高温海水出现明显的下沉现象。海水盐度在深度较浅的水层出现明显的季节变化,5 m层和50 m层海水盐度夏季的平均值为33.63和34.32,低于冬季5 m层的34.49(P < 0.01)和50 m层的34.60(P < 0.05),其余水层季节变化不明显。冬季海水盐度随深度增加变化不明显;而夏季表层海水盐度低于盐度稳定的深层海水。
![]() 图 2 水温、盐度和叶绿素a的季节和水层比较a.夏季;b.冬季;冬季200 m水层叶绿素a平均质量浓度 < 0.01μg·L-1(未列出)Fig. 2 Seasonal and vertical variation of temperature, salinity and concentration of chlorophyll-aa. summer; b. winter; the average concentration of chlorophyll-a at the depth of 200 meters in winter was below 0.01 μg·L-1 (not shown).
图 2 水温、盐度和叶绿素a的季节和水层比较a.夏季;b.冬季;冬季200 m水层叶绿素a平均质量浓度 < 0.01μg·L-1(未列出)Fig. 2 Seasonal and vertical variation of temperature, salinity and concentration of chlorophyll-aa. summer; b. winter; the average concentration of chlorophyll-a at the depth of 200 meters in winter was below 0.01 μg·L-1 (not shown).夏季5 m层叶绿素a质量浓度的平均值为0.11 μg·L-1,低于冬季(0.34 μg·L-1,P < 0.01);夏季75 m层叶绿素a质量浓度的平均值为0.33 μg·L-1,却高于冬季的0.18 μg·L-1(P < 0.05)。叶绿素a质量浓度存在明显的垂直深度变化,夏季高值多出现在50 m和75 m水层,冬季多出现在5 m和50 m水层。
2.2 南海北部浮游动物生物量
南海北部浮游动物生物量的分布存在明显的空间差异(图 3)。夏季浮游动物生物量的最高值出现在位于珠江口的C1站(13.62 mg·m-3);其次是东沙群岛附近的C8站(7.54 mg·m-3)和C6站(7.09 mg·m-3);台湾海峡南部C5站的生物量也高(6.57 mg·m-3),其他开阔深海区站位的浮游动物生物量均较低(小于5.1 mg·m-3)。冬季浮游动物生物量的分布特征与夏季相同,高值也出现在珠江口(C1站9.01 mg·m-3)和台湾海峡南部海域(C5站6.81 mg·m-3)。
从粒径结构上看,浮游动物生物量存在粒级和空间差异。夏季大型浮游动物生物量比例最高(49.80%,图 4),高于小型(29.09%)和中型浮游动物(21.11%);小型浮游动物高值多出现在开阔的深海区,中型浮游动物是在陆架区和开阔的深海区,而大型浮游动物的高值则主要出现在东沙群岛和台湾海峡南部。冬季大型浮游动物生物量(54.38%)也高于小型和中型浮游动物;小型和中型浮游动物生物量百分含量分布特征与夏季相同,高值也多出现在远海区,大型浮游动物则在台湾海峡南部海域的比例最高。
2.3 南海北部各粒级浮游生物的氮稳定同位素
浮游动物δ15N值在夏季(P < 0.05)和冬季(P < 0.01)都存在显著的粒级差异(图 5)。夏季小型浮游动物δ15N平均值为5.34±1.10,显著低于大型浮游动物δ15N平均值(6.58±0.99);夏季中型浮游动物的δ15N平均值为5.75±1.16,其中大部分站位的δ15N值低于大型浮游动物。冬季大型浮游动物δ15N平均值为6.48±1.53,显著高于中型浮游动物(5.97±0.52)和小型浮游动物(4.64±0.96)。
浮游动物氮稳定同位素出现明显的空间分布变化。夏季各粒级浮游动物δ15N值的空间分布差异相似,高值区都出现在珠江口(C1站)、东沙群岛附近(C6和C8站)和台湾海峡南部海域(C5站),而开阔深海区站位的稳定同位素值均最低。冬季各粒级浮游动物δ15N值的空间差异与夏季相似,高值区大多也出现在珠江口(C1站)、东沙群岛附近(C7和C8站)和台湾海峡南部海域(C5和C11站),尤其是大型浮游动物δ15N值的分布,其中最大值出现于C11站,为7.99。
对共同站位分析可知,浮游动物的氮稳定同位素出现显著的季节变化(P < 0.05),夏季δ15N平均值(6.53±1.02)高于冬季(5.54±1.09)。夏季小型浮游动物δ15N平均值为6.25±0.73,极显著高于冬季(4.45±0.74,P < 0.01),夏季δ15N最高值出现于C1站(7.07)。共同站位各粒级浮游动物δ15N值也出现了明显的空间变化,高值也都分布在珠江口和台湾海峡南部海域。
对浮游动物生物量和δ15N值进行相关性分析可知,小型浮游动物δ15N值与小型浮游动物生物量(P < 0.01)、中型浮游动物生物量(P < 0.05)和浮游动物总体生物量(P < 0.01)都存在明显的相关性,中型浮游动物δ15N值与小型浮游动物生物量(P < 0.05)和浮游动物总体生物量(P < 0.01)也有明显的相关性,大型浮游动物的δ15N值则与生物量的关系不明显。
3. 讨论
受季风、珠江冲淡水、台湾海峡南部上升流和黑潮暖流等水文动力的影响,南海北部海水温度和盐度季节变化明显,海水营养盐也具有明显的空间分布特征[18]。海水营养盐浓度和结构的变化会影响浮游植物的细胞丰度和群落结构[19-20],进而影响到浮游动物的生物量。杜明敏等[21]对中国近海浮游动物的研究就指出水温和盐度是影响浮游动物群落结构最重要的2个环境因子。已有研究表明南海北部浮游植物的细胞丰度通常近岸高于外海,高值区多出现于近岸、珠江口和台湾海峡南部海域[22-23],同时浮游植物生物量的高值也存在垂直变化,浅水区多出现在10 m处,深海区多在次表层(50~75 m)[24]。2015年夏季和冬季该研究海区叶绿素a质量浓度也能反映这一变化特征。文章结果显示南海北部夏季和冬季浮游动物生物量的高值区也都出现在珠江口和台湾海峡南部上升流海域,这与浮游植物生物量的分布特征相似。这说明作为浮游植物主要消费者的浮游动物,它的生物量会受到浮游植物群落结构的影响。
南海北部浮游动物的δ15N值与南沙海域、黄东海和波罗的海相差不大,但明显高于里昂湾,这可能与里昂湾所处的地理位置和复杂的水文条件有关[27-28]。里昂湾位于地中海西北部,而地中海是最大的陆间海,蒸发作用强,海水盐度可高达39,海洋生物也较其他海区稀少。还有研究指出浮游动物夏季δ15N值要高于冬季[5, 29],而表 1中分析的是冬季里昂湾浮游动物稳定同位素特征,这可能也是其δ15N值低的原因之一。
南海北部浮游动物δ15N值与其生物量相关性明显,而浮游动物δ15N值的高值也多分布于珠江口、台湾海峡南部,这说明浮游动物生物量对其氮稳定同位素的空间分布有着明显的影响,同样的结果也出现于南海南部[9]。邻近珠江口站位的各粒级浮游动物δ15N值在夏季和冬季均较高(一些粒级浮游动物δ15N出现最高值,如夏季大型浮游动物的7.99和冬季中型浮游动物的6.53),可能该区域受珠江径流影响,营养盐得到大量补充,刺激了浮游生物的生长[26]。台湾海峡南部海域浮游动物δ15N值也较高,这可能与台湾海峡南部上升流带来底层丰富的营养盐改变了该海区浮游植物的丰度和群落结构有关[30]。PETURSDOTTIR等[31]对北大西洋中脊锋面飞马哲水蚤(Calanus finmarchicus)氮稳定同位素研究也发现浮游植物群落的变化可能是导致δ15N值的区域差异的主要原因。
表 1 不同海域分粒级浮游动物氮稳定同位素Table 1 Different survey areas of stable nitrogen isotope of size-fractionated zooplankton粒径范围/μm
size fraction时间
timeδ15N值
stable nitrogen isotope调查海域
survey area100~200 1994-1995年 2.6~7.7 波罗的海[16] 200~500 1994-1995年 3.0~10.5 波罗的海[16] 500~1 500 1994-1995年 6.4~9.2 波罗的海[16] >160 2002-2003年 6.14±0.51 渤海湾[25] 100~200 2009-2010年 4.71±1.77(秋) 4.24±1.86(春) 黄东海[7] 200~500 2009-2010年 5.25±1.88(秋) 5.39±1.51(春) 黄东海[7] 500~1 000 2009-2010年 7.05±1.08(秋) 6.23±1.04(春) 黄东海[7] 1 000~2 000 2009-2010年 7.48±1.23(秋) 6.32±0.98(春) 黄东海[7] 80~200 2011年1月 2.49±0.59 里昂湾[26] 200~300 2011年1月 2.60±0.69 里昂湾[-26] 300~500 2011年1月 2.75±0.74 里昂湾[26] 500~1 000 2011年1月 3.45±0.92 里昂湾[26] 1 000~2 000 2011年1月 3.78±1.09 里昂湾[26] >2 000 2011年1月 1.18±3.13 里昂湾[26] 180~380 2013年4-7月 3.79~6.76(春) 2.53~6.51(夏) 南沙海域[9] 380~500 2013年4-7月 5.15~9.25(春) 3.12~6.79(夏) 南沙海域[9] < 500 2013年4-7月 4.94~8.18(春) 4.87~10.25(夏) 南沙海域[9] 180~380 2015年7-12月 5.34±1.10(夏) 4.64±0.96(冬) 南海北部 380~500 2015年7-12月 5.75±1.16(夏) 5.97±0.52(冬) 南海北部 < 500 2015年7-12月 6.58±0.99(夏) 6.48±1.53(冬) 南海北部 在海洋浮游食物网中,体型较大的浮游生物会摄食体型较小的浮游生物,存在以个体大小为基础的消费关系[16]。营养级较高的生物其δ15N值也较高。LOICK等[32]研究越南上升流海区浮游生物特征时就指出体型更大的浮游生物会具有更大的δ15N值和更高的营养位置。此结果也显示南海北部夏季和冬季浮游动物δ15N值均有显著的粒径差异,随粒径增大而增加,许多研究也都指出浮游动物δ15N值具有随体型变大而增加的规律[7-9, 26, 33]。
浮游动物δ15N值有季节变化,夏季δ15N值较高,而冬季较低[5, 26, 29]。与之相符,此研究结果也显示南海北部夏季浮游动物δ15N值高于冬季。季节改变会引起浮游植物群落结构和其δ15N值出现变化,进而可能影响浮游动物的δ15N值。马威等[23]研究指出南海北部夏季和冬季浮游植物优势种和平均细胞丰度均有季节差异。同样,季节的改变也会引起浮游动物种群结构的变化,可能影响其δ15N值。FANELLI等[34]研究大陆坡的食物网结构时发现,肉食性浮游动物的δ15N值要高于滤食性浮游动物,柯志新等[8]也认为大亚湾浮游动物δ15N值差异可能是由于浮游动物种类的差异造成的。以后需结合各粒级浮游动物的主要类群来进一步研究。
4. 结论
南海北部浮游动物生物量和氮稳定同位素空间分布差异明显,高值区多分布在珠江河口、东沙群岛和台湾海峡南部海域。浮游动物氮稳定同位素夏季δ15N平均值高于冬季,其中小型浮游动物δ15N平均值显著高于冬季(P < 0.01)。各粒级浮游动物氮稳定同位素随粒径增大而增加。相关性分析显示,小型和中型浮游动物氮稳定同位素与浮游动物生物量有明显的相关性,大型浮游动物氮稳定同位素与浮游动物生物量的相关性则不明显。
-
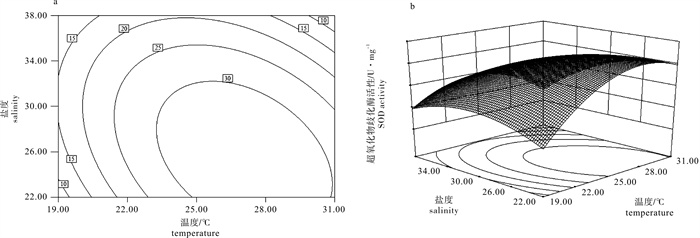
表 1 试验设计及结果
Table 1 Experiment design and result
试验组group 编码值coded value 实际值actual value 超氧化物歧化酶/U·mg-1
SOD过氧化氢酶/ U·mg-1
CAT谷胱甘肽过氧化物酶/ U·mg-1
GSH-PXT S T S 1 0 -1 25 22 31.43±1.43 38.32±1.03 14.27±1.32 2 1 1 31 38 7.21±1.46 11.09±1.39 11.28±0.58 3 -1 -1 19 22 6.14±0.22 17.94±2.10 6.34±1.64 4 0 0 25 30 30.51±0.64 35.25±0.56 27.43±1.02 5 0 0 25 30 28.65±0.13 32.95±0.42 31.34±0.75 6 -1 0 19 30 16.23±1.24 20.42±1.43 16.76±0.53 7 0 0 25 30 37.56±0.73 33.95±0.48 29.56±0.85 8 0 1 25 38 17.34±1.43 21.42±1.71 11.44±1.45 9 -1 1 19 38 9.95±1.28 16.32±1.91 5.96±1.35 10 1 -1 31 22 29.78±0.45 31.32±2.42 13.74±1.84 11 1 0 31 30 22.67±0.94 25.48±2.33 24.34±0.93 注:T. 温度;S. 盐度
Note:T. temperature;S. salnity表 2 温度和盐度对超氧化物歧化酶活性影响回归模型方差分析
Table 2 Variance analysis of synergistic effect of temperature and salinity on SOD activity
来源
source平方和
SS自由度
df均方
MSF P 模型 model 1 118.58 5 223.72 19.05 0.002 9 残差 residual 58.71 5 11.74 失拟 lack of fit 14.53 3 4.84 0.22 0.876 9 纯误差 pure error 44.18 2 22.09 cor total 1 177.29 10 注:决定系数R2=0.950 1;校正系数Adj R2=0.900 3;预测系数Pred R2=0.805 8
Note:R2=0.950 1;Adj R2=0.900 3;Pred R2=0.805 8表 3 回归方程系数显著性检验
Table 3 Significance test for regression coefficients
因子
factor系数估计
coefficient estimate标准误
standard errorP 95%置信下限
CI low95%置信上限
CI highintercept 31.89 1.76 27.37 36.41 T 4.56 1.40 0.022 5 0.96 8.15 S -5.48 1.40 0.011 3 -9.07 -1.88 T×S -6.60 1.71 0.012 0 -11.00 -2.19 T2 -11.91 2.15 0.002 6 -17.44 -6.37 S2 -6.97 2.15 0.023 0 -12.51 -1.44 注:系数估计值为编码形式
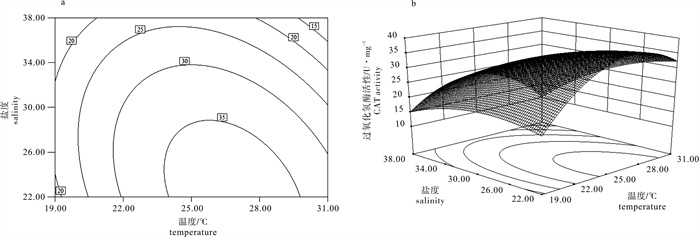
Note:The coefficient estimates were given in terms of coded factors.表 4 温度、盐度对过氧化氢酶活性影响的回归模型方差分析
Table 4 Variance analysis of synergistic effect of temperature and salinity on CAT activity
来源
source平方和
SS自由度
df均方
MSF P 模型 model 795.31 5 159.06 53.08 0.000 2 残差 residual 14.98 5 3.00 失拟 lack of fit 12.32 3 4.11 3.09 0.254 1 纯误差 pure error 2.66 2 1.33 cor total 810.29 10 注:决定系数R2=0.981 5;校正系数Adj R2=0.963 0;预测系数Pred R2=0.833 1
Note:R2=0.981 5;Adj R2=0.963 0;Pred R2=0.833 1表 5 回归方程系数显著性检验
Table 5 Test of significance for regression coefficient
因子
factor系数估计
coefficient estimate标准误
standard errorP 95%置信下限
CI low95%置信上限
CI highintercept 33.97 0.89 31.68 36.25 T 2.20 0.71 0.026 4 0.38 4.02 S -6.46 0.71 0.000 3 -8.28 -4.64 T×S -4.65 0.87 0.003 0 -6.88 -2.43 T2 -10.89 1.09 0.000 2 -13.69 -8.09 S2 -3.97 1.09 0.014 7 -6.77 -1.17 表 6 温度、盐度对谷胱甘肽过氧化物酶活性影响的回归模型方差分析
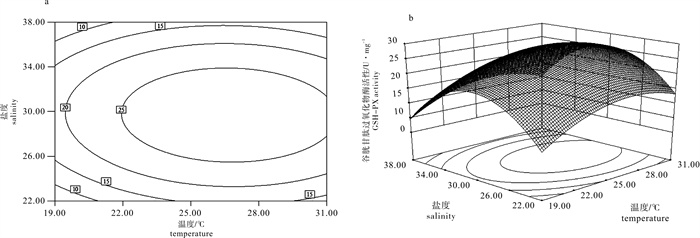
Table 6 Variance analysis of synergistic effect of temperature and salinity on GSH-PX activity
来源
source平方和
SS自由度
df均方
MSF P 模型 model 813.60 5 162.72 30.11 0.001 0 残差 residual 27.02 5 5.40 失拟 lack of fit 19.36 3 6.45 1.68 0.393 6 纯误差 pure error 7.66 2 3.83 cor total 840.63 10 注:决定系数R2=0.967 9;校正系数Adj R2=0.935 7;预测系数Pred R2=0.823 1
Note:R2=0.967 9;Adj R2=0.935 7;Pred R2=0.823 1表 7 回归方程系数显著性检验
Table 7 Test of significance for regression coefficient
因子
factor系数估计
coefficient estimate标准误
standard errorP 95%置信下限
CI low95%置信上限
CI high截距 intercept 28.31 1.19 25.25 31.38 T 3.38 0.95 0.016 1 0.94 5.82 S -0.94 0.95 0.365 1 -3.38 1.49 T×S -0.52 1.16 0.673 3 -3.51 2.47 T2 -6.07 1.46 0.008 9 -9.82 -2.31 S2 -13.76 1.46 0.000 2 -17.52 -10.01 -
[1] 肖克宇, 陈昌福, 李月红, 等. 水产动物免疫学[M]. 北京: 中国农业出版社, 2011: 91-92. https://xueshu.baidu.com/usercenter/paper/show?paperid=f700848bb51d23bc320231fd5af3e260&site=xueshu_se [2] KHESSIBA A, ROMÉO M, AISSA P. Effects of some environmental parameters on catalase activity measured in the mussel (Mytilus galloprovincialis) exposed tolindane[J]. Environ Pollut, 2005, 133(2): 275-281. doi: 10.1016/j.envpol.2004.05.035
[3] CHEN M Y, YANG H S, DELAPORTE M, et al. Immune condition of Chlamys farreri in response to acute temperature challenge[J]. Aquaculture, 2007, 271(4): 479-487. doi: 10.1016/j.aquaculture.2007.04.051
[4] 吕昊泽, 刘健, 陈锦辉, 等. 盐度对缢蛏超氧化物岐化酶和过氧化酶活力的影响[J]. 海洋渔业, 2013, 35(4): 474-478. doi: 10.3969/j.issn.1004-2490.2013.04.014 [5] 张晓丽, 胡玉珍, 李明云, 等. 养殖大黄鱼在自然海区降温不同阶段抗氧化水平及血清酶活力的变化[J]. 海洋科学, 2013, 37(11): 27-34. https://qikan.cqvip.com/Qikan/Article/Detail?id=48459485 [6] 尹飞, 孙鹏, 彭士明, 等. 低盐度胁迫对银鲳幼鱼肝脏抗氧化酶、鳃和肾ATP酶活力的影响[J]. 应用生态学报, 2011, 22(4): 1059-1066. https://www.cjae.net/CN/Y2011/V22/I04/1059 [7] 蔡英亚, 谢绍河. 广东的海贝[M]. 汕头: 汕头大学出版社, 2006: 256-257. https://xueshu.baidu.com/usercenter/paper/show?paperid=d867b5aa9d5a8db46f0e034381284b61&site=xueshu_se [8] 郑怀平, 孙泽伟, 张涛, 等. 华贵质控扇贝1龄贝数量性状的相关性及通径分析[J]. 中国农学通报, 2009, 25(20): 322-326. doi: 10.11924/j.issn.1000-6850.2009-1006 [9] 王琦, 袁涛, 何毛贤. 华贵栉孔扇贝养殖及遗传育种研究进展[J]. 南方水产科学, 2011, 7(5): 73-80. doi: 10.3969/j.issn.2095-0780.2011.05.012 [10] ARIAS A, FREIRE R, MÉNDEZ J, et al. Isolation and characterization of microsatellite markers in the Queen Scallop Aequipecten opercularis and their application to a population genetic study[J]. Aquat Living Resour, 2010, 23(2): 199-207. doi: 10.1051/alr/2010011
[11] 刘志刚, 王辉, 吕文刚, 等. 华贵栉孔扇贝壳色与闭壳肌颜色遗传规律的研究[J]. 海洋与湖沼, 2012, 43(2): 237-243. [12] 栗志民, 刘志刚, 谢丽, 等. 体重和温度对华贵栉孔扇贝耗氧率与排氨率的影响[J]. 海洋与湖沼, 2010, 41(1): 512-518. [13] LIU F, WANG W X. Differential roles of metallothionein-like proteins in cadmium uptake and elimination by the scallop Chlamys nobilis[J]. Environ Toxicol Chem, 2011, 30(3): 738-746. doi: 10.1002/etc.435
[14] 陈志鹏, 朱家壁, 陈洪轩, 等. 利用中心复合设计法优化联苯双酯脂质体处方[J]. 南京中医药大学学报, 2009, 25(5): 377-379. doi: 10.3969/j.issn.1000-5005.2009.05.017 [15] 李晓英, 沈睿杰, 董志国, 等. 温度骤升和窒息胁迫对青蛤抗氧化酶活力的影响[J]. 中国饲料, 2009 (1): 39-42. doi: 10.3969/j.issn.1004-3314.2009.01.015 [16] LIU W, LI M, HUANG F, et al. Effects of cadmium stress on xanthine oxidase and antioxidant enzyme activities in Boleophthalmus pectinirostris liver[J]. Chin J Appl Ecol, 2006, 17(7): 1310-1314. https://europepmc.org/article/MED/17044513
[17] YU B P. Cellular defenses against damage from reactive oxygen species [J]. Phys Rev, 1994, 74(1): 139-162. doi: 10.1152/physrev.1994.74.1.139
[18] MONARI M, MATOZZO V, FOSCHI J, et al. Effects of high temperatures on functional responses of haemocytes in the clam Chamelea gallina [J]. Fish Shellfish Immunol, 2007, 22(1): 98-114. doi: 10.1016/j.fsi.2006.03.016
[19] BARDA I, PURINA I, RIMSA E, et al. Seasonal dynamics of biomarkers in infaunal clam Macoma balthica from the Gulf of Riga (Baltic Sea)[J]. J Mar Sys, 2014, 129: 150-156. doi: 10.1016/j.jmarsys.2013.05.006
[20] De ZOYSA M, WHANG I, LEE Y, et al. Transcriptional analysis of antioxidant and immune defense genes in disk abalone (Haliotis discus) during thermal, low-salinity and hypoxic stress [J]. Biochem Mol Biol, 2009, 154(4): 387-395. doi: 10.1016/j.cbpb.2009.08.002
[21] 李大鹏, 刘松岩, 谢从新, 等. 水温对中华鲟血清活力氧含量及抗氧化防御系统的影响[J]. 水生生物学报, 2008, 32(3): 327-332. doi: 10.3321/j.issn:1000-3207.2008.03.006 [22] MORGAN J D, IWAMA G K. Effects of salinity on growth, metabolism, and ion regulation in juvenile rainbow and steelhead trout (Oncorhynchus mykiss) and fall chinook salmon (Oncorhynchus tshawytscha) [J]. Can J Fish Aquat Sci, 1991, 48(11): 2083-2094. doi: 10.1139/f91-247
[23] 郭黎, 马爱军, 王新安, 等. 盐度和温度对大菱鲆幼鱼抗氧化酶活力的影响[J]. 大连海洋大学学报, 2012, 27(5): 422-428. doi: 10.3969/j.issn.2095-1388.2012.05.008 [24] 雷思佳. 盐度与体重对台湾红罗非鱼耗氧率的影响[J]. 应用生态学报, 2002, 13(6): 739-742. https://www.cjae.net/CN/Y2002/V/I6/739 [25] 强俊, 任洪涛, 徐跑, 等. 温度与盐度对吉富品系尼罗罗非鱼幼鱼生长和肝脏抗氧化酶活力的协同影响[J]. 应用生态学报, 2012, 23(1): 255-263. https://www.cjae.net/CN/Y2012/V23/I01/255 [26] 时少坤, 王瑞璇, 王江勇, 等. 盐度胁迫对近江牡蛎几种免疫因子的影响[J]. 南方水产科学, 2013, 9(3): 26-30. [27] PAITAL B, CHAINY G B N. Antioxidant defenses and oxidative stress parameters in tissues of mud crab (Scyllaserrata) with reference to changing salinity[J]. Toxicol Pharmac, 2010, 151(1): 142-151. doi: 10.1016/j.cbpc.2009.09.007
[28] 杨健, 陈刚, 黄建盛, 等. 温度和盐度对军曹鱼幼鱼生长与抗氧化酶活力的影响[J]. 广东海洋大学学报, 2007, 27(4): 25-29. https://shdx.cbpt.cnki.net/WKB/WebPublication/paperDigest.aspx?paperID=73a1eb29-59ef-461f-a7e2-ece8b28b7eb3 -
期刊类型引用(6)
1. 张文博,黄洪辉,巩秀玉,刘华雪. 南海西部不同粒级浮游动物碳氮稳定同位素研究. 海洋环境科学. 2025(01): 89-96 .  百度学术
百度学术
2. 贡艺,梁茜,李云凯,刘必林,牛成功. 西北太平洋桡足类稳定同位素特征及其影响因素. 生态学杂志. 2024(02): 505-513 .  百度学术
百度学术
3. 严淋露,庞博,查穆哈,陈星瑶,康振坤,王强. 湿地食物网研究中基线物种及分馏因子的可变性对营养级评估的影响. 湿地科学. 2024(02): 291-302 .  百度学术
百度学术
4. 王开立,龚玉艳,陈作志,许友伟,孙铭帅,蔡研聪,李佳俊,徐姗楠. 基于稳定同位素技术的南海北部蓝圆鲹的营养生态位. 生态学杂志. 2022(04): 724-731 .  百度学术
百度学术
5. 庄康,胡晓娟,曹煜成,许云娜,张建设,文国樑. 不同寡营养培养条件下南海水体细菌群落结构及其对碳源的利用特征. 微生物学通报. 2020(09): 2697-2710 .  百度学术
百度学术
6. 刘华雪,张文博,徐军,李纯厚,黄洪辉. 南海北部不同粒级浮游动物碳稳定同位素研究. 南方水产科学. 2018(02): 36-40 .  本站查看
本站查看
其他类型引用(8)




 下载:
下载:




 粤公网安备 44010502001741号
粤公网安备 44010502001741号
