Synergistic effect of temperature and salinity on antioxidant enzymes activities of Chlamys nobilis
-
摘要:
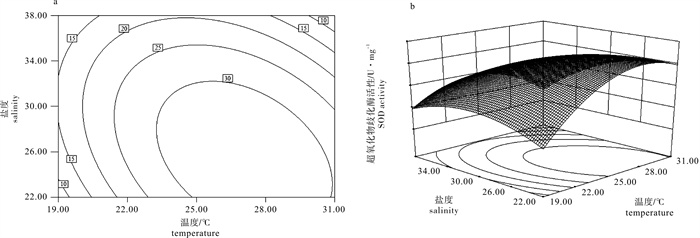
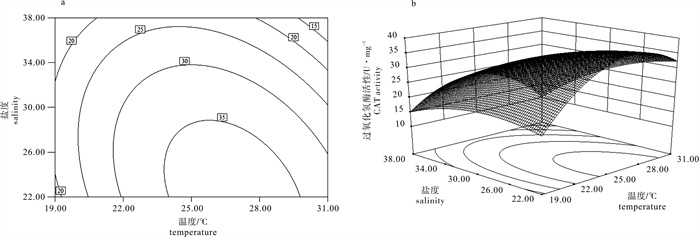
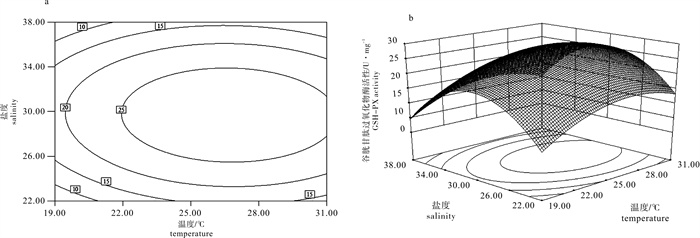
采用中心复合设计(CCD)和响应曲面分析法(RSM),研究了温度(19~31 ℃)和盐度(22~38)对华贵栉孔扇贝(Chlamys nobilis)超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-PX)3种抗氧化酶活性的联合效应。结果显示,温度的一次、二次效应对SOD、CAT和GSH-PX活性的影响显著(P < 0.05)。盐度的一次效应对SOD和CAT活性的影响显著(P < 0.05),但对GSH-PX活性影响不显著(P>0.05),盐度的二次效应对SOD、CAT和GSH-PX活性的影响均显著(P < 0.05)。温度和盐度的互作效应对SOD、CAT活性的影响显著(P < 0.05),但对GSH-PX活性的影响不显著(P>0.05)。采用响应曲面法建立模型方程决定系数分别为0.950 1、0.981 5和0.967 9,表明建立的模型拟合度极高,可用于预测华贵栉孔扇贝3种抗氧化酶活性的变化。模型优化和验证试验表明,26.4 ℃和盐度27.7时,SOD、CAT和GSH-PX活性达最大值,分别为33.02 U · mg-1、35.73 U · mg-1和27.94 U · mg-1,满意度为0.989。
Abstract:By using two-factor central composite design (CCD) and response surface methodology(RSM), we studied the synergistic effect of temperature (19~31 ℃) and salinity (22~38) on the superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GSH-PX) activities of Chlamys nobilis. The results show that the linear and quadratic effects of temperature on SOD, CAT and GSH-PX activities were significant (P < 0.05). The linear effects of salinity on SOD and CAT activities were significant (P < 0.05), but the linear effect of salinity on GSH-PX activity was not significant (P>0.05). Salinity had significant quadratic effect on SOD, CAT and GSH-PX activities (P < 0.05). The interactive effects of temperature and salinity were significant on SOD and CAT activities (P < 0.05), but there was no significant effect on GSH-PX activity (P>0.05). By response surface methodology, we established a model equation for the relationship of antioxidant enzyme activities to the two factors, with the R2 of 0.950 1, 0.981 5 and 0.967 9. It is suggested that the fitting capability of the model was satisfactory and could be practicably applied for prediction. The antioxidant enzyme activities reached their maximum (33.02 U · mg-1, 35.73 U · mg-1 and 27.94 U · mg-1) when the 2-factor combination was 26.4 ℃/27.7, with the desirability value being 0.989.
-
Keywords:
- Chlamys nobilis /
- central composite design /
- response surface method /
- temperature /
- salinity /
- antioxidant enzyme
-
全球气候变化对生态系统产生深远影响,制约着物种的生态习性和地理分布,是影响海洋生物分布格局的重要因素之一[1]。随着气候变化引起的海水酸化和温度上升等进程的持续,大多数海洋生物的新陈代谢、个体发育和生活史特征等在一定程度上受到了影响,导致群落结构发生变化,同时分布格局也随气候变化产生生境迁移[2-4]。这些改变可能导致生物面临种群数量显著下降或加速灭绝的风险,进而引起生态系统结构和功能紊乱、生物多样性丧失[5]。作为海洋生物的典型代表,长棘海星 (Acanthaster planci) 和褐拟鳞鲀 (Balistoides viridescens) 对气候变化的响应受到了广泛关注。了解它们对全球气候变化的响应并确定影响其生境分布的关键因素,对维持生物多样性的稳定以及珊瑚礁生态系统保护与恢复管理措施的制定具有至关重要的作用。
长棘海星隶属于棘皮动物门、海星纲、有棘目、长棘海星科、长棘海星属,分布于印度-太平洋热带珊瑚礁海域[6],是著名的“珊瑚杀手”。据统计,1963年以来澳大利亚大堡礁共经历了3次长棘海星大规模暴发,导致大量珊瑚白化,珊瑚礁生态系统严重退化、生物多样性显著降低[7]。1985—2012年间对珊瑚礁的广泛调查发现,全球珊瑚礁的活珊瑚覆盖率从28.0%下降至13.8%,其中由长棘海星造成的损害高达42%,对珊瑚礁生态系统造成了严重危害[8]。由于人类对其天敌 [如法螺 (Charonia tritonis) 等] 的过度捕捞、营养盐大量流入等影响,导致长棘海星易出现周期性暴发[9]。了解长棘海星在未来不同气候情景下的潜在分布变化可为保护和修复珊瑚礁生态系统提供理论依据和科学指导。遗憾的是我国对于长棘海星的研究仍处于起步阶段,相关研究鲜有报道。褐拟鳞鲀是长棘海星的重要捕食者,隶属于辐鳍鱼纲、鲀形目、鳞鲀科,分布在热带和温带的淡水和海洋环境中[10],具有非常高的经济价值。在印度洋-太平洋的海域中,褐拟鳞鲀会捕食成年长棘海星,与长棘海星的种群动态存在一定关联[11]。此外,气候变化对两个物种潜在适宜生境分布的影响也尚未得到评估。
物种分布模型 (Species distribution models, SDMs) 是研究气候变化对物种潜在生境分布格局影响及生物多样性响应的有效工具[12]。随着统计学和生态学理论的不断完善及计算机应用技术的深入发展,SDMs技术也得到了改进,并广泛应用于陆地、淡水和海洋物种的地理分布预测、生境气候适宜性评价及野生资源保护与管理等方面[13]。Feitosa等[14]利用SDMs并结合公开数据对小尾真鲨 (Carcharhinus porosus) 当前和未来的潜在分布做出预测,确定南美北部海岸为保护该物种最有潜力的区域;Zhang等[15]利用SDMs预测了未来不同情景下中国、韩国和日本沿海的日本少鳞鱚 (Sillago japonica) 的潜在生境分布情况,指出未来管理战略需考虑其适宜生境范围的缩小及北移,为制定管理策略提供了重要指导。可见,SDMs在模拟未来气候变化情景下物种的生境变化具有广泛应用。
目前关于长棘海星的研究主要集中在其生物累积与分布特征、暴发原因探讨、危害与防治等方面[16-17],也有少数利用单一物种分布模型对长棘海星的研究[18]。而褐拟鳞鲀的相关报道则集中在其生物学特征与遗传方面[10,19]。本研究结合长棘海星、褐拟鳞鲀的现有分布数据,利用组合物种分布模型对两者的适宜生境分布进行模拟,揭示影响分布的关键环境因子,并绘制两个物种当前和未来不同气候情景下的适宜生境,为维持珊瑚礁生态可持续发展及制定未来气候适应管理决策提供科学参考。
1. 材料与方法
1.1 物种分布数据
本研究主要针对长棘海星及其捕食者褐拟鳞鲀在全球范围内的分布情况。通过查询全球生物多样性信息网络 (Global biodiversity information facility, GBIF, http://www.Gbif.org) 获取2000年以来长棘海星及褐拟鳞鲀的发生记录。为减少采样带来的偏差并与环境数据分辨率相匹配,筛选掉重复及坐标不精确的样本,保证每个栅格数据内随机选取1个样本,最终获得1 094个长棘海星和1 793个褐拟鳞鲀的数据用于模型构建 (图1)。建模过程中部分算法有时需要环境条件来与发现物种的环境进行对比,需要物种的实际和缺席分布数据[20]。由于缺乏两物种不存在点数据,因此运行模型时在全球地理范围内随机生成10 000个坐标点作为伪不存在点,以提高模型性能。
1.2 环境变量
综合考虑数据可用性和环境相关性,本研究以全球海洋环境数据为分析依据。当前和未来 (2040—2050年) 的海洋遥感数据来源于BIO-Oracle v2.1 (https://bio-oracle.org/) 数据库及Global Marine Environment Datasets数据库 (http://gmed.auckland.ac.nz/index.html)。共下载57个环境变量,经过处理后空间分辨率为0.083 333 333。考虑到环境因子间的自相关性会影响模型的准确度,因此计算每对变量间的Pearson相关系数,若 >|0.7| 则认为相关性较强,保留其中1个变量[21],最终得到表1的12个环境变量。未来海洋环境数据的科学假设来自于4种排放情景,即“典型浓度目标 (Representative concentration pathways, RCP)”,分别代表不同CO2排放标准下的未来情景,包括RCP26 (最低温室气体排放)、RCP45 (中等温室气体排放)、RCP60 (较高温室气体排放) 和RCP85 (最高温室气体排放)[22]。本研究选择RCP26、RCP60和RCP85情景来模拟未来环境,用对应变量建模并对未来气候进行投影。
表 1 环境变量说明Table 1. Description of environmental variables变量 Variable 单位 Unit 最大叶绿素质量浓度 Maximum chlorophyll mg·m−3 最大流速 Maximum current velocity m·s−1 最小流速 Minimum current velocity m·s−1 平均溶解氧浓度Mean dissolved oxygen mol·m−3 最小铁离子浓度 Minimum iron μmol·m−3 最小硝酸盐浓度 Minimum nitrate mol·m−3 最小浮游动物浓度 Minimum phytoplankton μmol·m−3 最小初级生产力浓度
Minimum primary productivityg·m−3·d−1 平均盐度 Mean salinity ‰ 最小温度 Minimum temperature ℃ 深度 Depth m 离岸距离 Land distance km 1.3 物种分布模型构建
本研究基于R语言biomod2程序包对两个物种当前和未来的潜在分布区进行预测。选取广义线性模型 (Generalized Linear Model, GLM)、推进式回归树模型 (Generalized Boosting Model, GBM)、分类树分析 (Classification Tree Analysis, CTA)、人工神经网络 (Artificial Neural Network, ANN)、表面分布区分室 (Surface Range Envelope, SRE) 模型、柔性判别分析 (Flexible Discriminant Analysis, FDA) 以及随机森林 (Random Forest, RF) 7种单一模型。为构建更多单一模型结果,减小单次模型运行带来的误差,每种模型算法运行10次,模型参数设置为默认。而后对单一模型结果进行集成产生组合模型用于后续的结果分析,以提高模型精度。
1.4 模型评估方法
模型运行时,将数据随机拆分,80%作为训练集样本,20%作为测试集样本,对模型精度进行交叉验证。模型评价使用真实技巧统计 (True skill statistic, TSS) 和受试者操作特征曲线 (Receiver operating curve, ROC) 2个统计学参数[23]。ROC曲线以假正率为横坐标,真正率为纵坐标。TSS值综合敏感度和特异性指标,考虑了疏忽性和替代性的错误,其取值范围为 [0,1],>0.8时拟合效果极好,0.6~0.8拟合效果好,0.4~0.6拟合效果一般[24]。
1.5 模型集成方法
综合考虑所有模型的运算结果,保留TSS和ROC值均 >0.9的单模型构成最终组合模型的结果。采用投票平均 (Committee Averaging, CA) 和概率加权平均 (Weighted Mean of Probabilities, WM) 对所有单一模型进行集成产生组合模型 (Ensemble Model),并对模型的不确定性进行评估[25]。
2. 结果
2.1 模型性能评价
模型交叉验证结果显示,两个物种的模型性能结果存在一定的相似性 (图2),表现最好的模型均为随机森林模型 (RF),长棘海星RF的TSS和ROC值分别为0.96和0.99 (图2-a),褐拟鳞鲀RF的TSS和ROC值分别为0.97和0.99 (图2-b),表明模型的预测精度高,整体性能较优。然而SRE模型表现出了最差的性能 (图2),两物种SRE模型的TSS值均为0.62、ROC值均为0.81,结果显示了不同单一模型间的不确定性。长棘海星与褐拟鳞鲀投票平均和概率加权平均组合模型的TSS、ROC值分别为0.96、0.99与0.97、0.99,评估结果表明,组合模型能够一定程度上减少不同单一模型的不确定性,提高预测的准确性。
![]() 图 2 基于TSS和ROC的7种物种分布模型统计结果注:a. 长棘海星;b. 褐拟鳞鲀;GLM. 广义线性模型;GBM. 推进式回归树模型;CTA. 分类树分析模型;ANN. 人工神经网络模型;SRE. 表面分布区分室模型;FDA. 柔性判别分析模型;RF. 随机森林模型。Figure 2. Results of statistical analyses of seven species distribution models based on analyses of true skill statistics and receiver operating curveNote: a. A. planci; b. B. viridescens; GLM. Generalized Linear Model; GBM. Generalized Boosting Model; CTA. Classification Tree Analysis; ANN. Artificial Neural Network; SRE. Surface Range Envelope; FDA. Flexible Discriminant Analysis; RF. Random Forest.
图 2 基于TSS和ROC的7种物种分布模型统计结果注:a. 长棘海星;b. 褐拟鳞鲀;GLM. 广义线性模型;GBM. 推进式回归树模型;CTA. 分类树分析模型;ANN. 人工神经网络模型;SRE. 表面分布区分室模型;FDA. 柔性判别分析模型;RF. 随机森林模型。Figure 2. Results of statistical analyses of seven species distribution models based on analyses of true skill statistics and receiver operating curveNote: a. A. planci; b. B. viridescens; GLM. Generalized Linear Model; GBM. Generalized Boosting Model; CTA. Classification Tree Analysis; ANN. Artificial Neural Network; SRE. Surface Range Envelope; FDA. Flexible Discriminant Analysis; RF. Random Forest.2.2 环境变量重要性评估
筛选后参与建模的环境变量共12个 (表1),其Pearson相关系数均 <|0.7|,表明变量间的相关性较弱,可提高预测准确度。对于长棘海星,最小温度和离岸距离的重要性最高,两者重要性之和超过70% (表2),表明这两个变量是长棘海星空间分布的主要影响因子。对于褐拟鳞鲀,最小温度、平均溶解氧浓度和离岸距离的重要性最高,三者重要性之和占70%以上,因此,这3个变量可能是决定褐拟鳞鲀空间分布的主要影响因子 (表3)。
表 2 长棘海星影响因子重要性排序结果Table 2. Importance ranking of factors influencing distribution of A. planci影响因子
Environmental factor重要性
Importance/%排序
Sorting最小温度 Minimum temperature 43.34 1 离岸距离 Land distance 28.54 2 最小铁离子浓度 Minimum iron 8.03 3 平均溶解氧浓度 Mean dissolved oxygen 7.61 4 平均盐度 Mean salinity 2.75 5 最小初级生产力浓度
Minimum primary productivity1.90 6 深度 Depth 1.90 6 最小硝酸盐浓度 Minimum nitrate 1.48 8 最大流速 Maximum current velocity 1.27 9 最小浮游动物浓度
Minimum phytoplankton1.27 9 最大叶绿素浓度 Maximum chlorophyll 1.06 11 最小流速 Minimum current velocity 0.85 12 表 3 褐拟鳞鲀影响因子重要性排序结果Table 3. Importance ranking of factors influencing distribution of B. viridescens影响因子
Environmental factor重要性
Importance/%排序
Sorting最小温度 Minimum temperature 48.82 1 平均溶解氧浓度 Mean dissolved oxygen 15.94 2 离岸距离 Land distance 11.81 3 最小铁离子浓度 Minimum iron 8.86 4 平均盐度 Mean salinity 4.13 5 最小初级生产力
Minimum primary productivity2.36 6 最大流速 Maximum current velocity 2.17 7 最小硝酸盐浓度 Minimum nitrate 1.57 8 深度 Depth 1.57 8 最小浮游动物浓度
Minimum phytoplankton1.18 10 最大叶绿素浓度 Maximum chlorophyll 0.98 11 最小流速 Minimum current velocity 0.59 12 环境变量的响应曲线表示的是物种存在概率与对应环境变量之间的关系,可从中解析长棘海星和褐拟鳞鲀在不同环境下的生态位,从而确定其适宜生境。长棘海星的存在概率与温度整体上呈非线性关系,多数模型预测其存在概率随温度增加而逐渐增大并趋于稳定 (图3)。离岸距离响应曲线的结果显示出了模型间的差异,整体而言,离岸距离越小,长棘海星的生境适宜性越高。不同模型的铁离子浓度响应曲线也表现出一定的差异,长棘海星生境适宜性随铁离子浓度的增加而降低 (图3)。
![]() 图 3 预测长棘海星与褐拟鳞鲀发生概率随环境变量的响应曲线注:GLM. 广义线性模型;GBM. 推进式回归树模型;CTA. 分类树分析模型;ANN. 人工神经网络模型;SRE. 表面分布区分室模型;FDA. 柔性判别分析模型;RF. 随机森林模型。Figure 3. Response curves of predicted occurrence probability of A. planci and B. viridescens against environment variablesNote: GLM. Generalized Linear Model; GBM. Generalized Boosting Model; CTA. Classification Tree Analysis; ANN. Artificial Neural Network; SRE. Surface Range Envelope; FDA. Flexible Discriminant Analysis; RF. Random Forest.
图 3 预测长棘海星与褐拟鳞鲀发生概率随环境变量的响应曲线注:GLM. 广义线性模型;GBM. 推进式回归树模型;CTA. 分类树分析模型;ANN. 人工神经网络模型;SRE. 表面分布区分室模型;FDA. 柔性判别分析模型;RF. 随机森林模型。Figure 3. Response curves of predicted occurrence probability of A. planci and B. viridescens against environment variablesNote: GLM. Generalized Linear Model; GBM. Generalized Boosting Model; CTA. Classification Tree Analysis; ANN. Artificial Neural Network; SRE. Surface Range Envelope; FDA. Flexible Discriminant Analysis; RF. Random Forest.由图3可知,当温度低于6 ℃时,褐拟鳞鲀存在的概率很低,随着温度的增加,其存在的概率增大,当温度高于16 ℃时,其生境适宜性陡然增加,达0.8以上。而多数模型溶解氧浓度响应曲线的结果相似,其溶解氧浓度的适宜范围约为100~200 mol·m−3。褐拟鳞鲀的离岸距离响应曲线结果与长棘海星相似,不同模型间的差异较大。总体而言,离岸距离越小,生境适宜性越高。
2.3 长棘海星、褐拟鳞鲀适宜生境分布预测
2.3.1 长棘海星、褐拟鳞鲀当前在世界范围内的适宜生境分布预测
当前长棘海星潜在分布区主要集中在北印度洋和西太平洋海域,其极适宜生境广泛分布于澳大利亚北部海岸、印度尼西亚海岸以及中国南海一直延伸至东海海域,美洲中部海域及红海海域也有少量分布 (图4-a—4-b)。从褐拟鳞鲀的预测结果来看,其分布的主要区域与长棘海星大致重叠。其极适宜生境同样分布在澳大利亚北部海岸、印度尼西亚海岸以及中国南海海域 (图4-c—4-d)。与长棘海星不同的是,褐拟鳞鲀在非洲南部海岸、美洲中部海岸的潜在分布明显低于长棘海星,而在红海海域的分布明显高于长棘海星。两物种的预测结果总体表现为极高适宜生境与高适宜生境分布在热带、亚热带等低纬度地区,而低、中适宜生境向高纬度地区延伸扩散。
![]() 图 4 当前环境下长棘海星与褐拟鳞鲀的潜在分布适生区注:a、b. 长棘海星;c、d. 褐拟鳞鲀;WM. 概率加权平均组合模型;CA. 投票平均组合模型。Figure 4. Potential suitable habitat of A. planci and B. viridescens in current environmentNote: a, b. A. planci; c, d. B. viridescens; WM. Weighted Mean of Probabilities Ensemble Model; CA. Committee Averaging Ensemble Model.
图 4 当前环境下长棘海星与褐拟鳞鲀的潜在分布适生区注:a、b. 长棘海星;c、d. 褐拟鳞鲀;WM. 概率加权平均组合模型;CA. 投票平均组合模型。Figure 4. Potential suitable habitat of A. planci and B. viridescens in current environmentNote: a, b. A. planci; c, d. B. viridescens; WM. Weighted Mean of Probabilities Ensemble Model; CA. Committee Averaging Ensemble Model.长棘海星潜在适宜生境面积达3 027.80万km2,其中极适宜生境面积为460.90万km2 (约占全球海洋面积的1.2%),占适宜生境面积的15.22% (图4-a,表4),非适宜生境面积占绝大部分,达37 039.68万km2 (92.4%)。褐拟鳞鲀的潜在适宜生境比长棘海星更广,其面积达3 813.84万km2,其中极适宜生境面积为590.00万km2 (约占全球海洋面积的1.5%),占适宜生境面积的15.47% (图4-c,表4),非适宜生境面积达36 253.64万km2 (90.5%)。
表 4 长棘海星与褐拟鳞鲀的适宜生境占比Table 4. Proportions of suitable habitat for A. planci and B. viridescens物种
Species气候情景
Climate scenario低适宜生境占比
Proportion of
low suitability
habitat/%中适宜生境占比
Proportion of
moderately suitable
habitat/%高适宜生境占比
Proportion of
highly suitable
habitat/%极适宜生境占比
Proportion of
extremely suitable
habitat/%长棘海星
A. planci现在Current 40.23 24.33 20.22 15.22 RCP26 40.35 24.11 20.12 15.42 RCP60 40.18 24.06 20.09 15.67 RCP85 40.13 24.05 20.14 15.68 褐拟鳞鲀
B. viridescens现在Current 42.22 24.07 18.24 15.47 RCP26 41.82 24.10 18.31 15.77 RCP60 41.86 23.99 18.18 15.97 RCP85 41.86 23.90 18.24 16.00 注:非适宜生境不在计算范畴内。 Note: Unsuitable habitat is not included in the calculation. 2.3.2 未来不同气候情景下长棘海星和褐拟鳞鲀的适宜生境预测
两种不同组合模型 (WM、CA) 预测的长棘海星的适宜生境面积存在差异,但预测的总体趋势均为增大,不同气候情景下增幅不同。WM模型预测未来长棘海星在RCP26、RCP60和RCP85情景下总适宜生境面积分别增加78.87万、74.70万和102.41万km2,增幅分别为2.60%、2.47%和3.38%,其中极适宜生境增幅分别为3.97%、5.49%和6.49% (图5-a、5-c、5-e)。而CA模型预测RCP26、RCP60和RCP85情景下总适宜生境面积分别增加84.14万、75.83万和107.71万km2,增幅为3.50%、3.15%和4.48%,其中极适宜生境分别增加3.41%、3.82%和4.60% (图5-b、5-d、5-f)。不同气候情景下长棘海星未来的潜在分布面积均会扩大,且CA模型下的增幅略高于WM模型,但WM模型预测的极适宜生境面积增幅明显高于CA模型。
![]() 图 5 长棘海星未来不同气候情景下的潜在分布注:WM. 概率加权平均组合模型;CA. 投票平均组合模型;RCP26. 最低温室气体排放情景;RCP60. 较高温室气体排放情景;RCP85. 最高温室气体排放情景。Figure 5. Potential future distribution of A. planci under different climate scenariosNote: WM. Weighted Mean of Probabilities Ensemble Model; CA. Committee Averaging Ensemble Model; RCP26. Minimum greenhouse gas emission scenarios; RCP60. Higher greenhouse gas emission scenarios; RCP85. Maximum greenhouse gas emission scenarios.
图 5 长棘海星未来不同气候情景下的潜在分布注:WM. 概率加权平均组合模型;CA. 投票平均组合模型;RCP26. 最低温室气体排放情景;RCP60. 较高温室气体排放情景;RCP85. 最高温室气体排放情景。Figure 5. Potential future distribution of A. planci under different climate scenariosNote: WM. Weighted Mean of Probabilities Ensemble Model; CA. Committee Averaging Ensemble Model; RCP26. Minimum greenhouse gas emission scenarios; RCP60. Higher greenhouse gas emission scenarios; RCP85. Maximum greenhouse gas emission scenarios.褐拟鳞鲀全球潜在适宜生境在未来不同气候情景下也均表现为增加,WM模型预测RCP26、RCP60和RCP85情景下其总适宜生境面积分别增加90.75万、90.64万和112.09万km2,增幅分别为2.38%、2.37%和2.94%,其中极适宜生境分别增加4.38%、5.69%和6.49% (图6-a、6-c、6-e)。CA模型预测RCP26、RCP60和RCP85情景下总适宜生境面积分别增加111.13万、106.98万和145.99万km2,增幅为3.71%、3.58%和4.88%,其中极适宜生境分别增加5.02%、5.77%和6.78% (图6-b、6-d、6-f)。与长棘海星结果不同的是,CA模型预测褐拟鳞鲀的未来潜在分布总面积与极适宜生境面积增幅均高于WM模型,表现出模型对于不同物种的差异。除此之外,两物种的潜在分布区域均有向高纬度地区移动的趋势。
![]() 图 6 褐拟鳞鲀未来不同气候情景下的潜在分布注:WM. 概率加权平均组合模型;CA. 投票平均组合模型;RCP26. 最低温室气体排放情景;RCP60. 较高温室气体排放情景;RCP85. 最高温室气体排放情景。Figure 6. Potential future distribution of B. viridescens under different climate scenariosNote: WM. Weighted Mean of Probabilities Ensemble Model; CA. Committee Averaging Ensemble Model; RCP26. Minimum greenhouse gas emission scenarios; RCP60. Higher greenhouse gas emission scenarios; RCP85. Maximum greenhouse gas emission scenarios.
图 6 褐拟鳞鲀未来不同气候情景下的潜在分布注:WM. 概率加权平均组合模型;CA. 投票平均组合模型;RCP26. 最低温室气体排放情景;RCP60. 较高温室气体排放情景;RCP85. 最高温室气体排放情景。Figure 6. Potential future distribution of B. viridescens under different climate scenariosNote: WM. Weighted Mean of Probabilities Ensemble Model; CA. Committee Averaging Ensemble Model; RCP26. Minimum greenhouse gas emission scenarios; RCP60. Higher greenhouse gas emission scenarios; RCP85. Maximum greenhouse gas emission scenarios.3. 讨论
3.1 物种分布组合模型在适宜生境研究中的应用
多数研究表明,使用物种分布模型对海洋生物的潜在分布进行模拟时,各类单一模型的运行过程及算法存在不确定性和差异性,会降低预测的精度[26]。采用本研究构建的组合模型评估当前及未来3种不同气候情景下长棘海星与褐拟鳞鲀的潜在适生区动态变化,可有效降低单一模型造成的偏差。真实技巧统计值与受试者工作特征曲线是评价模型常用的指标[27]。研究结果显示,长棘海星与褐拟鳞鲀组合模型的TSS和ROC值高于大多数单一模型的结果,表明组合模型对两个物种潜在适生区的模拟结果准确。Weinert等[28]使用Biomod2程序包的6种单模型构建组合模型研究北海底栖生物的分布变化情况,结果也表明组合模型可降低模型的不确定性。本研究的模型预测结果与已知的长棘海星和褐拟鳞鲀的分布范围大致符合 (主要分布在北印度洋、西太平洋海域)。但本研究使用的建模方式仍存在一定的局限性。首先,物种扩散能力与种群动态息息相关,长棘海星与褐拟鳞鲀的扩散受到洋流及自身游泳能力的限制,但本研究并未考虑扩散的影响[29]。其次,人为因素对海洋生物的影响加剧[30],本研究只考虑了部分重要环境因素的影响。此外,受限于未来环境变量的获取,以及在实际情况下存在各种限制因素,本研究可能会高估长棘海星和褐拟鳞鲀的分布范围。生物间的相互作用也会对物种产生重要影响,褐拟鳞鲀作为长棘海星的重要捕食者,对长棘海星的种群动态也会产生干扰,并未纳入此次研究的范围。
3.2 影响长棘海星与褐拟鳞鲀适宜生境分布的主要因素
长棘海星与褐拟鳞鲀均生活在珊瑚礁生境,其种群动态与珊瑚礁生态系统密切相关。模型预测影响长棘海星空间分布的主要因素是温度和离岸距离,其中温度是最重要的因子。对褐拟鳞鲀分布有重要影响的环境变量为温度、溶解氧浓度与离岸距离,同样温度为最重要的因子。温度与海洋生物的新陈代谢有关,从而对生物的种群动态产生影响,模型结果显示,当温度高于15 ℃,长棘海星的生境适宜性增加。温度对长棘海星的产卵及幼虫成活率有重要影响,海水温度达27 ℃阈值时,长棘海星才开始产卵。其幼虫最佳发育温度在不同发育阶段有所差异,胚囊幼虫期为13~34 ℃,羽腕幼虫期为14.5~32 ℃,中晚期幼虫为26~30 ℃,当高于32 ℃时幼虫会死亡,低于25 ℃时则停止发育并退回早期发育阶段[31-32]。海水温度对中上层鱼类的水平和垂直移动有重要影响[33]。海温、叶绿素与上升流是影响鱼类空间分布的主要驱动因素,如鳀鱼 (Engraulis ringens) 等[34]。由此可见,温度可能是最主要和最普遍的鱼类分布驱动因子。离岸距离影响长棘海星分布,其原因可能与珊瑚礁形成有关,但未见相关的研究报道。长棘海星以珊瑚为食,在很大程度上珊瑚决定长棘海星的空间分布,而珊瑚对于生长环境的要求比较严格,主要分布在热带浅水海域,离海岸的距离较近。陆架边缘鱼类分布广泛、种类多,许多鱼类会在繁殖季节回到近岸海域产卵,因此离岸距离是影响鱼类栖息地的重要环境因子。一些鱼类的分布可能与特定生境的距离高度相关[35]。此外,溶解氧是海洋鱼类获得氧气的主要来源[36],对褐拟鳞鲀的栖息地分布起着重要作用。由于温室气体大量排放,未来全球气候变暖极有可能使当前适宜生存的环境因素超出物种的耐受阈值,诱发长棘海星和褐拟鳞鲀迁移到符合其生境偏好的新水域或在当前适宜生境做出适应性改变或急剧减少,从而引起两个物种的生境范围发生变化[37]。
3.3 不同气候情景下长棘海星与褐拟鳞鲀潜在适生区的变化
气候变暖导致全球海洋生物的丰度呈现向极地方向增加且向赤道方向减少的趋势[38]。本研究结果表明,当前环境下长棘海星的适宜栖息地主要分布于印度-太平洋海域、中国南海到澳大利亚海岸线、红海和阿拉伯海,与Sill和Dawson[18]的研究结果相似。本研究对长棘海星和褐拟鳞鲀当前和未来的栖息地分布做出了较为可靠的预测,可以为制定长棘海星暴发管理的策略提供一些参考。例如可针对长棘海星未来生境适宜性较高的海域,定期开展长棘海星的跟踪监测,对可能出现长棘海星暴发的海域进行预警[39]。当前环境下褐拟鳞鲀极适宜生境分布在40°N—40°S,其分布区域大部分覆盖了长棘海星的分布范围,可能是由于褐拟鳞鲀会捕食长棘海星,长棘海星存在的地方可以为它们提供部分食物来源,适合其生存[40]。未来不同气候情景下,长棘海星和褐拟鳞鲀的共性是两者的总体适生区范围均呈现出一定程度向高纬度地区扩大的趋势,模型预测温度是影响两个物种空间分布的最重要因素,未来全球气候变暖致使水温升高,促进了长棘海星与褐拟鳞鲀的生长发育。长棘海星具有逃离天敌存在区域的生物特性[41],因此可在其可能暴发的海域大量投放成本较低的长棘海星幼体和成体捕食者,从而减少长棘海星暴发的风险。在升温2 ℃的情况下,长棘海星幼虫的成活率可能会提高240%,在食物供应不变的情况下,发育速度会提高30%[42],从而导致其分布范围发生变化。本研究结果也符合未来条件下物种生存范围的变化趋势。研究显示气候变化改变了127种海洋生物的分布范围,其中大部分物种的潜在分布向高纬度海域移动[43]。在非洲南部海岸、美洲中部海岸,长棘海星的适宜生境明显比褐拟鳞鲀更广泛,这可能是因为在不适合褐拟鳞鲀栖息的地区,由于捕食者压力的潜在释放,会出现更为丰富的长棘海星种群[44]。到2050s,2种生物的潜在适宜生境在热带及亚热带海域的部分缩减,推测可能因气候变化使得海洋温度上升,海洋生物可能会向更适宜生存的极地迁徙[45]。在本研究记录数据以外的部分非洲和美洲沿岸海域也发现了褐拟鳞鲀的适宜栖息地,可能是由于气候变暖导致这些海域的理化性质改变,从而变得适合褐拟鳞鲀的生长。此外,控制海洋环境改变以及减少人为活动的干扰对减缓长棘海星暴发周期也具有重要作用[46],通过控制陆源污染以改善珊瑚礁区水质、设置禁渔或保护区以保护鱼类种群丰度和多样性,同时减少对长棘海星天敌的过度捕捞等都是维护珊瑚礁生态系统稳定和可持续发展的必要措施。
4. 结论
本研究基于组合物种分布模型,预测了不同气候情景下长棘海星与褐拟鳞鲀全球范围内的潜在分布格局,并分别探讨了2个物种分布的主要影响因子。结果表明,组合模型的结果优于单一模型,一定程度上能够提高预测的准确性。影响长棘海星空间分布的主要因素是温度和离岸距离,而影响褐拟鳞鲀空间分布的主要因素是温度、溶解氧浓度和离岸距离。长棘海星与褐拟鳞鲀在未来气候情景下的潜在分布均有扩大且向高纬度地区移动的趋势。本研究结果将为长棘海星生态管理的应用、维护生态系统多样性、制定未来气候适应管理决策提供科学依据。
-
表 1 试验设计及结果
Table 1 Experiment design and result
试验组group 编码值coded value 实际值actual value 超氧化物歧化酶/U·mg-1
SOD过氧化氢酶/ U·mg-1
CAT谷胱甘肽过氧化物酶/ U·mg-1
GSH-PXT S T S 1 0 -1 25 22 31.43±1.43 38.32±1.03 14.27±1.32 2 1 1 31 38 7.21±1.46 11.09±1.39 11.28±0.58 3 -1 -1 19 22 6.14±0.22 17.94±2.10 6.34±1.64 4 0 0 25 30 30.51±0.64 35.25±0.56 27.43±1.02 5 0 0 25 30 28.65±0.13 32.95±0.42 31.34±0.75 6 -1 0 19 30 16.23±1.24 20.42±1.43 16.76±0.53 7 0 0 25 30 37.56±0.73 33.95±0.48 29.56±0.85 8 0 1 25 38 17.34±1.43 21.42±1.71 11.44±1.45 9 -1 1 19 38 9.95±1.28 16.32±1.91 5.96±1.35 10 1 -1 31 22 29.78±0.45 31.32±2.42 13.74±1.84 11 1 0 31 30 22.67±0.94 25.48±2.33 24.34±0.93 注:T. 温度;S. 盐度
Note:T. temperature;S. salnity表 2 温度和盐度对超氧化物歧化酶活性影响回归模型方差分析
Table 2 Variance analysis of synergistic effect of temperature and salinity on SOD activity
来源
source平方和
SS自由度
df均方
MSF P 模型 model 1 118.58 5 223.72 19.05 0.002 9 残差 residual 58.71 5 11.74 失拟 lack of fit 14.53 3 4.84 0.22 0.876 9 纯误差 pure error 44.18 2 22.09 cor total 1 177.29 10 注:决定系数R2=0.950 1;校正系数Adj R2=0.900 3;预测系数Pred R2=0.805 8
Note:R2=0.950 1;Adj R2=0.900 3;Pred R2=0.805 8表 3 回归方程系数显著性检验
Table 3 Significance test for regression coefficients
因子
factor系数估计
coefficient estimate标准误
standard errorP 95%置信下限
CI low95%置信上限
CI highintercept 31.89 1.76 27.37 36.41 T 4.56 1.40 0.022 5 0.96 8.15 S -5.48 1.40 0.011 3 -9.07 -1.88 T×S -6.60 1.71 0.012 0 -11.00 -2.19 T2 -11.91 2.15 0.002 6 -17.44 -6.37 S2 -6.97 2.15 0.023 0 -12.51 -1.44 注:系数估计值为编码形式
Note:The coefficient estimates were given in terms of coded factors.表 4 温度、盐度对过氧化氢酶活性影响的回归模型方差分析
Table 4 Variance analysis of synergistic effect of temperature and salinity on CAT activity
来源
source平方和
SS自由度
df均方
MSF P 模型 model 795.31 5 159.06 53.08 0.000 2 残差 residual 14.98 5 3.00 失拟 lack of fit 12.32 3 4.11 3.09 0.254 1 纯误差 pure error 2.66 2 1.33 cor total 810.29 10 注:决定系数R2=0.981 5;校正系数Adj R2=0.963 0;预测系数Pred R2=0.833 1
Note:R2=0.981 5;Adj R2=0.963 0;Pred R2=0.833 1表 5 回归方程系数显著性检验
Table 5 Test of significance for regression coefficient
因子
factor系数估计
coefficient estimate标准误
standard errorP 95%置信下限
CI low95%置信上限
CI highintercept 33.97 0.89 31.68 36.25 T 2.20 0.71 0.026 4 0.38 4.02 S -6.46 0.71 0.000 3 -8.28 -4.64 T×S -4.65 0.87 0.003 0 -6.88 -2.43 T2 -10.89 1.09 0.000 2 -13.69 -8.09 S2 -3.97 1.09 0.014 7 -6.77 -1.17 表 6 温度、盐度对谷胱甘肽过氧化物酶活性影响的回归模型方差分析
Table 6 Variance analysis of synergistic effect of temperature and salinity on GSH-PX activity
来源
source平方和
SS自由度
df均方
MSF P 模型 model 813.60 5 162.72 30.11 0.001 0 残差 residual 27.02 5 5.40 失拟 lack of fit 19.36 3 6.45 1.68 0.393 6 纯误差 pure error 7.66 2 3.83 cor total 840.63 10 注:决定系数R2=0.967 9;校正系数Adj R2=0.935 7;预测系数Pred R2=0.823 1
Note:R2=0.967 9;Adj R2=0.935 7;Pred R2=0.823 1表 7 回归方程系数显著性检验
Table 7 Test of significance for regression coefficient
因子
factor系数估计
coefficient estimate标准误
standard errorP 95%置信下限
CI low95%置信上限
CI high截距 intercept 28.31 1.19 25.25 31.38 T 3.38 0.95 0.016 1 0.94 5.82 S -0.94 0.95 0.365 1 -3.38 1.49 T×S -0.52 1.16 0.673 3 -3.51 2.47 T2 -6.07 1.46 0.008 9 -9.82 -2.31 S2 -13.76 1.46 0.000 2 -17.52 -10.01 -
[1] 肖克宇, 陈昌福, 李月红, 等. 水产动物免疫学[M]. 北京: 中国农业出版社, 2011: 91-92. https://xueshu.baidu.com/usercenter/paper/show?paperid=f700848bb51d23bc320231fd5af3e260&site=xueshu_se [2] KHESSIBA A, ROMÉO M, AISSA P. Effects of some environmental parameters on catalase activity measured in the mussel (Mytilus galloprovincialis) exposed tolindane[J]. Environ Pollut, 2005, 133(2): 275-281. doi: 10.1016/j.envpol.2004.05.035
[3] CHEN M Y, YANG H S, DELAPORTE M, et al. Immune condition of Chlamys farreri in response to acute temperature challenge[J]. Aquaculture, 2007, 271(4): 479-487. doi: 10.1016/j.aquaculture.2007.04.051
[4] 吕昊泽, 刘健, 陈锦辉, 等. 盐度对缢蛏超氧化物岐化酶和过氧化酶活力的影响[J]. 海洋渔业, 2013, 35(4): 474-478. doi: 10.3969/j.issn.1004-2490.2013.04.014 [5] 张晓丽, 胡玉珍, 李明云, 等. 养殖大黄鱼在自然海区降温不同阶段抗氧化水平及血清酶活力的变化[J]. 海洋科学, 2013, 37(11): 27-34. https://qikan.cqvip.com/Qikan/Article/Detail?id=48459485 [6] 尹飞, 孙鹏, 彭士明, 等. 低盐度胁迫对银鲳幼鱼肝脏抗氧化酶、鳃和肾ATP酶活力的影响[J]. 应用生态学报, 2011, 22(4): 1059-1066. https://www.cjae.net/CN/Y2011/V22/I04/1059 [7] 蔡英亚, 谢绍河. 广东的海贝[M]. 汕头: 汕头大学出版社, 2006: 256-257. https://xueshu.baidu.com/usercenter/paper/show?paperid=d867b5aa9d5a8db46f0e034381284b61&site=xueshu_se [8] 郑怀平, 孙泽伟, 张涛, 等. 华贵质控扇贝1龄贝数量性状的相关性及通径分析[J]. 中国农学通报, 2009, 25(20): 322-326. doi: 10.11924/j.issn.1000-6850.2009-1006 [9] 王琦, 袁涛, 何毛贤. 华贵栉孔扇贝养殖及遗传育种研究进展[J]. 南方水产科学, 2011, 7(5): 73-80. doi: 10.3969/j.issn.2095-0780.2011.05.012 [10] ARIAS A, FREIRE R, MÉNDEZ J, et al. Isolation and characterization of microsatellite markers in the Queen Scallop Aequipecten opercularis and their application to a population genetic study[J]. Aquat Living Resour, 2010, 23(2): 199-207. doi: 10.1051/alr/2010011
[11] 刘志刚, 王辉, 吕文刚, 等. 华贵栉孔扇贝壳色与闭壳肌颜色遗传规律的研究[J]. 海洋与湖沼, 2012, 43(2): 237-243. [12] 栗志民, 刘志刚, 谢丽, 等. 体重和温度对华贵栉孔扇贝耗氧率与排氨率的影响[J]. 海洋与湖沼, 2010, 41(1): 512-518. [13] LIU F, WANG W X. Differential roles of metallothionein-like proteins in cadmium uptake and elimination by the scallop Chlamys nobilis[J]. Environ Toxicol Chem, 2011, 30(3): 738-746. doi: 10.1002/etc.435
[14] 陈志鹏, 朱家壁, 陈洪轩, 等. 利用中心复合设计法优化联苯双酯脂质体处方[J]. 南京中医药大学学报, 2009, 25(5): 377-379. doi: 10.3969/j.issn.1000-5005.2009.05.017 [15] 李晓英, 沈睿杰, 董志国, 等. 温度骤升和窒息胁迫对青蛤抗氧化酶活力的影响[J]. 中国饲料, 2009 (1): 39-42. doi: 10.3969/j.issn.1004-3314.2009.01.015 [16] LIU W, LI M, HUANG F, et al. Effects of cadmium stress on xanthine oxidase and antioxidant enzyme activities in Boleophthalmus pectinirostris liver[J]. Chin J Appl Ecol, 2006, 17(7): 1310-1314. https://europepmc.org/article/MED/17044513
[17] YU B P. Cellular defenses against damage from reactive oxygen species [J]. Phys Rev, 1994, 74(1): 139-162. doi: 10.1152/physrev.1994.74.1.139
[18] MONARI M, MATOZZO V, FOSCHI J, et al. Effects of high temperatures on functional responses of haemocytes in the clam Chamelea gallina [J]. Fish Shellfish Immunol, 2007, 22(1): 98-114. doi: 10.1016/j.fsi.2006.03.016
[19] BARDA I, PURINA I, RIMSA E, et al. Seasonal dynamics of biomarkers in infaunal clam Macoma balthica from the Gulf of Riga (Baltic Sea)[J]. J Mar Sys, 2014, 129: 150-156. doi: 10.1016/j.jmarsys.2013.05.006
[20] De ZOYSA M, WHANG I, LEE Y, et al. Transcriptional analysis of antioxidant and immune defense genes in disk abalone (Haliotis discus) during thermal, low-salinity and hypoxic stress [J]. Biochem Mol Biol, 2009, 154(4): 387-395. doi: 10.1016/j.cbpb.2009.08.002
[21] 李大鹏, 刘松岩, 谢从新, 等. 水温对中华鲟血清活力氧含量及抗氧化防御系统的影响[J]. 水生生物学报, 2008, 32(3): 327-332. doi: 10.3321/j.issn:1000-3207.2008.03.006 [22] MORGAN J D, IWAMA G K. Effects of salinity on growth, metabolism, and ion regulation in juvenile rainbow and steelhead trout (Oncorhynchus mykiss) and fall chinook salmon (Oncorhynchus tshawytscha) [J]. Can J Fish Aquat Sci, 1991, 48(11): 2083-2094. doi: 10.1139/f91-247
[23] 郭黎, 马爱军, 王新安, 等. 盐度和温度对大菱鲆幼鱼抗氧化酶活力的影响[J]. 大连海洋大学学报, 2012, 27(5): 422-428. doi: 10.3969/j.issn.2095-1388.2012.05.008 [24] 雷思佳. 盐度与体重对台湾红罗非鱼耗氧率的影响[J]. 应用生态学报, 2002, 13(6): 739-742. https://www.cjae.net/CN/Y2002/V/I6/739 [25] 强俊, 任洪涛, 徐跑, 等. 温度与盐度对吉富品系尼罗罗非鱼幼鱼生长和肝脏抗氧化酶活力的协同影响[J]. 应用生态学报, 2012, 23(1): 255-263. https://www.cjae.net/CN/Y2012/V23/I01/255 [26] 时少坤, 王瑞璇, 王江勇, 等. 盐度胁迫对近江牡蛎几种免疫因子的影响[J]. 南方水产科学, 2013, 9(3): 26-30. [27] PAITAL B, CHAINY G B N. Antioxidant defenses and oxidative stress parameters in tissues of mud crab (Scyllaserrata) with reference to changing salinity[J]. Toxicol Pharmac, 2010, 151(1): 142-151. doi: 10.1016/j.cbpc.2009.09.007
[28] 杨健, 陈刚, 黄建盛, 等. 温度和盐度对军曹鱼幼鱼生长与抗氧化酶活力的影响[J]. 广东海洋大学学报, 2007, 27(4): 25-29. https://shdx.cbpt.cnki.net/WKB/WebPublication/paperDigest.aspx?paperID=73a1eb29-59ef-461f-a7e2-ece8b28b7eb3




 下载:
下载:





 粤公网安备 44010502001741号
粤公网安备 44010502001741号
