Endogenous formaldehyde concentration of purpleback flying squid in the central and southern South China Sea
-
摘要:
分析采自南海中南部海域40个站点的鸢乌贼(Sthenoteuthis oualaniensis)头部、胴体、内脏的内源性甲醛质量分数,探讨了影响南海鸢乌贼甲醛质量分数的因素,并与其他头足类海洋生物的甲醛质量分数进行对比。结果表明,南海鸢乌贼内脏部分甲醛质量分数最高,平均值达到93.21 mg · kg-1,头部和胴体甲醛质量分数次之,分别为29.63 mg · kg-1和25.69 mg · kg-1,头部和胴体的内源性甲醛质量分数没有显著差异(P>0.05)。不同体长以及不同捕获区域的鸢乌贼头部、胴体和内脏的甲醛质量分数没有显著差异,但捕获于春夏季的鸢乌贼胴体(25.82 mg · kg-1和23.26 mg · kg-1)和内脏(69.43 mg · kg-1和123.74 mg · kg-1)的甲醛质量分数要高于捕获于秋季的鸢乌贼胴体(5.13 mg · kg-1,P < 0.05)和内脏(18.15 mg · kg-1,P < 0.05)的甲醛质量分数。和其他头足类的内源性甲醛相比,南海鸢乌贼胴体部位的内源性甲醛质量分数较高(25.69 mg · kg-1),高于其他种类鱿鱼胴体部位的游离甲醛和游离及可逆结合型甲醛质量分数(1.09~27.06 mg · kg-1)。根据美国环境保护署规定的每日甲醛最大摄入量0.2 mg · kg-1计算,一个体质量为60 kg的成年人每日食用南海鸢乌贼胴体的最大量约为467 g。另外,在南海鸢乌贼的后续加工过程中,较高的内源性甲醛质量分数应予以重视。
Abstract:We analyzed the formaldehyde (FA) concentration in the head, mantle and viscera of purpleback flying squid (Sthenoteuthis oualaniensis) from the central and southern South China Sea. Results show that the viscera had the highest concentration of endogenous FA (average: 93.21 mg · kg-1); the head and mantle had similar concentrations of FA, with an average of 29.63 mg · kg-1and 25.69 mg · kg-1, respectively. Significant difference was not found among the squids of various mantle lengths and those caught from different capturing areas (P > 0.05). However, the FA concentrations in the mantle of squids captured in spring and summer (25.82 mg · kg-1 and 23.26 mg · kg-1)and viscera (69.43 mg · kg-1 and 123.74 mg · kg-1) were higher than those captured in autumn (5.13 mg · kg-1 in mantle, 18.15 mg · kg-1 in viscera, P < 0.05). Compared with other species of the cephalopods family, the purpleback flying squid had relatively lower FA concentration in the viscera, but higher in the mantle(25.69 mg · kg-1), higher than free FA and free and reversible bound FA (1.09~27.06 mg · kg-1) in mantles of other types of squid. According to the maximum daily dose reference of 0.2 mg · kg-1 of FA suggested by US Environmental Protection Agency, the maximum daily consumption of S.oualaniensis for a man of 60 kg is 467 g. The relatively high FA concentration should be attached great importance to during further processing.
-
南海鸢乌贼(Sthenoteuthis oualaniensis)隶属柔鱼科鸢乌贼属,是南海中南部海域储量极大的大洋性头足类生物[1-2],张俊等[3]估计南海中南部海域春季的鸢乌贼资源量为244×104 t。另外,与其他物种相比,头足类具有较短的生命周期,通常为0.5~1年[4-5],且繁殖力强,可持续捕捞潜力巨大。并且南海鸢乌贼捕捞难度低,是南海中上层鱼类捕捞的主要作业方式——灯光罩网的绝对优势鱼种[6-7]。对南海鸢乌贼的营养成分分析表明,南海鸢乌贼具有水产品共有的高蛋白、低脂肪含量特性,且含有丰富的氨基酸及较高的不饱和脂肪酸含量[8]。因此,南海鸢乌贼作为食品原料有着巨大的开发潜力。
甲醛是食品贮藏加工过程中重要的危害物质,是国际癌症研究机构IARC(International Agency for Research on Cancer)[9]认定的人类致癌物。海洋生物体内因新陈代谢作用能产生一定含量的内源性甲醛,主要由生物体内的氧化三甲胺经酶解产生[10-12]。不同物种的内源性甲醛含量差异比较大。大量研究报道,头足类水产品含有较高含量的内源性甲醛[13-17],并且在加工过程中甲醛含量有所变化[18-20]。
目前对鸢乌贼资源的探索已经初具规模[21-25],但是针对鸢乌贼食品加工方面的研究主要集中在基本营养成分的测定、加工特性等[26-28]。此文在鸢乌贼生物学基础上,采用乙酰丙酮分光光度法,对捕自南海中南部海域不同站点的鸢乌贼头部、胴体、内脏3个部位的游离甲醛质量分数进行分析,从食品安全的角度分析南海鸢乌贼食用资源的安全性,为后续食品加工的研究提供参考。
1. 材料与方法
1.1 原料与试剂
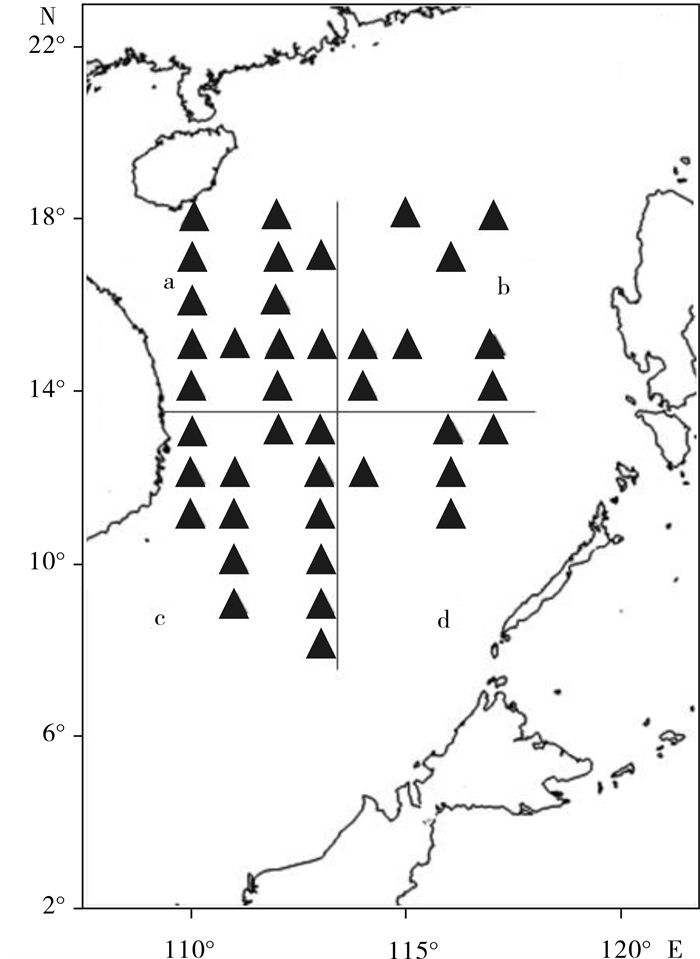
鸢乌贼由中国水产科学研究院南海水产研究所“南锋”号调查船捕于南海中南部海域。总共40个海洋调查站采样点覆盖了纬度5°N~18°N、经度110°E~118°E的范围(图 1)。每个站点的采样量在5只以上。捕获后,样品被立即分装并在-20 ℃保存。实验时,样品在解冻后测量其体长,并将其分为头部、胴体、内脏3个部分,分别进行游离甲醛质量分数的检测。各样品按体长分为小(< 100 mm)、中(100~200 mm)、大(>200 mm)3组;按捕获地点分为a (14°N~18°N, 110°E~113°E), b (14°N~18°N, 113°E~117°E),c (5°N~12°N, 110°E~113°E),d (5°N~12°N,113°E~117°E)4个区域;按捕获季节分为春(3、4月)、夏(6、7月)、秋(9、10月)三季进行分析。
乙酰丙酮、冰乙酸、乙酸铵、氢氧化钾、三氯乙酸、甲醛均为分析纯,购于广州化学试剂厂。硫代硫酸钠标准液(0.1 mol · L-1)购于深圳市尚品科技有限公司,用以标定甲醛标准溶液。
1.2 仪器与设备
UV2550型紫外可见分光光度计(岛津,日本产);T25型高速均质机(艾卡,德国产);GB204型电子天平(梅特勒,瑞士产)。
1.3 游离甲醛的检测
解冻后的样品剪成小块,绞碎。称取适量样品(肌肉和头部5 g、内脏2 g),进行游离甲醛的检测。检测采用乙酰丙酮分光光度法,参照马海霞等[29]对NASH[30]方法做的改进来进行。所测甲醛为湿质量游离甲醛质量分数。
1.4 数据分析
采用Excel 2010软件对数据进行初步处理,用SPSS 19.0进行方差分析。
2. 结果与分析
2.1 南海鸢乌贼不同部位游离甲醛质量分数
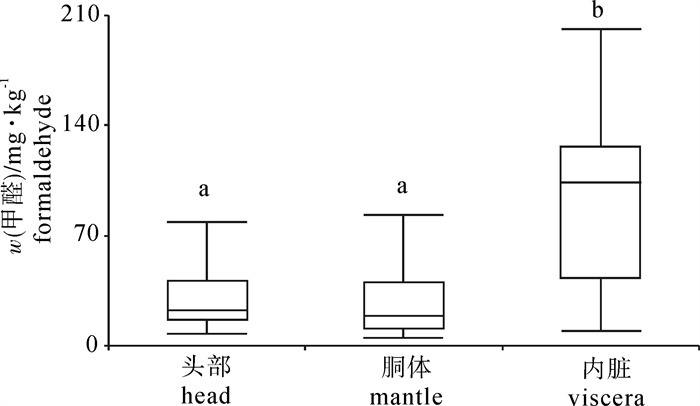
图 2表明鸢乌贼头部、胴体、内脏3个部位各自游离甲醛质量分数的最小值、四分之一分位值、中位值、四分之三分位值和最大值。可以明显看出, 内脏所含的游离甲醛质量分数最高,范围在8.83~201.67 mg · kg-1,平均值为93.21 mg · kg-1。这是因为内脏含有最高含量的氧化三甲胺以及氧化三甲胺酶[31],后者催化前者产生分解生成甲醛是海产品中甲醛本底的主要来源[32]。另外,头部和胴体的游离甲醛质量分数没有明显区别,头部的游离甲醛质量分数在6.99~78.9 mg · kg-1,平均值为29.63 mg · kg-1;胴体的游离甲醛质量分数在4.51~83.2 mg · kg-1,平均值为25.69 mg · kg-1。这可能是因为头部和胴体的氧化三甲胺质量分数类似。
2.2 样品大小、捕获区域及季节对南海鸢乌贼甲醛质量分数的影响
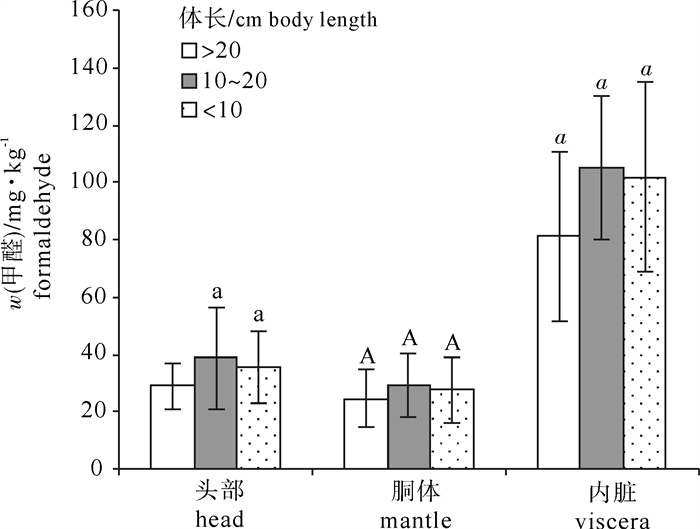
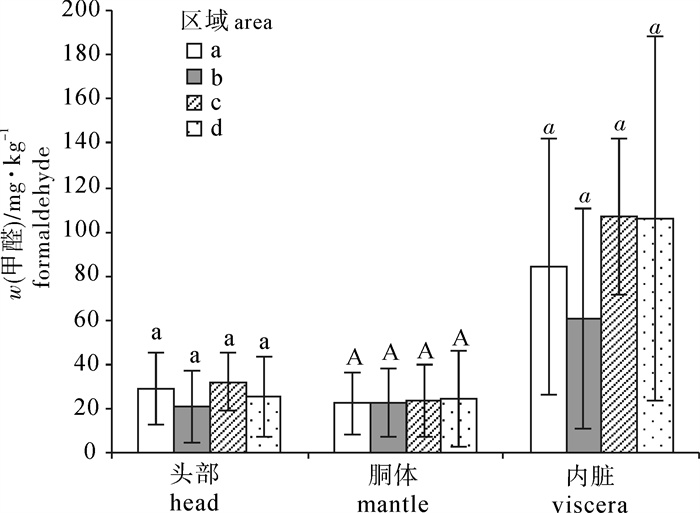
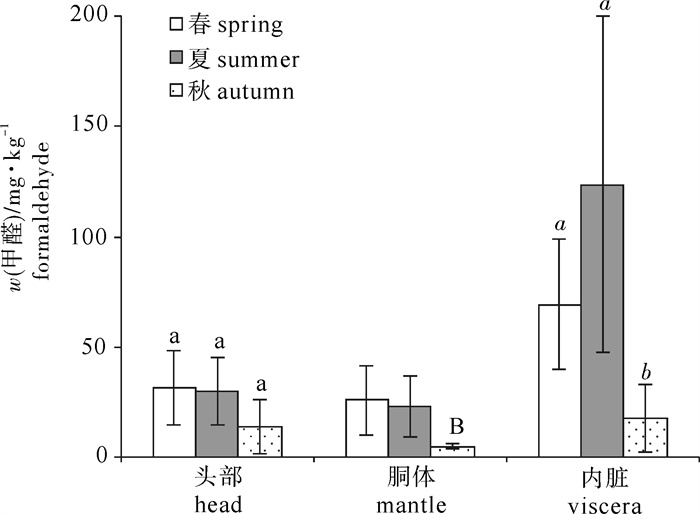
南海中南部海域40个站点捕获的鸢乌贼样品体长为82.2~225.6 mm,体质量为35.07~405.91 g。将样品按体长分为小(< 100 mm)、中(100~200 mm)、大(>200 mm)3组。图 3显示不同体长的鸢乌贼头部、胴体、内脏3个部位游离甲醛的平均质量分数。鸢乌贼这3个部位的甲醛质量分数均未随体长的不同而表现出明显差异。将南海中南部海域分为a (14°N~18°N, 110°E~113°E),b (14°N~18°N, 113°E~117°E),c (5°N~12°N, 110°E~113°E),d (5°N~12°N,113°E~117°E)4个区域,图 4显示这4个区域捕获的鸢乌贼头部、胴体、内脏3个部位的甲醛质量分数,同样,鸢乌贼这3个部位中的甲醛质量分数也与捕获地点无关。不同季节捕获鸢乌贼的甲醛质量分数有所差别(图 5),春夏季所捕获的鸢乌贼的胴体及内脏中甲醛质量分数要高于秋季捕获的样品(P < 0.05),而头部的甲醛质量分数未随捕获季节的变化而有差异。目前关于头足类甲醛含量的报道多集中于不同种类之间,鲜有文献细分原料的大小、捕获区域以及捕获时间等。由此文的结果可以看出,甲醛的质量分数不会在鸢乌贼的生长过程中发生明显变化, 不同的鸢乌贼族群之间的甲醛质量分数也没有区别。而季节对于鸢乌贼胴体和内脏甲醛质量分数的影响可能与温度有关[31],温度会影响降解氧化三甲胺成为甲醛的酶活性,因此,相较于春夏季,秋季偏低的海水温度可能在一定程度上抑制了甲醛的自然产生。此外,甲醛质量分数的高低也与原料的新鲜度有关[33],秋季较低的温度有助于海产品的保鲜。
![]() 图 4 不同捕获区域鸢乌贼的头部、胴体、内脏的游离甲醛质量分数区域a (14°N~18°N, 110°E~113°E), 区域b (14°N~18°N, 113°E~117°E),区域c (5°N~12°N, 110°E~113°E),区域d (5°N~12°N,113°E~117°E)Figure 4. Formaldehyde concentration in head, mantle and viscera of purpleback flying squid captured from different areasArea a (14°N~18°N, 110°E~113°E); Area b (14°N~18°N, 113°E~117°E); Area c (5°N~12°N, 110°E~113°E); Area d (5°N~12°N, 113°E~117°E)
图 4 不同捕获区域鸢乌贼的头部、胴体、内脏的游离甲醛质量分数区域a (14°N~18°N, 110°E~113°E), 区域b (14°N~18°N, 113°E~117°E),区域c (5°N~12°N, 110°E~113°E),区域d (5°N~12°N,113°E~117°E)Figure 4. Formaldehyde concentration in head, mantle and viscera of purpleback flying squid captured from different areasArea a (14°N~18°N, 110°E~113°E); Area b (14°N~18°N, 113°E~117°E); Area c (5°N~12°N, 110°E~113°E); Area d (5°N~12°N, 113°E~117°E)2.3 南海鸢乌贼甲醛质量分数与其他头足类甲醛质量分数对比
不同种类的鱿鱼甲醛质量分数有差异,阿根廷鱿鱼属于甲醛质量分数相对较高的种类,陈雪昌[34]对北太平洋鱿鱼、秘鲁鱿鱼和阿根廷鱿鱼进行了游离甲醛的检测,胴体部位的甲醛质量分数分别为5.95 mg · kg-1、12.66 mg · kg-1和23.84 mg ·kg-1,且阿根廷鱿鱼内脏的游离及可逆结合型甲醛质量分数高于其他鱿鱼种类的内脏;鱿鱼内脏甲醛的质量分数均高于胴体,南海鸢乌贼的甲醛质量分数与其他种类的头足类相比,胴体部位所含甲醛质量分数相对较高,平均值达29.63 mg ·kg-1,高于其余种类的鱿鱼胴体部位的游离甲醛、游离和可逆结合型甲醛质量分数(表 1)。因此,需要进一步检测南海鸢乌贼胴体中甲醛来源物——氧化三甲胺的含量,探讨南海鸢乌贼高甲醛质量分数的根本原因;在后续加工过程中,甲醛质量分数的变化情况也应该予以重视。此外,根据美国环境保护署规定的每日甲醛最大摄入量为0.2 mg · kg-1[36]计算,一个体质量为60 kg的成年人每日南海鸢乌贼胴体的最大食用量约为467 g。
表 1 头足类水产品原料中的甲醛质量分数Table 1. Formaldehyde concentrations in several species of cephalopods种类species 部位tissue 甲醛类型formaldehyde type w(甲醛)/mg·kg-1 formaldehyde 文献来源Reference 南海鸢乌贼S.oualaniensis 头部 游离甲醛 29.63±25.01 此文 胴体 游离甲醛 25.69±21.83 内脏 游离甲醛 93.21±60.83 阿根廷鱿鱼Illex argentinus 胴体 游离甲醛 23.84 陈雪昌[34] 胴体 游离及可逆结合型甲醛 20.13±0.33 叶丽芳[35] 内脏 游离及可逆结合型甲醛 465.00±21.64 胴体 游离及可逆结合型甲醛 27.06 安利华等[13] 内脏 游离及可逆结合型甲醛 479.09 秘鲁鱿鱼Dosidicus gigas 胴体 游离甲醛 12.66 陈雪昌[34] 胴体 游离及可逆结合型甲醛 15.86±2.04 叶丽芳[35] 内脏 游离及可逆结合型甲醛 176.52±13.39 胴体 游离甲醛 1.09±0.19 朱军莉和励建荣[18] 胴体 游离及可逆结合型甲醛 5.33±0.25 北太平洋鱿鱼Ommastrephes bartrami 胴体 游离甲醛 5.95 陈雪昌[34] 胴体 游离及可逆结合型甲醛 10.91±0.15 叶丽芳[35] 内脏 游离及可逆结合型甲醛 127.00±7.67 胴体 游离甲醛 1.49±0.09 朱军莉和励建荣[18] 胴体 游离及可逆结合型甲醛 6.86±0.12 3. 结论
1) 南海鸢乌贼内脏部分甲醛质量分数最高,平均值达到93.21 mg · kg-1,头部和胴体甲醛质量分数次之,分别为29.63 mg · kg-1和25.69 mg ·kg-1,头部和胴体的内源性甲醛质量分数没有显著差异(P>0.05)。
2) 不同体长以及不同捕获区域的鸢乌贼头部、胴体和内脏3个部位的甲醛质量分数没有显著差异,但捕获于春夏季的鸢乌贼胴体和内脏的甲醛质量分数要高于捕获于秋季的鸢乌贼胴体和内脏的甲醛质量分数。
3) 和其他头足类的内源性甲醛质量分数相比,南海鸢乌贼内脏部位的内源性甲醛质量分数较低,但是胴体部位的内源性甲醛质量分数较高。
-
图 4 不同捕获区域鸢乌贼的头部、胴体、内脏的游离甲醛质量分数
区域a (14°N~18°N, 110°E~113°E), 区域b (14°N~18°N, 113°E~117°E),区域c (5°N~12°N, 110°E~113°E),区域d (5°N~12°N,113°E~117°E)
Figure 4. Formaldehyde concentration in head, mantle and viscera of purpleback flying squid captured from different areas
Area a (14°N~18°N, 110°E~113°E); Area b (14°N~18°N, 113°E~117°E); Area c (5°N~12°N, 110°E~113°E); Area d (5°N~12°N, 113°E~117°E)
表 1 头足类水产品原料中的甲醛质量分数
Table 1 Formaldehyde concentrations in several species of cephalopods
种类species 部位tissue 甲醛类型formaldehyde type w(甲醛)/mg·kg-1 formaldehyde 文献来源Reference 南海鸢乌贼S.oualaniensis 头部 游离甲醛 29.63±25.01 此文 胴体 游离甲醛 25.69±21.83 内脏 游离甲醛 93.21±60.83 阿根廷鱿鱼Illex argentinus 胴体 游离甲醛 23.84 陈雪昌[34] 胴体 游离及可逆结合型甲醛 20.13±0.33 叶丽芳[35] 内脏 游离及可逆结合型甲醛 465.00±21.64 胴体 游离及可逆结合型甲醛 27.06 安利华等[13] 内脏 游离及可逆结合型甲醛 479.09 秘鲁鱿鱼Dosidicus gigas 胴体 游离甲醛 12.66 陈雪昌[34] 胴体 游离及可逆结合型甲醛 15.86±2.04 叶丽芳[35] 内脏 游离及可逆结合型甲醛 176.52±13.39 胴体 游离甲醛 1.09±0.19 朱军莉和励建荣[18] 胴体 游离及可逆结合型甲醛 5.33±0.25 北太平洋鱿鱼Ommastrephes bartrami 胴体 游离甲醛 5.95 陈雪昌[34] 胴体 游离及可逆结合型甲醛 10.91±0.15 叶丽芳[35] 内脏 游离及可逆结合型甲醛 127.00±7.67 胴体 游离甲醛 1.49±0.09 朱军莉和励建荣[18] 胴体 游离及可逆结合型甲醛 6.86±0.12 -
[1] 张鹏, 杨吝, 张旭丰, 等. 南海大洋性中上层生物资源开发现状及前景[J]. 南方水产, 2010, 6(1): 68-74. doi: 10.3969/j.issn.1673-2227.2010.01.012 [2] 江艳娥, 陈作志, 林昭进, 等. 南海中部鸢乌贼耳石形态特征分析[J]. 南方水产科学, 2014, 10(4): 85-90. doi: 10.3969/j.issn.2095-0780.2014.04.014 [3] 张俊, 陈国宝, 张鹏, 等. 基于渔业声学和灯光罩网的南海中南部鸢乌贼资源评估[J]. 中国水产科学, 2014, 21(4): 822-832. doi: 10.3724/SP.J.1118.2014.00822 [4] MORGANO M A, RABONATO L C, MILANI R F, et al. As, Cd, Cr, Pb and Hg in seafood species used for sashimi and evaluation of dietary exposure[J]. Food Control, 2014, 36(1): 24-29. doi: 10.1016/j.foodcont.2013.07.036
[5] STORELLI M M. Potential human health risks from metals (Hg, Cd, and Pb) and polychlorinated biphenyls (PCBs) via seafood consumption: estimation of target hazard quotients (THQs) and toxic equivalents (TEQs)[J]. Food Chem Toxicol, 2008, 46(8): 2782-2788. doi: 10.1016/j.fct.2008.05.011
[6] 晏磊, 张鹏, 杨吝, 等. 2011年春季南海中南部海域灯光罩网渔业渔获组成的初步分析[J]. 南方水产科学, 2014, 10(3): 97-103. doi: 10.3969/j.issn.2095-0780.2014.03.015 [7] 张鹏, 曾晓光, 杨吝, 等. 南海区大型罩网渔场渔期和渔获组成分析[J]. 南方水产科学, 2013, 9(3): 74-79. doi: 10.3969/j.issn.2095-0780.2013.03.012 [8] 于刚, 张洪杰, 杨少玲, 等. 南海鸢乌贼营养成分分析与评价[J]. 食品工业科技, 2014, 18: 358-361, 372. doi: 10.13386/j.issn1002-0306.2014.18.072 [9] IARC. Formaldehyde, 2-Butoxyethanol and 1-tert-Butoxypropan-2-ol[R]. Geneva, Switzerland: World Health Organization, 2006, 88: 1-478.
[10] AMANO K, YAMADA K. A biological formation of formaldehyde in the muscle tissue of gadoid fish[J]. Bull Jpn Soc Scient Fish, 1964, 30(5): 430-435. doi: 10.2331/suisan.30.430
[11] AMANO K, YAMADA K, BITO M. Detection and identification of formaldehyde in gadoid fish[J]. Bull Jpn Soc Sci Fish, 1963, 29(7): 695-701. doi: 10.2331/suisan.29.695
[12] YAMADA K, AMANO K. Studies on the biological formation of formaldehyde and dimethylamine in fish and shellfish. Ⅴ. On the enzymatic formation in the pyloric caeca of Alaska pollock[J]. Bull Jpn Soc Sci Fish, 1965, 31(1): 60-64. doi: 10.2331/suisan.31.60
[13] 安利华, 孙群, 郑万源. 东海地区常见水产品甲醛本底值调查及含量分析[J]. 中国食品卫生杂志, 2006, 17(6): 524-527. https://www.zgspws.com/zgspwszz/article/abstract/200506215?st=article_issue [14] 韩宏伟. 鱿鱼及其制品中甲醛本底值调查与评价[D]. 北京: 中国疾病预防控制中心, 2008. [15] 段文佳, 周德庆, 张瑞玲. 鲜活水产品中甲醛本底含量状况调查[J]. 中国农学通报, 2011, 27(3): 383-390. doi: 10.11924/j.issn.1000-6850.2010-3685 [16] 郑斌, 陈伟斌, 徐晓林, 等. 常见水产品中甲醛的天然含量及风险评估[J]. 浙江海洋学院学报: 自然科学版, 2007, 26(1): 6-11. doi: 10.3969/j.issn.1008-830X.2007.01.002 [17] 刘淑玲. 水产品中甲醛的风险评估与限量标准研究[D]. 青岛: 中国海洋大学, 2009. https://www.doc88.com/p-99036100437.html [18] 朱军莉, 励建荣. 鱿鱼及其制品加工贮存过程中甲醛的消长规律研究[J]. 食品科学, 2010, 31(5): 14-17. http://lib.cqvip.com/Qikan/Article/Detail?id=33270245&from=Qikan_Article_Detail [19] 王阳光, 李碧清, 高华明. 在室温下存放的鱿鱼甲醛含量的变化[J]. 食品工业科技, 2005, 26(7): 169-170. doi: 10.3969/j.issn.1002-0306.2005.07.065 [20] 靳肖. 鱿鱼丝甲醛产生的化学机制、残留变化与控制研究[D]. 青岛: 中国海洋大学, 2010. 10.7666/d.y1830067 [21] 杨权, 李永振, 张鹏, 等. 基于灯光罩网法的南海鸢乌贼声学评估技术研究[J]. 水产学报, 2013, 37(7): 1032-1039. doi: 10.3724/SP.J.1231.2013.38513 [22] 范江涛, 冯雪, 邱永松, 等. 南海鸢乌贼生物学研究进展[J]. 广东农业科学, 2013, 40(23): 122-128. doi: 10.3969/j.issn.1004-874X.2013.23.030 [23] 张宇美, 颜云榕, 卢伙胜, 等. 西沙群岛海域鸢乌贼摄食与繁殖生物学初步研究[J]. 广东海洋大学学报, 2013, 33(3): 56-64. doi: 10.3969/j.issn.1673-9159.2013.03.010 [24] 张俊, 陈作志, 陈国宝, 等. 南海鸢乌贼水声学测量和评估相关技术研究[J]. 南方水产科学, 2014, 10(6): 1-11. doi: 10.3969/j.issn.2095-0780.2014.06.001 [25] 陆化杰, 王从军, 陈新军. 4-6月东太平洋赤道公海鸢乌贼生物学特性初步研究[J]. 上海海洋大学学报, 2014, 23(3): 441-447. [26] 王进勉, 薛长湖, 刘鑫, 等. 印度洋鸢乌贼加工特性的初步研究[J]. 食品工业科技, 2007, 28(6): 128-130. doi: 10.3969/j.issn.1002-0306.2007.06.037 [27] 曲映红, 陈新军, 陈舜胜. 印度洋鸢乌贼的加工利用[J]. 科学养鱼, 2009 (6): 69-70. https://www.docin.com/p-789968314.html [28] 沈玉, 黄卉, 吴燕燕. 5种鸢乌贼解冻方法对品质影响的比较研究[J]. 食品安全质量检测学报, 2014, 5 (12): 4092-4096. https://d.wanfangdata.com.cn/periodical/Ch9QZXJpb2RpY2FsQ0hJTmV3UzIwMjQxMTA1MTcxMzA0EhNzcGFxemxqY2pzMjAxNDEyMDU0GghkbTlsd3Z3Yw%3D%3D [29] 马海霞, 李来好, 杨贤庆, 等. 分光光度法测定水产品中甲醛含量的研究[J]. 南方水产, 2008, 4(6): 26-32. doi: 10.3969/j.issn.2095-0780.2008.06.004 [30] NASH T. The colorimetric estimation of formaldehyde by means of the Hantzsch reaction[J]. Biochem J, 1953, 55(3): 416. doi: 10.1042/bj0550416
[31] 孙永, 靳肖, 周德庆. 龙头鱼中内源性甲醛产生的酶促机理初探[J]. 渔业科学进展, 2011, 31(6): 36-42. doi: 10.3969/j.issn.1000-7075.2010.06.006 [32] 贾佳. 秘鲁鱿鱼中氧化三甲胺热分解生成甲醛和二甲胺机理的初步研究[D]. 杭州: 浙江工商大学, 2009. 10.7666/d.Y1524162 [33] 戈树人. 海水产品甲醛本底值调查分析[J]. 海峡预防医学杂志, 2008, 14(1): 63-64. doi: 10.3969/j.issn.1007-2705.2008.01.037 [34] 陈雪昌. 几种水产品中游离态甲醛检测方法及风险评估研究[D]. 青岛: 中国海洋大学, 2008. 10.7666/d.y1337555 [35] 叶丽芳. 鱿鱼及制品中甲醛测定方法、本底含量和甲醛生成控制的初步研究[D]. 杭州: 浙江工商大学, 2007. [36] US Environmental Protection Agency. Integrated Risk Information System (IRIS)[EB/OL]. [2011-05-11]. http://www.epa.gov/IRIS/.



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
