A preliminary study on biology of Glowfish(Gnathodentex aureolineatus)in Yongshu Reef of Nansha area in the South China Sea
-
摘要:
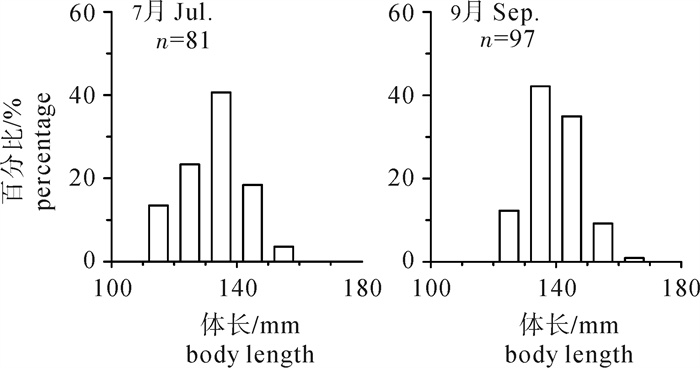
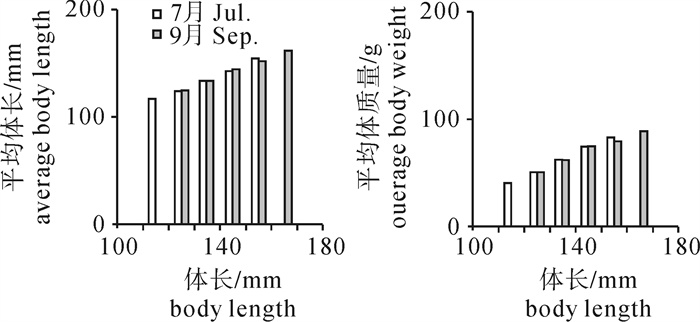
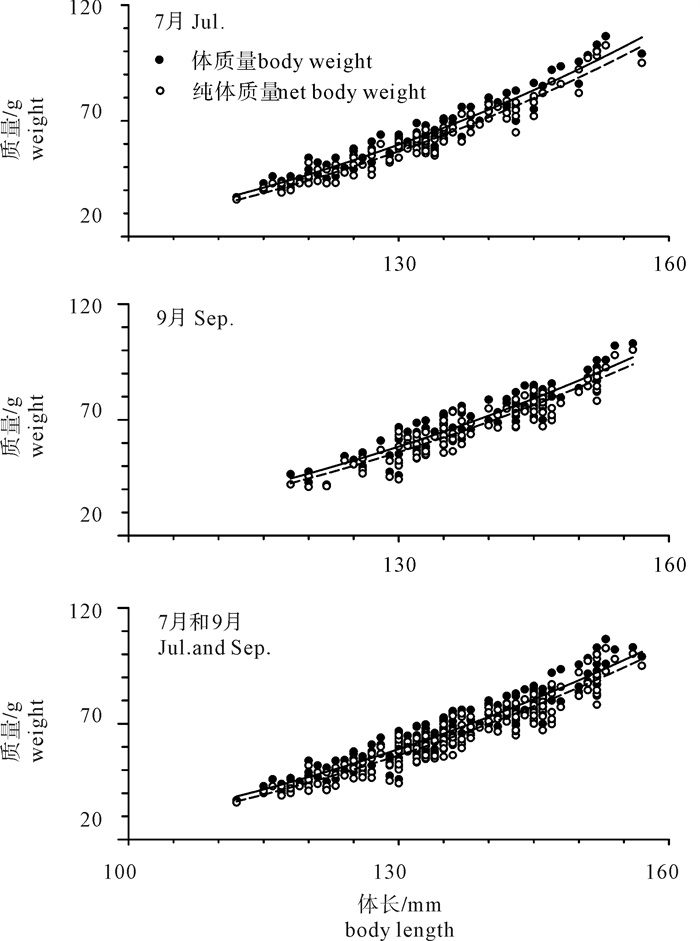
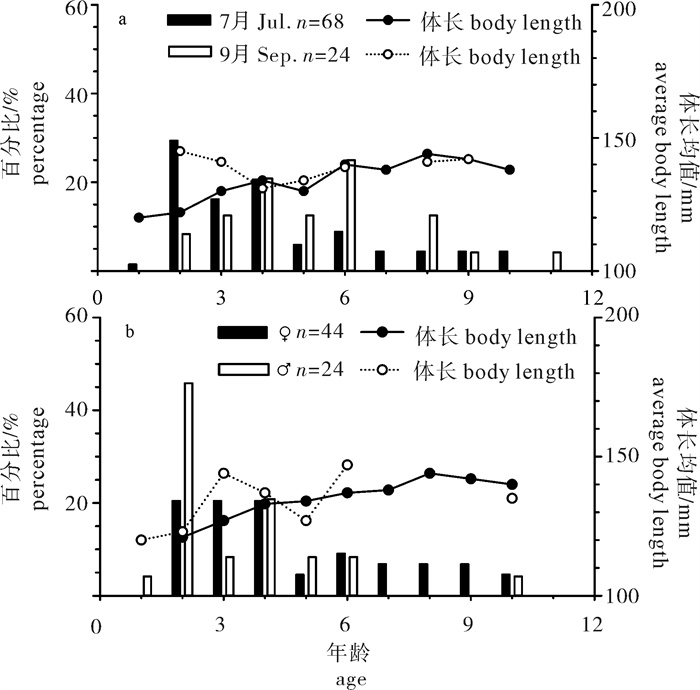
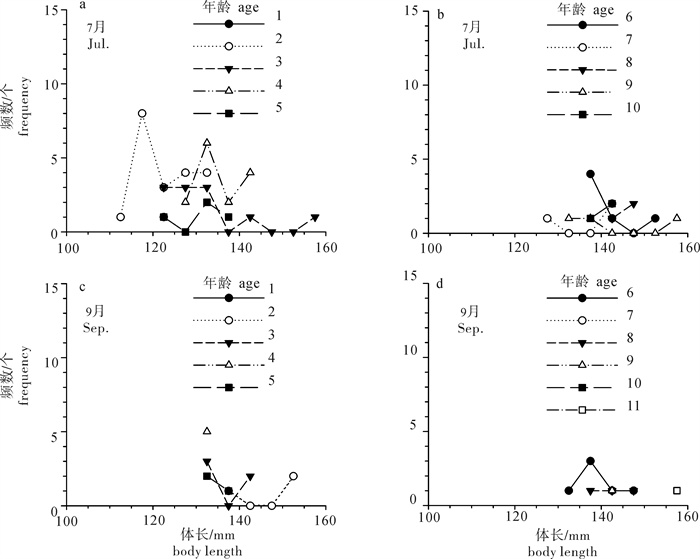
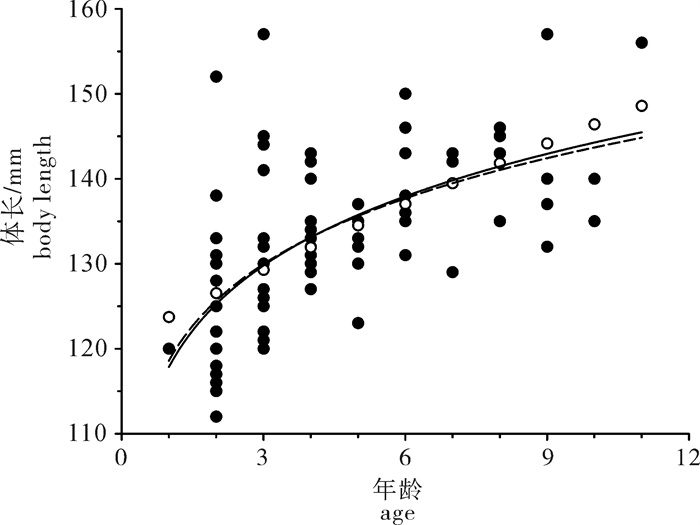
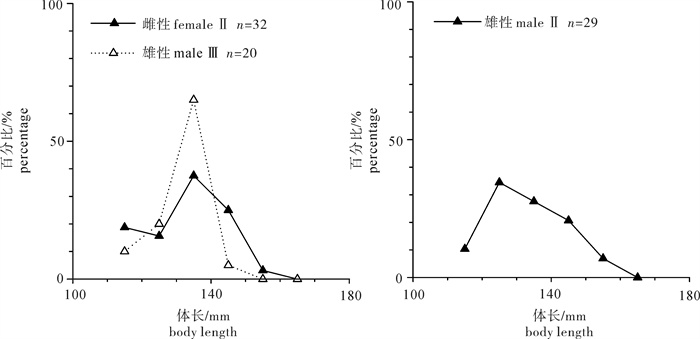
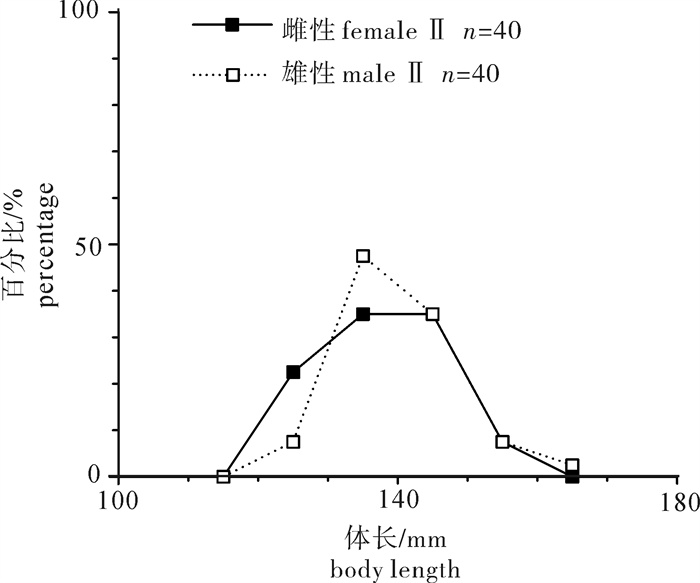
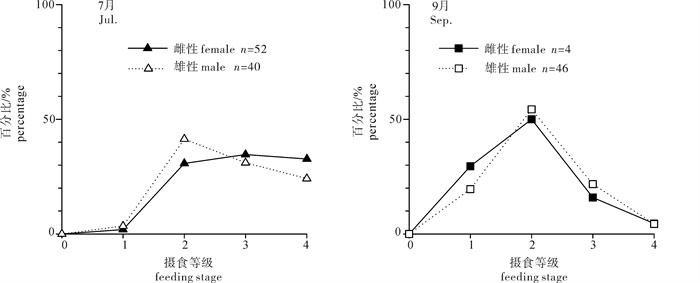
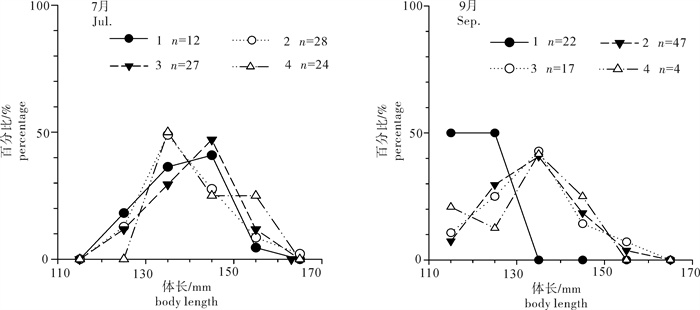
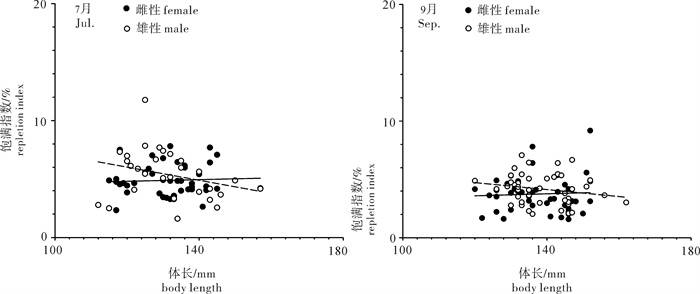
根据2013年于南沙海域永暑礁手钓采集的金带齿颌鲷(Gnathodentex aurolineatus) 样品,对其体长与体质量组成及关系、年龄组成、性比及性腺成熟组成、摄食强度等进行了初步研究。结果显示,7月和9月金带齿颌鲷体长分别为112~157 mm和120~162 mm,其体长分布、各体长组平均体长及平均体质量无显著差异(P>0.05)。7月和9月其体长与体质量关系生长参数b值分别为2.814 8和2.629 6。92个耳石中,年龄为1~11龄;7月优势年龄组为2~4龄,峰值为2龄;9月优势年龄组为3~6龄,峰值为6龄;其von Bertalanffy生长方程生长参数分别为: l∞= 224 mm,K = 0.028,t0=-27.282。7月金带齿颌鲷性腺成熟度包括Ⅱ期和Ⅲ期,9月则包括Ⅰ期、Ⅱ期和Ⅲ期。7月金带齿颌鲷摄食等级均以2级、3级和4级为主,9月则均以1级、2级和3级为主。随体长增加金带齿颌鲷雄性个体饱满指数降低。
Abstract:Taking Glowfish(Gnathodentex aureolineatus) collected by handline in Yongshu Reef of Nansha area in the South China Sea in 2013 as samples, we studied the composition and relation of body length with body weight, age composition, sex ratio, gonad maturity composition and feeding intensity of G.aureolineatus. The results show that the ranges of body length of G.aureolineatus were 112~157 mm and 120~162 mm in July and September, respectively, no significant difference was found in the body length distribution, average body length and weight (P > 0.05). The growing parameters (b value) between body length and body weight in July and September were 2.814 8 and 2.629 6, respectively. The age range of 92 otolith identified was 1~11 year old. The preponderant class and peak of age were 2~4 and 2 years old in July, and 3~6 and 6 years old in September. The parameters of the von Bertalanffy growth function were as follows: l∞=224 mm, K=0.028, t0=-27.282. The gonad maturity of G.aureolineatus were StageⅡ and Ⅲ in July, StageⅠ, Ⅱ and Ⅲ in September; the feeding stages of female and male G.aureolineatus were mainly at Stage 2, 3 and 4 in July and Stage 1, 2 and 3 in September. The repletion index of male G.aureolineatus decreased with increasing body length.
-
Keywords:
- Nansha area /
- Yongshu Reef /
- Gnathodentex aurolineatus /
- fishery biology
-
钙调蛋白(calmodulin,CaM)是广泛存在于真核生物细胞中的、结构和功能高度保守的一种钙离子(Ca2+)结合蛋白,由148个氨基酸组成,含4个EF手结构域,每个EF手能与1个Ca2+结合。4个EF手结构中EF1和EF3、EF2和EF4两两之间相似性最高,具有明显的内部同源性[1]。WATTERSON等[2]和NOJIMA[3]曾提出假说,编码4个EF手结构域的现代CaM基因可能是由编码单个EF手结构域的原始基因经过几轮复制进化而来。钙调蛋白在真核生物细胞中担当胞内钙受体角色,介导Ca2+对环腺苷酸代谢和糖原代谢的调控,在细胞分泌、细胞运动和Ca2+转运方面起重要作用[4]。已克隆得到的哺乳动物和鸟类、蛙等脊椎动物的钙调蛋白的氨基酸序列几乎完全一致,并且低等无脊椎动物居蟹皮海绵(Suberites domuncula)的CaM与脊椎动物CaM之间存在差异的氨基酸位点也仅5个[5-8]。钙调蛋白这种高保守性可以由它参与细胞活动之多、在细胞功能行使中地位之重要来解释。
到目前为止,钙调蛋白是真核细胞所有Ca2+结合蛋白中研究得最为透彻的一种。研究者们在牛(Bos taurus)、小鼠(Mus musculus)、拟南芥(Arabidopsis thaliana)等模式生物中,对CaM参与调控神经发育、心肌收缩、植物免疫等的研究工作已经进行得相当深入[9-11]。在海洋无脊椎动物中关于CaM参与调控机制的研究还不多,但也有一些进展。GAO等[12]研究发现在克氏原螯虾(Procambarus clarkii)蜕皮期间CaM和Ca2+-ATPase存在某种调控关联。在合浦珠母贝(Pinctada fucata)等贝类动物中,CaM被认为在贝类钙代谢中扮演重要角色,参与贝壳的形成[13]。LUAN等[14]的研究表明,CaM可能参与文昌鱼(Branchiostoma belcheri tsingtauense)消化道的分化。CHEN等[15]的研究表明CaM可能参与纹藤壶(Balanus amphitrite)幼体的附着。然而,海参中有关CaM的研究尚未见报道。
棘皮动物与脊索动物同属后口动物,是无脊椎动物中与高等脊椎动物进化上亲缘关系最近的类群,在进化上拥有独特的地位。同时,海参具有的吐脏、内脏再生和自溶等这些独特的生物现象,长期以来倍受研究人员关注。花刺参(Stichopus monotuberculatus)俗称“黄肉参”,隶属于棘皮动物门,海参纲,楯手目,刺参科,在中国台湾、广东、广西以及海南省的海域均有分布[16]。花刺参是中国热带海参中具有代表性的高经济价值种类,不仅是名贵的食用种类,也是重要的食品和医药原料,特别用作香脂、擦剂油、奶油、牙膏和化妆品等的原料[17]。该研究在花刺参中克隆了CaM的cDNA全长序列,并分析其在花刺参不同组织中的表达特点,以期为后续进一步研究CaM在海参生命活动中所起的作用奠定基础。
1. 材料与方法
1.1 试验材料
研究所用花刺参采自广西涠洲岛,在实验室水族箱中暂养一周。水族箱为过滤循环水系统,24 h充气,光周期12 h : 12 h。从水族箱中取出花刺参冰上解剖,体腔液经2 000 g离心15 min,弃上清得到体腔细胞沉淀,加入Trizol后放入-80 ℃保存;体壁、呼吸树和肠组织等经液氮迅速研磨成粉末,加入Trizol后放入-80 ℃保存。
1.3 总RNA提取及cDNA第一链合成
Trizol(invitrogen)法提取海参体壁、呼吸树、肠以及体腔细胞的总RNA,按照TaKaRa cDNA第一链合成试剂盒的说明进行反转录,-20 ℃保存。其中肠样品同时用于CaM基因cDNA全长序列克隆。
1.4 花刺参钙调蛋白(StmCaM)基因的克隆
基于已获得的花刺参EST序列设计引物G-F/G-R,用以扩增CaM基因中间片段。扩增程序为94 ℃ 5 min,预变性;94 ℃ 15 s,52 ℃ 15 s,72 ℃ 1 min,共35个循环;72 ℃ 10 min延伸。PCR产物经回收、连接、转化后挑选阳性克隆送测序。
根据获得的CaM中间片段序列,用Primer 5软件设计3′-RACE引物(F3-1和F3-2)和5′-RACE引物(R5-1和R5-2)。根据3′/5′-Full RACE Kit(Takara)说明书的指导,结合巢式PCR技术扩增CaM基因3′末端和5′末端序列。PCR产物用上面所述的方法进行回收、连接、转化克隆并测序。此研究所用的引物序列见表 1。
表 1 基因克隆与荧光定量PCR使用的引物及其序列Table 1. Primers used in gene cloning and real-time PCR引物 primer 序列 sequence(5′→3′) G-F AGACAGACAGTGAGGAAGA G-R TCATAGTTGACCTGACCATC F3-1 GATGGCAAGGAAGATGAAGGA F3-2 CTTGGAGAAAAATTGACAGATGA R5-1 TGAAACCATTGCCATCTTTG R5-2 AGCAAGTCAGGGTTAAGAGGT qF1 AATGGTTTCATCGGTGCTG qR1 AGGGTTAAGAGGTGGTGGAT Actin-F ACGAAGTTCAAGCCCTGGTTA Actin-R TCTTCTCCATATCATCCCAGTTTG 1.5 序列分析
将测序得到的5′末端序列、中间片段序列和3′末端序列拼接起来,获得花刺参CaM基因的cDNA全长序列。利用NCBI比对所获得的cDNA全长序列,并做同源性分析。应用BioEdit软件寻找ORF并翻译成蛋白质。使用SMART在线软件分析蛋白质结构和功能。使用SWISS-MODEL分析蛋白质的三维结构。用ClustalX及GeneDoc软件做蛋白质序列比对分析。利用Mega 5.0软件根据不同物种的CaM ORF序列以最小进化法构建系统进化树。
1.6 实时荧光定量PCR(real-time PCR)的表达分析
设计荧光定量PCR特异引物qF1和qR1及内参引物Actin F和Actin R。qRT-RCR反应体系包括SYBR Rremix Ex TaqⅡ(12.5 μL)、qF1(1.0 μL)、qR1(1.0 μL)、cDNA模板(2 μL)和灭菌蒸馏水(8.5 μL)。采用2步法扩增标准程序:1)预变性95 ℃ 30 s;2)95 ℃ 5 s,60 ℃ 30 s,40个循环。反应在RG-3000荧光实时定量PCR仪(Applied Biosystems)进行,每种组织cDNA样品及内参分别做3个重复。用RG-3000自带分析软件进行溶解曲线分析以确定单一扩增,用2-ΔCT法分析花刺参CaM基因的组织表达水平[18],ΔCT为目的基因CT值与内参基因CT值的差值,然后用公式2-ΔCT计算相对表达量。
2. 结果
2.1 花刺参CaM cDNA克隆与结构分析
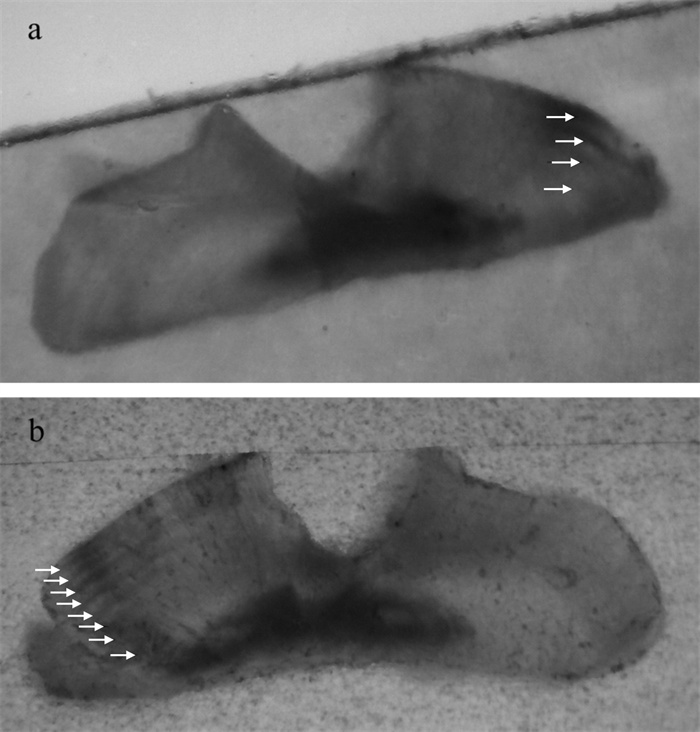
克隆得到的StmCaM cDNA全长1 394 bp(GenBank登录号KJ624993),其中包括138 bp的5′UTR,806 bp的3′-UTR和450 bp的ORF。3′-UTR端聚腺苷酸加尾信号(AAATAG)位于poly A尾上游第21个碱基位点处(图 1)。由ORF推导出的StmCaM含148个氨基酸,预测分子量约16.7 kD,理论等电点为4.1。与其他物种CaM一样花刺参CaM含4个EF手Ca2+结合域(图 1)。利用SWISS-MODEL在线软件分析花刺参CaM的三维结构(图 2),可见CaM含4个螺旋-环-螺旋(helix-loop-helix)结构,即代表 4个EF手。每个EF手包括2个螺旋和连接2个螺旋的环状结构。使用MegAlign软件分析花刺参CaM4个EF手结构域之间的相似度,EF1与EF3相似度为51.7%,EF2与EF4相似度为48.3%;这2个组合间相似度比其他任何两两组合之间,EF1和EF2(31%)、EF1和EF4(37.9%),EF2和EF3(31%)都要高。
![]() 图 1 StmCaM cDNA序列及推导的氨基酸序列下划线为聚腺苷酸加尾信号;*代表终止密码子;加框的序列为4个EF手结构;GenBank序列号KJ624993Figure 1. Nucleotide sequence of Stm CaM cDNA and deduced amino acid sequencesThe polyadenylation signal in 3′-UTR was underlined; the stop codon was marked by an asterisk, and four EF-Hand domains were included in rectangles. GenBank accession No. is KJ624993.
图 1 StmCaM cDNA序列及推导的氨基酸序列下划线为聚腺苷酸加尾信号;*代表终止密码子;加框的序列为4个EF手结构;GenBank序列号KJ624993Figure 1. Nucleotide sequence of Stm CaM cDNA and deduced amino acid sequencesThe polyadenylation signal in 3′-UTR was underlined; the stop codon was marked by an asterisk, and four EF-Hand domains were included in rectangles. GenBank accession No. is KJ624993.2.2 花刺参CaM进化与保守性分析
MegAlign软件对不同物种来源钙调蛋白进行相似度分析的结果,表中显示花刺参CaM与其他物种CaM相似度从95.9%到98%(表 2)。其中作为脊椎动物代表的小鼠的钙调蛋白与花刺参钙调蛋白之间的相似度最低为95.9%。另外,花刺参CaM与真海鞘(Halocynthia roretzi)、白氏文昌鱼(Branchiostoma lanceolatum)、中间球海胆(Strongylocentrotus intermedius)的相似度最高(均为98%);与秀丽隐杆线虫(Caenorhabditis elegans)、绣球海葵(Metridium senile)、居蟹皮海绵(Suberites domuncula)的相似度分别为96.6%、97.3%和96.6%。图 3比对了不同物种来源钙调蛋白之间发生氨基酸替换的全部氨基酸位点,从低等无脊椎海绵到高等脊椎动物小鼠一共有9个位点发生氨基酸替换。表 3具体列举了发生氨基酸替换的位点。花刺参CaM与中间球海胆CaM相比有3个氨基酸位点发生变换,同合浦珠母贝相比也仅有4个氨基酸位点发生变换。
表 2 花刺参CaM和其他物种CaM相似性比对Table 2. Similarity between StmCaM and other CaMs物种
species登录号
Accession No.相似度/%
similarity小鼠(M.musculus) NP_033920.1 95.9 真海鞘(H.roretzi) BAA33967.1 98.0 白氏文昌鱼(B.lanceolatum) P62148 98.0 中间球海胆(S.intermedius) BAB89360.1 98.0 克氏原螯虾(P.clarkii) ACI15835.1 97.3 加利福尼亚海兔(A.californica) NP_001191509 98.0 合浦珠母贝(P.fucata) GI: 46517823 96.6 黑腹果蝇(D.melanogaster) NP_523710 98.0 秀丽隐杆线虫(C.elegans) O16305 96.6 绣球海葵(M.senile) BAB61794.1 97.3 居蟹皮海绵(S.domuncula) CAA77069 96.6 表 3 不同物种CaM之间氨基酸差异位点Table 3. Variable residues among different CaMs物种
species位置 posion 27 57 78 99 101 130 143 146 147 小鼠(M.musculus) I A D Y S I Q T A 真海鞘(H.roretzi) I A D F S I T T S 白氏文昌鱼(B.lanceolatum) I A D F S I T T S 中间球海胆(S.intermedius) I A D F S I T T S 花刺参(S.monotuberculatus) T A E F G I T T S 克氏原螯虾(P.clarkii) I A D F S I R T S 加利福尼亚海兔(A.californica) I A D F S I T T S 合浦珠母贝(P.fucata) I A D F S I K M S 黑腹果蝇(D.melanogaster) I A D F S I T T S 秀丽隐杆线虫(C.elegans) I T E F S T G T S 绣球海葵(M.senile) I A D F S I K T S 居蟹皮海绵(S.domuncula) I T E F S T G T S 注:A. 丙氨酸;D. 天冬氨酸;F. 苯丙氨酸;I. 异亮氨酸;K. 赖氨酸;M. 蛋氨酸t;Q. 谷氨酰胺;R. 精氨酸;S. 丝氨酸;T. 苏氨酸
Note:A. Ala;D. Asp;F. Phe;I. Ile;K. Lys;M. Met;Q. Gln;R. Arg;S. Ser;T. Thr利用Mega 4软件,采用最小进化法构建CaM系统发育树。结果显示,花刺参CaM与囊舌虫(Saccoglossus kowalevskii)、绣球海葵、加利福尼亚海兔(Aplysia californica)三者的CaM亲缘关系较近,聚为一簇。另外,不同脊椎动物的CaM聚为一簇,居蟹皮海绵、黑腹果蝇(Drosophila melanogaster)和秀丽隐杆线虫聚为一簇;这2簇则与StmCaM亲缘关系较远(图 4)。
2.3 花刺参CaM基因在各组织中表达的差异
采用荧光定量PCR检测CaM基因在花刺参不同组织中的表达情况。结果显示体壁中CaM相对表达量最低,2-ΔCT值为0.9。呼吸树中最高,2-ΔCT为113.8,其次是体腔细胞和肠(图 5)。
3. 讨论
前人已经克隆并描述了真海鞘、白氏文昌鱼、凡纳滨对虾(Litopenaeus vannamei)、绣球海葵和居蟹皮海绵等不同进化地位的海洋无脊椎动物的钙调蛋白[19-22]。海参作为棘皮动物中代表性的一个类群,其钙调蛋白尚未被研究发表过。该研究克隆了花刺参CaM全长cDNA序列,由其ORF推导出的花刺参CaM与其他物种CaM的相似度从95.9%到98%,同样含有4个EF手结构域。比对花刺参CaM内部4个EF手结构相互之间相似性的结果显示EF1与EF3相似度为51.7%,EF2与EF4相似度为48.3%;表明花刺参CaM中EF1与EF3、EF2与EF4之间内具有很高的内同源性。这为WATTERSON等[2]和NOJIMA[3]曾提出的关于CaM基因进化的假说提供了支撑证据。
研究对CaM在花刺参不同组织中的mRNA表达水平作了定量分析。结果显示,StmCaM mRNA在呼吸树中表达量最高,其次为体腔细胞和肠,而体壁中则几乎检测不到其表达。刘晓云等[23]使用光学显微镜和电子显微镜观察刺参呼吸树超微结构,发现刺参呼吸树由外向内依次为体腔上皮、肌层、血腔、内皮细胞和中央腔。内皮细胞与流经中央腔的海水进行气体交换,同时里面含有丰富的囊泡(吞饮小泡和质膜小泡)可以吸收海水中营养物质。体腔上皮细胞游离面长有许多微绒毛,胞内同样含有丰富的囊泡,能与体腔液进行物质交换。前人对钙调蛋白功能的研究表明,钙调蛋白在细胞分泌、细胞运动和Ca2+中起重要作用。SATIR等[24]在草履虫(Paramecium tetraurelia)、四膜虫(Tetrahymena thermophila)和淡水蚌(Elliptio)的纤毛基部都发现有CaM存在,JAMIESON等[25]也证明钙调蛋白是纤毛轴丝复合物的组成成分;这些研究表明钙调蛋白可能参与纤毛的摆动[24, 26]。LINDEN等[27]研究发现Ca2+/calmodulin复合体能特异的结合到有被囊泡上,参与受体介导的细胞内吞作用。因此,从CaM在花刺参呼吸树中的高表达来推断,CaM可能介导花刺参呼吸树表皮细胞中囊泡吸收营养物质的过程,同时也可能参与微绒毛的摆动和Ca2+吸收。
脊椎动物和无脊椎动物天然免疫细胞中均存在由Toll样受体介导的活性氮(reactive nitrogen species,RNS)抗菌免疫机制[28]。RNS中主要有效成分一氧化氮(NO)由一氧化氮合成酶(Nitric oxide synthase,NOS)合成。紫海胆(Strongylocentrotus purpuratus)的基因组测序发现,棘皮动物中存在NOS基因,并存在多达220个Toll样受体基因,表明这种抗菌免疫机制在棘皮动物中也是存在的[29]。NOS蛋白的结构上有2个CaM结合域,需要与2个Ca2+/CaM结合形成复合体才能合成NO[30]。因此,花刺参肠道和体腔细胞中较高的CaM表达量,可能与其参与活性氮相关的抗菌免疫机制有关。
致谢: 感谢“南锋”号调查船及全体船员的支持! -
-
[1] BELLWOOD D, HUGHES T, FOLKE C, et al. Confronting the coral reef crisis[J]. Nature, 2004, 429(6994): 827-833. doi: 10.1038/nature02691
[2] 兰竹虹, 陈桂珠. 南中国海地区珊瑚礁资源的破坏现状及保护对策[J]. 生态环境, 2006, 15(2): 430-434. doi: 10.3969/j.issn.1674-5906.2006.02.046 [3] WILKINSON C. Status of coral reefs of the world: 2008[M]. Townsville, Australia: Global Coral Reef Monitoring Network and Reef and Rainforest Research Centre, 2008: 1-296.
[4] ABESAMIS R A, GREEN A L, RUSS G R, et al. The intrinsic vulnerability to fishing of coral reef fishes and their differential recovery in fishery closures[J]. Rev Fish Biol Fish, 2014, 24(4): 1033-1063. doi: 10.1007/s11160-014-9362-x
[5] 陈清潮. 中国海洋生物多样性的现状和展望[J]. 生物多样性, 1997, 5(2): 142-146. doi: 10.3321/j.issn:1005-0094.1997.02.011 [6] 黄晖, 李秀保. 南海珊瑚生物学与珊瑚礁生态学[J]. 科学通报, 2013, 58(17): 1573-1573. doi: 10.1360/csb2013-58-17-1573 [7] HUANG D, LICUANAN W Y, HOEKSEMA B W, et al. Extraordinary diversity of reef corals in the South China Sea[J]. Mar Biodiver, 2014, 44(2): 1-12. doi: 10.1007/s12526-014-0236-1
[8] LI Y Z, CHEN Y, YUAN W W, et al. Fish fauna of coral reef waters in the centre & north of Nansha Islands[J]. J Fish Soc Taiwan, 2000, 27(3): 187-200. https://www.semanticscholar.org/paper/Fish-Fauna-of-Coral-Reef-Waters-in-the-Centre-%26-of-Li-Chen/73ee71eeb88b000b993682a72d7a625659a62aa7
[9] 李永振, 林昭进, 陈丕茂, 等. 南沙群岛中北部重要岛礁鱼类资源调查[J]. 水产学报, 2003, 27(4): 315-321. doi: 10.3321/j.issn:1000-0615.2003.04.005 [10] 李永振, 史赟荣, 艾红, 等. 南海珊瑚礁海域鱼类分类多样性大尺度分布格局[J]. 中国水产科学, 2011, 18(3): 619-628. doi: 10.3724/SP.J.1118.2011.00619 [11] 孙典荣, 林昭进, 邱永松. 西沙群岛重要岛礁鱼类资源调查[J]. 中国海洋大学学报: 自然科学版, 2005, 35(2): 225-231. doi: 10.3969/j.issn.1672-5174.2005.02.010 [12] 王雪辉, 杜飞雁, 林昭进, 等. 西沙群岛主要岛礁鱼类物种多样性及其群落格局[J]. 生物多样性, 2011, 19(4): 463-469. doi: 10.3724/SP.J.1003.2011.07267 [13] HIYAMA Y. Report of an investigation on poisonous fishes of the south seas[R]. Odawara, Japan: Nissan Fishery Export Station, 1943: 137.
[14] RANDALL J E. A review of ciguatera, tropical fish poisoning, with a tentative explanation of its cause[J]. Bull Mar Sci, 1958, 8(3): 236-267.
[15] 国家水产总局南海水产研究所. 南海诸岛海域鱼类志[M]. 北京: 科学出版社, 1979: 1-613. [16] FRANCIS M P, RANDALL J E. Further additions to the fish faunas of Lord Howe and Norfolk Islands, Southwest Pacific Ocean[J]. Pacif Sci, 1993, 47(2): 118-135. https://www.researchgate.net/publication/29737254_Further_Additions_to_the_Fish_Faunas_of_Lord_Howe_and_Norfolk_Islands_Southwest_Pacific_Ocean
[17] LIESKE E, MYERS R. Collins pocket guide. Coral reef fishes. Indo-Pacific & Caribbean including the Red Sea[M]. Ottawa: Haper Collins Publishers, 1994: 1-400.
[18] 费鸿年, 张诗全. 水产资源学[M]. 北京: 中国科学技术出版社, 1990: 114-285. [19] RICKER W E. Computation and interpretation of biological statistics of fish populations[J]. Bull Fish Res Bd Can, 1975, 191: 1-382. doi: 10.1086/409405
[20] 李忠炉, 金显仕, 单秀娟, 等. 小黄鱼体长-体质量关系和肥满度的年际变化[J]. 中国水产科学, 2011, 18(3): 602-610. doi: 10.3724/SP.J.1118.2011.00602 [21] KING M. Fisheries biology, assessment and management[M]. New York: John Wiley & Sons, 2013: 1-400.
[22] 李永振, 贾晓平, 陈国宝, 等. 南海珊瑚礁鱼类资源[M]. 北京: 海洋出版社, 2007: 1-446. https://xueshu.baidu.com/usercenter/paper/show?paperid=dd289cec199e98c218f4e43038d193db [23] LORENZEN K, BEVERIDGE M, MANGEL M. Cultured fish: integrative biology and management of domestication and interactions with wild fish[J]. Biol Rev, 2012, 87(3): 639-660. doi: 10.1111/j.1469-185X.2011.00215.x
[24] 李永振. 西沙、中沙和南沙群岛海域珊瑚礁鱼类物种多样性与生物学研究[D]. 青岛: 中国海洋大学, 2010. https://d.wanfangdata.com.cn/thesis/ChhUaGVzaXNOZXdTMjAyNDA5MjAxNTE3MjUSB0Q0NTU2OTcaCDZsd2tvN3F5 [25] 陈国宝, 李永振. 南海主要珊瑚礁鱼科鱼类的组成与分布[J]. 南方水产, 2005, 1(3): 18-25. doi: 10.3969/j.issn.2095-0780.2005.03.003 [26] POTHIN K, TESSIER E, PASCALE C, et al. Larval life history traits and laval growth of Gnathodentex aurolineatus (Lethrinidae) before and after settlement in a sandy bay of Reunion Island (SW Indian Ocean)[J]. Cybium, 2006, 30(1): 27-33. https://www.researchgate.net/publication/282172020_Larval_life_history_traits_and_larval_growth_of_Gnathodentex_aurolineatus_Lethrinidae_before_and_after_settlement_in_a_sandy_bay_of_Reunion_Island_SW_Indian_Ocean
[27] MATSUMOTO W M, SKILIMAN R A, DIZON A E. Synopsis of biological data on skipjack tuna Katsuwonus pelamis[R]. Rome: FAO, NOAA Technical Report NMFS Circular 451, FAO Fish Synop No. 136, 1984: 1-92.
[28] ALLEN G R, ERDMANN M V. Reef fishes of the East Indies[M]. Perth, Australia: Universitiy of Hawaii Press, Volumes I-III. Tropical Reef Research, 2012.
[29] 张谷贤, 尹健强. 南沙群岛海区毛颚动物的昼夜垂直移动[J]. 热带海洋学报, 2002, 21(1): 48-56. doi: 10.3969/j.issn.1009-5470.2002.01.007 [30] 尹健强, 黄良民, 李开枝, 等. 南沙群岛珊瑚礁浮游动物多样性与群落结构[J]. 生物多样性, 2011, 19(6): 685-95. doi: 10.3724/SP.J.1003.2011.11130 [31] 林楠, 姜亚洲, 袁兴伟, 等. 象山港黄姑鱼的食物组成与摄食习性[J]. 中国水产科学, 2013, 20(6): 1284-1292. doi: 10.3724/SP.J.1118.2013.01284 [32] 纪东平, 卞晓东, 宋娜, 等. 荣成俚岛大泷六线鱼摄食生态研究[J]. 水产学报, 2014, 38(9): 1399-1409. doi: 10.3724/SP.J.1231.2014.49191 [33] 高永利, 黄晖, 练健生, 等. 西沙群岛礁栖鱼类物种多样性及其食性特征[J]. 生物多样性, 2014, 22 (5): 618-623. doi: 10.3724/SP.J.1003.2014.14102 [34] CARPENTER K E, ALLEN G R. FAO Species Catalogue. Vol. 9. Emperor fishes and large-eye breams of the world, family Lethrinidae: an annotated and illustrated catalogue of lethrinid species known to date[M]. Rome: FAO, FAO Fish Synop No. 125, 1989: 1-118.
-
期刊类型引用(4)
1. 陈淑吟, 张志勇, 吉红九, 李鹏, 赵永超, 张志伟. 黑鲷×真鲷杂交子代与真鲷的Calmodulin基因克隆与表达分析. 海洋渔业. 2018(04): 435-446 .  百度学术
百度学术
2. 邬晓勇, 孙雁霞, 梁勇, 陈月星, 苟小军. 基于CODEHOP的欧李钙调蛋白基因片段的克隆. 烟台大学学报(自然科学与工程版). 2017(04): 292-300 .  百度学术
百度学术
3. 陈淑吟, 李鹏, 张志勇, 许津, 祝斐, 贾超峰, 王思婷, 任忠宏. 黑鲷♀×真鲷♂反交子代与黑鲷的CaM基因克隆与mRNA表达分析. 中国水产科学. 2017(06): 1193-1202 .  百度学术
百度学术
4. 李彦, 李北平, 蔡永琴, 岳俊杰, 邱正良. 用高斯网络模型研究钙调蛋白的构象转变. 生物技术通讯. 2016(06): 799-803 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载:





 粤公网安备 44010502001741号
粤公网安备 44010502001741号
