Tissue distribution of grouper iridovirus genus Ranavirus in infected farmed juvenile giant grouper (Epinephelus lanceolatus)
-
摘要:
石斑鱼蛙病毒能够感染多种石斑鱼并造成严重死亡。研究利用原位杂交和荧光定量PCR技术对蛙病毒三亚株GIV-R-SY1301在人工感染发病的鞍带石斑鱼(Epinephelus lanceolatus)不同组织中的分布进行定位、定量研究。原位杂交结果显示GIV-R-SY1301广泛存在于发病鱼的多个组织中, 脾脏和肾脏中杂交信号最强, 其次是肠道、胃、鳃、肝, 心脏中也有少量的杂交信号, 而脑和眼组织中没有杂交信号存在。荧光定量PCR检测结果显示GIV-R-SY1301在不同组织中的病毒含量为4.5×104~6.85×107拷贝·μg-1 DNA, 其中脾脏、心脏和肾脏中最多。组织原位杂交和荧光定量PCR结果基本一致。
Abstract:Grouper ranavirus infected many grouper species and caused severe mortality. We isolated a grouper iridovirus (genus Ranavirus) named GIV-R-SY1301 in Sanya by using cell culture, to study the tissue distribution of GIV-R-SY1301 in experimentally infected farmed Epinephelus lanceolatus by in situ hybridization and real-time PCR. The GIV-R-SY1301 was widespread in all tissues from infected fish.Strong hybridization signals were obtained from kidney and spleen, while intermediate intensity signals were observed in stomach, gill and liver. The weakest signals were obtained from heart and no signal was found in brain and eye. The real-time PCR results show that there were most viruses copies in spleen, kidney and heart (4.5×104~6.85×107 copies·μg-1) DNA in different tissues, which was similar with the result of in situ hybridization.
-
Keywords:
- Ranavirus /
- Epinephelus lanceolatus /
- in situ hybridization /
- real-time PCR
-
石斑鱼作为名贵海水鱼类之一,近年来在中国沿海地区网箱养殖的规模不断增大,取得了良好的经济效益[1-2]。随着消费需求的增长,养殖密度不断增加,病害日益严重,给石斑鱼养殖造成较大的损失[3],其中虹彩病毒病是危害最大的传染病之一[4]。近些年来虹彩病毒病暴发造成了包括巨石斑鱼(Epinephelus tauvina)、棕点石斑鱼(E.fuscogutatus)、青石斑鱼(E.awoara)和斜带石斑鱼(E.coioides)在内的多种养殖石斑鱼大规模死亡,死亡率高达90%以上[5-11]。
虹彩病毒是一类大型正二十面体状的DNA病毒。虹彩病毒科(Iridoviridae)分为5个属,即虹彩病毒属(Iridovirus)、绿虹彩病毒属(Chloriridovirus)、淋巴囊肿病毒属(Lymphocystivirus)、蛙病毒属(Ranavirus)和肿大细胞病毒属(Megalocytivirus)[12]。在过去的几十年里,虹彩病毒在全世界范围内造成了野生鱼、饲养鱼、观赏鱼的严重疾病[13-15]。在虹彩病毒家族中,淋巴囊肿病毒、蛙病毒和肿大细胞病毒属的成员可感染鱼类,其中肿大细胞病毒属和蛙病毒属是鱼类重要病毒性病原,并且给鱼类养殖造成重大的经济损失。1986年LANGDON等[16-18]在大量死亡的河鲈(Perca fluviatilis)中发现虹彩病毒流行性造血器官坏死病毒(epizootic haematopoietic necrosis virus,EHNV),这是第一次在鱼体上发现蛙病毒。EHNV对河鲈具有很强的致病性,对虹鳟(Oncorhynchus mykiss)也能造成较高的死亡率,迄今为止,已经报道有13种鱼感染EHNV。新加坡石斑鱼虹彩病毒(Singapore grouper iridovirus,SGIV)是从巨石斑身上分离的一种重要的石斑鱼蛙病毒[9],GIV-R-SY1301与SGIV为同属病毒,但GIV-R-SY1301的MCP核苷酸序列与SGIV相比有4个碱基的差异[19]。蛙病毒对鞍带石斑鱼(E.lanceolatus)稚鱼具有强烈致病性(未报道资料),曾多次在台湾养殖鞍带石斑鱼身上检测到[19]。虽然目前对石斑鱼蛙病毒的病理学、全基因结构和功能、转录组分析、侵入途径、敏感细胞系的建立和分子药物等方面有了比较深入的了解[4, 20-23],但对于病毒的致病机制仍然不是很清楚。文章利用组织原位杂交和荧光定量PCR方法研究石斑鱼蛙病毒GIV-R-SY1301株在鞍带石斑鱼幼鱼的组织分布,为探讨该病毒的致病机制提供基础资料。
1. 材料与方法
1.1 细胞、病毒和试验鱼
病毒株GIV-R-SY1301来自实验室保存的毒株,该毒株最初在发病的珍珠龙胆石斑鱼(Epinephelus fuscoguttatus ♀×E.lance-olatus ♂)身上分离,通过接种到MFF-1细胞[24],得到一株纯培养病毒[19]。试验所用的鞍带石斑鱼(平均质量约5 g)均购自三亚当地某养殖场,暂养于海南三亚热带水产研究开发中心。暂养期间,每天投喂3次,水温为25~28 ℃,盐度为3.2,保持每天换水和不间断充气。试验组和对照组鱼每尾分别腹腔注射100 μL 105.5TCID50 GIV-R-SY1301病毒细胞培养液和100 μL DMEM medium。
组织原位杂交和绝对定量PCR取样:注射3 d后试验组鱼开始出现蛙病毒感染后的临床症状:病鱼体色变深、活力差、停止摄食和游动、似昏睡状侧躺在池底。选取症状明显且濒临死亡的10尾鱼,5尾于-80 ℃冷冻保存用于荧光定量PCR检测,另取5尾发病鱼的脾脏、肾脏、肝脏、心脏、鳃、肠、胃、脑和眼等组织,用锋利的刀片切成约为5 mm3的小片固定在10%的中性福尔马林溶液中48 h用于组织原位杂交。按照同样方式随机选取对照组10尾鱼进行处理。
1.2 病毒DNA抽提和MCP模板制备
按照天根海洋动物组织基因组DNA提取试剂盒(TIANamp Marine Animals DNA Kit)操作说明书进行。用于扩增病毒MCP基因的引物序列参考蛙病毒GIV的MCP的保守序列[19]。上游引物为5′-ATGACTTGTACAACGGGT-3′, 下游引物为5′-TTACAAGATAGGGAACCCCAT-3′。扩增体系为50 μL包含2dH2O 36.6 μL,病毒模板2 μL,上游引物2 μL,下游引物2 μL,10×Buffer 5 μL,dNTPs 2 μL,rTap酶0.4 μL。扩增条件为94 ℃,5 min;94 ℃,40 s;55 ℃,40 s;72 ℃,90 s;35个循环;72 ℃,10 min。PCR扩增产物经过1.2%琼脂糖凝胶电泳检测和切胶回收,切胶回收按照SanPrep柱式PCR产物纯化试剂盒(生工生物)的操作说明书进行,回收产物用分光光度计(NANODROP2000,Thermo)测定纯度和浓度,并保存在-20 ℃备用。
1.3 探针标记
GIV-R-SY1301的MCP基因探针标记按照DIG High Prime DNA标记及杂交检测试剂盒I(DIG High Prime DNA Labeling and Detection Starter Kit I,Roche)的说明书进行。步骤为:取1 μg MCP模板加双蒸水至16 μL,轻轻混匀后沸水浴10 min,进行变性处理,变性后立即将反应管置于冰上2 min;将DIG-High Prime(管1)混合均匀,取4 μL加入经变性的DNA中,混匀后简单离心,37 ℃孵育20 h;加入2 μL 0.2 mol · L-1 EDTA(pH 8.0)终止反应,标记的探针-20 ℃保存备用。探针定量标记反应效率的检测也按照DIG High Prime DNA标记及杂交检测试剂盒Ⅰ的说明书进行。
1.4 组织原位杂交
固定的组织按常规组织学方法,经一系列酒精梯度脱水、二甲苯透明、石腊包埋。将组织块于切片机上切片,厚度为5 μm,并贴片在防脱载玻片上,将切片于60 ℃烘烤30 min。
切片预处理。组织切片经脱腊和水化后用0.1 mol · L-1 PBS洗涤10 min×2;接着0.2 mol · L-1 HCl溶液处理20 min,然后在含有5 mmol · L-1 EDTA的2×SSC(0.3 mol · L-1 NaCl,0.03 mol · L-1 Na3C6H5O7)溶液55 ℃中浸泡30 min。加入蛋白酶K(100 μg · mL-1)37℃消化25 min后用0.2 mol ·L-1甘氨酸液室温10 min以中止蛋白酶反应。用预冷4%多聚甲醛室温固定10 min后0.1 mol · L-1PBS漂洗10 min×2。
预杂交。每张组织切片滴加100 μL预杂交液(预杂交液按照DIG High Prime DNA标记及杂交检测试剂盒I说明配制),42 ℃湿盒中预杂交30 min。
杂交。每张切片滴加25 μL杂交液,用盖玻片封盖,将切片95 ℃变性10 min,然后迅速置于冰上1 min,将切片置于湿盒内42 ℃杂交16~18 h。
杂交后漂洗。组织切片分别经2×SSC 55 ℃漂洗10 min×2和0.5×SSC 55 ℃漂洗5 min×2。
免疫检测(所用缓冲液试剂按照DIG High Prime DNA标记及杂交检测试剂盒Ⅰ说明配制)。封闭缓冲液下室温孵育30 min;马来酸缓冲液室温漂洗15 min;酶标地高辛抗体(1 ∶ 1 500,用马来酸缓冲液稀释)37 ℃30 min;马来酸缓冲液室温漂洗15 min×2;TE缓冲液终止反应,室温5 min。
显色与封片。按照DIG High Prime DNA标记及杂交检测试剂盒I说明下进行,显色完成后切片经过5% Bismarck Brown Y复染7 min、酒精梯度脱水、二甲苯透明、中性树胶封片、镜检。
1.5 荧光定量PCR
将胶回收的MCP基因扩增产物与pMD-18T载体连接,导入大肠杆菌感受态细胞中,涂布于抗氨苄LB固体培养基培养,挑取单菌落于抗氨苄的LB液体培养基中37 ℃,于摇床2 202 r · min-1,培养14~16 h。培养后菌液经测序测定为含有重组载体的大肠杆菌。菌液质粒提取(QIAprepSpin Miniprep Kit,QIAGEN),用分光光度计测定提取的质粒的质量和浓度,并计算质粒拷贝数。质粒拷贝数计算公式为:
分子拷贝数(拷贝· μL-1)=DNA质量浓度/DNA分子量
其中DNA质量浓度=260 nm吸光度×稀释倍数×6.02×1023;DNA分子量=DNA碱基数×324.5[25]。
标准曲线建立:根据病毒MCP开放阅读框序列设计上游引物F2:5′-CCGTGAGGTGGACCAAAAAC-3′和下游引物R2:5′-CCTGACCCTGAGCGGGAGTG-3′。将浓度为1×109拷贝· μL-1的重组质粒进行10倍梯度稀释,使其浓度依次为1×109 ~1×102拷贝· μL-1作为标准品模板, 在最佳反应条件下同时扩增, 反应结束后绘制标准曲线。反应体系包含SYBR Green Mix 10 μL,F2引物0.2 μL,R2引物0.2 μL,MCP模板1 μL,ddH2O 8.6 μL。反应条件为95 ℃,2 min;95 ℃,15 s;58 ℃,30 s;40个循环。
未知样品的检测:称取一定质量的发病死亡的3尾鱼的脾脏、肾脏、肝脏、心脏、鳃、肠、胃、脑和眼分别抽提DNA,并用分光光度计测定质量和浓度。将不同组织的DNA模板用双蒸水稀释到同一浓度后进行荧光定量PCR检测,每组重复3次。
2. 结果
2.1 原位杂交
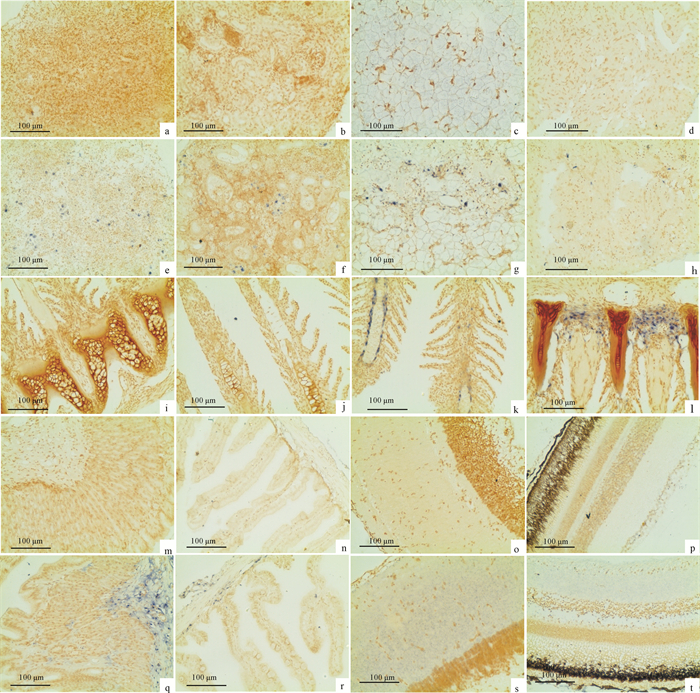
原位杂交结果显示,在GIV-R-SY1301感染的鞍带石斑鱼中,脾脏和肾脏组织中的杂交信号最强、阳性细胞数量最多;肝脏、鳃、肠道、胃组织其次;心脏中较少;而脑和眼中没有发现阳性信号(图 1-s和图 1-t)。在对照组鱼的所有组织中都没有发现阳性杂交信号。阳性信号主要出现在细胞核中,偶尔在细胞质中也存在。
![]() 图 1 感染GIV-R-SY1301后发病鞍带石斑鱼幼鱼各个组织的原位杂交结果阳性信号为蓝色。a,b,c,d,m,n,o,p,i,j分别为对照组脾、肾脏、肝脏、心脏、胃、肠、脑、眼和鳃组织的原位杂交结果图; e.发病鱼脾脏,大量阳性细胞散布在脾髓中;f.发病鱼肾脏,杂交信号主要存在于肾小体和其周围的造血组织中,肾小管中没有发现信号;g.发病鱼肝脏,杂交信号位于肝细胞周围的门管和血窦中,而正常的肝细胞没有信号;h.发病鱼心脏,少量的杂交信号位于心脏心肌细胞中;k~l.发病鱼的鳃,杂交信号主要位于血管和毛细血管丰富的周围组织,例如软骨组织周围的毛细血管网(k)和入鳃动脉(l);q~r.发病鱼胃和肠道,杂交信号主要在具有丰富血管的粘膜下层和浆膜层,粘膜层也有微弱的信号存在;s~t.发病鱼脑和眼,没有杂交信号在脑和眼中。Figure 1. Result of in situ hybridization in different tissues of E.lanceolatusThe signal is observed microscopically as blue staining. a, b, c, d, m, n, o, p, i and j are in situ hybridization results of spleen, kidney, liver, heart, stomach, intestines, brain, eye and gill, respectively. e. spleen of infected fish, many hybridization signals distributed in splenic pulp; f. hybridization signals were mainly in renal corpuscle and its surrounding hemopoietic tissues, but not in tubular epithelium; g. liver, hybri-dization signals were observed in portal area of necrotic hepatocyte, but not in normal hepatocyte; h. heart, only few hybridization signals were observed in myocardial cell; k~l. gill, hybridization signals were mainly around the afferent artery and capillary vessel lumen, such as in capillary vessel lumen around cartilage tissue (k) and afferent branchial vessel (l). q and r. stomach and intestines, hybridization signals were mainly in the submucosa and serosa where had rich blood vessels, and slightly in the mucosa; s~t. brain and eye, no hybridization signal was found in brain and eye.
图 1 感染GIV-R-SY1301后发病鞍带石斑鱼幼鱼各个组织的原位杂交结果阳性信号为蓝色。a,b,c,d,m,n,o,p,i,j分别为对照组脾、肾脏、肝脏、心脏、胃、肠、脑、眼和鳃组织的原位杂交结果图; e.发病鱼脾脏,大量阳性细胞散布在脾髓中;f.发病鱼肾脏,杂交信号主要存在于肾小体和其周围的造血组织中,肾小管中没有发现信号;g.发病鱼肝脏,杂交信号位于肝细胞周围的门管和血窦中,而正常的肝细胞没有信号;h.发病鱼心脏,少量的杂交信号位于心脏心肌细胞中;k~l.发病鱼的鳃,杂交信号主要位于血管和毛细血管丰富的周围组织,例如软骨组织周围的毛细血管网(k)和入鳃动脉(l);q~r.发病鱼胃和肠道,杂交信号主要在具有丰富血管的粘膜下层和浆膜层,粘膜层也有微弱的信号存在;s~t.发病鱼脑和眼,没有杂交信号在脑和眼中。Figure 1. Result of in situ hybridization in different tissues of E.lanceolatusThe signal is observed microscopically as blue staining. a, b, c, d, m, n, o, p, i and j are in situ hybridization results of spleen, kidney, liver, heart, stomach, intestines, brain, eye and gill, respectively. e. spleen of infected fish, many hybridization signals distributed in splenic pulp; f. hybridization signals were mainly in renal corpuscle and its surrounding hemopoietic tissues, but not in tubular epithelium; g. liver, hybri-dization signals were observed in portal area of necrotic hepatocyte, but not in normal hepatocyte; h. heart, only few hybridization signals were observed in myocardial cell; k~l. gill, hybridization signals were mainly around the afferent artery and capillary vessel lumen, such as in capillary vessel lumen around cartilage tissue (k) and afferent branchial vessel (l). q and r. stomach and intestines, hybridization signals were mainly in the submucosa and serosa where had rich blood vessels, and slightly in the mucosa; s~t. brain and eye, no hybridization signal was found in brain and eye.在脾脏中,众多的阳性细胞散布在脾髓中(图 1-e)。肾脏中阳性信号主要聚集在肾小体和其周围的造血组织中,而肾小管没有发现杂交信号(图 1-f)。在肝脏中,杂交信号只存在于坏死的肝细胞周围的门管和血窦中,而正常的肝细胞中没有信号存在(图 1-g)。
在鳃中,阳性信号主要位于鳃耙和软骨组织周围的鳃丝毛细血管腔中(图 1-k和图 1-l)。在肠和胃中,信号主要在具有丰富血管的粘膜下层,浆膜和粘膜层也存在微弱的信号(图 1-q和图 1-r)。少量的杂交信号位于心脏心肌细胞中(图 1-h)。
2.2 荧光定量PCR检测
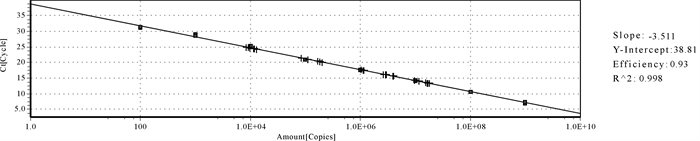
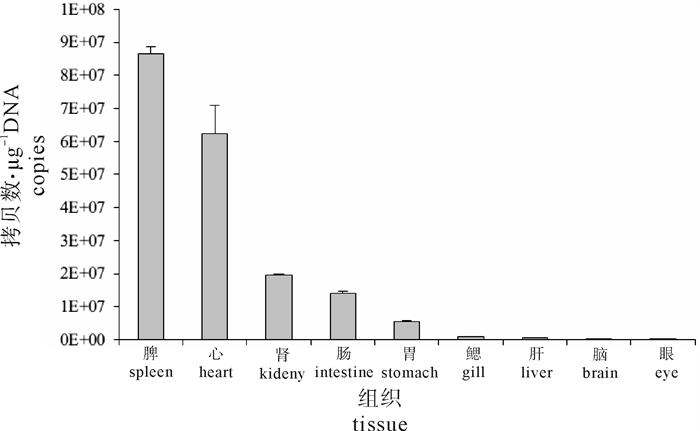
试验结果显示浓度依次为1×109~1×102标准模板的3个重复反应获得的扩增曲线的阈值基本相同,说明可进行稳定、可靠的检测。根据拷贝数和Ct值的关系得到标准曲线(图 2)。由图可知,该曲线的斜率为-3.511,相关系数R2为0.998,根据所测得的未知样品的Ct值就可获得该样品所含有的病毒拷贝数。鞍带石斑鱼各组织的病毒拷贝数在4.5×104~6.85×107拷贝· μg-1 DNA(图 2、图 3)。其中脾脏中的病毒含量最多,达6.85×107拷贝· μg-1 DNA。其次是心脏、肾脏、肠道。而在脑和眼中最少,分别是6.0×104和4.5×104拷贝· μg-1 DNA。
3. 讨论
蛙病毒能造成鱼类严重的系统性疾病,尤其对脾脏和肾脏等造血组织的损伤最为严重[26]。此试验原位杂交结果表明脾脏和肾脏组织中的杂交信号最强、阳性细胞数量最多;肠道、胃、肝脏、鳃组织其次;心脏中较少;而脑和眼中没有阳性信号发现。荧光定量PCR检测结果显示不同组织中的病毒拷贝数从多到少依次为脾脏、心脏、肾脏、肠道、胃、鳃、肝脏、脑和眼睛,拷贝数量在6.85×107~4.5×104拷贝· μg-1 DNA,与原位杂交结果基本吻合。但是肾脏和鳃组织的原位杂交结果与荧光定量PCR结果存在一定差异,这可能是因为病毒在鳃组织和肾组织中的聚集情况不同。鳃中病毒只聚集在特定部位,因此所选取的视野部分原位杂交结果的信号比较集中,而定量PCR结果显示病毒含量不高。而在肾脏和心脏组织中,原位杂交信号广泛、均匀地分布在整个组织中,因此视野中杂交信号显得不集中,但是荧光定量PCR检测含量却很高。
HUANG等[27]运用原位杂交技术检测新加坡虹彩病毒在点带石斑鱼(E.malabaricus)的组织分布发现,病毒广泛存在于发病石斑鱼的各个组织中,其中脾脏和肾脏中的核酸信号最强烈。杂交信号主要位于上皮组织、内皮组织、血管和血管周围中感染的肥大细胞中。这与GIV-R-SY1301感染鞍带石斑鱼幼鱼的情况基本一致,但是此研究中细胞肥大不明显并且只存在于脾脏和肾脏组织中。许多研究表明,这些肿大细胞很可能是虹彩病毒的靶细胞和复制位点。例如,感染台湾石斑鱼虹彩病毒(TGIV)的杂交石斑鱼中,肿大细胞首先在脾脏中形成,然后是肾脏和鳃组织,并且原位杂交信号只存在于嗜碱性的肿大细胞中。感染的初期杂交信号位于核中;感染末期胞质和胞核中都有核酸信号存在[28]。而在感染肿大细胞病毒的考氏鳍竺鲷(Pterapogon kauderni)中,核酸杂交信号位于肿大细胞的细胞质中[29]。此研究中脾脏和肾脏组织中的杂交信号最强、阳性细胞数量最多。这说明GIV-R-SY1301感染鞍带石斑鱼的主要靶器官是脾脏和肾脏。LEE等[30]在研究感染肿大细胞病毒的条石鲷时发现带有核酸标记信号的肿大细胞主要位于血液丰富的血管网和血窦周围的组织中,这些肿大细胞被证明是浸润的白细胞。同时血涂片原位杂交结果也显示白细胞中存在核酸信号。
此研究中,肝脏、鳃、肠道和胃组织杂交信号主要位于含有丰富血管的周围组织中。因此受感染的细胞可能是淋巴细胞和吞噬细胞。OGAWA等[31]报道病毒一旦在靶器官开始复制,可能通过感染的淋巴细胞或吞噬细胞经由血液循环系统感染全身,继而造成系统性病毒血症。CANO等[32]运用免疫组化和组织原位杂交技术也证明在感染淋巴囊肿病毒的金头鲷(Sparus aurata)中,阳性信号只存位于肾小体和其周围的造血组织中,而不存在于肾小管中;此研究发现GIV-R-SY1301阳性信号同样主要聚集在肾小体和其周围的造血组织中,而肾小管没有发现杂交信号。这似乎说明GIV-R-SY1301对肾小管造成的损伤不是由病毒直接导致的。
综上所述,蛙病毒GIV-R-SY1301广泛分布于内部组织器官中,能对鞍带石斑鱼幼鱼造成严重的系统性疾病。病毒在脾脏、心脏和肾脏组织中分布最多,但是其致病机制需要进一步研究。
-
图 1 感染GIV-R-SY1301后发病鞍带石斑鱼幼鱼各个组织的原位杂交结果
阳性信号为蓝色。a,b,c,d,m,n,o,p,i,j分别为对照组脾、肾脏、肝脏、心脏、胃、肠、脑、眼和鳃组织的原位杂交结果图; e.发病鱼脾脏,大量阳性细胞散布在脾髓中;f.发病鱼肾脏,杂交信号主要存在于肾小体和其周围的造血组织中,肾小管中没有发现信号;g.发病鱼肝脏,杂交信号位于肝细胞周围的门管和血窦中,而正常的肝细胞没有信号;h.发病鱼心脏,少量的杂交信号位于心脏心肌细胞中;k~l.发病鱼的鳃,杂交信号主要位于血管和毛细血管丰富的周围组织,例如软骨组织周围的毛细血管网(k)和入鳃动脉(l);q~r.发病鱼胃和肠道,杂交信号主要在具有丰富血管的粘膜下层和浆膜层,粘膜层也有微弱的信号存在;s~t.发病鱼脑和眼,没有杂交信号在脑和眼中。
Figure 1. Result of in situ hybridization in different tissues of E.lanceolatus
The signal is observed microscopically as blue staining. a, b, c, d, m, n, o, p, i and j are in situ hybridization results of spleen, kidney, liver, heart, stomach, intestines, brain, eye and gill, respectively. e. spleen of infected fish, many hybridization signals distributed in splenic pulp; f. hybridization signals were mainly in renal corpuscle and its surrounding hemopoietic tissues, but not in tubular epithelium; g. liver, hybri-dization signals were observed in portal area of necrotic hepatocyte, but not in normal hepatocyte; h. heart, only few hybridization signals were observed in myocardial cell; k~l. gill, hybridization signals were mainly around the afferent artery and capillary vessel lumen, such as in capillary vessel lumen around cartilage tissue (k) and afferent branchial vessel (l). q and r. stomach and intestines, hybridization signals were mainly in the submucosa and serosa where had rich blood vessels, and slightly in the mucosa; s~t. brain and eye, no hybridization signal was found in brain and eye.
-
[1] 何永亮, 区又君, 李加儿, 等. 石斑鱼人工繁育技术研究进展[J]. 南方水产, 2008, 4(3): 75-79. doi: 10.3969/j.issn.2095-0780.2008.03.013 [2] 董秋芬, 刘楚吾, 郭昱嵩, 等. 9种石斑鱼遗传多样性和系统发生关系的微卫星分析[J]. 遗传, 2007, 29(7): 837-843. doi: 10.3321/j.issn:0253-9772.2007.07.011 [3] 陈大玮, 邓利, 刘志刚, 等. 斜带石斑鱼抗菌肽hepcidin基因克隆及其成熟肽的原核融合表达[J]. 南方水产科学, 2011, 7(1): 1-7. doi: 10.3969/j.issn.2095-0780.2011.01.001 [4] HUANG Y, HUANG X, YAN Y, et al. Transcriptome analysis of orange-spotted grouper (Epinephelus coioides) spleen in response to Singapore grouper iridovirus[J]. BMC genomics, 2011, 12(1): 556-568. doi: 10.1186/1471-2164-12-556
[5] CHUA F, LOO J, WEE J, et al. Investigation of outbreaks of a novel disease, 'sleepy grouper disease', affecting the brown-spotted grouper, Epinephelus tauvina Forskal[J]. J Fish Dis, 1994, 17(4): 417-427. doi: 10.1111/j.1365-2761.1994.tb00237.x
[6] GIBSON K, NGOH-LIM G, NETTO P, et al. A systemic iridoviral disease in mullet, Mugil cephalus L., and tiger grouper, Epinephelus fuscoguttatus Forsskal: a first report and study[J]. J Fish Dis, 2004, 27(12): 693-699. doi: 10.1111/j.1365-2761.2004.00589.x
[7] MAHARDIKA K, YAMAMOTO A, MIYAZAKI A, et al. Susceptibility of juvenile humpback grouper Cromileptes altivelis to grouper sleepy disease iridovirus (GSDIV)[J]. Dis Aquat Org, 2004, 59(1): 1-9. https://pubmed.ncbi.nlm.nih.gov/15212286/
[8] MURALI S, WU F, GUO I, et al. Molecular characterization and pathogenicity of a grouper iridovirus (GIV) isolated from yellow grouper, Epinephelus awoara (Temminck & Schlegel)[J]. J Fish Dis, 2002, 25(2): 91-100. doi: 10.1046/j.1365-2761.2002.00343.x
[9] QIN Q, CHANG S, NGOH L, et al. Characterization of a novel ranavirus isolated from grouper Epinephelus tauvina[J]. Dis Aquat Org, 2003, 53(1): 1-9. https://www.researchgate.net/publication/10880376_Characterization_of_a_novel_ranavirus_isolated_from_grouper_Epinephelus_tauvina
[10] CHOU H, HSU C, PENG T. Isolation and characterization of pathogenic iridovirus from cultured grouper (Epinephelus sp.) in Taiwan[J]. Fish Pathol, 1998, 33: 201-206. doi: 10.3147/jsfp.33.201
[11] MA H, XIE J, WENG S, et al. Co-infection of megalocytivirus and viral nervous necrosis virus in a very severe mass mortality of juvenile orange-spotted groupers (Epinephelus coioides)[J]. Aquaculture, 2012, 35(8): 170-175. https://www.sciencedirect.com/science/article/pii/S0044848612003973
[12] KING A, ADAMS M, LEFKOWITZ E, et al. Virus taxonomy: classification and nomenclature of viruses: Ninth Report of the International Committee on Taxonomy of Viruse[R]. San Diego, CA: Elsevier, 2012: 193-210.
[13] HYATT A, GOULD A, ZUPANOVIC Z, et al. Comparative studies of piscine and amphibian iridoviruses[J]. Arch Virol, 2000, 145(2): 301-331. doi: 10.1007/s007050050025
[14] PIASKOSKI T, PLUMB J, ROBERTS S, et al. Characterization of the largemouth bass virus in cell culture[J]. J Aquat Anim Heal, 1999, 11(1): 45-51. doi: 10.1577/1548-8667(1999)011<0045:COTLBV>2.0.CO;2
[15] WANG Y, LÜ L, WENG S, et al. Molecular epidemiology and phylogenetic analysis of a marine fish infectious spleen and kidney necrosis virus-like (ISKNV-like) virus[J]. Arch Virol, 2007, 152(4): 763-773. doi: 10.1007/s00705-006-0870-4
[16] LANGDON J, HUMPHREY J, WILLIAMS L, et al. First virus isolation from Australian fish: an iridovirus-like pathogen from redfin perch, Perca fluviatilis L. [J]. J Fish Dis, 1986, 9(3): 263-268. doi: 10.1111/j.1365-2761.1986.tb01011.x
[17] LANGDON J, HUMPHREY J, WILLIAMS L. Outbreaks of an EHNV-like iridovirus in cultured rainbow trout, Salmo gairdneri Richardson, in Australia[J]. J Fish Dis, 1988, 11(1): 93-96. doi: 10.1111/j.1365-2761.1988.tb00527.x
[18] LANGDON J, HUMPHREY J. Epizootic haematopoietic necrosis, a new viral disease in redfin perch, Perca fluviatilis L., in Australia[J]. J Fish Dis, 1987, 10(4): 289-297. doi: 10.1111/j.1365-2761.1987.tb01073.x
[19] 马红玲, 郭志勋, 何建国. 一株新的石斑鱼虹彩病毒(蛙病毒)的分离鉴定与特性分析[G]//中国水产学会渔病专业委员会2013年学术研讨会摘要汇编. 海口: 中国水产学会, 2013: 70. [20] WANG S, HUANG X, HUANG Y, et al. Entry of a novel marine DNA virus, Singapore grouper iridovirus, into host cells occurs via clathrin-mediated endocytosis and macropinocytosis in a pH-dependent manner[J]. J Virol, 2014, 88(22): 13047-13063. doi: 10.1128/JVI.01744-14
[21] LI P, YAN Y, WEI S, et al. Isolation and characterization of a new class of DNA aptamers specific binding to Singapore grouper iridovirus (SGIV) with antiviral activities[J]. Virus Res, 2014, 188: 146-154. doi: 10.1016/j.virusres.2014.04.010
[22] GONG J, HUANG Y, HUANG X, et al. Establishment and characterization of a new cell line derived from kidney of grouper, Epinephelus akaara (Temminck & Schlegel), susceptible to Singapore grouper iridovirus (SGIV)[J]. J Fish Dis, 2011, 34(9): 677-686. doi: 10.1111/j.1365-2761.2011.01281.x
[23] YAN Y, CUI H, GUO C, et al. Singapore grouper iridovirus-encoded semaphorin homologue (SGIV-sema) contributes to viral replication, cytoskeleton reorganization and inhibition of cellular immune responses[J]. J General Virol, 2014, 95(Pt 5): 1144-1155. https://pubmed.ncbi.nlm.nih.gov/24535211/
[24] DONG C, WENG S, SHI X, et al. Development of a mandarin fish Siniperca chuatsi fry cell line suitable for the study of infectious spleen and kidney necrosis virus (ISKNV)[J]. Virus Res, 2008, 135(2): 273-281. doi: 10.1016/j.virusres.2008.04.004
[25] 周勇, 曾令兵, 孟彦, 等. 大鲵虹彩病毒TaqMan实时荧光定量PCR检测方法的建立[J]. 水产学报, 2012, 36(5): 772-778. doi: 10.3724/SP.J.1231 [26] WHITTINGTON R. BECKER J, DENNIS M, et al. Iridovirus infections in finfish-critical review with emphasis on ranaviruses[J]. J Fish Dis, 2010, 33(2): 95-122. doi: 10.1111/j.1365-2761.2009.01110.x
[27] HUANG C, ZHANG X, GIN K, et al. In situ hybridization of a marine fish virus, Singapore grouper iridovirus with a nucleic acid probe of major capsid protein[J]. J Virolog Methods, 2004, 117(2): 123-128. doi: 10.1016/j.jviromet.2004.01.002
[28] CHAO C, CHEN C, LAI Y, et al. Histological, ultrastructural, and in situ hybridization study on enlarged cells in grouper Epinephelus hybrids infected by grouper iridovirus in Taiwan (TGIV)[J]. Dis Aquat Org, 2004, 58(2/3): 127-142. https://pubmed.ncbi.nlm.nih.gov/15109134/
[29] WEBER E, WALTZEK T, YOUNG D, et al. Systemic iridovirus infection in the Banggai cardinalfish (Pterapogon kauderni Koumans 1933)[J]. J Veter Diagnost Investig, 2009, 21(3): 306-320. doi: 10.1177/104063870902100302
[30] LEE N, DO J, PARK J, et al. Characterization of virus distribution in rock bream (Oplegnathus fasciatus; Temminck and Schlegel) infected with Megalocytivirus[J]. J Comp Pathol, 2009, 141(1): 63-69. doi: 10.1016/j.jcpa.2009.03.008
[31] OGAWA M, AHNE W, FISCHER S, et al. Pathomorphological alterations in sheatfish fry Silurus glanis experimentally infected with iridovirus-like agent[J]. Dis Aquat Org, 1990, 9(3): 187-191. https://www.semanticscholar.org/paper/Pathomorphological-alterations-in-sheatfish-fry-an-Ogawa-Ahne/e44ab1f4840faf7201188a23596c68c33da98bf3
[32] CANO I, FERRO P, ALONSO M, et al. Application of in situ detection techniques to determine the systemic condition of lymphocystis disease virus infection in cultured gilt-head seabream, Sparus aurata L. [J]. J Fish Dis, 2009, 32(2): 143-150. doi: 10.1111/j.1365-2761.2008.00970.x
-
期刊类型引用(6)
1. 刘铁柱,李建东,王世文. 登革热疫苗研究进展. 病毒学报. 2025(02): 580-586 .  百度学术
百度学术
2. 王巧煌,林楠,张杰,张杰鑫,陈小强,谢友佺,黄光亮. 大黄鱼虹彩病毒的流行情况初步调查及组织分布研究. 病毒学报. 2025(02): 571-579 .  百度学术
百度学术
3. 王丛旭,潘晓艺,周可欣,穆雪娇,姚嘉赟,蔺凌云,赵建华,沈锦玉. 体外传代对大口黑鲈蛙虹彩病毒毒株毒力的影响. 大连海洋大学学报. 2023(04): 623-629 .  百度学术
百度学术
4. 赵丹阳,施慧,许文军,何杰,王庚申. 养殖三疣梭子蟹十足目虹彩病毒1的检出及组织病理学分析. 中国水产科学. 2023(08): 1042-1053 .  百度学术
百度学术
5. 杨展展,林强,付小哲,罗霞,刘礼辉,梁红茹,牛银杰,左绍志,张晓婷,李宁求. 大口黑鲈蛙病毒分子流行病学及组织病理分析. 水产学报. 2022(06): 1063-1073 .  百度学术
百度学术
6. 马红玲,徐力文,程长洪,苏友禄,邓益琴,冯娟,郭志勋. 石斑鱼育苗场传染性病原(病毒)传入途径风险评估指标体系的构建. 中国动物检疫. 2019(05): 19-28+48 .  百度学术
百度学术
其他类型引用(4)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
