Study on mucous and gastrin cells of digestive tract in Qinglong grouper (Epinephelus coioides♀×E.lanceolatus♂) juveniles
-
摘要:
利用组织化学(AB-PAS)和免疫组织化学(SABC)的方法分别对斜带石斑鱼(Epinephelus coioides ♀)×鞍带石斑鱼(E.lanceolatus ♂)杂交子代(青龙斑)幼鱼消化道的粘液细胞和胃泌素(gastrin, Gas)分泌细胞的分布进行系统的研究。青龙斑幼鱼食道中有Ⅰ、Ⅱ、Ⅲ和Ⅳ型粘液细胞, 含中性粘多糖和酸性粘多糖。贲门胃粘液细胞有Ⅰ、Ⅱ、Ⅲ种类型, 胃体部有Ⅰ、Ⅲ、Ⅳ型粘液细胞, 在胃腺的周围含有较多的Ⅰ和Ⅳ型粘液细胞, 而幽门胃中只有Ⅰ型粘液细胞, 只含有中性粘多糖。幽门盲囊和肠道都含有中性粘多糖和酸性粘多糖, 幽门盲囊以Ⅱ型粘液细胞最多, 少量的Ⅲ型粘液细胞, 前肠、中肠和后肠均有4种类型的粘液细胞。肠道粘液细胞数量为中肠>后肠>前肠。利用免疫学的方法研究青龙斑幼鱼消化道Gas细胞的分布, 表明幼鱼的整个肠道和幽门盲囊均有Gas细胞的存在, 食道和胃中未发现Gas免疫阳性细胞。
Abstract:We studied the distribution of mucous and gastrin cells of digestive tract in Qinglong grouper (Epinephelus coioides ♀×E.lanceolatus ♂) juveniles by histochemistry (AB-PAS) and immunohistochemistry (SABC). Mucous cells in esophagus of juvenile were of TypeⅠ, TypeⅡ, TypeⅢ and TypeⅣ containing neutral and acidic mucoitin; mucous cells of TypeⅠ, TypeⅡ and Type Ⅲ were found in cardiac stomach; mucous cells of TypeⅠ, Type Ⅲ and Type Ⅳ were found in fundic stomach. Many mucous cells of TypeⅠ, and Type Ⅳ could be found around gastric gland, and only mucous cells of TypeⅠcontaining neutral mucointin was found in pyloric stomach. Pyloric caeca and intestines contained neutral and acidic mucointin. Mucous cells in the pyloric caeca were mostly of Type Ⅱ but less Type Ⅲ. Four types of mucous cells could all be observed in foregut, midgut and hindgut. The descending order of number of intestinal mucous cells was midgut>hindgut>foregut. Moreover, the study on the distribution of gastrin cells in the digestive tract by immunohistochemistry indicates that the gastrin cells were found in entire intestine and pyloric caeca but not in esophagus and stomach.
-
Keywords:
- Epinephelus coioides /
- E.lanceolatus /
- hybrid /
- digestive tract /
- mucous cells /
- gastrin cells
-
近江牡蛎(Crassostrea rivulari)和波纹巴非蛤(Paphia undulate)是2种主要的养殖经济贝类,因其具有营养丰富、味道鲜美和食用方便等特点,深受消费者欢迎。它们能为人体提供丰富的蛋白质和氨基酸,尤其牡蛎还享有“海中牛奶”的美称[1],作为高灰分、低脂肪的食物[2],对不同年龄段的人、特别是老年人具有营养与保健功能[3]。同时近江牡蛎和波纹巴非蛤还富含人体必需的微量元素铁(Fe)、铜(Cu)等,常作为治疗缺乏微量元素(如Fe)辅助治疗的食疗材料[4]。
贝类作为食物进入人体消化道后,只有部分营养物质会被消化吸收,同时贝类不同的食用方式也会对其消化吸收[5]有影响,为更好地评估摄入量,体外仿生模型被引入到贝类中微量金属的分析研究中,通过模拟人体胃肠消化过程,考察贝类中微量金属在人体消化过程中的生物可接受性[6-9]。目前采用体外仿生模型研究食品、药品的生物可接受性已被广泛应用和认可[10-12]。近江牡蛎和波纹巴非蛤微量金属元素分析主要集中在总量[13-17],关于生物可接受性研究、特别是食用方式影响的研究甚少。该研究采用体外全仿生消化方法对近江牡蛎和波纹巴非蛤进行处理,模拟2种贝类在人体消化道环境中的消化过程,对胃、肠消化过程中转运至仿生消化液中的微量金属进行测定,考察生、熟2种状态下贝类微量金属在提取液中提取量、生物可接受性的变化规律及特征,并进行微量元素摄入评估,以期为近江牡蛎和波纹巴非蛤的食用药用价值提供基础数据。
1. 材料与方法
1.1 材料与试剂
1.1.1 样品制备
2013年在广东省石栏洲海域、博贺湾、独湾海域、桂山岛海域4个主要贝类养殖区采集近江牡蛎106个,在柘林湾青屿、浮屿海域采集波纹巴非蛤贝类样品40个,采集的样品在现场用海水将外壳洗净后,冰冻保存带回实验室。在实验室取出贝类样品的软组织和体液,冻干至恒质量,用玛瑙研钵研磨后装于食品塑料袋内待用。
1.1.2 试验试剂
牛血清白蛋白(分析纯,广州威佳科技有限公司出品),黏液素(分析纯,广州鼎国公司出品),氯化钾、硫氰化钾、磷酸二氢钠、磷酸钠、氯化钠、氢氧化钠、尿素、a-淀粉酶、尿酸、氯化钙、氯化铵、氯化镁、碳酸氢钠、磷酸二氢钾、葡萄糖、葡萄糖醛酸、氨基葡萄糖盐酸盐、胃蛋白酶、胰液素、脂肪酶、胆汁(分析纯,上海晶纯生化科技股份有限公司出品)。
1.2 仪器与设备
试验过程使用的仪器设备主要有Milestone微波消解萃取系统(Ethos1)、智诚气浴恒温振荡器(ZHWY-2000)、Crist真空冷冻干燥机(ALPHA 1-4/Ldplue)、HITCH原子吸收分光光度计Z-2000。
1.3 方法
1.3.1 全仿生消化液的制备方法
试验所用唾液、胃液、肠液、胆汁等消化液的组成见表 1。参照LAIRD和CHAN[18]的方法,分别加入相应的无机物、有机物、消化酶,调节pH与4 ℃下保存备用。
表 1 唾液、胃液、十二指肠液、胆汁组成成分Table 1. Main components of saliva, gastric juice, duodenal juice and bile无机物inorganic matter 有机物organic matter 消化酶digestive enzyme pH 唾液sailiva 10 mL 189.6 g·L-1 KCl
10 mL 20 g·L-1 KSCN 10 mL 88.80 g·L-1 NaH2PO4
10 mL 57 g·L-1 Na3PO4
1.7 mL 175.3 g·L-1 NaCl
1.8 mL 40 g·L-1 NaOH8 mL 25 g·L-1尿素 145 mg α-淀粉酶
15 mg尿酸
50 mg粘液素6.5±0.2 胃液gastric juice 15.7mL 175.3 g·L-1 NaCl
3.0 mL 88.8 g·L-1 NaH2PO4
9.2 mL 89.6 g·L-1 KCl
18 mL 22.2 g·L-1 CaCl2
8.3 mL 37% HCl10 mL 65 g·L-1葡萄糖
10 mL 2 g·L-1葡萄糖醛酸
3.4 mL 25 g·L-1尿素
10 mL 33 g·L-1 氨基葡萄糖盐酸盐1 g牛血清蛋白
1 g胃蛋白酶
3 g脂肪酶1.07±0.07 十二指肠液
duodenal juice40 mL 175.3 g·L-1 NaCl
40 mL 84.7 g·L-1 NaHCO3
10 mL 8 g·L-1 KH2PO4
6.3 mL 89.6 g·L-1 KCl
10 mL 5 g·L-1 MgCl2
9 mL 22.2 g·L-1 CaCl2
0.18 mL 37% HCl4 mL 25 g·L-1尿素 1 g牛血清蛋白
3 g胰液素
0.5 g脂肪酶7.8±0.2 胆汁bile 30 mL 175.3 g·L-1 NaCl
68.3 mL 4.7 g·L-1 NaHCO3
4.2 mL 89.6 g·L-1 KCl
0.2 mL 37% HCl
10 mL 2.2 g·L-1 CaCl21 g牛血清蛋白
6 g胆汁8.0±0.2 注:用盐酸或碳酸氢钠溶液调pH,用超纯水定容至500 mL,在4 ℃下保存
Note: The pH values of all solutions were adjusted using HCl or NaHCO3 and the total volume of each digestion solution was diluted to 500 mL with ultrapure water before storage at 4 ℃.1.3.2 贝类全仿生消化方法
样品仿生消化具体步骤[18]为:称取贝类样品(生食样品)1.00 g,加入10 mL仿生唾液,在37 ℃恒温振荡5 min后加入150 mL仿生胃液,再于37 ℃恒温振荡2 h后取100 mL胃仿生消化食糜离心,得胃提取液待测;余下部分加入200 mL仿生十二指肠和80 mL仿生胆汁,恒温振荡8 h后取100 mL肠道仿生食糜离心,得肠提取液待测。熟食样品为制备好的贝类样品(生食样品)加入15 mL高纯水加热,沸腾10 min所得,仿生消化步骤同上。
1.3.3 贝类样品和提取液中重金属测定方法
取0.5 g贝类样品或30 mL仿生提取液(1.3.1制得),加入8 mL浓硝酸、1 mL双氧水微波消解后转移至烧杯加热,最终定容到10 mL的容量瓶,用原子吸收分光光度计分别测定贝类样品和仿生提取液中的Fe、Cu。样品平行双份,测定结果以平均值表示。
1.3.4 数据处理
$$ \;\;\;\;\;\;生物可接受性 (\%)=\\\frac{\text { 贝类消化液中金属质量分数 }\left(\mathrm{mg} \cdot \mathrm{kg}^{-1}\right)}{\text { 贝类样品中金属质量分数 }\left(\mathrm{mg} \cdot \mathrm{kg}^{-1}\right)} \times 100 $$ 居民日微量元素摄入量(mg · d-1)=每日膳食贝类摄入量(g)×贝类金属元素质量分数(mg · g-1)×生物可接受性;式中每日膳食贝类摄入量:男为19.4 g、女为17.7 g[19]。
2. 结果
2.1 贝类样品Fe、Cu总量
分析结果表明近江牡蛎和波纹巴非蛤均富含Fe元素,贝类样品近江牡蛎w(Fe)变化范围为0.97~1.83 mg · g-1,波纹巴非蛤w(Fe)的变化范围为0.96~1.24 mg · g-1,近江牡蛎w(Fe)平均值略大于波纹巴非蛤;与w(Fe)相比w(Cu)较低,2种贝类w(Cu)相差较大,近江牡蛎w(Cu)平均值为0.31 mg · g-1,而波纹巴非蛤w(Cu)平均值不及近江牡蛎的十分之一。
2.2 消化阶段提取液中Fe、Cu的变化
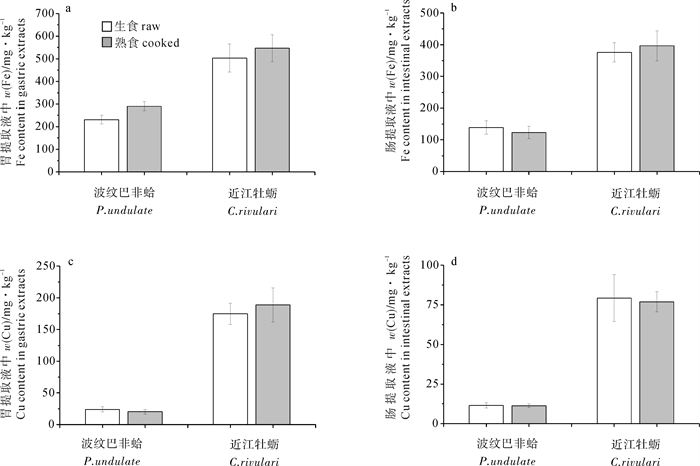
胃、肠仿生消化过程中(图 1-a,图 1-b),熟近江牡蛎仿生消化液中Fe的提取量比生的大。在胃仿生消化阶段,熟牡蛎提取液中Fe的提取量为547 mg · kg-1,而生牡蛎的只有503.5 mg ·kg-1。在肠仿生消化阶段,熟牡蛎提取液中Fe的提取量也比生牡蛎略高,是生牡蛎的1.05倍。熟牡蛎中Cu在胃肠消化阶段变化不一致,在胃消化阶段Cu的提取量比生牡蛎高,但是在肠消化阶段则比生牡蛎低,纵观整个仿生消化过程,熟牡蛎被仿生消化液提取出来的Cu比生牡蛎的高。
熟的波纹巴非蛤仿生消化过程中,Fe、Cu元素变化规律相同。胃仿生消化阶段(图 1-a,图 1-c),熟的波纹巴非蛤提取液中Fe、Cu提取量均比生波纹巴非蛤高;而在肠仿生消化阶段,熟波纹巴非蛤Fe、Cu提取量均比生波纹巴非蛤低,分别是生波纹巴非蛤提取量的88%和97%(图 1-b,图 1-d),Fe提取量降低幅度大于Cu。
胃是人类消化系统中主要消化场所,此试验也印证了这一点。不管是煮熟还是生食,近江牡蛎和波纹巴非蛤中的Fe、Cu在胃仿生消化中释放的量比肠消化阶段多,胃和肠提取液中Cu差别比较大。有研究表明生牡蛎中经胃消化阶段被提取的Cu可高达80%[20]。
2.3 生物可接受性
经过仿生消化后,熟近江牡蛎中的Fe、Cu生物可接受性比生近江牡蛎高,加热后近江牡蛎的Fe生物可接受性平均值增加7.3%,Cu生物可接受性平均值增加4.6%(表 2),消化液Fe、Cu提取量均比总量低,近江牡蛎组织中有超过13.8%~74.6%的Fe和3.3%~22.3%的Cu留在食物残渣中未进入人体消化循环。AMIARD等[21]研究发现生牡蛎经过胃肠仿生消化后,3%~39%的Cu留在食物残渣中。食用方式对波纹巴非蛤中2种元素的生物可接受性影响不一致,熟波纹巴非蛤中Fe的生物可接受性平均比生的高11.5%,Cu则低了11.5%,可见熟食方式提高了波纹巴非蛤Fe生物可接受性同时降低了Cu的生物可接受性。
表 2 近江牡蛎和波纹巴非蛤中铁、铜的生物可接受性Table 2. Bioaccessibility of Fe and Cu in C.rivulari and P.undulate% 元素
element近江牡蛎C.rivulari 波纹巴非蛤P.undulate 生牡蛎raw 熟牡蛎cooked 生蛤raw 熟蛤cooked 铁Fe 52.0±32.7 55.8±30.4 40.7±13.2 45.4±11.2 铜Cu 83.4±11.6 87.2±9.5 87.8±10.3 77.7±12.7 无论是那种食用方式,近江牡蛎和波纹巴非蛤Cu的生物可接受性都比Fe高,但是2种贝类的Fe总量均比Cu高,可见2种贝类中Fe、Cu生物可接受性与其总量高低并没有明显关系。JORGE等[22]对5种贝类的Fe、Cu生物可接受性进行测定,结果显示Cu生物可接受性均比Fe高。
2.4 评价
食用方式变化会改变人体消化系统对贝类Fe、Cu的利用率,文章采用近江牡蛎和波纹巴非蛤Fe、Cu仿生消化结果进行评价,考察2种贝类对人体Fe、Cu摄入量的贡献(表 3)。参照唐洪磊等[19]估算贝类摄入量,食用近江牡蛎和波纹巴非蛤所摄入的Fe和Cu均未超过中国居民DRIs委员会[23]推荐的每日适宜摄入量,食用近江牡蛎每日可为人体提供1.97~2.32 mg的Fe,占适宜摄入量的9.9%~15.5%,同时提供人体所需Cu的22.6%~25.9%,熟近江牡蛎提供Fe、Cu均比生牡蛎高。食用波纹巴非蛤摄入的Fe、Cu均比近江牡蛎少,每日可为人体提供1.27~1.56 mg的Fe和0.06~0.08 mg的Cu,最高可提供10.4% Fe(熟蛤)和3.9%(生蛤)摄入量。PAWELPOH等[24]研究多种蜂蜜对人体微量元素摄入贡献,发现日食用100 g蜂蜜最高可为人体提供11.1%~19.2%的Fe和6.0%~7.5%的Cu[适宜摄入量(AI,mg ·d-1)为Fe:11~14、Cu:2.0~2.5],近江牡蛎和波纹巴非蛤为人体提供Fe、Cu元素摄入量不同,食用方式不同也略有影响,但总体而言所提供的Fe、Cu相对比较高。
表 3 居民日微量元素摄入量Table 3. Daily consumption of Fe and Cu in shellfishmg · d-1 元素
element适宜摄入量
AI可耐受摄入量
UI近江牡蛎C.rivulari 波纹巴非蛤P.undulate 生牡蛎raw 熟牡蛎cooked 生蛤raw 熟蛤cooked 男 女 男 女 男 女 男 女 男 女 男 女 铁Fe 15 20 50 50 2.16 1.97 2.32 2.12 1.39 1.27 1.56 1.47 铜Cu 2.0 2.0 8.0 8.0 0.50 0.45 0.52 0.47 0.08 0.07 0.07 0.06 注:适宜摄入量和可耐受摄入量采用成年居民(≥18岁)推荐值
Note:Values of Al an Ul using adult (age≥18) recommended values of DRIs.3. 讨论
此试验模拟人体胃肠消化过程,加入全仿生消化液对样品进行处理,考察近江牡蛎和波纹巴非蛤中金属元素Fe、Cu转移进入消化液的情况。结果表明,近江牡蛎和波纹巴非蛤样品中Fe、Cu进入到消化液中的量均小于其总量,其中Fe仅约50%转运到消化液中。FANNY等[25]研究智利贻贝(Mytilus chilensis)表明,无论是生贝还是熟贝,仿生消化液中镉(Cd)的提取量都比样品本身Cd总量低,同为金属元素的Fe、Cu也有相同表现。食物在消化道中的消化方式影响其金属元素被人体吸收利用的程度,消化是金属元素伴随营养物质进入人体、被吸收利用的重要途径,选用适宜、科学的消化方法是合理评估的基础。
煮熟的近江牡蛎中Fe、Cu的生物可接受性均有提高,而煮熟的波纹巴非蛤中Fe的生物可接受性提高的同时,Cu的生物可接受性却降低。METIAN等[26]研究紫贻贝(M.galloprovincialis)仿生消化也发现,煮熟后紫贻贝锰(Mn)、镅(Am)的生物可接受性提高,但Cd、钴(Co)、锌(Zn)等的生物可接受性却降低。贝类的不同食用方式可能引起其食糜在人体消化环境中消化过程的改变,不同元素受到的影响不一致,Fe、Cu生物可利用性发生不同程度改变,这种改变可能影响到近江牡蛎和波纹巴非蛤中Fe、Cu在人体中的吸收和利用,改变可能进入人体循环系统Fe、Cu的量。总体看2种试验贝类熟食比生食能为人体提供更多的Fe摄入量。
贝类品种的差异影响金属配合物的配体组成,近江牡蛎和波纹巴非蛤经过仿生消化后,形成了不同的仿生食糜成分,且仿生食糜基体成分复杂,食糜提取液中金属元素结合态、形态、结构态等存在差异,相同金属元素的不同形态分布可能影响其生物可接受性,而不同金属元素也可能由配位能力的因素,导致生物可接受性的不同。
近江牡蛎和波纹巴非蛤中Fe、Cu生物可接受性大小与其总量高低并没有明显的关系,且消化液提取量均比总量低。以往评估贝类样品为人体提供的微量元素摄入时,多数采用总量进行评估,结果可能导致摄入量被高估或是低估,考虑到实际食物进入人体消化系统并不是完全被消化吸收,此试验选择更加符合人体消化方式的全仿生消化方法处理样品,在进行评估的时候加入生物可接受性参数,结果可能更为科学有效。
-
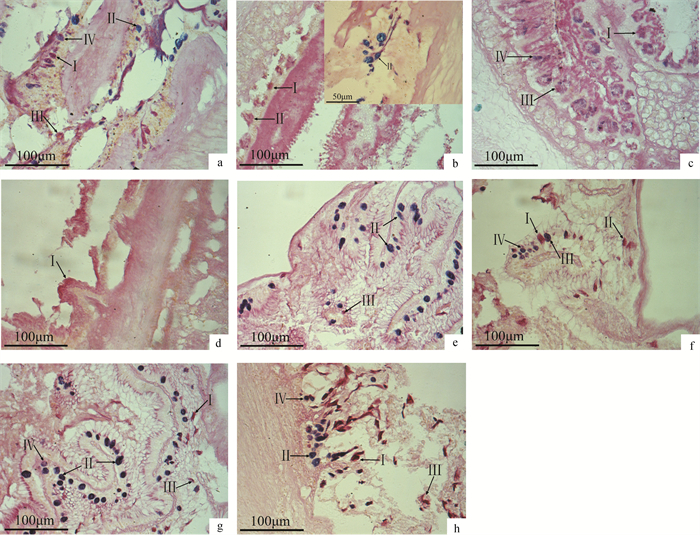
图 1 青龙斑消化道粘液细胞的显微观察(AB-PAS染色)
a. 食道(×200);b. 贲门胃(×200);c. 胃体(×200);d. 幽门胃(×200);e. 幽门盲囊(×200);f. 前肠(×200);g. 中肠(×200);h. 后肠(×200);Ⅰ. Ⅰ型粘液细胞;Ⅱ. Ⅱ型粘液细胞;Ⅲ. Ⅲ型粘液细胞;Ⅳ. Ⅳ型粘液细胞
Fig. 1 Light microscopical observation of mucous cells in digestive tract of Qinglong grouper (AB-PAS staining)图 2 青龙斑消化道Gas细胞的定位(SABC)
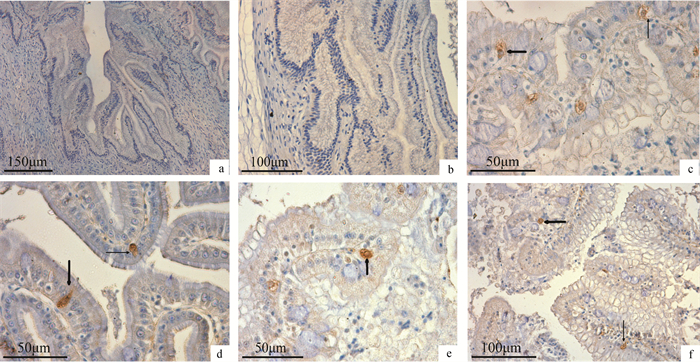
a. 胃体部阴性反应(×100);b. 幽门部阴性反应(×200);c. 幽门盲囊Gas细胞(×400);d. 前肠Gas细胞(×400);e. 中肠Gas细胞(×400);f. 后肠Gas细胞(×400)
Figure 2. Location of Gas cells in digestive tract of Qinglong grouper
a. negative reaction in fundic stomach (×100);b. negative reaction in pyloric stomach (×200);c. Gas cells in pyloric caeca (×400);d. Gas cells in foregut (×400);e. Gas cells in midgut (×400);f. Gas cells in hindgut (×400)
表 1 青龙斑消化道粘液细胞的类型和密度
Table 1 Type and destiny of mucous cells in intestine of Qinglong grouper
粘液细胞类型
type of mucous cells食道
esophagus贲门部
cardiac stomach胃体部
fundic stomach幽门部
pyloric stomach幽门盲囊
pyloric caeca前肠
foregut中肠
midgut后肠
hindgutⅠ ++ +++ +++ + - + +++ +++ Ⅱ + + - - +++ + +++ ++ Ⅲ + + + - + + + + Ⅳ + - ++ - - + + + 注:-. 阴性反应;+. 粘液细胞数量<10个· mm-2;+ +. 粘液细胞数量10~30个· mm-2;+ + +. 粘液细胞数量>30个· mm-2
Note:-. negative reaction;+. mucus cell numbers (<10 cell · mm-2);+ +. mucus cell numbers (10~30 cell · mm-2);+ + +. mucus cell numbers (> 30 cell · mm-2) -
[1] 麦贤杰, 黄伟健, 叶富良, 等. 海水鱼类繁殖生物学和人工繁育[M]. 北京: 海洋出版社, 2005: 166-167. [2] TAKESHITA A, SOYANO K. Effects of fish size and size-grading on cannibalistic mortality in hatchery-reared orange-spotted grouper Epinephelus coioides juveniles[J]. Fish Sci, 2009, 75(5): 1253-1258. doi: 10.1007/s12562-009-0135-8
[3] TEW K S, MENG P J, LIN H S, et al. Experimental evaluation of inorganic fertilization in larval giant grouper (Epinephelus lanceolatus Bloch) production[J]. Aquac Res, 2011, 44(3): 439-450. doi: 10.1111/j.1365-2109.2011.03051.x
[4] HEEMTRA P C, RANDALL J E. Groupers of the world[J]. FAO Fish Synopsis, 1993, 16(125): 130-132. https://www.fao.org/4/t0540e/t0540e00.htm
[5] LIU M, de MITCHESSO Y S. The influence of social factors on juvenile sexual differentiation in a diandric, protogynous grouper Epinephelus coioides[J]. Ichthyological Res, 2011, 58(1): 84-89. doi: 10.1007/s10228-010-0187-x
[6] 吕国敏, 黄小林, 李涛, 等. 青龙斑高位池人工育苗技术研究[J]. 江苏农业科学, 2013, 41(11): 149-251. doi: 10.3969/j.issn.1002-1302.2013.11.056 [7] 黄小林, 吕国敏, 刘付永忠, 等. 30日龄青龙斑形态性状对体质量影响的通径分析[J]. 广东农业科学, 2012, 39(21): 139-143. doi: 10.3969/j.issn.1004-874X.2012.21.044 [8] 吴水清, 李加儿, 区又君, 等. 斜带石斑鱼(♀)×鞍带石斑鱼(♂)杂交子一代仔、稚鱼的异速生长[J]. 中国水产科学, 2014, 21(3): 503-510. https://www.cnki.com.cn/Article/CJFDTotal-ZSCK201403009.htm [9] KIRIYAKIT A, GALLARDO W G, BART A N. Successful hybridization of groupers (Epinephelus coioides×Epinephelus lanceolatus) using cryopreserved sperm[J]. Aquaculture, 2011, 320(1/2): 106-112. https://www.sciencedirect.com/science/article/pii/S0044848611003899
[10] FACCIOLI C K, CHEDID R A, AMARAL A C, et al. Morphology and histochemistry of the digestive tract in carnivorous freshwater Hemisorubim platyrhynchos (Siluriformes: Pimelodidae)[J]. Micron, 2014, 64: 10-19. doi: 10.1016/j.micron.2014.03.011
[11] NVENKAT A R, RITESH K S. Distribution of Gastrin immune reactive cells in the alimentary canal of a stomachless hill stream loach, Lepidocephalus guntea (Hamilton): an immuno-iistochemical study[J]. Proc Indian Natl Sci Acad B Biol Sci, 2013, 83(4): 603-607. doi: 10.1007/s40011-013-0163-0
[12] 安利国, 王钦东. 鲤稚幼鱼早期发育过程中粘液细胞的发生和变化[J]. 水生生物学报, 2001, 25(2): 191-194. doi: 10.3321/j.issn:1000-3207.2001.02.014 [13] 区又君, 李加儿, 勾效伟. 卵形鲳鲹消化道的形态学、组织学和组织化学[J]. 大连海洋大学学报, 2012, 27(1): 38-43. doi: 10.3969/j.issn.1000-9957.2012.01.008 [14] 杨桂文, 安利国. 鱼类粘液细胞研究进展[J]. 水产科学, 1999, 23(4): 403-408. https://www.cnki.com.cn/Article/CJFDTotal-SCKX199904013.htm [15] 王永翠, 李加儿, 区又君, 等. 野生与养殖黄鳍鲷消化道中粘液细胞的类型及分布[J]. 南方水产科学, 2012, 8(5): 46-51. doi: 10.3969/j.issn.2095-0780.2012.05.007 [16] 张伟妮, 林旋, 林树根, 等. 褐牙鲆消化道粘液细胞的类型及分布[J]. 福建农林大学学报: 自然科学版, 2009, 38(3): 280-284. [17] 辛俭, 薛宝贵, 楼宝, 等. 黄姑鱼消化道粘液细胞的类型和分布[J]. 浙江海洋学院学报: 自然科学版, 2013, 32(1): 10-14. doi: 10.3969/j.issn.1008-830X.2013.01.003 [18] 石戈, 王健鑫, 刘雪珠, 等. 褐菖鲉消化道的组织学和组织化学[J]. 水产学报, 2007, 31(3): 293-302. doi: 10.3321/j.issn:1000-0615.2007.03.004 [19] ZDRAVKO P, SREBRENKA N, SNJEZANA K, et al. Mucosubstances of the digestive tract mucosa in northern pike (Esox lucius L.) and european catfish (Silurus glanis L.)[J]. Veterinarski Arhiv, 2005, 75(4): 317-327. https://www.researchgate.net/publication/279694435_Mucosubstances_of_the_digestive_tract_mucosa_in_northern_pike_Esox_lucius_L_and_European_catfish_Silurus_glanis_L
[20] MURRAY H M, WRIGHT G M, GOFF G P. A comparative histological and histochemical study of the post-gastric alimentary canal from three species of pleuronectid, the Atlantic halibut, the yellowtail flounder and the winter flounder[J]. J Fish Biol, 1996, 48(2): 187-206. doi: 10.1111/j.1095-8649.1996.tb01112.x
[21] 勾效伟, 区又君, 廖锐. 平鲷消化系统形态学、组织学及组织化学研究[J]. 南方水产, 2008, 4(5): 28-36. doi: 10.3969/j.issn.2095-0780.2008.05.005 [22] 区又君, 李加儿, 勾效伟, 等. 黄斑篮子鱼消化道组织学和组织化学研究[J]. 南方水产科学, 2013, 9(5): 51-57. doi: 10.3969/j.issn.2095-0780.2013.05.009 [23] 谢湘筠, 林淑慧, 林树根. 花鲈消化道粘液细胞的类型及分布[J] 福建农业学报, 2007, 22(3): 271-275. doi: 10.3969/j.issn.1008-0384.2007.03.011 [24] 张金花, 王树迎. 鱼类胃肠道内分泌细胞的研究进展[J]. 水产科学, 2002, 21(3): 37-39. doi: 10.3969/j.issn.1003-1111.2002.03.015 [25] KUROKAWA T, SUZUKI T, HSASHMOTO H. Identification of gastrin and multiple cholesystokinin genes in teleost[J]. Peptides, 2003, 24(2): 227-235. doi: 10.1016/S0196-9781(03)00034-2
[26] BOSI G, GIANCAMILLO A D, ARRIGHI S, et al. An immunohistochemical study on the neuroendocrine system in the alimentary canal of the brown trout, Salmo trutta, L., 1758[J]. Gen Comp Endocrinol, 2004, 138(2): 166-181. doi: 10.1016/j.ygcen.2004.06.003
[27] CERDA-REVERTER J M, MARTINEZ-RODRIGUEZ G, ZANUY S, et al. Cloning the neuropeptide Y Exon 2 from sea bass (Dicentrarchus labrax)[J]. Comp Biochem Physiol, 1999, 123(2): 181-186. doi: 10.1016/S0305-0491(99)00055-3
[28] KU S, LEE H, HOH J, et al. An immunohistochemical study on the neuropeptide-producing endocrine cells in the alimentary tract of wrinkled frog, Rana rugosa (Ranidae)[J]. Gen Comp Endocrinol, 2003, 131(1): 1-8. doi: 10.1016/S0016-6480(02)00642-1
[29] 杨青, 叶海辉, 黄辉洋, 等. 黄鳍鲷消化道内分泌细胞的免疫组化定位[J]. 海洋通报, 2005, 24(4): 87-90. doi: 10.3969/j.issn.1001-6392.2005.04.014 [30] 韩师昭, 叶海辉, 黄辉洋, 等. 大弹涂鱼消化道内分泌细胞的免疫组织化学研究[J]. 厦门大学学报: 自然科学版, 2005, 44(3): 407-409. doi: 10.3321/j.issn:0438-0479.2005.03.030 [31] BERMUDEZ R, VIGLIANO F, QUIROGA M I, et al. Immunohistochemical study on the neuroendocrine system of the digestive tract of turbot, Scophthalmus maximus (L.), infected by Enteromyxum scophthalmi (Myxozoa)[J]. Fish Shellfish Immun, 2007, 22(3): 252-263. doi: 10.1016/j.fsi.2006.05.006
[32] VIGLIANO F A, MUNOZ L, HERNANDEZ D, et al. An immunohistochemical study of the gut neuroendocrine system in juvenile pejerrey Odontesthes bonariensis (Valenciennes)[J]. J Fish Biol, 2011, 78(3): 901-911. doi: 10.1111/j.1095-8649.2011.02912.x
[33] VIGNA S R. Evolution of the cholecystokinin and gastrin peptides and receptors[J]. Amer Zool, 2000, 40(2): 287-295. https://academic.oup.com/icb/article/40/2/287/419692
[34] HERNANDEZD D R, VIGLIANO F A, SANCHEZ S, et al. Neuroendocrine system of the digestive tract in Rhamdia quelen juvenile: an immunohistochemical study[J]. Tissue Cell, 2012, 44(4): 220-226. doi: 10.1016/j.tice.2012.03.005
[35] 方永强, 翁幼竹, 胡晓霞, 等. 鲻鱼胃肠道内分泌细胞免疫组织化学的定位[J]. 水产学报, 2002, 26(6): 481-485. doi: 10.3321/j.issn:1000-0615.2002.06.001 [36] 林树根, 杨志峰, 王寿昆. 黑鲷消化道内分泌细胞免疫组织化学的定位[J]. 福建农林大学学报: 自然科学版, 2006, 35(1): 77-81. doi: 10.3321/j.issn:1671-5470.2006.01.018 [37] 刘志刚, 翁幼竹, 宋海霞, 等. 5种胃肠激素样内分泌细胞在斜带石斑鱼稚鱼期消化道中的定位[J]. 中国水产科学, 2009, 16(2): 199-205. doi: 10.3321/j.issn:1005-8737.2009.02.007 [38] 韩师昭, 朱艾嘉, 叶海辉, 等. 五种海洋鱼类消化道G细胞的定位[J]. 海洋科学, 2008, 32(1): 52-55. https://www.cnki.com.cn/Article/CJFDTotal-HYKX200801012.htm [39] 章龙珍, 杨金海, 庄平, 等. 长鳍篮子鱼消化道内分泌细胞的免疫组织化学鉴别和定位[J]. 海洋渔业, 2012, 34(1): 39-44. doi: 10.3969/j.issn.1004-2490.2012.01.006 [40] 潘黔生, 方之平. 鱼类胃肠胰内分泌系统APUD细胞研究的现状[J]. 水生生物学报, 1995, 19(3): 275-282. doi: 10.3321/j.issn:1000-3207.1995.03.001 -
期刊类型引用(1)
1. 旷泽行,汪慧娟,谷阳光,齐占会,黄洪辉. 海南岛昌化江河口海域生物体重金属富集特征与概率健康风险评价. 海洋环境科学. 2021(05): 699-706 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
