Analysis of daily weight gain and GH mRNA expression in juvenile Clarias gariepinu reared at different stocking densities
-
摘要:
革胡子鲶(Clarias gariepinus)幼鱼在35 kg · m-3、65 kg · m-3、95 kg · m-3和125 kg · m-3的密度下养殖60 d,第30和第60天时分析鱼的日增质量并应用半定量RT-PCR法分析垂体生长激素(GH)基因mRNA的相对表达量。0~30 d养殖期内,35 kg · m-3和65 kg · m-3密度组间及95 kg · m-3和125 kg · m-3密度组间的鱼日增质量差异不显著,但前2个密度组的鱼日增质量显著高于后2个密度组;而养殖第30天时各养殖密度组间GH基因mRNA相对表达量差异均不显著。30~60 d养殖期内,35 kg · m-3和65 kg · m-3密度组的日增质量显著高于125 kg · m-3密度组,但其余各密度组间差异不显著;养殖第60天时,35 kg · m-3和65 kg · m-3密度组GH基因mRNA相对表达量显著高于95 kg · m-3和125 kg · m-3密度组。结果表明革胡子鲶幼鱼的日增质量与垂体GH基因mRNA相对表达量不存在紧密的相关性。
Abstract:Juvenile Clarias gariepinus were reared at densities of 35 kg · m-3, 65 kg · m-3, 95 kg · m-3 and 125 kg · m-3 for 60 d. On 30th and 60th day, we measured the daily weight gain (DWG) and assayed the mRNA level of GH in pituitary by semi-quantitative RT-PCR. During 0~30 d breeding, the DWGs showed no significant difference between 35 kg · m-3 and 65 kg m-3 treatments as well as between 95 kg · m-3 and 125 kg m-3 treatments, but the DWGs were significantly higher at 35 kg · m-3 and 65 kg · m-3 treatments than those at 95 kg · m-3 and 125 kg · m-3 treatments. While on 30th day, significant difference was not found in the GH mRNA level of pituitary between any two stocking densities. During 30~60 d breeding, the DWGs of 35 kg · m-3 and 65 kg · m-3 treatments were significantly higher than that of 125 kg · m-3 treatment, there was no significant difference in DWG between the other two treatments. On 60th day, the expressions of GH gene were significantly higher in 35 kg · m-3 and 65 kg · m-3 treatments than those in 95 kg · m-3 and 125 kg · m-3 treatments. The results indicate that there was no close correlation between DWG and mRNA level of GH in pituitary of juvenile C.gariepinus.
-
Keywords:
- Clarias gariepinus /
- daily weight gain /
- growth hormone /
- semi-quantitative RT-PCR
-
硬骨鱼类的生长主要受生长轴,即生长激素(GH)/胰岛素样生长因子(IGF)的调控,GH为脑垂体分泌的单链肽类激素,通过生长激素受体(GHR)刺激肝脏等组织分泌IGF,进而发生生物学效应。GH居于生长轴的中心位置,在鱼类的个体生长中起关键性作用[1]。研究表明鱼类垂体GH基因的转录和转译水平受性别[2-5]、季节和生理状态[4-7]及外界理化因子[8-10]等因素的影响,且研究结果显示在一定条件下垂体GH基因转录或转译水平高的鱼类其生长速度也快。因此,GH成为研究鱼类生长性能的重要指标。
高密度养殖是提高单位面积产量、实现更大经济效益的有效手段,但不可避免地影响养殖对象的生长速度和健康。而革胡子鲶(Clarias gariepinus)比其他养殖鱼类对高密度养殖的适应性强[11-16]。天津市德仁农业发展有限公司设施化养殖的革胡子鲶,在高密度下仍然能够快速生长(最高产量可达400 kg · m-3水体),推测与其内在的生长调控因子有关。文章通过分析不同养殖密度下革胡子鲶幼鱼的日增质量和垂体GH基因mRNA的表达水平,初步探讨革胡子鲶幼鱼在不同养殖密度下生长差异和生长差异的内在原因,以期为深入探究革胡子鲶的生长调节以及高密度养殖快速生长的机理奠定基础。
1. 材料与方法
1.1 试验材料
试验用鱼为天津市德仁农业发展有限公司从福建漳州购进约1.5 g的革胡子鲶饲养而成,选取大小规格相近的幼鱼为试验对象,平均体质量为10~12 g。
1.2 养殖试验
试验分组及饲养管理同DAI等[17]。即试验用革胡子鲶幼鱼取回后在天津农学院天津市水产生态及养殖重点实验室于水族箱(70 cm×50 cm×50 cm)中暂养2周后,选取发育良好、体质健康的个体[平均体质量为(30.71±0.89)g]用于该试验。试验鱼随机分为35 kg · m-3、65 kg · m-3、95 kg ·m-3和125 kg · m-3 4个密度组,每组3个重复,饲养于水族箱(70 cm×50 cm×50 cm)中,实际水体积为120 L。模拟天津市德仁农业发展有限公司水泥池饲养革胡子鲶幼鱼的实际养殖条件,每日10: 00和18: 00各换水一次,每次换水量为水体积的3/4;养殖水温保持在(27±1)℃。按体质量的2%每天8: 00和16: 00各投喂一次,所用饲料为天津市天祥水产有限公司生产的鲶鱼膨化配合饲料(粗蛋白35%、粗脂肪5%、粗纤维10%、灰分10%)。养殖试验为期60 d,试验期间水体积保持不变,每30 d取样一次。每天观察并记录鱼的摄食及死亡情况。
1.3 相关指标分析方法
1.3.1 革胡子鲶生长的测定
分别于第30和第60天各分析一次。分析时停饲24 h,并以200 mg · L-1的MS-222麻醉,以水族箱为单位称量鱼体的总质量,同时计数鱼体数量,根据下列公式计算鱼的均质量和日增质量:
鱼的均质量=试验结束时每箱鱼总质量(g)/鱼的数量(尾)
日增质量=[试验结束时鱼的均质量(g · 尾-1)-试验开始时鱼的均质量(g · 尾-1)]/养殖天数
1.3.2 GH基因mRNA表达的半定量分析
养殖第30和第60天时,每个养殖密度各取经MS-222麻醉的鱼18尾(每个水族箱取鱼6尾),解剖取出垂体后立即放入液氮中,之后于-80 ℃保存备用。以β-肌动蛋白基因作为内参基因分析垂体GH基因mRNA的相对表达量。试验中以个体为单位,根据王晓梅等[18]报道的方法进行垂体总RNA的提取、cDNA第一条链的合成、GH基因ORF区段和β-肌动蛋白基因片段的扩增以及GH基因mRNA相对表达量分析。
1.3.3 数据统计分析
试验数据以“平均值±标准差”(X+SD)表示,数据采用SPSS 11.5统计软件进行单因素方差分析(One-Way ANOVA),LSD法多重比较各组间数值的差异显著性(P<0.05)。
2. 结果
2.1 生长分析
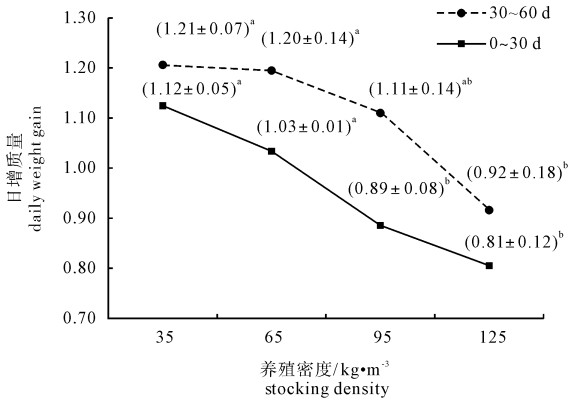
根据革胡子鲶在不同密度养殖30 d和60 d后体质量(表 1)计算鱼体在0~30 d以及30~60 d 2个养殖期的日增质量。结果表明,试验期间随着养殖密度的增大出现日增质量降低的趋势(图 1),统计分析结果显示,在0~30 d的养殖期间,35 kg ·m-3和65 kg · m-3密度组的日增质量差异不显著(P>0.05),95 kg · m-3和125 kg · m-3密度组的日增质量差异也不显著(P>0.05);但35 kg · m-3和65 kg · m-3密度组的日增质量显著高于95 kg · m-3和125 kg · m-3密度组(P<0.05);养殖30~60 d期间,35 kg · m-3和65 kg · m-3密度组的日增质量显著高于125 kg · m-3密度组(P<0.05),而其余各密度组间的日增质量差异均不显著(P>0.05)。
表 1 养殖密度对革胡子鲶体质量的影响Table 1. Effect of stocking density on body weight of juvenile C.gariepinus指标index 养殖密度/ kg·m-3 stocking density 35 65 95 125 初始体质量/g initial body weight 31.01±0.47 29.77±0.32 30.82±1.17 31.22±0.90 第30天体质量/g body weight on 30th day 64.75±1.21a 60.79±0.43ab 57.40±3.38bc 55.38±2.83c 第60天体质重/g body weight on 60th day 100.94±3.42a 96.64±3.84a 90.70±1.19b 82.87±2.71c 死亡率/% mortality 3.69±0.76a 3.68±1.13a 5.13±0.36b 5.40±0.43b 注:部分数据引自文献[17]。同一行肩标字母相同或无肩标字母者表示差异不显著(P>0.05),肩标字母不同者表示差异显著(P<0.05)
Note:Some data in this table are taken from Reference [17].Values with the same letters or no letter within the same row are not significantly different (P>0.05);whereas those with different letters are significantly different (P<0.05).![]() 图 1 不同养殖密度革胡子鲶日增质量同一线上肩标字母不同者为差异显著(P<0.05),肩标字母相同者为差异不显著(P>0.05)Figure 1. Daily weight gain of C.gariepinus reared at different stocking densitiesValues with different superscripts on the same lines are significantly different (P < 0.05), while those with the same superscripts are not significantly different (P > 0.05).
图 1 不同养殖密度革胡子鲶日增质量同一线上肩标字母不同者为差异显著(P<0.05),肩标字母相同者为差异不显著(P>0.05)Figure 1. Daily weight gain of C.gariepinus reared at different stocking densitiesValues with different superscripts on the same lines are significantly different (P < 0.05), while those with the same superscripts are not significantly different (P > 0.05).2.2 GH基因mRNA表达的半定量RT-PCR分析
2.2.1 总RNA分离结果
经1%琼脂糖凝胶电泳检测表明提取的革胡子鲶脑垂体总RNA完整性较好(图 2显示了4个RNA样本的电泳结果)。用核酸蛋白测定仪(德国Eppendorf公司出品,BioPhotometer型)测定出每个RNA样本光密度比(OD260/OD280)为1.80~2.00,表明总RNA纯度较好,RNA样本可以用于后续的试验。
2.2.2 PCR扩增产物电泳检测结果
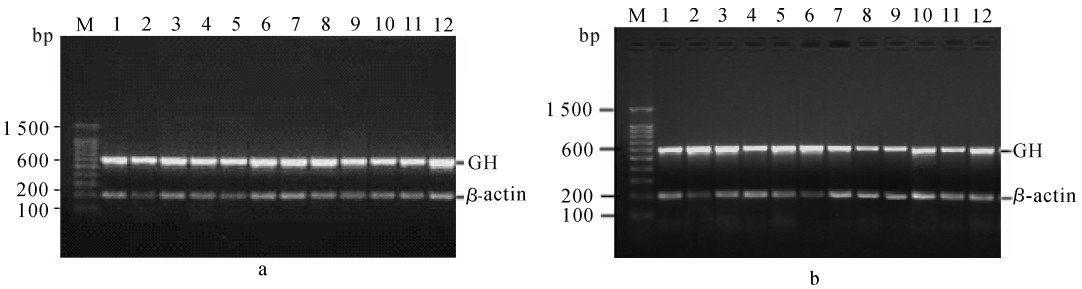
图 3-a和图 3-b分别为养殖第30和第60天时革胡子鲶部分个体GH和β-actin基因片段扩增后的电泳检测结果。
![]() 图 3 养殖第30天(a)和第60天时(b)革胡子鲶个体GH和β-actin基因片段PCR产物电泳图泳道1~3、4~6、7~8和9~12分别为养殖密度35 kg · m-3、65 kg · m-3、95 kg · m-3和125 kg · m-3的各3个体GH和β-actin基因片段RCR产物电泳图,泳道M为DNA标准分子量(BBI公司)Figure 3. Electrophoretic patterns of PCR products of GH and β-actin gene fragments of individuals on 30th (a) and 60th day nursing(b)Lanes 1~3, 4~6, 7~8 and 9~12 are electrophoretic patterns of PCR products of GH and β-actin gene fragments separately on three individuals at stocking densities of 35 kg · m-3, 65 kg · m-3, 95 kg · m-3 and 125 kg · m-3, respectively; Lane M is DNA Marker (BBI Company)
图 3 养殖第30天(a)和第60天时(b)革胡子鲶个体GH和β-actin基因片段PCR产物电泳图泳道1~3、4~6、7~8和9~12分别为养殖密度35 kg · m-3、65 kg · m-3、95 kg · m-3和125 kg · m-3的各3个体GH和β-actin基因片段RCR产物电泳图,泳道M为DNA标准分子量(BBI公司)Figure 3. Electrophoretic patterns of PCR products of GH and β-actin gene fragments of individuals on 30th (a) and 60th day nursing(b)Lanes 1~3, 4~6, 7~8 and 9~12 are electrophoretic patterns of PCR products of GH and β-actin gene fragments separately on three individuals at stocking densities of 35 kg · m-3, 65 kg · m-3, 95 kg · m-3 and 125 kg · m-3, respectively; Lane M is DNA Marker (BBI Company)2.2.3 GH mRNA表达半定量PCR分析的数据统计
利用GeneTools软件分析革胡子鲶个体GH(目标基因)和β-actin(内参基因)基因片段扩增后的电泳图谱,GH与β-actin基因片段扩增产物的信号强度比即为GH基因的相对表达量。
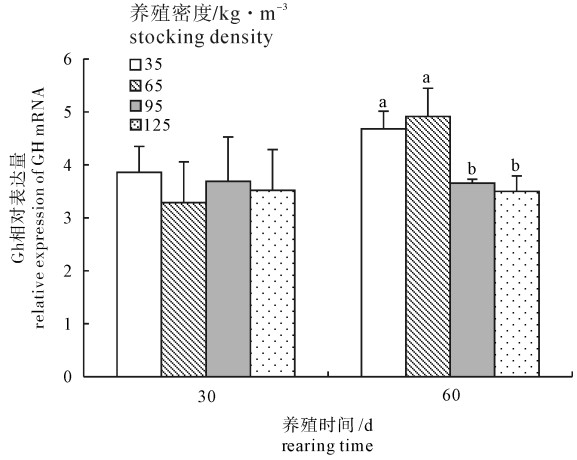
图 4为养殖第30和第60天时不同养殖密度下革胡子鲶GH基因mRNA平均相对表达量的统计分析结果。养殖第30天时,各养殖密度间革胡子鲶GH基因mRNA相对表达量差异均不显著(P>0.05);养殖第60天时,革胡子鲶GH基因mRNA相对表达量在35 kg · m-3和65 kg · m-3密度组间差异不显著(P>0.05),95 kg · m-3和125 kg · m-3密度组间差异也不显著(P>0.05),但35 kg · m-3和65 kg · m-3密度组GH基因mRNA的相对表达量显著高于95 kg · m-3和125 kg · m-3密度组(P<0.05)。
![]() 图 4 不同养殖密度革胡子鲶GH基因mRNA的相对表达量标有不同字母者为差异显著(P<0.05),无字母或字母相同者为差异不显著(P>0.05)Figure 4. Relative expression of GH mRNA in pituitary of C.gariepinus reared at different densitiesDifferent letters above the bar indicate significant difference (P < 0.05);while the same letters or no letter above the bar indicate no significant difference (P > 0.05)
图 4 不同养殖密度革胡子鲶GH基因mRNA的相对表达量标有不同字母者为差异显著(P<0.05),无字母或字母相同者为差异不显著(P>0.05)Figure 4. Relative expression of GH mRNA in pituitary of C.gariepinus reared at different densitiesDifferent letters above the bar indicate significant difference (P < 0.05);while the same letters or no letter above the bar indicate no significant difference (P > 0.05)3. 讨论
鱼体的生长状况是水产养殖中备受关注的重要经济性状,而GH与鱼类的生长密切相关,在鱼类的个体生长及生长调节中起关键性作用。马细兰等[2]指出垂体GH基因在转录水平上反映GH的合成速度,是反映动物生长速度的有效指标,生长快速的鱼其垂体GH mRNA表达量高;并且应用半定量RT-PCR法分析得出尼罗罗非鱼(Oreochromis niloticus)雄鱼垂体GH mRNA表达水平明显高于雌鱼,认为这可能是尼罗罗非鱼雄鱼生长快于雌鱼的主要内在原因之一。性成熟的金钱鱼(Scatophagus argus)雌鱼生长快于雄鱼,其生长差异与垂体GH mRNA的水平也呈显著的正相关[3]。同样,生长快速的雌性黄鲈(Perca flavescens)垂体GH mRNA水平显著高于雄鱼,并且在生长快速的春季显著高于秋季[4]。性成熟的鲤(Cyprinus carpio)垂体GH mRNA表达也呈现出季节性的周期变化,生长较快的季节(水温18~20 ℃)垂体GH mRNA表达比生长相对较慢的季节(水温8~10 ℃)高3倍[6]。鲇形目鳠科的大鳍鳠(Mystus macropterus)脑垂体GH的含量分别在3月和8月出现峰值,与该鱼春季和秋季的快速生长一致[7]。该目鲇科的野生鲇(Silurus asotus)垂体GH的含量在3月和7月各出现一个高峰值,研究者认为这可能与野生鲇春季和产卵后生长加快有关;并且雌性鲇鱼垂体GH的周年含量显著高于雄鱼,与雌鱼生长速度显著快于雄鱼的现象相符合[5]。SHIN等[8]研究发现光的波长可影响观赏性鱼类——克氏双带锯齿盖鱼(Amphiprion clarkii)的生长速度和垂体GH mRNA水平、生长速率与垂体GH mRNA的水平呈正相关。李云等[9]研究显示饲料中添加一定量的半胱胺盐酸盐(1 mg · g-1饲料)可显著提高斜带石斑鱼(Epinephelus coioides)的体质量增长率和垂体GH的转录水平。马细兰等[10]发现促黄体素释放激素类似物(LHRH-A)可显著上调尼罗罗非鱼生长轴相关基因(GH、GHR和IGF)的表达,从而促进鱼类的生长。上述研究说明鱼体的生长速度与垂体GH基因的转录水平呈正相关。
由于脑垂体合成GH后经过血液运送至靶器官,再通过GHR和IGF的介导进而达到促进鱼体生长的作用,因此鱼类的生长速度并不能完全通过GH水平来体现,还与GHR和IGF的水平有关。如银大麻哈鱼(Oncorhynchus kisutch)在禁食3周后,比正常投喂组肝脏GHR mRNA水平低,提示长时间禁食可引起肝脏GHR基因表达的下降[19]。SAERA-VILA等[20]报道金鲷(Sparus aurata)肝脏和脂肪组织GHRⅠ基因表达最丰富,但禁食后可引起GHRⅠmRNA水平的下降。斑点叉尾(Ictalurus punctatus)在投喂外源皮质醇或者禁食4周后,与对照组相比,肝脏GHR mRNA的丰度以及血清中IGF的浓度均显著下降,且肝脏GHR mRNA的丰度和血清中IGF的浓度呈正相关;投喂外源皮质醇后鱼的生长显著下降,禁食组鱼的体质量减少[21]。华益民和林浩然[22]报道鲤饥饿32 d导致生长受阻,肝组织IGF-ⅠmRNA表达水平下降;再投喂后,其生长和肝组织IGF-ⅠmRNA丰度都逐渐恢复,表现出鲤的生长状况与肝组织IGF-ⅠmRNA水平的同步变化。尼罗罗非鱼饥饿28 d内血清GH含量反倒显著升高,而血清IGF含量和肝胰脏IGF mRNA表达丰度显著下降,饥饿后再投喂,第14天时血清GH含量显著升高,继续投喂7 d血清GH含量又表现出显著下降,但仍与饥饿第7天时的GH水平相当,而血清IGF含量和肝胰脏IGF mRNA表达丰度在第21天恢复投喂过程中显著升高,并恢复到饥饿前水平[23]。鲮(Cirrhinus molitorella)在投喂不同蛋白水平的饲料时,在8周的养殖期内其特定生长率与肝组织IGF mRNA的表达量呈极显著的正相关[24]。但强俊等[25]在分析温度和饲料蛋白水平对吉富品系尼罗罗非鱼幼鱼生长的影响时则发现血清GH水平与鱼的特定生长率相关性较低。黄国强等[26]研究也发现褐牙鲆(Paralichthys olivaceus)幼鱼在低温胁迫10 d导致的生长减缓能在恢复至最适生长温度的30 d内获得完全补偿生长,但血浆GH和IGF水平与生长率不存在明显的相关性。
该研究通过分析不同养殖密度下革胡子鲶幼鱼的生长以及垂体GH基因的表达,探讨养殖密度对二者的影响以及二者的相关性。该研究的数据统计分析结果显示,0~30 d养殖期内,35 kg · m-3和65 kg · m-3密度组间的日增质量以及95 kg · m-3和125 kg · m-3密度组间的日增质量差异均不显著,但前2个密度组的日增质量显著高于后2个密度组(图 1)。但养殖第30天时各密度组间GH基因mRNA的相对表达量并未受养殖密度的影响,即各密度组间的GH基因的相对表达量差异不显著(图 4)。30~60 d养殖期内,35 kg · m-3和65 kg · m-3密度组间的日增质量与95 kg · m-3密度组差异不显著,但显著高于125 kg · m-3密度组(图 1)。而养殖第60天时,GH mRNA表达量的分析结果显示35 kg · m-3和65 kg · m-3密度组显著高于95 kg · m-3和125 kg · m-3密度组(图 4)。上述结果表明在该研究中革胡子鲶幼鱼的日增质量与垂体GH基因mRNA相对表达量不存在紧密的相关性。结合前人的研究结果,在该研究中笔者推测,仅就生长轴GH-GHR-IGF而言,革胡子鲶在较短的养殖时间内(30 d),养殖密度增大时,由于空间不足、摄食不均等原因可能影响鱼体生存状态和营养水平,而导致GH下游的生长调控因子,如GHR和IGF的合成与分泌减少,最终使鱼体的日增质量降低。但是随着养殖时间的延长(60 d),养殖密度增大到一定程度时则会影响处于生长轴中心位置的因子——GH mRNA表达的下降,进而GH的合成与分泌减少,这可能成为影响鱼体生长速度的主要内在因素。对于GH-GHR-IGF这一生长轴在革胡子鲶生长中的调节作用以及三者的相互补偿关系仍需进一步深入探究。
-
图 1 不同养殖密度革胡子鲶日增质量
同一线上肩标字母不同者为差异显著(P<0.05),肩标字母相同者为差异不显著(P>0.05)
Figure 1. Daily weight gain of C.gariepinus reared at different stocking densities
Values with different superscripts on the same lines are significantly different (P < 0.05), while those with the same superscripts are not significantly different (P > 0.05).
图 3 养殖第30天(a)和第60天时(b)革胡子鲶个体GH和β-actin基因片段PCR产物电泳图
泳道1~3、4~6、7~8和9~12分别为养殖密度35 kg · m-3、65 kg · m-3、95 kg · m-3和125 kg · m-3的各3个体GH和β-actin基因片段RCR产物电泳图,泳道M为DNA标准分子量(BBI公司)
Figure 3. Electrophoretic patterns of PCR products of GH and β-actin gene fragments of individuals on 30th (a) and 60th day nursing(b)
Lanes 1~3, 4~6, 7~8 and 9~12 are electrophoretic patterns of PCR products of GH and β-actin gene fragments separately on three individuals at stocking densities of 35 kg · m-3, 65 kg · m-3, 95 kg · m-3 and 125 kg · m-3, respectively; Lane M is DNA Marker (BBI Company)
图 4 不同养殖密度革胡子鲶GH基因mRNA的相对表达量
标有不同字母者为差异显著(P<0.05),无字母或字母相同者为差异不显著(P>0.05)
Figure 4. Relative expression of GH mRNA in pituitary of C.gariepinus reared at different densities
Different letters above the bar indicate significant difference (P < 0.05);while the same letters or no letter above the bar indicate no significant difference (P > 0.05)
表 1 养殖密度对革胡子鲶体质量的影响
Table 1 Effect of stocking density on body weight of juvenile C.gariepinus
指标index 养殖密度/ kg·m-3 stocking density 35 65 95 125 初始体质量/g initial body weight 31.01±0.47 29.77±0.32 30.82±1.17 31.22±0.90 第30天体质量/g body weight on 30th day 64.75±1.21a 60.79±0.43ab 57.40±3.38bc 55.38±2.83c 第60天体质重/g body weight on 60th day 100.94±3.42a 96.64±3.84a 90.70±1.19b 82.87±2.71c 死亡率/% mortality 3.69±0.76a 3.68±1.13a 5.13±0.36b 5.40±0.43b 注:部分数据引自文献[17]。同一行肩标字母相同或无肩标字母者表示差异不显著(P>0.05),肩标字母不同者表示差异显著(P<0.05)
Note:Some data in this table are taken from Reference [17].Values with the same letters or no letter within the same row are not significantly different (P>0.05);whereas those with different letters are significantly different (P<0.05). -
[1] 李文笙, 林浩然. 鱼类生长激素合成与分泌的内分泌调控网络: 垂体生长激素分泌细胞中的信号整合[J]. 中国科学, 2010, 40(2): 149-158. doi: 10.1360/zc2010-40-2-149 [2] 马细兰, 张勇, 黄卫人, 等. 尼罗罗非鱼生长激素及其受体的cDNA克隆与mRNA表达雌雄差异[J]. 动物学报, 2006, 52(5): 924-933. https://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_dwxb200605014 [3] DENG S P, WU B, ZHU C H, et al. Molecular cloning and dimorphic expression of growth hormone (gh) in female and male spotted scat Scatophagus argus[J]. Fish Sci, 2014, 80(4): 715-723. doi: 10.1007/s12562-014-0763-5
[4] LYNN S G, POWELL K A, WESTNEAT D F, et al. Seasonal and sex-specific mRNA levels of key endocrine genes in adult yellow perch (Perca flavescens) from Lake Erie[J]. Mar Biotechnol, 2009, 11(2): 210-222. doi: 10.1007/s10126-008-9136-3
[5] 温海深, 林浩然, 肖东. 野生鲇鱼生长激素分泌的季节变化及其神经内分泌调控[J]. 动物学报, 2002, 48(2): 213-220. https://www.doc88.com/p-0764364038983.html [6] FIGUEROA J, MARTÍN R S, FLORES C, et al. Seasonal modulation of growth hormone mRNA and protein levels in carp pituitary: evidence for two expressed genes[J]. J Comp Physiol B, 2005, 175(3): 185-192. doi: 10.1007/s00360-005-0474-4
[7] 王德寿, 林浩然, 张为民. 大鳍鳠脑垂体和血清生长激素水平的季节变化[J]. 水产学报, 1999, 23(1): 1-5. http://scxuebao.ijournals.cn/scxuebao/article/abstract/19990101 [8] SHIN H S, LEE J, CHOI C Y. Effects of LED light spectra on the growth of the yellowtail clownfish Amphiprion clarkia[J]. Fish Sci, 2012, 78(3): 549-556. doi: 10.1007/s12562-012-0482-8
[9] 李云, 蔡生力. 半胱胺对斜带石斑鱼(Epinephelus coioides)生长激素及其受体mRNA水平的影响[J]. 海洋与湖沼, 2011, 42(2): 244-250. https://www.doc88.com/p-378487383742.html [10] 马细兰, 张勇, 周立斌, 等. LHRH-RA对尼罗罗非鱼生长及生长轴相关基因表达的影响[J]. 水生生物学报, 2013, 37(1): 42-47. doi: 10.7541/2013.42 [11] Van de NIEUWEGIESSEN P G, BOERLAGE A S, VERRETH J A J, et al. Assessing the effects of a chronic stressor, stocking density, on welfare indicators of juvenile African catfish, Clarias gariepinus Burchell[J]. Appl Anim Behav Sci, 2008, 115(3/4): 233-243. https://www.researchgate.net/publication/276973582_Assessing_the_effects_of_a_chronic_stressor_stocking_density_on_welfare_indicators_of_juvenile_African_catfish_Clarias_gariepinus_Burchell
[12] Van de NIEUWEGIESSEN P G, OLWO J, KHONG S, et al. Effects of age and stocking density on the welfare of African catfish, Clarias gariepinus Burchell[J]. Aquaculture, 2009, 288(1/2): 69-75. https://research.wur.nl/en/publications/effects-of-age-and-stocking-density-on-the-welfare-of-african-cat
[13] HOSFELD C D, HAMMER J, HANDELAND S O, et al. Effects of fish density on growth and smoltification in intensive production of Atlantic salmon (Salmo salar L. )[J]. Aquaculture, 2009, 294(3/4): 236-241. https://www.semanticscholar.org/paper/Effects-of-fish-density-on-growth-and-in-intensive-Hosfeld-Hammer/c6bf3bf7e16af4688990cc9a7b8250bf6eb9c26c
[14] LUPATSCH I, SANTOS G A, SCHRAMA J W, et al. Effect of stocking density and feeding level on energy expenditure and stress responsiveness in European sea bass Dicentrarchus labrax[J]. Aquaculture, 2010, 298(3/4): 245-250. https://www.semanticscholar.org/paper/Effect-of-stocking-density-and-feeding-level-on-and-Lupatsch-Santos/8f1a5aaf83806f568a5a0974bdd5d4b3fe6178e2
[15] SANTOS G A, SCHRAMA J W, MAMAUAG R E P, et al. Chronic stress impairs performance, energy metabolism and welfare indicators in European seabass (Dicentrarchus labrax): the combined effects of fish crowding and water quality deterioration[J]. Aquaculture, 2010, 299(1/2/3/4): 73-80. https://research.wur.nl/en/publications/chronic-stress-impairs-performance-energy-metabolism-and-welfare-
[16] TOLUSSI C E, HILSDORF A W S, CANEPPELE D, et al. The effects of stocking density in physiological parameters and growth of the endangered teleost species piabanha, Brycon insignis (Steindachner, 1877)[J]. Aquaculture, 2010, 310(1/2): 221-228. https://www.mdpi.com/2076-3921/11/7/1215
[17] DAI W, WANG X M, GUO Y J. Growth performance, hematological and biochemical responses of African catfish (Clarias gariepinus) reared at different stocking densities[J]. Afr J Agric Res, 2011, 28(6): 6177-6182. https://www.researchgate.net/publication/281008830_Growth_performance_hematological_and_biochemical_responses_of_African_catfish_Clarias_gariepinus_reared_at_different_stocking_densities
[18] 王晓梅, 戴伟, 郭永军, 等. 高密度养殖下革胡子鲶生长激素mRNA表达的半定量分析[J]. 华北农学报, 2011, 26(1): 94-98. https://www.doc88.com/p-2999598529779.html [19] FUKADA H, OZAKI Y, PIERCE A L, et al. Salmon growth hormone receptor: molecular cloning, ligand specificity, and response to fasting[J]. Gen Comp Endocrinol, 2004, 139(1): 61-71. doi: 10.1016/j.ygcen.2004.07.001
[20] SAERA-VILA A, CALDUCH-GINER J A, PÉREZ-SÁNCHEZ J. Duplication of growth hormone receptor (GHR) in fish genome: gene organization and transcriptional regulation of GHR typeⅠand Ⅱ in gilthead sea bream (Sparus aurata)[J]. Gen Comp Endocrinol, 2005, 142(1/2): 193-203. https://pubmed.ncbi.nlm.nih.gov/15862563/
[21] BRIAN C S, CHRISTOPHER A M, GEOFFREY C W, et al. Reduction in channel catfish hepatic growth hormone receptor expression in response to food deprivation and exogenous cortisol[J]. Domest Anim Endocrinol, 2006, 31(4): 340-356. doi: 10.1016/j.domaniend.2005.12.003
[22] 华益民, 林浩然. 营养状况对幼年鲤鱼肝脏IGF-ⅠmRNA表达的影响[J]. 动物学报, 2001, 47(1): 94-100. https://www.doc88.com/p-7899756958026.html [23] 田娟, 涂玮, 曾令兵, 等. 饥饿和再投喂期间尼罗罗非鱼生长、血清生化指标和肝胰脏生长激素、类胰岛素生长因子-Ⅰ和胰岛素mRNA表达丰度的变化[J]. 水产学报, 2012, 36(6): 900-907. https://www.doc88.com/p-1817571150317.html [24] 姜巨峰, 张殿昌, 邱丽华. 等. 用IGF-ⅠmRNA表达量评价鲮饲料配方效果的研究[J]. 南方水产, 2010, 6(2): 66-72. doi: 10.3969/j.issn.1673-2227.2010.02.011 [25] 强俊, 杨弘, 王辉, 等. 温度与饲料蛋白质水平对吉富品系尼罗罗非鱼(Oreochromis nilotica) 幼鱼生长和血清生长激素水平的影响[J]. 动物营养学报, 2012, 24(8): 1589-1601. doi: 10.3969/j.issn.1006-267x.2012.08.026 [26] 黄国强, 李洁, 唐夏, 等. 温度胁迫及恢复过程中褐牙鲆幼鱼GH、IGF-Ⅰ、RNA/DNA比值和糖原的变化[J]. 南方水产科学, 2012, 8(6): 16-21. doi: 10.3969/j.issn.2095-0780.2012.06.003 -
期刊类型引用(5)
1. 刘婷婷,刘小丽,邢燕,高慧,王勤,魏滨. 山东沿海6市市售水产品中多氯联苯污染特征及健康风险评估. 食品安全导刊. 2025(01): 99-102+108 .  百度学术
百度学术
2. 陈征兵,王楚. 水环境中持久性有机污染物风险评价研究进展. 黑龙江环境通报. 2024(01): 10-12 .  百度学术
百度学术
3. 马丽莎,谢文平,田斐,尹怡,单奇,郑光明,李恒翔. 广东沿海养殖牡蛎中多氯联苯残留水平及人体饮食暴露风险评估. 南方水产科学. 2021(02): 11-19 .  本站查看
本站查看
4. 杨代凤,刘腾飞,陆皓茜,毛健,钱辉,赵佳昕. 气相色谱-质谱法测定小麦中二噁英类多氯联苯. 食品安全质量检测学报. 2020(17): 6209-6215 .  百度学术
百度学术
5. 肖妙,张彩云,李玉卡,刘二花,苏青. 畜产品中持久性有机污染物危害及检测. 今日畜牧兽医. 2019(10): 1-2 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
