Characteristics of transglutaminase from bighead carp
-
摘要:
文章研究了温度、pH、二硫苏糖醇(DTT)以及不同的金属离子和抑制剂对鳙(Hypophthalmichthys nobilis)鱼肉中内源性转谷氨酰胺酶(transglutaminase,TGase)活性的影响。结果表明,鳙内源性TGase的最适温度在37~45 ℃之间,最适pH为6.5~7.5,适量的钙离子(Ca2+)(0~2.2 mmol · L-1)可以激发酶活性,低浓度(0~0.2 mmol · L-1)的DTT可以提高酶活性,但高浓度的钠离子(Na+)和钾离子(K+)会降低酶活性,镁离子(Mg2+)、铜离子(Cu2+)、锌离子(Zn2+)、钡离子(Ba2+)、铁离子(Fe3+)、亚铁离子(Fe2+)、铅离子(Pb2+)和乙二胺四乙酸(EDTA)也会抑制酶的活性。
Abstract:We studied the transglutaminase (TGase) from bighead carp (Hypophthalmichthys nobilis) under different conditions (temperature, pH, DTT). The optimum temperature and pH of TGase were 37~45 ℃ and 6.5~7.5, respectively. The optimum concentrations of CaCl2 and dithiothreitol were 0~2.2 mmol · L-1 and 0~0.2 mmol · L-1, respectively. The TGase activity decreased as concentrations of Na+ and K+ increased, and was inactivated by Mg2+, Cu2+, Zn2+, Ba2+, Fe3+, Fe2+, Pb2+ and EDTA.
-
Keywords:
- bighead carp /
- transglutaminase /
- enzyme activity
-
鱼糜制品在水产品加工中占据着重要地位,目前在全球范围内海水鱼是加工鱼糜制品的主要原料,但过度的海洋捕捞和日益加剧的海洋污染使海洋渔业资源正在减少,进而影响优质鱼糜以及鱼糜制品的生产。由于近年来淡水鱼养殖规模的不断扩大,产量逐年上升,以淡水鱼作为原料生产鱼糜将成为鱼糜加工业新趋势。然而淡水鱼凝胶能力较差,成为阻碍产业发展的瓶颈,因此,如何提高淡水鱼糜的凝胶形成能力是目前亟待解决的问题。
在鱼糜的制作过程中,冷冻鱼糜加盐擂溃后需在0~40 ℃进行保温,这一过程即为凝胶化。经过凝胶化的鱼糜具有更好的凝胶强度和弹性,这是由于鱼糜中含有内源性转谷氨酰胺酶(transglutaminase,TGase)的原因。TGase是一种催化酰基转移的酶,研究表明在鱼糜的低温凝胶化过程中TGase催化肌球蛋白重链的谷氨酰胺残基的γ-羧基酰胺基与赖氨酸残基的ε-氨基之间发生交联作用,生成分子内或分子间ε-(γ-Glu)-Lys非二硫共价键,这些共价键非常稳定,能促进蛋白质分子之间发生交联,从而改善了蛋白质的凝胶性质,提高了鱼糜的凝胶强度,提升了鱼糜的品质[1]。
海水鱼糜中的内源性TGase的特性在国内外已有较多的研究[2-6],从哺乳类动物和植物到海洋生物以及微生物,研究人员都对TGase进行了相关的分析,而关于鳙(Hypophthalmichthys nobilis)的TGase的研究鲜见报道。文章以中国产量大、精深加工少的鳙为研究对象,研究鳙TGase的活性以及不同外部因素对其活性的影响,旨在为淡水鱼糜的品质改良提供理论参考。
1. 材料与方法
1.1 材料与试剂
鳙购于浙江省杭州市西湖区物美超市;N-苄氧羰基-L-谷氨酰甘氨酸(Nα-CBZ-Gln-Gly)、还原型谷胱甘肽(GSH)、L-谷氨酸γ单羟肟酸(L-glutamic acid γ-monohydroxamate)均购于Sigma公司;二硫苏糖醇(DTT)、乙二胺四乙酸(EDTA)、羟胺溶液(Hydroxylamine solution,NH2OH)、盐酸(HCl)、三氯化铁(FeCl3)、三氯乙酸(TCA)、三羟甲基氨基甲烷(Tris)、氯化钙(CaCl2)等试剂均为国产分析纯。
1.2 仪器与设备
Evolution 60S紫外可见分光光度计(ThermoFisher公司出品);BSA124S-CW电子分析天平(Sartorius公司出品);PB-10 pH计(Sartorius公司出品);SORVALL RC-6 PLUS冷冻离心机(ThermoFisher公司出品);TGL-16G台式离心机(上海安亭科学仪器厂出品);IKA T18均质机(IKA公司出品);DK-S24电热恒温水浴锅(上海森信实验仪器有限公司出品)。
1.3 试验方法
1.3.1 酶的提取
酶的提取方法参考WORRATAO和YONGSAWATDIGUL[4]的方法并稍作改动。鲜鱼购买以后保存在冰中并于20 min内转运至实验室,后去头、皮及内脏,取鱼肉。鱼肉混合4倍体积的提取缓冲液均质(10 mmol · L-1 NaCl,5 mmol · L-1 EDTA,2 mmol · L-1 DTT,10 mmol · L-1 Tris-HCl,pH 7.5),均质后离心(16 000 r · min-1,4 ℃,20 min)。离心后取上清液继续离心(20 000 r · min-1,4 ℃,60 min),得到的上清液视为粗酶。
测定在37 ℃下TGase酶活力,结果表明,TGase在37 ℃下1 mL粗酶活力为110.60 U,比活力为5.59 U · mg-1。
1.3.2 TGase的活性测定
TGase能催化特殊的底物Nα-CBZ-Gln-Gly形成异羟肟酸,因此可以通过测定异羟肟酸的形成来测定酶的活力[7]。
一份1 mL的基质溶液含有0.4 mL 0.1 mol ·L-1醋酸缓冲液(pH 5.5)、0.2 mL 0.1 mmol · L-1 NH2OH、0.2 mL 0.01 mmol · L-1 GSH以及0.2 mL 0.15 mmol · L-1 Nα-CBZ-Gln-Gly,加入0.1 mL 3.75 mmol · L-1 DTT和0.1 mL 6.75 mmmol · L-1 CaCl2后与0.4 mL 10倍稀释的粗酶液混合,37 ℃保温20 min,然后加入0.4 mL混合酸制剂终止反应(含有1体积12% HCl,1体积12% TCA和1体积5% FeCl3溶液),然后离心(10 000 r · min-1,4 ℃,5 min),取上清液在525 nm下测定吸光值。使用L-glutamic acid γ-monohydroxamate作为标准物。酶的活力单位数定义为37 ℃下TGase每分钟催化形成1.0 nmol L-glutamic acid γ-monohydroxamate所使用的酶。
1.3.3 TGase的生化特性研究
测定最佳温度时将反应溶液分别置于0、15 ℃、30 ℃、37 ℃、40 ℃、45 ℃、50 ℃、60 ℃、70 ℃和80 ℃反应20 min随后测定酶活。测定最适pH时,pH 4.0~7.5使用0.1 mol ·L-1醋酸缓冲液,pH 7.5~9.0使用0.2 mol ·L-1 Tris-HCl缓冲液,pH 9.0~12.0使用50 mmol · L-1硼酸缓冲液。在测定DTT、氯化钠(NaCl)、EDTA以及各种金属离子的影响时,钙离子(Ca2+)浓度维持在0.4 mmol · L-1。
2. 结果与讨论
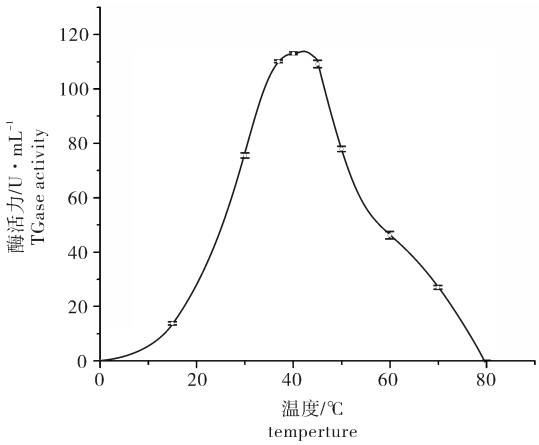
2.1 温度对TGase活性的影响
鳙的TGase的酶活力随着温度的升高先增加后降低,最适温度在37~45 ℃之间。0~15 ℃时,随着温度升高酶活力缓慢增加,超过15 ℃以后随着温度的继续升高酶活力开始急剧增加并在40 ℃时到达顶峰,同时在37~45 ℃之间基本保持稳定。但当温度超过45 ℃后继续升高则酶活力急剧降低,到80 ℃时已经彻底失去了酶活力(图 1)。海洋生物如虾夷扇贝(Patinopecten yessoensis)[8]、长牡蛎(Crassostrea gigas)[5]、狭鳕(Theragra chalcogramma)[9]肝脏中的TGase最适温度在35~50 ℃。淡水鱼种如草鱼(Ctenopharyngodon idellus)[11]和尼罗罗非鱼(Oreochromis niloticus)[12],其最适温度分别在37~45 ℃和35~50 ℃。该研究中鳙TGase的最适温度与上述结论基本吻合,这表明来源不同的TGase最适温度虽然各不相同,但差异不大,海洋生物和淡水鱼的内源性TGase有着相似的最适温度。
周爱梅等[10]研究表明鳙鱼糜适合在40 ℃进行凝胶化,其最大凝胶强度出现在40 ℃,保温1 h。同时通过SDS-PAGE发现在40 ℃时随着时间的推移鳙鱼糜中肌球蛋白重链逐渐减少。这与鳙TGase最适温度相一致。可以认为在制作鱼糜的低温凝胶化过程中内源性TGase起着关键作用,TGase能够催化肌球蛋白重链之间的相互交联进而可以提高鱼糜制品的凝胶强度[11]。
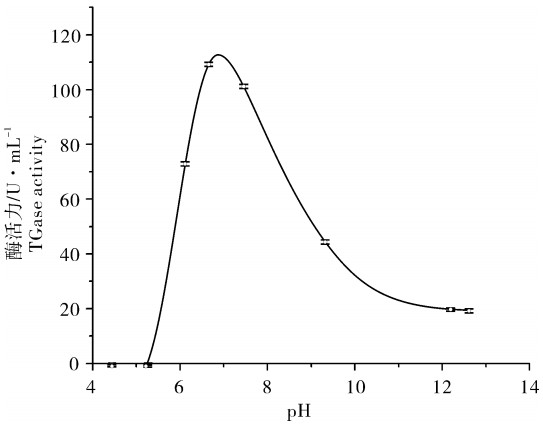
2.2 pH对TGase活性的影响
鳙的TGase的酶活力随着pH的升高先增加后降低,最适pH为7~7.5。pH在4~5时TGase酶活力为零。但随着pH的上升,酶活力开始增加并在pH 7~7.5维持着较高的水平。但随着pH的进一步上升,酶活力开始出现下降(图 2)。淡水鱼中罗非鱼的TGase最适pH为7~7.5[12],与鳙的TGase最适pH相一致,草鱼的TGase最适pH在8~9[11]。海洋生物红金线鱼(Nemipterus furcosus)肝脏中的TGase最适pH在8.5~9.0[13],而来自长尾大眼鲷(Priacanthus tayenus)[14]、真鲷(Pagrosomus major)鱼肝[6]的TGase最适pH分别为8.0、9~9.5。这表明来自不同鱼种的内源性TGase最适pH各不相同。
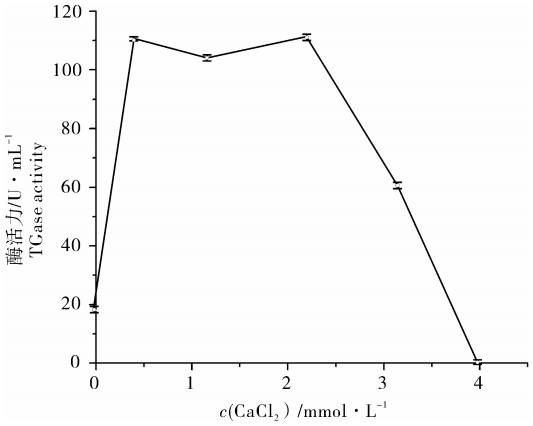
2.3 CaCl2对TGase活性的影响
鳙TGase在Ca2+处于低浓度(0~0.4 mmol ·L-1)时,其酶活力随着Ca2+浓度升高而增加。Ca2+浓度进一步升高,酶活力基本保持稳定,Ca2+浓度为2.2 mmol · L-1时酶活力达到最高值;但当Ca2+浓度超过2.2 mmol · L-1时,酶活性受到抑制,酶活力开始降低;当Ca2+浓度达到4 mmol· L-1时酶活性被完全抑制,酶活力降为零。鳙的内源性TGase所需的最适Ca2+浓度在0.4~2.2 mmol · L-1之间(图 3)。
哺乳动物及鱼的内源性TGase通常需要Ca2+作为激活剂[15],由试验结果可知鳙的TGase显然也对Ca2+有依赖性。研究表明在淡水鱼中罗非鱼的TGase在Ca2+浓度为1.2 mmol · L-1时活性达到最大[12],草鱼的TGase在0~1 mmol · L-1时酶活随着Ca2+浓度升高而增加[11]。海洋生物中来自真鲷鱼肝[6]、长牡蛎[5]、扇贝[8]以及狭鳕鱼肝[9]的TGase所需的最适Ca2+浓度分别为0.5 mmol · L-1、25 mmol · L-1、10 mmol · L-1和3 mmol · L-1。这表明不同来源的TGase所需的激活剂Ca2+浓度各不相同。
有研究表明,Ca2+引诱酶的构象发生改变,从而使活性部位的半胱氨酸暴露出来[16],进而促进酶反应的发生。因此较低浓度的Ca2+(0~2.2 mmol · L-1)可以提高内源性TGase的酶活力,但继续提高Ca2+浓度则会抑制内源性TGase的酶活力,这与草鱼中的TGase相类似[11]。但鳙的TGase对Ca2+更加敏感,Ca2+浓度超过4 mmol · L-1时便失去了活力。周爱梅等[10]研究表明适量添加Ca2+可明显改善鳙鱼糜的凝胶特性,这是因为Ca2+作为鳙内源性TGase的激活剂,适量添加Ca2+可以提高酶活力,促进肌球蛋白重链之间的交联提高凝胶强度。因此在制作鳙鱼糜时,适量添加Ca2+可以提高鳙鱼糜的品质。
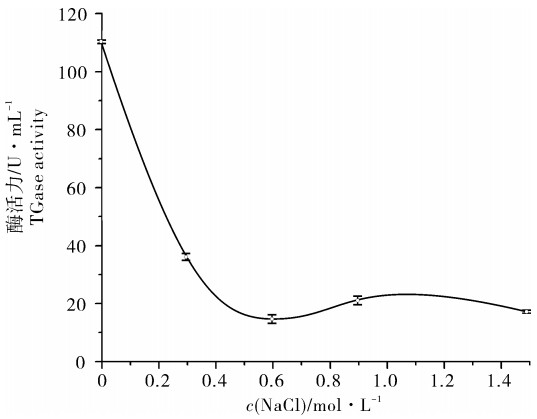
2.4 NaCl和K+对TGase活性的影响
鳙内源性TGase的酶活力随着NaCl浓度升高而降低(图 4),同时由表 1可以看出0.1 mmol · L-1钾离子(K+)也会抑制酶的活性,因此NaCl和K+会抑制鳙内源性TGase的活力。有研究表明淡水鱼中的内源性TGase易受到盐类的影响,草鱼[11]、尼罗罗非鱼[12]的内源性TGase活力都随着NaCl浓度升高而降低。高浓度的NaCl可以引起酶分子的构象发生改变,从而抑制了酶的活性[5, 17]。然而对于海洋生物如扇贝、日本长额虾(Pandalus nipponensis)和太平洋褶柔鱼(Todarodes pacificus),NaCl可以显著增加其TGase活力[14]。这表明内源性TGase所需的最适条件和来源生物的生活条件有着密切联系。鳙作为一种淡水鱼,其内源性TGase需要在低盐环境下工作,高盐的环境会抑制TGase的酶活力,这与其他淡水鱼中的TGase表现出相同的性质[11-12]。
表 1 金属离子和抑制剂对鳙转谷氨酰胺酶活性的影响Table 1 Effect of metal ions and inhibitors on TGase activity of bighead carp试剂reagent 浓度/mmol·L-1 concentration 相对酶活/% relative enzyme activity 空白blank 10 100 镁离子Mg2+ 10 71 铜离子Cu2+ 10 0 锌离子Zn2+ 10 0 钾离子K+ 100 31 钡离子Ba2+ 10 0 铁离子Fe3+ 10 0 铁离子Fe2+ 10 67 铅离子Pb2+ 10 0 乙二胺四乙酸DTA 10 0 2.5 DTT对TGase活性的影响
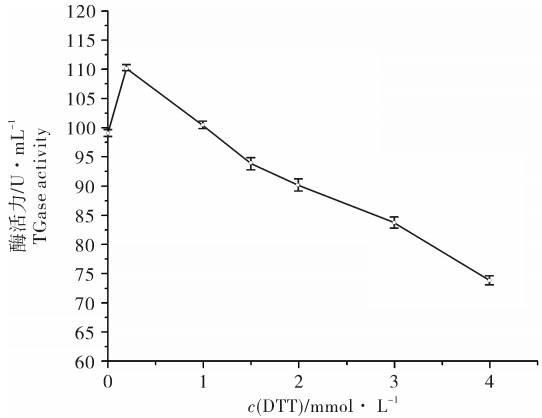
低浓度(0~0.2 mmol · L-1)的DTT可以激发酶的活性,DTT浓度继续升高酶活力有所降低(图 5)。有研究表明0~1 mmol · L-1和0~5 mmol · L-1的DTT可以分别提高草鱼和罗非鱼内源性TGase的酶活力[11-12],浓度继续升高酶活力稍有降低,这与鳙的TGase性质相似。
这是因为DTT作为一种强还原剂,可以抑制酶的活性中心的巯基被氧化失活,进而提高酶的活力。但尽管巯基保护试剂DTT对酶活力有着激活作用,DTT同时也可以逆转激活作用。因为它同时也是蛋白质变性剂可以破坏二硫键,变性目的蛋白。因此当DTT浓度超过0.2 mmol · L-1时酶活力反而降低。不过可能由于空间位阻的作用,DTT对鳙、草鱼以及罗非鱼中的TGase的影响没有很明显。
2.6 金属离子和抑制剂对TGase活性的影响
铜离子(Cu2+)、锌离子(Zn2+)和铅离子(Pb2+)在浓度为10 mmol · L-1时会使鳙内源性TGase完全失活(表 1)。这一现象不仅和淡水鱼中的草鱼、罗非鱼的TGase性质相类似[11-12],也和很多海洋生物例如乌贼鳃、鲎(Limulus polyphemus)血细胞以及微生物中的拉达卡链霉菌(Streptoverticillium ladakanum)的TGase性质相似[18-20]。这可能是因为Cu2+、Zn2+和Pb2+这些金属离子对巯基有着很强的亲和能力。由Cu2+、Zn2+和Pb2+能抑制TGase的活性,可知鳙的内源性TGase和其他来源的TGase一样,在活性部位具有硫醇基团[8, 18]。
铁离子(Fe3+)、亚铁离子(Fe2+)、镁离子(Mg2+)和钡离子(Ba2+)会抑制酶的活性。有研究表明Mg2+和Ba2+勉强可以激活真鲷、狭鳕鱼肝中TGase的活性[6, 9]。但Fe3+、Fe2+和Mg2+作为常见的酶激活剂并未提高鳙内源性TGase的活力,这可能是因为这些金属浓度太低不能引起TGase构象发生正确的改变[6],也有可能是因为Ca2+的拮抗作用抑制了这些金属离子发挥作用。
EDTA能完全抑制TGase活力,这与真鲷、草鱼、尼罗罗非鱼、鲎血细胞以及虹鳟(Oncorhynchus mykiss)中的现象相一致[6, 11-12, 19, 21]。1)由于EDTA作为金属离子螯合剂可以与激活剂Ca2+结合从而抑制了酶的活性;2)EDTA是一种巯基烷基化剂,能与TGase活性部位的巯基结合使其烷化[11],这进一步证明了TGase的活性部位含有硫醇基团。
3. 结论
试验结果表明鳙的内源性TGase最适温度在37~45 ℃,最适pH为6.5~7.5,需要适量的Ca2+(0~2.2 mmol · L-1)作为激活剂。DTT作为一种强还原剂在低浓度(0~0.2 mmol · L-1)时可以增加酶的活力。10 mmol · L-1的Fe3+、Fe2+、Mg2+、Ba2+和高浓度Na+、K+会抑制鳙中的TGase的活性。EDTA、Cu2+、Zn2+、Pb2+在浓度为10 mmol · L-1时会使鳙内源性TGase完全失活。鱼肉中的内源性TGase是鱼糜凝胶形成的关键酶,因此,研究鳙内源性TGase的活性及其影响因素可以为TGase在鱼糜加工中的应用提供理论依据。
-
表 1 金属离子和抑制剂对鳙转谷氨酰胺酶活性的影响
Table 1 Effect of metal ions and inhibitors on TGase activity of bighead carp
试剂reagent 浓度/mmol·L-1 concentration 相对酶活/% relative enzyme activity 空白blank 10 100 镁离子Mg2+ 10 71 铜离子Cu2+ 10 0 锌离子Zn2+ 10 0 钾离子K+ 100 31 钡离子Ba2+ 10 0 铁离子Fe3+ 10 0 铁离子Fe2+ 10 67 铅离子Pb2+ 10 0 乙二胺四乙酸DTA 10 0 -
[1] 徐辉. 谷氨酰胺转氨酶对秘鲁鱿鱼肌原纤维蛋白凝胶特性的影响[D]. 杭州: 浙江工商大学, 2007. https://d.wanfangdata.com.cn/thesis/Y1166844 [2] ANDO H, ADACHI M, UMEDA K, et al. Purification and characteristics of a novel transglutaminase derived from microorgamnisms[J]. Agric Biol Chem, 1989, 53(10): 2613-2617. https://www.jstage.jst.go.jp/article/bbb1961/53/10/53_10_2613/_article/-char/en
[3] FOLK J E, COLE P W. Identification of a functional cysteine essential for the activity of guinea pig liver transglutaminase[J]. J Biol Chem, 1966, 241(13): 3238-3240. doi: 10.1016/S0021-9258(18)96522-1
[4] WORRATAO A, YONGSAWATDIGUL J. Purification and characterization of transglutaminase from tropical tilapia (Oreochromis niloticus)[J]. Food Chem, 2005, 93(4): 651-658. doi: 10.1016/j.foodchem.2004.09.044
[5] KUMAZAWA Y, SANO K, SEGURO K, et al. Purification and characterization of transglutaminase from Japanese oyster (Crassostrea gigas)[J]. J Agric Food Chem, 1997, 45(3): 604-610. doi: 10.1021/jf9604596
[6] YASUEDA H, KUMAZAWA Y, MOTOKI M. Purification and characterization of a tissue-type transglutaminase from red seabream (Pagrus major)[J]. Biosci Biotech Bioch, 1994, 58(11): 2041-2045. doi: 10.1271/bbb.58.2041
[7] GROSSOWICZ N, WAINFAN E, BOREK E, et al. The enzymatic formation of hydroxamic acids from glutamine[J]. J Biol Chem, 1950, 187(1): 111-125. doi: 10.1016/S0021-9258(19)50936-X
[8] NOZAWA H, SEKI N. Purification of transglutaminase from scallop striated adductor muscle and NaCl-induced inactivation[J]. Fish Sci, 2001, 67(3): 493-499. doi: 10.1046/j.1444-2906.2001.00263.x
[9] KUMAZAWA Y, NAKANISHI K. YASUEDA H, et al. Purification and characterization of transglutaminase from walleye pollack liver[J]. Fish Sci, 1996, 62(6): 959-964. doi: 10.2331/fishsci.62.959
[10] 周爱梅, 张祥刚, 龚翠, 等. 内源性转谷氨酰胺酶对淡水鱼鱼糜凝胶化的影响[J]. 食品科技, 2009, 34(2): 130-135. http://api.bafs.ac.cn/storage/upload/spkx/201507043.pdf [11] 孙静静, 罗自生, 吴翔, 等. 草鱼中内源性转谷氨酰胺酶特性的研究[J]. 中国食品学报, 2012, 12(9): 67-72. doi: 10.3969/j.issn.2095-0780.2014.06.010 [12] WORRATAO A, YONGSAWATDIGUL J. Cross-linking of actomyosin by crude tilapia (Oreochromis niloticus) transglutaminase[J]. J Food Biochem, 2003, 27(1): 35-51. doi: 10.1111/j.1745-4514.2003.tb00265.x
[13] HEMUNG B, YONGSAWATDIGUL J. Partial purification and characterization of transglutaminase from threadfin bream(Nemipterus sp. ) liver[J]. J Food Biochem, 2008, 32(2): 182-200. doi: 10.1111/j.1745-4514.2008.00154.x
[14] NOZAWA H, MAMEGOSHI S, SEGI N. Partial purification and characterization of six transglutaminase from ordinary muscles of various fishes and marine iverterbrates[J]. Comp Biochem Phys B, 1997, 118(2): 313-317. doi: 10.1016/S0305-0491(97)00062-X
[15] YONGSAWATDIGUL J, WORRATAO A, PARK J W. Effect of endogenous transglutaminase on threadfin bream surimi gelation[J]. J Food Sci, 2002, 67 (9): 3258-3263. doi: 10.1111/j.1365-2621.2002.tb09575.x
[16] JIANG S T, LEE J J. Purification and characterization of pig plasma factor ⅩⅢa[J]. J Agric Food Chem, 1992, 40(7): 1101-1107. doi: 10.1021/jf00019a002
[17] KISHI H, NOZAWA H, SEKI N. Reactivity of muscle transglutaminase on carp myofibrils and myosin B[J]. Nippon Suisan Gakk, 1991, 57(6): 1203-1210. doi: 10.2331/suisan.57.1203
[18] NOZAWA H, CHO S Y, SEKI N. Purification and characterization of transglutaminase from squid gill[J]. Fish Sci, 2001, 67(5): 912-919. doi: 10.1046/j.1444-2906.2001.00341.x
[19] TOKUNAGA F, YAMADA M, MIYATA T, et al. Limulus hemocyte transglutaminase: its purification and characterization and identification of the intracellular substrates[J]. J Biol Chem, 1993, 268(1): 252-261. doi: 10.1016/S0021-9258(18)54143-0
[20] TSAI G J, LIN S M, JIANG S H. Transglutaminase from Streptoverticillium ladakanum and application to minced fish product[J]. J Food Sci, 1996, 61(6): 1234-1238. doi: 10.1111/j.1365-2621.1996.tb10968.x
[21] HA C R, IUCHI I. Enzyme responsible for egg envelope (Chorion) hardening in fish: purification and partial characterization of two transglutaminases associated with their substrate, unfertilized egg chorion, of the rainbow trout, Oncorhynchus mykiss[J]. J Biochem, 1998, 124(5): 917-926. doi: 10.1093/oxfordjournals.jbchem.a022208
-
期刊类型引用(4)
1. 易林,安玥琦,张晗玮,熊善柏. 鲢和青鱼转谷氨酰胺酶诱导下肌球蛋白凝胶特性的研究. 华中农业大学学报. 2023(04): 254-261 .  百度学术
百度学术
2. 易林,安玥琦,刘茹,胡杨,熊善柏. 鲢鱼和青鱼内源性转谷氨酰胺酶纯化及酶学性质比较. 食品与机械. 2023(10): 4-12 .  百度学术
百度学术
3. 叶月华,钱敏,刘晓艳,白卫东,赵文红,潘振辉. 不同外源物质对淡水鱼鱼糜热诱导凝胶特性增效作用的研究进展. 食品与发酵工业. 2021(12): 285-293 .  百度学术
百度学术
4. 李金玲,叶蕾蕾,尤娟,熊善柏,胡杨,安玥琦. 鲢内源性转谷氨酰胺酶的纯化及其性质. 华中农业大学学报. 2018(06): 105-112 .  百度学术
百度学术
其他类型引用(4)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
