Analysis of shell nacre color in full-sib families of pearl oyster (Pinctada fucata)
-
摘要:
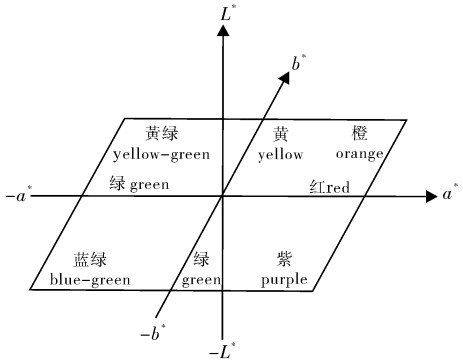
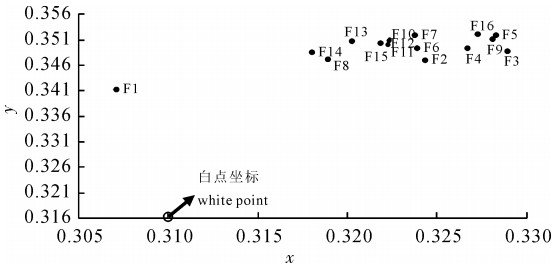
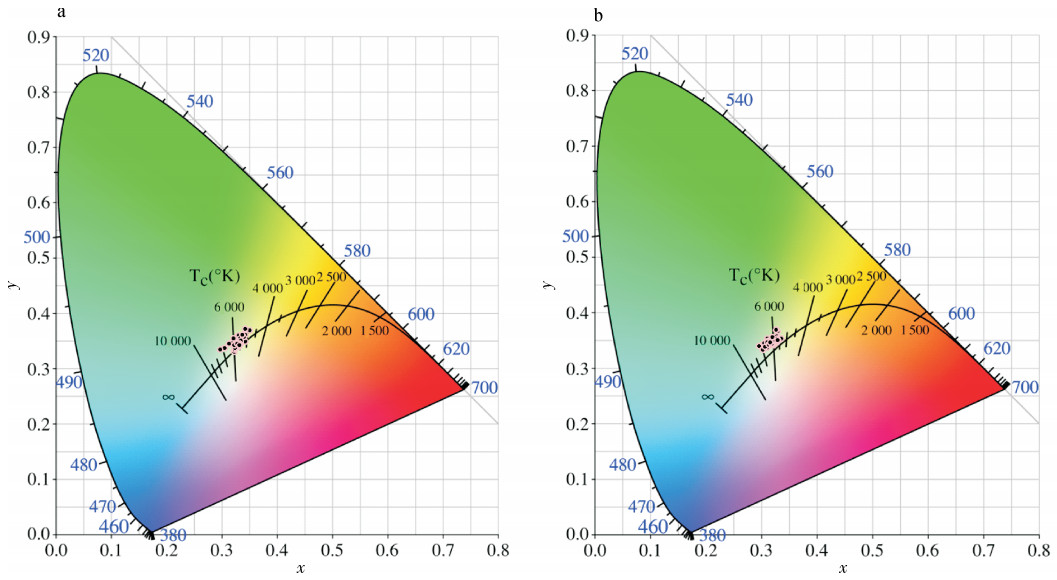
合浦珠母贝(Pinctada fucata)小片贝的珍珠质颜色直接影响育珠贝所产珍珠的颜色。每个合浦珠母贝的珍珠质颜色都有自己的颜色特征值,即三刺激值和颜色参数。试验选择16个合浦珠母贝全同胞家系,用CSE成像分析色度系统测量并比较各家系左壳内侧外缘珍珠质颜色参数Lab和三刺激值,以筛选适合做插核小片贝的家系。珍珠质的颜色参数明度(L)为98.586~105.234,其中F16家系的明度最大,F3家系的明度最小;a(红绿色品)为-0.967~-6.577,b(黄蓝色品)为5.915~11.237,F14家系色品最偏向于绿色(-a),F16家系色品最偏向于黄色(b)。F3和F14家系贝壳外缘珍珠质的色差(ΔEab)最大(7.885),肉眼能明显觉察。16个家系的合浦珠母贝都属于白色系列,其中离白光中心最近(a2+b2最小)且个体颜色集中的F1家系最适合用作小片贝来选育培养。
Abstract:The shell nacre colors of the donor pearl oysters (Pinctada fucata) directly affect the colors of the pearls produced by the donor′s mantle pieces. Each pearl oyster′s shell nacre has its own color characteristics, namely the tristimulus values and color parameters. Sixteen full-Sib families were analyzed in the study. Average value of L (light), a (red and green) and b (yellow and blue) ranged between 98.586~105.234, -0.967~-6.577 and 5.915~11.237, respectively. The color of F14 was the closest to green (-a) among all families, while F16 was the closest to yellow (b). The biggest Eab was 7.885 between F3 and F14, which could be observed easily by naked eye. The colours of all the families belonged to white. Among them, F1 was the best one as a candidate donor pearl oyster to provide mantle pieces because of the small color differences among individuals and the shortest distant to white color center.
-
Keywords:
- Pinctada fucata /
- pearl /
- donor pearl oyster /
- shell nacre color
-
斑节对虾(Penaeus monodon)属于对虾科,对虾属,广泛分布于西太平洋和印度洋沿岸的大部分地区,我国的海南、广东、广西、浙江、福建以及台湾省沿岸都有分布。这种虾具有生长快、个体大、产量高、肉味鲜美、营养丰富等优点,成为我国东南沿海以及东南亚各国水产养殖的重要对象。目前,国内用于生产的斑节对虾亲虾主要来源于东南亚国家和我国海南的野生种群。由于过度捕捞,三亚海区成熟斑节对虾资源量锐减,该种群的遗传多样性受到关注。因此,研究该种群的遗传结构和遗传变异水平,对于管理、保护和利用该种群的种质资源具有重要意义。
动物线粒体DNA由于具有分子量小、结构简单、母性遗传、一级结构进化速度快等特征而作为一种优良的分子标记广泛应用于动物的群体遗传学和系统进化研究[1-2]。本文通过测定斑节对虾mtDNA 16S rRNA基因和控制区序列片段,分析了斑节对虾海南三亚野生地理种群16S rRNA基因和控制区序列的多态性,其目的是了解目前该种群的遗传多样性水平,为种质资源保护和遗传育种提供理论依据。
1. 材料与方法
1.1 样品采集
2003年,从中国海南三亚海区采集了野生成熟斑节对虾样品20尾,样品编号依次为1~20。每个样品取一小块肌肉组织,于75%酒精中4℃冰箱保存。采集的样品所在地见图 1。
1.2 总DNA提取
每个样品取约100 mg肌肉剪碎,使其乙醇完全挥发后,加入500 μL TEN9细胞裂解缓冲液(Tris.Cl 50 mmol · L-1,pH 9.0;EDTA 100 mmol ·L-1;NaCl 200 mmol · L-1),终浓度为2%的SDS和1 mg · mL-1的蛋白酶K,混匀后56℃消化过夜,分别用等体积的酚:氯仿:异戊醇(25:24:1)和氯仿抽提,至无蛋白质中间相,再用2倍体积无水乙醇和1/10体积NaAc(3 mol · L-1,pH 5.2)沉淀,70%乙醇洗涤后,用无离子超纯水溶解,-20℃存放。
1.3 mtDNA 16S rRNA和控制区序列片段的PCR扩增及序列测定
用于16S rRNA扩增的引物序列为L2510(5′-CGCCTGTTTAACAAAAACAT-3′)和H3059(5′-CCGGTCTGAACTCAGATCATGT-3′)[3]。用于控制区序列扩增的引物为:12S(5′-AAGAACCAGCTAGGATAAAACTTT-3′)和PCR-1R(5′-GATCAAAGAACATTCTTTAACTAC-3′)[4]。扩增的反应总体积60 μL,其中10×ExTaq Buffer (Takara) 6 μL,ExTaq polymerase (Takara 5 U · μL-1) 0.3 μL,dNTP (Takara 2.5 mmol · L-1) 4 μL,10 pmol · μL-1引物2 μL,1 μL模板DNA,补足灭菌双蒸水至60 μL。16S rRNA扩增条件为:94℃预变性2 min,之后进行35个循环(94℃ 45 s,50℃ 45 s,72℃ 60 s),最后72℃延伸7 min。控制区序列的扩增条件:94℃预变性3 min,之后进行35个循环(94℃ 45 s,48.8℃ 20 s,72℃ 40 s),最后72℃延伸5 min扩增产物经1.5%琼脂糖凝胶电泳,胶回收纯化。纯化后的产物送至测序公司(博亚公司)测序。
1.4 数据处理
用Clustal X程序对所得的DNA序列进行比对[5]。种群的遗传多样性指标基因多样度(Genediversity,H)[6]和碱基多样度(Nucleotide diversity,π)[7]由ARLEQUIN 2000[8]统计软件计算获得。利用MEGA软件构建NJ系统树。
2. 结果
2.1 目的片段的序列特征及种群内的序列变异
对斑节对虾20个个体的mtDNA 16S rRNA和控制区部分序列进行了PCR扩增,均获得了特异性很好的PCR产物,经序列测定,获得的mtDNA 16S rRNA的片段大小为495 bp,对应整个斑节对虾mtDNA序列(GenBank序列号NC_ 002184)位置在12 817~13 311 bp之间。共检测出多态位点17个,8个单倍型(单倍型编号为:a~h,图 2),其中具有单倍型b的个体有11个,具有单倍型a和d的个体各2个,具有其它单倍型的个体各1个。20个个体16S rRNA基因的4种碱基T、C、A、G的平均含量分别为34.9%,12.2%,33.9%,19.0%,这个结果与其他研究者得到甲壳类的16S rRNA碱基组成类似。
获得的mtDNA控制区序列的片段大小为470 bp,对应整个斑节对虾mtDNA序列(GenBank序列号NC_ 002184)位置在15 024~15 492 bp之间。共检测出多态位点100个,17种单倍型(单倍型编号为:A~Q,图 3),其中具有单倍型A、B、C的个体各2个,具有其它单倍型的个体各1个。20个个体控制区部分序列的4种碱基T、C、A、G的平均含量分别为40.1%,9.5%,41.2%,9.3%。
2.2 种群内遗传多样性分析
通过ARLEQUIN 2000软件分别计算出20个个体16S rRNA、控制区序列的主要遗传多样性指数,具体数据见表 1。
表 1 20个个体种群内16S rRNA和控制区序列主要的遗传多样性指数Table 1 Diversity indices of 20 P.monodon individuals based on mtDNA 16S rRNA and control region遗传多样性指数diversity indices 16S rRNA mtDNA 16S rRNA sequence 控制区序列mtDNA control region sequence 单倍型数haplotype 8 17 基因多样度gene diversity, H 0.7000±0.1092 0.9842±0.0205 碱基多样度nucleotide diversity, π 0.004519±0.002901 0.048022±0.024639 2.3 种群内个体间的遗传关系
以20个个体的16S rRNA基因和控制区部分序列构建的NJ系统树分别见图 4和图 5。从图 4和图 5可以看出,16S rRNA基因和控制区部分序列构建的NJ系统树基本一致。
3. 讨论
mtDNA序列分析较其它DNA分子标记技术更为直接、准确和可靠,因为它可以直接检测到基因碱基间的替换、缺失及插入等每一个变异位点情况,更灵敏地分析个体、群体及种间的遗传变异情况,广泛应用于种水平的系统发育和种内种群遗传差异分析及遗传多样性分析。QUAN等[9]和CHU等[4]认为mtDNA 16S rRNA基因序列比较保守,不适应甲壳类种群内类的遗传多样性分析。CHU等[4]认为mtDNA控制区序列进化比较快,是进行甲壳类种群内遗传多样性分析的理想分子标记。本文利用线粒体DNA 16S rRNA基因和控制区序列片段对三亚海区斑节对虾野生种群进行遗传多样性分析,发现16S rRNA序列比较保守,不适应斑节对虾种群内遗传多样性分析;而控制区序列是进行斑节对虾种群内遗传多样性分析的理想分子标记,与以上学者的观点一致。
本文得到的海南三亚野生种群20个个体斑节对虾控制区部分序列的碱基多样度为4.80%,高于东亚沿海日本对虾群体的碱基多样度[10],说明海南三亚野生种群的遗传多样性较为丰富。但是与深圳斑节对虾野生群体比较,其碱基多样度略低[11]。由于尚未有人利用mtDNA序列碱基变异进行海南三亚斑节对虾种群的遗传多样性分析,本文的结果只能反映海南三亚斑节对虾遗传多样性的现状,无法与以前的遗传多样性水平进行比较,因而无法了解到其遗传多样性的变化。海南三亚斑节对虾遗传多样性会否因亲虾资源量的下降而有所下降,还需要长期定期的对该种群进行监测。
-
表 1 各家系颜色Lab平均值
Table 1 Average value of Lab for each family
家系family 颜色参数color parameter L a b F1 100.039 -4.315 5.915 F2 100.201 -2.337 8.329 F3 98.586 -0.967 9.776 F4 98.674 -2.311 9.573 F5 98.830 -2.624 10.698 F6 99.979 -3.710 9.097 F7 99.496 -4.929 9.929 F8 100.294 -5.286 7.284 F9 103.278 -2.425 10.730 F10 103.666 -5.335 9.558 F11 103.652 -5.096 9.235 F12 100.819 -5.355 9.584 F13 103.741 -6.481 9.138 F14 103.780 -6.577 7.848 F15 103.385 -5.471 9.309 F16 105.234 -3.530 11.237 表 2 全同胞16个子代家系之间的色差ΔEab
Table 2 Chromatic abrration ΔEab among 16 full-sib families
ΔEab F2 F3 F4 F5 F6 F7 F8 F9 F10 F11 F12 F13 F14 F15 F16 F1 3.125 5.313 4.389 5.216 3.240 4.097 1.699 6.103 5.241 4.968 3.893 5.365 4.781 4.904 7.479 F2 2.566 1.970 2.753 1.590 3.127 3.131 3.903 4.744 4.510 3.327 5.510 5.570 4.573 5.934 F3 1.362 1.911 3.151 4.068 5.271 5.005 6.703 6.558 4.928 7.575 7.885 6.598 7.274 F4 1.178 1.971 2.767 4.088 4.748 5.836 5.714 3.724 6.577 6.874 5.678 6.877 F5 2.250 2.520 4.570 4.452 5.660 5.613 3.558 6.437 6.947 5.548 6.490 F6 1.552 2.423 3.899 4.056 3.928 1.910 4.673 4.923 3.840 5.678 F7 2.785 4.606 4.206 4.217 1.432 4.589 5.040 3.975 6.050 F8 5.382 4.067 3.888 2.360 4.092 3.760 3.699 6.567 F9 3.161 3.084 3.993 4.382 5.080 3.363 2.304 F10 0.403 2.847 1.223 2.117 0.400 2.922 F11 2.866 1.391 2.033 0.466 2.995 F12 3.163 3.644 2.583 5.056 F13 1.294 1.085 3.917 F14 1.875 4.784 F15 3.303 表 3 16个子代群体三刺激值的平均数及在色度图上的坐标
Table 3 Average tristimulus values of 16 full-sib families and coordinates on CIE color diagram
家系family 三刺激值tristimulus value 色度图坐标coordinates on color diagram X Y Z x y F1 92.90 100.57 98.88 0.318 0.344 F2 95.13 101.79 96.37 0.324 0.347 F3 91.86 97.44 90.01 0.329 0.349 F4 90.50 96.81 89.74 0.327 0.349 F5 90.92 97.46 88.59 0.328 0.352 F6 93.01 100.33 93.83 0.324 0.349 F7 91.33 99.25 91.49 0.324 0.352 F8 93.01 101.27 97.33 0.319 0.347 F9 101.86 108.99 99.61 0.328 0.351 F10 101.16 110.09 102.59 0.322 0.351 F11 101.27 110.01 102.97 0.322 0.350 F12 94.00 102.39 95.22 0.322 0.351 F13 100.66 110.25 103.41 0.320 0.351 F14 100.7 110.35 105.59 0.318 0.349 F15 100.35 109.27 102.19 0.322 0.350 F16 106.29 114.37 104.12 0.327 0.352 -
[1] 宋中华, 喻学惠, 章西焕. 养殖珍珠质量影响因素[J]. 宝石和宝石学杂志, 2001, 3(1): 18-21. http://scxuebao.ijournals.cn/scxuebao/article/abstract/20110607579 [2] WADA K T. The pearls produced from the groups of pearl oyster selected for colour of nacre in the shell for two generations[J]. Bull Natl Res Inst Aquacult, 1985(7): 1-7. https://www.semanticscholar.org/paper/The-pearls-produced-from-the-groups-of-pearl-fucata-Wada/040905ab24b6e37189660acb76bff03f901c529f
[3] ACOSTA-SALMÓN H, MARTÍNEZ-FERN NDEZ E, SOUTHGATE P C. A new approach to pearl oyster broodstock selection: can saibo donors be used as future broodstock?[J]. Aquaculture, 2004, 231(1/2/3/4): 205-214. https://researchonline.jcu.edu.au/5778/
[4] ACOSTA-SALMÓN H, MARTÍNEZ-FERN NDEZ E, SOUTHGATE P C. Use of relaxants to obtain saibo tissue from the blacklip pearl oyster (Pinctada margaritifer) and the Akoya pearl oyster (Pinctada fucata)[J]. Aquaculture, 2005, 246(1/2/3/4): 167-172. https://www.researchgate.net/publication/222028879_Use_of_relaxants_to_obtain_saibo_tissue_from_the_blacklip_pearl_oyster_Pinctada_margaritifera_and_the_Akoya_pearl_oyster_Pinctada_fucata
[5] 李立平, 陈钟惠. 养殖珍珠的辐照处理[J]. 宝石和宝石学杂志, 2002, 4(3): 16-22. https://xueshu.baidu.com/usercenter/paper/show?paperid=9ce4c88c244fc0ae6df704eba6d36ad6&site=xueshu_se [6] 顾志峰, 王嫣, 王爱民, 等. 马氏珠母贝两个不同地理种群的形态性状和贝壳珍珠质颜色比较分析[J]. 渔业科学进展, 2009, 30(1): 79-86. http://yykxjz.ijournals.cn/yykxjzen/ch/reader/create_pdf.aspx?file_no=20090113&year_id=2009&quarter_id=1&falg=1 [7] 王嫣, 石耀华, 王爱民, 等. 成像分析系统在马氏珠母贝遗传育种上的初步应用[C]//第三届海洋生物高技术论坛文集. 厦门: 国家863计划资源环境技术领域办公室, 2005: 504-507. https://www.docin.com/p-533357865.html [8] 叶翬. 马氏珠母贝选育家系遗传结构分析及贝壳珍珠质颜色分析[D]. 海口: 海南大学, 2006. https://wf.pub/thesis/article:Y998390 [9] GERVIS M H, SIMS N A. The biology and culture of pearl oysters (Bivalvia: Pteridae)[C]. London: Overseas Development Administration (ODA), 1992: 1-49. https://www.semanticscholar.org/paper/The-biology-and-culture-of-pearl-oysters-(Bivalvia:-Gervis-Sims/fa9e67d8fb3ad4518f0063a24d0d29a3ab083881
[10] 焦钰, 师尚丽, 杜晓东, 等. 马氏珠母贝珍珠囊发育的组织和组织化学研究[J]. 广东海洋大学学报, 2010, 30(4): 7-10. https://xueshu.baidu.com/usercenter/paper/show?paperid=81e87ac85fd129d50cbf7392cfdda22b&site=xueshu_se [11] WADA K T. Experimental biological studies on the occurrence of yellow color in pearls[J]. Bull Natl Pearl Res Lab, 1969(14): 1765-1820. https://www.nature.com/articles/s41598-021-87262-3
[12] TAYLOR J J. Producing golden and silver south sea pearls from Indonesian hatchery reared Pinctada maxima: 3rd World Aquaculture Conference, April 23-27, 2002, Beijing, China[C]. [S. l. ]: World Aquaculture Society, 2002: 754. https://xueshu.baidu.com/usercenter/paper/show?paperid=05336f30e99551b0f7efc102f6acd7c0
[13] McGINTY E L, EVANS B S, TAYLOR J U U, et al. Xenografts and pearl production in two pearl oyster species, P. maxina and P. margaritifera: effect on pearl quality and a key to understanding genetic contribution[J]. Aquaculture, 2010, 302(3/4): 175-181. https://www.semanticscholar.org/paper/Xenografts-and-pearl-production-in-two-pearl-oyster-McGinty-Evans/27121aa965e3cf443e64515c1ffba16ef9f518ff
[14] 张根芳, 许式见, 方爱萍. 三角帆蚌(Hyriopsis cumingii)外套膜无核珍珠颜色成因的育珠实验[J]. 海洋与湖沼, 2013, 44(2): 531-536. https://xueshu.baidu.com/usercenter/paper/show?paperid=cb2104d8bb041b13d5447e379a8bd065 [15] 朱文彬. 两种不同贝壳珍珠质色三角帆蚌的形态性状和珍珠颜色的比较分析[C]//中国动物学会. 中国海洋湖沼学会贝类学会分会第十四次学会研讨会论文摘要汇编, 2009: 31. doi: 10.14012/j.cnki.fjsc.2023.05.003 [16] 吴广州, 王慧, 翁文剑, 等. 淡水养殖珍珠的化学染色及其对珍珠表面形貌的影响[J]. 宝石和宝石学杂志, 2006, 8(2): 9-14. http://jogg.cug.edu.cn/cn/article/id/cbafe65f-1828-423e-8456-3761f7275672 [17] YASUNORI M. Effects of Y-irradiation on color and fluorescence of pearls[J]. JJAP, Part 1, 1998, 27(2): 235-239. doi: 10.1143/JJAP.27.235
[18] 杜春玲, 张唏, 葛蕾, 等. 颜色测量仪器及其发展[J]. 现代仪器, 2005, 11(3): 56-57. https://lib.cqvip.com/Qikan/Article/Detail?id=12127082&from=Qikan_Article_Detail [19] 李宏光, 吴宝宁, 施浣芳, 等. 几种颜色测量方法的比较[J]. 应用光学, 2005, 26(3): 60-63. http://www.yygx.net/article/id/8978 [20] 陈仲林, 张玉奇. 色差研究[J]. 照明工程学报, 1998, (4): 28-32. https://cqvip.com/qikan/Detail.aspx?gch=98201X&years=1998&num=4 [21] 陈炳若, 杜科, 李玉传, 等. 颜色探测的研究与进展[J]. 半导体光电, 2000, 21(4): 238-255. https://wenku.baidu.com/view/a2d86ac70a75f46527d3240c844769eae009a329.html [22] 严俊, 胡仙超, 王巨安, 等. 不同颜色的淡水养殖珍珠呈色机理研究[J]. 岩矿测试, 2013, 32(2): 263-268. https://www.cgsjournals.com/article/id/ykcs_3f230373-2ef9-4dc0-8e25-d82003572e5a




 下载:
下载:





 粤公网安备 44010502001741号
粤公网安备 44010502001741号
