Effect of different nutrient salts on growth and chemical constituents of Gracilaria blodgettii
-
摘要:
为探讨适宜大型海藻芋根江蓠(Gracilaria blodgettii)栽培的生态条件,分别测定了在不同总无机氮浓度(48 μmol·L-1、96 μmol·L-1、144 μmol·L-1、192 μmol·L-1、240 μmol·L-1、288 μmol·L-1和336 μmol·L-1)和不同氮磷比(N/P)(1/1、5/1、10/1、50/1和100/1)的培养条件下,芋根江蓠藻体的相对生长速率(RGR)和生化组分的变化。结果表明,最适总无机氮浓度为192 μmol·L-1,最适N/P为10/1。芋根江蓠适宜在氨氯(NH4+-N)比例较高的海水中生长,3种无机氮最适合质量比值是m[硝氮(NO3--N)] : m(NH4+-N) : m[亚硝氮(NO2--N)]=1 : 10 : 5和m(NO3--N) : m(NH4+-N) : m(NO2--N)=5 : 10 : 1。在最适宜的营养盐因子环境条件下,芋根江蓠在生化组分(光合色素及可溶性蛋白)和抗氧化能力等方面都表现较好;而在海水总无机氮浓度过低、N/P过高以及NH4+-N在总无机氮中所占比例较低等条件下,都不利于藻体正常生长,会导致藻体营养不良、生长缓慢。
Abstract:In order to determine the best ecological conditions for the growth of Gracilaria blodgettii, we observed the changes in its relative growth rate (RGR) and biochemical constituents at different total inorganic nitrogen concentrations (48 μmol·L-1, 96 μmol·L-1, 144 μmol·L-1, 192 μmol·L-1, 240 μmol·L-1, 288 μmol·L-1, 336 μmol·L-1) and with different N/P values (1/1, 5/1, 10/1, 50/1, 100/1). The optimum total inorganic nitrogen concentration was 192 μmol·L-1; the optimum N/P value was 10/1;the optimum m(NO3--N) : m(NH4+-N) : m(NO2--N) were 1 : 10 : 5 and 5 : 10 : 1. Under these conditions, G.blodgettii obtained higher RGR, the highest contents of phycobiliprotein and soluble protein, but lower peroxidas(POD) activity and malondialdehyde (MDA) content. However, the algae suffered malnutrition and slow growth when total inorganic nitrogen concentration was too low, N/P value was too high and the ratio of NH4+-N to total inorganic nitrogen was relatively low.
-
Keywords:
- Gracilaria blodgettii /
- nutrient salt /
- growth /
- biochemical constituent
-
随着沿海养殖业的发展,沿海生态系统的富营养化问题也受到前所未有的关注[1],由于养殖对象排泄物的分解以及残余饵料的积累,导致水体中氮(N)、磷(P)无机物含量越来越高,养殖区污染日趋严重。目前防治水体富营养化的方法主要是控制和减少水体中多余的N、P无机物浓度,缓解富营养化水域的负荷[2]。大型海藻既能从环境中吸收大量的N、P元素,也能释放出氧气(O2),提高水体的溶解氧浓度[3],同时还能对微藻数量产生一定的抑制,从而起到改善养殖区水质的作用[4]。近年来,陆续有学者就大型海藻对N、P营养盐吸收情况开展了研究工作。杨宇峰等[5]、YU和YANG[6]、YANG等[7]认为龙须菜(Gracilaria lemaneiformis)等大型海藻的大规模栽培是减轻养殖区富营养化的有效途径;程丽巍等[8]的研究结果表明N、P的同时加富可以显著促进龙须菜的生长;许忠能等[9]通过对细基江蓠繁枝变种(G.tenuistipi-tata var. liui)的研究,认为其对N、P营养盐吸收的比例随着水体的N、P变化而变化。
芋根江蓠(Gracilaria blodgettii)是重要的经济海藻,其含胶量高达30%以上,主要用于提取琼胶和作为鲍鱼饵料[10],也是一种高膳食纤维、低能量、富含矿物质的优质保健食品原料[11]。黄中坚等[12]研究了芋根江蓠对生态因子的适应性。而目前尚未见对其营养吸收方面的研究报道,笔者研究了不同营养盐条件对芋根江蓠的生长及组分的影响,不仅为其栽培生产提供技术依据,也可为利用芋根江蓠进行池塘生态修复提供理论支持。
1. 材料与方法
1.1 材料
芋根江蓠试验材料在2013年7月采集于海南省三亚市崖城镇的海水池塘(18°21.299′N,109°6.328′E)。挑选健康无溃烂的藻体进行培养,在室温(28±0.5)℃,光照强度约为5 000 lx,光周期为光亮(L) : 黑暗(D)=12 h : 12 h,用过滤灭菌的自然海水(pH 8.3,盐度25)暂养3 d后进行试验。1 000 mL三角烧瓶放入鲜质量为1 g的藻体,在智能型光照培养箱(GXZ-300B,中国宁波江南仪器厂出品)中进行恒温培养。
1.2 研究方法
试验所用海水参考ESAW人工海水配方配制(pH 8.4,盐度30),总无机氮浓度试验共设置7个浓度(48 μmol·L-1、96 μmol·L-1、144 μmol ·L-1、192 μmol·L-1、240 μmol·L-1、288 μmol·L-1和336 μmol·L-1),P浓度为人工海水本底浓度(21 μmol·L-1),海水温度为28 ℃,光照强度为6 000 lx,光周期为L : D=12 h : 12 h;试验共设置5个N/P梯度(1/1、5/1、10/1、50/1和100/1),本底N浓度为192 μmol·L-1,海水温度为28 ℃,光照强度为6 000 lx,光周期为L : D=12 h : 12 h;设置7个N形态比例梯度{m[硝氮(NO3--N)] : m[氨氮(NH4+-N)] : m[亚硝氮(NO2--N)]}分别为1 : 1 : 1、10 : 5 : 1、10 : 1 : 5、5 : 10 : 1、5 : 1 : 10、1 : 10 : 5和1 : 5 : 10,总无机氮浓度为192 μmol·L-1,光周期为L : D=12 h : 12 h,海水温度为28 ℃,光照强度为6 000 lx。每2 d换一次灭菌海水,每个处理进行3个重复。
藻体的生长用相对生长速率(RGR),即通过测定藻体在培养7 d内鲜质量的变化来表示,利用公式RGR(%·d-1)=[ln(Mt/M0)/t]×100求得,其中M0为初始鲜质量,Mt为t天后的鲜质量,称量前用吸水纸吸干藻体的水分。
叶绿素a(Chl-a)和类胡萝卜素(Car)的测定采用乙醇法,根据PORRA[13]的公式计算w(Chl-a);根据PARSONS和STRICKLAN[14]的公式计算w(Car);藻红蛋白(R-PE)和藻蓝蛋白(R-PC)的测定参考BEER和ESHEL的方法[15];可溶性蛋白(SP)利用考马斯亮蓝G250染色法[16]测定;过氧化物酶(POD)活性参考张志良和瞿伟菁[16]方法测定;丙二醛(MDA)按照DHINDSA等[17]方法测定。
1.3 数据处理
试验数据采用Excel 2007和Origin 7.0统计软件进行数据处理及统计分析。用One Way ANOVA(LSD)和t检验差异的显著性,设显著水平为P=0.05。
2. 结果与分析
2.1 不同营养盐因子对生长的影响
2.1.1 总无机氮对生长的影响
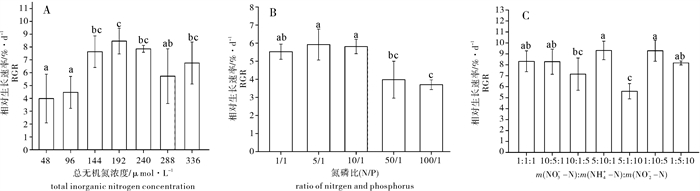
在不同总无机氮浓度梯度下,芋根江蓠的RGR差异明显,高氮处理组的RGR均高于低氮处理组(图 1-A)。总无机氮浓度小于192 μmol·L-1时,芋根江蓠的RGR随着无机氮浓度的升高而增长,随后开始逐渐下降;当浓度为144~240 μmol·L-1时RGR显著高于其他组(P < 0.05)。随着培养时间的延长,低浓度处理组的藻体颜色开始变浅,后期出现了“黄化现象”。
![]() 图 1 不同总无机氮浓度(A)、氮磷比(B)和氮形态(C)对芋根江蓠相对生长速率的影响(n=3)不同的字母代表不同处理间有显著性差异(P < 0.05),下图同此Figure 1. Effects of different total inorganic nitrogen concentrations (A), N/P values (B) and forms of nitrogen (C) on relative growth rate of G.blodgettiiDifferent letters represent significant difference among different treatments (P < 0.05). The same case in the following figures.
图 1 不同总无机氮浓度(A)、氮磷比(B)和氮形态(C)对芋根江蓠相对生长速率的影响(n=3)不同的字母代表不同处理间有显著性差异(P < 0.05),下图同此Figure 1. Effects of different total inorganic nitrogen concentrations (A), N/P values (B) and forms of nitrogen (C) on relative growth rate of G.blodgettiiDifferent letters represent significant difference among different treatments (P < 0.05). The same case in the following figures.2.1.2 N/P对生长的影响
不同N/P对芋根江蓠的生长的影响不同(图 1-B)。在N/P为5~10时藻体具有较高的RGR,与N/P为50和100的处理组呈显著性差异(P < 0.05)。随着N/P的升高芋根江蓠的RGR逐渐下降,低N/P更有利于江蓠生物量的积累。
2.1.3 N形态对生长的影响
在NH4+-N浓度占比例较大的处理组中,芋根江蓠的RGR比其他处理组都高;当m(NO3--N) : m(NH4+-N) : m(NO2--N)为5 : 10 : 1时RGR出现最大值(4.65%);而当m(NO3--N) : m(NH4+-N) : m(NO2--N)为5 : 1 : 10时RGR最小(图 1-C)。在m(NH4+-N)浓度最小的2个处理组中,RGR差异不明显(P>0.05)。除第3组以外,m(NO3--N) : m(NH4+-N) : m(NO2--N)=5 : 1 : 10的处理组与其他各组都出现极显著差异(P < 0.01)。
2.2 不同营养盐因子对光合色素的影响
2.2.1 总无机氮对光合色素质量分数的影响
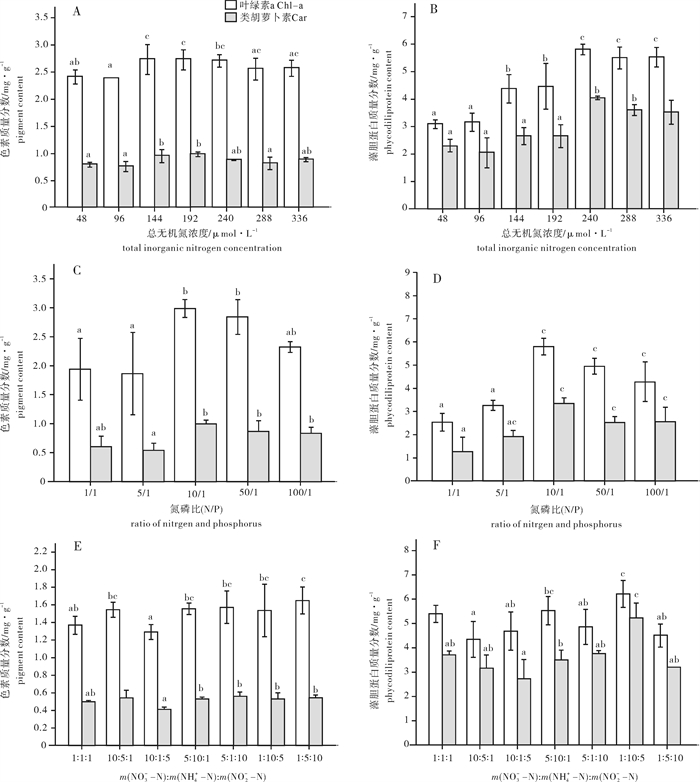
随着总无机氮浓度的改变,芋根江蓠的w(Chl-a)和w(Car)变化不大,最大值都出现在c(N)为144 μmol·L-1时,但与其他处理组差异不明显(P>0.05)(图 2-A);而藻体中的w(R-PE)和w(R-PC)随着c(N)的增加而呈现总体逐渐升高的趋势,并在c(N)为240 μmol·L-1时达到最高(图 2-B)。高浓度组(240~366 μmol·L-1)与低浓度组(48~192 μmol·L-1)相比呈现出显著差异(P < 0.05)。
2.2.2 N/P对光合色素质量分数的影响
在N/P=10/1的处理组中,芋根江蓠的w(Chl-a)和w(Car)最高(图 2-C),较低与较高的N/P都不利于藻体叶绿素的积累;随着N/P的增大,w(R-PE)和w(R-PC)逐渐增加,N/P=10/1时w(R-PE)和w(R-PC)均高于其他处理组,与N/P为1/1和5/1的处理组有显著性差异(P < 0.05)(图 2-D)。
2.2.3 N形态对光合色素质量分数的影响
第3组[m(NO3--N) : m(NH4+-N) : m(NO2--N)=10 : 1 : 5)]与第7组[m(NO3--N) : m(NH4+-N) : m(NO2--N)=1 : 5 : 10)]对于w(Chl-a)的影响具有显著性差异(P>0.05),其他各处理组对藻体内w(Chl-a)和w(Car)的影响不明显,没有显著性差异(P>0.05)(图 2-E);不同形态N对w(R-PE)和w(R-PC)有一定的影响,从w(R-PE)的结果可以看出,第6组[m(NO3--N) : m(NH4+-N) : m(NO2--N)=1 : 10 : 5)]与第2组[m(NO3--N) : m(NH4+-N) : m(NO2--N)=10 : 5 : 1)]相比升高了43.51%,而各处理组对于w(R-PC)的影响没有显著性差异(P>0.05)(图 2-F)。
2.3 不同营养盐因子对可溶性蛋白质量分数的影响
2.3.1 总无机氮对可溶性蛋白质量分数的影响
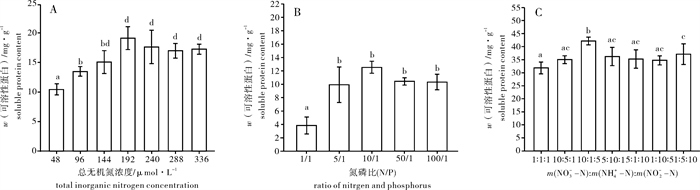
总无机氮浓度小于192 μmol·L-1时,芋根江蓠的w(SP)随着总无机氮水平浓度的增加而显著升高,总无机氮浓度大于192 μmol·L-1时,w(SP)变化不明显(P>0.05)(图 3-A)。
2.3.2 N/P对可溶性蛋白质量分数的影响
随着N/P的升高,w(SP)整体呈现先升高后降低的趋势,最高值出现于N/P=10/1的处理下,最低出现在N/P为1/1时,该处理组与其余各组呈现出极显著差异(P < 0.01)(图 3-B)。
2.3.3 N形态对可溶性蛋白质量分数的影响
不同形态N对芋根江蓠的w(SP)影响不大,最高值出现在m(NO3--N) : m(NH4+-N) : m(NO2--N)=10 : 1 : 5的处理下,最低出现在N/P为m(NO3--N) : m(NH4+-N) : m(NO2--N)=1 : 1 : 1时(图 3-C),最高值比最低值高了32.30%,两者具有显著性差异(P < 0.05)。其余各组w(SP)的变化不大。
2.4 不同营养盐因子对POD活性和MDA生成量的影响
2.3.1 总无机氮对可溶性蛋白质量分数的影响
总无机氮浓度小于192 μmol·L-1时,芋根江蓠的w(SP)随着总氮浓度的增加而显著升高,总氮浓度大于192 μmol·L-1时,w(SP)变化不明显(P>0.05)(图 3-A)。
2.3.2 N/P对可溶性蛋白质量分数的影响
随着N/P的升高,w(SP)整体呈现先升高后降低的趋势,最高值出现于N/P=10/1的处理下,最低出现在N/P为1/1时,该处理组与其余各组呈现出极显著差异(P < 0.01)(图 3-B)。
2.3.3 N形态对可溶性蛋白质量分数的影响
不同形态N对芋根江蓠的w(SP)影响不大,最高值出现在m(NO3--N) : m(NH4+-N) : m(NO2--N)=10 : 1 : 5的处理下,最低出现在N/P为m(NO3--N) : m(NH4+-N) : m(NO2--N)=1 : 1 : 1时,最高值比最低值高了32.30%,两者具有显著性差异(P < 0.05)。其余各组w(SP)的变化不大(图 3-C)。
2.4.1 总无机氮对POD活性和b(MDA)的影响
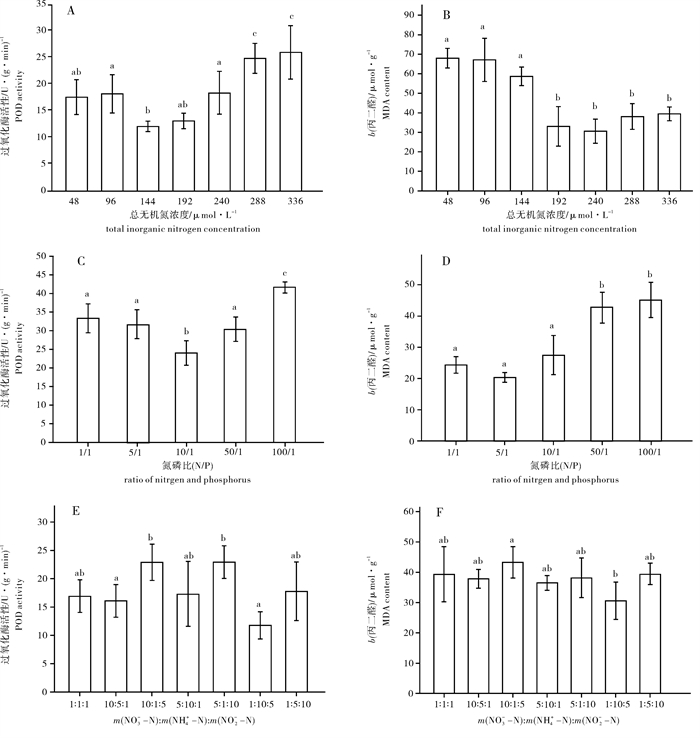
芋根江蓠POD的活性受总无机氮浓度变化的影响显著(图 4-A)。c(N)为144 μmol·L-1时POD活性出现最小值,随后呈现出显著上升(P < 0.05)的趋势;随着总无机氮浓度的增加,b(MDA)逐渐下降,在c(N)为240 μmol·L-1时出现最小值(图 4-B)。高氮组(192 μmol·L-1、240 μmol·L-1、288 μmol·L-1和336 μmol·L-1)与低氮组(48 μmol·L-1、96 μmol·L-1和144 μmol·L-1)相比,b(MDA)降低,差异性显著(P < 0.05)。
2.4.2 N/P对POD活性和b(MDA)的影响
不同N/P处理条件下,芋根江蓠的POD活性出现一定的差异。POD活性最大值出现在N/P为100/1时,最小值出现在5/1时(图 4-C),最大值比最小值升高了73.23%,具有显著性差异(P < 0.05);不同N/P的处理对b(MDA)影响显著,高N/P(N/P>10)中,b(MDA)高于低N/P(N/P < 10),其差异性显著(P < 0.05)(图 4-D)。
2.4.3 N形态对POD活性和b(MDA)的影响
不同形态的N对芋根江蓠的POD活性产生了一定的影响(图 4-E)。高NH4+-N组(第4、第6组)与高NO3-N组(第2、第3组)和高NO2-N组(第5、第7组)相比,POD活性都较低。而高NH4+-N处理的POD活性比低NH4+-N(第3、5组)明显下降,差异性显著(P < 0.05);图 4-F则表示出不同形态的N对b(MDA)的影响,m(NO3--N) : m(NH4+-N) : m(NO2--N)=10 : 1 : 5时b(MDA)有最大值,最小值则出现在m(NO3--N) : m(NH4+-N) : m(NO2--N)=1 : 10 : 5的处理组中,两组有显著性差异(P < 0.05),其余各组间均没有显著性差异(P>0.05)。
3. 讨论
3.1 不同总无机氮浓度对芋根江蓠生长及生化组分的影响
该试验结果表明,芋根江蓠的生长速率受到N加富的影响。N的升高在一定程度内对芋根江蓠的生长起到促进作用,当总无机氮浓度为192 μmol ·L-1时藻体的RGR最高(8.46%),而在144 μmol·L-1和240 μmol·L-1梯度组,其RGR也分别达到了7.64%和7.86%,说明适宜芋根江蓠生长的总无机氮浓度范围为144~240 μmol·L-1。无机氮浓度大于240 μmol·L-1时藻体的生长速率开始出现波动,但仍然维持在较高水平。徐永健等[18]在氮素营养对龙须菜(G.lemaneiformis)的生长研究中发现,在高氮浓度条件下生长的龙须菜比低氮浓度下的生长速率要高得多,与笔者的试验结果相同。这是因为海藻生长的介质中,高浓度的营养条件使得藻体利用营养进行生长的生理过程的底物浓度升高了,所以在一定范围内高的无机氮浓度能促进芋根江蓠加快生长。相关研究结果表明,在一定范围内,营养盐的升高促进了龙须菜的生长,但当浓度达到生长所需的临界营养盐浓度时,藻类生长饱和,营养盐浓度过高则导致营养盐在藻体内的积累[7]。钱鲁闽等[19]在对龙须菜和菊花江蓠(G.lich-evoides)的研究中发现,在一定范围内2种江蓠的N、P吸收速率都随着介质中N、P浓度的增加而增大。
芋根江蓠的w(Chl-a)在不同N水平下变化不大(P>0.05),说明环境中不缺乏N时江蓠Chl-a的生成与介质中所含无机氮的关系不大。有研究表明,海藻的w(Chl-a)与环境中的光照和温度有关[20-21]。黄中坚等[12]在研究光照强度和温度对芋根江蓠生长和生化组分影响时发现,芋根江蓠在低温和9 000 lx的光强下,w(Chl-a)得到显著升高,低温和高光照有利于Chl-a的生成。笔者试验结果表明,在一定范围内芋根江蓠体内w(R-PE)和w(R-PC)与介质中N质量分数成正相关,但到了一定浓度之后则不再升高,说明藻体内的w(R-PE)和w(R-PC)与介质中无机氮浓度密切相关。这是由于海藻中的藻胆蛋白作为N的储存物质,介质中N过多时藻体吸收过量的N会储存在藻胆蛋白中,其主要组成部分为R-PE。同时,w(SP)与w(R-PE)基本成正相关(图 3-A),这是由于藻胆蛋白作为N的储存库,经常被用来合成其他蛋白质[22]。介质中的无机氮浓度升高时,以N为底物的N代谢作用增强,从而增加了N同化物的积累,w(SP)也随之升高。
POD活性在无机氮浓度为144~240 μmol·L-1范围内比较低,而过低或过高浓度的无机氮都使得POD活性升高,这是由于在低氮和高氮环境下,藻体产生了过剩的自由基,刺激了POD的合成,以清除过剩的自由基,减少过氧化物对藻体的损伤[23]。自由基可诱导POD活性的升高,又可直接攻击生物大分子,破坏蛋白质的分子结构,并可使酶活性丧失[24],影响藻体的生长, 这从芋根江蓠的RGR也可以得到证明。同时,藻体活性氧自由基的积累会引起膜脂过氧化,从而导致MDA产生,MDA的生成量可反映细胞膜受损程度[25]。该研究结果表明,在无机氮浓度为192~240 μmol ·L-1,MDA的质量摩尔浓度最低,说明在该浓度条件下,藻体细胞的受损程度最小,更适宜江蓠的生长。
3.2 不同N/P对芋根江蓠生长及生化组分的影响
N是海藻生长的重要限制性营养元素,P在一些研究中也起到正面作用,而N/P也对海藻生长具有较大的影响[26-27]。相关研究发现,提克江蓠(G.tikvahiae)和海带(Laminaria longicruris)同化氮磷的比例为N/P=30/1[28]。李信书等[29]的研究发现,N、P同时加富对条斑紫菜(Porphyra yezonensis)的生长及组分质量分数均有促进作用。笔者试验结果表明,在N/P为1~10范围内,芋根江蓠的RGR比较高,N/P越高,江蓠的RGR越低。这是由于N不变时,P对植物的生长产生了影响,藻类生理代谢可利用无机磷浓度的增加,光合磷酸化水平升高,三磷酸腺苷(ATP)合成增加,进而促进了卡尔文循环效率提高和藻体的生长。无机氮浓度不变时,N/P的降低实际表现为P浓度的升高,而高N/P处理组对江蓠的生长产生了磷限制,所以芋根江蓠在低N/P条件下生长更快。
在N/P为10/1试验组中,芋根江蓠的w(Chl-a)、w(R-PE)和w(R-PC)均达到最大值(图 2-C)。说明介质中总无机氮浓度在藻体生长的适宜范围内时,N/P的变化(无机磷质量分数的变化)成为影响江蓠光合色素质量分数的关键因素。相关研究认为,叶绿体是消耗磷的细胞器[30]。P是组成植物叶绿素的关键元素[31],在适宜的浓度范围内会使植物叶绿素等光合色素质量分数增加,促进植物吸收光能,增强光合作用,积累有机物,如可溶性蛋白、藻胆蛋白等,为较快的生长奠定了良好的生理基础[32]。当N/P过低时(无机磷质量分数高),芋根江蓠的叶绿素a、藻胆蛋白和可溶性蛋白均显著低于高N/P组,这可能是由于过低N/P(高P)对藻体的生长产生了胁迫,使其不能很好地进行光合作用,单位面积或质量上的光合色素的减少,进而减少了藻体有机物的合成[33](图 2-C,D和图 3-B)。
POD是植物在逆境条件下酶促防御系统的关键酶之一,MDA是植物膜脂过氧化的产物,其含量高低代表了藻体受到的胁迫程度。试验结果显示,芋根江蓠在N/P=10/1的处理组中,其POD活性和MDA质量摩尔浓度最低,表示江蓠在该N/P介质中生长受到的胁迫最小。在高N/P和低N/P处理组中,2个指标均有一定上升,说明江蓠受到了磷胁迫。有研究表明,低磷胁迫和高磷胁迫都会影响光合作用的速率、降低气孔导度[34],这可能与抑制了卡尔文循环的关键酶有关。在胁迫条件下藻体产生了过剩的自由基,诱导了POD酶活性的升高,积累的活性氧诱导了膜脂的过氧化,导致MDA水平的升高。
3.3 不同氮形态对芋根江蓠生长及生化组分的影响
自然海水中无机氮存在的形态主要有NO3--N、NO2--N以及NH4+-N。已有研究发现,3种氮形态以一定比例混合,有利于海藻的生长[35]。试验在总无机氮浓度为192 μmol·L-1下设置了7个不同形态氮比例的处理组。试验结果表明,芋根江蓠在NH4+-N质量分数最高的2个处理组中RGR最高。而当m(NO3--N) : m(NH4+-N) : m(NO2--N)=5 : 1 : 10时NO2--N的质量分数最高,江蓠的生长最慢。这是由于植物吸收、转化氮素是一个耗能的生理过程。从植物吸收、转化氨态氮与硝态氮耗能来看,直接吸收、利用氨态氮可以减少能量消耗,因为每还原1个氨态氮分子,大约消耗15个ATP分子[36],而还原亚硝态氮比硝态氮更消耗能量。因此提供氨态氮的处理要比提供硝态氮和亚硝态氮更有利于藻体生物量的积累。另外,第1组和第2组相比,氨态氮质量分数更高,但这两组处理下的江蓠RGR却没有差别。这可能是由于同化硝态氮的酶是硝酸还原酶(nitrate reductase,NR),其活性一般会随着介质中硝氮质量分数的升高而增强,而植物体内吸收的部分氨态氮是硝态氮被还原后的产物,氨氮对NR既有促进,也有抑制作用[37]。所以当介质中氨态氮的质量分数足够高时,反而抑制了藻体对硝态氮的吸收,不利于促进江蓠生物量的积累。徐永健等[18]的研究结果发现,添加NH4+-N的高氮处理中龙须菜的生长速率略大于添加NO3--N的高氮处理,也大于添加NH4+-N+NO3--N的高氮处理组,与笔者试验结果一致。
相关研究表明,在m(NH4+-N) : m(NO3--N)=2 : 7的营养条件下,细基江蓠繁枝变型有最高的叶绿素a、藻红素及可溶性蛋白质量分数[35]。从笔者试验结果看来,在不同N形态的处理组中,芋根江蓠的叶绿素a、类胡萝卜素和藻红、藻蓝蛋白和可溶性蛋白质量分数都没有很大的差异,这可能是由于各处理组中的总无机氮浓度相同,而3种形态的氮都没有达到抑制色素和及其他有机物合成的浓度,这可以从MDA质量摩尔浓度看出各处理组下芋根江蓠都没有受到明显的胁迫(图 4-F)。而POD活性则在第6组最低,说明最适合芋根江蓠还是更适应在氨氮浓度高的环境中生长。
4. 结论
综上所述,芋根江蓠适宜生长总无机氮浓度为144~240 μmol·L-1,最适总无机氮浓度为192 μmol·L-1,适宜N/P是1~10,最适N/P为10/1。芋根江蓠适宜在NH4+-N比例较高的海水中生长,3种无机氮最适合比值是m(NO3--N) : m(NH4+-N) : m(NO2--N)=1 : 10 : 5和m(NO3--N) : m(NH4+-N) : m(NO2--N)=5 : 10 : 1。在最适宜的环境条件下,藻体具有较高的日RGR,其藻胆蛋白和可溶性蛋白的质量分数最高,POD活性及MDA含量最低,受环境的胁迫最小。从生长状态、光合色素和抗氧化等方面分析,芋根江蓠具有适应高营养盐和高氨态氮环境条件的特性。
-
图 1 不同总无机氮浓度(A)、氮磷比(B)和氮形态(C)对芋根江蓠相对生长速率的影响(n=3)
不同的字母代表不同处理间有显著性差异(P < 0.05),下图同此
Figure 1. Effects of different total inorganic nitrogen concentrations (A), N/P values (B) and forms of nitrogen (C) on relative growth rate of G.blodgettii
Different letters represent significant difference among different treatments (P < 0.05). The same case in the following figures.
-
[1] HARDISON A K, CANUEL E A, ANDERSON I C, et al. Fate of macroalgae in benthic systems: carbon and nitrogen cycling within the microbial community[J]. Mar Ecol Prog Ser, 2010, 414: 41-55. doi: 10.3354/meps08720
[2] HUONG M, FOTEDAR R, FEWTRELL J. Evaluation of Sargassum sp. as a nutrient-sink in an integrated seaweed-prawn (ISP) culture system[J]. Aquaculture, 2010, 310(1/2): 91-98. doi: 10.1016/j.aquaculture.2010.09.010
[3] MARINHO-SORIANO E, PANUCCI R A, CARNEIRO M A A, et al. Evaluation of Gracilaria caudata J. Agardh for bioremediation of nutrients from shrimp farming wastewater[J]. Bioresour Technol, 2009, 100(24): 6192-6198. doi: 10.1016/j.biortech.2009.06.102
[4] 许妍, 董双林, 金秋. 几种大型海藻对赤潮异弯藻生长抑制效应的初步研究[J]. 中国海洋大学学报: 自然科学版, 2005, 35(3): 475-477. doi: 10.3969/j.issn.1672-5174.2005.03.026 [5] 杨宇峰, 费修绠. 大型海藻对富营养化海水养殖区生物修复的研究与展望[J]. 青岛海洋大学学报: 自然科学版, 2003, 33(1): 53-57. doi: 10.3969/j.issn.1672-5174.2003.01.026 [6] YU J, YANG Y F. Physiological and biochemical response of seaweed Gracilaria lemaneiformis to concentration changes of N and P[J]. J Exp Mar Biol Ecol, 2008, 367(2): 142-148. doi: 10.1016/j.jembe.2008.09.009
[7] YANG Y F, FEI X G, SONG J M, et al. Growth of Gracilaria lemaneiformis under different cultivation conditions and its effects on nutrient removal in Chinese coastal waters[J]. Aquaculture, 2006, 254(1/2/3/4): 248-255. doi: 10.1016/j.aquaculture.2005.08.029
[8] 程丽巍, 邹定辉, 刘兆普, 等. 不同N、P水平对龙须菜生长及生理生化特性的影响[J]. 海洋环境科学, 2011, 30(2): 211-215. doi: 10.3969/j.issn.1007-6336.2011.02.014 [9] 许忠能, 林小涛, 林继辉, 等. 营养盐因子对细基江蓠繁枝变种氮、磷吸收速率的影响[J]. 生态学报, 2002, 22(3): 366-374. doi: 10.3321/j.issn:1000-0933.2002.03.012 [10] 刘思俭. 我国江蓠的种类和人工栽培[J]. 湛江海洋大学学报, 2001, 21(3): 71-79. doi: 10.3969/j.issn.1673-9159.2001.03.016 [11] 赵谋明. 江蓠藻的营养学评价[J]. 营养学报, 1997, 19(1): 64-69. doi: 10.3321/j.issn:0512-7955.1997.01.013 [12] 黄中坚, 宋志民, 杨晓, 等. 生态因子对芋根江蓠的生长及生化组分的影响[J]. 南方水产科学, 2014, 10(1): 27-34. doi: 10.3969/j.issn.2095-0780.2014.01.005 [13] PORRA R J. The chequered history of the development and use of simultaneous equations for the accurate determination of chlorophylls a and b[J]. Photosynth Res, 2002, 73(1): 149-156. doi: 10.1007/1-4020-3324-9_56
[14] PARSONS T R, STRICKLAND J D H. Disscussion of spectrophotometric determination of marine plant pigments, with revised equation for ascertaining chlorophylls and carotenoids[J]. J Mar Res, 1963, 21(3): 155-163. https://www.semanticscholar.org/paper/Discussion-of-spectrophotometric-determination-of-Parsons-Strickland/5cce5cee4e7c3ba73055511ba7d25f678e6ecbb4
[15] BEER S, ESHEL A. Determining phycoerythrin and phycocyanin concentrations in aqueous crude extracts of red algae[J]. Aust J Mar Freshw Res, 1985, 36(6): 785-792. doi: 10.1071/MF9850785
[16] 张志良, 瞿伟菁. 植物生理学实验指导[M]. 3版. 北京: 高等教育出版社, 2002: 158-160. [17] DHINDSA R S, PLUMB-DHINDSA P, THORPE T. Leaf senescence: correlated with increase leaves of membrane permeability and lipid peroxidation and decreased levels of superoxide dismutase and catalase[J]. J Exp Bot, 1981, 32(1): 93-101. doi: 10.1093/jxb/32.1.93
[18] 徐永健, 钱鲁闽, 王永胜. 氮素营养对龙须菜生长及色素组成的影响[J]. 台湾海峡, 2006, 25(2): 222-228. doi: 10.3969/j.issn.1000-8160.2006.02.011 [19] 钱鲁闽, 徐永健, 王永胜. 营养盐因子对龙须菜和菊花江蓠氮磷吸收速率的影响[J]. 台湾海峡, 2005, 24(4): 546-552. doi: 10.3969/j.issn.1000-8160.2005.04.020 [20] 刘静雯, 董双林. 光照和温度对细基江蓠繁枝变型的生长及生化组成影响[J]. 青岛海洋大学学报: 自然科学版, 2001, 31(3): 332-338. https://www.cqvip.com/doc/journal/943335791 [21] 刘长发, 张泽宇, 雷衍之. 盐度、光照和营养盐对孔石莼光合作用的影响[J]. 生态学报, 2001, 21(5): 795-798. doi: 10.3321/j.issn:1000-0933.2001.05.016 [22] FRIEDLANDER M, KROM M D, BENAMOTZ A. The effects of light and ammonium on growth, epiphytes and chemical constituents of Gracilaria conferta in outdoor cultures [J]. Bot Mar, 1991, 34(3): 161-166. doi: 10.1515/botm.1991.34.3.161
[23] 梁艳荣, 胡晓红, 张颍力. 植物过氧化物酶生理功能研究进展[J]. 内蒙古农业大学学报, 2003, 24(2): 110-113. doi: 10.3969/j.issn.1009-3575.2003.02.026 [24] BLOKHINA O, VIROLAINEN E, FAGERSTEDT K V. Antioxidants, oxidative damage and oxygen deprivation stress: a review[J]. Anna Bot, 2003, 91(2): 179-194. doi: 10.1093/aob/mcf118
[25] 鹿宁, 臧晓南, 张学成, 等. 高温胁迫下不同龙须菜品系抗氧化能力的比较[J]. 武汉大学学报: 理学版, 2010, 56(5): 570-577. https://www.cqvip.com/doc/journal/971054116 [26] OYAMA H, KITADAI Y, KADOWAKI S. Production of cultured Laminaria japonica and its nitrogen and phosphate uptake in a coastal fish farm Yatsushiro Sea[J]. Mem Fac Fish Kagoshima Univ, 2005, 54: 29-34. https://www.semanticscholar.org/paper/Production-of-Cultured-Laminaria-japonica-and-its-a-Ohyama-Kitadai/6a47d0d231e527f6e117f287b2ade4c47ef7ae01
[27] MIZUTA H, OGAWA S, YASUI H. Phosphorus requirement of the sporophyte of Laminaria japonica (Phaeophyceae)[J]. Aquat Bot, 2003, 76(2): 117-126. doi: 10.1016/S0304-3770(03)00034-2
[28] GAO K S, KELTON R M. Use of macroalgae for marine biomass production and CO2 remediation: a review[J]. J Appl Phycol, 1994, 6(1): 45-60. doi: 10.1007/BF02185904
[29] 李信书, 伏光辉, 陈百尧, 等. 氮、磷加富对条斑紫菜生长及生化组成的影响[J]. 水产科学, 2012, 31(9): 544-548. doi: 10.3969/j.issn.1003-1111.2012.09.008 [30] 王芳, 刘鹏, 朱靖文. 镁对大豆根系活力叶绿素含量和膜质透性的影响[J]. 农业环境科学报, 2004, 23(2): 235-239. doi: 10.3321/j.issn:1672-2043.2004.02.008 [31] 董树亭. 高产小麦群体光合能力与产量关系的研究[J]. 作物学报, 1991, 17(6): 461-496. https://d.wanfangdata.com.cn/periodical/Ch9QZXJpb2RpY2FsQ0hJTmV3UzIwMjQxMTA1MTcxMzA0Eg96dW93eGIxOTkxMDYwMDkaCHJvZndwOWdp [32] 刘建福. 磷胁迫对澳洲坚果幼苗叶片光合作用的影响[J]. 西南师范大学学报, 2007, 32(2): 45-48. doi: 10.3969/j.issn.1000-5471.2007.02.011 [33] 陈钰, 郭爱花. 不同磷胁迫对韭菜光合色素的影响[J]. 天津农业科学, 2008, 14(6): 25-27. doi: 10.3969/j.issn.1006-6500.2008.06.009 [34] 林郑和, 陈荣冰, 陈常颂. 植物对氮胁迫的生理适应机制研究进展[J]. 湖北农业科学, 2011, 50(23): 4761-4764. doi: 10.3969/j.issn.0439-8114.2011.23.003 [35] 黄鹤忠, 孙菊燕, 申华. 无机氮浓度及其配比对细基江蓠繁枝变型生长及生化组成的影响[J]. 海洋科学, 2010, 30(9): 23-27. doi: 10.3969/j.issn.1000-3096.2006.09.005 [36] 曹翠玲, 李生秀. 氮素形态对作物生理特性及生长的影响[J]. 华中农业大学学报, 2004, 23(5): 581-586. doi: 10.3321/j.issn:1000-2421.2004.05.025 [37] 李彩凤, 马凤鸣, 赵越. 氮素形态对甜菜氮糖代谢关键酶活性及相关产物的影响[J]. 作物学报, 2003, 29(1): 128-132. doi: 10.3321/j.issn:0496-3490.2003.01.023 -
期刊类型引用(9)
1. 杜欣欣,刘福利,袁艳敏,梁洲瑞,张朋艳,刘升平. 极北海带幼苗对氮、磷和铁营养元素需求的研究. 水产科学. 2021(01): 81-88 .  百度学术
百度学术
2. 袁艳敏,刘福利,梁洲瑞,王潇. 氮营养盐对极北海带幼苗生长和生理生化特性的影响. 水产科学. 2021(02): 203-209 .  百度学术
百度学术
3. 吴翔宇,黄良夫,杨守国,曾俊,邢诒炫. 芋根江蓠对对虾养殖水体氮磷的去除效果. 现代农业科技. 2021(08): 178-179 .  百度学术
百度学术
4. 曾俊,童立豪,吴翔宇,黄敏,唐贤明. 不同营养盐条件对琼枝生长的影响. 渔业科学进展. 2021(04): 168-176 .  百度学术
百度学术
5. 叶鹏浩,韩婷婷,付贵权,谷阳光,黄洪辉. 半叶马尾藻对重金属镉胁迫的生理响应. 南方水产科学. 2019(05): 35-40 .  本站查看
本站查看
6. 韩婷婷,齐占会,黄洪辉,梁庆洋. 3种氮源加富对半叶马尾藻幼苗生长和生化组成的影响. 渔业科学进展. 2018(04): 159-166 .  百度学术
百度学术
7. 张文文,郭永坚,李俊伟,朱长波,陈素文,颉晓勇. 营养盐对海萝生长和藻体生化成分的影响. 南方水产科学. 2016(02): 30-35 .  本站查看
本站查看
8. 王云祥,李正,秦传新,陈丕茂,袁华荣,周文礼. 不同季节江蓠脱落物对大型海藻场上覆水的影响. 南方水产科学. 2016(02): 13-20 .  本站查看
本站查看
9. 戴晓玲,李文红,章增林,庞洋洋,黄柳琪. 芋根江蓠和异枝江蓠早期腐解过程及其氮磷释放规律的研究. 上海海洋大学学报. 2016(04): 582-590 .  百度学术
百度学术
其他类型引用(8)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
