Construction of lentiviral vector for overexpression of Penaeus monodon Cyclin B and its influence on Hela cells proliferation
-
摘要:
细胞周期蛋白B(Cyclin B)是影响卵母细胞发育成熟的重要基因。文章构建了PmCyB慢病毒表达载体,并和慢病毒包装复合物在293T细胞中包装成慢病毒颗粒。利用包装好的慢病毒颗粒,感染干扰了Cyclin B1基因的Hela细胞,研究了PmCyB对Hela细胞增殖的影响。结果表明,通过siRNA干扰细胞自身的Cyclin B1后,转染对照组病毒液的Hela细胞增殖减缓;同时,干扰后转入含有PmCyB重组慢病毒表达载体,Hela细胞增殖速度明显要高于转染对照组病毒液的Hela细胞的增殖速度。这一结果表明,PmCyB基因的过表达能补偿Cyclin B1缺失导致的细胞增殖减缓的现象,说明PmCyB基因具有细胞周期调控功能,是细胞增殖与分化的重要调控基因,且功能可能与人类的Cyclin B1相似。人类的Cyclin B1是卵母细胞发育成熟的重要基因。由此可以推断,PmCyB基因可能对斑节对虾(Penaeus monodon)卵巢发育成熟起着重要作用。
Abstract:Cyclin B plays an important role in oocyte development. The recombinant lentiviral vector of Penaeus monodon Cyclin B (PmCyB) was constructed. The recombinant lentiviral vector plasmid and Packaging Plasmid Mix were co-transfected into 293T cells to obtain recombinant lentivirus.After Cyclin B1 of Hela cells was interfered with siRNA, the recombinant lentivirus was transfected into these cells and its influence on the Hela cells proliferation was researched. The results show that Hela cells proliferation slowed down after siRNA interference, but renewed after being transfected by the packaged lentivirus particles containing PmCyB, which indicates that PmCyB gene has cell cycle activity and is important for regulation of cell proliferation and differentiation gene. The results also suggest that PmCyB might play an important role in ovarian development, as same as Homo sapiense Cyclin B1 which is an ovarian development essential gene.
-
Keywords:
- Penaeus monodon /
- cyclin B /
- lentiviral vector /
- cell proliferation
-
斑节对虾(Penaeus monodon)是中国重要对虾养殖种类。由于对其调控繁殖的机理、特别是卵母细胞发育成熟的分子调控机制尚未明确,切除眼柄仍是斑节对虾亲虾催熟的主要手段,但该方法不利于亲虾重复使用,增加了斑节对虾苗种培育的成本。因此,研究斑节对虾卵巢发育相关的分子调控机理,对于阐明斑节对虾卵巢发育调控机制、开发新的有效的催熟技术具有重要意义。
近年来,人们越来越重视卵母细胞发育成熟的分子调控,相继在脊椎和部分无脊椎动物中开展了研究,如哺乳类[1]、两栖类[2-4]、鱼类[5-8]及海星[9]。经研究发现,卵母细胞的发育与成熟需要细胞内各信号通路的协同调控,其中Mos/MAP通路与plx1/cdc25/cyclinB-P34cdc2通路是孕酮诱导下启动卵母细胞成熟的中心环节,且细胞周期蛋白B(Cyclin B)及其相关调控蛋白cdc25等起了关键性的作用[10]。
Cyclin B又称周期素B,在G2期或G2/M转变期发挥着重要的作用。催化亚基P34cdc2和Cyclin B结合,组成物种间高度保守的刺激因子MPF(cyclinB-P34cdc2),在卵母细胞减数分裂过程中起中心调控作用。在甲壳动物中,对于卵巢发育的分子调控机理尤其是卵母细胞成熟的分子调控机制还知之甚少。目前也仅限于Cyclin B基因克隆及mRNA水平表达的研究,如斑马纹贻贝(Dreissena polymorpha)[11]、中华绒螯蟹(Eriocheir sinensis)[12]、日本囊对虾(Marsupenaeus japonicus)[13]、斑节对虾[14-15]等。因此,对于Cyclin B在甲壳动物卵巢发育中调控卵母细胞成熟的作用机制还有待深入研究。研究发现,Cyclin B基因存在多个亚型,且不同亚型在卵巢发育过程中发挥不同作用[16-21]。已报道的斑节对虾Cycling B[14-15]基因与人类的细胞周期蛋白B1(Cyclin B1)具有较高的同源性,达到60%。Cyclin B1为有丝分裂期(M期)细胞周期蛋白,是成熟促进因子(maturation promoting factor,MPF)的调节亚单位,含有一段约100个氨基酸的保守序列,介导其与MPF的催化亚单位——细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK1)结合,CDK1只有与Cyclin B1结合才具有激酶的活性,CDK1/Cyclin B1即MPF在G晚期积聚,其生物学功能为启动真核细胞有丝分裂[22]。因此,文章拟通过构建含有PmCyB基因的重组慢病毒载体,研究其对干扰了Cyclin B1基因的人类Hela细胞增殖影响,为斑节对虾卵巢发育的分子调控机理提供一定的基础数据。
1. 材料与方法
1.1 材料
XbaI和BstBI等内切酶购置于NEB公司;Kod plus、T4 ligase以及DNA Marker均购置于takara;质粒抽提试剂盒、胶回收试剂盒购置于天根;293T细胞和Hela细胞购置于ATCC;lipeofectamine-2000、无血清DMEM培养基和细胞总RNA提取和RT-PCR试剂盒购置于英俊公司;MTT和DMSO均购置于sigma;慢病毒表达载体质粒pEGH及慢病毒包装复合物购置于思路迪生物技术有限公司;人类(Homo sapiens)Cyclin B1 siRNA(Mir1-4 siRNA)及阴性对照siRNA(NC siRNA)序列由上海生物工程公司设计并合成,其中NC siRNA合成时含有红色荧光标记。Mir1 siRNA正义链序列为5′-TAACAAAGTCAGTGAACAA-3′,Mir2 siRNA正义链序列为5′-GGATAATGGTGAATGGACA-3′,Mir3 siRNA正义链序列为5′-AGAATGTAGTCATGGTAAA-3′,Mir4 siRNA正义链序列为5′-GTGAACAACTGCAGGCCAA-3′,NC siRNA正义链序列为5′-AATTCTCCGAACGTGTCACGT-3′。
1.2 方法
1.2.1 p3D-LV-OE-018EGH-CopGFP-PmCyB慢病毒质粒的构建及鉴定
根据GenBank中斑节对虾Cyclin B的mRNA序列(EF015589),以斑节对虾未成熟卵巢cDNA为模版,用PCR法扩增获得PmCyB基因。对扩增出的PmCyB和p3D-LV-OE-018EGH-CopGFP用XbaI,BstBI进行双酶切,胶回收、连接并转化到感受态细菌中。挑选阳性克隆送英俊公司进行测序。
1.2.2 慢病毒包装
把构建好的慢病毒表达载体与慢病毒包装复合物质粒共转染293T细胞。转染前一天胰酶消化处于对数生长期生长状态良好的293T细胞,以合适比例接种至若干个100 mm细胞培养皿内。细胞接种24 h后按lipeofectamine-2000的说明书进行转染操作,把慢病毒表达质粒及慢病毒包装复合物共转染到293T细胞中。48 h后收取上清病毒液,再加细胞培养液培养24 h后收取上清病毒液。纯化后测定病毒滴度(根据GFP荧光表达情况,病毒滴度等于带有荧光的细胞数除以病毒原液量)。
1.2.3 重组慢病毒感染目的细胞
胰酶消化处于对数生长期生长状态良好的Hela细胞,以合适比例接种至96孔细胞培养板中进行培养,37 ℃,5%二氧化碳(CO2)。细胞接种24 h后分别用4个干扰组Mir1-4siRNA和对照组NC siRNA分别转染Hela细胞,沉默Cyclin B1基因。4 h后荧光显微镜下观察,是否转染入Hela细胞,换液。细胞转染24 h后取样,利用RT-PCR检测干扰效果。同时在4个试验组和对照组分别感染上述收集的含PmCyB基因病毒液及阴性对照病毒液,每孔加100 μL病毒粗液。感染后24 h,换液。培养72 h后进行四甲基偶氮唑盐比色法(MTT法)检测细胞浓度。
1.2.4 统计学分析
应用SPSS 13.0统计软件处理数据,两样本率的比较采用χ2检验,组间差异比较用方差分析,P < 0.05为有统计学意义。
2. 结果
2.1 PmCyB重组慢病毒表达载体的构建与鉴定
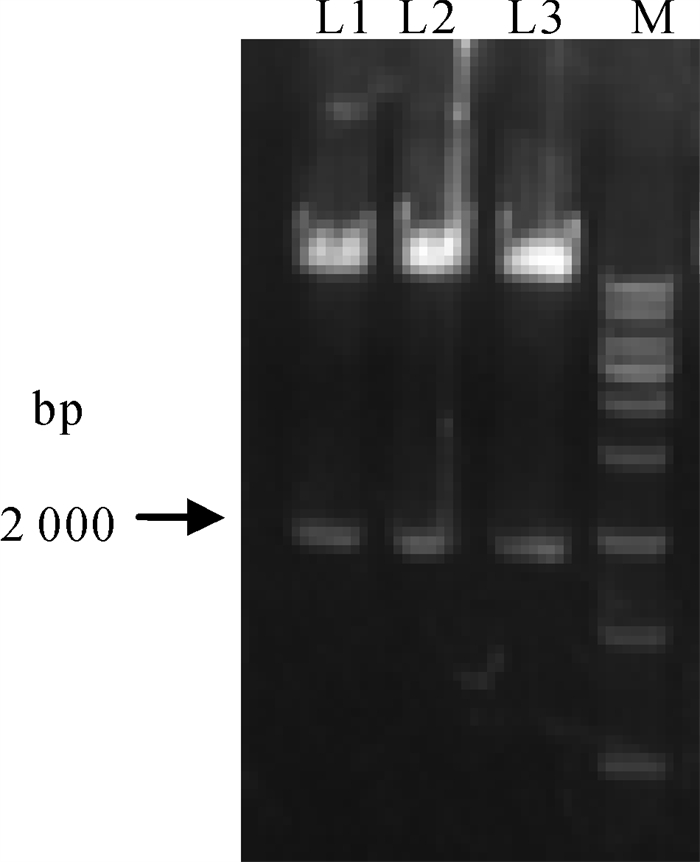
将PCR扩增获得的PmCyB基因和p3D-LV-OE-018EGH-CopGFP载体酶切、连接、转化,挑克隆进行PCR鉴定。PCR鉴定阳性克隆再用XbaI,BstBI进行双酶切鉴定,酶切鉴定阳性者可在2 000 bp处见一特异条带(图 1)。此外,PCR鉴定阳性克隆送测序,测序结果显示PmCyB基因序列与GenBank中序列一致,无缺失或突变。以上结果表明,p3D-LV-OE-018EGH-CopGFP-PmCyB慢病毒表达载体构建成功。
2.2 重组慢病毒p3D-LV-OE-018EGH-CopGFP-PmCyB的包装
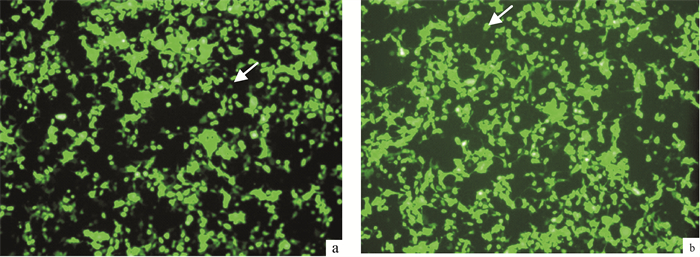
把构建好的慢病毒表达载体与慢病毒包装复合物质粒共转染293T细胞,转染24h后倒置荧光显微镜观察培养细胞可见大量的绿色荧光蛋白的表达(图 2),转染效率将近100%。收集并浓缩病毒液,得到含有PmCyB基因的病毒液和空白对照病毒液。
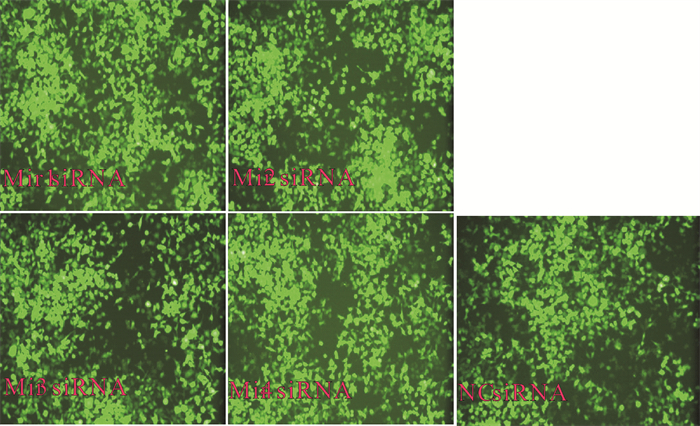
2.3 对照组NC siRNA检测Cyclin B1 siRNA转染Hela细胞效果
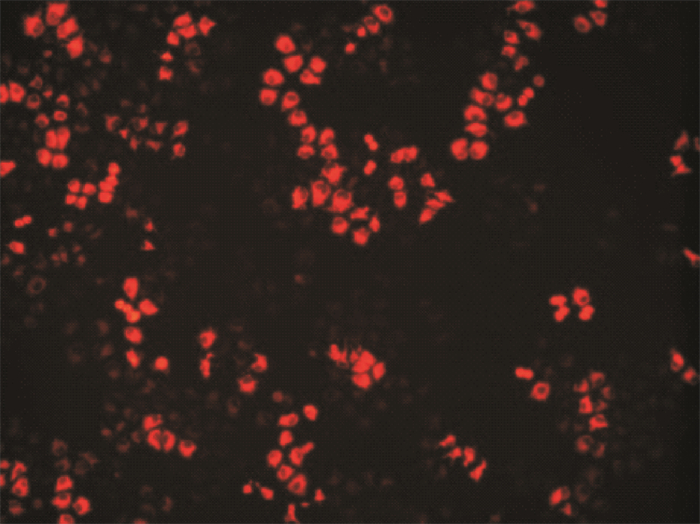
对照组NC siRNA转染进入细胞24 h后,荧光镜检Hela细胞可见散在分布于细胞中的颗粒状红色荧光,证实siRNA成功转染了Hela细胞(图 3)。
2.4 Cyclin B1 siRNA对Hela细胞其mRNA表达水平的影响
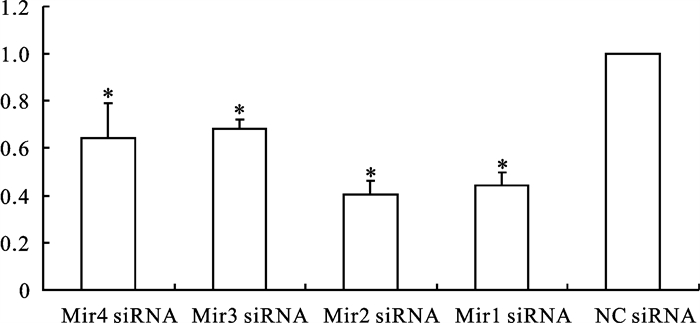
4个干扰组Mir1-4siRNA和对照组NC siRNA分别转染Hela细胞24 h后,经实时荧光定量PCR检测发现4个干扰组的Hela细胞Cyclin B1 mRNA表达量与阴性对照组之间差异显著(P < 0.05)(图 4),结果表明4个干扰组的Hela细胞Cyclin B1的表达显著下调。
2.5 PmCyB基因对干扰了内源Cyclin B1的Hela细胞增殖的影响
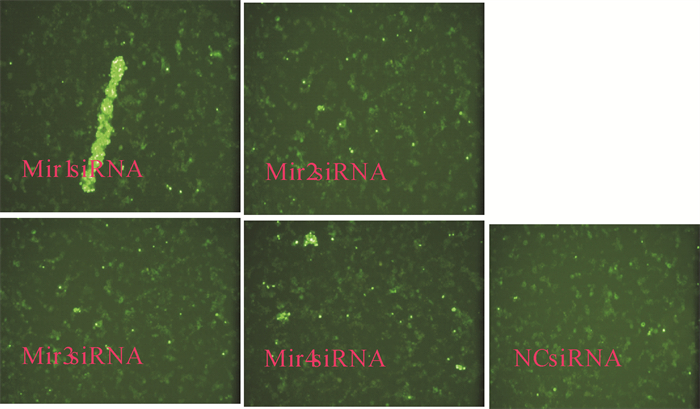
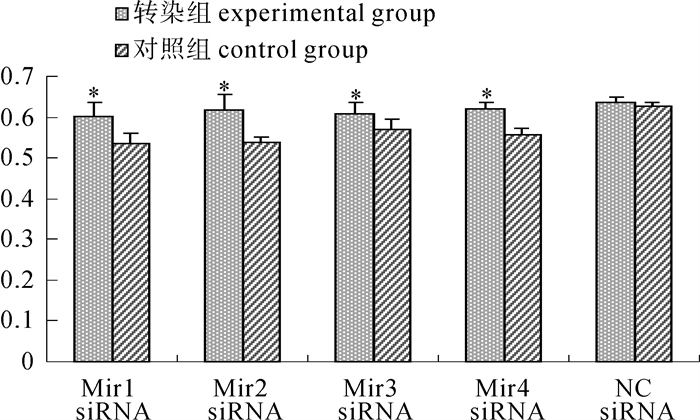
转染了Mir1-4siRNA以及NC siRNA的4个干扰组和1个对照组Hela细胞24 h后,再把含PmCyB基因的慢病毒液和对照组病毒液分别感染4个干扰组和对照组Hela细胞。24 h后荧光镜检Hela细胞,显示绿色荧光,表明慢病毒液成功感染了Hela细胞(图 5,图 6)。转染病毒液72 h后用MTT比色法检测Hela细胞增殖情况,结果显示感染了含有PmCyB基因慢毒液的4个干扰组的Hela细胞增殖速度虽然略低于NC对照组的细胞,但显著高于转染了对照病毒液的4个干扰组的细胞增殖速度(表 1,表 2,图 7)。
表 1 四唑盐比色法检测转染对照组病毒液72 h后不同试验组Hela细胞的光密度Table 1 Optical density of experimental groups′ Hela cells with transfection control lentivirus liquid after 72 h by MTT method试验组别 experimental group 光密度 optical density Mir1 siRNA组 Mir1 siRNA group 0.511 0.537 0.559 Mir2 siRNA组 Mir2 siRNA group 0.526 0.539 0.550 Mir3 siRNA组 Mir3 siRNA group 0.570 0.595 0.547 Mir4 siRNA组 Mir4 siRNA group 0.544 0.556 0.576 NC siRNA组 NC siRNA group 0.625 0.615 0.637 表 2 四唑盐比色法检测转染含PmCyB基因的病毒液72 h后不同试验组Hela细胞的光密度Table 2 Optical density of experimental groups′ Hela cells with transfection recombinant lentivirus liquid after 72 h by MTT method试验组别 experimental group 光密度 optical density Mir1 siRNA组 Mir1 siRNA group 0.637 0.572 0.599 Mir2 siRNA组 Mir2 siRNA group 0.656 0.581 0.614 Mir3 siRNA组 Mir3 siRNA group 0.637 0.606 0.581 Mir4 siRNA组 Mir4 siRNA group 0.637 0.618 0.604 NC siRNA组 NC siRNA group 0.639 0.626 0.647 3. 讨论
病毒载体比非病毒载体转染效率高,是应用最为普遍的基因转移工具[23-26]。目前可供利用的病毒可分为逆转录病毒、慢病毒与腺病毒。与其他病毒载体相比,慢病毒载体最大的特点就是强大的穿透性[27]。慢病毒属于逆转录病毒,可将其携带的外源基因高效整合到宿主细胞中,且外源基因可在细胞内长期稳定表达。文章成功构建了PmCyB慢病毒表达载体,即p3D-LV-OE-018EGH-CopGFP-PmCyB。该载体含有GFP报告基因,具有很强的实用性,同时GFP报告基因以加强型真核启动子hEF1-HTLV启动子启动,其表达效率高,观察结果方便快捷,为后续研究,尤其是为研究PmCyB基因过表达对斑节对虾卵巢发育分子调控的作用机理研究奠定基础。
文章通过构建PmCyB慢病毒表达载体,研究了其对Hela细胞增殖的影响。结果表明,Cyclin B1被siRNA干扰后,Hela细胞增值减缓,不过PmCyB基因的过表达能补偿Cyclin B1缺失导致的细胞增殖减缓的现象,说明笔者克隆得到的PmCyB基因具有细胞周期调控功能,且作用可能与人类的Cyclin B1基因一样。Cyclin B1作为激酶CDC2的调节亚基,与CDC2形成活性复合物即细胞促分裂因子(mitosis-promoting factor,MPF),主要参与G2/M期转变的调节[28-29]。在卵母细胞发生过程中发生G2/M转变对卵母细胞发育成熟至关重要[10]。因此,Cyclin B1是卵母细胞发育成熟重要基因,由此可以推断,PmCyB也可能在斑节对虾卵巢发育成熟中起着重要的调控作用。该基因如何调控斑节对虾卵母细胞发育成熟还需更进一步的深入研究。
-
表 1 四唑盐比色法检测转染对照组病毒液72 h后不同试验组Hela细胞的光密度
Table 1 Optical density of experimental groups′ Hela cells with transfection control lentivirus liquid after 72 h by MTT method
试验组别 experimental group 光密度 optical density Mir1 siRNA组 Mir1 siRNA group 0.511 0.537 0.559 Mir2 siRNA组 Mir2 siRNA group 0.526 0.539 0.550 Mir3 siRNA组 Mir3 siRNA group 0.570 0.595 0.547 Mir4 siRNA组 Mir4 siRNA group 0.544 0.556 0.576 NC siRNA组 NC siRNA group 0.625 0.615 0.637 表 2 四唑盐比色法检测转染含PmCyB基因的病毒液72 h后不同试验组Hela细胞的光密度
Table 2 Optical density of experimental groups′ Hela cells with transfection recombinant lentivirus liquid after 72 h by MTT method
试验组别 experimental group 光密度 optical density Mir1 siRNA组 Mir1 siRNA group 0.637 0.572 0.599 Mir2 siRNA组 Mir2 siRNA group 0.656 0.581 0.614 Mir3 siRNA组 Mir3 siRNA group 0.637 0.606 0.581 Mir4 siRNA组 Mir4 siRNA group 0.637 0.618 0.604 NC siRNA组 NC siRNA group 0.639 0.626 0.647 -
[1] MEHLMANN L M. Stops and starts in mammalian oocytes: recent advances in understanding the regulation of meiotic arrest and oocyte maturation[J]. Reproduction, 2005, 130(3): 791-799. https://xueshu.baidu.com/usercenter/paper/show?paperid=1g0a02104p5e0gj09e3w0xn06g687475&site=xueshu_se
[2] MALLER J L, KREBS E G. Regulation of oocyte maturation[J]. Curr Top Cell Regul, 1980, 16(2): 271-311. doi: 10.1111/j.1440-169X.2008.01019.x
[3] MASUI Y, CLARKE H J. Oocyte maturation[J]. Int Rev Cytol, 1979, 57(1): 185-282. https://academic.oup.com/humupd/article/21/4/427/683343
[4] HAMMES S R. Steroids and oocyte maturation: a new look at an old story[J]. Mol Endocrinol, 2004, 18(4): 769-775. https://academic.oup.com/mend/article/18/4/769/2747572
[5] NAGAHAMA Y. Endocrine regulation of gametogenesis in fish[J]. Int J Dev Biol, 1994, 38(2): 217-229. doi: 10.1016/0141-8130(94)90045-0
[6] NAGAHAMA Y. 17a, 20b-Dihydroxy-4-pregnen-3-one, a maturation-inducing hormone in fish oocytes: mechanisms of synthesis and action[J]. Steroids, 1997, 62(2): 190-196. doi: 10.1016/S0039-128X(96)00180-8
[7] THOMAS P. Hormonal control of final oocyte maturation in sciaenid fishes[M]//DAVEY K G, PETER R E, TOBE S S. Perspectives in comparative endocrinology. Ottawa: National Research Council of Canada, 1994: 619-625.
[8] OZAKI Y, SAITO K, SHINYA M, et al. Evaluation of Sycp3, Plzf and Cyclin B3 expression and suitability as spermatogonia and spermatocyte markers in zebrafish[J]. Gene Exp Patterns, 2011, 11(5/6): 309-315. https://www.sciencedirect.com/science/article/pii/S1567133X11000275
[9] KISHIMOTO T. Activation of MPF at meiosis reinitiation in starfish oocytes[J]. Dev Biol, 1999, 214(1): 1-8. https://www.sciencedirect.com/science/article/pii/S0012160699993934
[10] 孟艳, 刘嘉茵, 王淑玉. 细胞周期蛋白及相关蛋白因子在卵母细胞成熟过程中的调控网络[J]. 国外医学生理病理科学与临床分册, 2004, 24(3): 267-270. doi: 10.3969/j.issn.1673-2588.2004.03.021 [11] LAMERS A E, HEINEY J P, RAM J L. Cloning and sequence analysis of two cDNAs encoding cyclin A and cyclin B in the zebra mussel Dreissena polymorpha[J]. Biochim Biophys Acta, 1999, 1448(3): 519-524. https://www.sciencedirect.com/science/article/pii/S0167488998001682
[12] FANG J J, QIU G F. Molecular cloning of cyclin B transcript with an unusually long 30 untranslation region and its expression analysis during oogenesis in the Chinese mitten crab, Eriocheir sinensis[J]. Mol Biol Rep, 2009, 36(6): 1521-1529. doi: 10.1007/s11033-008-9346-9
[13] QIU G F, YAMANO K. Three forms of cyclin B transcripts in the ovary of the kuruma prawn Marsupenaeus japonicus: their molecular characterizations and expression profiles during oogenesis[J]. Comp Biochem Physiol B, 2005, 141(2): 186-195. https://www.sciencedirect.com/science/article/pii/S1096495905000692
[14] QIU L H, JIANG S G, ZHOU F L, et al. Molecular cloning and characterization of a cyclin B gene on the ovarian maturation stage of black tiger shrimp (Penaeus monodon)[J]. Mol Biol Rep, 2007(Epub ahead of print). doi: 10.1007/s11033-006-9052-4
[15] VISUDTIPHOLE V, KLINBUNGA S, KIRTIKARA K. Molecular characterization and expression profiles of cyclin A and cyclin B during ovarian development of the giant tiger shrimp Penaeus monodon[J]. Comp Biochem Physiol A, 2009, 152(4): 535-543. doi: 10.1016/j.cbpa.2008.12.011
[16] JACKMAN M, FIRTH M, PINES J. Human cyclin B1 and B2 are localized to strikingly different structures: B1 to microtu-bules, B2 primarily to the Golgi apparatus[J]. EMBO J, 1995, 14(8): 1646-1654. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC398257/
[17] IHARA J, YOSHIDA N, TANAKA T, et al. Either cyclin B1 or B2 is necessary and sufficient for inducing germinal vesicle breakdown during frog (Rena japonica) oocyte maturation[J]. Mol Reprod Dev, 1998, 50(2): 499-509. https://pubmed.ncbi.nlm.nih.gov/9669534/
[18] MINSHULL J, BLOW J J, HUNT T. Translation of cyclin mRNA is necessary for extracts of activated Xenopus eggs to enter mitosis[J]. Cell, 1989, 56(6): 947-956. https://www.sciencedirect.com/science/article/pii/0092867489906284
[19] CHAPMAN D, WOLGEMUTH D. Identification of a mouse B-type cyclin which exhibits developmentally regulated expression in the germ line[J]. Mol Reprod Dev, 1992, 33(3): 259-269. https://ntrs.nasa.gov/search.jsp?R=20050000586
[20] GALLANT P, NIGG E A. Identification of a novel vertebrate cyclin: cyclin B3 shares properties with both A- and B-type cyclins[J]. EMBO J, 1994, 13(3): 595-605. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC394849/
[21] GAO C Y, ZELENKA P S. Cyclins, cyclin-dependent kinases and differentiation[J]. Bio Essays, 1997, 19(4): 307-315. https://pubmed.ncbi.nlm.nih.gov/9136628/
[22] 李洁, 陈平, 胡火珍. 正、反义全长腺病毒载体的构建及对细胞增殖和凋亡的影响[J]. 四川大学学报: 医学版, 2009, 40(5): 765-769. doi: 10.3969/j.issn.1672-173X.2009.05.001 [23] CHUMAKOV S P, KRAVCHENKO J E, PRASSOLOV V S, et al. Effcient downregulation of multiple mRNA targets with a single shRNA: expressing lentiviral vector[J]. Plasmid, 2010, 63(3): 143-149. https://pubmed.ncbi.nlm.nih.gov/20064551/
[24] 沈媛, 彭辉, 冯敏, 等. 构建/非病毒载体介导高效基因传递的研究[J]. 中山大学学报: 自然科学版, 2009, 48(5): 91-96. doi: 10.3321/j.issn:0529-6579.2009.05.019 [25] KEEN J E, HUNGERFORD L L, LITYLEDIKE E T, et al. Effect of ewe ovine lentivirus infection on ewe and lamb productivity[J]. Prev Vet Med, 1997, 30(2): 155-169. https://www.sciencedirect.com/science/article/pii/S0167587796011014
[26] 钟建辉, 银巍, 藏林泉, 等. 腺病毒载体介导的大鼠多聚酶β重组体的构建及其在细胞中的表达[J]. 中山大学学报: 医学科学版, 2005, 6(26): 622-625. doi: 10.3321/j.issn:1672-3554.2005.06.005 [27] AZZOUZ M, KINGSMAN M, MAZARAKIS N D. Lentiviral vectors for treating andmodeling human CNS disorders[J]. J Gene Med, 2004, 6(9): 951-962. doi: 10.1002/jgm.600
[28] 赵春玲, 宋咏梅, 樊飞跃, 等. 细胞周期蛋白cyclin B1与肿瘤[J]. 肿瘤, 2007, 27(4): 322-326. doi: 10.3781/j.issn.1000-7431.2007.04.018 [29] 王璐, 封全灵, 史惠蓉. 细胞周期蛋白B1在卵巢癌中的研究进展[J]. 国际妇产科学杂志, 2008, 35(1): 44-46. doi: 10.3969/j.issn.1674-1870.2008.01.015 -
期刊类型引用(1)
1. 李运东, 周发林, 黄建华, 马振华, 杨其彬, 邱丽华, 傅明骏, 陈劲松, 江世贵. 斑节对虾组织蛋白酶L基因的克隆及其表达分析. 南方水产科学. 2016(03): 58-66 .  本站查看
本站查看
其他类型引用(0)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
