Formation and variation of heterocyclic amines in grass carp (Ctenopharyngodon idellus) surimi products by different cooking methods
-
摘要:
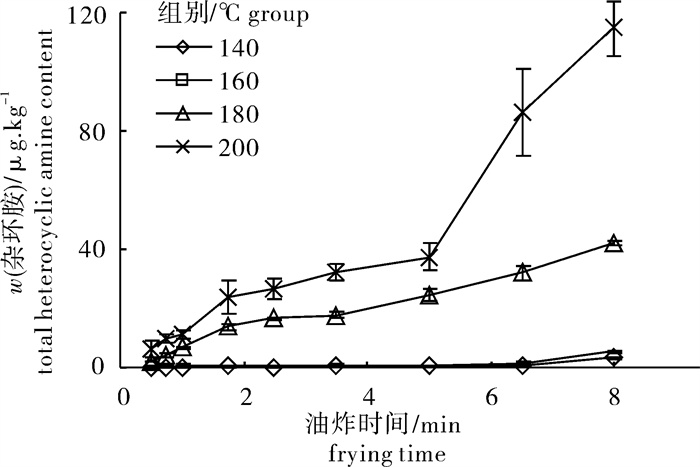
文章研究了草鱼(Ctenopharyngodon idellus)鱼糜制品在水煮、200 ℃烘烤和140~200 ℃油炸条件下杂环胺的变化,并初步探讨了杂环胺形成机制。11种杂环胺的质量分数采用超高效液相色谱-电喷雾串联质谱法进行测定。结果表明杂环胺的种类和生成速率与加工方式有关。水煮方式下仅检出2种杂环胺,第60分钟时总量为1.78 μg · kg-1;200 ℃烘烤方式下检出9种杂环胺,第30分钟时总量为75.78 μg · kg-1;200 ℃油炸方式检出9种杂环胺,第8分钟时总量高达115.11 μg · kg-1。在140~200 ℃油炸温度下杂环胺的质量分数随着油炸时间和温度的增加而显著增大(P < 0.05), 生成杂环胺的种类也有所增加。
Abstract:We investigated the effect of different cooking methods on variation of heterocyclic amines in grass carp (Ctenopharyngodon idellus) surimi products and discussed their formation mechanism. With ultra-high performance liquid chromatography-electrospray tandem mass spectrometry, we detected the contents of 11 kinds of heterocyclic amines. Results reveal that types of heterocyclic amines and their formation rate were related with cooking methods. Only two kinds of heterocyclic amines were detected, with 1.78 μg · kg-1 at the 60th minute by boiling method; nine kinds of heterocyclic amines were detected, with 75.78 μg · kg-1 at the 30th minute by 200 ℃ baking method; nine kinds of heterocyclic amines were detected, with 115.11 μg · kg-1 at the 8th minute by 200 ℃ frying method. At frying temperature of 100~200 ℃, the types and contents of heterocyclic amines increased significantly with increase of frying temperature and time.
-
Keywords:
- heterocyclic amine /
- cooking method /
- grass carp surimi product
-
软体动物缺乏获得性免疫系统,完全依赖非特异性免疫防御反应来阻止病原入侵。抗菌肽(AMPs)是先天免疫系统的主要成分,构成了宿主抵抗病原体感染的第一道防线[1-2]。迄今为止,已超过40种软体动物AMPs收录于Antimicrobial Sequences Database (http://aps.unmc.edu/AP/main.php)。在海洋贝类中,AMPs可以直接结合并破坏菌膜从而杀死入侵的细菌[3]。目前,已经从贝类中鉴定出多种AMPs,包括防御素(defensins)、大防御素(big defensins)、贻贝素(mytilins)、贻贝肽(myticins)、贻贝霉素(mytimycins)和贻贝几丁质结合肽(mytichitins)[4-6]等。AMPs具有广谱杀菌性、不易产生耐药性且热稳性和水溶性好等特点,使其成为抗生素的潜在替代品[7-9]。
在众多AMPs中,防御素是最常见的家族之一。贝类防御素是小的阳离子肽(4~5 kD),存在3个或4个二硫键并具有半胱氨酸稳定的α-螺旋/β-折叠基序(Csαβ)[10]。鉴于半胱氨酸数量的差异,贝类防御素可分为两大类:1) 六半胱氨酸防御素,属于节肢动物和软体动物-6半胱氨酸防御素,包括斑马贻贝(Dreissena polymorpha)[11]、池蝶蚌(Hyriopsis schlegelii)[12]和翡翠贻贝(Perna viridis)[13]等;2) 八半胱氨酸防御素,属于软体动物型-8半胱氨酸防御素,包括花蛤(Venerupis philippinarum)[3]、牡蛎(Crassostrea gigas和Magallana gigas)[14-15]、贻贝(Brachidontes pharaonis)[2]和河蚌(Cristaria plicata)[16]等。虽然这2种类型的防御素在一级结构上有所不同,但都具有相似的广谱抗菌活性。
杂色鲍(Halitotis diversicolor)是一种生活在中国南部沿海的土著品种,具有很高的商业价值。近年来,大规模疾病暴发导致杂色鲍产量逐年下滑。而这些突发事件的发生与哈维弧菌(Vibrio harveyi)[17]的感染有着紧密的关系。因此,了解杂色鲍先天免疫反应的基本知识,是应对和处理类似事件的基础。本研究鉴定和描述了一种新的杂色鲍防御素,研究和讨论了其预测蛋白的3D结构和组织特异性表达模式,同时还研究了哈维弧菌感染后该基因的瞬时表达变化。
1. 材料与方法
1.1 杂色鲍HdDef1的基因克隆
基于杂色鲍RNA-seq数据库中HdDef1的部分cDNA序列,使用SMARTer® RACE 5'/3' 试剂盒(TaKaRa,大连)提供的方法,设计4个基因特异性引物以获得3' 和5' 末端(表1)。巢式引物P1 (外部)和P2 (内部)用于5' RACE,巢式引物P3 (外部)和P4 (内部)用于3' RACE。第一轮PCR反应条件为:94 ℃ 30 s,70 ℃ 3 min,5个循环;94 ℃ 30 s,67 ℃ 30 s,72 ℃ 3 min,5个循环;94 ℃ 30 s,64 ℃ 30 s,72 ℃ 3 min,20个循环。第二轮PCR反应条件为:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 3 min,30个循环;72 ℃ 10 min。最后将PCR产物连接到pMD-18T载体(TaKaRa,大连)中并进行双向测序,通过拼接3' 和5' 末端序列获得HdDef1全长序列。
表 1 实验所用引物序列Table 1. Sequences of primers used in this study引物名称
primer name引物序列 (5'−3')
primer sequence序列信息
sequence informationP1 CATCACCTGCGATCTGCTCTCCTTTA 5' RACE primer out (HdDef1) P2 TTCTGCCTGTGCTGCTAAATGCCTTG 5' RACE primer in (HdDef1) P3 ACAGACACAGACGCCACCATGACAG 3' RACE primer out (HdDef1) P4 GCCATACCGACGATGACAACAACCAAAC 3' RACE primer in (HdDef1) Def-F TGGTTGTTGTCATCGTCGGTAT qRT-PCR primer for HdDef1 Def-R AGTAACAAGGCATTTAGCAGCAC qRT-PCR primer for HdDef1 18S-F ACGCATCTATCAAGTGTCTGCCCTA qRT-PCR primer for 18S 18S-R CTGCTGCCTTCCTTGGATGTGGTAG qRT-PCR primer for 18S 1.2 HdDef1的生物信息学分析
使用BLAST (http://www.ncbi.nlm.nih.gov/blast)和Expert Protein Analysis System (http://www.expasy.org)分析HdDef1的核苷酸和编码的氨基酸序列;使用Simple Modular Architecture Research Tool (http://smart.cmbl-heidelberg.de/)预测信号肽和蛋白质功能结构域;使用APD3 (http://aps.unmc.edu/AP/prediction/prediction_main.php)评估净电荷和疏水比;通过Swiss-model (http://swissmodel.expasy.org/workspace)预测三级结构模型;使用ClustalX程序进行多序列比对;使用MEGA 5.05采用Neighbor-joining (NJ)法构建进化树。
1.3 实验材料、样品采集和感染实验
实验用杂色鲍取自中国水产科学研究院南海水产研究所深圳试验基地,运到实验室后,暂养2周。在此期间,海水水温保持在26 ℃,盐度为30。感染用哈维弧菌为杂色鲍致病菌,由本实验室保存。分别从6只健康鲍中取肠、头、足、外套膜、鳃和肝胰腺,用于HdDef1 mRNA的组织特异性表达分析。在感染实验中,将50 μL (1.6×106 CFU·mL−1)的哈维弧菌稀释液以足部注射方式感染杂色鲍,对照组注射等量的无菌过滤海水(SSW),在感染后的第2、第4、第6、第12、第24、第48和第72小时采集杂色鲍肝胰腺组织,所有采集样品都经过液氮速冻后−80 ℃保存备用。
1.4 RNA提取和cDNA合成
使用TRIzol试剂盒(Invitrogen,Carlsbad,CA,USA)根据说明书从所有收集的组织中提取总RNA。使用NanoDrop 2000 (Thermo Scientific,Waltham,MA,USA)检测RNA含量,通过1%琼脂糖凝胶电泳检查RNA完整性。采用PrimeScriptTM RT试剂盒(TaKaRa,大连),在20 μL反应系统中,以1 μg总RNA合成第一链cDNA。反转录中,选用RNA模板的OD260/OD280均介于1.8和2.0。
1.5 HdDef1表达的荧光定量PCR分析
在LightCycler®480 (Roche Biochemicals, Indianapolis,IN,USA)上使用SYBR® Premix Ex TaqTM II (TaKaRa,大连)试剂盒进行荧光定量分析。选择18S rRNA作为参考基因。实验中使用的相关引物见表1。扩增条件为:95 ℃ 5 min;95 ℃ 5 s,60 ℃ 30 s,40个循环。最后进行扩增产物的溶解曲线分析。所有实验包含3个技术重复和3个生物学重复,采用2−ΔΔCT法[18]获得基因表达量。
1.6 统计分析
数据采用“平均值±标准误(
$\overline X \pm {\rm SEM }$ )”表示。使用SPSS 19.0统计软件对所有数据进行单因素方差分析(ANOVA),显著性差异设置为P<0.05。2. 结果
2.1 目的基因cDNA序列分析
杂色鲍HdDef1 cDNA(GenBank登录号:MK358140)的全长为306 bp,由201 bp的开放阅读框(ORF)、21 bp的5' 非编码区(UTR)和84 bp的3' UTR组成。3' UTR具有典型的多聚腺苷酸加尾信号(AATAAA)和一个多聚A尾。该基因编码66个氨基酸,预测分子量为4.90 kD,理论等电点(pI)为7.82。预测信号肽为N端的1~18个氨基酸,成熟肽中含有6个保守的半胱氨酸残基(图1)。使用APD3软件对HdDef1成熟肽的抗菌特征进行预测,结果显示HdDef1具抗菌肽的特点,如较高的疏水残基比(45%)和净阳性电荷(+1)。
![]() 图 1 HdDef1基因的核苷酸序列和氨基酸序列起始密码子(ATG)和终止密码子(TGA)以红色显示,预测的信号肽使用阴影覆盖,经典的多聚腺苷酸化加尾信号用下划线标示,半胱氨酸残基使用方框标记Figure 1. Nucleotide and deduced amino acid sequences of HdDef1Translation start (ATG) and stop (TGA) codons are highlighted in red. The predicted signal peptide is shaded. The classical polyadenylation signal is underlined. Cysteine residues are boxed.
图 1 HdDef1基因的核苷酸序列和氨基酸序列起始密码子(ATG)和终止密码子(TGA)以红色显示,预测的信号肽使用阴影覆盖,经典的多聚腺苷酸化加尾信号用下划线标示,半胱氨酸残基使用方框标记Figure 1. Nucleotide and deduced amino acid sequences of HdDef1Translation start (ATG) and stop (TGA) codons are highlighted in red. The predicted signal peptide is shaded. The classical polyadenylation signal is underlined. Cysteine residues are boxed.将杂色鲍HdDef1与GenBank中其他软体动物和节肢动物防御素的蛋白序列进行比对时发现,杂色鲍HdDef1与其他品种鲍防御素具有最高的相似性,如日本盘鲍(H. discus discus)、皱纹盘鲍(H. discus hannai)和日本鲍螺(H. madeka),其相似性分别为71.21%、71.21%和72.73%;其次,与来自节肢动物的防御素有较高的相似性,如印度跳蚁(Harpegnathos saltator)、黑腹果蝇(Drosophila melanogaster)和冈比亚按蚊(Anopheles gambiae),其相似性分别为50.04%、32.54%和30.80%;然而,与海洋双壳贝类防御素的相似性较低,与紫贻贝(Mytilus galloprovincialis)防御素1的相似性为11.27%,与长牡蛎外套膜防御素的相似性为15%,与菲律宾蛤仔(Ruditapes philippinarum)防御素的相似性为6%。杂色鲍HdDef1的6个半胱氨酸的位置是保守的,且与节肢动物防御素具有相似的二硫键连接模式(C1-C4、C2-C5和C3-C6,图2)。然而,由于2个额外的半胱氨酸残基的存在,在长牡蛎、菲律宾蛤仔和紫贻贝中形成4个二硫键(C1-C5、C2-C6、C3-C7和C4-C8)。此外,在所有物种的防御素中都检测到一个保守的甘氨酸残基(图2)。由Swiss-model预测的杂色鲍HdDef1 3D结构模型与蛋白质数据库中的冈比亚按蚊防御素(2ny9)相似(图3)。这2种防御素都具有一些相似的结构特征,如都含有1个α-螺旋和2个β-折叠,且3个二硫键位于相似的位置。
![]() 图 2 杂色鲍HdDef1与其他软体动物和节肢动物防御素成熟肽的多序列比对黑色阴影显示相同的氨基酸,灰色阴影显示相似的氨基酸,二硫键桥以黑色连线显示Figure 2. Multiple alignment of mature HdDef1 sequence and other defensins found in mollusks and arthropodThe black shadow shows identical amino acids and the gray indicates similar amino acids. The disulfide linkages are shown with black lines.
图 2 杂色鲍HdDef1与其他软体动物和节肢动物防御素成熟肽的多序列比对黑色阴影显示相同的氨基酸,灰色阴影显示相似的氨基酸,二硫键桥以黑色连线显示Figure 2. Multiple alignment of mature HdDef1 sequence and other defensins found in mollusks and arthropodThe black shadow shows identical amino acids and the gray indicates similar amino acids. The disulfide linkages are shown with black lines.![]() 图 3 杂色鲍HdDef1和冈比亚按蚊防御素结构A. 冈比亚按蚊防御素的3D结构(PDB登录号:2ny9);B. 杂色鲍HdDef1的3D结构;C. 杂色鲍HdDef1和冈比亚按蚊防御素的二级结构;6个半胱氨酸残基的相对位置及3个二硫键(半胱氨酸之间的蓝线)用蓝色标记;相似的结构单元用灰色阴影标记Figure 3. Structures of HdDef1 and A. gambiae defensinA. 3D structure of A. gambiae defensin (PDB accession: 2ny9); B. 3D structure of HdDef1; C. secondary structures of A. gambiae defensin and HdDef1; the relative positions of six cysteine residues and three disulfide bonds (blue lines between cysteines) are labelled in blue and the similar elements of structure are shaded in gray.
图 3 杂色鲍HdDef1和冈比亚按蚊防御素结构A. 冈比亚按蚊防御素的3D结构(PDB登录号:2ny9);B. 杂色鲍HdDef1的3D结构;C. 杂色鲍HdDef1和冈比亚按蚊防御素的二级结构;6个半胱氨酸残基的相对位置及3个二硫键(半胱氨酸之间的蓝线)用蓝色标记;相似的结构单元用灰色阴影标记Figure 3. Structures of HdDef1 and A. gambiae defensinA. 3D structure of A. gambiae defensin (PDB accession: 2ny9); B. 3D structure of HdDef1; C. secondary structures of A. gambiae defensin and HdDef1; the relative positions of six cysteine residues and three disulfide bonds (blue lines between cysteines) are labelled in blue and the similar elements of structure are shaded in gray.使用Mega 5.05将来自软体动物、节肢动物、鱼类和哺乳动物的防御素基于邻接法构建系统发育树(图4)。这些选定的防御素主要分为两大类:无脊椎动物和脊椎动物防御素。在无脊椎动物中,鲍类连同斑马贻贝与节肢动物防御素形成一个分支,而其他双壳贝类防御素形成另一个分支。此外,脊椎动物防御素也分为两大支,分别为鱼类和哺乳动物防御素。
2.2 杂色鲍HdDef1的组织分布
采用qRT-PCR研究了杂色鲍HdDef1的组织分布。在所有组织中都检测到HdDef1的表达,包括肠、头、鳃、足、外套膜和肝胰腺(图5)。HdDef1在肠中的表达量最低;在头、鳃、足和外套膜中的表达量都显著高于肠中的表达量(P<0.05),但在头、鳃、足和外套膜中表达量差异不显著;肝胰腺中具有最高的表达量并显著高于其他组织(P<0.05)。
2.3 病原感染后HdDef1的表达模式
肝胰腺是重要的免疫防御器官,也是HdDef1表达的主要组织,因此本研究检测了杂色鲍经过哈维弧菌感染后,肝胰腺中HdDef1在不同时间点的瞬时表达模式。在感染后的6 h内,HdDef1被诱导表达,且第4和第6小时的表达量显著高于第0小时(P<0.05,图6)。感染后第12小时,HdDef1表达量急剧降低且显著小于第0小时(P<0.05)。之后随着时间的推移,表达量缓慢上调。
3. 讨论
杂色鲍是中国南部沿海地区大规模养殖的经济品种。近年来,由于集约化海水养殖的快速发展和养殖水环境的恶化,增加了杂色鲍对许多病原的易感性(如弧菌属细菌等)。杂色鲍完全依赖于先天免疫,而不具有获得性免疫。因此,亟需掌握杂色鲍先天免疫的基础知识。其中,抗菌肽(AMPs)被认为是海洋无脊椎动物先天免疫系统的主要组成部分[19-21]。在本研究中,通过转录组测序和RACE技术从杂色鲍中克隆了一种新型防御素HdDef1。
目前,贝类防御素主要分为2种类型。1) 含有6个半胱氨酸残基的多肽,多肽中半胱氨酸残基的排列方式为C-X5-16-C-X3-C-X9-10-C-X4-7-C-X1-C,由半胱氨酸形成的二硫键的连接方式为C1-C4、C2-C5和C3-C6;2) 含有8个半胱氨酸残基的多肽,多肽中半胱氨酸残基的排列方式为C-X5-6-C-X3-C-X4-6-C-X3-4-C-X7-8-C-X-C-X2-C,由半胱氨酸形成的二硫键的连接方式为C1-C5、C2-C6、C3-C7和C4-C8[22-23]。此外,贝类防御素还含有3~4个二硫键稳定的一个α-螺旋和反平行的双链β-折叠结构[10, 24]。在本研究中,杂色鲍HdDef1含有6个半胱氨酸残基,形成3个二硫键(C1-C4、C2-C5和C3-C6),并以C-X16-C-X3-C-X9-C-X4-C-X1-C的模式排列。这与日本盘鲍防御素相似,同属于第一种类型[25]。此外,预测3D模型显示杂色鲍HdDef1同样具有1个α-螺旋和两个反平行的β-折叠链。多重比对和系统发育树分析表明,与含有8个半胱氨酸残基的贝类防御素相比,杂色鲍HdDef1更接近节肢动物防御素。同样,在其他含有6个半胱氨酸残基的贝类防御素中也发现了类似现象,包括斑马贻贝[11]和翡翠贻贝[13]等。
由于参与抗菌活动的空间部位不同,贝类防御素具有多种组织表达模式。外套膜是贝类暴露于海洋环境中最多的组织之一,是免疫防御的第一道防线[26-27]。一些贝类的防御素主要分布于该组织中,包括日本盘鲍[25]和长牡蛎[14]。血细胞是无脊椎动物免疫的主要细胞效应物,血细胞可将大量的可溶性抗微生物和细胞毒性物质分泌到血淋巴中。在花蛤中,血细胞为防御素表达的主要组织[3]。在贻贝中,防御素(MGD1和MGD2)仅在血细胞中产生[28]。由于和足丝形成相关,斑马贻贝的防御素主要在足部表达[11]。在本研究中,杂色鲍肝胰腺为表达HdDef1的主要组织,与翡翠贻贝防御素的组织表达分布一致[13]。肝胰腺是一种重要的免疫组织,它可以合成免疫因子,启动免疫体液反应,并含有许多高度特化的细胞和巨噬细胞[29-30],因此HdDef1在肝胰腺中的高表达可能与此有关。
为探讨细菌感染后杂色鲍HdDef1的表达情况,本研究检测了杂色鲍经革兰氏阴性细菌(哈维弧菌)感染后72 h内,肝胰腺中HdDef1的相对表达水平。结果显示,哈维弧菌可显著诱导杂色鲍肝胰腺HdDef1表达。在经过革兰氏阴性菌感染后,斑马贻贝[11]、美洲牡蛎(Crassostrea virginica)[31]和翡翠贻贝[13]的防御素也可被诱导表达。然而,这与长牡蛎的研究结果不同。长牡蛎防御素主要抑制革兰氏阳性菌的生长,而对革兰氏阴性菌的抑制效果有限[32-33]。在注射哈维弧菌后的第6小时,HdDef1 mRNA达到最高表达水平。而翡翠贻贝和菲律宾蛤仔防御素分别在感染后的第24和第12小时具有最高表达[13,34],这可能与物种的生理状态和感染细菌剂量的不同有关。在感染后的第12小时,杂色鲍HdDef1的表达量急剧下降;随后,在第24、第48和第72小时逐渐恢复,此结果与池蝶蚌(Hyriopsis schlegelii)类似[12]。作为防御反应的第一道防线,杂色鲍HdDef1的下调表达可能与病原体的逐步清除有关。随着病原体的持续入侵,有其他细胞因子开始被转录,以增强免疫防御反应,弥补防御素的衰竭。综上,哈维弧菌感染后杂色鲍肝胰腺HdDef1能够被显著诱导表达,但病原体感染后HdDef1的潜在作用机制还需要进一步研究。
-
表 1 杂环胺名称与缩写
Table 1 Names and abbreviations of heterocyclic amines
序号No. 中文名称Chinese name 英文名称English name 缩写abbreviation 1 2-氨基-3-甲基咪唑并[4,5-f]喹啉 2-amino-3-methylimidazo[4,5-f]quinoline IQ 2 2-氨基-3,4-二甲基咪唑并[4,5-f]喹啉 2-amino-3,4-dimethylimidazo[4,5-f]quinoline MeIQ 3 2-氨基-3,8-二甲基咪唑并[4,5-f]喹喔啉 2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline MeIQx 4 2-氨基-3,4,8-三甲基咪唑并[4,5-f]喹喔啉 2-amino-3,4,8-trimethyl-imidazo[4,5-f]quinoxaline 4,8-DiMeIQx 5 2-氨基-1-甲基-6-苯基-咪唑并[4,5-b]吡啶 2-amino-1-methyl-6-Phenylimidazo[4,5-b]pyridine PhIP 6 3-氨基-1,4-二甲基-5H-吡啶并[4,3-b]吲哚 3-Amino-1,4-dimethyl-5H-Pyrido[4,3-b]indole Trp-P-1 7 3-氨基-1-甲基-5H-吡啶并[4,3-b]吲哚 3-amino-1-methyl-5H-Pyrido[4,3-b]indole Trp-P-2 8 9-H-吡啶并[4,3-b]吲哚 9H-Pyrido[3,4-b]indole Norharman 9 1-甲基-9-H-吡啶并[4,3-b]吲哚 1-methyl-9H-Pyrido[3,4-b]indole Harman 10 2-氨基-9H-吡啶并[2,3-b]吲哚 2-amino-9H-Pyrido[2,3-b]indole AαC 11 2-氨基-3甲基-9H-吡啶并[2,3-b]吲哚 2-amino-3methyl-9H-Pyrido[2,3-b]indole MeAαC 表 2 140 ℃油炸温度下杂环胺的变化(X ±SD,n=3)
Table 2 Variation of heterocyclic amines at oil temperature of 140 ℃
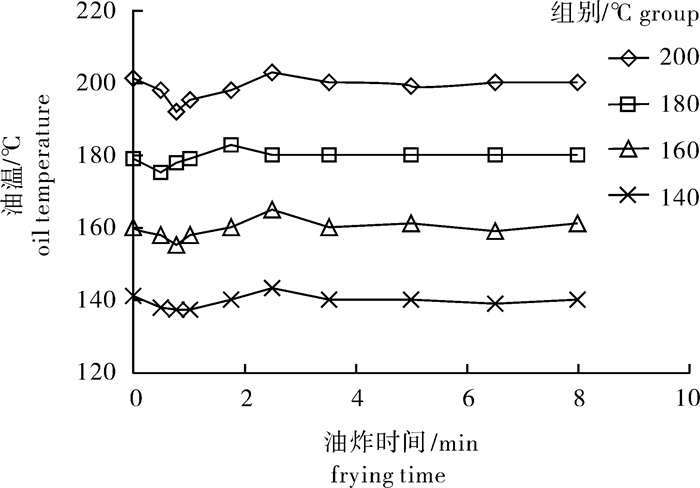
时间/mintime w (杂环胺)/μg·kg-1 content of heterocyclic amine IQ MeIQ 4,8-DiMeIQx Trp-P-1 Trp-P-2 Harman Norharman 0.50 ND ND ND ND ND ND ND 0.75 ND ND ND ND ND ND ND 1.00 ND ND ND ND ND ND 0.24±0.10a 1.75 ND ND ND ND ND 0.18±0.12b 0.25±0.13a 2.50 ND ND ND ND ND 0.14±0.13ab ND 3.50 ND ND ND ND ND 0.22±0.06bc 0.34±0.10a 5.00 ND 0.13±0.11a ND ND ND 0.35±0.13cd 0.37±0.12a 6.50 ND 0.28±0.09b ND ND ND 0.10±0.11ab 0.40±0.17a 8.00 0.15±0.07a 0.16±0.04a 0.15±0.05a 1.47±0.47a 0.72±0.22a 0.45±0.10d 0.28±0.09a 注:每列上标不同字母者差异显著(P < 0.05);后表同此
Note: Values with different superscript letters within the same column are significantly different from one another (P < 0.05). The same case in the following tables.表 3 160 ℃油炸方式下杂环胺的变化
Table 3 Variation of heterocyclic amines at oil temperature of 160 ℃
时间/mintime w (杂环胺)/μg·kg-1 content of heterocyclic amine IQ MeIQ MeIQx 4,8-DiMeIQx Trp-P-1 Trp-P-2 Harman Norharman 0.50 ND ND ND ND ND ND ND 0.33±0.15ab 0.75 ND ND ND ND ND ND 0.12±0.11a 0.16±0.15a 1.00 ND ND ND ND ND ND 0.59±0.19b 0.22±0.21ab 1.75 ND ND ND ND ND ND 0.20±0.12a 0.28±0.10ab 2.50 ND 0.44±0.14b ND ND ND ND 0.30±0.15a 0.14±0.08a 3.50 ND ND ND 0.17±0.12a ND ND 0.31±0.18a 0.51±0.25b 5.00 ND 0.17±0.03a ND ND ND ND 0.18±0.07a 0.38±0.06ab 6.50 0.14±0.07a 0.19±0.08a 0.15±0.05a ND ND ND 0.76±0.24b 0.44±0.13ab 8.00 0.27±0.06b 0.71±0.16c 0.25±0.11b 0.14±0.12a 1.64±0.29a 0.77±0.09a 1.20±0.21c 0.32±0.26ab 表 4 180 ℃油炸方式下杂环胺的变化
Table 4 Variation of heterocyclic amines at oil temperature of 180 ℃
时间/mintime w (杂环胺)/μg·kg-1 content of heterocyclic amine IQ MeIQ MeIQx 4,8-DiMeIQx Trp-P-1 Trp-P-2 PhIP Harman Norharman 0.50 ND ND ND 0.73±0.11a ND ND ND 0.55±0.23a 0.93±0.33a 0.75 0.22±0.06a 1.25±0.30a 0.29±0.07a 0.59±0.09a ND ND ND 1.08±0.25abc 0.94±0.47a 1.00 0.45±0.08a 3.78±0.30b 0.23±0.20a 0.68±0.15a ND ND ND 0.79±0.26ab 0.97±0.18a 1.75 3.18±0.77bc 7.08±0.93c 0.75±0.24a 0.47±0.16a ND ND ND 0.60±0.19a 1.82±0.17ab 2.50 2.38±0.31b 7.15±1.03c 2.70±0.86b 1.70±0.51ab ND ND ND 1.24±0.39bcd 1.51±0.26a 3.50 2.27±0.12b 7.66±1.42c 2.91±0.29b 1.88±0.50ab ND ND ND 1.52±0.47cd 1.55±0.10a 5.00 3.93±0.65cd 10.5±1.11d 4.11±0.74c 2.56±0.45b ND ND ND 1.66±0.23d 1.62±0.60ba 6.50 4.19±0.74de 10.88±0.16d 6.57±1.23d 5.59±0.68c 0.73±0.42a 0.71±0.23a 0.16±0.06a 1.71±0.39d 1.39±0.54a 8.00 4.95±0.96e 14.82±1.13e 7.97±0.30e 8.28±2.01d 0.92±0.27a 0.99±0.21b ND 1.66±0.24d 2.45±0.93b 表 5 200 ℃油炸方式下杂环胺的变化
Table 5 Variation of heterocyclic amines at oil temperature of 200 ℃
时间/mintime w (杂环胺)/μg·kg-1 content of heterocyclic amine IQ MeIQ MeIQx 4,8-DiMeIQx Trp-P-1 Trp-P-2 PhIP Harman Norharman 0.50 ND 0.64±0.56a 1.92±1.31a ND ND ND ND 1.47±0.49ab 2.44±1.06a 0.75 1.17±0.16a 1.07±0.73a 3.67±1.34a 0.96±0.76a ND ND ND 0.93±0.86a 2.10±1.02a 1.00 2.13±1.02a 1.27±0.77a 3.78±0.66a 1.08±0.70a 0.38±0.35a ND ND 0.71±0.66a 2.14±0.90a 1.75 2.88±0.71ab 2.39±0.36ab 12.45±3.29b 1.48±0.52a 0.45±0.43a ND ND 2.27±1.36ab 2.66±1.37a 2.50 3.93±1.36abc 4.02±1.77ab 10.23±2.15b 2.15±1.06ab 0.45±0.13a 0.46±0.40a 1.02±0.87a 2.43±1.47ab 1.80±0.67a 3.50 5.63±1.00bc 3.07±1.13ab 11.32±1.99b 3.03±0.93ab 0.89±0.37ab 2.20±1.42b 0.73±0.90a 2.62±1.62abc 2.66±1.37a 5.00 6.70±1.56c 6.70±2.92b 7.08±1.64ab 4.21±1.96b 1.18±0.27ab 2.40±1.58b 1.85±0.91ab 3.49±0.35bcd 3.78±1.28a 6.50 16.43±1.11d 16.43±5.52c 25.15±7.06c 11.98±1.61c 1.91±1.13b 2.80±1.33b 3.14±1.16bc 4.64±1.46cd 3.90±2.01a 8.00 21.66±4.70e 21.66±4.81d 37.21±3.67d 13.31±1.68c 3.60±1.70c 3.90±1.75b 4.82±2.30c 4.97±1.06d 4.02±0.95a 表 6 200 ℃烘烤方式下杂环胺的变化
Table 6 Variation of heterocyclic amines at baking temperature of 200 ℃
时间/mintime w (杂环胺)/μg·kg-1 content of heterocyclic amine IQ MeIQ MeIQx 4,8-DiMeIQx Trp-P-1 Trp-P-2 PhIP Harman Norharman 1 ND ND ND ND ND ND ND 0.40±0.45a 1.05±0.15a 5 ND ND ND ND ND ND ND 0.57±0.13a 1.23±0.70a 10 ND ND ND ND ND ND ND 0.78±0.46a 1.62±0.66ab 15 2.22±1.27a 9.71±0.50a ND 2.98±0.84a ND ND 1.38±0.49a 0.97±0.36ab 1.37±0.73a 20 7.78±1.74b 21.03±3.04b 6.24±1.71a 4.79±1.58a ND ND 2.61±0.95b 1.21±0.61ab 1.64±0.29ab 30 11.63±3.29c 31.86±4.37c 13.86±2.77b 9.70±3.04b 0.55±0.52a 0.27±0.25a 3.68±0.56c 1.79±0.76b 2.44±0.51b 表 7 100 ℃水煮方式下杂环胺的变化
Table 7 Variation of heterocyclic amines at boiling temperature of 100 ℃
时间/min w (杂环胺)/μg·kg-1 content of heterocyclic amine time Harman Norharman 1 ND ND 5 ND ND 10 ND ND 15 ND ND 20 ND ND 30 0.36±0.08a 0.50±0.13a 60 0.70±0.27b 1.08±0.65b -
[1] SUGIMURA T, NAGAO M, KAWACHI T, et al. Mutagens carcinogens in food, with special reference to highly mutagenic paralytic products in broiled food[M]//HIATT H H, WATON J D, WINSTEN J A. Origins of human cancer. New York: Cold Spring Harbor Laboratory, 1977: 1561-1577.
[2] 姚瑶, 彭增起, 邵斌, 等. 加工肉制品中杂环胺的研究进展[J]. 食品科学, 2010, 31(23): 447-453. https://d.wanfangdata.com.cn/periodical/Ch9QZXJpb2RpY2FsQ0hJTmV3UzIwMjQxMTA1MTcxMzA0Eg1zcGt4MjAxMDIzMDk3GghhZ3F3d3lxNA%3D%3D [3] ALAIN K, SYLVIE C, ELEONORE G, et al. Formation of heterocyclic amines in slices of Longissimus thoracis beef muscle subjected to jets of superheated steam[J]. Food Chem, 2010, 119(1): 19-26. doi: 10.1016/j.foodchem.2009.02.081
[4] GIBIS M, WEISS J. Antioxidant capacity and inhibitory effect of grape seed and rosemary extract in marinades on the formation of heterocyclic amines in fried beef patties[J]. Food Chem, 2012, 134(2): 766-774. doi: 10.1016/j.foodchem.2012.02.179
[5] HELMUSA D S, THOMPSONB C L, ZELENSKIYA S, et al. Red meat-derived heterocyclic amines increase risk of colon cancer: a population-based case-control study[J]. Nutr Cancer, 2013, 65(8): 1141-1150. doi: 10.1080/01635581.2013.834945
[6] SINHA R, ROTHMAN N, BROWN E D, et al. Pan-fried meat containing high levels of heterocyclic aromatic amines but low levels of polycyclic aromatic hydrocarbons induces cytochrome P450IA2 activity in humans[J]. Cancer Res, 1994, 54: 6165-6195. https://pubmed.ncbi.nlm.nih.gov/7954461/
[7] AOYAMA T, GELBOIN H, GONZALEZ F. Mutagenic activation of 2-amino-3-methylimidazo [4, 5-f] quinoline by complementary DNA-expressed human liver P450[J]. Cancer Res, 1990, 50: 2060-2063. https://pubmed.ncbi.nlm.nih.gov/2180561/
[8] LIAO G Z, WANG G Y, XU X L, et al. Effect of cooking methods on the formation of heterocyclic aromatic amines in chicken and duck breast[J]. Meat Sci, 2010, 85(1): 149-154. doi: 10.1016/j.meatsci.2009.12.018
[9] PUANGSOMBAT K, SMITH J S. Inhibition of heterocyclic amine formation in beef patties by ethanolic extracts of rosemary[J]. J Food Sci, 2010, 75(2): 40-47. doi: 10.1111/j.1750-3841.2009.01491.x.
[10] 徐琦, 杨洪生, 吴光红, 等. 超高效液相色谱-电喷雾串联质谱法同时测定鱼类加工品中12种杂环胺类化合物[J]. 南方水产科学, 2012, 8(4): 7-15. [11] 邵兵, 彭增起, 杨洪生, 等. 固相萃取-高效液相色谱法同时测定传统禽肉制品中的9种杂环胺类化合物[J]. 色谱, 2011, 29(8): 755-761. doi: 10.3724/SP.J.1123.2011.00755. [12] 万可慧, 邵斌, 姚瑶, 等. 加工肉制品中杂环胺的形成与控制[J]. 食品科技, 2012, 37(6): 168-172. https://d.wanfangdata.com.cn/periodical/Ch9QZXJpb2RpY2FsQ0hJTmV3UzIwMjQxMTA1MTcxMzA0Eg1zcGtqMjAxMjA2MDQ4GghzNWtsdGlkMg%3D%3D [13] ALAEJOS M S, AYALA J H, GONZALEZ V, et al. Analytical methods applied to the determination of heterocyclic aromatic amines in foods[J]. J Chromatogr B, 2008, 862(1/2): 15-42. doi: 10.1016/j.jchromb.2007.11.040
[14] SKOG K, SOLYAKOV A, JAGERSTAD M. Effects of heating conditions and additives on the formation of heterocyclic amines with reference to amino-carbolines in a meat juice model system[J]. Food Chem, 2000, 68(3): 299-308. doi: 10.1016/S0308-8146(99)00195-8
[15] DIEM S, HERDERICH M. Reaction of tryptophan with carbohydrates: identification and quantitative determination of novel β-carbolinesalkaloids in food[J]. J Agric Food Chem, 2001, 49(5): 2486-2492. doi: 10.1021/jf0014112
[16] BORGEN E, SOLYAKOV A, SKOG K. Effects of precursor composition and water on the formation of heterocyclic amines in meat model systems[J]. Food Chem, 2001, 74(1): 11-19. doi: 10.1016/S0308-8146(00)00333-2
[17] OZ F, KABAN G, KAYA M. Effects of cooking methods and levels on formation of heterocyclic aromatic amines in chicken and fish with Oasis extraction method[J]. J Food Sci Technol, 2010, 43(9): 1345-1350. doi: 10.1016/j.lwt.2010.04.014
[18] BALOGH Z, GRAY J I, GOMAA E A, et al. Formationand inhibition of heterocyclic aromatic amines in fried ground beef patties [J]. Food Chem Toxico, 2000, 38(5): 395-401. doi: 10.1016/S0278-6915(00)00010-7
[19] KNIZE M G, DOLBEARE F A, CARROLL K L, et al. Effect of cooking time and temperature on the heterocyclic amine content of fried beef patties[J]. Food Chem Toxico, 1994, 32(7): 595-603. doi: 10.1016/0278-6915(94)90002-7
[20] SKOG K I, JOHANSSON M A, JAGERSTAD M I. Carcinogenic heterocyclic amines in model systems and cooked foods: a review on formation, occurrence and intake[J]. Food Chem Toxicol, 1998, 36(9/10): 879-896. doi: 10.1016/S0278-6915(98)00061-1
[21] AHN J, GRVN I U. Heterocyclic amines: 1. Kinetics of formation of polar and nonpolar heterocyclic amines as a function of time and temperature[J]. J Food Sci, 2005, 70(2): 173-179. doi: 10.1111/j.1365-2621.2005.tb07079.x
[22] ARVIDSSON P, Van BOEKEL M A J S, SKOG K, et al. Kinetics of formation of polar heterocyclic amines in a meat model system[J]. J Food Sci, 1997, 62(5): 911-916.
-
期刊类型引用(9)
1. 王禹,段静瑶,王志龙,苏岩峰,喻佩. 水产品中杂环胺类化合物的形成及调控研究进展. 中国食品添加剂. 2024(02): 283-290 .  百度学术
百度学术
2. 阳日东,倪来学,姚现琦,解万翠,车红霞,李红燕,董秀芳. 肉制品中杂环胺影响因素及检测方法的研究进展. 肉类研究. 2023(08): 52-60 .  百度学术
百度学术
3. 陈敬敬,韩金花,张永胜,师希雄. 肉制品中杂环胺的研究进展. 中国食品卫生杂志. 2022(01): 168-174 .  百度学术
百度学术
4. 王惠汀,孙学颖,王丹,郭进,靳烨,赵丽华. 肉制品中杂环胺类化合物形成及控制措施的研究进展. 食品研究与开发. 2022(05): 195-203 .  百度学术
百度学术
5. 程轶群,雷阳,周兴虎,金福源,汪昌保,黄明. 传统肉制品中杂环胺研究进展. 食品科学. 2022(05): 316-327 .  百度学术
百度学术
6. 谢洋洋,王小溪,闫文杰,赵卓,李兴民. 肉制品中杂环胺的研究进展. 食品研究与开发. 2017(15): 199-205 .  百度学术
百度学术
7. 王晓龙,佟长青,赵前程,李伟. 我国输美水产品退回数据、存在问题及其解决对策. 河北渔业. 2016(01): 64-66 .  百度学术
百度学术
8. 陈炎,蔡克周,杨潇,刘亚茜,潘丽军,姜绍通,陈从贵. 外源成分对肉制品中杂环胺抑制效果的研究进展. 食品科学. 2015(23): 329-333 .  百度学术
百度学术
9. 王南,王桂瑛,赵莹莹,刘登勇. 高温加工肉制品中PhIP的形成与控制. 肉类研究. 2014(10): 33-36 .  百度学术
百度学术
其他类型引用(10)



 下载:
下载:







 粤公网安备 44010502001741号
粤公网安备 44010502001741号
