Bacterial composition in feed mash of fresh frozen trash fish for large yellow croaker (Larimichthys crocea)
-
摘要:
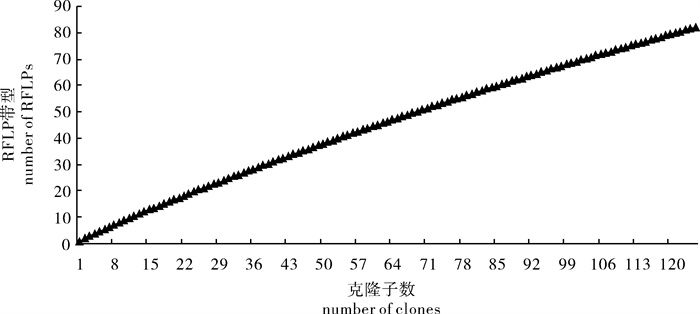
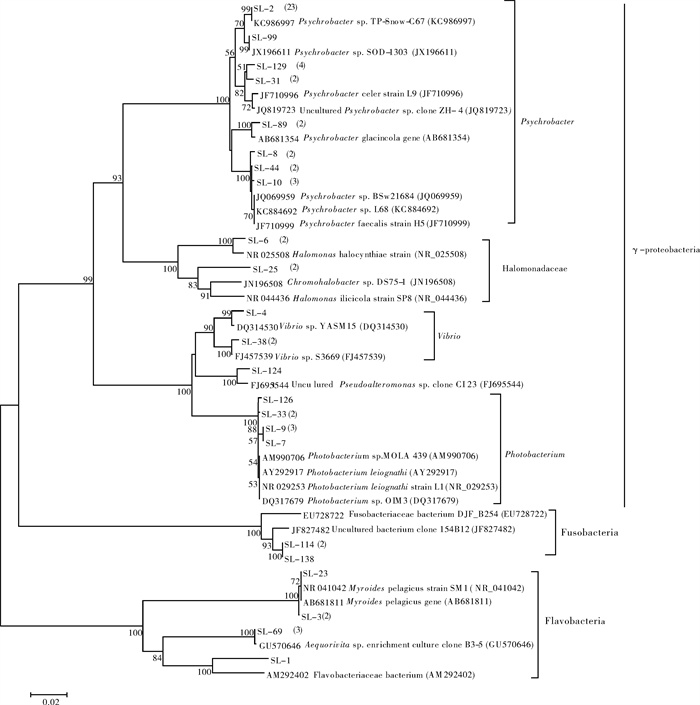
为研究大黄鱼(Larimichthys crocea)冰鲜杂鱼饲料中细菌的多样性,用细菌通用引物构建了细菌16S rRNA基因克隆文库。从文库中随机挑选125个克隆子进行限制性片段长度多态性(RFLP)分析,得到82个不同的RFLP带型。对部分代表性克隆子进行测序,得到23条有效序列。序列同源性分析和系统进化分析结果表明,大黄鱼冰鲜杂鱼饲料中细菌主要分为3大类群,其中γ-变形菌纲(γ-Proteobacteria)细菌占据明显地优势地位,约占所分析克隆子数的84.4%;其次是黄杆菌纲(Flavobacteria)细菌,约占10.9%;还有少量的梭杆菌纲(Fusobacteria)细菌,约占4.7%。γ-变形菌纲细菌中以嗜冷杆菌(Psychrobacter sp.)最多,其次是发光杆菌(Photobacterium)。
-
关键词:
- 大黄鱼 /
- 养殖饲料 /
- 细菌 /
- 16S rRNA基因 /
- RFLP
Abstract:To examine the bacterial composition in the feed mash of large yellow croaker (Larimichthys crocea), we constructed a 16S rRNA gene clone library using universal primers for the domain bacteria. 125 clones randomly selected from the library were screened by restriction fragment length polymorphism (RFLP) analysis. These clones were divided into 82 different RFLP patterns. Some representative clones were sequenced and 23 sequences were obtained. Sequence homology and phylogenetic analysis reveal high bacterial diversity in large yellow croaker′s feed mash. The sequences were clustered into three major groups, in which γ-Proterbacteria were the most predominant group, accounting for about 84.4% of the sampled clones; Flavobacteria were the second dominant group, accounting for about 10.9%. There were a small number of Fusobacteria, accounting for about 4.7%. Psychrobacter sp. were the most abundant members within γ-Proterbacteria, and Photobacterium were the second abundant members.
-
Keywords:
- large yellow croaker /
- mariculture feed mash /
- bacteria /
- 16S rRNA gene /
- RFLP
-
草鱼 (Ctenopharyngodon idella) 是我国重要的大宗淡水经济鱼类,养殖总产量约占我国淡水经济鱼类总产量的1/5[1]。当前,可持续发展是草鱼产业面临的主要挑战之一,而饲料成本控制是其中最主要的一环。糖类是水产饲料中最为廉价的能量来源,在饲料中添加一定量的糖类物质具有蛋白质节约效应和活化氨基酸的作用,能有效节省饲料成本[2]。然而,与哺乳动物不同,鱼类被认为是“天生的糖尿病患者”,对葡萄糖的利用能力较低,饲料中过多的糖类可能导致鱼类出现生长迟缓、肝脏肿大、损伤等问题 [3-5]。
草鱼喜好以天然水草为饵料,与其他饵料相比,水草的粗蛋白含量高、粗纤维含量低[6],富含糖类物质[7];因此,草鱼是研究鱼类糖利用能力的理想对象。目前认为,在相同蛋白水平下,适宜草鱼生长的饲料糖水平为15%~33%,当饲料糖水平超过40%时,其生长性能受到抑制,肠系膜脂肪沉积增加,糖类无法发挥蛋白质节约作用[8-10]。但也有研究显示,饲喂6%、22%和38% 3种糖水平饲料的草鱼特定或相对生长率无显著性差异[11]。用25%、45%和50% 3种糖水平饲料饲喂草鱼的研究也得到了相似结果,且糖水平超过40%时仍能发挥蛋白质节约效应[12];此外,当糖水平同为42%时,低蛋白质饲料能促进草鱼相对和特定生长率的增加[13]。由此可见,不同高糖饲料下草鱼的生长性能表现不一致,仅从糖水平高低的角度无法完全解释其生长性能差异。
探索糖代谢与生长之间的关系,是交叉融合了水产营养学与育种学的新型研究方向。本实验室前期从糖酵解途径中挖掘到与草鱼生长相关的SNP位点[14],且草鱼快长和慢长群体中糖酵解、糖异生和糖原合成途径中的一些关键基因表达量差异显著[15],推测糖代谢调控可能与草鱼生长密切相关。已有研究发现,摄食高糖饲料后,不同于肉食性鱼类,草鱼肝脏能够调节糖酵解途径的葡萄糖激酶 (Glucokinase, Gk)和糖异生途径的葡萄糖-6-磷酸酶 (Glucose-6-phosphatase, G6pase) 的基因表达以应对摄入的过量糖[9,16]。糖酵解和糖异生途径的糖代谢相关基因表达可能受到鱼体体质量、饲料中主要能量源添加(蛋白质、糖类和脂质)水平以及养殖时间等因素的影响 [9-10,13,17]。研究不同营养参数、养殖时间对糖代谢相关基因,暨对糖酵解的关键限速酶Gk和丙酮酸激酶 (Pyruvate kinase, Pk)、糖异生的关键限速酶G6pase和磷酸烯醇式丙酮酸碳羧化酶 (Phosphoenolpyruvate carboxykinase, Pepck)、糖原合酶 (Glycogen synthase, Gys) 和脂肪酸合成酶 (Fatty acid synthase, Fas) 基因表达的影响,有助于解释饲喂高糖饲料草鱼出现亚健康状态表征和生长性能下降的原因。
目前对草鱼糖类物质营养需求的研究多局限于体质量约10 g的草鱼[8-10,12],尚不清楚体质量约100 g草鱼的营养需求是否符合已有的研究成果。为探究饲喂高糖饲料不同时间下,体质量约100 g草鱼的生长性能及肝脏糖代谢相关基因的表达变化,本研究配制了普通糖和高糖两种饲料对草鱼进行长期投喂,定期测量其生长指标和与糖代谢相关的生理生化指标,分析肝脏糖代谢相关基因的表达变化规律,综合评价其生长性能和健康水平,为草鱼糖代谢与生长之间的关系提供理论基础,并为耐糖性状选育研究提供依据和方向。
1. 材料与方法
1.1 实验饲料与试剂耗材
参照陈团等[18]对饲料糖源的选择,及Cai等[10]对饲料糖水平的设置,本研究以木薯生淀粉作为鱼体可消化糖源,以细统糠 (主要成分为纤维素) 作为不可消化的等碳添加物,分别配制饲料糖质量分数为15% (普通饲料) 和40% (高糖饲料) 的等氮等能饲料。所有原料 (淮安市禾丰饲料有限公司提供)粉碎过80目筛后,采用逐级扩大法混匀后,加入大豆油及适量蒸馏水再次混匀,经螺旋挤压机加工成直径4 mm的硬颗粒饲料,自然风干后于−20 ℃保存待用。饲料配方和营养组成见表1。
表 1 实验饲料配方及常规成分分析Table 1. Formulation and proximate composition of diets主要成分
Essential component普通饲料
Normal
diet/%高糖饲料
High-carbohydrate
diet/%鸡肉粉 Poultry meal 5 5 普通蒸汽级鱼粉 Ordinary fish meal 15 15 豆粕 Bean meal 33.57 33.57 木薯生淀粉 Raw cassava starch 15 40 豆油 Soybean oil 3 3 细统糠 Fine bran 25 0 多维多矿预混料① Premix (1%) 1 1 磷酸二氢钙 Ca(H2PO4)2 2 2 氯化胆碱 Choline chloride (50%) 0.2 0.2 食盐 Common salt 0.2 0.2 抗氧化剂 Antioxidant 0.03 0.03 合计 Total 100 100 营养成分 Nutritional ingredient 粗蛋白 Primary protein 28.55 28.55 粗脂肪 Crude fat 5.22 5.32 钙 Ca 1.35 1.35 磷 P 1.41 1.41 赖氨酸 Lys 1.83 1.83 蛋氨酸 Met 0.53 0.53 注:① 多维多矿预混料为商用预混料,由淮安市禾丰饲料有限公司提供。 Note: ① Multi-mineral premix is a commercial premix provided by Huai'an Hefeng Feed Co. Ltd.. 实验所用组织固定液购自武汉赛维尔生物科技有限公司,血糖、肝/肌糖原含量检测试剂盒、胰岛素ELISA检测试剂盒均购自南京建成生物工程研究所。RNA保护液 (RNAsafer Stabilizer Reagent) 购自Omega Bio-Tek公司,总RNA分离试剂 (Trizol Reagent) 购自Thermo Fisher Scientific公司,逆转录、荧光定量试剂盒均购自TaKaRa Bio Inc. 公司。
1.2 实验设计及饲养管理
实验用草鱼购自广州市南沙海鸥岛养殖场,在广东梁氏水产种业有限公司英德基地开展实验。实验鱼暂养2周后,选取平均体质量为 (132.01±16.43) g的草鱼1 800尾,随机分成两组,每组设3个重复,每个重复300尾鱼,放入长10 m×宽10 m室外水泥池中养殖。两组分别投喂普通饲料 (对照组) 和高糖饲料 (高糖组),每日8:00和16:00投喂2次,每次投喂至鱼群不再进食为止。养殖期间,水泥池不间断充氧,每天吸污排污,隔3 d换水1次,换水量约为池水的1/3,水体pH 维持在7.7~7.9,养殖时间为140 d。在第40 、第60 、第80 和第140天时,从每个池中随机挑选已禁食24 h的20尾草鱼测量体质量、体长和体高;挑选10尾从尾静脉采集血液置于抗凝管中,制备血浆用于检测血糖和胰岛素含量,另取肝脏组织称质量,置于RNA保存液中4 ℃过夜,再转至−80 ℃冰箱保存。第140天时,每个重复挑选10尾草鱼测量内脏团、肠系膜脂肪质量,采集部分肝脏和肌肉组织快速置于液氮下保存,再用于检测糖原,另采集部分肝脏和肠道组织置于多聚甲醛溶液中固定,用于制备组织切片。所有样品的保存方式均为单一个体单管保存。
1.3 指标测定
1.3.1 生长性能测定
测量不同时期两组草鱼的体质量增长率 (Weight gain rate, RWGR)、肥满度 (Fullness, RF)、脏体比 (Viserosomatic index, RVI)、肝体比 (Hepatosomatic index, RHI)、肠系膜脂肪系数 (Mesenteric fat index, RMFI)和空壳质量 (Eviscerated mass, WE),计算公式如下:
$$ R_{\mathrm{WGR}}=\left[\left(W_1 - W_0\right) / W_0\right] \times 100 {\text{%}} $$ (1) $$ R_{\mathrm{F}}=\left(W_1 / L_1^3\right) \times 100 $$ (2) $$ R_{\mathrm{VI}}=W_{\mathrm{v}} / W_1 \times 100 {\text{%}} $$ (3) $$ R_{\mathrm{HI}}=W_{\mathrm{h}} / W_1 \times 100 {\text{%}} $$ (4) $$ R_{\mathrm{MFI}}=W_{\mathrm{m}} / W_1 \times 100{\text{%}} $$ (5) $$ W_{\mathrm{E}}=W_1 - W_{\mathrm{v}} $$ (6) 式中:W0为实验草鱼的初始体质量;W1为实验草鱼的终末体质量;L1为实验草鱼的终末体长;Wv、Wh、Wm分别为实验草鱼的内脏团总质量、肝脏总质量、肠系膜脂肪总质量。
1.3.2 血糖、胰岛素含量测定
血糖、血浆胰岛素含量检测分别按照葡萄糖含量检测试剂盒、鱼胰岛素测试盒说明书操作,使用多功能酶标仪Cytation 5 (BioTek, America)检测样品吸光度,计算血糖和胰岛素含量。
1.3.3 组织糖原含量测定
采用肝/肌糖原测定试剂盒测定每个个体肝脏和肌肉组织中的糖原含量,按试剂盒说明书操作步骤,将样品漂洗、吸干、研磨后水解制备糖原检测液,用UV-7504型单光束紫外可见分光光度计 (上海欣茂仪器有限公司) 于波长620 nm、光径1 cm下检测样品的OD值,计算糖原含量。
1.3.4 组织切片制作与观察
将采集自第140天的肝脏和中肠样品经梯度乙醇脱水、二甲苯透明、石蜡包埋、切片机切片、HE染色,制备的切片在ZEISS Scope.A1正置显微镜下成像拍照,使用Microsoft PowerPoint 2016软件整理和标注图片,检查肝脏和肠道组织的健康状况。成像完成后统一以毫米为标准单位,使用Image-Pro Plus 6.0软件分别测量每张切片中5根完整肠绒毛高度及对应的5处绒毛宽度。
1.3.5 肝脏糖代谢相关基因表达分析
取已采集的肝脏组织匀浆后用TRIzol™试剂裂解,通过氯仿-异丙醇分离沉淀总RNA,经75% (体积分数)乙醇洗涤后重新溶解总RNA。使用多功能酶标仪Cytation 5 (BioTek, 美国) 检测RNA浓度及纯度,用琼脂糖凝胶电泳检测其完整性。按照PrimeScript™ RT reagent Kit with gDNA Eraser (Perfect Real Time) 说明书反转录合成cDNA,置于−20 ℃保存。以β-actin为内参基因,采用RT-PCR检测肝脏糖代谢相关基因在不同养殖时间下的相对表达量。荧光定量PCR反应体系为20 μL,包括上下游引物各0.5 μL、模板cDNA 2 μL、去离子水7 μL、TB Green (SYBR 酶)10 μL,引物序列见表2。反应在LightCycler® 96 Instrument荧光定量PCR仪上进行,反应程序为:95 ℃预变性10 min;95 ℃ 15 s,58 ℃ 30 s,72 ℃ 30 s,共35个循环。每个样品进行3次重复实验,采用2−ΔΔCT 法计算各基因的相对表达量,以40 d 对照组的相对表达量为对照,分析各组各时间下该基因的表达量差异。
表 2 草鱼糖代谢相关基因 qRT-PCR 引物Table 2. qRT-PCR primers of grass carp glycometabolism genes基因
Gene引物序列 (5'—3')
Primer sequence (5'–3')GenBank 登录号
GenBank ID参考文献
Referencegk F: GGACAATGGTGAACTGGAGGACTTC
R: TAGCAGCACAAGACGCACAAGCGU065314 [19] pk F: GCCGAGAAAGTCTTCATCGCACAG
R: CGTCCAGAACCGCATTAGCCACJQ951928 [20] pepck F: ATCGTCACGGAGAACCAA
R: CCTGAACACCAAACTTAGCAJQ898294.1 [20] g6pase F: AAGGACAGCAGGTAGAAGAGG
R: ACGGAAAACAAGAAGAGCAGKY742725.1 gys2 F: CCTCCAGTAACAACTCACAACA
R: CAGATAGATTGGTGGTTACGCJQ792167 [19] fas F: GATGGGTCTAAGCCTGATGG
R: GACACCCTGTGGACATTGAGCMG241310 [19] β-actin F: GCTATGTGGCTCTTGACTTCG
R: GGGCACCTGAACCTCTCATTM25013.1 [21] 1.3.6 数据处理
使用SPSS Statistics 26软件对实验数据进行分析,生长指标、糖原含量、肠道组织绒毛高度、宽度和肌层厚度使用独立样本t检验法分析两组样本间的差异;基因的相对表达量数据使用单因素方差分析 (One-way ANOVA),采用Duncan's 法进行组间多重比较。结果用“平均值±标准差(
$\bar x $ ±s)”表示,差异显著水平为P<0.05,P<0.01时差异极显著。使用Excel 2016、PowerPoint 2016软件作图。2. 结果
2.1 高糖和低糖饲料对草鱼生长性能的影响
两组草鱼的生长性能各指标如表3所示,相较于对照组,高糖组草鱼体质量在第60和第80天显著提高 (P<0.05),并在第140天时极显著提高 (P<0.01);体质量增长率在第60和第80天时显著提高 (P<0.05);体高在第60和第140天时极显著提高 (P<0.01);肥满度在第40、第80和第140天时极显著提高 (P<0.01);在第140天时,草鱼脏体比、肠系膜脂肪系数和空壳质量均极显著提高 (P<0.01)。而两组草鱼的体长、肝体比无显著性差异 (P>0.05)。
表 3 高糖饲料对草鱼生长性能的影响Table 3. Effects of dietary carbohydrate on growth performance of grass carp项目
Item样本量/组
N/Group养殖时间
Culture time/d对照组
Control group高糖组
Group H初始体质量 Initial body mass/g 60 0 130.61±14.79 132.83±13.36 终末体质量 Final body mass/g 60 40 146.08±27.97 143.88±20.43 60 153.18±29.40 165.54±36.64* 80 168.71±36.73 195.53±48.70* 140 361.18±67.61 388.57±59.02** 体质量增长率 RF/% 60 40 109.98±15.64 110.18±9.33 60 121.24±4.21 133.28±4.09* 80 129.82±0.23 147.20±9.68* 140 271.78±13.07 297.51±15.85 体长 Body length/cm 60 40 20.74±1.29 20.13±1.05 60 20.34±1.21 20.75±1.41 80 21.21±1.71 21.58±2.16 140 29.27±0.82 29.22±1.09 体高 Body height/cm 60 40 4.90±0.37 4.96±0.37 60 4.88±0.44 5.20±0.51** 80 5.34±0.59 5.49±0.70 140 6.54±0.15 6.87±0.32** 肥满度 RF 60 40 1.61±0.13 1.76±0.32** 60 1.78±0.28 1.85±0.23 80 1.77±0.19 1.92±0.28** 140 1.48±0.13 1.72±0.17** 肝体比 RHI/% 30 40 1.94±0.47 2.19±0.62 60 1.68±0.61 2.14±0.60 80 2.17±0.27 2.29±0.49 140 1.23±0.24 1.39±0.14 脏体比 RVI/% 30 140 6.64±1.29 8.12±0.71** 肠系膜脂肪系数 RMFI/% 30 140 1.16±0.54 2.20±0.64** 空壳质量 WE/g 30 140 345.71±20.67 383.23±27.46** 注:*. 同一时期下高糖组与对照组相比差异显著 (P<0.05);**. 差异极显著 (P<0.01)。后表同此。 Note: *. There are significant differences between the high glucose group and the control group during the same period (P<0.05); **. Extremely significant differences (P<0.01). The same case in the following table. 2.2 两种不同糖水平饲料对草鱼血糖、胰岛素、糖原的影响
如表4所示,高糖组和对照组草鱼在各个时期的空腹血糖均无显著性差异 (P>0.05)。第140天时,高糖组草鱼血浆胰岛素、肝糖原和肌糖原质量分数均高于对照组,其中肝糖原质量分数差异性显著 (P<0.05)。
表 4 高糖饲料对草鱼血糖、胰岛素、糖原的影响Table 4. Effects of dietary carbohydrate on plasma glucose, insulin and glycogen of grass carp项目
Item养殖时间
Culture time/d对照组
Control group高糖组
Group H血糖浓度 Blood glucose/(mmol·L−1) 40 10.95±0.99 10.99±1.17 60 11.46±2.15 13.65±1.63 80 9.77±1.77 10.79±1.78 140 13.39±0.63 12.78±1.00 胰岛素水平 Insulin level/(mIU·L−1) 140 9.23±1.18 10.31±1.17 肝糖原质量分数 Liver glycogen/(mg·g−1) 140 24.23±13.03 36.29±10.41* 肌糖原质量分数 Muscle glycogen/(mg·g−1) 140 0.15±0.06 0.24±0.08 2.3 肝脏、肠道组织切片观察
2.3.1 肝脏组织外形、HE染色切片观察
将经HE染色的第140天草鱼肝脏组织切片置于显微镜中观察 (图1)。以中央静脉为中心,对照组肝组织中肝索呈放射状整齐排列,相邻肝索吻合成网状,肝索之间可见肝血窦;细胞大小正常,呈椭圆形,细胞核大、居中,空泡不明显。高糖组肝脏组织的肝索排列规则,肝血窦细长狭窄,肝细胞稍膨大,细胞核不在细胞中央,空泡数量较多。
![]() 图 1 草鱼肝脏组织结构注:a. 对照组草鱼肝脏 (400×);b. 高糖组草鱼肝脏 (400×);c. 对照组草鱼肝脏 (1 000×);d. 高糖组草鱼肝脏 (1 000×)。Figure 1. Tissue slices of liver of grass carpNote: a. Liver of grass carp (400×); b. Liver in Group H of grass carp (400×); c. Liver in control group of grass carp (1 000×); d. Liver in Group H of grass carp (1 000×).
图 1 草鱼肝脏组织结构注:a. 对照组草鱼肝脏 (400×);b. 高糖组草鱼肝脏 (400×);c. 对照组草鱼肝脏 (1 000×);d. 高糖组草鱼肝脏 (1 000×)。Figure 1. Tissue slices of liver of grass carpNote: a. Liver of grass carp (400×); b. Liver in Group H of grass carp (400×); c. Liver in control group of grass carp (1 000×); d. Liver in Group H of grass carp (1 000×).2.3.2 肠道组织结构
将经HE染色的中肠肠道组织切片置于显微镜中观察 (图2),对照组绒毛结构完整,上皮细胞排列规整紧密,未见损伤,绒毛近、中端形态正常。但绒毛远端出现肿胀,比例为80% (n=10)。高糖组绒毛结构有不同程度的损伤,绒毛肿胀、变形并伴有绒毛折叠,肠腔面积增大,纹状缘缺刻,比例为90% (n=10)。在400×显微镜下观察 (图2-c—d),对照组微绒毛排列紧密、均匀,高糖组微绒毛排列疏松,出现膨胀。经测量和分析 (图3,N=50),高糖组肠绒毛高度极显著高于对照组,但两组间绒毛宽度和肌层厚度差异不显著 (P>0.05)。
![]() 图 2 草鱼中肠组织结构注:a. 对照组草鱼中肠 (100×);b. 高糖组草鱼中肠 (100×);c. 对照组草鱼中肠 (400×);d. 高糖组草鱼中肠 (400×)。Figure 2. Tissue slices of midgut of grass carpNote: a. Midgut in Control group grass carp (100 ×); b. Midgut in Group H of grass carp (100×); c. Midgut in control group of grass carp (400×); d. Midgut in Group H of grass carp (400×).
图 2 草鱼中肠组织结构注:a. 对照组草鱼中肠 (100×);b. 高糖组草鱼中肠 (100×);c. 对照组草鱼中肠 (400×);d. 高糖组草鱼中肠 (400×)。Figure 2. Tissue slices of midgut of grass carpNote: a. Midgut in Control group grass carp (100 ×); b. Midgut in Group H of grass carp (100×); c. Midgut in control group of grass carp (400×); d. Midgut in Group H of grass carp (400×).2.4 不同时期草鱼肝脏组织糖代谢相关基因的表达
2.4.1 糖酵解关键基因的表达
如图4-a所示,随着养殖时间的增加,高糖组的gk基因 mRNA表达量均呈下降趋势,对照组表达量在所有时间上无显著变化 (P>0.05)。第40天时高糖组的gk基因 mRNA表达量显著高于对照组(P<0.05),其余时间两组间无显著性差异。高糖组的pk基因 mRNA表达量随养殖时间的增加整体呈下降趋势,对照组表达量在所有时间上无显著变化 (P>0.05,图4-b)。第60和第140 天时,高糖组表达量显著低于对照组 (P<0.05),而第40和第80 天时两组间无显著性差异 (P>0.05)。
![]() 图 4 草鱼肝脏糖代谢相关基因的表达注:方柱上的不同大写字母表示同一时间点高糖组、对照组的相对表达量差异显著,不同小写字母表示同一组在不同时间点的相对表达量差异显著 (P<0.05)。Figure 4. Relative expression of genes related to liver glucose metabolism in grass carpNote: Different uppercase letters on the square columns indicate significant differences in relative expression levels between the high glucose group and the control group at the same time point, while different lowercase letters on the square columns indicate significant differences in relative expression levels of the same group at different time points (P<0.05).
图 4 草鱼肝脏糖代谢相关基因的表达注:方柱上的不同大写字母表示同一时间点高糖组、对照组的相对表达量差异显著,不同小写字母表示同一组在不同时间点的相对表达量差异显著 (P<0.05)。Figure 4. Relative expression of genes related to liver glucose metabolism in grass carpNote: Different uppercase letters on the square columns indicate significant differences in relative expression levels between the high glucose group and the control group at the same time point, while different lowercase letters on the square columns indicate significant differences in relative expression levels of the same group at different time points (P<0.05).2.4.2 糖异生关键基因的表达
如图4-c所示,随着养殖时间的增加,高糖组和对照组的pepck基因 mRNA表达量均呈上升趋势,第140天时两组的表达量均达峰值。其中第40天时高糖组的表达量显著低于对照组,其余时间两组间的表达量无显著性差异。高糖组和对照组的g6pase基因 mRNA表达量随养殖时间的增加均呈升高趋势 (图4-d)。相较于对照组,第40和第60天高糖组的g6pase基因 mRNA表达量显著降低,第80和第140天时显著提高。
2.4.3 糖原、脂肪合成关键基因的表达
如图4-e所示,高糖组和对照组的gys2基因 mRNA表达量随养殖时间增加均呈下降趋势,但第40天时高糖组的gys2基因 mRNA表达量与对照组无显著性差异,第40和第60天时高糖组的表达量均显著高于对照组。高糖组和对照组的fas基因 mRNA表达量随养殖时间增加总体呈下降趋势 (图4-f),相较于对照组,高糖组的fas基因 mRNA表达量在第40天时显著降低,第60和第140天时显著提高。
3. 讨论
3.1 饲喂高糖饲料对草鱼生长性能的影响
在饲料中添加适宜水平的糖有助于提高鱼类的生长性能。根据已有研究,饲喂糖水平低于38%的饲料,草鱼幼鱼的生长性能无显著变化[8,10];但当饲料糖水平超过40%时,草鱼的生长性能显著下降[8,10,22],并引起血糖升高和肝肿大[5,8-9,23]。纤维素是鱼类饲料中常用的填料和黏合剂[24-25],鱼类对纤维素的利用能力有限[26],为了研究不同糖水平饲料对赤点石斑鱼(Epinephelus akaara)生长性能的影响[27],纤维素作为等碳添加物的添加量达1.97%~33.3%,将纤维素作为不可消化的糖源配制等氮等能饲料不会影响草鱼的生长性能[10,26]。本研究中饲喂添加40%木薯淀粉饲料的高糖组草鱼,体质量在第60、第80和第140天时显著高于对照组,在第140天时空壳质量显著高于对照组,说明添加40%木薯淀粉的高糖饲料可促进草鱼体质量增加,且体质量的增加主要源于肌肉质量增加。摄食高糖饲料提高鱼类生长性能的结果在其他草食性鱼类中也有报道,在脂质水平低的饲料中添加高水平糖能够促进银鲫 (Carassius gibelio)[24]、团头鲂 (Megalobrama amblycephala)[28]的生长,摄食高糖饲料后生长性能表现不同可能与糖类、脂质和蛋白质三者的交互作用有关。Abimorad等[29]配制了包含2种蛋白质水平、2种脂质水平和3种糖水平的12种饲料饲喂草食性鱼类细鳞鲳(Piaractus mesopotamicus),结果显示20%蛋白质水平的高糖 (50%) 饲料可显著降低其体质量增长率,而23%蛋白质水平的高糖饲料可显著提高其体质量增长率,40%和80%脂质水平的高糖饲料对体质量增长率的影响也不相同,相似的结果在短盖巨脂鲤 (Piaractus brachypomus)[30]、黄颡鱼 (Pelteobagrus fulvidraco)[31]中也有报道。在草鱼的研究中,将高糖 (45%) 饲料的蛋白质水平从32%降至20%显著提高了体质量增长率[13],说明草鱼摄食高糖饲料后出现的生长性能表现差异可能与营养素间的交互作用有关。
长期摄食高水平糖饲料会导致草鱼肝体指数增加[32-33],引起代谢紊乱[34],从而抑制其生长。本研究中高糖组草鱼肝脏糖原水平相比对照组显著提高,肝体指数增加但差异不显著,肝细胞形态发生了改变,总体反映出高糖组草鱼肝脏糖代谢负担加重,但并没有因糖原和脂肪积累而发生明显肝肿大,也未对生长性能造成明显的负面影响。尽管高糖组草鱼肝脏gys2和fas基因 mRNA表达水平在第40和第60天均显著高于对照组,但随着养殖时间延长,高糖组草鱼gys2和fas基因 mRNA表达水平整体呈下降趋势,这与Fang等[19]用高糖水平饲料饲喂草鱼的结果相似,表明草鱼可能通过自身新陈代谢减少肝糖原和脂肪的积累,从而减轻对肝脏器官损伤。中肠组织切片观测发现,高糖组绒毛形态改变,出现损伤,这可能与实验草鱼处于生长阶段早期、肠道形态结构对鱼体营养状况反应敏感有关[19]。实验组草鱼在第60和第80天时体质量增长率显著高于对照组,而在第140天时高糖组体质量增长率高于对照组但差异不显著,可能受饲喂高糖饲料导致草鱼幼鱼肠道绒毛宽度减少、消化与吸收能力降低的影响[19,35],从而引起实验组草鱼生长速度减缓。
3.2 高糖饲料对肝脏糖代谢的调节
糖酵解是鱼类葡萄糖分解的唯一途径,其中葡萄糖激酶是肝脏中催化葡萄糖分解的第一个关键酶,饲喂高糖饲料的团头鲂[36]、尼罗罗非鱼 (Oreochromis niloticus)[17]和虹鳟 (Oncorhynchus mykiss)[26,37]等多种鱼类肝脏糖酵解相关基因表达水平显著升高。本研究中,随实验时间延长饲喂高糖饲料组和对照组的草鱼肝脏gk基因表达水平无显著性差异,与Fang等[19]饲喂草鱼高糖(60%)饲料73 d未能显著改变肝脏gk基因表达水平的结果一致。但Cai等[10]用高糖饲料饲喂草鱼56 d后发现高糖饲料组的gk基因表达水平显著升高,推测可能与饲喂时间长短有关。Boonanuntanasarn等[17]研究不同糖水平饲料饲喂罗非鱼时发现,短期 (45 d) 饲喂高糖饲料显著提高了gk基因表达水平,而长期 (90 d) 饲喂对gk基因表达水平无显著性影响,该研究结果与本研究一致。本实验饲喂草鱼高糖饲料短期 (40 d) 内显著提高了肝脏的gk基因表达水平,而长期 (140 d) 饲喂对gk基因表达水平无显著性影响,表明短期和长期饲喂高糖饲料对草鱼肝脏gk基因表达的影响不同,这可能是分子水平上的一种适应性调节[17]。
糖异生是非糖类物质转化合成葡萄糖的过程,葡萄糖-6-磷酸酶是糖异生途径中直接催化葡萄糖合成的酶,同时在肝糖原合成葡萄糖的反应中也起催化作用。高糖饲料对不同鱼类肝脏g6pase基因表达水平的影响不同,对同一种鱼类也可能存在不同影响。已有研究发现,饲喂高糖饲料不会显著改变银鲫[24]、罗非鱼[17]、虹鳟在空腹时肝脏g6pase基因表达水平;而Song等[25]和 Marandel等[16]采用高糖饲料饲喂虹鳟,发现其肝脏g6pase基因表达水平显著升高。在本实验条件下,饲喂高糖饲料140 d草鱼肝脏g6pase基因表达水平显著升高,与Cai等[10]、徐晶等[38]的研究结果相似。Qiang等[39]饲喂罗非鱼高糖饲料0、27、45 d,发现其肝脏g6pase基因表达水平随实验时间延长而升高;Boonanuntanasarn等[17]长期饲喂罗非鱼不同糖水平饲料,90 d高糖饲料组肝脏g6pase基因表达水平较45 d高,表明持续饲喂罗非鱼高糖饲料可提高其肝脏g6pase基因表达水平。本研究高糖组g6pase基因表达水平随实验时间的延长而升高,并在第140天时显著高于对照组,与上述罗非鱼的研究结果相似[17,39] ;表明长期饲喂草鱼高糖饲料会导致g6pase基因表达水平升高,推测可能与本研究高糖组胰岛素水平较高和血糖水平较低有关。胰岛素可促进糖酵解、脂肪合成、糖原合成并抑制糖异生来降低血糖水平[40],当血糖水平较低时,机体通过提高g6pase基因表达水平来转化中间代谢物,重新合成葡萄糖并补充血糖含量。
4. 结论
综上,采用高糖 (40%) 饲料投喂草鱼可促进其体质量的增加,但长期饲喂会对其生理指标产生一定的负面影响,肝脏糖代谢相关基因表达变化显著,合成肝糖原和脂肪酸是葡萄糖的主要转化方式。本研究结果可为探明适宜草鱼生长的饲料糖水平提供数据支持,也可为后续耐糖性状标记的开发提供理论依据。
-
图 2 大黄鱼冰鲜杂鱼饲料中细菌系统进化树
编号SL-N(n代表克隆子编号)是来自大黄鱼饲料克隆子的序列,后面括号中数值表示RFLP带型出现的次数,未标出次数的带型均只出现一次,参比序列来自GenBank,每个节点上显示大于50的自举值(100次重复),标尺代表核酸置换率。
Figure 2. Phylogenetic tree of bacteria in feed mash of large yellow croaker
SL-N (n represents different clones No.) represent cloned sequences from feed mash of large yellow croaker. Numbers in brackets that follow the clones indicate the occurrence frequency of the RFLP patterns, and clones without brackets indicate the RFLP patterns that occurred only once.Reference sequences are derived from the GenBank. Bootstrap values above 50 (100 iterations) are shown at each node. Scale bar represents the nucleotide substitution percentage.
-
[1] 赵金柱, 艾庆辉, 麦康森, 等. 微粒饲料替代生物饵料对大黄鱼稚鱼生长、存活和消化酶活力的影响[J]. 水产学报, 2008, 32(1): 91-97. doi: 10.3321/j.issn:1000-0615.2008.01.015 [2] 李海. 饲料干鲜搭配养殖大黄鱼[N]. 中国渔业报, 2012-10-09 (007). [3] 冯晓宇, 丁玉庭, 郑岳夫. 大黄鱼低沉性配合饲料养殖试验[J]. 浙江海洋学院学报, 2006, 25(2): 143-147. doi: 10.3969/j.issn.1008-830X.2006.02.006 [4] 张璐, 麦康森, 艾庆辉, 等. 饲料中添加植酸酶和非淀粉多糖酶对大黄鱼生长和消化酶活性的影响[J]. 中国海洋大学学报, 2006, 36(6): 923-928. doi: 10.3969/j.issn.1672-5174.2006.06.015 [5] 李会涛, 麦康森, 艾庆辉, 等. 大黄鱼对几种饲料蛋白原料消化率的研究[J]. 水生生物学报, 2007, 31(3): 370-375. doi: 10.3321/j.issn:1000-3207.2007.03.011 [6] 张春晓, 麦康森, 艾庆辉, 等. 饲料中添加肽聚糖对大黄鱼生长和非特异性免疫力的影响[J]. 水产学报, 2008, 32(3): 411-415. doi: 10.3321/j.issn:1000-0615.2008.03.012 [7] 于明超, 李卓佳, 林黑着, 等. 饲料中添加芽孢杆菌和中草药制剂对凡纳滨对虾生长及肠道菌群的影响[J]. 热带海洋学报, 2010, 29(4): 132-137. doi: 10.3969/j.issn.1009-5470.2010.04.021 [8] 刘小玲, 曹俊明, 邝哲师, 等. 嗜酸乳酸菌对吉富罗非鱼生长、非特异性免疫酶活性和肠道菌群的影响[J]. 广东农业科学, 2013(1): 123-126. doi: 10.3969/j.issn.1004-874X.2013.01.040 [9] 薛超波, 王建跃, 王世意, 等. 大黄鱼养殖网箱内外细菌的数量分布及区系统组成[J]. 中国微生态学杂志, 2005, 17(5): 336-338. doi: 10.3969/j.issn.1005-376X.2005.05.009 [10] 郭全友, 杨宪时, 许钟. 养殖大黄鱼细菌菌群分离鉴定与分析[J]. 微生物学通报, 2006, 33(3): 92-97. doi: 10.3969/j.issn.0253-2654.2006.03.018 [11] 金珊, 蔡完其, 王国良, 等. 养殖大黄鱼细菌性疾病的病原研究[J]. 浙江海洋学院学报: 自然科学版, 2002, 21(3): 225-230. doi: 10.3969/j.issn.1008-830X.2002.03.005 [12] YU Z, MORRISON M. Improved extraction of PCR-quality community DNA from digesta and fecal samples[J]. Short Tec R, 2004, 36(5): 808-812. https://pubmed.ncbi.nlm.nih.gov/15152600/
[13] DOJKAM A, HUGENHOLTZ P, HAACK S K, et al. Microbialdiversity in a hydrocarbon-and chlorinated-solvent contaminated aquifer undergoing intrinsic bioremediation[J]. Appl Environ Microbiol, 1998, 64 (10): 3869-3877. doi: 10.1128/AEM.64.10.3869-3877.1998
[14] MAIDAK B L, COLE J R, LILBURN T G, et al. The RDP2Ⅱ (ribosomal database project)[J]. Nucleic Acids Res, 2001, 29(1): 173-174. doi: 10.1093/nar/29.1.173
[15] COTON M, DELBES-PAUS C, IRLINGER F, et al. Diversity and assessment of potential risk factors of Gram-negative isolates associated with French cheeses[J]. Food Microbiol, 2012, 29(1): 88-98. doi: 10.1016/j.fm.2011.08.020
[16] GRAM L, MELCHIORSEN J, BRUHN J B. Antibacterial activity of marine culturable bacteria collected from a global sampling of ocean surface waters and surface swabs of marine organisms[J]. Mar Biotechnol, 2010, 12 (4): 439-451. doi: 10.1007/s10126-009-9233-y
[17] NITHYANAND P, INDHUMATHI T, RAVI A V, et al. Culture independent characterization of bacteria associated with the mucus of the coral Acropora digitifera from the Gulf of Mannar[J]. World J Microbiol Biotechnol, 2011, 27 (6): 1399-1406. doi: 10.1007/s11274-010-0591-4
[18] ROMANENKO L A, SCHUMANN P, ROHDE M, et al. Halomonas halocynthiae sp. nov., isolated from the marine ascidian Halocynthia aurantium[J]. Int J Syst Evol Microbiol, 2002, 52 (5): 1767-1772. doi: 10.1099/00207713-52-5-1767
[19] ARENAS M, BAÑÓN P I, COPA-PATIÑO J L, et al. Halomonas ilicicola sp. nov., a moderately halophilic bacterium isolated from a saltern[J]. Int J Syst Evol Microbiol, 2009, 59 (3): 578-582. doi: 10.1099/ijs.0.003509-0
[20] YOON J, MANEERAT S, KAWAI F, et al. Myroides pelagicus sp. nov., isolated from seawater in Thailand[J]. Int J Syst Evol Microbiol, 2006, 56 (8): 1917-1920. doi: 10.1099/ijs.0.64336-0
[21] FERNANDEZ-PIQUER J, BOWMAN J P, ROSS T, et al. Molecular analysis of the bacterial communities in the live Pacific oyster (Crassostrea gigas) and the influence of postharvest temperature on its structure[J]. J Appl Microbiol, 2012, 112(6): 1134-1143. doi: 10.1111/j.1365-2672.2012.05287.x



 下载:
下载:











 粤公网安备 44010502001741号
粤公网安备 44010502001741号
