Observation of embryonic and larval development of blood parrot cichlid fish Cichlasoma synspilum×C.citrinellum
-
摘要:
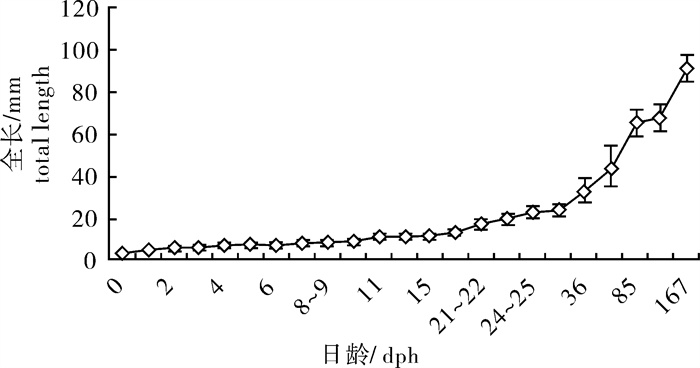
对红头丽体鱼[Cichlasoma synspilum(♀)]×红魔丽体鱼[C.citrinellum(♂)]杂交子一代(F1)(俗称“血鹦鹉”)的胚胎及仔鱼形态发育进行观察,描述了各发育时期的发育时序和形态特征。平均受精率为(91.33±3.06)%,平均孵化率为(91.67±2.08)%;血鹦鹉的受精卵呈椭圆球形,黏性,有浅黄、白灰和红褐3种颜色,无油球,平均卵长径为(1.89±0.04)mm;发育过程可分为6个阶段:受精卵阶段、卵裂阶段、原肠期、神经胚期、器官形成期和孵出期,并进一步分为28个发育分期;在水温(30±0.5)℃下历时约52 h 36 min完成孵化。初孵仔鱼全长(3.71±0.05)mm,卵黄长径为(1.74±0.09)mm,短径为(1.25±0.07)mm,于第3天开始摄食轮虫,孵出后第5天卵黄囊完全消失。第13天全长(11.86±1.02)mm,各鳍条基本形成,进入稚鱼期。
-
关键词:
- 红头丽体鱼×红魔丽体鱼子一代 /
- 胚胎发育 /
- 仔鱼形态
Abstract:We observed the embryonic and larval development of hybrids between Cichlasoma synspilum (♀) and C.citrinellum (♂).The average fertilization rate and hatching rate were (91.33±3.06)% and(91.67±2.08)%, respectively. The oval-shaped and adhesive fertile egg had three colors such as light yellow, white-gray and red brown without oil globule. The average length of fertile egg was (1.89±0.04) mm. The progress of embryonic development comprised six stages: zygote stage, cleavage stage, gastrula stage, neurula stage, organogenesis stage and hatching stage, each divided into 28 periods. At water temperature of (30±0.5)℃, the hatching time was 52 h 36 min. The total length of newly hatched larvae was (3.71±0.05) mm with yolk sac length of (1.74±0.09) mm in long diameter and (1.25±0.07) mm in short diameter. The larva started to ingest rotifers after 3 d, and the yolk sac was consumed completely 5 d later. On 13th day, the total length of the larvae was (11.86±1.02) mm and most of fin rays appeared, indicating that the larvae turned into juveniles.
-
贻贝是目前国内水产养殖的一个重要品种,具有很高的经济价值。近年来,随着贻贝养殖业的快速发展,贻贝养殖过程中的病害也日益严重[1],对贻贝免疫机制的研究已成为贻贝养殖病害防治的关键。贻贝缺乏特异性免疫系统,其免疫主要依赖于血细胞的吞噬作用和血清中各种抗菌肽分子。目前,对贻贝血清抗菌肽分子的研究较为深入,已从地中海贻贝(Mytilus galloprovincialis)和紫贻贝(M.edulis) 等不同种类的贻贝中分离鉴定了4类抗菌肽分子,分别为Mytilin、Myticin、MGD和Mytimycin[2-6]。除抗菌肽分子外,贻贝体内的各种血细胞[7-9],特别是颗粒细胞在贻贝的免疫机制中也发挥着重要的作用[10]。但目前对贻贝血细胞的蛋白质组学研究尚无相关报道,对贻贝颗粒细胞中免疫颗粒的蛋白质分子组成尚不清楚。
厚壳贻贝(M.coruscus)是广泛分布于中国东部沿海的贝类,其血清中富含各种抗菌肽分子[11-13]。为进一步了解厚壳贻贝血细胞中颗粒的蛋白质分子组成,笔者以厚壳贻贝为研究对象,通过离心方法收集厚壳贻贝血细胞,进一步分离血细胞中的颗粒,采用超声结合酸抽提方法提取颗粒中的蛋白质成分,利用线性离子阱-四级杆质谱(linear ion trap quadrupole,LTQ)对其进行了Shotgun分析,结合Mascot数据库搜索,从中鉴定了125种高丰度蛋白质成分,为深入了解厚壳贻贝血细胞的免疫机制奠定了基础,并为贻贝养殖过程中的病害防治提供理论依据。
1. 材料与方法
1.1 动物与试剂
1.1.1 试验动物
成年厚壳贻贝采自浙江舟山东极岛海域,以洁净海水在通氧条件下饲养于恒温水族箱(18~20 ℃)。
1.1.2 试剂
三氟乙酸(TFA)、α-氰基-4-羟基-肉桂酸(CCA)、二硫苏糖醇(DTT)、碘乙酰胺(IAA)、胰蛋白酶Trypsin(测序级)均为Sigma公司产品;所有测序试剂均来自Applied Biosystems公司; 色谱纯乙腈购自美国TEDIA公司;其余试剂均为进口或国产分析纯试剂。试验用去离子水由Millipore synergy纯水系统(法国Millipore公司出品)制取。
1.2 试验方法
1.2.1 血细胞的收集
厚壳贻贝饲养24 h后,参照文献[3]方法,以内含抗凝剂(Alsever液)的注射器收集厚壳贻贝血淋巴,立即离心(4 ℃,800×g,15 min),沉淀部分收集后以PBS缓冲液[137 mmol · L-1氯化钠(NaCl),7.8 mmol · L-1磷酸氢二钠(Na2HPO4),2.7 mmol · L-1氯化钾(KCl),1.47 mmol · L-1磷酸二氢钾(KH2PO4),pH 7.4]洗涤2次后收集血细胞在光学显微镜下进行检测。收集的血细胞置于-80 ℃冰箱保存备用。
1.2.2 血细胞颗粒的收集和蛋白质的提取
厚壳贻贝血细胞颗粒的收集及蛋白质的抽提参照文献[2]方法进行。上述步骤中收集的厚壳贻贝血细胞悬浮于50 mmol · L-1 Tris缓冲液(pH 8.7,含50 mmol · L-1 NaCl),采取反复冻融法对厚壳贻贝血细胞进行破裂,之后以手持式组织匀浆器于冰浴中进行匀浆,匀浆后经离心(4 ℃,10 000×g,20 min),收集位于沉淀部分的血细胞颗粒,置于2 mol · L-1醋酸溶液中[V(沉淀) : V(醋酸)=1 : 3],以超声波法(10×30 S)充分裂解所收集的血细胞颗粒,裂解液经离心(4 ℃,10 000×g,20 min)后收集上清液,加入4倍体积预冷(-20 ℃)的丙酮,待蛋白质充分沉淀后离心(4 ℃,12 000×g,20 min)收集蛋白质沉淀,冷冻干燥后于-20 ℃冰箱保存备用。
1.2.3 蛋白质的还原烷基化及酶解
上述步骤中经丙酮提取的蛋白质组分加入50 μL碳酸氢氨(NH3HCO3)(25 mmol · L-1,含10 mmol · L-1 DTT),57 ℃保温1 h后室温冷却,除去过量液体,迅速加入同等体积的新配置的NH4HCO3(25 mmol · L-1,含55 mmol · L-1碘乙酰胺),室温下暗处放置40 min以进行烷基化反应,之后将蛋白质混合物置于NH4HCO3(100 mmol · L-1,pH 8.5)溶液中。将胰蛋白酶溶于1 mmol · L-1的盐酸(HCl)中,至质量浓度为1 g · L-1。然后用NH4HCO3 (25 mmol · L-1,含10%的乙腈)溶液配成0.02 g · L-1终质量浓度的溶液,上述蛋白质组分经还原烷基化反应后加入适量胰蛋白酶酶解液于37 ℃条件下消化16~18 h。
1.2.4 LC MS/MS分析和数据处理
上述蛋白质酶解后的混合物上样反相色谱进行分离,色谱仪为纳升级LC-20AD(日本岛津公司出品),色谱柱为C18柱(15 cm×0.01 cm,填料粒径为3.5 μm,日本Michom公司出品)。流动相A相为5% CAN(含0.1% TFA),B相为95% ACN(含0.1% TFA),流速为500 μL · min-1。样品以20 μL · min-1的速度注入进样环中,使用线性梯度洗脱分离,45 min内B相体积分数由0%升至45%。
肽段鉴定在线性离子阱-轨道离子阱质谱仪(LTQ-Orbitrap,美国Thermo Fisher公司出品)上进行。质谱分析模式为:1)以Orbitrap轨道离子阱在400~2 000的质荷比(m/z)范围内以60 000的分辨率采集一级质谱图;2)用LTQ线性离子阱将第一步采集得到的质谱图中强度最高的信号进行串联质谱实验,扫描分辨率为7 500;质谱条件采用纳升级电喷雾电离方式(nano-ESI),电离电压1 900 V,扫描范围m/z 400~2 000;质谱数据由Xcalibur软件(Ⅴ2.0.7)采集并处理;处理后的质谱数据用Mascot软件分析,搜索数据库为Swiss Prot的UniProtKB(2010年9月发布)。数据库搜索参数为肽段质量误差= 50×10-6,肽段碎片离子质量误差=1.0 Da,甲硫氨酸氧化、蛋白质N端乙酰化作为可变修饰。
2. 结果
2.1 血细胞的分离收集
厚壳贻贝经灭活大肠杆菌诱导后,以注射器从后闭壳肌处收集血淋巴,通过离心方式收集血细胞,以400倍光镜进行检测,结果见图 1。所收集的厚壳贻贝血细胞形态完整,以颗粒细胞为主,细胞质中可见明显的具有折光性的颗粒,其形态特征与CHENG[9]报道一致。
2.2 血细胞颗粒的Shotgun质谱分析及数据库搜索
利用LTQ-Orbitrap质谱对厚壳贻贝血细胞颗粒蛋白质的酶解混合物进行串联质谱分析,通过de novo方法总共获得9 870个肽段序列信息,经非冗余整理后总共获得419个非冗余肽段序列。上述肽段的串联质谱图(MS/MS)信号峰明显,信噪比较高,图 2展示了表 1中序号为3的蛋白质的MS/MS质谱分析图以及推导的氨基酸序列。由图 2可见,鉴定到的肽段质量精度非常高,图 2-a为质荷比(m/z)为1 656.837 Da的母离子的MS/MS图谱,与推导的氨基酸序列(TFLVWVNEEDHIR)的理论分子量1 656.826 Da相比仅0.011 Da的差别,且理论中的24个b/y离子找到15个,说明LTQ-Orbitrap质谱所获得的MS/MS的离子碎片的质量精度和分辨率都非常好,其结果也有助于提高de novo序列鉴定以及蛋白质鉴定的准确度。
表 1 LTQ质谱MS/MS数据的搜库结果Table 1 Protein identification of hemocyte granule from M.coruscus by LTQ-Orbitrap with Mscot searching序号
No.数据库编号
accession No.in UniProtKB同源性
identity/homology物种
species匹配肽段
matched peptide得分
score1 B4J603_DROGR GH21113 Drosophila grimshawi 1 305 2 Q6UQ16_MYTED EP protein Mytilus edulis 3 258 3~4 KARG_LIOJA arginine kinase Liolophura japonica 2 215 5 B3MCR5_DROAN GF11480 Drosophila ananassae 1 209 6 ACT_PLAMG actin Placopecten magellanicus 6 209 7 Q5BQE3_9VEST actin A3 Haliotis iris 5 209 8~9 Q760P6_CRAGI arginine kinase Crassostrea gigas 3 179 10 B3N2H1_DROAN GF20391 Drosophila ananassae 4 153 11 Q9NC09_9MOLL actin Mastigoteuthis magna 1 137 12 ACT_MAYDE actin Mayetiola destructor 4 111 13~14 D7GXP9_TRICA histone H2B Tribolium castaneum 3 111 15 Q17C86_AEDAE actin Aedes aegypti 4 103 16 Q2LDZ7_HIRME cytoplasmic actin Hirudo medicinalis 3 98 17 MLE_TODPA myosin catalytic light chain Todarodes pacificus 1 97 18 Q9NC07_9MOLL actin (fragment) Alluroteuthis antarcticus 3 87 19 D0ES27_9HYME beta actin Polyrhachis vicina 6 84 20~24 B3VN78_BOMMOL.L-1A actin Bombyx mandarina 5 84 25 B4LVN2_DROVI histone H4 Drosophila virilis 1 79 26 B2YGD6_9ARAC actin Goleba lyra 2 79 27~30 B0FRF9_LITVA arginine kinase Litopenaeus vannamei 1 78 31 B4LB51_DROVI GJ12598 Drosophila virilis 1 78 32 B6EAU5_HOMAM skeletal muscle actin Homarus americanus 4 78 33 B3MQE5_DROAN histone H2A Drosophila ananassae 2 77 34 A4FT58_9BILA actin Macrobiotus sp. 3 76 35~37 B4KDT0_DROMO histone H2A Drosophila mojavensis 2 75 38 C7SP19_9BILA fructose-bisphosphate aldolase Glottidia sp. 1 75 39~41 E2IV58_HELAM actin Helicoverpa armigera 4 72 42 Q7Q944_ANOGA AGAP004835-PA Anopheles gambiae 2 70 43~45 B2YGB1_9ARAC actin Habronattus americanus 4 70 46 B0LUD9_LYMDI beta-actin Lymantria dispar 2 70 47 TPM_MYTED tropomyosin Mytilus edulis 2 66 48~50 Q966R4_9DIPT actin Chironomus yoshimatsui 2 64 51 D2A3B9_TRICA putative protein Tribolium castaneum 1 62 52 B0X6X2_CULQU dumpy Culex quinquefasciatus 1 60 53 B3MD57_DROAN GF11439 Drosophila ananassae 1 59 54 B4JTF2_DROGR GH24039 Drosophila grimshawi 1 59 55 B4N5S6_DROWI GK17871 Drosophila willistoni 1 59 56 Q6S015_DROME reverse transcriptase Drosophila melanogaster 1 59 57 Q7PYN5_ANOGA AGAP002033-PA Anopheles gambiae 1 59 58 Q6X4W3_HAELO actin Haemaphysalis longicornis 5 59 59 D2DGZ3_9CUCU cytoplasmic actin Ips confusus 2 59 60 B3MDN4_DROAN GF11378 Drosophila ananassae 1 57 61 B4NFT1_DROWI GK22698 Drosophila willistoni 2 56 62 D6X1R9_TRICA putative protein Tribolium castaneum 1 56 63 Q9VLL1_DROME D12 Drosophila melanogaster 1 55 64 B4KI41_DROMO GI10553 Drosophila mojavensis 1 54 65 B0WCT3_CULQU leucine-rich transmembrane protein Culex quinquefasciatus 1 54 66 E0AD92_BOOMI angiotensin-converting enzyme-like protein Boophilus microplus 1 50 67 E2B904_9HYME putative protein Harpegnathos saltator 1 50 68 D6WDM1_TRICA putative protein Tribolium castaneum 2 49 69 B0W6D8_CULQU survivin Culex quinquefasciatus 2 49 70 A2AXC2_TRICA gustatory receptor Tribolium castaneum 1 49 71 B0XCW8_CULQU putative protein Culex quinquefasciatus 1 49 72 B4MJJ2_DROWI GK20842 Drosophila willistoni 1 48 73 B3P4Z6_DROER GG11834 Drosophila erecta 1 48 74 E2BDR6_9HYME lipid storage droplets surface-binding protein 1 Harpegnathos saltator 1 48 75 B7UEY4_MYTGA superoxide dismutase Mytilus galloprovincialis 1 47 76 B4NIN2_DROWI GK13512 Drosophila willistoni 1 47 77 B0XJN8_CULQU phosphatase Slingshot Culex quinquefasciatus 1 47 78 E2BKC0_9HYME MAP kinase Harpegnathos saltator 1 47 79 E2BI22_9HYME N-acetylglucosamine-6-sulfatase Harpegnathos saltator 1 46 80 Q75W49_CRAGI 78kDa glucose regulated protein Crassostrea gigas 2 46 81 D7EKZ5_TRICA putative protein Tribolium castaneum 1 46 82 E2AMK0_9HYME DE-cadherin Camponotus floridanus 1 46 83 B0W9Q9_CULQU putative protein Culex quinquefasciatus 1 46 84 B3MMOL.L-1U1_DROAN GF15119 Drosophila ananassae 1 45 85 Q95UF1_DROSI ankyrin Drosophila simulans 1 45 86 B4KUQ4_DROMO GI11592 Drosophila mojavensis 1 45 87 Q16WC1_AEDAE putative protein Aedes aegypti 1 45 88 Q1HPK0_BOMMOL.L-1O vesicle amine transport protein Bombyx mori 1 45 89 D6X0H5_TRICA putative protein Tribolium castaneum 1 45 90 E0VRW9_PEDHC putative protein Pediculus humanus 1 45 91 B4M706_DROVI GJ16541 Drosophila virilis 2 45 92 B0W417_CULQU ataxia telangiectasia Culex quinquefasciatus 1 45 93 Q7PK24_ANOGA AGAP009815-PA Anopheles gambiae 1 45 94 D0IQG5_DROME MIP13274p Drosophila melanogaster 1 44 95 B7P8Q8_IXOSC putative protein Ixodes scapularis 1 44 96 B3ME79_DROAN GF12460 Drosophila ananassae 1 44 97 D7F165_BOMMOL.L-1O endonuclease-reverse transcriptase Bombyx mori 1 44 98 D7EKS8_TRICA putative protein Tribolium castaneum 1 43 99 D7ELX7_TRICA putative protein Tribolium castaneum 1 43 100 Q9U0S5_MYTGA catchin protein Mytilus galloprovincialis 2 43 101 Q9U0S7_MYTGA myosin heavy chain Mytilus galloprovincialis 1 43 102 B4JUI7_DROGR GH15720 Drosophila grimshawi 1 43 103 Q966V3_MYTGA calponin-like protein Mytilus galloprovincialis 5 43 104 Q16SH8_AEDAE putative protein Aedes aegypti 1 43 105 E2BDB9_9HYME putative protein Harpegnathos saltator 1 43 106 MLE_AEQIR myosin essential light chain Aequipecten irradians 1 43 107 E2C3M9_9HYME hexokinase-2 Harpegnathos saltator 1 43 108 B5DNP1_DROPS GA22337 Drosophila pseudoobscura 1 42 109 A7UTW9_ANOGA AGAP005832-PA Anopheles gambiae 1 42 110 B7P2A1_IXOSC 26S proteasome regulatory complex Ixodes scapularis 1 42 111 B0WTT0_CULQU putative protein Culex quinquefasciatus 1 42 112 B7PXU8_IXOSC CAP-Gly linker protein Ixodes scapularis 1 42 113 B0WAH4_CULQU WD repeat protein 36 Culex quinquefasciatus 1 42 114 E2A5M0_9HYME putative protein Camponotus floridanus 1 42 115 B4JPX7_DROGR GH13313 Drosophila grimshawi 1 42 116 C4WX22_ACYPI ACYPI004711 protein Acyrthosiphon pisum 1 42 117 B4J2K3_DROGR GH16634 Drosophila grimshawi 1 42 118 Q0C728_AEDAE golgi protein Aedes aegypti 1 42 119 E0VRY6_PEDHC guanine nucleotide exchange factor DBS Pediculus humanus subsp. corporis 1 41 120 D2T1I1_9NEOP cadherin-like protein Polyplectropus sp. 1 41 121 Q16U82_AEDAE putative protein Aedes aegypti 1 41 122 E0VM19_PEDHC alpha-actinin-4 Pediculus humanus 1 41 123 D1M9K5_9MAXI elongation factor 1 Notochthamalus scabrosus 1 40 124 E2A3P3_9HYME N-acetylgalactosaminyltransferase Camponotus floridanus 1 40 125 E2C7U1_9HYME putative protein Harpegnathos saltator 1 40 注:按数据库得分从高到低排列,展示得分在40分以上的结果
Note: Scores are ranked from high to low,and those more than 40 are shown.![]() 图 2 表 1中序号为3的蛋白质MS/MS图谱a. m/z为1 656.84 Da的MS/MS图谱,分别显示了其b离子系列和y离子系列的单电荷峰及双电荷峰(“+ +”标注),由此推导的肽段氨基酸序列为“TFLVWVNEEDHIR”;b.m/z为1 997.95 Da的MS/MS图谱,分别显示了其b离子系列和y离子系列的单电荷峰及双电荷峰(“+ +”标注),由此推导的肽段氨基酸序列为“GIHGEHTESVGGVYDISNK”;其鉴定结果为精氨酸激酶(来自Liolophura japonica)Fig. 2 Tandem mass spectrum of No.3 protein in Tab. 1a. m/z indicates MS/MS spectrum with m/z 1 656.84 acquired on LTQ-Orbitrap mass spectrometer and the amino acid sequence "TFLVWVN-EEDHIR" deduced from precise mass difference between adjacent b-and y-ions; b. m/z indicates MS/MS spectrum with m/z 1 997.95 acquired on LTQ-Orbitrap mass spectrometer and the amino acid sequence "GIHGEHTESVGGVYDISNK" deduced from precise mass difference between adjacent b-and y-ions. The results of the Mascot search are presented as arginine kinase from Liolophura japonica.
图 2 表 1中序号为3的蛋白质MS/MS图谱a. m/z为1 656.84 Da的MS/MS图谱,分别显示了其b离子系列和y离子系列的单电荷峰及双电荷峰(“+ +”标注),由此推导的肽段氨基酸序列为“TFLVWVNEEDHIR”;b.m/z为1 997.95 Da的MS/MS图谱,分别显示了其b离子系列和y离子系列的单电荷峰及双电荷峰(“+ +”标注),由此推导的肽段氨基酸序列为“GIHGEHTESVGGVYDISNK”;其鉴定结果为精氨酸激酶(来自Liolophura japonica)Fig. 2 Tandem mass spectrum of No.3 protein in Tab. 1a. m/z indicates MS/MS spectrum with m/z 1 656.84 acquired on LTQ-Orbitrap mass spectrometer and the amino acid sequence "TFLVWVN-EEDHIR" deduced from precise mass difference between adjacent b-and y-ions; b. m/z indicates MS/MS spectrum with m/z 1 997.95 acquired on LTQ-Orbitrap mass spectrometer and the amino acid sequence "GIHGEHTESVGGVYDISNK" deduced from precise mass difference between adjacent b-and y-ions. The results of the Mascot search are presented as arginine kinase from Liolophura japonica.对上述419个非冗余肽段序列进行Mascot数据库搜索,因Mascot数据库过于庞大且贻贝本身没有基因组数据库,为提高搜库结果的准确性,采用的搜索数据库为Protostomia 201011(原口动物门,包含666 319个非冗余序列),经数据库搜索,总计获得得分较高(score>40)的蛋白质鉴定结果为125个(表 1)。此次研究中所鉴定的蛋白部分来自于贝类,如地中海贻贝、紫贻贝以及日本花棘石鳖(Acanthopleura japonica)、扇贝(Chlamys farreri)、长牡蛎(Ostrea gigas)等,还有部分鉴定结果来自于其他亲缘关系较远的物种,例如果蝇(Drosophila virilis)和黑斑海兔(Aplysia kurodai)等,这是由于厚壳贻贝没有基因组数据库或完整的蛋白质数据库,因此在搜库过程中所匹配的结果往往是来自于其他物种的同源蛋白。
在已鉴定的125种蛋白中,肌动蛋白所占比例较高,其他高丰度蛋白还包括精氨酸激酶,组蛋白,细胞骨架蛋白,代谢相关酶类,免疫相关蛋白,细胞粘附相关蛋白,以及部分未知蛋白等。
3. 讨论
贻贝缺乏特异性免疫系统,其免疫机制主要依赖于呼吸爆发机制、巨噬细胞的吞噬以及血淋巴中的各种抗菌肽分子[14-15]。其中血细胞在贝类的免疫系统中占据着中心地位,可通过吞噬、胞内消化、细胞毒性等直接杀死或清除入侵微生物,同时可激活或加强其他免疫反应机制,如诱导细胞内的酶类和细胞毒分子分泌,协同血淋巴中的体液免疫因子等[15-16]。贻贝的颗粒细胞可运动至贻贝受伤部位或微生物入侵部位,通过内吞作用或者释放颗粒细胞内所储存的免疫相关蛋白来达到消灭病原微生物的目的[17-18],但目前对于贻贝颗粒细胞的蛋白质组成尚不清楚,贻贝颗粒细胞中免疫颗粒的蛋白质组成研究对于了解贻贝血细胞的免疫机制具有重要意义。
为了解厚壳贻贝血细胞中免疫颗粒的蛋白质组成特点,笔者利用LTQ-Orbitrap质谱对酸抽提的厚壳贻贝血细胞免疫颗粒蛋白质成分进行了Shotgun分析。Shotgun策略是一种快速、高通量鉴定蛋白质混合物的质谱方法,可直接用于微量蛋白质混合物的快速分析和鉴定,而无需经过双向电泳对蛋白质的预先分离;同时,LTQ-Orbitrap质谱具有扫描速度快、分辨率高以及质量精度高等特点,非常适合于Shotgun分析[19]。利用上述方法在厚壳贻贝血细胞免疫颗粒中共鉴定了125种数据库评分在40分以上的蛋白(表 1),具体可分为以下几大类:1)细胞骨架相关蛋白,包括肌动蛋白以及其他骨架蛋白如肌凝蛋白和catching蛋白等;2)细胞粘附相关蛋白,如钙黏着蛋白和锚蛋白等;3)代谢相关酶类,如果糖二磷酸醛缩酶、己糖激酶和精氨酸激酶等;4)膜泡运输相关蛋白,如单胺囊泡转运蛋白、lipid storage droplets surface-binding protein等;5)解毒相关蛋白,如超氧化物歧化酶(SOD)等;6)细胞信号转导相关蛋白,如丝裂原活化蛋白激酶(MAPK)等;7)其他蛋白,包括组蛋白、细胞凋亡相关蛋白以及未知蛋白等。
该研究从厚壳贻贝血细胞颗粒中鉴定的蛋白质种类与其他无脊椎动物血细胞的蛋白质组学研究结果具有一致性,例如,HERBINIERE等[20]在对普通卷甲虫(Armadillidium vulgare)的血细胞进行蛋白质组学分析时,发现丰度最高的蛋白主要是细胞骨架蛋白、酶类、细胞粘附蛋白等。此外,上述鉴定结果中已有部分蛋白被证明与无脊椎动物的免疫存在直接联系。例如,发现部分无脊椎动物的肌动蛋白在宿主细胞遭受微生物入侵时,其表达量会显著上升[21-23];精氨酸激酶在甲壳动物受到免疫刺激或者病毒感染后,其表达量大量增加[24-25];丝裂原活化蛋白激酶则在宿主清除体内入侵病原体的时候被激活,在无脊椎动物免疫系统中发挥着至关重要的作用[26]。
在上述鉴定的蛋白中,SOD被认为是贝类通过呼吸爆发参与免疫反应过程中的一种关键酶,可通过产生过氧化氢(H2O2)来达到杀菌效果,并且SOD可以保护贝类细胞在呼吸爆发过程中保护自身细胞免受超氧化物的损伤[26-27];而其他蛋白,如肌动蛋白、膜泡运输相关蛋白、精氨酸激酶及细胞信号转导相关蛋白等,推测在贻贝的免疫过程中也发挥着关键作用。例如,由于贝类血细胞具有较强的趋化以及吞噬作用,高丰度的肌动蛋白、骨架蛋白和膜泡运输相关蛋白可能与贻贝血细胞趋化、吞噬、免疫囊泡的释放等有关;而精氨酸激酶与细胞信号转导相关蛋白则可能与贻贝免疫细胞的激活和细胞杀伤作用有关;尽管上述蛋白与贻贝免疫反应之间的联系尚缺乏进一步试验证据,但该研究结果为深入了解免疫颗粒的蛋白质成分的组成以及在贻贝免疫过程中的机制奠定了基础,其鉴定结果中的部分蛋白可作为贻贝免疫相关蛋白进行深入的结构与功能分析。该研究未能鉴定到溶菌酶以及抗菌肽等常规的免疫相关蛋白,这可能与该类分泌蛋白在血细胞颗粒中的丰度较低有关。
对于无脊椎动物的细胞免疫,目前的研究多集中于免疫细胞的分类、功能和细胞杀伤机制等。多数无脊椎动物免疫细胞均含有不同类型的免疫颗粒,免疫颗粒在无脊椎动物的免疫系统中发挥着关键作用[16]。但是,对于无脊椎动物免疫细胞的颗粒蛋白质组成,由于其提取困难、蛋白质丰度极低,因此相关研究尚不多见。目前对于无脊椎动物免疫相关蛋白的研究大多数采用直接从血清和血细胞中纯化或是在不同物种中克隆和鉴定与已知免疫因子同源的免疫相关基因,这样的研究策略显然限制了高通量发现新颖无脊椎动物的免疫相关蛋白及其免疫机制的深入分析。该研究利用Shotgun技术的高通量和高分辨率优势,初步探明了厚壳贻贝血细胞颗粒的蛋白质组成及特点,为深入了解厚壳贻贝血细胞颗粒的蛋白组成、贻贝免疫分子标记的筛选及其免疫机制奠定了基础。
-
图版Ⅰ 血鹦鹉鱼的胚胎发育图(×20)(左至右、上至下排列)
1. 受精卵;2. 胚盘形成;3. 2细胞期;4. 4细胞期;5. 8细胞期;6. 16细胞期;7. 32细胞期;8. 64细胞期;9. 多细胞期;10. 桑椹期;11. 高囊胚期;12. 低囊胚期;13. 原肠初期;14. 原肠中期;15. 原肠后期;16. 胚体形成期;17. 胚孔封闭期;18. 视囊形成期;19. 体节形成期;20. 听囊形成期;21. 晶体形成期;22. 头部与卵分开;23. 心脏跳动期;24. 肌肉效应期;25. 将孵期
图版Ⅰ. Developmental stages ofC.synspilum×C.citrinellum (from left to right)
1. zygote; 2. blastoderm formation; 3. 2-cell stage; 4. 4-cell stage; 5. 8-cell stage; 6. 16-cell stage; 7. 32-cell stage; 8. 64-cell stage; 9. multicellular stage; 10. morula stage; 11. high blastula stage; 12. low blastula stage; 13. early gastrula stage; 14. mid gastrula stage; 15. late gastrula stage; 16. embryo body stage; 17. closure of blastopore stage; 18. optic capsule stage; 19. muscle burl stage; 20. otocyst stage; 21. crystal stage; 22. head isolation stage; 23. heart-beating stage; 24. muscle effect stage; 25. hatching stage
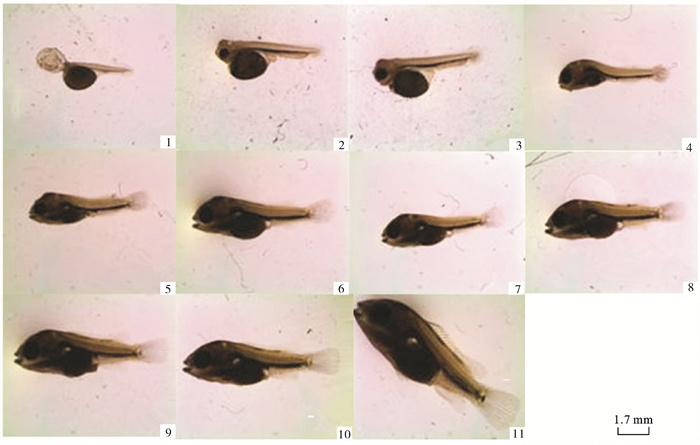
图版Ⅱ 仔鱼图版(×7)
1. 初孵仔鱼;2. 1日龄仔鱼;3. 2日龄仔鱼;4. 3日龄仔鱼;5. 4日龄仔鱼;6. 5日龄仔鱼;7. 6日龄仔鱼;8. 7日龄仔鱼;9. 8~9日龄仔鱼;10. 10日龄仔鱼;11. 11日龄仔鱼
图版Ⅱ. Development of larvae of C.synspilum×C.citrinellum
1. newly-hatched larva; 2.1-dph larva; 3. 2-dph larva; 4. 3-dph larva; 5. 4-dph larva; 6. 5-dph larva; 7. 6-dph larva; 8. 7-dph larva; 9. 8~9-dph larva; 10. 10-dph larva; 11. 11-dph larva
表 1 血鹦鹉专用配合饲料
Table 1 Formulated feed of C.synspilum×C.citrinellum
% 营养成分proximate composition 质量分数content 粗蛋白crude protein ≥52 粗脂肪crude fat ≥9.0 粗灰分crude ash ≤16 粗纤维crude fiber ≤3.0 钙Ca ≥2.0 总磷TP ≥1.8 赖氨酸lysine ≥3.5 水分moisture ≤10.0 表 2 血鹦鹉受精卵的受精率和孵化率
Table 2 Fertilization rate and hatching rate of C.synspilum×C.citrinellum
试验次数experimental times 受精率/% fertilization rate 孵化率/% hatching rate 1 94 90 2 88 91 3 92 94 x±SD 91.33±3.06 91.67±2.08 表 3 血鹦鹉的胚胎发育过程
Table 3 Embryonic development of C.synspilum×C.citrinellum
发育时期developmental stage 发育过程development 发育时间developmental time (h:min) 受精后时间time after fertilization 主要特征main characteristics of each stage 受精卵阶段zygote stage 受精 15:30 0 (图版Ⅰ-1) 胚盘形成 16:16 46 min 侧面观如帽状突起(图版Ⅰ-2) 卵裂阶段cleavage stage 2细胞期 16:55 1 h 25 min 第1次卵裂,形成2个细胞(图版Ⅰ-3) 4细胞期 17:20 1 h 50 min 第2次卵裂,分裂面成“十”字形,形成4个细胞(图版Ⅰ-4) 8细胞期 17:40 2 h10 min 第3次卵裂,分裂面与第一次平行,形成8个细胞(图版Ⅰ-5) 16细胞期 17:52 2 h 22 min 第4次卵裂,分裂面与第二次平行,形成16个细胞(图版Ⅰ-6) 32细胞期 18:38 3 h 08 min 第5次卵裂,形成32个细胞(图版Ⅰ-7) 64细胞期 18:52 3 h 20 min 第6次卵裂,形成64个细胞(图版Ⅰ-8) 多细胞期 19:56 4 h 2 4min 细胞变小,开始重叠(图版Ⅰ-9) 桑椹期 21:46 6 h 14 min 细胞变的更小,细胞团似桑椹(图版Ⅰ-10) 高囊胚期 22:12 6 h 40 min 囊胚高而集中,呈高帽状(图版Ⅰ-11) 低囊胚期 23:22 7 h 50 min 囊胚边缘变薄,细胞开始下包(图版Ⅰ-12) 原肠期gastrula stage 原肠初期 2:43 11 h 11 min 细胞下包卵黄1/4处(图版Ⅰ-13) 原肠中期 6:20 14 h 48 min 细胞下包卵黄1/2处(图版Ⅰ-14) 原肠后期 9:04 17 h 32 min 细胞下包卵黄3/4处(图版Ⅰ-15) 神经胚期neurula stage 胚体形成期 11:54 20 h 24 min 胚体轮廓清晰(图版Ⅰ-16) 胚孔封闭期 13:24 22 h 54 min 胚层下包,胚孔将封闭(图版Ⅰ-17) 器官形成期organogenesis stage 视囊形成期 14:54 24 h 24 min 胚体头部出现一对视囊(图版Ⅰ-18) 体节形成期 16:50 26 h 20 min 胚体中部出现体节(图版Ⅰ-19) 听囊形成期 19:36 29 h 06 min 视囊后边出现一对听囊(图版Ⅰ-20) 晶体形成期 23:16 32 h 46 min 晶体轮廓形成(图版Ⅰ-21) 头部与卵分开 0:42 34 h 12 min 头部开始与卵分开(图版Ⅰ-22) 心脏跳动期 3:01 36 h 31 min 心脏开始跳动(图版Ⅰ-23) 血流期 7:35 41 h 05 min 胚体中血液在流行 肌肉效应期 15:19 48 h 49 min 胚体扭动(图版Ⅰ-24) 孵出期hatching stage 将孵期 18:23 51 h 53 min 胚体剧烈扭动,尾部变长绕至头部。心脏跳动加快 孵化期 18:57 52 h 17 min 头部破膜而出,而尾部仍在膜中(图版Ⅰ-25) 初孵期 19:16 52 h 36 min 全部孵出(图版Ⅱ-1) -
[1] 李景龙, 钱辉仁, 邹金照. 血鹦鹉鱼高密度养殖技术[J]. 科学养鱼, 2012(9): 77-79. https://xueshu.baidu.com/usercenter/paper/show?paperid=2841c9dfd6604855423321a92f94af82&site=xueshu_se&hitarticle=1 [2] 张晓红, 吴锐全, 王海英, 等. 饲料中添加虾青素对血鹦鹉皮肤类胡萝卜素含量和体色三刺激值的影响[J]. 广东海洋大学学报, 2010, 30(4): 77-80. doi: 10.3969/j.issn.1673-9159.2010.04.016 [3] 石英, 冷向军, 李小勤, 等. 饲料蛋白水平对血鹦鹉幼鱼生长、体组成和肠道蛋白消化酶活性的影响[J]. 水生生物学报, 2009, 33(5): 874-880. doi: 10.3724/SP.J.0000.2009.50874 [4] 梁利国, 秦国民, 张晓君, 等. 血鹦鹉铜绿假单胞菌病原菌鉴定和药敏试验[J]. 淡水渔业, 2010, 40(6): 50-55. doi: 10.3969/j.issn.1000-6907.2010.06.009 [5] YANG Huiyun, MU Xidong, LUO Du, et al. Sodium taurocholate, a novel effective feed-additive for promoting absorption and pigmentation of astaxanthin in blood parrot (Cichlasoma synspilum ♀×Cichlasoma citrinellum ♂)[J]. Aquaculture, 2012, 350/351/352/353: 42-45.
[6] 任丽珍, 程利民, 徐建荣, 等. 鳡鱼(♂)和赤眼鳟(♀)杂交F1胚胎发育研究[J]. 淡水渔业, 2011, 41(4): 89-95. https://wenku.baidu.com/view/6fcff703581b6bd97f19ea2a.html?_wkts_=1731916001752&needWelcomeRecommand=1 [7] 张兴忠. 鱼类遗传与育种[M]. 北京: 农业出版社, 1988: 27-36, 167-168, 181-192, 200-201. [8] 张杨宗, 谭玉钧, 欧阳海. 中国池塘养鱼学[M]. 北京: 科学出版社, 1989: 32, 249-254. [9] 金万昆, 朱振秀, 王春英, 等. 框鳞镜鲤(♀)×团头鲂(♂)杂交及其杂种F1的形态学特征[J]. 淡水渔业, 2003, 33(5): 16-18. doi: 10.3969/j.issn.1000-6907.2003.05.004 [10] 徐玲玲, 邵邻相, 谢炜, 等. 七彩神仙鱼胚胎及仔鱼发育研究[J]. 河南师范大学学报: 自然科学版, 2012, 40(1): 125-129. doi: 10.3969/j.issn.1000-2367.2012.01.033 [11] 丁庆忠, 王芳, 齐遵利, 等. 金鱼品种琉金(♀)×龙睛(♂)杂交种F1胚胎发育观察[J]. 安徽农业科学, 2012, 40(13): 7755-7758. doi: 10.3969/j.issn.0517-6611.2012.13.054 [12] 陈国柱, 方展强, 马广智. 唐鱼胚胎发育观察[J]. 中国水产科学, 2004, 11(6): 489-496. doi: 10.3321/j.issn:1005-8737.2004.06.001 [13] 王世锋, 谢丽, 王玉涛, 等. 日本锦鲤人工繁殖技术和胚胎发育过程观察[J]. 喀什师范学院学报, 2010, 31(5): 49-51. doi: 10.3969/j.issn.1006-432X.2010.03.017 [14] LIN Qiang, LU Junyi, GAO Yongli, et al. The effect of temperature on gonad, embryonic development and survival rate of juvenile seahorses, Hippocampus kuda Bleeker[J]. Aquaculture, 2006, 254(1/2/3/4): 701-713. doi: 10.1016/j.aquaculture.2005.11.005
[15] 李岑, 姜志强, 刘庆坤, 等. 泰国斗鱼的胚胎发育及温度对胚胎发育的影响[J]. 大连海洋大学学报, 2011, 26(5): 402-406. https://d.wanfangdata.com.cn/periodical/Ch9QZXJpb2RpY2FsQ0hJTmV3UzIwMjQxMTA1MTcxMzA0Eh5TY2llbmNlUGFwZXIyMDEzMDkyNDAwMDAyMDUxMDMaCDUybm9jeWt4 [16] 胡文彪, 李清, 杨瑞斌, 等. 翘嘴鲌(♀)和黑尾近红鲌(♂)杂交F1的胚胎发育和胚后发育观察[J]. 华中农业大学学报, 2013, 32(1): 103-108. https://www.doc88.com/p-0099211733371.html [17] 易祖盛, 陈湘粦, 王春, 等. 倒刺鲃胚胎发育的研究[J]. 中国水产科学, 2004, 11(1): 65-68. doi: 10.3321/j.issn:1005-8737.2004.01.012 [18] 周秋白, 吴华东, 吴红翔, 等. 黄鳝的胚胎及胚后发育[J]. 水产学报, 2003, 27(6): 505-512. doi: 10.3321/j.issn:1000-0615.2003.06.001 [19] 杜劲松, 海萨, 苏德学, 等. 白斑狗鱼胚胎和仔鱼发育的研究[J]. 水生生物学报, 2004, 28(6): 629-634. doi: 10.3321/j.issn:1000-3207.2004.06.008 [20] 李弘华. 淤泥湖、梁子湖、鄱阳湖团头鲂mtDNA序列变异及遗传结构分析[J]. 淡水渔业, 2008, 38(4): 63-65. doi: 10.3969/j.issn.1000-6907.2008.04.014 [21] 柳学周, 孙中之, 马爱军, 等. 半滑舌鳎亲鱼培育及采卵技术研究[J]. 海洋水产研究, 2006, 27(2): 25-32. doi: 10.3969/j.issn.1000-7075.2006.02.004 -
期刊类型引用(4)
1. 路俊怡,姜立妍,龙凯,王韬,吴正理,李艳红. HcTLR1通过MyD88-NF-κB信号通路参与三角帆蚌抗菌免疫应答. 南方水产科学. 2024(06): 19-30 .  本站查看
本站查看
2. 张林宝,孙伟,宁璇璇,蔡文贵,张喆,陈海刚,马胜伟,贾晓平. 菲律宾蛤仔脂多糖诱导的肿瘤坏死因子α VpLITAF基因克隆及其对微生物侵染的应答研究. 海洋与湖沼. 2014(04): 895-901 .  百度学术
百度学术
3. 王志新,梁海鹰,杜晓东,朱家萍. 蛋白质组学在贝类研究中的应用. 生命科学研究. 2014(02): 184-188 .  百度学术
百度学术
4. 张晗,姜敬哲,王江勇. 蛋白质组学研究的发展及其在经济贝类研究中的应用. 广东农业科学. 2013(22): 170-173+182 .  百度学术
百度学术
其他类型引用(4)




 下载:
下载:


 粤公网安备 44010502001741号
粤公网安备 44010502001741号
