Study on burst swimming speeds of two typical releasing fish from Beipan River
-
摘要:
长臀

Cranoglanis bouderius and Onychostoma sima, the main releasing fish in Beipan River, have obvious differences in their releasing effect. We tested the two fish′s burst swimming speeds by increasing velocity method with the device made by ourself. The results show that the burst swimming speed of O.sima was higher than that of C.bouderius. The burst swimming speed and relative burst swimming speed of the two fish increased and declined along with the increasing body length with linear approximation, respectively. The investigation provides references for assessment of enhancement and releasing effect for fish from Beipan River as well as protective measures for blocking fish, luring fish and fishing boat in Beipan River in the future.
-
北盘江发源于云南宣威马雄山西北麓,流经滇东、黔西南,在贵州省望谟县蔗香双江口与南盘江汇合后称红水河,其水能资源十分丰富,有多处优良水力坝址。随着11座梯级水电站在北盘江上陆续建成运行,势必对该流域鱼类资源产生重要影响。为了防止水利工程对河道鱼类产生不利影响,结合工程实际情况决定采用增殖放流措施来保护鱼类资源。近期正在放流的对象有长臀






根据国外研究报道,对于放流的幼鱼,在放流后7 d内能否生存取决于其游泳能力,且有过逃避捕食经验的鱼会比无经验的鱼更好地逃避敌害而幸存下来[3]。其中突进游泳是鱼类在逃避敌害、捕获食物、短暂急促环境刺激、穿越高速水流等情况下表现出的游泳行为[4-6],在一定程度上决定了鱼类野外生存的能力。可以认为放流鱼的突进游速与其野外生存能力之间存在着一定的联系。
突进游速持续时间在20 s以内,是鱼类无氧运动的重要测量指标[7],是鱼类3种常规判定鱼类游泳能力指标之一[8],而中国学者对鱼的突进游速研究甚少,仅见史航等[9]对许氏平鲉(Sebastods schlegelii)、大泷六线鱼(Hexagrammos otakii)的临界游速与爆发游速及其生理指标的研究和乔云贵等[10]对不同淡水鱼类游泳速度的初步研究。而且中国对于游泳能力的研究主要是为近年来兴起的鱼道建设提供设计参考资料,对于游泳能力与增殖放流之间联系的探索并不多。对已有的长臀


1. 材料与方法
1.1 试验装置
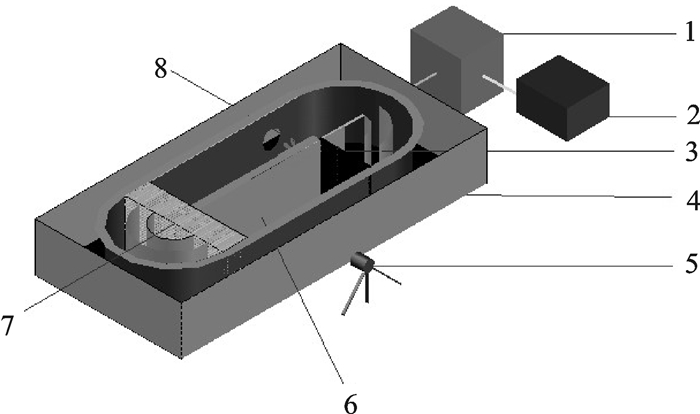
测试研究所用装置为实验室自制装置[14](图 1)。装置的体积为54 L(长×宽×高:86 cm×37 cm×17 cm),观察区体积为4.50 L(长×宽×高:37 cm×11 cm×11 cm)。试验装置通过调频器改变电机的转速来实现水流流速的改变,在水流进入观察区处设置整流器,使得试验鱼能在较为平稳的近似等速的水流中游泳,当试验鱼在迎流的游动中保持相对位置不变时可认为鱼在用一个与水流流速十分接近的游速在游动,最后认为此时水流的流速等于试验鱼的游速。整个装置中的水流处于循环流动中,在螺旋桨的旁边开一圆形小孔,可以补充与大气连接的水体进入密闭空间,使水流获得一定的溶氧,进一步减小溶氧因素对鱼类游泳能力的影响。
1.2 试验材料
试验鱼由贵州北盘江光照鱼类增殖放流站提供,选取即将要放流的白甲鱼和长臀


1.3 流速校核
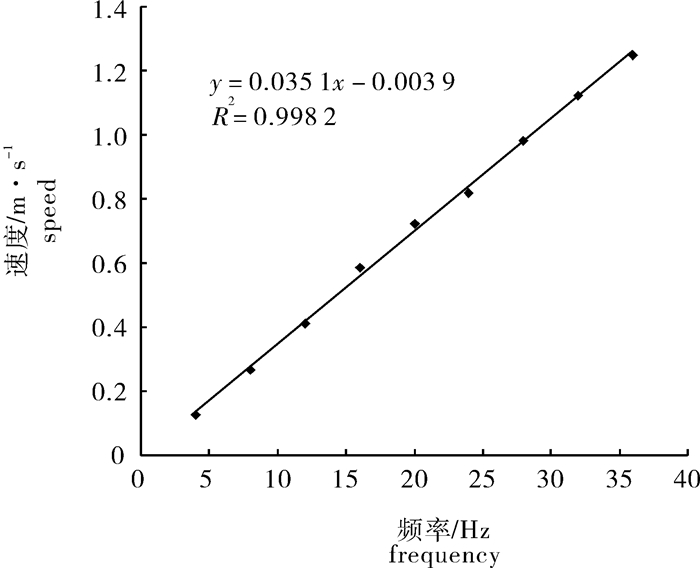
通过调节变频器控制电机转速从而改变试验水槽中的水流流速,频率步长为4 Hz。此次试验在游泳槽的观察区选取3个断面,每个断面上选取上、中、下3个点进行测速,水流的速度由Vectrino小威龙点式流速仪(Nortek)测定,每一频率下各个点读取3次读数,最后取平均值。建立流速(y) 与调节频率(x) 之间的线性关系:y=0.035 1x-0.003 9,R2=0.998 2 (图 2)。
1.4 试验及计算方法
第一步需要进行临界游速Ucrit预试验。选取1尾体质状况良好的鱼放于水槽游泳区内,给鱼一个极小的流速适应20 min,之后每1min以0.5 BL·s-1(BL:体长)的速度升高水流速度,直到试验鱼疲劳。由频率与速度关系得出临界游速粗略值,作为随后正式试验的调节参数。
正式试验时,在循环控温水池中选取状况良好、未受伤的2种鱼各10尾进行逐条试验。将每尾试验鱼用直径为20 cm的小塑料盆舀至试验水槽测试区,封上测试区顶盖,开启调频电机,在0.5 BL·s-1的水流速度下适应1 h后,每隔5 min将流速调高0.5 BL·s-1直至60%的Ucrit估计值[15],以后每隔20 s将流速提高15%Ucrit,直到试验鱼达到力竭状态(疲劳判定准则为试验鱼被水冲至游泳槽尾部拦网并停留20 s以上)。整个游泳试验过程溶解氧质量浓度不低于7 mg·L-1,游泳装置内水温控制在(22.0±0.5)℃。记录试验鱼的力竭时刻,并将其从观察区中取出,测定体长、体质量。Uburst计算公式参照临界游速公式[16]:
$$ U_{\text {burst }}=U+(t / T) \Delta U $$ (1) 式中T为在各速度梯度下设定时间(min),U为鱼力竭前一档速度,ΔU为各速度梯度的速度增量(15% Ucrit估计值),t为未能完成设定时间的实际持续游泳时间(t<20 s)。实测Uburst即为绝对临界游泳速度$U_{\text {burst }}^a$ ,为了消除体长对Uburst的影响、以便更有效地比较各种鱼的游泳能力,一般采用相对临界游泳速度(Ur,单位为BL·s-1),其计算公式表示为:
$$ U_{\text {burst }}^r=U_{\text {burst }}^a/ B L $$ (2) 1.5 数据处理
试验测试所得数据用Excel 2003进行计算绘图并用SPSS 19.0软件进行了鱼种之间数据比较,分析比较2种鱼类的突进游速及相对突进游速之间的差异。统计值以平均数±标准差(X ±SD)描述,差异显著以P<0.05表示。通过回归分析对鱼类体长与临界游速、体长与突进游速的关系进行拟合。
2. 结果与分析
根据鱼类游速公式计算,经分析得出长臀



 表 1 长臀
表 1 长臀 Table 1 Burst swimming speed of C.bouderius and O.sima
Table 1 Burst swimming speed of C.bouderius and O.sima种类
species体长/cm
length突进游速/cm·s-1
burst swimming speed相对突进游速/BL·s-1
relative burst swimming speed长臀 
11.44±3.31 94.10±10.93a 8.67±1.75a 白甲鱼(O.sima) 14.99±4.46 153.70±9.97b 10.94±2.71b 注:表中的值为平均值±标准差(n=10);同一列中具有不同字母标记的数值表示差异显著(P < 0.05)
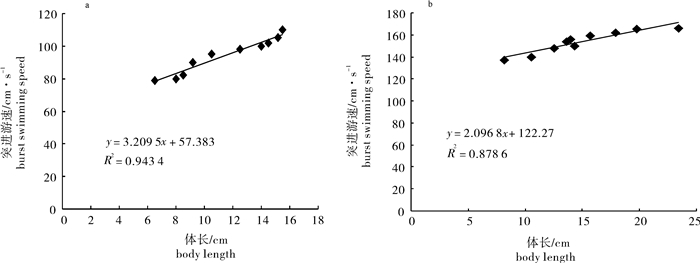
Note: Data are shown in X ±SD(n=10);values with different superscript letters in the same column are different from each other(P < 0.05).2种鱼的突进游速随体长的增长呈递增趋势(图 3),而相对突进游速随体长的增长则呈递减趋势,并且线性关系比较显著(图 4)。其中长臀


3. 讨论
衡量突进游泳行为的指标——突进游速与持续时间,与鱼的规格等因素有关,就绝对速度而言,突进游速与鱼的体长成正比例关系,而相对游速则与鱼的体长成反比例关系[17-18]。此研究结果表明,白甲鱼的突进游速大于长臀




长臀


笔者认为,白甲鱼的增殖放流效果显著可能得益于其突出的游泳能力,而其体型特征是突出游泳能力的根本原因;长臀

研究表明,大规格的放流鱼苗成活率要高于小规格的鱼苗[25],这与鱼类的突进游速随着体长的增大而增加存在一定的关系。可以根据鱼类体长与突进游速的关系得出鱼类在野外生存所需最佳突进游速下的体长参数。由于研究鱼类野外生存所需最佳突进游速涉及众多因素,目前没有相关的概念阐述,笔者研究仅从捕食关系来选定野外生存最佳突进游速。北盘江中分布着一定数量的平均体长在20.00 cm左右的鳜(Simiperca)、鳡(Elopichthys bambusa)、鲶(Silurus)等野生鱼,这些鱼种在遇到尺寸合适的放流幼鱼时会进行猎食,由于绝大多数鱼类的突进游速可近似采用10.00 BL·s-1进行估算,笔者研究采用9.00 BL·s-1估算,认为3种捕食鱼的突进游速为180.00 cm·s-1。则放流鱼类要想逃脱捕食鱼类的攻击至少需要具备180.00 cm·s-1的突进游速,因此选择该游速为放流鱼类野外生存的最佳突进游速。根据笔者研究得出的突进游速与体长的关系,计算出长臀


目前对于突进游速的测试方法还不成熟,笔者仅参照相对较为成熟的临界游速测试方法测定长臀

-
表 1 长臀

Table 1 Burst swimming speed of C.bouderius and O.sima
种类
species体长/cm
length突进游速/cm·s-1
burst swimming speed相对突进游速/BL·s-1
relative burst swimming speed长臀 
11.44±3.31 94.10±10.93a 8.67±1.75a 白甲鱼(O.sima) 14.99±4.46 153.70±9.97b 10.94±2.71b 注:表中的值为平均值±标准差(n=10);同一列中具有不同字母标记的数值表示差异显著(P < 0.05)
Note: Data are shown in X ±SD(n=10);values with different superscript letters in the same column are different from each other(P < 0.05). -
[1] 乐佩琦, 陈宜瑜, 中华人民共和国濒危物种科学委员会. 中国瀕危动物红皮书: 鱼类[M]. 北京: 科学出版社, 1998: 222-223. http://www.irgrid.ac.cn/handle/1471x/204793 [2] 周路, 张竹青, 李正友, 等. 北盘江光照水电站建设前后鱼类资源变化[J]. 水生态学杂志, 2011, 32(5): 134-137. doi: 10.3969/j.issn.1003-1278.2011.05.026 [3] HYV RINEN P, VEHANEN T. Effect of brown trout body size on post-stocking survival and pike predation[J]. Ecol Freshw Fish, 2004, 13(2): 77-84. doi: 10.1111/j.1600-0633.2004.00050.x
[4] 叶超, 王珂, 黄福江, 等. 异齿裂腹鱼游泳能力初探[J]. 淡水渔业, 2013, 43(3): 33-37. doi: 10.3969/j.issn.1000-6907.2013.03.006 [5] PLAUT I. Critical swimming speed: its ecological relevance[J]. Comp Biochem Physiol A, 2001, 131(1): 41-50. doi: 10.1016/S1095-6433(01)00462-7
[6] WATKINS T B. Predator-mediated selection on burst swimming performance in tadpoles of the Pacific tree frog, Pseudacris regilla[J]. Physiol Zool, 1996, 69(1): 154-167. doi: 10.1086/physzool.69.1.30164205
[7] BAILEY D M, BAGLEY P M, JAMIESON A J, et al. In situ investigation of burst swimming and muscle performance in the deep-sea fish Antimora rostrata[J]. J Exp Mar Biol Ecol, 2003, 285: 295-311. doi: 10.1016/S0022-0981(02)00534-8
[8] KIEFFER J D. Perspective: exercise in fish: 50+ years and going strong[J]. Comp Biochem Physiol A, 2010, 156(2): 163-168. doi: 10.1016/j.cbpa.2010.02.009
[9] 史航, 陈勇, 赵子仪, 等. 许氏平鲉、大泷六线鱼临界游速与爆发游速及其生理指标的研究[J]. 大连海洋大学学报, 2010, 25(5): 407-412. doi: 10.3969/j.issn.1000-9957.2010.05.006 [10] 乔云贵, 黄洪亮, 黄妙芬, 等. 不同淡水鱼类游泳速度的初步研究[J]. 湖南农业科学, 2012(15): 116-119. doi: 10.3969/j.issn.1006-060X.2012.15.038 [11] 周立斌, 叶卫. 长臀 
[12] 郁桐柄, 沈丽红. 长臀 
[13] 黄卫盛, 谢俊刚, 苏怡林, 等. 珠江长臀 
[14] 石小涛, 陈求稳, 刘德富, 等. 胭脂鱼幼鱼的临界游泳速度[J]. 水生生物学报, 2012, 36(1): 133-136. doi: 10.3724/SP.J.1035.2012.00133 [15] 鲜雪梅, 曹振东, 付世建. 4种幼鱼临界游泳速度和运动耐受时间的比较[J]. 重庆师范大学学报: 自然科学版, 2010(4): 16-20. doi: 10.3969/J.ISSN.1672-6693.2010.04.005 [16] ZENG L, CAO Z, FU S, et al. Effect of temperature on swimming performance in juvenile southern catfish (Silurus meridionalis)[J]. Comp Biochem Physiol A, 2009, 153(2): 125-130. doi: 10.1016/j.cbpa.2009.01.013
[17] HAMMER C. Fatigue and exercise tests with fish[J]. Comp Biochem Physiol A, 1995, 112(1): 1-20. doi: 10.1016/0300-9629(95)00060-K
[18] YEH M, HO C, LEE M. Burst swimming speeds of two minnows Acrossocheilus paradoxus and Varicorhinus barbatulus in relation to water temperature and body size[J]. J Fish Soc Taiwan, 2010, 37(1): 49-63. https://www.researchgate.net/publication/268813499_Effects_of_endurance_swimming_on_the_growth_of_0-_and_1-age_group_of_whiting_Merlangius_merlangus_Gadidae
[19] HAMMER C. Effects of endurance swimming on the growth of 0-age and 1-age group of whiting, Merlangius merlangus, Gadidae[J]. Arch Fish Mar Res, 1994, 42(2): 105-122. https://www.researchgate.net/publication/268813499_Effects_of_endurance_swimming_on_the_growth_of_0-_and_1-age_group_of_whiting_Merlangius_merlangus_Gadidae
[20] RYLAND J S. The swimming speeds of plaice larvae[J]. J Exp Biol, 1963, 40(2): 285-299. doi: 10.1242/jeb.40.2.285
[21] 夏皮罗, 谈镐生. 形与流——漫谈阻力流体动力学[M]. 北京: 科学出版社, 1979: 73-75. http://www.irgrid.ac.cn/handle/1471x/522875?mode=full [22] 郑金秀, 韩德举, 胡望斌, 等. 与鱼道设计相关的鱼类游泳行为研究[J]. 水生态学杂志, 2010, 31(5): 104-110. [23] JOHNSON G D, GILL A C. Perches and their allies[M]. New York: Academic Press, 1995: 181-196.
[24] DICKSON K A, DONLEY J M, SEPULVEDA C, et al. Effects of temperature on sustained swimming performance and swimming kinematics of the chub mackerel Scomber japonicus[J]. J Exp Biol, 2002, 205(7): 969-980. doi: 10.1242/jeb.205.7.969
[25] MARTIN R M, WERTHEIMER A. Adult production of chinook salmon reared at different densities and released as two smolt sizes[J]. Prog Fish-Cult, 1989, 51(4): 194-200. doi: 10.1577/1548-8640(1989)051<0194:APOCSR>2.3.CO;2
[26] BILTON H T, ALDERDICE D F, SCHNUTE J T. Influence of time and size at release of juvenile coho salmon (Oncorhynchus kisutch) on returns at maturity[J]. Can J Fish Aquat Sci, 1982, 39(3): 426-447. doi: 10.1139/f82-060
-
期刊类型引用(4)
1. 王永猛,柯森繁,林晨宇,张奔,杨国党,雷青松,邓晓川,石小涛. 红河(元江)流域的典型鱼类游泳能力探究及在过鱼设施流速设计中的应用. 湖泊科学. 2021(06): 1820-1831 .  百度学术
百度学术
2. 周艳波,陈丕茂,冯雪,袁华荣. 广东主要海洋经济物种增殖放流初期存活率探讨. 安徽农业科学. 2020(22): 103-106+140 .  百度学术
百度学术
3. 刘慧杰,王从锋,刘德富,陈明明,朱良康. 不同运动状态下鳙幼鱼的游泳特性研究. 南方水产科学. 2017(02): 85-92 .  本站查看
本站查看
4. 刘岩,孙典荣,耿倩,杨长平,赵静,段妍. 茜素红与钙黄绿素标记不同规格黑鲷幼鱼的比较研究. 南方水产科学. 2016(06): 17-24 .  本站查看
本站查看
其他类型引用(2)



 下载:
下载:

 粤公网安备 44010502001741号
粤公网安备 44010502001741号
