Effect of No.0 diesel oil water-soluble fraction on CYP4 gene expression in green mussel (Perna viridis)
-
摘要:
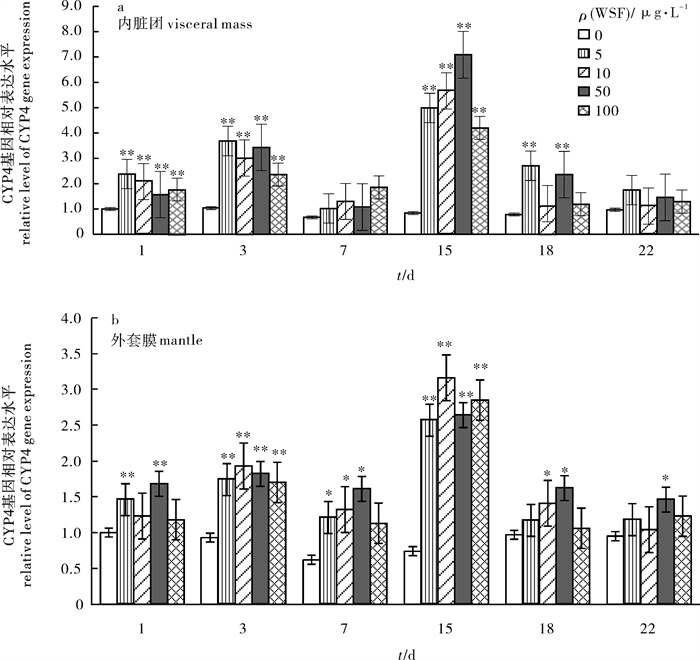
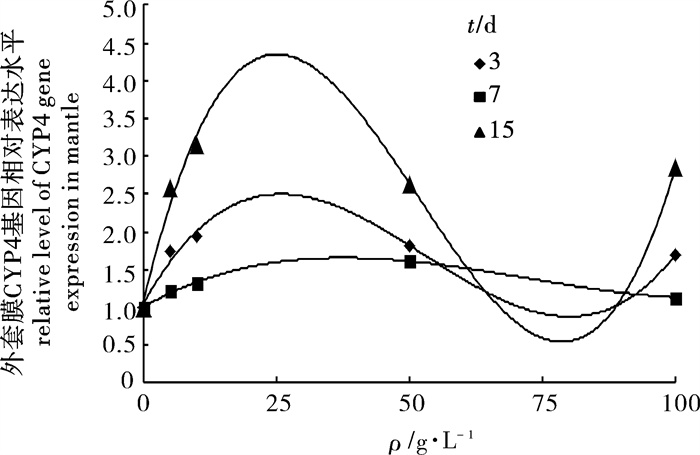
在室内半静水的试验条件下,应用实时荧光定量PCR技术研究了不同质量浓度(0 μg · L-1、5 μg · L-1、10 μg · L-1、50 μg · L-1和100 μg · L-1)的0#柴油水溶液(WSF)胁迫15 d和清洁海水恢复7 d中翡翠贻贝(Perna viridis)外套膜与内脏团组织中CYP4基因的相对表达水平变化。2-△△Ct法分析结果表明,CYP4基因在翡翠贻贝外套膜和内脏团中均有表达,WSF胁迫对其表达水平有明显的诱导作用,且表达水平具有组织差异性;内脏团表达水平明显高于外套膜,两组织CYP4基因相对表达水平随着WSF胁迫时间的延长,整体呈现出先诱导后抑制再诱导的波动变化趋势,其中50 μg · L-1浓度组表现最为显著(P < 0.01)。WSF胁迫解除后外套膜与内脏团CYP4基因相对表达水平迅速下降,部分浓度组逐渐恢复到正常水平。
Abstract:Green mussels (Perna viridis), exposed to 0 μg · L-1, 5 μg · L-1, 10 μg · L-1, 50 μg · L-1 and 100 μg · L-1 No.0 diesel oil water-soluble fraction (WSF) for 15 d under semi-hydrostatic simulation, were transferred to clean sea water for 7 d to analyze the gene expression levels of CYP4 by the method of 2-△△Ct combining with real-time quantitative PCR. Results show that WSF obviously induced CYP4 up-regulation and was differentially expressed in both visceral mass and mantle in P.viridis. The expression level of CYP4 was obviously higher in visceral mass than in mantle. The relative gene expression level initially increased then decreased and increased again as time elapsed in those two kinds of tissues. The most significant difference was observed in 50 μg · L-1concentration group (P < 0.01)compared to the control. At the last 7 d, the expression level in visceral mass and mantle decreased quickly and that in some groups gradually returned to normal level by being transferred to clean sea water.
-
我国开始实行更富弹性的人民币汇率机制,人民币汇率的不确定性增大,截至2007年5月8日人民币兑美元的汇率已跌破7.7,人民币兑美元年均升值幅度将维持在4%左右[1]。人民币与国际货币之间比值的变化,将对我国水产品国际贸易产生重要影响。
有人通过对我国进出口弹性的计算分析,认为我国水产品的进出口弹性之和绝对值小于或接近1,基本不符合马歇尔-勒纳条件。厉以宁等[2]通过对1985~1998年数据的回归分析,得出我国水产品进、出口弹性分别为-0.0566和-0.0057,进出口弹性之和的绝对值仅为0.0623;殷德生[3]的研究表明,中国的水产品进、出口弹性也仅为0.0112和-0.5689。上述结论虽然说明了我国水产品贸易受汇率变动的整体影响较小,但并没有明确在汇率变动时我国水产品贸易所受到的具体影响。因此,本文将从不同角度研究人民币汇率升值对我国水产品国际贸易产生影响的机理和路径,并针对这些影响提出对策建议,力图填补国内学者对其分析之不足。
1. 人民币升值带来的国际贸易结算风险
1.1 人民币与外币之间的结算风险
水产品国际贸易从签约到债权债务的清偿,要经历一段时间,这段时间内刚好人民币升值,外币在没有预料到人民币升值的情况下就要承担相应风险。我国水产品进出口合同中,大部分以美元为计价和结算货币。人民币升值几乎成了定势,根据芝加哥商业交易所(Chicage Mercantile Exchange, CME)2007年12月人民币对美元期货合约显示,人民币汇率将上升到7.32兑1美元,在某一货币的升值中,必然伴随着以这种货币计价资产的升值甚至是资产泡沫化,而根据国际货币基金组织(International Monetary Fund, IMF)的数据,人民币实际购买力与汇率之间的比值是1 : 1.8[5]。人民币明显被低估,还有很大的升值空间。一旦人民币升值到位,也就是人民币汇率达到浮动区间的上限,由于汇率不会再次扩大浮动区间,投机资金就会在享受完人民币升值的“美餐”后扬长而去。他们将大量抛售手中的人民币资产(包括期货合约),兑换成美元出境。投机力量的抛售将导致国内市场期货价格大幅下挫。如果普遍预期人民币还将持续升值,对流动性效应和财富效应将产生放大效果,即资产的泡沫化过程,从而带动水产品价格的大幅上涨。一旦人们认为升值一步到位,则升值之前涌入的大量游资可能会选择获利了结的策略,游资大规模退出则会导致水产品价格的大幅下跌。
1.2 外币与外币之间的结算风险
我国水产品国际贸易的主要伙伴依次为日本、韩国、美国和欧盟,部分国际贸易合同以对方国家货币(非美元货币)计价。使其它外币的风险表现在与美元之间的汇率变化上。我国从欧盟进口水产品时,多以欧元为计价货币,但国家安排给企业的外汇指标有可能是美元,在经常项目下可以拥有自由支配外汇的企业也都大多留有美元货币,在实际结算时,欧元和美元汇价的较大波动,会使企业承受较大的外汇结算风险。如,在外汇汇率为1欧元=1.36美元时买入1万欧元。这时所花费的金额为1.36美元×1万欧元=1.36万美元。之后,美元贬值欧元升值,外汇汇率变为1欧元=1.40美元。于是,1万欧元的价值变为1.40美元×1万欧元=1.40万美元。如果这时将1万欧元卖掉的话,能卖1.40万欧元。这1万欧元是以1.36万美元买入以1.40万美元卖出,这0.04万(1.40万-1.36万)就为所得的外汇差额利润。相反的,如果美元升值欧元贬值,变为1欧元=1.30美元的话,原本花费1.36万美元买入的1万欧元变为1.30万美元,1.30万美元-1.36万美元=-0.06万美元,即蒙受了0.06万美元的外汇差额损失。
1.3 先是外币与外币,后是外币与人民币之间的结算风险
人民币目前尚不是自由外汇,水产品的国际贸易面临双重汇率风险。人民币升值将导致以外币计价的资产价值贬值,以外币计价的负债资产价值也将因此而下降。例如,我国水产品企业向日本出口水产品以日元计价,而银行贷款主要是美元贷款,则企业只有以美元为保证金才能开出日元信用证,这样企业面临美元与日元汇率变动的第一重风险;在债务到期时,需要以美元归还贷款本息,即以人民币购买美元,企业又要承担第二重汇率风险:人民币与美元汇率变动的风险。因此,完善我国外汇市场尤其是远期外汇市场,增加汇率风险的避险工具、途径和效率,对我国水产品国际贸易是很重要的。
2. 人民币升值对我国水产品国际贸易的影响
2.1 人民币升值将使我国水产品贸易顺差扩大
本币升值会促进本国贸易进口抑制出口,贸易收支向均衡方向发展,但从实际效应来看并非如此,2005年我国进、出口均实现大幅增长,分别比上年增加28%和18%,进出口总额达14 222亿美元,比上年增加23%,贸易顺差有增无减,全年贸易顺差达1 019亿美元(几乎相当于2001~2004年4年的贸易顺差累计总和),其中下半年贸易顺差达623亿美元,比汇改前的上半年贸易顺差396亿美元还多226亿美元;2006年头4个月的贸易额和顺差分别为5 147亿美元和338亿美元,分别比上年同期增24%和61%[6]。主要是因为贸易类型不同可能会受到不同的影响。对于从事出口的水产品加工企业,人民币的升值会削弱一部分纯加工企业的低成本优势,此次的升值幅度大约为3%,企业会加大内销来应对。出口导向型水产品企业将会遭受出口收入转化成人民币时的汇兑损失,及由于出口量减少造成的损失。一方面,出口水产品在国外市场的价格提高,销量减少,对于出口价格弹性低的商品,出口收入将会增加,对于出口价格弹性高的商品,出口收入将会减少。另一方面,出口所获外汇收入需要转换成人民币,人民币的升值会带来出口收入的汇兑损失。但人民币升值能购买到更多的原材料和中间产品,有利于加工贸易的进口环节,这类企业只收取加工费用,只需承担少量的加工费汇率风险,对汇率不太敏感。人民币升值后,这些水产品企业在加工贸易中是“两头在外”,进口原材料的价格降低,即成本降低,意味着利润空间扩大,抵消绝大部分因人民币升值对出口的消极影响。所以,判断人民币升值利弊,需要分析境外采购成本的下降能否弥补产品出口下降造成的损失。
2.2 人民币升值有利于改善我国水产品国际贸易条件,使社会福利增加
我国的“贫困化增长”,即贸易条件恶化问题已不容乐观,据中国海关编制的贸易条件指数,1993~2003年中国的整体贸易条件下降12%[7];陈飞翔[8]认为,2004年我国商品价格贸易条件指数比1995年下降17%。在水产品的国际贸易中,我们不但要注意出口商品的价格,而且还要注意进口商品的价格。当人民币汇率相对上升时,我国出口水产品以美元表示的国际市场价格会上涨,进口的水产品以美元表示的国际市场价格没有发生多大变化,通过对1994~2003年相关数据进行回归分析,得出人民币每贬值一个百分比,中国贸易条件恶化0.353个百分比,反之,人民币每升值一个百分比,中国贸易条件将改善0.353个百分比[9],这表明我国水产品贸易条件得到改善,社会福利增加。
2.3 人民币升值将使我国水产品国际贸易结构升级
人民币适度升值有利于改善我国水产品贸易结构,推动我国水产品出口由单纯依靠汇率贬值低价出口,转为逐步靠提高技术竞争力、产品竞争力来进行出口。人民币汇率趋向于市场化的改革,对我国经济的发展利大于弊,是我国向市场化国家迈进的标志性举动,有利于缓解近期频发的国际贸易摩擦,使我国水产品能更顺畅地融合于国际市场的大环境中。人民币升值导致出口水产品外币价上升,会对那些高成本、低效益的企业产生挤出效应;同时,人民币升值会降低先进设备的进口成本,有利于促进我国出口商品结构和产业结构的升级换代。升值后,我国低附加值水产品出口将会面临严峻的形势,将迫使我们加快出口水产品结构的调整。水产品企业要想继续发展,必须及时适应外部环境的转变,在高附加值水产品开发、水产品深加工上多做文章,就要紧盯国际市场,从原有的初级水产品,向半加工水产品,如旅游食品、罐装食品等方面发展,开拓水产品保鲜加工,促进水产品精深加工,提高水产品的档次和科技含量,尽快完成水产品贸易结构升级。
3. 结论和建议
针对人民币升值可能对我国水产品国际贸易造成的上述影响,当前和今后一段时期,我们可从以下方面采取应对措施。
3.1 加快市场多元化步伐、引导水产品企业开展信息化建设,降低人民币升值带来的成本压力
支持水产品企业巩固传统市场、发展新兴市场、开发潜在市场。我国渔业企业拓展中东、非洲市场已初见成效,但总量偏小,市场有待进一步占领、份额有待进一步提高。日本、美国等市场仍待进一步开拓,由于我国水产品对日、美出口比重较大,必须进一步熟知这些国外市场的贸易规则及新的动向。拉丁美洲和东盟市场仍待我国水产企业开发。目前,大多数企业在网上开设了主页和E-mail地址,有效的国际国内外市场信息是我国水产品贸易顺利进行的重要保证。各级政府都有责任和义务推动包括企业在内的全社会信息化建设进程,出资建立水产品出口服务体系,提供世界市场同类产品的生产情况和市场动态,预测各种水产品销售能力,指导水产品企业生产和出口。
3.2 加快水产品对外贸易增长方式的转变
可通过进一步优化水产品进出口结构,完善进出口协调机制,深化外贸体制改革来实现。对于出口,可通过行业政策导向,引导水产品出口由数量型向质量型转变,鼓励节约型、高技术、高附加值水产品出口,并扶持品牌产业的发展;同时,继续发展加工贸易,大力发展配套服务贸易,使其与加工贸易相互促进,同步提高。但对于加工贸易,人民币升值对其出口的影响并不大,加工贸易的进出口规模将随人民币升值而进一步扩大,所以要注意我国外贸结构中水产品加工贸易占贸易总体的比重逐步加大、贸易结构进一步失衡问题。对于进口,要求欧美等国放弃对华水产技术出口和水产行业高科技产品出口等限制,促进国际收支平衡。但是,如果升值过快,超过了我国经济的消化能力,可能会造成我国出口竞争力下降的负面影响。企业的存款应采用多种货币,减少单一美元的存款,减少对进口原料的库存,增加对国内来源原料的库存,转变中国经济发展对出口市场的过度依赖,挖掘国内市场潜力;同时要改变单一的出口方式,实行出口转内销。
3.3 推动水产企业做大做强,弱化人民币升值对中小型水产企业的影响
水产品国际贸易中水产企业是主角,重点渔区各级政府应最大限度地为水产企业做好服务,在不干涉企业经营前提下,通过创造投资环境和贸易环境,推动企业做大做强。目前,沿海很多市县政府都制定了新一轮的外贸扶持政策,调整了以出口实绩为标准的奖励政策,这是一个较好的尝试。另外,政府应把更多的扶持资金用于以下3个方面:(1)重视人才培养。在汇率变动的时代,水产品企业不仅仅是在做商品贸易,更是一种投资行为。(2)支持水产企业优化产品结构、推动企业开展各项国际认证。改善我国水产品进出口的结构,提高高科技水产品的进口,平衡资源性水产品的进出口,限制初级水产品、高耗能高污染水产品的出口,促进水产品的深加工等一系列措施,使我国水产品外贸发展进入良性健康的发展轨道上来;政府应引导和鼓励水产企业积极开展各项国际认证。(3)促进品牌产品出口。水产品企业要积极探索产业化的有效形式,扩大生产规模,实行标准化生产,从源头上提高水产品质量;不断进行研发创新,包括从国外引进的适用技术与丰富的劳动力资源相结合,努力开发具有新效用的产品;转变经营理念、在营销中实施品牌战略,这是更进一步创造水产品竞争优势的关键。
3.4 随着人民币的升值,应重新考虑我国水产品出口导向的产业政策
随着国内和国际形势的变化,过去常被我们津津乐道的水产品国际贸易成功经验,在人民币升值以后可能成为制约我国水产品外贸可持续发展的绊脚石。现在已经到了重新考虑我国水产品出口导向的产业政策的时候了。政府应创造一个良好的经营环境和支持性制度,以确保投入要素能够高效地使用,我国水产品贸易战略应该改变对贸易顺差和“出口导向”的偏爱,规划水产品出口的目标,防范行业内的过度竞争,引导水产品出口企业实施名牌战略,积极开拓俄罗斯、东盟各国和南美洲等地区具有潜力的市场,制定出相应的出口政策,加强市场开拓的针对性。追求水产品贸易本身的平衡发展,追求国际收支平衡,扩大中国水产品的国际市场份额,并使水产品贸易发展目标与水产品经济、水产品社会发展目标实现融合。
3.5 水产品企业应利用远期外汇交易规避人民币升值带来的风险
(1) 利用直接远期外汇交易规避风险,通过在签订水产品进出口贸易合同时,企业与银行协商签订远期外汇买卖合同,把将来办理结汇或售汇时的外汇币种、金额、汇率以及交割期限固定下来。合同签订好,未来的外汇收付价格即已确定,以后不管人民币汇率升值到哪个位置,对该笔水产品交易都不会产生影响,从而消除了升值带来的风险。(2)利用外汇掉期业务规避风险,先以A货币兑换成B货币,在未来某一特定时间,再以B货币换回A货币的交易。它的主要目的是轧平各货币因到期日不同造成的资金缺口,对于人民币升值而言,买入和卖出的金额是相等的,并不改变外汇的净头寸,这就很好的规避了人民币升值给水产品贸易带来的成本风险。
-
-
[1] MANSUY D. The great diversity of reactions catalyzed by cytochromes P450[J]. Comp Biochem Physiol, 1998, 121(1): 5-14. doi: 10.1016/S0742-8413(98)10026-9
[2] WERCK-REICHHART D, FEYEREISEN R. Cytochromes P450: a success story[J]. Genome Biol, 2000, 1(6): 3003-3004. doi: 10.1186/gb-2000-1-6-reviews3003
[3] 许华夏, 李培军, 刘宛. 生物细胞色素P450的研究进展[J]. 农业环境保护, 2002, 21(2): 188-191. doi: 10.3321/j.issn:1672-2043.2002.02.029 [4] BAUSTISTA M A M, TANAKA T. Identification of permethrin-inducible cytochrome P450s from the diamondback moth, Plutella xylostella (L) and the possibility of involvement in permethrin resistance[J]. Pestic Biochem Physiol, 2007, 8(1): 85-93. doi: 10.1016/j.pestbp.2006.06.004
[5] HOARAU P, DAMIENS G, ROMEO M, et al. Cloning and expression of a GST-pi gene in Mytilus galloprovincialis. Attempt to use the GST-pi transcript as a biomarker of pollution[J]. Comp Biochem Physiol, 2006, 143(2): 196-203. doi: 10.1016/j.cbpc.2006.02.007
[6] 石玉荣, 耿建, 王惠, 等. 苯并[a]芘对宫颈癌HeLa细胞细胞色素P4501A1诱导作用[J]. 上海交通大学学报: 医学版, 2010, 30(12): 1513-1516. doi: 10.3969/j.issn.1674-8115.2010.12.016 [7] CAPDEVILA J H, FALCK J R. The CYP 450 arachidonic acid monooxygenases: from cell signaling to blood pressure regulation[J]. Biochem Biophys Res Commun, 2001, 285(3): 571-576. doi: 10.1006/bbrc.2001.5167
[8] DAVID J P, BOYER S, MESNEAU A, et al. Involvement of cytochrome P450 monooxygenases in the response of mosquito larvae to dietary plant xenobiotics[J]. Insect Biochem Mol Biol, 2006, 36(5): 410-420. doi: 10.1016/j.ibmb.2006.02.004
[9] 国家海洋局. 海洋监测规范(GB 17378.1-2007)[M]北京: 海洋出版社, 2007: 153-156. https://xueshu.baidu.com/usercenter/paper/show?paperid=1f0d0690t23p08w0w94s0j80dm465256&site=xueshu_se&hitarticle=1 [10] 周驰, 李纯厚, 张为民, 等. 翡翠贻贝CYP4基因克隆及其表达水平分析[J]. 热带海洋学报, 2010, 29(4): 82-88. doi: 10.3969/j.issn.1009-5470.2010.04.013 [11] LICAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real time quantitative PCR and the 2-△△Ct method[J]. Methods, 2001, 25(4): 402-408. doi: 10.1006/meth.2001.1262
[12] 龙敏明, 黄桂菊, 邹记兴, 等. 育珠对合浦珠母贝N19和Prismalin-14基因表达水平的影响[J]. 南方水产科学, 2013, 9(5): 58-63. doi: 10.3969/j.issn.2095-0780.2013.05.010 [13] 吴益东, 沈文飚. 棉铃虫六龄幼虫微粒体细胞色素P450和细胞色素b5的测定及组织分布[J]. 农业生物技术学报, 1997, 5(3): 297-301. https://xueshu.baidu.com/usercenter/paper/show?paperid=715b6198a4baf17dd0252ac6f8d7ad4b&site=xueshu_se [14] 陈立兵, 葛卫红, 林洁. 细胞色素P450 mRNA表达研究进展[J]. 医学研究杂志, 2007, 36(7): 79. doi: 10.3969/j.issn.1673-548X.2007.07.004 [15] 徐增光, 文冠华, 高雅娟. 苯并(a)芘对小鼠肺组织细胞色素P450 1A表达的影响[J]. 华中科技大学学报: 医学版, 2005, 34(4): 404-406. doi: 10.3870/j.issn.1672-0741.2005.04.007 [16] FISHER T, CKANE M. Induction of cytochrome P450 activity in individual Chironomus riparius Meigen larvae exposed to xenobiotics[J]. Ecotoxicol Environ Saf, 2003, 54(1): 1-6. doi: 10.1016/S0147-6513(02)00031-3
[17] BURNETT K G, BAIN L J. Fundus as the premier teleost model in environmental biology: opportunities for new insights using genomics[J]. Comp Biochem Physiol, 2007, 2(4): 257-286. doi: 10.1016/j.cbd.2007.09.001
[18] 周驰, 李纯厚, 张为民. 翡翠贻贝肾CYP4基因表达受多氯联苯影响的研究[J]. 安徽农业科学, 2008, 36(22): 9418-9422. doi: 10.3969/j.issn.0517-6611.2008.22.036 [19] STEGEMAN J J, SMOLOWITZ R M, HAHN M E. Immunohistochemical localization of environmentally induced cytochrome P450IAl in multiple organs of the marine teleost Stenotomus chrysops(scup)[J]. Toxicol Appl Pharmacol, 1991, 110(3): 486-504. doi: 10.1016/0041-008X(91)90049-K
[20] 张薇, 宋玉芳, 孙铁珩. 菲和芘对蚯蚓(Eisenia fetida)细胞色素P450和抗氧化酶系的影响[J]. 环境化学, 2007, 26(2): 202-206. doi: 10.3321/j.issn:1672-2043.2009.02.021 [21] 王磊, 宋玉芳, 张薇, 等. 蚯蚓(Eisenia fetida)细胞色素P450及抗氧化酶系对环境浓度苯并(a)芘的响应[J]. 农业环境科学学报, 2009, 28(2): 337-342. doi: 10.3321/j.issn:1672-2043.2009.02.021 [22] 肖雅元, 李纯厚, 徐姗楠, 等. 水溶性石油烃组分对翡翠贻贝的毒性效应研究[J]. 农业环境科学学报, 2012, 31(3): 598-606. [23] 王燕红, 王东, 李兵, 等. 野桑蚕细胞色素P450家族CYP4M5基因的克隆和诱导表达[J]. 蚕业科学, 2009, 35(1): 78-83. doi: 10.3969/j.issn.0257-4799.2009.01.013 -
期刊类型引用(3)
1. 王会虎,任超,郑国栋,邹曙明. 团头鲂选育家系亲子鉴定方法的建立. 水生生物学报. 2024(08): 1378-1384 .  百度学术
百度学术
2. 胡玉婷,汪焕,段国庆,周华兴,凌俊,江河,潘庭双,杨敏,李彤. 瓦氏黄颡鱼养殖群体的微卫星遗传多样性. 安徽农业大学学报. 2024(05): 802-807 .  百度学术
百度学术
3. 胡芹宝,张荟,孙渭博,吕铭,高明. 微卫星标记的多重PCR方法应用于BALB/c小鼠遗传质量检测的可行性分析. 微生物学免疫学进展. 2024(06): 20-26 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
