Analysis of paternity and relatedness in Oreochromis niloticus (♀)×Sarotherodon melanotheron (♂) hybrid F1 families by microsatellite markers
-
摘要:
利用尼罗罗非鱼(Oreochromis niloticus)第2代遗传连锁图谱标记,对3组不同尼罗罗非鱼(♀)×萨罗罗非鱼(Sarotherodon melanotheron)(♂)杂交F1家系内亲权关系进行分析。结果显示,86个微卫星位点中共筛选出20个在尼罗罗非鱼、萨罗罗非鱼中存在差异的扩增位点,含13个种间特异性和7个共享带差异位点。尼萨杂交F1中,平均等位基因2.90,平均多态信息含量0.439,位点多态性较高。3个尼萨杂交F1家系组间遗传距离0.362~0.504,组内个体间遗传距离0.245~0.316,组内遗传距离明显小于组间。利用3个种间特异位点组合,可对3个不同家系组父、母本个体进行鉴别。通过对各组亲本与子代位点基因型分析,家系A、B和C组分别使用4、8和12个特异位点组合进行亲权鉴定,累积排除概率分别为99.99%、99.99%和99.91%,家系A、B组分别含3个半同胞家系,家系C组含2对非同胞或4个半同胞家系。
Abstract:We conducted an analysis of paternity and relatedness in 3 family groups of Oreochromis niloticus (♀)× Sarotherodon melanotheron (♂) hybrids F1 with different parental information and different sizes by microsatellite markers from the 2nd genetic linkage map of Nile tilapia. The results show there were 20 loci with different-sized alleles in O.niloticus and S.melanotheron detected in 86 pairs of microsatellites, including 13 specific loci and 7 shared allelic loci. The average number of alleles in F1 was 2.90 and of polymorphism information was 0.439. The genetic distance among the 3 family groups was 0.362~0.504, and within each group was 0.245~0.316. The individual parents in the 3 different family groups were effectively identified by 3 completely higher polymorphic markers combinations. Using genotypic information, 4, 8 and 12 loci were needed for accurate paternity identification in family group A, B and C with high parent exclusion probability of 99.99%, 99.99% and 99.91%, respectively. Groups A and B contained 3 half-sib families, while group C contained 2 pairs of non-sib families or 4 half-sib families.
-
Keywords:
- Oreochromis niloticus /
- Sarotherodon melanotheron /
- hybrid /
- family /
- paternity analysis /
- microsatellite marker
-
鱼类在与外界环境进行物质交换时,环境中的化学元素不断被摄入鱼体,通过鱼类的鳃呼吸等方式进入血液,在鱼体内经过一系列的代谢和循环,最终沉积到耳石。现已发现耳石中含有钙(Ca)、铝(Al)、锶(Sr)、铁(Fe)、钠(Na)、钾(K)、氯(Cl)、氮(N)和硫(S)等多种化学元素[1-3]。在耳石的组成成分中,碳酸钙(CaCO3)占96.2%,痕量元素占0.7%,有机质占3.1%。耳石在形成过程中其轮纹形态结构与化学组成相当稳定,记录了鱼类个体生活过程中丰富的生物-物理-化学环境信息,所以,耳石信息分析可以揭示鱼类的生活史及其所经历的环境变化[1, 4]。研究表明,水体盐度、食物中Sr的含量、生长的季节变化和生殖周期等生理因素均可能影响元素在耳石中的沉积[5-6]。海、淡水洄游性鱼类从海水进入淡水或从淡水进入海水后耳石中Ca、Sr等元素的沉积量也会有明显的变化[7-9]。许多因素影响着耳石中的锶/钙(Sr/Ca)比率,并且一些因素对耳石中的Sr/Ca比率具有协同影响作用[10]。一般认为耳石各部分元素沉积量与环境中该元素的可利用率以及水化学特性等有关[3-4]。此外,耳石中化学元素的沉积是一个生理过程,与环境温度也关系密切[11]。所以,很多学者认为分析耳石中化学元素的沉积规律有助于鱼类生活史的研究[12],甚至通过耳石中化学元素的分析来研究水域的污染度。Ca对动物生理机能有着重要作用,是构成骨、齿、鳞及甲壳的主要成分。Ca在组织中参与肌肉收缩、血液凝固、神经传导、渗透压调节、某些酶的激活以及细胞膜的完整性和通透性的维持等生理作用。水中钙离子(Ca2+)质量浓度不同能影响水生生物的产卵孵化[13]、成活和生长[14-16]。
褐牙鲆(Paralichthys olivaceus),俗称牙片、偏口、比目鱼,是名贵的暖温性、底栖海产经济鱼类,也是中国北方沿海重要的海水增养殖鱼类之一。目前,还未见关于Ca2+质量浓度对褐牙鲆鱼体和耳石元素积累方面的研究。文章通过研究Ca2+质量浓度对褐牙鲆鱼体组分和耳石成分的影响,探求其影响褐牙鲆生长的化学成分机制。
1. 材料与方法
1.1 试验材料
试验鱼于2008年5月29日购自山东省文登市小观镇养殖场,于室内循环水槽暂养20 d。暂养期间,水温(20±0.5)℃,pH(7.80±0.40),盐度30,连续充气,每天饱食投喂山东升索牌牙鲆颗粒饲料2次(08: 00和18: 00)。
1.2 试验设计和海水配置
为排除其他离子成分的干扰,试验用水以海水素和自来水配制。海水素为中国海洋大学海水素厂专门设计和生产的无钙海水素。保证其他离子成分和总盐度(30)基本不变,分别由氯化钙(CaCl2)、硫酸镁(MgSO4·6H2O)或氯化镁(MgCl2·7H2O)降低和增加Ca、Mg含量,盐度差值部分由无钙海水素补充。Ca2+、镁离子(Mg2+)质量浓度用EDTA络合滴定法测定。在预试验基础上设置了5个处理组,按ρ(Ca2+)不同设为A、B、C、D和E共5组,其中B组(对照)中ρ(Ca2+)为正常海水值(表 1)。暂养结束后试验鱼停食24 h,从中选取600尾大小均匀、体质量为(4.06±0.04)g的褐牙鲆幼鱼用作试验。用纱布吸干鱼体表水分,精确称质量到0.01 g。按照每组3个平行,每个水族箱(120 L)放养试验鱼40尾。每天早、晚各投喂1次(8:30和18:00)。试验为期60 d,试验期间投喂规格为P1饵料(山东升索牙鲆颗粒饲料)。
表 1 各处理组人工海水中钙离子浓度(X ±SD)Table 1. Ca2+ concentration in different artificial seawater treatments处理组/mg·L-1 treatments 200 A 400(对照 control) B 800 C 1 600 D 3 000 E 钙/镁Ca2+/Mg2+ 1/5.80 1/2.82 1/1.41 1/0.71 1/0.37 ρ(钙离子)/mg·L-1 Ca2+ 194±15 418±24 780±37 1 567±52 2 935±73 ρ(镁离子)/mg·L-1 Mg2+ 1 126±46 1 179±52 1 097±53 1 117±44 1 080±63 1.3 日常管理
每天补充因收集残饵和粪便流失的水量,每隔5~7 d按水族箱1/3~1/2量换一次水(补水和换水为提前配好的试验用水,保持各试验组ρ(Ca2+)、ρ(Mg2+)不变,试验期间保持光照[光照(L) : 黑暗(D)]14L : 10D,pH为7.80±0.40,ρ(DO)为(7.30±0.41)mg·L-1,氨氮(NH4-N)质量浓度低于0.05 mg·L-1,温度设定在(20±0.50)℃。
1.4 样品处理和分析
试验结束后用纱布吸干鱼体水分称体质量,用烘箱在70 ℃烘干至恒质量,磨碎。耳石去除包膜和黏液,清洗后60 ℃烘烤24 h,于干燥器中冷却后,用电子天平称质量,精确到0.01 mg。取磨碎的全鱼和耳石样品分别经高氯酸和硝酸消化后[17],经电感耦合等离子体原子发射光谱仪(Icp-Oes;Vista-Mpx,Varian)测定样品成分。每个试验组取15尾鱼,每个样品测定3次,取平均值。在解剖镜下观察耳石形态、测量其长和宽(μm)[18-19],并拍照(图 1)。
1.5 数据计算和统计分析
对所有试验数据进行单因子方差分析,如果差异显著,进一步对各处理组进行Duncan′s多重比较,以P < 0.05作为差异显著的标准。数据的统计分析采用SPSS 13.0进行。
2. 结果
2.1 水体Ca2+质量浓度对鱼体成分的影响
试验发现鱼体中含有多种元素,其中Ca、磷(P)、Na、镁(Mg)元素质量分数接近或超过1 mg·g-1,各元素在鱼体中顺序为w(P)>w(Ca)>w(Na)>w(Mg)>w(Sr)(表 2)。w(Ca)在各组中差异不显著(P>0.05),各组间w(Ca)、w(P)、w(Na)、w(Mg)的差异均显著(P < 0.05)。其中E组w(P)显著低于A和B组,分别为66.24%和65.13%(P < 0.05);C组w(Na)显著低于A和B组,分别为70.19%和67.85%(P < 0.05);E组w(Mg)显著低于A和B组,为68.53%和66.67%(P < 0.05);A和B组w(Sr)显著高于其他各组(P < 0.05)。同时鱼体中含有多种微量元素,在鱼体中顺序为w(Fe)>w(锌)(Zn)>w(锰)(Mn)>w(铜)(Cu)>w(镍)(Ni),各组间w(Zn)和w(Cu)差异不显著(P>0.05);A组w(Fe)、w(Mn)和w(Ni)显著高于B、C、D和E组(P < 0.05),A组w(Mn)显著高于C和E组(P < 0.05),A组w(Ni)显著高于C、D和E组(P < 0.05)(表 3)。
表 2 不同钙离子质量浓度下褐牙鲆鱼体主要元素成分的变化(X ±SD,n=3)Table 2. Main element content of P.olivaceus in the artificial seawater with different Ca2+ concentrationsmg·g-1 处理组
treatmentsw(磷)
Pw(钙)
Caw(钠)
Naw(镁)
Mgw(锶)
SrA 21.18±0.99b 12.44±0.56a 4.63±0.32bc 1.43±0.06b 0.27±0.01c B 21.54±2.10b 12.52±0.99a 4.79±0.34c 1.47±0.14b 0.14±0.02b C 16.32±2.62ab 11.58±0.87a 3.25±0.60a 1.12±0.16ab 0.07±0.01a D 18.32±1.25ab 12.91±1.01a 4.00±0.15abc 1.25±0.08ab 0.07±0.01a E 14.03±1.48a 11.50±0.50a 3.44±0.41ab 0.98±0.11a 0.04±0.00a 注:同一行数字不同上标字母表示差异显著(P < 0.05);后表同此
Note:Values with different superscripts within the same line are singnificantly different(P < 0.05).The same case in the following tables.表 3 不同钙离子质量浓度下褐牙鲆鱼体微量元素成分的变化(X ±SD,n=3)Table 3. Microelement content of P.olivaceus in the artificial seawater with different Ca2+ concentrationsμg·g-1 处理组
treatmentsw(铁)
Few(锌)
Znw(锰)
Mnw(铜)
Cuw(镍)
NiA 60.14±4.54b 56.97±1.14a 47.46±4.40b 9.29±2.47a 5.41±1.93b B 32.11±1.63a 58.84±0.39a 41.85±4.64ab 8.35±1.35a 2.67±0.11ab C 31.13±4.37a 42.80±4.00a 30.84±3.60a 3.99±0.40a 0.97±0.30a D 35.87±5.89a 48.68±11.42a 34.64±3.59ab 6.79±1.94a 0.73±0.48a E 32.09±3.29a 48.23±3.71a 32.36±3.54a 4.19±0.25a 1.20±0.24a 2.2 耳石常规指标分析
各组试验鱼体长、体质量差异均不显著(P>0.05)(表 4)。A组耳石长显著低于B组和C组,分别为B组和C组的92.38%和90.77%(P < 0.05);A组耳石宽也显著低于B组和C组,分别为90.10%和95.71%(P < 0.05);A组耳石长宽比L/W显著低于D组,为D组的94.77%(P < 0.05);A组的耳石质量显著低于B组和D组,分别为89.69%和90.16%(P < 0.05)。通过拟合得到各组褐牙鲆耳石长和耳石质量的关系分别为A组y=0.648 2e0.005 6x,R2=0.565 8;B组y=2.275 8e0.001 6x,R2=0.276 6;C组y=1.084 4e0.003 9x,R2=0.281 2;D组y=0.766 8e0.004 9x,R2=0.481 3;E组y=0.523 9e0.006 2x,R2=0.721 8(图 2)。
表 4 不同钙离子质量浓度下褐牙鲆耳石形态特征的变化(X ±SD)Table 4. The variation of otolith morphology of P.olivaceus in the artificial seawaterwith different Ca2+ concentrations处理组
treatments体质量/g
body weight体长/cm
body length耳石长/μm
otolith length耳石宽/μm
otolith width耳石长/宽比(L/W)
length/width耳石质量/mg
otolith weightA 23.18±1.28a 13.78±0.29a 297.30±4.60a 205.57±3.02a 1.45±0.02a 3.48±0.12a B 24.99±1.27a 14.41±0.21a 321.83±8.26bc 216.17±2.41c 1.49±0.03ab 3.88±0.10b C 22.53±0.86a 13.73±0.18a 309.54±3.20ab 209.25±2.62abc 1.48±0.02ab 3.63±0.08ab D 25.05±1.01a 14.24±0.17a 327.52±3.31c 214.79±2.28bc 1.53±0.02b 3.86±0.09b E 22.48±0.84a 13.80±0.17a 308.06±4.58ab 206.88±3.32ab 1.49±0.01ab 3.59±0.12ab 2.3 水体Ca2+质量浓度对耳石元素成分的影响
褐牙鲆耳石中含有多种元素,主要元素在鱼体中顺序为w(Ca)>w(Na)>w(Sr)>w(Mg)>w(Fe)(表 5)。其中各处理组耳石中w(Ca)差异均不显著(P>0.05),w(Sr)随ρ(Ca2+)增加显著下降(P < 0.05);各处理组耳石w(Na)和w(Fe)差异不显著(P>0.05);D组w(Mg)显著低于B组和C组,为82.61%和61.29%(P < 0.05)。耳石中存在多种微量元素,w(P)>w(Cu)>w(Mn)>w(铅)(Pb)>w(Ni),各处理组w(Mn)和w(Ni)差异不显著(P>0.05),A和C组w(P)和w(Pb)显著高于其他组(P < 0.05);C组w(Cu)显著高于其他各组(P < 0.05)(表 6)。分析耳石微量成分发现,Sr/Ca、Mg/Ca随水体ρ(Ca2+)增加而显著下降;E组Cu/Ca显著低于B组和C组,分别为B、C组的87.5%和87.5%(P < 0.05);各处理组Fe/Ca差异不显著(P>0.05)(表 7)。
表 5 不同钙离子质量浓度下褐牙鲆耳石主要元素成分的变化(X ±SD)Table 5. Main element content in otolith of P.olivaceus in the artificial seawater with different Ca2+ concentrationsmg·g-1 处理组
treatmentsw(钙)
Caw(钠)
Naw(锶)
Srw(镁)
Mgw(铁)
FeA 26.05±0.13a 3.47±0.05a 2.54±0.03d 0.21±0.02ab 0.08±0.01a B 24.25±0.84a 3.52±0.04a 1.16±0.01c 0.23±0.01b 0.08±0.01a C 27.44±0.31a 3.54±0.03a 0.88±0.01b 0.31±0.01c 0.10±0.01a D 24.44±0.41a 3.60±0.00a 0.70±0.01a 0.19±0.01a 0.08±0.01a E 27.77±1.14a 3.64±0.16a 0.73±0.03a 0.21±0.01ab 0.09±0.01a 表 6 不同钙离子质量浓度下褐牙鲆耳石微量元素成分的变化(X ±SD)Table 6. Microelement content in otolith of P.olivaceus in the artificial seawater with different Ca2+ concentrationsμg·g-1 处理组
treatmentsw(磷)
Pw(铜)
Cuw(锰)
Mnw(铅)
Pbw(镍)
NiA 51.18±2.39b 29.50±2.11a 19.09±0.52a 8.87±1.12b 1.81±0.40a B 44.41±3.37a 29.19±1.35a 21.45±3.33a 4.74±1.04a 1.02±0.21a C 55.44±1.52b 36.84±1.72b 18.01±1.02a 7.69±0.82b 0.83±0.42a D 42.49±0.78a 27.57±1.31a 20.27±1.92a 4.63±0.78a 1.27±0.33a E 38.78±2.31a 30.46±2.24a 15.77±2.53a 4.13±0.62a 1.01±0.37a 表 7 不同钙离子质量浓度下褐牙鲆耳石主要元素比例的变化(X ±SD)Table 7. Element ratio in otolith of P.olivaceus in the artificial seawater with different Ca2+ concentrations处理组
treatments锶/钙
Sr/Ca镁/钙
Mg/Ca铁/钙
Fe/Ca铜/钙
Cu/CaA 44.68±0.32e 13.59±1.02b 2.24±0.25a 0.72±0.05ab B 21.82±0.13d 15.71±0.11c 2.40±0.08a 0.75±0.00b C 14.62±0.39c 18.42±0.27d 2.60±0.09a 0.85±0.03c D 13.01±0.18b 12.91±0.10ab 2.34±0.15a 0.71±0.01ab E 12.11±0.25a 12.41±0.28a 2.24±0.09a 0.66±0.01a 3. 讨论
3.1 耳石形态
鱼类耳石的形态、大小、功能和微结构特征随种类而存在差异,因此,鱼类耳石不仅可作为分类鉴别的特征之一,而且可作为鉴定年龄和分析生长的材料[18, 20-22]。研究表明,水温、盐度、离子浓度等均可能影响鱼类耳石的形成[2, 23-24]。叶振江等[25]研究了2种鲈鱼(Lateolabrax sp.)耳石形态的地理变异,发现鲈(Lateolabrax japonicus)与花鲈(L.maculates)耳石形态、耳石质量-耳石长的关系差异显著;并认为中国近海不同海域的花鲈群体耳石形态存在显著地理差异。STRANSKY[26]通过耳石形态分析了平鲉(Sebastes marinus)和尖吻平鲉(S.mentella)的地理差异,获得较高的判别率。郭弘艺等[19, 27]研究了中国鲚属鱼类矢耳石的形态特征,发现海水种类或海水生活周期较长种类的矢耳石要明显大于淡水种类或海水生活周期较短的种类,即在海水生活阶段矢耳石元素的沉积速度要明显大于在淡水生活阶段;并且认为耳石形态分析在近缘种判别方面具有良好的应用前景。KATAYAMA和ISSHIKI[28]研究了褐牙鲆耳石形态特征以区分养殖和野生鱼,发现野生鱼耳石更趋于椭圆,而养殖鱼耳石边缘粗糙不清晰,且水温和投饵条件对耳石形态没有影响。区又君等[29-31]研究了黄唇鱼(Bahaba flavolabiata)、大黄鱼(Pseudosciaena crocea)和棘头梅童鱼(Collichthys lucidus)耳石的形态特征和微结构,总结了这几种鱼类耳石形态的异同及鉴别特征。
环境中ρ(Ca2+)的改变也可能影响鱼类耳石的发育。笔者试验发现,水体ρ(Ca2+)变化后鱼体耳石外部形态受到显著影响(图 1),高ρ(Ca2+)组耳石长/耳石宽显著大于低ρ(Ca2+)组和对照组。通过拟合发现,各试验组褐牙鲆耳石长和耳石质量的关系式基本符合指数关系,水体ρ(Ca2+)对其相关性影响较大。结果说明水体ρ(Ca2+)能影响褐牙鲆耳石的形成,使其形态发生显著变化。
3.2 鱼体成分
鱼体中含有多种元素,这些元素在生命活动中发挥重要作用。现已知有26种元素为动物生长所必需,按其含量可分为三大类,碳(C)、氢(H)、氧(O)、N为大量元素,构成机体的有机物质;Ca、P、Mg、Na、K、Cl和S为常量矿物元素,约占体内无机物质的60%~80%;Fe、Cu、Mn、Zn和Ni等在动物体内质量分数不超过50 mg·kg-1,称为微量元素,还有一些含量极微的称为痕量元素。这些元素在褐牙鲆鱼体中也存在,且含量基本符合上述结论。研究表明,水生生物能够富集水体中重金属离子,可以作为评价水体污染情况的指标[32-33]。LAROCQUE和RASMUSSEN[34]报道了Ca、Cu、Fe、Mg、Pb和Zn元素会从水中进入鱼体内,且鱼体内重金属含量远大于水体中含量,证明这些离子可在鱼体中富集。因此,LIAO和LING[35]建议用莫桑比克罗非鱼(Oreochromis mossambicus)作为监测水体污染的指标。一般肝脏和鳃中的金属含量要高于肌肉中的含量。
笔者试验发现,褐牙鲆鱼体也含有多种元素,在高ρ(Ca2+)组Mg、Sr、Fe、Mn、Ni质量分数较低,说明高ρ(Ca2+)降低了一些金属离子在体内的累积。水体较高ρ(Ca2+)可以调节其他离子的利用,并控制重金属离子的毒性,主要通过化学竞争、生物学适应或者两者协同作用[35-36]。PERSCHBACHER和WURTS[37]报道Ca-Mg硬度增加会降低硫酸铜(CuSO4)对斑点叉尾(Ictalurus punctatus)的毒性,在1.25 mg·L-1 CuSO4溶液中暴露48 h后,10 mg·L-1 CaCO3水体中斑点叉尾的死亡率为90%,而400 mg·L-1 CaCO3水体中为5%。笔者试验结果也证实高ρ(Ca2+)水体可能限制了一些离子在鱼体的积累。但未发现在鱼体内Ca的累积与水体ρ(Ca2+)呈正相关,推测Ca在鱼体内累积还受其他因素的影响,需要进一步研究加以验证。
3.3 耳石成分
关于耳石中化学元素的沉积规律,前人作过较多的研究。耳石元素组成受到很多因素的影响,主要包括一些生理因素(生长率、胁迫和再生等)和环境因素(温度、盐度和水中离子含量等)[1, 4, 22]。WRIHGT等[24]对大西洋鲑(Salmo salar)的研究发现,耳石上Ca的沉积受血浆中Ca含量的调节,血浆中Ca含量增高,耳石生长的速度也加快。通过鱼耳石微化学分析,可以了解远距离迁徙鱼类生活习性的转变。海、淡水洄游性鱼类从海水进入淡水或从淡水进入海水后,耳石中Ca、Sr等元素的沉积量会有变化[8],生活在不同水系淡水环境中的红大麻哈鱼(Oncorhychus nerkas)耳石中的Sr含量的变化依赖于水体中该元素含量的变化[9]。TZENG[38]发现在海洋生活阶段,日本鳗鲡(Anguilla iaponica)耳石上Sr的含量逐渐增加,约在溯河洄游前1个月达到高峰;进入河口后Sr含量急剧下降并长期维持在较低水平。ARAI等[39]通过研究远东哲罗鱼(Hucho perryi)耳石的Sr/Ca,探讨其在河流的迁移路径,认为耳石Sr/Ca比可以作为鱼类迁移的路标。王巍令[40]对中国沿海8个站点斑尾复鰕虎鱼(Synechogobius ommaturus)耳石的10种元素进行了研究,以分析斑尾复鰕虎鱼生活水体的相似度,结果显示Sr、Co、Ba、Pb、K、Mn和Sr/Ca有显著性差异。
笔者试验发现,各组褐牙鲆幼鱼耳石中仅w(Ca)差异不显著。分析认为,Ca在耳石中主要以CaCO3形式存在,虽然一些微量元素可以替代,但因水体中含量有限,对耳石中w(Ca)影响不大。另一方面,试验水体中ρ(Ca2+)很高,远超过鱼类生长发育的需要,因此,各组试验鱼耳石w(Ca)没有显著差异。但其他离子的质量分数有显著差异,一些微量元素的质量分数随着ρ(Ca2+)的增加而下降,其中w(Sr)随ρ(Ca2+)增加显著下降,且随ρ(Ca2+)增加Sr/Ca比、Mg/Ca比显著下降。研究表明,鱼类从海洋进入河口或河流时耳石Sr/Ca比急剧下降[41]。BROWN[17]分析了侧枝鲽(Pleuronectes vetulus)和眼点副棘鲆(Citharichthys stigmaeus)耳石元素组成在河口和海岸带的差异,发现与海岸带相比,河口区鱼类耳石中Sr的含量较高,锂(Li)的含量较低,利用耳石多种元素判别鱼类生活类群的准确率在80%。笔者试验高ρ(Ca2+)水体中试验鱼耳石Sr/Ca比、Mg/Ca比的下降,说明水体中ρ(Ca2+)的改变在耳石中留下明显标记,耳石离子组分可作为养殖水体中离子成分变化的指标。
水体中离子成分的改变,对试验鱼体组分、耳石形状和组分影响显著。由此说明,通过鱼体和耳石组分微量元素的检测分析,对研究鱼类耳石生长、元素累积和评价水环境以及鱼类生活史具有重要意义。
-
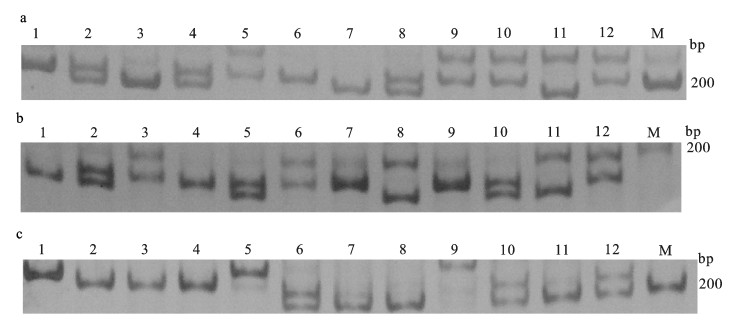
图 2 3组尼萨杂交亲本GM020(a)、GM028(b)、GM182(c)位点扩增结果
DNA标记;1. ♀A1;2~4. ♂A1、♂A2、♂A3;5. ♀B1;6~8. ♂B1、♂B2、♂B3;9~10. ♀C1、♀C2;11~12. ♂C1、♂C2
Figure 2. Amplification of GM020 (a) and GM028 (b), GM182 (c) in parents of 3 O.niloticus (♀)×S.melanotheron (♂) groups
M. molecular marker; 1. ♀A1; 2~4. ♂A1, ♂A2, ♂A3; 5. ♀B1; 6~8. ♂B1, ♂B2, ♂B3; 9~10. ♀C1, ♀C2; 11~12. ♂C1, ♂C2
表 1 20对微卫星引物信息
Table 1 Information of 20 pairs of microsatellite primers
位点locus GenBank号GenBank No. 引物序列(5′→3′) primer sequence(5′→3′) 重复序列repeat unit 退火温度/℃ annealing temperature GM258* BV005380 F: CCTTCACCTCCACCACTTTCT
R: AGATCGAACGTCGTCCTCTG(CA)n 64 GM526* BV005475 F: TCTTCCTCAGCCCATCTGTT
R: CAACTGTTGGCAGTGACAG(AC)n 62 GM182* BV005347 F: GACTTAGCCTCTGCCAATAC
R: AGCCACATACCAACATCCAG(CT)m(CA)n 62 GM017* BV005269 F: CCCTCTGTTTCCATCTCA
R: GATACCTGTCCATACCTCCTC(CA)n 56 GM028* BV005277 F: GACAGACAGGAAATAAGGG
R: AGCCTGATGGATGGTGA(CA)n 56 UNH990# G68270 F: GCCACAGGTGACCATGTTAG
R: GGTGTCTGATTGCACTGACG(TG)n 62 UNH911# G68224 F: AAGAGGAGAGCACGGAAACA
R: GTCACAAACCACAGCCAAGA(AC)n 60 GM641* BV005536 F: TGCAGAAGGTTGCAGTGTTT
R: GTCGGGGCTCTTTGTAATCA(TG)n 58 GM276# BV005389.1 F: CGCAGGAGGCTTTACCACA
R: TCAAGTTGCGTCTCTGTCACC(TG)n 60 GM020* BV005271.1 F: TTAAGCCACATTTATCTGCTC
R: CTACACCGCTGGGACA(CA)n 58 UNH906# G68220 F: AACATGCTTTCAGCCTTCGT
R: TGAGCAAATCCCGTCCATA(AC)n 56 GM222# BV005366 F: AACGGTGACATCTTCGCAACT
R: GATTTGGCTATCTGGCGTGTG(CA)n 62 GM004* BV005565 F: CATTCTTGGTCTTCCTGAC
R: AACTACTAGGACTTGATGGG(CA)m(AC)n 56 UNH919* G68230 F: TGACAGCCTGGCATAATGAG
R: CACTGAGACTGGAAGGCACA(AC)n 60 GM560* BV005496 F: TGGAACAGCTTTCCTCAACC
R: TCGCTGAGATTACACCATCG(TG)n 60 GM145# BV005330 F: AGCCATCCCCGTCTTTCT
R: TATTTTCTGTGAGCCCGTTTG(AC)n 58 UNH974* G68261.1 F: GCACGTCTGAGAGTGTGGAA
R: CAGCTTTCACACCAGCCTAA(GT)n 60 GM676# BV005555 F: GATTCACGGCGATGAAGTCT
R: CGTGAGCATCACCATCACTC(CA)n 62 UNH957* G68251 F: CTCCGTGACACCAAGCTTTC
R: ATGGCATCCACTACAAGCTG(GT)n 60 GM631* BV005528 F: TCCACCTGTGGAATGATGAG
R: CATGTTTGGGATCAGCATCA(GT)n 58 注:F. 正向引物;R. 反向引物;*. 种间特异性位点;#. 含共享带特异位点
Note:F. forward primer;R. reverse primer;*. specific loci of the intraspecific;#. containing shared with specific loci表 2 尼萨F1 20个位点的遗传参数分析
Table 2 Genetic parameters at 20 loci in O.niloticus (♀)×S.melanotheron (♂) hybrids F1
位点locus 样本数number of samples (N) 等位基因数number of alleles (Na) 有效等位基因数effect number of alleles (Ne) 观测杂合度observed heterozygosity (H0) 期望杂expected heterozygosiy (He) 多态信息含量polymorphim information (PIC) GM028 55 4.00 3.94 1.00 0.747 0.735 GM020 55 3.00 2.98 1.00 0.688 0.712 UNH919 55 2.00 2.00 0.95 0.530 0.488 GM182 55 3.00 2.88 1.00 0.625 0.664 GM017 55 3.00 2.22 1.00 0.628 0.462 UNH974 55 2.00 2.00 0.95 0.530 0.266 GM526 55 3.00 2.10 1.00 0.506 0.494 GM004 55 2.00 2.00 1.00 0.506 0.472 GM631 55 3.00 2.44 0.95 0.592 0.409 GM258 55 4.00 2.74 1.00 0.628 0.398 GM560 55 3.00 2.57 1.00 0.625 0.488 UNH957 55 4.00 2.93 1.00 0.625 0.421 GM641 55 2.00 2.00 1.00 0.562 0.462 GM222 55 4.00 3.46 0.65 0.448 0.365 UNH990 55 3.00 2.12 0.59 0.412 0.375 UNH911 55 2.00 1.86 0.68 0.464 0.411 GM276 55 3.00 2.46 0.72 0.512 0.312 UNH906 55 4.00 3.48 0.77 0.548 0.303 GM676 55 3.00 2.42 0.52 0.406 0.269 GM145 55 3.00 2.63 0.66 0.496 0.288 mean 55 2.90 2.56 0.86 0.554 0.439 表 3 3组尼萨F1家系组间和组内的遗传距离及相似性指数
Table 3 Genetic distance and similar index among 3 O.niloticus (♀)×S.melanotheron (♂) hybrids F1 groups
家系family A B C A 
0.684 0.606 B 0.362 
0.527 C 0.474 0.504 
注:斜线上方为相似性指数,下方为遗传距离
Note:Above the slashare the similarity indexes;under the slash are the genetic distances.表 4 3个家系组内亲子关系鉴定结果
Table 4 Paternity analysis in 3 O.niloticus (♀)×S.melanotheron (♂) hybrids F1 families
位点
locus家系组family ♀A1 ♂A1 ♂A2 ♂A3 ♀B1 ♂B1 ♂B2 ♂B3 ♀C1 ♀C2 ♂C1 ♂C2 GM028 - 106 407 309 - - 607 - 508017 10406029 408017029 10506 GM020 - 206 408 - - - 306012 - 203017 10607027 207017027 10306 UNH919 - 105 40708 - - - - - 809023 4020024 40809023 20024 GM182 - 205 - 309 - 1040508 7015 209010 20305012 20026027 2026027 305012020 UNH974 - - - - - 508016 - - - - - - GM526 - - - - - 1011016 - - 308010013 1014015 8010013014 103015 GM004 - - - - - - 607014 209013 209018 607015016 207090180 6015016 GM631 - - - - - 405011 7012015 - 9021025 7020029 709029 20021025 GM258 - - - - - - - - 11025028 26029030 26029030 11025028 GM560 - - - - - - 307014 10013 21023028 407030 407023030 21028 UNH957 - - - - - - - - 10011013 4014015 4010013014 11015016 GM641 - - - - - - - - 10011022 6014019 10014022 11019 GM017 - - - - - - - - 12013022 14019 13014022 12019 注:阿拉伯数字分别代表各家系组内F1个体编号Note:Arabic numbers represent F1 individuals in each family group. -
[1] 李思发. 我国罗非鱼产业的发展前景和瓶颈问题[J]. 科学养鱼, 2003(9): 3-5. doi: 10.3969/j.issn.1004-8421.2004.04.001 [2] LEMARIE G, BAROILLER J F, CLOTA F, et al. A simple test to estimate the salinity resistance of fish with specific application to O. niloticus and S. melanotheron[J]. Aquaculture, 2004, 240(1/2/3/4): 575-587. http://eurekamag.com/pdf.php?pdf=004023652
[3] LAVERTY G, SKADHAUGE E. Adaptation of teleosts to very high salinity[J]. Comp Biochem Physiol A, 2012, 163(3): 1-6. doi: 10.1016/j.cbpa.2012.05.203
[4] 李思发, 颜标, 蔡完其, 等. 尼罗罗非鱼与萨罗罗非鱼正反交鱼自繁后代F2耐盐性、生长性能及亲本对杂种优势贡献力的评估[J]. 水产学报, 2008, 32(3): 335-341. doi: 10.3321/j.issn:1000-0615.2008.03.003 [5] LI S F, ZHAO Y, FAN W J, et al. Possible genetic reproductive isolation between two tilapiine genera and species: Oreochromis niloticus and Sarotherodon melanotheron[J]. Zool Res, 2011, 32(5): 521-527. doi: 10.3724/SP.J.1141.2011.05521
[6] O'CONNELL M, WRIGHT J M. Microsatellite DNA in fishes[J]. Rev Fish Biol Fish, 1997, 7(1): 331-363. doi: 10.1023/A:1018443912945
[7] 陈文华, 李建林, 徐跑, 等. 五个家系吉富罗非鱼的遗传多样性分析[J]. 生物技术通报, 2009, 8(3): 83-87. [8] 李腾云, 李思发. 尼罗罗非鱼与萨罗罗非鱼回交子代遗传变异的微卫星分析[J]. 上海水产大学学报, 2008, 17(4): 396-401. https://xueshu.baidu.com/usercenter/paper/show?paperid=de6f4f1e0bf3c31ddc477b290446ba6f&site=xueshu_se&hitarticle=1 [9] LEE B Y, LEE W J, STREELMAN J T, et al. A second-generation genetic linkage map of tilapia (Oreochromis spp. )[J]. Genetics, 2005, 170(1): 237-244. doi: 10.1534/genetics.104.035022
[10] 孙效文, 张晓锋, 赵莹莹, 等. 水产生物微卫星标记技术研究进展及其应用[J]. 中国水产科学, 2008, 15(4): 689-703. doi: 10.3321/j.issn:1005-8737.2008.04.022 [11] 顾颖, 李超, 鲁翠云, 等. 建鲤微卫星DNA亲权鉴定[J]. 遗传, 2012, 34(11): 1447-1455. doi: 10.3724/SP.J.1005.2012.01447 [12] 鲁双庆, 刘臻, 刘红玉, 等. 鲫鱼(C. auratus auratus)4群体基因组DNA遗传多样性及亲缘关系的微卫星分析[J]. 中国水产科学, 2005, 12(4): 371-376. doi: 10.3321/j.issn:1005-8737.2005.04.001 [13] NORRIS A T, BRADLEY D G, CUNNINGHAM E P. Parentage and relatedness determination in farmed Atlantic salmon (Salmo salar) using microsatellite markers[J]. Aquaculture, 2000, 182(4): 73-83. doi: 10.1016/S0044-8486(99)00247-1
[14] 王鸿霞, 吴长功, 张留所, 等. 微卫星标记应用于凡纳滨对虾家系鉴别的研究[J]. 遗传, 2006, 28(2): 179-183. doi: 10.3321/j.issn:0253-9772.2006.02.010 [15] CASTRO J, BOUZA C, SANCHEZ L, et al. Gynogenesis assessment using microsatellite genetic markers in turbot (Scophthalmus maximums)[J]. Mar Biotechnol, 2003, 5(2): 584-592. doi: 10.1007/s10126-003-0004-x
[16] 于飞, 王伟继, 孔杰, 等. 微卫星标记在大菱鲆(Scophthalmus maximus L. )家系系谱印证中的应用研究[J]. 海洋学报, 2009, 31(3): 127-136. doi: 10.3321/j.issn:0253-4193.2009.03.015 [17] BJORNSTAD G, ROED K H. Evaluation of factors affecting individual assignment precision using microsatellite data from horse breeds and simulated breed crosses[J]. Anim Genet, 2002, 33(5): 262-270. doi: 10.1046/j.1365-2052.2002.00868.x
[18] BLOTT S C, WILLIAMS J L, HALEY C S. Discriminating among cattle breeds using genetic markers[J]. Heredity, 1999, 82(3): 613-619. doi: 10.1046/j.1365-2540.1999.00521.x
[19] 楼允东, 李小勤. 中国鱼类远缘杂交研究及其在水产养殖上的应用[J]. 中国水产科学, 2006, 13(1): 151-158. doi: 10.3321/j.issn:1005-8737.2006.01.024 [20] 李建林, 唐永凯, 李红霞, 等. 利用微卫星标记进行6个建鲤家系遗传结构分析和家系鉴定[J]. 江苏农业学报, 2012, 28(4): 917.920. doi: 10.3969/j.issn.1008-0384.2012.09.005 [21] BOSTSEIN D, WHITE R I, SKOLNICK M, et al. Construction of a genetic linkage map in man using restriction fragment polymorphisms[J]. Am J Human Genet, 1980, 32(2): 314-331. doi: 10.1016/0165-1161(81)90274-0
[22] 张春雷, 佟广香, 匡友谊, 等. 哲罗鱼微卫星亲子鉴定的应用[J]. 动物学研究, 2010, 31(4): 395-400. https://xueshu.baidu.com/usercenter/paper/show?paperid=e0d0b26d51f165042cb0b0cbda71d37b&site=xueshu_se&hitarticle=1 -
期刊类型引用(5)
1. 贾智英, 白姗姗, 李池陶, 李保, 石连玉. 德国镜鲤抗病选育群体的亲子鉴定及遗传结构分析. 基因组学与应用生物学. 2017(09): 3735-3741 .  百度学术
百度学术
2. 魏继海, 赵金良, 吴俊伟, 罗明坤, 叶卫, 符云, 陈辉崇. 尼罗罗非鱼(♀)×萨罗罗非鱼(♂)杂交F_2与F_3群体遗传特征的微卫星分析. 南方水产科学. 2016(01): 30-35 .  本站查看
本站查看
3. 吴俊伟, 筴金华, 张艳红, 任炳琛, 罗明坤, 梁从飞, 赵岩, 赵金良. 尼罗罗非鱼与萨罗罗非鱼回交一代与回交二代群体遗传特征的微卫星分析. 淡水渔业. 2015(04): 10-14 .  百度学术
百度学术
4. 油九菊, 范嗣刚, 黄桂菊, 郝博飞, 陈飞飞, 喻达辉. 合浦珠母贝基因组微卫星富集文库的构建与分析. 海洋科学. 2015(10): 8-14 .  百度学术
百度学术
5. 刘永新, 孙朝徽, 王玉芬, 刘奕, 刘英杰. 牙鲆家系亲权鉴定的微卫星DNA标记分析. 水产学报. 2015(11): 1593-1603 .  百度学术
百度学术
其他类型引用(7)



 下载:
下载:


 粤公网安备 44010502001741号
粤公网安备 44010502001741号
