Cluster analysis on 15 strains of pathogenic Nocardia seriolae from fish
-
摘要:
文章对2006年~2012年从华南地区采样或送检的患“结节病”的鱼类(8个鱼种)样品中分离到的15个病原菌株进行了系统发育和聚类分析。系统发育分析结果显示,所有供试菌的16S rDNA序列均与
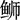
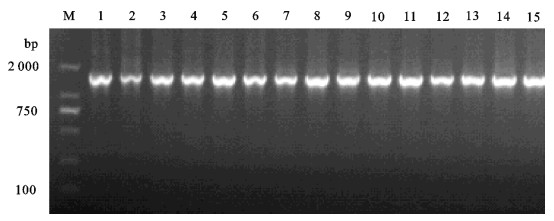
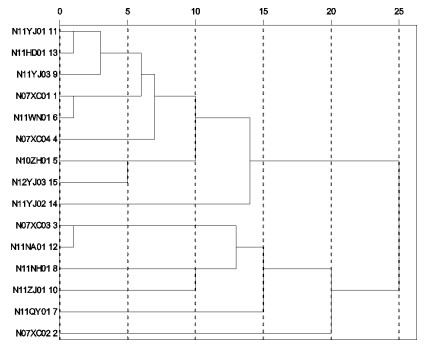
Using phylogenetic and cluster analysis, we studied 15 strains of bacteria isolated from eight species of South China sampling and inspected fish that were suffering from sarcoidosis. Phylogenetic analysis indicates that the 16S rDNA sequences of 15 isolated strains, which share 99% similarity to that of Nocardia seriolae, have a close evolutionary relationship with the member of the N.seriolae, and could be grouped into 2 clusers. Cluster analysis shows that 15 isolated strains could be divided into two groups when T=23, which could be divided into two and four subgroups respectively when T=11. The results suggest that diversity exists in the 15 strains of N.seriolae.
-
Keywords:
- Nocardia seriolae /
- pathogen /
- phylogenetic analysis /
- cluster analysis
-
氨氮是养殖水体环境中主要的污染物,是水环境评估的重要标志之一。以氨氮质量浓度升高为标志的养殖水质恶化直接影响养殖水生动物的免疫力,间接地增加水生动物对病原菌的易感性[1-2]。水体中的氨氮主要是以非离子氨(NH3)和离子氨(NH4+) 2种形式存在,两者处于动态平衡。由于NH3不带电荷,具有较高的脂溶性,能够穿透细胞膜,对生物造成毒害作用[3]。NH3进入水生生物体内后对酶水解反应和膜稳定性产生明显影响,使水生生物表现出呼吸困难、不摄食、抵抗力下降、惊厥、昏迷甚至死亡等现象,影响其生理、生化指标与生长状况,严重时可导致养殖生物大批死亡,造成经济损失[4]。因此,养虾先养水,维护对虾养殖良好的环境是养殖成功的保障。但是,对虾养殖水体环境中理化因子的作用和调控机理非常复杂,受天气、水环境、生物及人工投饵等多因子作用。目前暴雨、台风等恶劣天气对养殖水体环境的影响和给养殖对虾造成的应激引发病害至今仍无有效的方法解决。开展耐逆(环境变化)对虾新品种的选育是一种有效解决以上问题的方法。
家系选育是选择育种的重要方法,特别是对抗病和抗逆等遗传力低的经济性状的选择育种是一种较有效的方法[5]。ARGUE等[6]利用家系选育对凡纳滨对虾(Litopenaeus vannamei)生长和抗TSV(桃拉综合症病毒)进行选育,最终选育出子代的生长速度较未选育组快21%,选育出的对虾较对照组成活率高20%。世界各海水养殖大国均非常重视并已开展对虾优良品种的选育,在凡纳滨对虾、中国明对虾(Fenneropenaeus chinensis)、斑节对虾(Penaeus monodon)等几个主要养殖品种良种选育上取得了重大进展,在抗病或抗逆方面的选育也取得了一些进展。何玉英等[7]研究发现中国明对虾家系早期幼体对高氨氮和高pH的耐受性差异显著,具有较大的选择潜力;孙苗苗等[8]研究发现不同斑节对虾家系耐高氨氮性能具有显著差异;黄忠等[9]对人工选育的6个斑节对虾家系进行了生长、饲料利用以及成活率的研究,结果发现不同家系的增重率、饵料系数和成活率存在差异性;王专伟等[10]研究了斑节对虾家系生长与抗白斑病毒病的关系。
笔者通过对斑节对虾各家系在96 h高氨氮胁迫下的死亡率结果分析,比较了不同来源、不同交配组合、不同方式构建的家系对氨氮的耐受性,筛选出一批耐高氨氮的家系,为耐高氨氮斑节对虾品种选育提供参考。
1. 材料与方法
1.1 家系建立
试验在中国水产科学研究院南海水产研究所三亚热带水产研究中心进行。利用948项目“国外优质斑节对虾种质资源引进”从泰国(T)、印度尼西亚(Y)、非洲(F) 引进野生斑节对虾亲虾,室内暂养1 d,待水温回升至26~27 ℃,雌虾进行人工镊烫眼柄催熟,雌、雄分池培育,亲虾培养水温控制在27~28 ℃,每天4次分别投喂活沙蚕、鱿鱼、牡蛎,每天吸污换水50%,对亲虾进行营养强化培育。对于已经自然交配的卵巢达到IV~V期成熟雌虾,每尾分别移入单独的产卵池产卵、幼体孵化和苗种培育。对于蜕壳后未交配的雌虾,采用巢式不平衡设计进行人工精荚移植,参照杨其彬等 [11]的方法构建群体内和群体间家系、培育苗种,每种组合构建4个以上家系。
1.2 试验管理
对产卵时间相近和标粗养殖成功的家系进行急性毒性试验,每个家系挑选大小相近的个体[(5.0±0.5)cm],每组3个平行,每个平行放30尾虾;试验在500 L的玻璃纤维桶中进行,水体为300 L。每个家系设有试验组和对照组,对照组所用水为经沉淀、消毒的自然海水,试验组水体中氨氮质量浓度为30 mg·L-1[通过急性毒性试验,获得斑节对虾96 h半致死质量浓度(LD50)为29.94 mg·L-1],氨氮质量浓度用氯化铵(分析纯)来调节。试验期间不充气,定时观察个体死亡情况,及时取出死亡个体和粪便,准确记录96 h内的死亡尾数。
1.3 统计分析
用Excel 2003计算各家系死亡率的平均值、标准差、杂种优势,用SPSS 13.0对数据作单因素方差分析(ANOVA),对差异显著的性状用Duncan′s多重比较法分析不同组合间的差异显著性(P < 0.05)。杂交子代的杂交优势率H(%)计算公式[12]为:
$$ H(\%)=\frac{\bar{F}_1-\frac{1}{2}\left(\bar{P}_1+\bar{P}_2\right)}{\frac{1}{2}\left(\bar{P}_1+\bar{P}_2\right)} \times 100 $$ 其中F1、P1、P2分别代表杂交一代、亲本1、亲本2的平均值。
2. 结果
2.1 氨氮胁迫下各家系的死亡率
各家系在氨氮胁迫下的死亡率见表 1。对各家系的氨氮耐受性进行单因素方差分析,结果表明,在96 h高氨氮的胁迫下各家系的死亡率为15.56%~100%,不同家系对氨氮的耐受性差异极显著(P < 0.01)。氨氮耐受性最强的家系为F243×F381,平均死亡率为15.56%,氨氮耐受性最弱的家系为T182×T104,3个重复组死亡率均为100%。如果将家系平均死亡率低于30%划分为高氨氮耐受性家系,30%~60%为氨氮耐受性中等的家系,高于60%划分为氨氮耐受性弱的家系,则氨氮耐受性强、中、弱的家系数分别有7、29、9个。
表 1 氨氮胁迫下各家系的死亡率Table 1. Effect of ammonia-N on mortality of different P.monodon families家系
family死亡率/%
mortality家系
family死亡率/%
mortality家系
family死亡率/%
mortalityF243×F381 15.56±6.94 Y154 37.78±5.09 Y126×Y175 68.89±6.94 F305×F279 20.00±6.67 Y159 37.78±15.03 >Y174×T115 28.89±9.62 F392×F254 24.44±5.09 >Y164 37.78±3.85 >Y125×T115 37.78±13.47 F433×F399 31.11±5.09 >Y171 44.44±10.18 >Y128×T181 42.22±13.47 F281×F379 51.11±10.18 >Y175 44.44±6.94 >Y126×T115 44.44±10.18 F433×F379 53.33±13.33 >Y180 44.44±8.39 >Y106×T181 66.67±15.28 F318×F268 77.78±8.39 >Y181 44.44±18.36 >T111×Y137 37.78±6.94 Y160 22.22±3.85 >Y197 53.33±12.02 >T154×Y137 40.00±6.67 Y162 24.44±5.09 >Y179 62.22±13.47 >T113×Y137 57.78±6.94 Y198 24.44±9.62 >Y153 73.33±17.32 >T121×Y137 60.00±8.82 Y101 33.33±10.00 >Y113×Y104 37.78±5.09 >T174×Y168 73.33±8.82 Y174 33.33±5.77 >Y158×Y104 37.78±7.70 >T173 37.78±3.85 Y103 35.56±3.85 >Y175×Y104 44.44±3.85 >T139 62.22±8.39 Y149 35.56±9.62 >Y158×Y184 51.11±5.09 >T169×T116 68.89±12.62 Y126 37.78±5.09 Y115×Y168 53.33±10.00 T182×T104 100.00±0 2.2 不同父本和母本来源家系氨氮耐受性比较
比较不同父本和母本来源的家系在96 h高氨氮胁迫下的死亡率。结果表明,父本或母本为非洲来源的家系平均死亡率最低[(39.04±22.49)%],氨氮耐受性最强,其次是印尼来源和泰国来源的家系(表 2)。父本为非洲来源的家系氨氮耐受性显著高于父本为泰国来源的家系(P < 0.05),而与父本为印尼来源的家系无显著差异(P>0.05)。母本为非洲和印尼来源的家系氨氮耐受性显著高于泰国来源的母本家系(P < 0.05),而非洲和印尼来源的母本家系氨氮耐受性无显著差异(P>0.05)。母本为印尼来源的家系死亡率要低于印尼来源的父本家系,而母本为泰国来源的家系死亡率则高于泰国来源的父本家系,但均无显著差异。
表 2 不同父本和母本来源家系的氨氮耐受性比较Table 2. Comparison of ammonia-N tolerance for different male and female parent families父本来源
origin of male parent家系数量
number of family平均死亡率/%
average mortality母本来源
origin of female parent家系数量
number of family平均死亡率/%
average mortality非洲Africa 7 39.04±22.49a 非洲Africa 7 39.04±22.49a 印尼Indonesia 29 44.44±15.45ab 印尼Indonesia 29 42.75±15.13a 泰国Thailand 9 54.32±23.14b 泰国Thailand 9 59.75±20.42b 注:同列数字右上字母不同代表有显著差异(P < 0.05),相同则无显著差异(P>0.05),后表同此
Note: Values with different superscripts within the same row are significantly different from one another(P < 0.05), and those with the same superscripts have no significant difference. The same case in the following tables.2.3 不同组合的家系氨氮耐受性及杂交优势分析
5种亲本组合的家系对氨氮的耐受性由高到低依次为F♀×F♂>Y♀×Y♂>Y♀×T♂>T♀×Y♂>T♀×T♂(表 3)。用Duncan′s多重比较法对5种组合家系在氨氮胁迫下的死亡率差异显著性进行方差分析,结果显示,T♀×T♂组合家系对氨氮耐受性极显著低于其他4种组合家系(P < 0.01),T♀×Y♂组合家系氨氮耐受性显著低于F♀×F♂、Y♀×Y♂和Y♀×T♂组合家系(P < 0.05),F♀×F♂、Y♀×Y♂和Y♀×T♂组合家系对氨氮耐受性差异不显著(P>0.05)。
表 3 不同组合对氨氮耐受性比较Table 3. Comparison of ammonia-N tolerance for families of different mate combinations组合
combination家系数
number of family平均死亡率/%
average mortality杂交优势/%
heterosisF♀×F♂ 7 39.05 ±22.51a - Y♀×Y♂ 22 42.50±12.90ab - T♀×T♂ 4 67.22±25.62c - Y♀×T♂ 5 44.00±14.00ab -19.80 T♀×Y♂ 5 53.78±14.86b -1.98 对泰国和印尼来源的自交组合和杂交组合家系在高氨氮胁迫下的死亡率进行杂交优势分析(表 3)。结果表明,泰国和印尼群体的杂交组合家系的氨氮耐受性表现出杂交优势,Y♀×T♂和T♀×Y♂杂交优势分别为-19.80%和-1.98%。
2.4 父系和母系半同胞家系的氨氮耐受性比较分析
对来自6个父本的16个父系半同胞家系在氨氮胁迫下的死亡率比较分析发现,不同母本的父系半同胞家系间的死亡率不同,其中父本和母本均来自印尼和非洲群体的父系半同胞家系的氨氮耐受性无显著差异(P>0.05),但父本和母本来自泰国和印尼的部分杂交父系半同胞家系间存在显著差异(P < 0.05)(表 4)。T111×Y137与T113×Y137和T121×Y137,T174×Y168和Y115×Y168,Y106×T181和Y128×T181存在显著差异(P < 0.05),父本为T115的3个杂交父系半同胞不存在显著差异(P>0.05)。
表 4 父系半同胞家系间的氨氮耐受性比较Table 4. Comparison of ammonia-N tolerance of half-sib families from same male parent家系编号
family No.平均死亡率/%
average mortality95% 置信区间95% confidence interval 下限
lower limit上限
upper limit极小值
minimum极大值
maximumY113×Y104 37.78±5.09ab 25.13 50.43 33.33 43.33 Y158×Y104 37.78±7.70ab 18.65 56.90 33.33 46.67 Y175×Y104 44.44±3.85abcd 34.88 54.01 40.00 46.67 T111×Y137 37.78±6.94ab 20.54 55.01 30.00 43.33 T154×Y137 40.00±6.67abc 23.44 56.56 33.33 46.67 T113×Y137 57.78±6.94cdef 40.54 75.01 50.00 63.33 T121×Y137 60.00±8.82def 38.09 81.91 53.33 70.00 T174×Y168 73.33±8.82f 51.43 95.24 66.67 83.33 Y115×Y168 53.33±10.00bcde 28.49 78.17 43.33 63.33 Y106×T181 66.67±15.28ef 28.72 104.61 53.33 83.33 Y128×T181 42.22±13.47abcd 8.76 75.69 30.00 56.67 Y174×T115 28.89±9.62a 4.99 52.79 23.33 40.00 Y125×T115 37.78±13.47ab 4.31 71.24 30.00 53.33 Y126×T115 44.44±10.18abcd 19.15 69.74 33.33 53.33 F281×F379 51.11±10.18bcde 25.81 76.41 40.00 60.00 F433×F379 53.33±13.33bcde 20.21 86.46 40.00 66.67 对4个母本均来自印尼群体的9个母系半同胞家系在氨氮胁迫下的死亡率比较分析发现,除Y126和Y126×Y175外,另2个父本和母本均来自印尼群体的Y158和Y175母系半同胞家系间的氨氮耐受性无显著性差异(P>0.05),但父本来自泰国群体的杂交家系的氨氮耐受性高于其父母本均为印尼的母系半同胞家系,Y174×T115>Y174,Y126×T115>Y126×Y175,且后者存在显著差异(P < 0.05)(表 5)。
表 5 母系半同胞家系间的氨氮耐受性比较Table 5. Comparison of ammonia-N tolerance of half-sib families from same female parent家系编号
family No.平均死亡率/%
average mortality95% 置信区间95% confidence interval 下限
lower limit上限
upper limit极小值
minimum极大值
maximumY158×Y104 37.78±7.70 abc 18.65 56.90 33.33 46.67 Y158×Y184 51.11±5.09c 38.46 63.76 46.67 56.67 Y175 44.44±6.94bc 27.21 61.68 36.67 50.00 Y175×Y104 44.44±3.85bc 34.88 54.01 40.00 46.67 Y174×T115 28.89±9.62 a 4.99 52.79 23.33 40.00 Y174 33.33±5.77 ab 18.99 47.68 30.00 40.00 Y126 37.78±5.09 abc 25.13 50.43 33.33 43.33 Y126×T115 44.44±10.18 bc 19.15 69.74 33.33 53.33 Y126×Y175 68.89±6.94d 51.65 86.13 63.33 76.67 3. 讨论
氨氮作为对虾养殖中最主要的污染物质,对对虾生长和成活有不利影响。因此,对虾养殖池塘水质环境调控技术和提高对虾对环境应激的适应力成为对虾健康养殖技术的研究热点。该研究表明,斑节对虾不同家系对氨氮的耐受性存在较大的遗传变异,使选择具有高氨氮耐受性的对虾品系成为可能,并有助于从养殖品种的遗传改良方面解决对虾养殖后期环境恶化和高产量之间的矛盾。目前有关对虾耐高氨氮性状的选育研究报道极少。何玉英等[7]以24 h、48 h和72 h平均LD50值综合评价中国对虾家系幼体(P5)对氨氮的耐受性,筛选出对氨氮耐受性最强的家系8个;孙苗苗等[8]以48 h平均LD50值(43 mg·L-1)评估了13个斑节对虾家系稚虾[(3.46±0.10)g]对氨氮的耐受性,发现不同家系对氨氮的耐受性差异极显著(P < 0.01),显示了斑节对虾高氨氮耐受性选育的潜力。已有研究表明,随着对虾幼体发育生长,其对氨氮耐受性增强,仔虾对氨氮的耐受性明显强于无节幼体、蚤状幼体和糠虾幼体[13]。可见不同种类对虾和同种类不同规格对虾对氨氮的耐受性也不一样。王新安等[14]研究大菱鲆(Scophthalmus maximus)家系的生长性能时发现,不同家系在不同生长阶段的生长数据不一致,建议对大菱鲆进行遗传改良时,进行个体选择的时期应不低于9月龄;于飞等 [15]研究认为大菱鲆不适合早期选择,否则,选择的效率和可信度会十分有限。因此,选择对虾哪个生长阶段才能有效评估其真实的耐氨氮能力,仍有待进一步的研究。
笔者研究发现,尽管同一来源的亲体作母本和父本构建家系的死亡率不同,但没有显著性差异,不同群体家系的平均氨氮耐受性由高到低为非洲来源>印尼来源>泰国来源。除Y126和Y126×Y175外,父母本均来自相同群体的父系和母系半同胞家系间的氨氮耐受性没有显著性差异(P>0.05)。分析表明,泰国和印尼群体的杂交家系的氨氮耐受性表现出杂交优势,Y♀×T♂组合(19.8%)优于T♀×Y♂(1.98%)组合。父本来自泰国群体的杂交家系的氨氮耐受性高于其父母本均为印尼的母系半同胞家系,Y174×T115>Y174,Y126×T115>Y126×Y175,且后者存在显著差异(P < 0.05),也表明印尼和泰国群体杂交优势的存在。季士治等[16]研究发现大菱鲆的西班牙和英国群体自交和杂交组合的后代在体长和体质量生长上表现出杂交优势。笔者研究相同父本不同母本的T111×Y137与T113×Y137和T121×Y137,T174×Y168和Y115×Y168,Y106×T181和Y128×T181 3对杂合父系半同胞家系之间死亡率存在显著性差异,表明斑节对虾对氨氮的耐受性可能存在一定的母性效应。孙苗苗等[8]认为斑节对虾的生长和对氨氮抗性方面也存在一定的母系效应。BENZIE等[17]证实来自同一雄性不同雌性的斑节对虾后代的生长存在显著差异,表现出明显的母系遗传影响。姚雪梅等[18]发现凡纳滨对虾杂交系子一代的生长和成活率遗传力偏向母本,母系遗传占主导地位。笔者研究只有4对母系半同胞家系,部分家系间存在杂交优势,因此对父系的影响还难以进行分析。
笔者以高氨氮胁迫96 h下家系的平均死亡率为评价指标,从45个家系中筛选高氨氮耐受性家系7个,中等氨氮耐受性家系29个,低氨氮耐受性家系9个。其中非洲和印尼群体构建的家系具有较高的氨氮耐受性。在高氨氮耐受性家系中非洲来源的有3个,印尼来源的有3个,另一个为印尼和泰国组合家系(Y174×T115)。下一步将对筛选出的抗逆性强的家系进行保种,通过连续选育和纯化提高家系内斑节对虾耐氨氮的能力。根据每代家系对氨氮耐受性强弱,经连续选育后构建不同氨氮耐受性的配套系,同时利用现代分子生物学方法筛选氨氮耐受性特异性分子标记,为实际生产中的斑节对虾遗传改良和高健康品种的选育提供技术支撑。
-
表 1 供试菌株一览表
Table 1 List of tested strains
菌株序号
strain No.菌株
strain分离时间
date of sampling感染对象
infected object采样地点
location of sampling养殖方式
breeding method1 N07XC01 20060404 卵形鲳鲹(T.ovatus) 海南陵水 海水网箱 2 N07XC02 20060404 卵形鲳鲹 海南陵水 海水网箱 3 N07XC03 20060404 卵形鲳鲹 海南陵水 海水网箱 4 N07XC04 20060404 卵形鲳鲹 海南陵水 海水网箱 5 N10ZH01 20100612 鲈(Lateolabrax japonicus) 广东珠海 海水网箱 6 N11WN01 20110315 尖吻鲈(Lates calcarifer) 广西港北 海水网箱 7 N11QY01 20110517 大口黑鲈(Microptorus salmonoides) 广东清远 淡水池塘 8 N11NH01 20110616 乌鳢(Channa argus) 广东佛山 淡水池塘 9 N11YJ03 20110725 斜带髭鲷(Hapalogenys nitens) 广东阳江 海水网箱 10 N11ZJ01 20110728 卵形鲳鲹 广东湛江 海水网箱 11 N11YJ01 20110913 卵形鲳鲹 广东阳江 海水网箱 12 N11NA01 20111011 
广东南奥 海水网箱 13 N11HD01 20111024 杂交鲶(Silurus soldatovi×S.asotus) 广东花都 淡水池塘 14 N11YJ02 20111210 卵形鲳鲹 广东阳江 海水网箱 15 N12YJ03 20120710 卵形鲳鲹 广东阳江 海水网箱 表 2 菌落在营养琼脂培养基上的形态
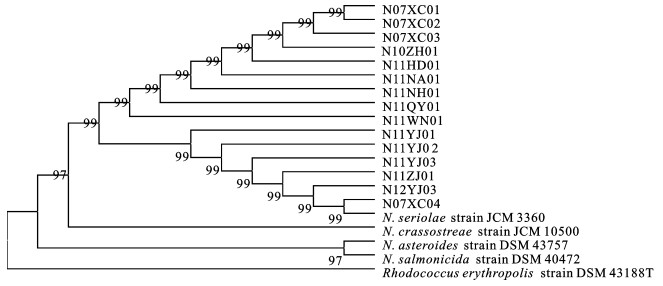
Table 2 Shape of the isolates on Nutrient Agar Medium
菌株序号
strain No.菌落形态 colony morphology 形状
shape颜色
colour干燥/湿润
dry/humid透明/不透明
transparent/opaque光滑/粗糙
smooth/rough1 雪花状 白色 干燥 不透明 粗糙 2 圆形 淡黄色 湿润 不透明 光滑 4、9 不规则形 淡黄色 干燥 不透明 粗糙 3、7、8、10、12 圆形 白色 湿润 不透明 光滑 5、6、11、13、15 不规则形 白色 干燥 不透明 粗糙 -
[1] 张建丽, 刘志恒. 诺卡氏菌型放线菌的分类[J]. 微生物学报, 2001, 41(4): 513-517. doi: 10.3321/j.issn:0001-6209.2001.04.022 [2] 刘志恒, 姜成林. 放线菌现代生物学与生物技术[M]. 北京: 科学出版社, 2004: 78-79. https://xueshu.baidu.com/usercenter/paper/show?paperid=1u2004105v6q04s0mg140a60y2749727&site=xueshu_se [3] ELKESH A, KANTHAM K, SHINN A P, et al. Systemic nocardiosis in a Mediterranean population of cultured meagre, Argyrosomus regius Asso (Perciformes: Sciaenidae)[J]. J Fish Dis, 2013, 36(2): 141-149. doi: 10.1111/jfd.12015
[4] 蒋依依, 李言伟, 周素明, 等. 加州鲈诺卡菌病病原的分离与鉴定[J]. 中山大学学报: 自然科学版, 2012, 51(1): 76-81. https://xueshu.baidu.com/usercenter/paper/show?paperid=24452fd22a49a807dc7d57f6ff73988a&site=xueshu_se&hitarticle=1 [5] 王瑞旋, 刘广锋, 王江勇, 等. 养殖卵形鲳鲹诺卡氏菌病的研究[J]. 海洋湖沼通报, 2010(1): 52-58. doi: 10.3969/j.issn.1003-6482.2010.01.008 [6] 王国良, 徐益军, 金珊, 等. 养殖乌鳢诺卡氏菌病及其病原研究[J]. 水生生物学报, 2009, 32(2): 277-283. doi: 10.3724/SP.J.0000.2009.20277 [7] NARDO D P, GIANCOLA M L, NOTO S, et al. Left thigh phlegmon caused by Nocardia farcinica identified by 16S rRNA sequencing in a patient with Leprosy: a case report[J]. BMC Infectious Dis, 2013, 13(1): 162. doi: 10.1186/1471-2334-13-162
[8] FLATEAU C, JURADO V, LEMAITRE N, et al. First case of cerebral abscess due to a novel Nocardia species in an immunocompromised patient[J]. J Clinical Microbiol, 2013, 51(2): 696-700. doi: 10.1128/JCM.00762-12
[9] MCGHIE T, FADER R, CARPENTER J, et al. Nocardia neocaledoniensis as a cause of skin and soft tissue infection[J]. J Clinical Microbiol, 2013, 51(1): 384. doi: 10.1128/JCM.03004-12
[10] ORCHARD V A. Nocardial infections of animals in New Zealand, 1976-1978[J]. New Zealand Vete J, 1979, 27(8): 159-165. doi: 10.1080/00480169.1979.34634
[11] WALTON A M, LIBKE K G. Nocardiosis in animals[J]. Vet Med & Small Aminal Clinician, 1974, 69(9): 1105-1107. https://www.semanticscholar.org/paper/Nocardiosis-in-animals.-Am-Kg/94cf325880edf09061d00e5c111d0bedb47ceae5
[12] BOIRON P, LOCCI R, GOODFELOW M, et al. Nocardia, nocardiosis and mycetoma[J]. Med Mycol: Official Publication of the International Society for Human and Animal Mycology, 1998, 36: 26-37. https://pubmed.ncbi.nlm.nih.gov/9988489/
[13] BRANSDEN M P, CARSON J, MUNDAY B L, et al. Nocardiosis in tank-reared Atlantic salmon, Salmo salar L.[J]. J Fish Dis, 2000, 23(1): 83-85. doi: 10.1046/j.1365-2761.2000.00201.x
[14] 黄郁葱, 简纪常, 吴灶和, 等. 卵形鲳鲹结节病病原的分离与鉴定[J]. 广东海洋大学学报, 2008, 28(4): 49-53. doi: 10.3969/j.issn.1673-9159.2008.04.011 [15] 曹铮, 沈锦玉, 谢荣林, 等. 乌鳢结节病病原-诺卡氏菌的分离与鉴定[J]. 水生生物学报, 2009, 32(2): 338-341. [16] 蒋依依, 李安兴. 
[17] 王国良, 刘璐, 徐益军. 
[18] 王国良, 刘璐, 李思源. 
[19] ITANO T, KAWAKAMI H, KONO T, et al. Detection of fish nocardiosis by loop-mediated isothermal amplification[J]. J Appl Microbiol, 2006, 100(6): 1381-1387. doi: 10.1111/j.1365-2672.2006.02872.x
[20] 常藕琴, 石存斌, 潘厚军, 等. 乌鳢诺卡氏菌病的组织病理学[J]. 水产学报, 2008, 32(2): 209-216. doi: 10.3321/j.issn:1000-0615.2008.02.006 [21] 满其蒙, 徐力文, 区又君, 等. 
[22] HOLT J G, KRIEG N R, SNEATH P H A, et al. Bergey′s manual of determinative bacteriology[M]. 9th Edition. London: Williams and Wilkins, 1994: 190-194, 259-271.
[23] 刘志恒, 姜成林. 放线菌现代生物学与生物技术[M]. 北京: 科学出版社, 2004: 14-60. https://book.sciencereading.cn/shop/book/Booksimple/show.do?id=B84404A56066B4128A4DAC22B7DBA4F3B000 [24] Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; Sixteenth informational supplement[S]. CLSI document M100-S16(ISBN 1-56238-588-7). Wayne, Pa, USA: Clinical and Laboratory Standards Institute, 2006.
[25] CHEN S C, LEE J L, LAI C C, et al. Nocardiosis in sea bass, Lateolabrax japonicus, in Taiwan[J]. J Fish Dis, 2000, 23(5): 299-307. doi: 10.1046/j.1365-2761.2000.00217.x
[26] 王国良, 袁思平, 金珊. 网箱养殖大黄鱼诺卡氏菌病的初步研究[J]. 水产学报, 2006, 30(1): 103-107. http://scxuebao.ijournals.cn/scxuebao/article/abstract/20060116?st=article_issue [27] CHEN S C. Study on the pathogenicity of Nocardia asteroides to the Formosa snakehead, Channa maculata (Lacepède), and largemouth bass, Micropterus salmoides (Lacepède)[J]. J Fish Dis, 1992, 15(1): 47-53. doi: 10.1111/j.1365-2761.1992.tb00635.x
[28] 林伟, 彭新亮, 杨治国. 招财鱼红斑病病原——诺卡氏菌的分离与鉴定[J]. 信阳农业高等专科学校学报, 2012, 22(2): 99-101. doi: 10.3969/j.issn.1008-4916.2012.02.031 [29] MORACE G, DETTORI G, SANGUINETTI M, et al. Biotyping of aerobic actinomycetes by modified killer system[J]. Eur J Epidemiol, 1988, 4(1): 99-103. doi: 10.1007/BF00152699
[30] PIER A C, FICHTNER R E. Distribution of serotypes of Nocardia asteroides from animal, human, and environmental sources[J]. J Clinical Microbiol, 1981, 13(3): 548-553. doi: 10.1128/jcm.13.3.548-553.1981
[31] YAMAMURA H, HAYAKAWA M, NAKAAGAWA Y, et al. Characterization of Nocardia asteroides isolates from different ecological habitats on the basis of repetitive extragenic palindromic-PCR fingerprinting[J]. Appl Environ Microbiol, 2004, 70(5): 3149-3151. doi: 10.1128/AEM.70.5.3149-3151.2004
[32] PROVOST F, LAURENT F, UZCATEGUI L R, et al. Molecular study of persistence of Nocardia asteroides and Nocardia otitidiscaviarum strains in patients with long-term nocardiosis[J]. J Clinical Microbiol, 1997, 35(5): 1157-1160. doi: 10.1128/jcm.35.5.1157-1160.1997
[33] LAURENT F, PROVOST F, COUBLE A, et al. Genetic relatedness analysis of Nocardia strains by random amplification polymorphic DNA: validation and applications[J]. Res Microbiol, 2000, 151(4): 263-270. doi: 10.1016/S0923-2508(00)00152-2
[34] BLVMEL J, BLVMEL E, YASSIN A F, et al. Typing of Nocardia farcinica by pulsed-field gel electrophoresis reveals an endemic strain as source of hospital infections[J]. J Clinical Microbiol, 1998, 36(1): 118-122. doi: 10.1128/jcm.36.1.118-122.1998
[35] 尤仲杰, 张爱菊. 浙江沿海7种织纹螺形态聚类分析研究[J]. 浙江海洋学院学报: 自然科学版, 2009, 28(2): 161-164. doi: 10.3969/j.issn.1008-830X.2009.02.010 -
期刊类型引用(3)
1. 谭红林,谭均军,石小涛,李振,柯森繁,刘志雄. 鱼道进口诱鱼技术研究进展. 生态学杂志. 2021(04): 1198-1209 .  百度学术
百度学术
2. 张宁,林晨宇,许家炜,施家月,罗佳,白艳勤,尹入成,石小涛. 水流对草鱼幼鱼趋光行为的影响. 水生生物学报. 2019(06): 1253-1261 .  百度学术
百度学术
3. 王琼,林晨宇,罗佳,祝银,刘雁,刘国勇,刘德富,石小涛. 流水和静水条件下鲢幼鱼对不同强度光源的趋性研究. 水生态学杂志. 2018(05): 60-66 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载:
 粤公网安备 44010502001741号
粤公网安备 44010502001741号
