Effect of Rhodopseudomonas palustris on the storage of Oocystis borgei at normal temperature
-
摘要:
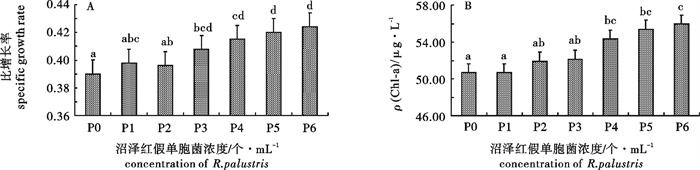
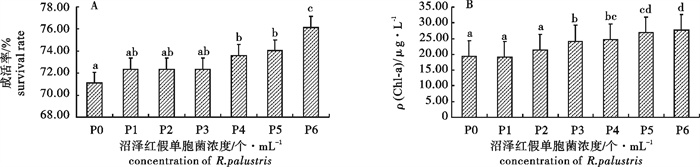
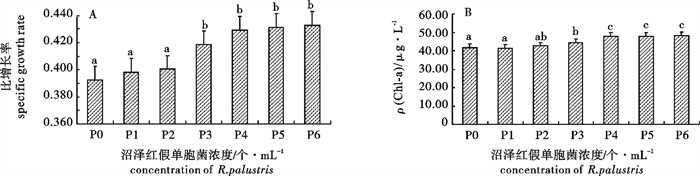
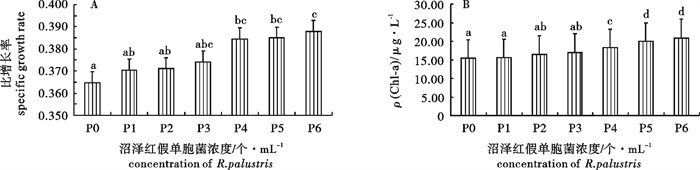
波吉卵囊藻(Oocystis borgei)是亚热带对虾高位池养殖水体常见的优势种,对于稳定池塘生态结构,保持良好水体环境具有重要的意义。研究常温下波吉卵囊藻的保存效果有利于波吉卵囊藻的简易保存和虾类养殖的直接投入使用,以便推动水产养殖行业的微藻生态调控。在25 ℃、30 ℃和35 ℃下研究了不同沼泽红假单胞菌(Rhodopseudomonas palustris)浓度对波吉卵囊藻保存效果的影响。结果显示,在25 ℃、30 ℃和35 ℃下波吉卵囊藻保存的成活率、叶绿素a(Chl-a)质量浓度,以及恢复培养后的比增长率和ρ(Chl-a)与沼泽红假单胞菌添加浓度呈正相关,1.94×106个· mL-1为最佳浓度;25 ℃为最适保存温度,但是在30 ℃下保存后恢复生长时发现比增长率要比25 ℃下保存的高(0.432)。因此,25 ℃下添加沼泽红假单胞菌浓度为1.94×106个· mL-1时波吉卵囊藻的保存效果最佳,成活率达到87.5%,ρ(Chl-a)为31.14 μg · L-1,经恢复培养后比增长率为0.424,ρ(Chl-a)为55.94 μg · L-1。
Abstract:Oocystis borgei is dominant algae in subtropical prawn farming, which plays an important role in stabling pool ecological structure and regulating water quality. Study on the effect of O.borgei at normal temperature can promote simple storage and the application of O.borgei into shrimp and prawn culture, so as to promote technology of microalgae ecological management. We studied the effect of Rhodopseudomonas palustris with different concentration on the storage of O.borgei at 25 ℃, 30 ℃ and 35 ℃. The results show that, in each temperature the survival rate and chlorophyll a content of O.borgei are positively correlated withthe concentration of R.palustris, as well as itsspecific growth rate and chlorophyll a content after re-culturing. The best concentration of R.palustris is 1.94×106 cells · mL-1, and the optimal temperature for O.borgei storage is 25 ℃, while the specific growth rate of O.borgei after re-culturing at 30 ℃(0.432) is higher than that of at 25 ℃. To sum up, when 1.94×106 cells · mL-1 R.palustris added at 25 ℃, we may get the optimal O.borgei storage with thesurvival rate 87.5%and the chlorophyll a content 31.14 μg · L-1, anda good storage of O.borgei after reculturing with the specific growth rate 0.424 and the chlorophyll a 55.94 μg · L-1.
-
Keywords:
- Rhodopseudomonas palustris /
- Oocystis borgei /
- storage
-
pH调节法提取蛋白质早期应用于鱼白肉和碎鱼肉中提取、分离鱼蛋白。20世纪末,美国学者就报道了一种提取动物蛋白的新方法,即pH调节法或称酸碱法、等电点溶解/沉淀法[1]。该法是根据蛋白质在不同酸碱度中溶解度的异同,利用蛋白质在等电点附近溶解度最低的原理将蛋白质沉淀并回收。整个提取过程具有操作温度低、蛋白质变性程度小、功能特性保持较完全等优点。此后,采用等电点法提取分离动物蛋白的报道逐渐增多。UNDELAND等[2]报道了利用等电点法从鲱(Clupea harengus)鱼肉中提取的分离蛋白具有更好的色泽和优良的凝胶强度。CHOI和PARK[3]对酸处理(pH 5.0)回收太平洋鳕(Gadus macrocephalus)蛋白的研究表明,与传统水洗法相比,酸处理法回收蛋白的得率高、组织蛋白酶的活性强,但部分蛋白,如肌球蛋白和肌动蛋白在提取过程中发生了降解。等电点法主要应用于以鱼白肉、碎鱼肉和鱼下脚料为原料的鱼蛋白提取[4-7]。GIGLIOTTI等[8]采用了等电点法从南极磷虾(Euphaususa superba)中分离提取蛋白,并对其营养价值和安全性进行了分析。其蛋白质含量为78%(干基),安全性与酪蛋白无明显差异。
在甲壳动物中,绝大多数类胡萝卜素都以类胡萝卜蛋白(类胡萝卜素结合高密度脂蛋白)的形式存在[9]。该蛋白被认为有2种作用,改善色素的水溶性和提供颜色。甲壳动物的类胡萝卜素蛋白分为3种[10-11]:1)类胡萝卜脂蛋白。主要分布在甲壳动物的卵和卵巢中,但在血液和表皮中也有少量存在。它们使组织呈现蓝色、绿色和紫色;2)从甲壳动物外壳中发现的几丁质类胡萝卜素。它们由几丁质和类胡萝卜素通过Schiff碱键结合而成或是由几丁质的氮端和类胡萝卜素上的酮环结合而成;3)类胡萝卜结合蛋白。主要是虾青素结合脱辅基蛋白而生成的虾青蛋白,它们主要存在于甲壳动物的体表结构中,为其提供保护色。
虾壳在虾熟制过程中会发生红变现象,这是由于虾青蛋白受热变性,释放了与其共价结合的类胡萝卜素而引起的[12]。虾壳的色泽不仅会左右人们的购买,而且也在一定程度上反映了整虾的新鲜程度[13]。传统方法提取虾青蛋白主要是经硫酸铵分级沉淀后,采用高效液相色谱进一步纯化[14]。不仅试验试剂消耗大、目标蛋白得率低,并且温度对目标蛋白的提取影响大。该试验采用pH调节法对比传统硫铵盐析法从凡纳滨对虾壳中提取β虾青蛋白,并对所得蛋白在回收率、纯度和光谱性质等方面进行比较,旨在对pH调节法提取虾青蛋白的可行性进行分析讨论,为有效提取、利用甲壳动物甲壳中的虾青蛋白提供参考。
1. 材料与方法
1.1 材料
凡纳滨对虾(Litopenaeus vannamei)虾壳(亚洲水产,湛江产),运回实验室后立即用冰水洗净、4 ℃下干燥、粉碎、称质量。
1.2 仪器与试剂
UV-1800紫外可见分光光度计(日本岛津出品),CR22GⅡ型高速冷冻离心机(日本日立出品),LC-20AD高效液相色谱仪(日本岛津出品),AE-7300型电泳仪(日本帝国理化出品),Jasco-725型圆二色光谱仪(日本Jasco出品),Alpha 2-4型真空冷冻干燥机(德国Martin Christ出品),Ettan IPGphorⅡ型等电聚焦仪(美国GE Healthcare出品),F-52型pH计(日本崛场出品),Immobiline DryStrip pH 3-10 NL、13 cm型胶条(美国GE Healthcare出品)。试验用水为超纯水,磷酸氢二钠、磷酸二氢钠、EDTA和CHAPS等试剂均为国产分析纯。
1.3 方法
1.3.1 盐析法提取β虾青蛋白
参考ZAGALSKY[14]。将虾壳用预冷却的质量分数为10%的EDTA溶液浸泡[m(虾壳,g):V(EDTA, mL)=25:1 000]10 h(4 ℃)。过滤后向滤液中加入55%饱和度的硫酸铵,4 ℃静置10 h。离心(10 000 g,4 ℃,20 min)后,用100 mL、50 mmol·L-1磷酸盐缓冲液(pH 7.0)溶解沉淀并加入20 %饱和度的硫酸铵,4 ℃静置10 h。二次离心后弃沉淀并向清液中加入50%饱和度的硫酸铵,4 ℃静置10 h后离心所得沉淀即为粗蛋白。将多次提取的粗蛋白收集后,通过真空冷冻干燥浓缩、保存。
在使用高效液相色谱纯化前,需用保存液(50 mmol·L-1,pH 7.0磷酸盐缓冲液)透析数次,以尽量减少硫酸铵对纯化的影响。试验选用的是离子交换柱(5 mm×50 mm Mono Q阴离子交换柱)。流动相:溶剂A为50 mmol·L-1磷酸盐缓冲液(pH 7.0),溶剂B为含1.0 mol·L-1氯化钠的50 mmol·L-1磷酸盐缓冲液(pH 7.0)。梯度洗脱程序为10~80 min内溶剂B的体积从0上升至70%,90 min时增加至100%并维持10 min,115 min时降为0;流速为0.5 mL·min-1,进样量1 mL。
1.3.2 pH调节法提取β虾青蛋白
将预处理后的凡纳滨对虾虾壳用预冷却的质量分数为10%的EDTA溶液浸泡10 h、过滤。提取液pH设置为3.0~11.0,以1.0为pH变化梯度。将滤液分为2份,分别用2 mol·L-1的盐酸(HCl)调节至3.0(酸处理)和2 mol·L-1的氢氧化钠(NaOH)调节pH至11.0(碱处理)。4 ℃、10 000 g离心17 min,得到不同pH下的溶出物和未溶物。
用2 mol·L-1的HCl或NaOH将溶出物的pH调节至等电点后4 ℃、10 000 g离心17 min,得到目标蛋白和未回收的溶出物。
蛋白质溶解度和回收率计算公式为[15]:
$$ 蛋白质溶解度 (\%)=\frac{A}{C} \times 100 $$ $$ 蛋白质回收率 (\%)=\frac{A-A_1}{C} \times 100 $$ 其中A为不同pH处理后离心所得清液中虾青蛋白质量(mg)=清液中蛋白质质量浓度(mg·mL-1)×清液体积(mL);A1为等电点沉淀后,离心所得清液中的虾青蛋白质量(mg);C为总虾青蛋白质量(mg),C=EDTA脱钙后滤液中虾青蛋白质量浓度(mg·mL-1)×滤液体积(mL)。每组试验重复3次取平均值。
1.3.3 β虾青蛋白的基本性质分析
1) 等电聚焦电泳。将经盐析、离子交换色谱纯化后的蛋白质溶于50 mmol·L-1磷酸盐缓冲液中(pH 7.0),透析数次,以消除盐对试验结果的影响。向洁净、干燥的胶条槽(13 cm)内加入含1.0 mL β虾青蛋白纯品(170.14 mg)的再水化液250 mL,将撕去保护膜的IPG胶条置于胶条槽内(酸性端位于正极),尽量避免气泡的形成。最后加入IPG覆盖液以防止蛋白质样品的蒸发和尿素结晶的形成。等电聚焦电泳参数设定为500 V,60 min;1 000 V梯度,60 min;8 000 V梯度,150 min;8 000 V,25 min。电泳完成后经固定、染色、脱色后拍照、保存。2)SDS-PAGE电泳。预制胶浓度为5%~20%(Atto,日本产),Marker范围为10~250 kDa(Bio-Rad,美国产)。电泳完成后经考马斯亮蓝R250染色,脱色。3)凝胶过滤层析。对经过2种方法纯化后的蛋白质选用HiPrep 16/60 Sephacryl S-100 HR和S-300 HR预装柱(GE Healthcare,美国产)进一步确认其分子量。洗脱液为50 mmol·L-1、pH 7.0的磷酸盐缓冲液,流速为15 mL·h-1,标准品分子量为1.35~670 kDa(Bio-Rad,美国产)。4)蛋白质纯度测定。利用凯氏定氮法(GB/T 5009.5-2003)进行测定。每组试验重复3次取平均值。5)最大吸收波长的测定。利用紫外可见光谱仪对蛋白质的最大吸收波长进行测定。6)β虾青蛋白二级结构的测定。在Jasco-725型圆二色光谱仪上进行圆二色光谱测量,光源系统用氮气保护(流量为15 L·min-1),试验均采用2 mm光程石英样品池。测量参数:扫描波长范围200~240 nm,扫描时间50 nm·min-1,分辨率0.1 nm,响应时间1 s,累积次数3次,在室温下进行测定[16]。CD谱用平均残基摩尔椭圆度表示,单位deg·cm2·dmol-1。利用圆二色光谱仪附带的杨氏法二级结构分析软件对二级结构含量进行计算[17]。
2. 结果与分析
2.1 pH调节法分离蛋白质的回收率、溶解度和纯度
pH处理对蛋白质溶解度的影响呈现先下降后上升的趋势(图 1)。当pH为3.0~5.0时溶解度呈逐渐下降趋势;pH为5.0~11.0时溶解度呈上升趋势;5.0~9.0时上升较为缓慢。酸性溶液中蛋白质溶解度在pH 3.0时最大为60.5%,碱性溶液中蛋白质溶解度在pH 11.0时最大为55.7%;pH为5.0时溶解度最小为15.4%。
pH调节法对蛋白质回收率的影响趋势与溶解度一致。最大回收率为pH 3.0时的47.5%,高于传统硫铵盐析的24.3%。同时,pH调节法所得β虾青蛋白的纯度经凯氏定氮法测得为78.23%,也高于盐析法的74.06%。
2.2 β虾青蛋白的光谱性质
盐析法所得虾青蛋白粗品经高效液相分离纯化,按洗脱先后顺序共有3个峰:1)在20% B液条件下洗脱出,在520 nm处有最大吸收,被定义为α虾青蛋白;2)在40% B液条件洗脱出,在580 nm处有最大吸收,被定义为β虾青蛋白;3)在100% B液条件下被洗脱出,在500 nm处有最大吸收,被定义为虾青蛋白的变性产物(图 2)。这与ZAGALSKY [14]的研究一致,α虾青蛋白在0.25 mol·L-1浓度下被洗脱。而TIMME等 [18]对南非龙虾(Jasus lalandii)的研究认为α与β虾青蛋白的洗脱浓度分别为0.4 mol·L-1和0.2 mol·L-1 B液浓度,且最大吸收峰分别为525 nm和560 nm。产生洗脱差异的原因仍需进一步研究,初步推断是组成蛋白质的氨基酸序列和数量的不同所引起。
图 3为不同提取方法获得的β虾青蛋白的紫外可见光谱图。可见2种方法获得的目标蛋白在最大吸收波长上无差异,均为580 nm。TIMME等[18]发现南非龙虾壳中提取的β虾青蛋白的最大吸收波长为560 nm;ZAGALSKY[14]在对无脊椎动物中提取的类胡萝卜蛋白研究后指出,美国龙虾壳中提取的β虾青蛋白的最大吸收波长为580~590 nm;CHAYEN等[19]研究发现欧洲龙虾(Homarus gammarus)壳中提取的β虾青蛋白的最大吸收波长为585 nm。不同地区虾壳中提取的β虾青蛋白最大吸收波长差异的原因仍需进一步研究。
标准蛋白质二级结构的圆二色光谱为:α螺旋在222 nm和208 nm处呈现负峰,在192 nm附近显示一个正峰;β折叠在215 nm处呈负峰,在198 nm附近有一正峰;无规则卷曲则在198 nm有一负峰,在220 nm附近有一正峰。试验得到的圆二色光谱可以看作一定百分比的α螺旋、β折叠和无规则卷曲的线性迭加图谱[20]。通过对比标准二级结构的远紫外圆二色光谱图,试验结果显示β虾青蛋白二级结构主要是α螺旋(盐析法),含量为65%~70% (25 ℃)(图 4)。pH调节法所得β虾青蛋白与传统盐析法提取的β虾青蛋白在二级结构含量上无明显差异,分别为70.1%和67%。
2.3 β虾青蛋白的等电点与分子量
盐析法所得β虾青蛋白等电聚焦电泳仅显示1条条带(图 5),证明凯氏定氮中盐析法所得蛋白质纯度为74.06%是可靠的。以标准蛋白质等电点为对照计算得知β虾青蛋白等点电为5.6,这也符合pH 5.0~6.0时蛋白质溶解度最低。
凝胶色谱结果显示,在20% B液下收集的520 nm处有最大吸收峰,被定义为α虾青蛋白的物质,分子量为380 kDa;在40% B液下收集的580 nm处有最大吸收峰,被定义为β虾青蛋白的物质,分子量为45 kDa,这与TIMME等[18]的研究结果较为一致。
聚丙烯酰胺凝胶电泳粗蛋白显示3个特征条带区(图 6),分布在相对分子量为350 kDa、75 kDa和37 kDa处。β虾青蛋白是由2个分子量约为20 kDa的亚基组成的二聚物[14, 19],因此推断37 kDa附近的条带为β虾青蛋白。而α虾青蛋白是由8个β型组合而成的一个八面体结构[14, 19],因此350 kDa的条带推断为α虾青蛋白。75 kDa的条带仍需进一步研究,推测为α型的降解产物[19]或是纯化过程中得到的其他蛋白质亚基[14]。2种方法纯化后的蛋白质在37 kDa附近的条带均被稀释,说明SDS-PAGE不适合用来鉴定β虾青蛋白分子量。
3. 讨论
蛋白质的溶解度对优化酸碱法回收蛋白质有决定性作用。在酸性或碱性条件时,蛋白质由于携带不同电荷会发生沉淀或溶解的现象[21]。极端pH条件下,由于强烈的排斥作用蛋白质很难发生沉淀(尽管此时已有蛋白质发生变性),它会与水分子结合而使溶解度升高。当溶液pH处于蛋白质等电点附近时,蛋白质净电荷为零而产生聚合现象使溶解度降低[19]。溶解度高有利于将目标蛋白从杂质中分离出来,而等电点时的低溶解度则有利于提高目标蛋白的回收率[22]。从凡纳滨对虾壳中提取的β虾青蛋白溶解度曲线呈U型,这与尼罗罗非鱼(Oreochromis niloticus)[23]和南极磷虾[15]肌肉中回收的蛋白质溶解度曲线一致。随着pH的降低,溶解度逐渐增加的原因是蛋白质在酸度系数2.5~7.0时比7.0~11.0含有更多的离子化基团[2]。
β虾青蛋白通过萃取和沉淀从凡纳滨对虾壳中获得,在pH 3.0和11.0时其回收率约为40%~47%。PALAFOX等[22]使用pH调节法从巨型鱿鱼(Dosidicus gigas)中提取肌肉蛋白的回收率约为75%;KRISTINSSON等[24]采用pH调节法从石首鱼(Micropogonias undulates)中提取肌肉蛋白的回收率约为65%~78%。β虾青蛋白回收率较低的原因是虾壳主要由虾青素和几丁质构成,蛋白质含量相对较低[25]; CHEN和JACZYNSKI[26]报道了pH调节法提取蛋白质的回收率与溶液离子强度有关。类胡萝卜素在结合载脂蛋白后会增强其水溶性[10, 12],同时蛋白质在pH 3.0和11.0时的高溶解度会进一步提高β虾青蛋白的回收率。
pH调节法在目标蛋白的纯度和产量上均优于传统盐析法。这主要是由于pH调节法可以减少提取步骤从而降低杂蛋白的产量和不利影响。同时,蛋白质具有酸碱基团的特性也有利于增加产量、提高目标蛋白纯度。
虾青蛋白对虾壳熟制过程中的颜色变化发挥着重要作用,因此提高蛋白质的提取率对深入了解和利用虾青蛋白具有重要意义。pH调节法提取β虾青蛋白在蛋白质回收率、纯度上均优于传统盐析法,蛋白质分子量、二级结构也无明显差异。虽然等电点的确认需要通过传统盐析法得到纯品,而且在等电点法提取时酸碱会在一定程度上引起蛋白质变性,但该法简单、快捷,蛋白质产量和纯度均优于传统方法, 同时试剂消耗少,试验条件要求低。因此,pH调节法可以作为从虾壳中提取β虾青蛋白的参考方法。
-
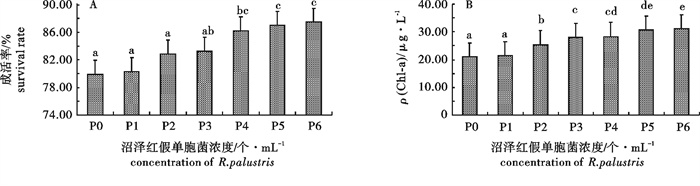
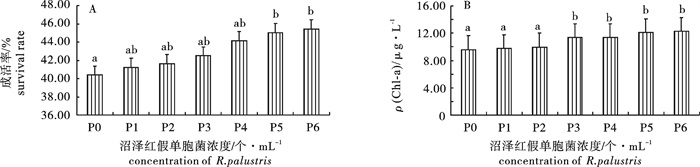
图 1 不同沼泽红假单胞菌浓度下波吉卵囊藻的成活率(A)和叶绿素a质量浓度(B)
P1. 1.94×10个· mL-1;P2. 1.94×102个· mL-1;P3. 1.94×103个· mL-1;P4. 1.94×104个· mL-1;P5. 1.94×105个· mL-1;P6. 1.94×106个· mL-1;后图同此
Figure 1. Survival rate (A) and Chlorophyll a content (B) of O.borgei with different concentration of R.palustris
P1. 1.94×10 cells · mL-1; P2. 1.94×102 cells · mL-1; P3. 1.94×103 cells · mL-1; P4. 1.94×104 cells · mL-1; P5. 1.94×105 cells · mL-1; P6. 1.94×106 cells · mL-1; The same case in the following figures.
-
[1] WU Q, CHEN Y, XU K, et al. Intra-habitat heterogeneity of microbial food web structure under the regime of eutrophication and sediment resupension in the large subtropical shallow Lake Taihu, China[J]. Hydrobiologia, 2007, 581(1): 241-254. doi: 10.1007/s10750-006-0500-x
[2] 李保珍, 冯佳, 谢树莲. 光合细菌对铜绿微囊藻生长的抑制效应[J]. 生态环境学报, 2009, 18(5): 1736-1740. doi: 10.3969/j.issn.1674-5906.2009.05.025 [3] 闫震, 徐春霞, 闫海, 等. 沼泽红假单胞菌与小球藻USTB-01的共培养研究[J]. 现代化工, 2009, 29(2): 172-175. https://xueshu.baidu.com/usercenter/paper/show?paperid=1a6c08k0rk1b0c70cq560mp0me714752&site=xueshu_se [4] 赵巧玲, 李谷, 陶玲, 等. 光合细菌强化对精养鱼塘藻类群落结构的影响[J]. 淡水渔业, 2010, 40(6): 61-65. doi: 10.3969/j.issn.1000-6907.2010.06.011 [5] ODA Y, LARIMER F W, CHAIN P S, et al. Multiple genome sequences reveal adaptations of a photorophic bacterium to sediment microenvironments[J]. Proc Natl Acad Sci, 2008, 105(2): 18543-18548. doi: 10.1073/pnas.0809160105
[6] HUNTER C N, DALDAL F, THURNAUER M C, et al. The purple phototrophic bacteria[M]. The Netherlands: Springer, 2009: 577-689. doi: 10.1007/s11099-009-0072-x
[7] 黄翔鹄, 王庆恒. 对虾高位池浮游植物优势种群与成因的研究[J]. 热带海洋学报, 2002, 21(4): 36-44. doi: 10.3969/j.issn.1009-5470.2002.04.006 [8] 黄翔鹄, 李长玲, 刘楚吾, 等. 两种微藻改善虾池环境增强凡纳对虾抗病力的研究[J]. 水生生物学报, 2002, 26(4): 342-347. doi: 10.3321/j.issn:1000-3207.2002.04.005 [9] 朱明, 阎斌伦, 滕亚娟, 等. 三角褐指藻浓缩液长期保存技术研究[J]. 水产科技情报, 2003, 30(6): 246-249. doi: 10.3969/j.issn.1001-1994.2003.06.007 [10] 颜润润, 逄勇, 王珂, 等. 不同培养条件下扰动对两种淡水藻生长的影响[J]. 环境科学与技术, 2007, 30(3): 10-13. doi: 10.3969/j.issn.1003-6504.2007.03.004 [11] 中华人民共和国国家质量监督检查检疫总局, 中国国家标准化管理委员会. 近海污染生态调查和生物监测[M]. 北京: 中国标准出版社, 2008: 24-25. https://baike.baidu.com/item/%E6%B5%B7%E6%B4%8B%E7%9B%91%E6%B5%8B%E8%A7%84%E8%8C%83%E7%AC%AC7%E9%83%A8%E5%88%86%EF%BC%9A%20%E8%BF%91%E6%B5%B7%E6%B1%A1%E6%9F%93%E7%94%9F%E6%80%81%E8%B0%83%E6%9F%A5%E5%92%8C%E7%94%9F%E7%89%A9%E7%9B%91%E6%B5%8B/64058648 [12] 王少沛, 曹煜成, 李卓佳, 等. 水生环境中细菌与微藻的相互关系及其实际应用[J]. 南方水产, 2008, 4(1): 70-80. doi: 10.3969/j.issn.2095-0780.2008.01.014 [13] FOGG G E. The extracellular products of algae[J]. Oceanogr Mar Biol Annu Rev, 1966, 4(1): 195-212. https://xueshu.baidu.com/usercenter/paper/show?paperid=b2c7f6b6306ae24b6ee4c9690189e359&site=xueshu_se&hitarticle=1
[14] BELL W, MITCHELL R. Chemotactic and growth responses of marine bacteria to algal extracellular products[J]. Biol Bull, 1972, 143(2): 265-277. https://xueshu.baidu.com/usercenter/paper/show?paperid=daf944cf2c81f9a0948635f678efa714
[15] 吴向华, 杨启银, 刘五星. 光合细菌的研究进展及其应用[J]. 中国农业科技导报, 2004, 6(2): 35-38. doi: 10.3969/j.issn.1008-0864.2004.02.008 [16] 俞吉安, 张承康, 陈峰, 等. 光合细菌的抗氧化作用机理探讨[J]. 发光学报, 2000, 21(3): 219-223. doi: 10.3321/j.issn:1000-7032.2000.03.008 [17] 蒋霞敏, 朱艺峰, 王志铮, 等. 单胞藻浓缩、保藏与应用技术的初步研究[J]. 浙江水产学院学报, 1993, 12(2), 81-91. https://xueshu.baidu.com/usercenter/paper/show?paperid=9dd38c26963442fd627d461ba0f46cc6&site=xueshu_se [18] 潘瑞炽, 董愚得. 植物生理学[M]. 北京: 高等教育出版社, 1995: 330-331. [19] 王培磊, 宫庆礼, 麦康森, 等. 两种海洋单胞藻浓缩与保存效果的研究[J]. 海洋湖沼通报, 2001(4): 12-19. doi: 10.3969/j.issn.1003-6482.2001.04.003 [20] 王云鹏, 衣华波, 王华民, 等. 单胞藻静置保种技术研究[J]. 齐鲁渔业, 1997(4): 29-30. [21] 黄翔鹄, 李长玲, 刘楚吾, 等. 波吉卵囊藻培养的生态条件[J]. 湛江海洋大学学报, 2002, 22(3): 8-12. doi: 10.3969/j.issn.1673-9159.2002.03.003 [22] 曹煜成, 李卓佳, 杨莺莺, 等. 浮游微藻生态调控技术在对虾养殖应用中的研究进展[J]. 南方水产, 2007, 3(4): 70-73. doi: 10.3969/j.issn.2095-0780.2007.04.012 [23] 吴瑞珊, 魏东. 微藻高密度培养与冷冻保藏的研究进展[J]. 水生态学杂志, 2009, 2(1): 109-113. [24] 王培磊, 宫庆礼, 黄海龙. 海洋单胞藻浓缩和保存研究进展[J]. 临沂师范学院学报, 2000, 22(6): 36-57. -
期刊类型引用(2)
1. 黄珺,黄洪辉,吴风霞,戴明,齐占会. 嗜盐杆菌HSQAY1对中肋骨条藻的溶藻物质特性. 环境工程学报. 2016(04): 2077-2082 .  百度学术
百度学术
2. 魏玖红,娄永江,魏丹丹,宋美,方磊. 南美白对虾红变因素及控制技术研究. 食品工业科技. 2016(19): 148-152 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载:





 粤公网安备 44010502001741号
粤公网安备 44010502001741号
